Method Article
Eine einfache Ein-Schritt-Dissection-Protokoll für Whole-mount Vorbereitung von Adult
In diesem Artikel
Zusammenfassung
Der erwachsene Drosophila Gehirn ist ein wertvolles System zur Untersuchung der neuronalen Schaltkreise, höhere Hirnfunktionen und komplexe Erkrankungen. Eine effiziente Methode ganze Hirngewebe von der kleinen Fliegenkopf zu sezieren werden Gehirn basierte Studien erleichtern. Hier beschreiben wir eine einfache, one-step-Dissektion Protokoll von erwachsenen Gehirn mit gut erhaltenen Morphologie.
Zusammenfassung
Es gibt ein zunehmendes Interesse Drosophila im Umgang mit menschlichen Gehirn degenerative Krankheiten zu modellieren, neuronale Schaltkreise in erwachsenen Gehirn abbilden und untersuchen die molekularen und zellulären Grundlagen der höheren Hirnfunktionen. Eine ganze Montage Vorbereitung von erwachsenen Gehirn mit gut erhaltenen Morphologie ist von entscheidender Bedeutung für eine solche ganze Gehirn-basierte Studien, kann aber technisch anspruchsvoll und zeitaufwendig sein. Dieses Protokoll beschreibt eine einfach zu erlernende, Ein-Schritt-Dissektion Ansatz eines erwachsenen Fliege Kopf in weniger als 10 s, während das intakte Gehirn zum Rest des Körpers angebracht halten nachfolgende Bearbeitungsschritte zu erleichtern. Das Verfahren hilft die meisten der Augen- und tracheale Gewebe entfernen, die normalerweise mit dem Gehirn verbunden, die mit dem späteren Abbildungsschritt stören kann, und stellt auch weniger Anforderungen an die Qualität der Pinzette. Zusätzlich beschreiben wir eine einfache Methode, die auf einem Deckglas praktisch Umklappen der montierten Gehirnproben ermöglicht, die zum Abbilden auf beiden Seiten der b wichtig istRegen mit ähnlichen Signalstärke und Qualität. Als ein Beispiel des Protokolls, wir eine Analyse der dopaminerge (DA) Neuronen in Gehirnen von erwachsenen WT präsentieren (w 1118) fliegt. Die hohe Wirksamkeit der Dissektion Methode macht es besonders nützlich für große erwachsenen Gehirn-basierte Studien in Drosophila.
Einleitung
Der Modellorganismus Drosophila, die gemeinhin als die Fruchtfliege bekannt ist , hat für seine eleganten genetischen Werkzeuge, kurze Fortpflanzungszeiten, geschätzt und hoch konservierten molekularen und zellulären Wege lang sind. Die Fruchtfliege wurde erfolgreich eingesetzt grundlegende Signalwege zu sezieren, die Strukturierungsmechanismen von mehrzelligen Organismen, sowie die Mechanismen der neuronalen Entwicklung, Funktionen zugrunde liegen, und Krankheiten 1,2. Mit den jüngsten Fortschritten in Zellmarkierung und Imaging - Technologien, hat die Fruchtfliege Gehirn besonders mächtig geworden in Feinkartierung der neuronalen Schaltkreise und in der molekularen und zellulären Grundlagen der höheren Hirnfunktionen zu sezieren, wie Lernen und Gedächtnis, und zirkadianen Rhythmus 1,3, 4,5,6,7,8.
Ein besonderer Vorteil des Drosophila - Systems ist seine relativ kleine Größe, so dass ganze Montage Vorbereitung und Untersuchung des Gehirns eine regelmäßige Verbindung oder konfokalen Mikroskop. This-Funktion ermöglicht eine detaillierte anatomische und funktionelle Analysen der neuronalen Schaltkreise, oder auch nur ein einziges Neuron, auf zellulärer und subzellulärer Ebene im Rahmen einer ganzen Hirngewebe, so dass sowohl eine ganzheitliche Sicht des untersuchten Subjekts und seiner exakten Geometrie innerhalb der gesamten Bereitstellung Gehirn. Doch die eher geringen Größe des Gehirns gegeben, es stellt auch eine technische Herausforderung bei der effizienten ein intaktes Hirngewebe aus dem Schutz Exoskelett Kopf Fall bei einem erwachsenen Fliege sezieren. Verschiedene wirksame und relativ einfache Dissektion Methoden wurden im Detail beschrieben , die in der Regel vorsichtig beinhalten und stufenweise Entfernung des Kopfgehäuses und die damit verbundenen Gewebe , einschließlich der Augen, der Trachea und Fett aus dem Gehirn richtigen 9, 10. Diese mikrochirurgische Dissektion Methoden oft legen eher hohe Anforderungen an die Qualität der Präparation einer Pinzette, mit feinen gut ausgerichteten Spitzen auf einer Pinzette verlassen, die leicht beschädigt werden können. Außerdem ist, wie die Gehirne seziert sind oft separatwegen ihrer geringen Größe und ihrer Transparenz im Verarbeitungspuffer ed von dem Rest des Körpers, kann die Gehirne leicht während der nachfolgenden Färbung und Waschverfahren verloren. Hier beschreiben wir eine relativ einfache und leicht zu erlernende, Ein-Schritt-Dissektion Protokoll für die erwachsenen Gehirn, die die seziert Gehirne an dem Rumpf hält. Die Dissektion Prozess löscht oft leicht die meisten der Gehirn-assoziierten Gewebe wie das Auge und die Luftröhre entfernt und verringert die Nachfrage nach guter Qualität Dissektion Pinzette.
Zusätzlich wird, wenn das Gehirn unter dem Fluoreszenzmikroskop Verbindung oder konfokalen Mikroskop Bildgebung, die Seite des Gehirns, die von der fluoreszierenden Lichtquelle weg erzeugt oft ein schwächeres Signal und weniger klare Bilder aufgrund der Dicke des gesamten Montage Gehirn. Hier haben wir auch eine einfache Montage-Methode beschreiben, die leicht Umklappen der Gehirnproben ermöglicht, so dass bequem Bildgebung von beiden Seiten des Gehirns mit ähnlichen Signal intensiviertenty und Qualität.
Als proof-of-concept für die Anwendung dieses Verfahrens das adulte Gehirn zu untersuchen, untersuchten wir ferner die Anwesenheit von DA - Neuronen im Gehirn von w 1118 Fliegen; ein Genotyp , die oft als die Elternlinie verwendet wird transgenen Fliegen und die Wildtyp - Kontrolle in vielen Drosophila Studien zu erzeugen.
Protokoll
1. Verwendete Lösungen für Gehirnsezierung und Immunfluoreszenzanfärbung
- Präparieren der erwachsenen Fliegen Gehirne in künstlichen zerebraler spinaler Flüssigkeit (aCSF): 119 mM NaCl, 26,2 mM NaHCO 3, 2,5 mM KCl, 1 mM NaH 2 PO 4, 1,3 mM MgCl 2 und 10 mM Glukose. Vor der Verwendung der Gas aCSF mit 5% CO 2/95% O 2 für 10 bis 15 min und Spitze mit 2,5 mM CaCl 2. Sterilisieren der aCSF Lösung durch Filtrieren durch ein 0,22-um-Membranfilter.
Hinweis: Bewahren aCSF bei 4 ° C eine bakterielle Kontamination zu verhindern. Fliegen Gehirn kann auch in einem Phosphat-gepufferter Saline (PBS) Lösung präpariert werden, obwohl detaillierte Vergleiche der Wirkungen der beiden dissection Lösungen auf die endgültige Bildqualität der sezierten Gehirne wurden nicht durchgeführt. - Verwenden 4% Paraformaldehyd (PFA), hergestellt in 1x PBS als Fixierungslösung, die normalerweise in Aliquote aufgeteilt und bei -20 ° C gelagert.
Caution: PFA ist giftig und ätzend und sollten mit Vorsicht behandelt werden. - Verwenden Sie 1x PBS die PFA aus dem Gehirn und nach dem letzten Waschschritt während der Immunfluoreszenzanfärbung der sezierten Gehirne zu spülen. Bereiten Sie die 1x PBS aus 10x PBS - Stammlösung (1,37 M NaCl, 27 mM KCl, 100 mM Na 2 HPO 4 und 18 mM KH 2 PO 4).
- Verwenden 0,3% Tween-20 in 1x PBS (1x PBT) für alle nachfolgenden Waschschritte bei Immunofluoreszenz-Färbung der sezierten Gehirnen.
2. Mikro Dissektion der erwachsenen Fliege Heads
Anmerkung: Die Dissektion Verfahren in Abbildung 1 dargestellt ist.
- Anesthetize die erwachsenen Fliegen mit CO 2. Mit einer Pinzette, wählen Sie eine Fliege und kurz Entwachsen seine Kutikula, indem es in 70% Ethanol für 3 Tauchen - 5 s. Dadurch wird sichergestellt, dass keine Blasen in die Kutikula fly haften, wenn sie in den aCSF oder 1X PBS dissection Lösung eingetaucht.
- Unter einemBinokular mit einer Lichtquelle in einem Winkel, der nicht durch die Hände blockiert werden, stellen Sie die Objektivlinse eine klare Sicht auf die Fliege (1.2X Vergrößerung) zu erreichen. Verwenden einer Pinzette , mit der nicht - dominanten Hand , um das Tier zu immobilisieren und tauchen die Fliege in die kalte Dissektion Lösung mit ihrem Bauch nach oben, wie in 1A gezeigt.
- Halten der Zange in einem 160-170 ° -Winkel in Bezug auf die Dissektion Platte, während eine kleine Kraft auf den Bauch der Fliegen ausübt (wie die Pfeile in Figur 1A dargestellt). Mit diesem Schritt wird die Fliege zu immobilisieren und zwingen sie den Kopf nach hinten um 15 zu bewegen - 25 °, während die Rüssel nach oben erstrecken. In dem Verfahren wird eine weiche und lichtdurchlässigen Bereich der Kutikula, unterhalb der Rüssel sollte deutlich werden. Erhöhen Sie die Vergrößerung und stellen Sie die Fokusebene auf diese Region.
Hinweis: Halten Sie nicht die Zange zu fest, sondern nur fest genug zu stabilisierendie Fliege. Zu viel Kraft führt dazu, dass die inneren Organe in die Lösung zu Bruch. - Verwenden Sie die dominante Hand die Pinzette zu drücken, so dass ihre Spitzen geschlossen sind, die eine leichte Widerstandskraft an den Spitzen der Zange erzeugt wird, so dass die Zange aufspringen wird, wenn der Druck von der Halte Hand freigegeben wird. Positionieren Sie die Zange senkrecht zu der Zange die Fliege halten, wie in 1B gezeigt.
- Pierce die geschlossenen Spitzen der Dissektion Zange durch die weiche und durchlässigen Bereich der Kutikula unter den Rüssel, wie in 1B durch den roten Pfeil dargestellt ist . Es ist wichtig, nicht die Zange eindringen zu tief, dass es das Gehirn berührt. Das Gehirn besitzt, sollten sichtbar werden. Aufrechterhaltung eines stabilen Griff der Fliege mit der nicht-dominanten Hand.
- Schnell, aber stetig, lassen Sie die Spitzen der Dissektion Zange durch seine eigene Kraft und setzen auf die Dynamik von dieser Version loszureißen ter Exoskelett rund um das Fliegenkopf. Eine intakte Gehirn richtigen sollte (das weiße Gewebe oberhalb der Spitze des unteren forcep in 1C sofort) sichtbar werden , folgen eine imaginäre Linie , die Dynamik der freiPinzettenSpitzen zu führen (wie die nach außen rote Pfeile in 1C gezeigt dargestellt). Dies entfernt sanft das Exoskelett und die meisten des Gehirns assoziiertes Auge und Trachea vom Gehirn. Der richtige Zeitpunkt und die ausgeübte Kraft das Exoskelett zu öffnen wird auf die Prüfer Erfahrung abhängig sein.
Anmerkung: Dies ist der wichtigste Schritt bei der Präparation ist. Es ist wichtig, auf die natürliche Kraft von der Dynamik der Öffnung Zange erzeugt verlassen, um die Exoskelett zu entfernen, während die freiliegenden Gehirn verlassen, um den Rest des Körpers befestigt bleibt. - Verwenden Sie die Zange in der dominanten Hand sorgfältig die Überbleibsel Zubehör Gewebe, wie zum Beispiel die tracheale entfernen, die als weiße Faserstrukturen erscheint remaining an das Gehirn. Achten Sie darauf, nicht zu ziehen oder das Gehirn die richtige beschädigen.
3. Immunfluoreszenzanfärbung der Gehirne
- Befestigen Sie die seziert Gehirnproben mit ihren zugehörigen Torsos in etwa 1 ml 4% PFA für 40 - 60 min.
Hinweis: Für diese und die nachfolgenden Schritte, halten die Rohre oder Platten mit Proben auf einem Nutator richtig die Proben in der Lösung mischen. - Spülen mit 1 ml 1x PBS durch die up-Lösung pipettiert und ab 3 mal. Achten Sie darauf, nicht die Gehirne entfernt abzusaugen.
- Waschen Sie 5-mal mit 1x PBT für jeweils 5 Minuten. Halten Sie die Proben auf der Nutator während der Inkubation.
- Inkubieren mit primären Antikörpern an geeigneten Verdünnung O / N bei 4 ° C.
- Am nächsten Tag, entfernen Sie die primären Antikörper und waschen Sie die Proben 5-mal mit 1x PBT. Lassen Sie die Proben 5 - 10 min in der 1x PBT-Lösung zwischen jedem Waschen. Halten Sie die Proben auf der Nutator während der Inkubation.
- Inkubieren des gewaschenenProben, die in einem geeigneten sekundären Antikörper mit der vorgeschlagenen Verdünnung und Inkubationszeit.
- Waschen Sie die Proben sechsmal mit 1x PBT mit einer 10-minütigen Inkubation zwischen jedem Waschen.
Dieser Schritt ist entscheidend für die Entfernung von unspezifisch gebundenen Sekundärantikörper von der Probe. - Inkubieren in einer 1: 10000 Verdünnung von 1 mg / ml 4 ', 6'-Diamidino-2-phenylindol (DAPI) in 1x PBT Lösung für 30 min. DAPI ist ein DNA-Farbstoff, der auf die AT Regionen der DNA bindet und verwendet werden kann, die Gesamtmorphologie des Gehirns zu offenbaren.
- Spülen Sie dreimal mit 1x PBS.
- Transfer Proben auf eine Dissektion Gericht, und trennen Sie die Gehirne von den Körpern in einer Dissektion Gericht mit einer Pinzette.
- Nach der Färbung und Waschschritte, montieren Sie die Gehirne zwischen zwei Deckgläser und legen Sie die Deckgläser auf einem Montage Folie. Auf diese Weise können die Gehirnproben leicht umgedreht werden, so dass beide Seiten des Gehirns mit einer ähnlichen Signalintensität abgebildet werden.
Hinweis. Der Montagevorgang wird im folgenden näher erläutert.- Legen Sie eine 18 x 18 mm Deckglas auf einem Montage Folie. Widen die Eröffnung einer Pipettenspitze mit einer Klinge und es verwenden, um die Gehirne in 1x PBS-Lösung auf die 18 x 18 mm Deckglas zu übertragen.
- Legen Sie die Gehirne auf die Mitte des Deckglases, entfernen Sie die Flüssigkeit um das Gehirn mit einer feinen Pipettenspitze, und dann fügen Sie eine weitere 20 bis 40 & mgr; l anti-fade Eindeckmediums (0,2% (w / v) n-Propylgallat in 99,5 % ACS-Qualität Glycerin) über das Gehirn.
Hinweis: Die Menge an Eindeckmedium geprüft , hängt von der Anzahl der Gehirne hinzugefügt. - verbreiten Sie vorsichtig die Köpfe, während das viskose Eindeckmediums nach außen zu verschieben. Legen Sie eine zweite 18 x 18 mm Deckglas auf der Oberseite des Gehirns, indem man zuerst die Folie von einer Seite absenken, bis es in Kontakt kommt mitdie Oberfläche des Befestigungs slip, und dann senkt sich langsam auf der anderen Seite des Gehirns Kontakt mit Luftblasen zu minimieren.
Hinweis: Es gibt keine Notwendigkeit besteht , einen Abstandshalter zwischen den beiden Deckplättchen, als das Volumen des Befestigungsmedium zu verwenden und die Gehirne sollte einen Raum ausreichend zu trennen , die beiden Deckgläser bereitzustellen. - Lassen Sie die Folien nach unten absetzen. Entfernen Sie überschüssige Flüssigkeit, die mit einem Labor Gewebe von den Seiten der Gleiter kommen.
- Um die Deckgläser mit den montierten Gehirne nicht fallen die Montageschieber während des Transports ab, verwenden Sie ein kleines Stück Klebeband, um die Deckgläser an der Montage Schlitten zu befestigen.
Hinweis: Gehirne montiert zwischen den Folien direkt abgebildet werden kann , oder bei 4 ° C aufbewahrt für bis zu einer Woche ohne wesentlichen Verlust an Fluoreszenzsignal, ohne Notwendigkeit , eine Dichtungsmasse zu verwenden , um die Folien zu versiegeln. Für die langfristige Erhaltung der gefärbten Gehirn kann die Seite der beiden schlüpft abgedichtet werden with Nagellack und gelagert in einem -20 ° C Gefrierschrank, obwohl gefärbten Gehirne ihre Signale im Laufe der Zeit verlieren. Dies ist nicht empfehlenswert.
- Verwenden Sie eine geeignete Verbindung Fluoreszenzmikroskop oder konfokalen Mikroskop das Gehirn abzubilden.
- Zuerst erwirbt das Bild von der Seite des Gehirns näher an dem Ziel, und dann vorsichtig die Deckgläser Flip die Proben in der Mitte eingeschoben haben. Dieser Schritt erleichtert das Bild der anderen Seite desselben Gehirns zu erwerben.
- Verwenden Sie eine aufrechte Verbindung Fluoreszenzmikroskop und einem 20X Objektiv zur Abbildung des gesamten Gehirns (Beispiele in Abbildung 2) und ein 40X - Objektiv zur Bild kleinere Regionen des Gehirns, wie DA Neuronen im Gekoppelte Anterior Medial (PAM) Clusterregion (Beispiele in Abbildung 3).
Ergebnisse
Abbildung 1 zeigt die Hauptverfahren für adulte Gehirn Dissektion, wie oben beschrieben , die Figuren 2 und 3 sind repräsentative Bilder von 3 Tage alten WT. (Genotyp: w 1118) erwachsenen Gehirnen Fliegen, die mit einem Antikörper gegen Tyrosinhydroxylase (TH costained wurden in rot, in Figur farbigen 2 und weiß in 3), einem Marker allgemein zu bezeichnen DA - Neuronen 11, zusätzlich zu dem DNA - Farbstoff DAPI zu etikettieren alle Zellkerne und einen Antikörper gegen Elav Protein, einem Marker für differenzierte Neuronen verwendet in der Fliege (in grün gefärbt), die zusammen die Gesamtstruktur des Gehirns offenbart.
Für den primären Antikörper in den 2 und 3 verwendeten wir Kaninchen - Anti-TH - Antikörper bei einer 1: 200 Verdünnung und Ratten - Anti-Elav Antikörper bei einer 1: 100 Verdünnung, WHIch wurden in 1x PBT mit 5% normalem Ziegenserum nicht-spezifische Bindung zu blockieren. Für sekundäre Antikörper, verwendeten wir Alexa Fluor 488-konjugiertem Ziege-anti-Ratte-Antikörper und AlexaFluor596-konjugiertem Ziege-anti-Kaninchen-Antikörper bei einer 1: 500-Verdünnung in 1x PBT.
Um das Bild zu den Gehirnen verwendeten wir eine aufrechte Verbindung Fluoreszenzmikroskop mit einer Apotome Funktion ausgestattet Z-Stapel-Bilder von Hirnschnitten, die die ganze Tiefe der Region von Interesse im Gehirn zu erwerben decken. Um zum Beispiel eine klare Visualisierung der allgemeinen Verteilung von DA - Neuronen im gesamten Gehirn zu erhalten, verwendeten wir eine 20fach Objektiv separat Bild der vorderen und hinteren Seiten des gleichen Gehirns (Abbildung 2). Die Tiefe jeder Seite des Gehirns abgebildet, dass können alle DA Neuronen decken ist etwa 20 bis 25 & mgr; m insgesamt. Um zuverlässig zu visualisieren und DA Neuronen im PAM Clusterregion zu quantifizieren, die kleinere Zellgrößen und schwächer TH si habengnale (siehe unten), haben wir eine 40-fach Objektivlinse. Zusätzlich ist in der Z-Serie Erfassungsfunktion von der kommerziellen Software, wählten wir eine Schnittdicke von 0,5 bis 1 & mgr; m zwischen jeder abgebildeten Schicht, die eine optimale Bildqualität in einer 3D - Rekonstruktion des PAM Clusterregion (3c) gewährleistet. Die Dicke der PAM-Cluster im Gehirn, die alle DA Neuronen umfasst ca. 8 - 10 & mgr; m insgesamt. Nach unserer Erfahrung kann die Apotome Funktion signifikant das Rauschsignal bei der Abbildung dicken Proben mit hohem Hintergrund, wie ein ganzes Gehirn oder der PAM-Cluster-Region zu reduzieren.
Die 2A-E zeigen die vordere Ansicht eines Gehirns, während 2F-J die hintere Ansicht des gleichen Gehirns zeigen , nachdem die Deckgläser Spiegeln, die die Gehirnproben halten, die zwischen zwei Seiten des Gehirns ein ähnliches Niveau der Signalintensität anzuzeigen alle drei Kanäle abgebildet. Die DA neurons wurden 11 nach dem frühen Bezeichnung in verschiedene Cluster gruppiert, obwohl hier verwenden wir den Hinteren Medial (PPM) Gepaart Namen der PPM1, PPM2 und PPM3 Cluster an der vorderen Seite des Gehirns und den Namen posterior Lateral (PPL Gepaart enthalten ) die pPL1 und PPL2 Cluster von der hinteren Seite des Gehirns zu bedecken, wie in den Figuren 2E und 2J. 2E und 2J in weiß zeigen vordere und hintere Ansichten des gleichen Gehirns in hoher Vergrößerung dargestellt, um die verschiedenen Gruppen von dA enthüllt Neuronen auf beiden Seiten des Gehirns. Der weiße gestrichelte Linien die herausragende PAM und Paired Anterior Lateral (PAL) Cluster in der vorderen Seite des Gehirns (2E) sowie die PPL und die PPM - Clustern in der hinteren Seite des Gehirns (2J) hervorzuheben.
3A und 3B ein re Zusammenfassungen der Quantifizierungsergebnisse für einige der DA - Cluster in w 1118 Fliegen. Wir zählten DA Neuronen Scheibe für Scheibe und auch von rekonstruierten 3D-Bildern, die ungenau Zählen minimieren sollte. Wir gehen davon aus, dass die 3-Tage-alten w 1118 fliegt durchschnittlich 27 DA - Neuronen haben insgesamt im PPM - Cluster pro Gehirn, 16 DA Neuronen in der PPL - Cluster pro Hemisphäre, 5 DA Neuronen in PAL - Cluster pro Hemisphäre (3A), und 97 DA Neuronen in jeder der PAM - Cluster (3B). 3C ist eine repräsentative 3D - Rekonstruktion von DA - Neuronen in den PAL und PAM - Cluster, projiziert von Scheiben mit hoher Vergrößerung Bilder , die alle DA - Neuronen in dieser Region. Es ist offensichtlich, dass im Vergleich zu anderen Clustern wie die PAL, DA-Neuronen in den PAM-Cluster relativ kleinere Zellgrößen und schwächer TH Anfärbung Signale aufweisen.
"Src =" / files / ftp_upload / 55128 / 55128fig1.jpg "/>
Abb . 1: Grafische Darstellung des Dissection - Protokoll für Erwachsene Drosophila Gehirn (A) Flies mit der Bauchseite nach oben positioniert und durch den Brustkorb gehalten , um die nicht-dominanten Hand. Force sanft aufgetragen (rote Pfeile) an der Zange nach hinten Kippen des Fliegenkopf und leichte Außen Verlängerung des Rüssels zu induzieren, unter den weißen transparenten Bereich ausgesetzt wird. (B) Pinzetten aus der dominanten Hand sind in den transparenten Bereich unter den Rüssel eingeführt, einen flachen Einschnitt zu schaffen (roter Pfeil). Beachten Sie, dass die Zange wir nicht sehr feinen spitzen Enden verwenden müssen. (C) Forceps dürfen außer durch seine eigene Kraft zu kommen, wie durch die roten Pfeile angedeutet. Die Dynamik , die durch die Zange öffnen entfernt die Augen und Exoskelett, eine relativ saubere Drosophila Gehirn ausgesetzt wird . Die meisten der Trachea werden in dem Prozess entfernt. ( D) Excess Zubehör Gewebe um das Gehirn sind richtige für volle Belichtung des Gehirns sorgfältig getrimmt weg. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
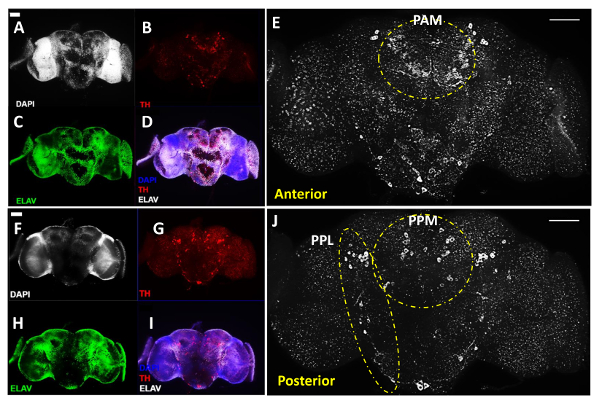
Abbildung 2:. DA Neurone Revealed mit Anti-Tyrosin - Hydroxylase (TH) Antikörper in Adult Male Drosophila B regen (mit einem 20x - Objektiv erworben) Darin enthalten sind repräsentative Bilder von seziert erwachsenen Gehirn, rekonstruiert mit Z-stacked Bilder des Gehirns Region Interesse mit der Verbindung Fluoreszenzmikroskop erhalten. (AE) Anterior und (FJ) posterior Ansichten des gleichen erwachsenen Gehirn; (A & F) Zellkerne wurden durch DAPI - Färbung (weiß) abgebildet und (C & H) Neuronen were von pan-neuronalen Marker anti-Elav Antikörper (grün) markiert; (B & G) DA Neuronen werden durch Anti-TH - Antikörper (rot) ergab. (D & I) Überlagerung von Bildern für DAPI, TH und Elav Behandlung. (E & J) vergrößerte Ansicht der Hirnregionen mit DA - Neuronen in weiß dargestellt. Gestrichelte Linien verdeutlichen die PAL und PAM-Cluster in der anterioren des Gehirns und PPL und PPM-Clustern in dem hinteren Teil des Gehirns. Der Maßstab entspricht 50 & mgr; m in alle Panels. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Die Quantifizierung von DA Neurone in Gehirnen von männlichen Erwachsenen mit 1118 Fliegen (mit einem 40x - Objektiv erworben). (A & B) Quantifizierung der DA neurons von Tag 3 männlich w 1118 Fliegen, durch Anti-TH - Färbung ergab. Die Daten werden durch Whisker Box-Plots zeigen Minimal- und Maximalwerte wie die Ausreißer dargestellt; sowie der ersten (Q1), zweiten (Q2) und dritten (Q3) Quartile. Der zweite Quartil wird als Mittelwert dargestellt. (A) PPM {(n = 28) Min: 21, Q1: 24, Durchschnitt: 27, Q2: 30, Max: 32}, PPL {(n = 26) Min: 10, Q1: 12, Durchschnitt: 16, Q2: 18, Max: 25} und {PAL (n = 24), Min: 2, Q1: 4, Durchschnitt: 5, Q2: 5, Max: 10} Cluster; (B) PAM - Cluster {(n = 20) min: 86, Q1: 94, Durchschnitt: 97, Q2: 97, Max: 99}. (C) Eine repräsentative Projektionsbild zeigt DA Neuronen in den PAM und PAL - Cluster von männlichen w 1118 fliegt bei 3 d. Maßstabsbalken entspricht 20 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Mit zunehmendem Interesse an der Verwendung erwachsenen Drosophila Gehirn menschliche Gehirn Krankheiten zu studieren, neuronale Schaltkreise und höheren Hirnfunktionen, ist es notwendig , eine einfache und schnelle Methoden zu entwickeln , intakte Fliegen Gehirne für ganze-mount zu erhalten Analysen, die für groß besonders wichtig ist , skalieren Gehirn-basierte Bildschirme. Unser Verfahren bietet eine einfache und leicht zu erlernende Ansatz eine Fliege Kopf zu sezieren aus (oft in weniger als 10 s mit Erfahrung) mit gut erhaltenen Morphologie, die weitgehend von assoziierten Gewebe gelöscht wird. Da die sezierte Gehirne noch den Rest der Flugkörper angebracht sind, sinken sie in der Regel auf den Boden des Probenröhrchens schnell und leicht während des Wasch- und Färbeschritte zu erkennen und zu sammeln. Dies minimiert deutlich Probenverlust, die eine herausragende Problem bei der Verarbeitung der Gehirnproben von winzigen physikalischen Größen sein kann. Dieses Problem kann besonders wichtig für groß angelegte Studien. Das Gehirn kann leicht von dem Körper gelöst werdennach Beendigung des Färbeprozesses, vor der Montage.
Während der Präparation ist es wichtig, die Fliege richtig halten, die richtigen Winkel zu positionieren, wenn das Exoskelett vom Fliegenkopf zu entfernen und sanft die richtige Kraft ausüben, in jeden Schritt durchführen. Es wird empfohlen , dass die Zange senkrecht zueinander angeordnet sind , um decapitation der Fliege (1B) zu verhindern. Wie in den repräsentativen Bildern in Abbildung 2 gezeigt, vorbereitet das Gehirn unter Verwendung dieses Protokolls zufriedenstellende Ergebnisse. In diesem Beispiel konzentrieren wir uns auf die DA-Neuronen in den PAM-Cluster von erwachsenen Gehirnen. A Drosophila Gehirn in Durchschnitt hat insgesamt etwa 280 DA - Neuronen pro Protocerebrum, die in unterschiedliche Cluster in verschiedenen Regionen des Gehirns mit markanten Projektionsmuster und Funktionsausgang 11, 12 verteilt sind. Zurück Charakterisierung von DA - Neuronen im erwachsenen Gehirn Drosophila, including Modelle menschlicher Krankheitsgene fliegen wie in Parkin - Mutanten, weitgehend auf dem PAL konzentriert, PPL und PPM - Cluster , die relativ große Zellgrößen und prominente Expression von TH haben, die Standard - Hersteller zur Kennzeichnung von DA - Neuronen verwendet 13-18.
Jedoch sind die meisten DA-Neuronen im Gehirn fly in den PAM-Cluster, die mit etwa 100 DA-Neuronen pro Cluster. Im Vergleich zu Zellen in anderen DA-Clustern, DA Neuronen im PAM-Cluster zeigen in der Regel einen geringeren Grad an Tyrosin-Hydroxylase Expression und kleinere Zellgrößen. Verwendung einer Verbindung Fluoreszenzmikroskop, ohne konfokale Abbildung In Proben aus unserer Dissektion und Färbungsprotokoll vorbereitet, können die DA Neuronen im PAM-Cluster eindeutig in hochwertigen visualisiert und abgebildet werden. Aufgrund ihrer großen Anzahl, Quantifizierung von DA-Neuronen im PAM Cluster von verschiedenen genetischen Hintergründen könnte zuverlässigere und reproduzierbare Ergebnisse liefern. Wir schlagen vor, dass DA Neuronen in den PAM cluster ein weiteres nützliches System darstellen DA biology für Studium und DA-Dysfunktionen Modellierung, wie Parkinson-Krankheit.
Nach unserer Erfahrung die Apotome Funktion aus dem Mikroskop verwendeten wir können das Hintergrundsignal deutlich zu reduzieren, vor allem in Proben mit einem signifikanten Dicke, wie der gesamten erwachsenen Fliegenhirn zu untersuchen. Obwohl konfokalen Mikroskop Bilder mit mehr Details, höhere Vergrößerung und eine bessere Qualität erzeugen kann, ist es oft zeitaufwendig und teuer. Dies gilt insbesondere für eine große Anzahl von dicken Proben wie erwachsenen Gehirn für die Bildgebung, die für klare 3D-Rekonstruktion und Dekonvolutionsanalyse Reihe von Z-Stack Abschnitt erfordern. In dieser Hinsicht stellt die Apotome Funktion eine schnelle und kostengünstige Alternative Bilder von ausreichender Qualität zu produzieren (zB Bilder in den Abbildungen 2 und 3).
Im Gehirn Studien, ist es oft notwendig, um Bildzellen auf beiden sides des gleichen Gehirns. Sind beispielsweise DA-Neuronen, die in Clustern von den beiden vorderen und hinteren Seiten des Gehirns. Doch aufgrund seiner Dicke, nachdem ein Gehirn auf dem Schlitten montiert ist, entfernt die Seite , von der Lichtquelle (dh die Seite der Montageplanschieber) gibt in der Regel Anlass zu schwächeren Signalen und weniger scharfe Bilder , wenn regelmäßige Verbindung und konfokale abgebildet mit Mikroskope. Durch die Montage der Proben zwischen den beiden Deck gleitet, ermöglicht es bequem Umklappen der Proben auf dem montierten Schieber und nachfolgende Abbildung von beiden Seiten desselben Gehirns mit ähnlichen Signalintensitäten. 2 ist ein Beispiel von Abbildungs DA - Neuronen von beiden Seiten des fliegen Gehirn mit dieser Methode, die relativ vergleichbare Signalintensität und Bildqualität zeigte.
Mehrere easy-to-follow - Ansätze für die erwachsenen Gehirn gewesen fliegen Sezieren beschrieben schön 9, 10. Unser Ansatz stellt eine alternative Methode , die Fell kannther vereinfachen die Präparation und Färbung Prozesse der erwachsenen Gehirn fliegen. Mit groß angelegten Studien das gesamte Gehirn neuronale Schaltkreise sowie deren molekulare und zelluläre Bestandteile zu kartieren durchgeführt wird, ist es absehbar , dass automatisierte Präparation und Bildgebung Ansätze für erwachsene Drosophila Gehirn entwickelt werden können , mit hohem Durchsatz genetischen und Drogen - Bildschirme zu erkennen , in vivo in diesem klassischen genetischen Modell.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Wir erkennen an Mr. Enes Mehmet, Frau Kiara Andrade, Frau Pilar Rodriguez, Chris Kwok und Frau Danna Ghafir für ihre immense Unterstützung für das Projekt.
Materialien
| Name | Company | Catalog Number | Comments |
| w*; parkΔ21/TM3, P{GAL4-Kr.C}DC2, P{UAS-GFP.S65T}DC10, Sb1 | Bloomington Drosophila Stock Center | 51652 | Balancer was switched to TM6B |
| PBac{WH}parkf01950 | Exelixis at Harvard Medical School | f01950 | Balancer was switched to TM6C |
| NaCl | Fisher Scientific | S640-500 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | 02-003-990 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, monobasic monohydrate (NaHCO3) | Fisher Scientific | 02-004-198 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | 02-003-265 | |
| D-Sorbitol | Sigma-Aldrich | S1876-500G | Replaces glucose |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C5670-500G | |
| EMD Millipore Durapore PVDF Membrane Filters: Hydrophilic: 0.22 µm Pore Size | Fisher Scientific | GVWP14250 | |
| Formalin Solution, 10% (Histological) | Fisher Scientific | SF98-20 | |
| Potassium Phosphate, Dibasic, Powder, Ultrapure Bioreagent | Fisher Scientific | 02-003-823 | |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Excelta Precision Tweezers with Very Fine Points | Fisher Scientific | 17-456-055 | Protocol does not require very fine points. |
| Anti-Tyrosine Hydroxylase Antibody | Pel-Freez Biologicals | P40101 | |
| Rat-Elav-7E8A10 anti-elav | The Developmental Studies Hybridoma Bank | Clone 7E8A10 | |
| Goat anti-Rat IgG (H+L) Secondary Antibody, Alexa Fluor 647 conjugate | ThermoFisher Scientific | A-21247 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | ThermoFisher Scientific | A-11037 | |
| DAPI Solution (1 mg/mL) | ThermoFisher Scientific | 62248 | |
| Propyl gallate powder | Sigma-Aldrich | P3130-100G | |
| Glycerol ACS reagent, ≥99.5% | Sigma-Aldrich | G7893-500ML | |
| Zeiss Axioimager Z1 | Zeiss | Quote | |
| Zeiss Apotome.2 | Zeiss | Quote | |
| Zen lite software | Quote |
Referenzen
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199, 639-653 (2015).
- Bellen, H. J., Yamamoto, S. Morgan's legacy: fruit flies and the functional annotation of conserved genes. Cell. 163, 12-14 (2015).
- Aso, Y., et al. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Reiter, L. T., Potocki, L., Chien, S., Gribskov, M., Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
- Yamagata, N., et al. Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A. 112, 578-583 (2015).
- Nern, A., Pfeiffer, B. D., Rubin, G. M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system. Proc Natl Acad Sci U S A. 112, 2967-2976 (2015).
- Waddell, S. Neural Plasticity: Dopamine Tunes the Mushroom Body Output Network. Curr Biol. 26, 109-112 (2016).
- Wolff, T., Iyer, N. A., Rubin, G. M. Neuroarchitecture and neuroanatomy of the Drosophila central complex: A GAL4-based dissection of protocerebral bridge neurons and circuits. J Comp Neurol. 523, 997-1037 (2015).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011, 1472-1474 (2011).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1, 2110-2115 (2006).
- Mao, Z., Davis, R. L. Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits. 3, 5(2009).
- White, K. E., Humphrey, D. M., Hirth, F. The dopaminergic system in the aging brain of Drosophila. Front Neurosci. 4, 205(2010).
- Yang, Y., et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proc Natl Acad Sci U S A. 103, 10793-10798 (2006).
- Greene, J. C., et al. Mitochondrial pathology and apoptotic muscle degeneration in Drosophila parkin mutants. Proc Natl Acad Sci U S A. 100, 4078-4083 (2003).
- Whitworth, A. J., et al. Increased glutathione S-transferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc Natl Acad Sci U S A. 102, 8024-8029 (2005).
- Pesah, Y., et al. Drosophila parkin mutants have decreased mass and cell size and increased sensitivity to oxygen radical stress. Development. 131, 2183-2194 (2004).
- Trinh, K., et al. Decaffeinated coffee and nicotine-free tobacco provide neuroprotection in Drosophila models of Parkinson's disease through an NRF2-dependent mechanism. J Neurosci. 30, 5525-5532 (2010).
- Kim, K., Kim, S. H., Kim, J., Kim, H., Yim, J. Glutathione s-transferase omega 1 activity is sufficient to suppress neurodegeneration in a Drosophila model of Parkinson disease. J Biol Chem. 287, 6628-6641 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten