Method Article
Une seule étape simple protocole Dissection pour Whole-mount Préparation des adultes
Dans cet article
Résumé
L'adulte drosophile cerveau est un système utile pour l' étude de circuits neuronaux, les fonctions supérieures du cerveau et des troubles complexes. Une méthode efficace pour disséquer tout le tissu du cerveau de la petite tête de mouche facilitera les études basées sur le cerveau. Nous décrivons ici une seule étape simple protocole, de la dissection des cerveaux adultes avec une morphologie bien préservée.
Résumé
Il y a un intérêt croissant pour l' utilisation de drosophile pour modéliser les maladies dégénératives cérébrales humaines, la carte circuitries neuronales dans le cerveau adulte, et d' étudier la base moléculaire et cellulaire des fonctions cérébrales supérieures. Une préparation toute monture de cerveaux adultes avec une morphologie bien conservée est critique pour de telles études sur la base du cerveau entières, mais peut être techniquement difficile et prend du temps. Ce protocole décrit une approche de dissection en une étape facile à apprendre, d'une tête de mouche adulte en moins de 10 s, tout en gardant le cerveau intact attaché au reste du corps pour faciliter les étapes de traitement ultérieures. La procédure permet de supprimer la plupart des tissus de l'oeil et trachéaux normalement associées au cerveau qui peut interférer avec l'étape de formation d'image ultérieure, et met également moins de demande sur la qualité de la pince à disséquer. En outre, nous décrivons une méthode simple qui permet le retournement commode des échantillons de cerveau montés sur une lamelle couvre-objet, ce qui est important pour imager les deux côtés du bpluies avec une intensité de signal similaire et de qualité. À titre d'exemple du protocole, nous présentons une analyse des dopaminergiques (DA) des neurones dans le cerveau adulte de WT (w 1118) mouches. L'efficacité élevée de la méthode de dissection, il est particulièrement utile pour des études basées sur le cerveau des adultes à grande échelle dans la drosophile.
Introduction
Le organisme modèle drosophile, communément connu comme la mouche des fruits, a longtemps été apprécié pour ses outils génétiques élégants, les temps de reproduction courtes et très conservée voies moléculaires et cellulaires. La mouche des fruits a été employée avec succès pour disséquer les voies de signalisation de base, les mécanismes de mise en forme d'organismes multicellulaires, ainsi que les mécanismes sous - jacents du développement neuronal, les fonctions et les maladies 1,2. Avec les récents progrès dans les technologies de marquage cellulaire et d' imagerie, le cerveau de la mouche des fruits est devenu particulièrement puissant dans la cartographie fine des circuits neuronaux et à disséquer la base moléculaire et cellulaire des fonctions cérébrales supérieures, telles que l' apprentissage et la mémoire, et le rythme circadien 1,3, 4,5,6,7,8.
Un avantage particulier du système Drosophila est sa taille relativement petite, ce qui permet toute monture préparation et l' examen du cerveau en utilisant un composé régulier ou microscope confocal. This fonctionnalité permet des analyses détaillées anatomiques et fonctionnelles des circuits neuronaux, ou même un seul neurone, au niveau cellulaire et subcellulaire, dans le contexte d'un tissu du cerveau entier, offrant ainsi à la fois une vision globale du sujet étudié et sa géométrie exacte dans l'ensemble cerveau. Cependant, étant donné la taille plutôt miniature du cerveau, il présente également un défi technique efficace de dissection d'un tissu cérébral intact sur le boîtier de protection de la tête d'exosquelette dans une mouche adulte. Diverses méthodes de dissection efficaces et relativement simples ont été décrites en détail, qui impliquent habituellement prudent et pas-sage retrait du boîtier de la tête et les tissus associés , y compris les yeux, de la trachée, et la graisse du cerveau proprement dit 9, 10 Ces méthodes de dissection. Microchirurgie placer souvent des exigences plutôt strictes sur la qualité de la pince de dissection, se fondant sur une pince avec de fines pointes bien alignées qui peuvent être facilement endommagés. En outre, comme les cerveaux disséqués sont souvent separated du reste du corps, le cerveau peuvent facilement être perdus au cours des processus de coloration et de lavage ultérieures en raison de leur petite taille et leur transparence dans la mémoire tampon de traitement. Ici, nous décrivons un protocole de dissection une étape relativement simple et facile à apprendre, pour les cerveaux adultes qui maintient les cerveaux disséqués attachés au torse. Le processus de dissection souvent efface facilement loin la plupart des tissus du cerveau associées telles que l'œil et de la trachée et réduit la demande pour les pinces de dissection de bonne qualité.
En outre, lorsque l'imagerie du cerveau au microscope composé fluorescent ou un microscope confocal, la partie du cerveau qui est éloigné de la source de lumière fluorescente produit souvent un signal plus faible et les images moins précises en raison de l'épaisseur du cerveau entier monture. Ici, nous décrivons également une méthode de montage simple qui permet de retournement facile des échantillons du cerveau, ce qui permet l'imagerie pratique des deux côtés du cerveau avec signal similaire intensity et de qualité.
Comme une preuve de concept pour l'application de cette méthode pour étudier le cerveau adulte, nous avons examiné en outre la présence de neurones dopaminergiques dans le cerveau des w 1118 mouches; un génotype qui est souvent utilisé comme la lignée parentale pour générer des mouches transgéniques et le contrôle de type sauvage dans de nombreuses études de drosophile.
Protocole
1. Solutions utilisées pour Brain Dissection et immunofluorescence
- Disséquer le cerveau adulte mouche artificielle dans le liquide céphalorachidien (aCSF): 119 mM de NaCl, 26,2 mM de NaHCO3, 2,5 mM de KCl, 1 mM de NaH 2 PO 4, 1,3 mM de MgCl2 et 10 mM de glucose. Avant utilisation, le gaz du LCRa avec 5% de CO 2/95% O 2 pendant 10 - 15 min et pic avec 2,5 mM de CaCl2. Stériliser la solution LCRa par filtration à travers un filtre membrane de 0,22 pm.
Remarque: Magasin LCRa à 4 ° C pour éviter toute contamination bactérienne. Fly cerveaux peuvent également être disséqués dans un tampon phosphate salin (PBS), bien que les comparaisons détaillées des effets des deux solutions de dissection sur la qualité finale des cerveaux disséqués d'imagerie n'a été réalisée. - En utilisant 4% de paraformaldehyde (PFA) préparé dans 1 x PBS comme solution fixative, qui est normalement aliquoté et conservé à -20 ° C.
caution: PFA est toxique et corrosif et doit être manipulé avec précaution. - Utilisez 1x PBS pour rincer la PFA à partir des cerveaux et après la dernière étape de lavage, au cours de la coloration immunofluorescente des cerveaux disséqués. Préparer le PBS 1x de 10x PBS solution mère (1,37 M de NaCl, 27 mM de KCl, 100 mM Na 2 HPO 4, et 18 mM KH 2 PO 4).
- Utiliser 0,3% de Tween-20 dans du PBS 1X (1x PBT) pour toutes les étapes ultérieures de lavage au cours de la coloration immunofluorescente des cerveaux disséqués.
2. Microsurgical Dissection des adultes Fly Heads
Remarque: La procédure de dissection est illustré sur la figure 1.
- Anesthetize les mouches adultes avec le CO 2. En utilisant des pinces, ramasser une mouche et brièvement DEWAX sa cuticule en le plongeant dans 70% d'éthanol pendant 3 - 5 s. Cela garantit que l'absence de bulles adhèrent à la cuticule de mouche lorsqu'il est immergé dans l'LCRa ou d'une solution de dissection PBS 1X.
- Sous undissection microscope avec une source de lumière à un angle qui ne sera pas bloquée par les mains, réglez l'objectif d'atteindre une vision claire de la mouche (1.2X grossissement). Utiliser une pince à la main non dominante pour immobiliser l'animal , et immerger la volée dans la solution froide de dissection avec son abdomen tournée vers le haut, comme représenté sur la figure 1A.
- Gardez la pince à 160 - angle de 170 ° par rapport à la plaque de dissection, tout en exerçant une petite force sur l'abdomen de la mouche (illustrée par des flèches sur la figure 1A). Cette étape va immobiliser la mouche et le forcer à déplacer la tête vers l'arrière par 15 - 25 ° tout en prolongeant la trompe vers le haut. Dans le processus, une région souple et translucide de la cuticule, sous les proboscidiens, devrait devenir apparente. Augmenter le grossissement et ajuster le plan focal sur cette région.
Note: Ne pas tenir la pince trop serré, mais plutôt juste assez ferme pour stabiliserla mouche. Une trop grande force entraînera les organes à l'intérieur de la rupture dans la solution. - Utilisez la main dominante pour appuyer sur la pince de dissection afin que ses conseils sont fermés, ce qui va générer une force de résistance légère sur les pointes de la pince, de sorte que la pince surgiront ouverte lorsque la pression de la main de maintien est libéré. Positionner la pince perpendiculairement à la pince de retenue à la volée, comme représenté sur la figure 1B.
- Pierce les astuces fermés de la pince de dissection à travers la région souple et translucide de la cuticule sous les proboscidiens, comme illustré par la flèche rouge sur la figure 1B. Il est important de ne pas pénétrer dans la pince trop profondément ce qu'elle touche le cerveau. Le cerveau proprement dit devrait devenir visible. Maintenir une prise stable de la volée avec la main non dominante.
- Rapidement mais sûrement, libérer les pointes des pinces à dissection par sa propre force et de compter sur l'élan de cette version pour arracher til entoure exosquelette la tête de mouche. Un cerveau intact appropriée devrait devenir visible (tissu blanc immédiatement au- dessus de la pointe de la pince inférieure de la figure 1C) Suivre une ligne imaginaire pour guider l'élan des conseils de pince libérés (illustrés comme les flèches rouges extérieurs illustrés à la figure 1C). Cela permettra d'éliminer en douceur l'exosquelette et la plupart de l'œil du cerveau associée et de la trachée du cerveau. Le moment et la force appropriée appliquée pour ouvrir l'exosquelette dépendra de l'expérience de l'enquêteur.
Note: Ceci est l'étape la plus critique lors de la dissection. Il est important de compter sur la force naturelle produite à partir de la dynamique de la pince d'ouverture pour enlever l'exosquelette tout en laissant le cerveau exposé reste attaché au reste du corps. - Utilisez la pince dans la main dominante pour retirer soigneusement les tissus accessoires résiduels, tels que le trachéale qui apparaît comme des structures de fibres blanches remaining attaché au cerveau. Veillez à ne pas tirer ou endommager le cerveau proprement dit.
3. immunofluorescence des cerveaux
- Fixer les échantillons de cerveau disséqués avec leurs torses associés dans environ 1 ml de 4% PFA pour 40 - 60 min.
Remarque: Pour cela et étapes ultérieures, garder les tubes ou les plaques avec des échantillons sur un nutator correctement mélanger les échantillons dans la solution. - Rinçage avec 1 ml de PBS 1x par pipetage de la solution vers le haut et vers le bas 3 fois. Veillez à ne pas aspirer les cerveaux loin.
- Laver 5 fois avec 1x PBT pendant 5 minutes chacun. Gardez les échantillons sur la nutator pendant l'incubation.
- Incuber avec des anticorps primaires à la dilution O bon / N à 4 ° C.
- Le lendemain, retirez les anticorps primaires, et laver les échantillons 5 fois avec 1x PBT. Laissez les échantillons pendant 5 - 10 min dans la solution 1x PBT entre chaque lavage. Gardez les échantillons sur la nutator pendant l'incubation.
- Incuber la laveéchantillons dans des anticorps secondaires appropriés avec la dilution et le temps d'incubation suggéré.
- Laver les échantillons à six reprises avec 1x PBT avec une incubation de 10 min entre chaque lavage.
Cette étape est essentielle pour l'élimination des anticorps secondaires liés de façon non spécifique de l'échantillon. - Incuber dans une dilution de 1: 10000 à 1 mg / ml de 4 ', 6'-diamidino-2-phénylindole (DAPI) dans une solution de PBT 1x pendant 30 min. DAPI est un colorant d'ADN qui se lie aux régions à l'ADN et peuvent être utilisées pour révéler la morphologie globale du cerveau.
- Rincer trois fois avec PBS 1x.
- échantillons de transfert à un plat de dissection, et séparer les cerveaux des corps dans un plat de dissection en utilisant une pince.
- Après la coloration et des étapes de lavage, monter les cerveaux entre deux lamelles et placez les lamelles sur le dessus d'une glissière de montage. De cette manière, les échantillons de cerveau peuvent facilement être basculés de sorte que les deux côtés du cerveau peut être imagée avec une intensité de signal similaire.
Note: Montage du cerveau sur la lamelle plutôt que directement sur la glissière de montage permet le retournement de l'orientation de l'échantillon librement. Le procédé de montage est expliquée plus en détail ci-dessous.- Placez un 18 x 18 mm lamelle sur le dessus d'une glissière de montage. Elargissez l'ouverture d'une pointe de pipette avec une lame et l'utiliser pour transférer le cerveau en solution PBS 1x sur le 18 x 18 mm lamelle.
- Placez le cerveau sur le milieu de la lamelle, enlever le liquide autour du cerveau avec une pointe de pipette bien, puis ajouter un autre 20 - 40 pi d'anti-fade milieu de montage (0,2% (p / v) n-propyle gallate dans 99,5 % qualité ACS glycérol) sur le cerveau.
Remarque: La quantité de milieu de montage ajouté dépend du nombre de cerveaux examinés. - Doucement étaler les cerveaux tout en déplaçant le milieu de montage visqueux vers l'extérieur. Placez une seconde 18 x 18 mm lamelle sur le dessus du cerveau par un premier abaissement de la lame d'un côté jusqu'à ce qu'il soit en contact avecla surface du glissement de montage, puis abaisser lentement l'autre côté pour minimiser le contact du cerveau avec des bulles d'air.
Remarque: il n'y a pas besoin d'utiliser une pièce d' écartement entre les deux lamelles couvre -objet , le volume du support de montage et le cerveau devraient fournir un espace suffisant pour séparer les deux lamelles. - Autoriser les diapositives à installer. Éliminer l'excès de liquide qui sortent des côtés des feuillets avec un tissu de laboratoire.
- Pour éviter que les lamelles avec les cerveaux montés de tomber de la glissière de montage pendant le transport, utiliser un petit morceau de ruban adhésif pour fixer les lamelles à la diapositive de montage.
Note: Brains montés entre les diapositives peuvent être visualisés immédiatement ou conservés à 4 ° C pendant jusqu'à une semaine sans perte significative de signal fluorescent, sans qu'il soit nécessaire d'utiliser un produit d' étanchéité pour sceller les diapositives. Pour la conservation à long terme des cerveaux colorés, du côté des deux feuillets peut être scellé with vernis à ongles et stocké dans un congélateur à -20 ° C, bien que les cerveaux colorés pourraient perdre leurs signaux au fil du temps. Ce n'est pas recommandé.
- Utiliser un microscope composé fluorescent approprié ou microscope confocal à l'image du cerveau.
- Tout d'abord, l'acquisition de l'image à partir du côté du cerveau plus proche de l'objectif, puis retourner soigneusement les lamelles pour que les échantillons pris en sandwich au milieu. Cette étape facilite l'acquisition de l'image de l'autre côté du même cerveau.
- Utilisez un microscope droit composé fluorescent et un objectif 20X à l' image du cerveau entier (exemples de la figure 2) et un objectif 40X d'images plus petites régions du cerveau, tels que les neurones dopaminergiques dans la région de cluster Paired Anterior Medial (PAM) (exemples sur la figure 3).
Résultats
La figure 1 illustre les principales procédures de cerveau adulte dissection, tel que décrit plus haut Les figures 2 et 3 sont des images représentatives de trois jours d'âge WT. (Génotype: w 1118) mouche adulte cerveau, qui ont été costained avec un anticorps dirigé contre la tyrosine hydroxylase (TH , coloré en rouge sur la figure 2 et blanc sur la figure 3), un marqueur couramment utilisé pour désigner des neurones dopaminergiques 11 en plus du colorant d'ADN DAPI pour marquer les noyaux cellulaires et un anticorps contre la protéine Elav, un marqueur pour les neurones différenciés à la volée (colorée en vert), qui, ensemble, ont révélé la structure globale du cerveau.
Pour les anticorps primaires dans les figures 2 et 3, on a utilisé un anticorps de lapin anti-TH à une dilution de 1: 200 et de rat anticorps anti Elav à une dilution de 1: 100, WHIont été préparés ch en 1x PBT avec 5% de sérum de chèvre normal pour bloquer la liaison non spécifique. Pour des anticorps secondaires, on a utilisé Alexa Fluor anticorps de chèvre anti-rat conjugué à 488 et de chèvre AlexaFluor596 conjugué anticorps anti-lapin à une dilution de 1: 500 dans 1 x PBT.
Pour l'image du cerveau, nous avons utilisé un microscope composé fluorescent vertical équipé d'une fonction de ApoTome pour acquérir des images Z-stack de tranches de cerveau qui couvrent toute la profondeur de la région de l'intérêt dans le cerveau. Par exemple, pour obtenir une visualisation claire de la distribution générale des neurones dopaminergiques dans le cerveau entier, nous avons utilisé un objectif 20X à l' image séparément les côtés antérieur et postérieur du même cerveau (Figure 2). La profondeur de chaque côté du cerveau imagé qui peut couvrir tous les neurones DA est d'environ 20 à 25 um au total. Pour visualiser de manière fiable et quantifier les neurones dopaminergiques dans la région de cluster de PAM, qui ont des tailles de cellules plus petites et plus faibles TH signaux (voir ci-dessous), nous avons utilisé un objectif 40X. En outre, dans la fonction d'acquisition série Z du logiciel commercial, nous avons sélectionné une épaisseur de coupe de 0,5 à 1 um entre chaque tranche imagée, qui assure une qualité d'image optimale dans une reconstruction 3D de la région de cluster PAM (Figure 3c). L'épaisseur de la grappe PAM dans le cerveau qui couvre tous les neurones dopaminergiques est d'environ 8-10 pm au total. Dans notre expérience, la fonction ApoTome peut réduire de manière significative le signal de bruit dans l'imagerie des échantillons épais avec un bruit de fond, comme un cerveau entier ou de la région de cluster PAM.
Figures 2A-E montrent la vue antérieure d'un cerveau, alors que les figures 2F-J montrent la vue postérieure du même cerveau après retournement des lamelles qui maintiennent les échantillons de cerveau, qui affichent un niveau d'intensité de signal similaire entre deux côtés du cerveau pour tous les trois canaux imagées. Le neur DAons ont été regroupées en différents groupes suivants au début désignation 11, bien que nous utilisons ici le nom Couplé Postérieur Medial (PPM) pour inclure le PPM1, PPM2 et grappes ppm3 à la face antérieure du cerveau, et le nom Couplé Postérieur latéral (PPL ) pour couvrir les grappes PPL1 et pPL2 de la face postérieure du cerveau, comme représenté sur les figures 2E et 2J. figures 2E et 2J en blanc montrent antérieure et vues postérieures du même cerveau en fort grossissement, révélant les différents groupes de DA neurones sur les deux côtés du cerveau. Le blanc lignes pointillées mettent en évidence le PAM proéminent et Paired Anterior latéral (PAL) grappes dans la partie antérieure du cerveau (Figure 2F), ainsi que la PPL et les clusters de PPM dans la partie postérieure du cerveau (Figure 2J).
Les figures 3A et 3B , un re des résumés des résultats de quantification pour certains des groupes DA en 1118 w mouches. Nous avons compté les neurones DA tranche par tranche et aussi de 3D reconstruit des images, ce qui devrait réduire le comptage imprécis. Nous estimons que les 3 jours d'âge w 1118 mouches ont une moyenne de 27 neurones DA globale du cluster PPM par le cerveau, 16 neurones dopaminergiques dans le cluster PPL par hémisphère, 5 neurones DA en cluster PAL par hémisphère (figure 3A), et 97 neurones dopaminergiques dans chacune des grappes de PAM (figure 3B). la figure 3C est une reconstruction 3D représentant des neurones dopaminergiques dans les PAL et PAM clusters, projetés à partir de tranches d'images à fort grossissement couvrant l' ensemble des neurones dopaminergiques dans cette région. Il est évident que par rapport à d'autres groupements, tels que le PAL, les neurones dopaminergiques dans la grappe PAM ont des tailles de cellules relativement petites et des signaux de coloration les plus faibles TH.
"Src =" / files / ftp_upload / 55128 / 55128fig1.jpg "/>
Figure 1:. Illustration graphique du Protocole Dissection pour adultes Drosophila cerveau (A) Les mouches sont positionnés avec la face ventrale vers le haut, et maintenus par le thorax en utilisant la main non dominante. Force a été doucement appliquée (flèches rouges) à la pince pour induire l'inclinaison vers l'arrière de la tête de mouche et légère extension vers l'extérieur de la trompe, l'exposition de la région transparente blanche au-dessous. (B) Forceps de la main dominante sont insérés dans la région transparente sous les proboscidiens, créant une incision peu profonde (flèche rouge). Notez que la pince que nous utilisons n'ont des extrémités très fines pointes. (C) Forceps sont autorisés à se démarquer par sa propre force, comme indiqué par les flèches rouges. La dynamique engendrée par l' ouverture de la pince supprime les yeux et exosquelette, exposant un cerveau Drosophila relativement propre. La majeure partie de la trachée sont éliminés dans le processus. ( D) tissus accessoires excédentaires entourant le cerveau sont soigneusement taillés loin pour une exposition complète du cerveau appropriée. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
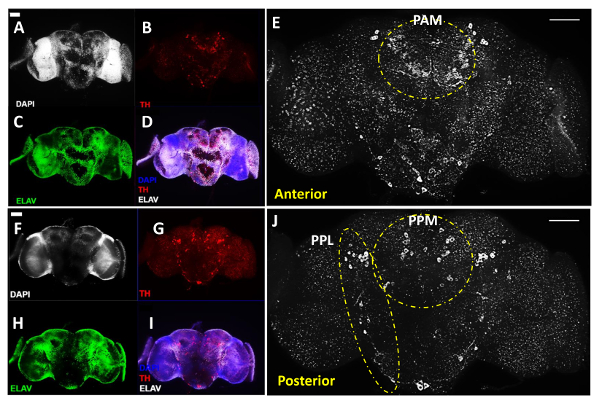
Figure 2:. DA Neurones Revealed anti-Tyrosine hydroxylase (TH) anticorps chez les hommes adultes Drosophila B pluie (acquise avec un objectif 20X) Ce chiffre comprend des images représentatives de cerveaux adultes disséqués, reconstruit en utilisant des images Z-stack de la région du cerveau de intérêt obtenue avec le microscope à fluorescence composé. (AE) Anterior et (FJ) vues postérieures du même cerveau adulte; (A et F) Les noyaux cellulaires ont été imagées par coloration DAPI (blanc) et (C & H) w neuronesere marqué par le marqueur pan-neuronal anti-Elav anticorps (vert); Neurones (B & G) DA sont révélées par des anticorps anti-TH (rouge). (D & I) Superposition des images pour DAPI, TH et le traitement Elav. (E & J) Vue agrandie des régions du cerveau avec des neurones dopaminergiques indiqués en blanc. Les lignes pointillées mettent en évidence les PAL et PAM clusters dans la partie antérieure du cerveau et PPL et PPM grappes dans la partie postérieure du cerveau. La barre d'échelle représente 50 um dans tous les panneaux. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Quantification de DA Neurones dans le cerveau des adultes Homme w 1118 mouches (acquis avec un objectif 40X). (A & B) Quantification de DA neurons de jour 3 mâle w 1118 mouches, révélées par la coloration anti-TH. Les données sont représentées par quartiles des graphiques représentant les valeurs minimales et maximales que les valeurs aberrantes; ainsi que le premier (Q1), second (Q2) et troisième (Q3) quartiles. Le deuxième quartile est représentée par la valeur moyenne. (A) PPM {(n = 28) Min: 21, Q1: 24, moyenne: 27, Q2: 30, Max: 32}, PPL {(n = 26) Min: 10, Q1: 12, moyenne: 16, Q2: 18, Max: 25} et {PAL (n = 24), Min: 2, Q1: 4, moyenne: 5, Q2: 5, Max: 10} grappes; Groupe (B) PAM {(n = 20) Min: 86, Q1: 94, moyenne: 97, Q2: 97, Max: 99}. (C) Une image de projection représentatif montrant les neurones dopaminergiques dans les PAM et PAL grappes de mâle w 1118 mouches à 3 d. La barre d'échelle représente 20 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Avec un intérêt croissant à l' aide de la drosophile adulte cerveau pour étudier les maladies humaines du cerveau, circuits neuronaux et les fonctions supérieures du cerveau, il est nécessaire de développer des méthodes simples et rapides pour obtenir les cerveaux des mouches intactes pour toute monture d' analyses, ce qui est particulièrement important pour les Large- l'échelle des écrans à base de cerveau. Notre méthode fournit un moyen simple et facile à apprendre approche de disséquer une tête de mouche (souvent en moins de 10 s avec expérience) ayant une morphologie bien conservée qui est largement effacé des tissus associés. Comme les cerveaux disséqués sont encore attachés au reste des corps de mouche, ils coulent habituellement au fond du tube d'échantillon rapidement et sont faciles à reconnaître et à recueillir au cours de lavage et de coloration étapes. Cela réduit considérablement les pertes échantillon qui peut être une question de premier plan dans le traitement des échantillons de cerveau de petites tailles physiques. Ce problème peut être particulièrement important pour les études à grande échelle. Le cerveau peut être facilement détaché du corpsaprès l'achèvement du processus de teinture, avant le montage.
Au cours de la dissection, il est important de positionner correctement la volée, à maintenir les angles appropriés lors du retrait de l'exosquelette de la tête de braguette, et doucement exercer la force appropriée pour effectuer chaque étape. Il est recommandé que les pinces sont disposées perpendiculairement les unes aux autres afin d'empêcher la décapitation de la mouche (figure 1B). Comme on le voit dans les images de représentation dans la figure 2, les cerveaux préparés en utilisant ce protocole de produire des résultats satisfaisants. Dans cet exemple, nous nous sommes concentrés sur les neurones dopaminergiques dans le cluster de PAM de cerveaux adultes. Un cerveau de drosophile en moyenne a un total d'environ 280 neurones DA par protocérébron, qui sont répartis dans des groupes distincts dans les différentes régions du cerveau avec des motifs de projection distinctifs et sortie fonctionnelle 11, 12. Caractérisation précédente des neurones dopaminergiques dans adultes cerveaux drosophile, including voler modèles de gènes de maladies humaines telles que des mutants parkin, ont principalement porté sur le PAL, les clusters PPL, et PPM qui ont relativement grandes tailles de cellules et expression importante de TH, le fabricant standard utilisé pour l' étiquetage des neurones DA 13-18.
Cependant, la majorité des neurones dopaminergiques dans le cerveau des mouches se trouvent dans les grappes de PAM, avec environ 100 neurones dopaminergiques par cluster. Par rapport à des cellules dans d'autres grappes DA, les neurones dopaminergiques dans le cluster PAM montrent normalement un niveau d'expression de la tyrosine hydroxylase et de la taille des cellules plus petites plus petites. Dans les échantillons préparés à partir de notre protocole de dissection et la coloration, les neurones dopaminergiques dans le cluster de PAM peuvent être clairement visualisées et imagés en haute qualité en utilisant un microscope à fluorescence composé, sans imagerie confocale. Compte tenu de son grand nombre, la quantification des neurones dopaminergiques dans le cluster de PAM de différentes origines génétiques pourrait produire des résultats plus fiables et reproductibles. Nous suggérons que les neurones dopaminergiques dans les clus PAMter représentent un autre système utile pour étudier la biologie de DA et de modélisation des troubles liés à DA, tels que la maladie de Parkinson.
Dans notre expérience, la fonction ApoTome du microscope, nous avons utilisé peut réduire considérablement le signal de fond, en particulier dans l'examen d'échantillons avec une épaisseur importante, comme l'ensemble du cerveau de la mouche adulte. Bien microscope confocal peut produire des images avec plus de détails, plus fort grossissement et de meilleure qualité, il est souvent fastidieux et coûteux. Cela est particulièrement vrai pour l'imagerie d'un grand nombre d'échantillons épais tels que le cerveau adulte qui nécessitent série de section Z-stack pour la reconstruction 3D claire et l'analyse de déconvolution. Dans cette perspective, la fonction ApoTome représente une alternative rapide et rentable pour produire des images de qualité suffisante (par exemple, des images dans les figures 2 et 3).
Dans les études sur le cerveau, il est souvent nécessaire de cellules d'image à la fois sides du même cerveau. Par exemple, les neurones dopaminergiques sont présents dans des groupes à la fois des côtés antérieur et postérieur du cerveau. Cependant, en raison de son épaisseur, après un cerveau est monté sur la glissière, du côté opposé à la source de lumière (ie, la face tournée vers la glissière de montage) donne généralement lieu à des signaux plus faibles et des images moins claires lorsque imagée en utilisant le composé régulier et confocal microscopes. En montant les échantillons entre les deux lames de couverture, il permet le retournement pratique des échantillons sur la lame montée et ensuite imagerie des deux côtés du même cerveau avec des intensités de signaux similaires. La figure 2 est un exemple d'imagerie neurones dopaminergiques des deux côtés de voler les cerveaux en utilisant cette méthode, qui a montré l'intensité de signalisation relativement comparables et de qualité d'image.
Plusieurs approches faciles à suivre pour disséquer les adultes voler les cerveaux ont été bien décrit 9, 10. Notre approche fournit une méthode alternative qui peut fourrurether simplifier les processus de dissection et de coloration des adultes volent cerveaux. Avec plus d' études à grande échelle menées pour cartographier l'ensemble de circuits neuronaux du cerveau ainsi que ses constituants moléculaires et cellulaires, il est prévisible que la dissection et d' imagerie des approches automatisées peuvent être développés pour adultes Drosophila cerveaux pour réaliser des écrans génétiques et de drogues à haut débit in vivo dans ce modèle génétique classique.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Nous reconnaissons M. Enes Mehmet, Mme Kiara Andrade, Mme Pilar Rodriguez, Chris Kwok, et Mme Danna Ghafir pour leur immense soutien au projet.
matériels
| Name | Company | Catalog Number | Comments |
| w*; parkΔ21/TM3, P{GAL4-Kr.C}DC2, P{UAS-GFP.S65T}DC10, Sb1 | Bloomington Drosophila Stock Center | 51652 | Balancer was switched to TM6B |
| PBac{WH}parkf01950 | Exelixis at Harvard Medical School | f01950 | Balancer was switched to TM6C |
| NaCl | Fisher Scientific | S640-500 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | 02-003-990 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, monobasic monohydrate (NaHCO3) | Fisher Scientific | 02-004-198 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | 02-003-265 | |
| D-Sorbitol | Sigma-Aldrich | S1876-500G | Replaces glucose |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C5670-500G | |
| EMD Millipore Durapore PVDF Membrane Filters: Hydrophilic: 0.22 µm Pore Size | Fisher Scientific | GVWP14250 | |
| Formalin Solution, 10% (Histological) | Fisher Scientific | SF98-20 | |
| Potassium Phosphate, Dibasic, Powder, Ultrapure Bioreagent | Fisher Scientific | 02-003-823 | |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Excelta Precision Tweezers with Very Fine Points | Fisher Scientific | 17-456-055 | Protocol does not require very fine points. |
| Anti-Tyrosine Hydroxylase Antibody | Pel-Freez Biologicals | P40101 | |
| Rat-Elav-7E8A10 anti-elav | The Developmental Studies Hybridoma Bank | Clone 7E8A10 | |
| Goat anti-Rat IgG (H+L) Secondary Antibody, Alexa Fluor 647 conjugate | ThermoFisher Scientific | A-21247 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | ThermoFisher Scientific | A-11037 | |
| DAPI Solution (1 mg/mL) | ThermoFisher Scientific | 62248 | |
| Propyl gallate powder | Sigma-Aldrich | P3130-100G | |
| Glycerol ACS reagent, ≥99.5% | Sigma-Aldrich | G7893-500ML | |
| Zeiss Axioimager Z1 | Zeiss | Quote | |
| Zeiss Apotome.2 | Zeiss | Quote | |
| Zen lite software | Quote |
Références
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199, 639-653 (2015).
- Bellen, H. J., Yamamoto, S. Morgan's legacy: fruit flies and the functional annotation of conserved genes. Cell. 163, 12-14 (2015).
- Aso, Y., et al. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Reiter, L. T., Potocki, L., Chien, S., Gribskov, M., Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
- Yamagata, N., et al. Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A. 112, 578-583 (2015).
- Nern, A., Pfeiffer, B. D., Rubin, G. M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system. Proc Natl Acad Sci U S A. 112, 2967-2976 (2015).
- Waddell, S. Neural Plasticity: Dopamine Tunes the Mushroom Body Output Network. Curr Biol. 26, 109-112 (2016).
- Wolff, T., Iyer, N. A., Rubin, G. M. Neuroarchitecture and neuroanatomy of the Drosophila central complex: A GAL4-based dissection of protocerebral bridge neurons and circuits. J Comp Neurol. 523, 997-1037 (2015).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011, 1472-1474 (2011).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1, 2110-2115 (2006).
- Mao, Z., Davis, R. L. Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits. 3, 5(2009).
- White, K. E., Humphrey, D. M., Hirth, F. The dopaminergic system in the aging brain of Drosophila. Front Neurosci. 4, 205(2010).
- Yang, Y., et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proc Natl Acad Sci U S A. 103, 10793-10798 (2006).
- Greene, J. C., et al. Mitochondrial pathology and apoptotic muscle degeneration in Drosophila parkin mutants. Proc Natl Acad Sci U S A. 100, 4078-4083 (2003).
- Whitworth, A. J., et al. Increased glutathione S-transferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc Natl Acad Sci U S A. 102, 8024-8029 (2005).
- Pesah, Y., et al. Drosophila parkin mutants have decreased mass and cell size and increased sensitivity to oxygen radical stress. Development. 131, 2183-2194 (2004).
- Trinh, K., et al. Decaffeinated coffee and nicotine-free tobacco provide neuroprotection in Drosophila models of Parkinson's disease through an NRF2-dependent mechanism. J Neurosci. 30, 5525-5532 (2010).
- Kim, K., Kim, S. H., Kim, J., Kim, H., Yim, J. Glutathione s-transferase omega 1 activity is sufficient to suppress neurodegeneration in a Drosophila model of Parkinson disease. J Biol Chem. 287, 6628-6641 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon