Method Article
Методы изоляции, культуры и функциональная характеристика САУ миоцитов от взрослых мышей
В этой статье
Резюме
Методы продемонстрированы для выделения САУ миоцитов (Sams) от взрослых мышей для патч зажим электрофизиологии или визуализации исследований. Выделенные клетки могут быть использованы непосредственно или могут быть сохранены в культуре, чтобы обеспечить экспрессию белков, представляющих интерес, таких как генетически кодируемых репортеров.
Аннотация
САУ миоциты (Sams) действуют как естественные кардиостимуляторы сердца, инициируя каждым ударом сердца путем генерации спонтанных потенциалов действия (APS). Эти кардиостимуляторов точки доступа отражают согласованную деятельность многочисленных мембранных токов и внутриклеточного кальция езды на велосипеде. Однако точные механизмы, которые управляют спонтанное кардиостимулятора активности в SAMs остаются неуловимыми. Остро изолированные SAMs являются существенной подготовки для экспериментов рассекать молекулярной основы сердца pacemaking. Тем не менее, нечеткие анатомия, комплекс микродиссекции и привередливые ферментативные условия пищеварения предотвратили широкое применение остро изолированной ЗУР. Кроме того, методы не были доступны до недавнего времени, чтобы обеспечить долгосрочную культуру SAMs для экспрессии белка исследований. Здесь мы предлагаем протокол и демонстрации видео шаг за шагом для выделения SAMs от взрослых мышей. Способ также демонстрируется для поддержания взрослой мыши Sams в пробирке и для Expressiна экзогенных белков через аденовирусной инфекции. Остротоксичные выделяли и культивировали МССП, приготовленные с помощью этих методов пригодны для различных электрофизиологических и визуализации исследований.
Введение
Кардиостимулятор миоциты в САУ сердца (синусовый миоциты, "SAMs") порождают спонтанные, ритмические потенциалы действия (AP), которые распространяются через миокард инициировать каждый сердцебиение. Эксперименты с использованием остро изолированных Sams из многих видов были необходимы для выяснения механизмов, которые способствуют генерации пейсмекерной активности. SAMs являются узкоспециализированными кардиомиоциты, которые существенно отличаются от их аналогов в предсердий и желудочков миокарда с точки зрения морфологии, функции и экспрессии белка. Отличительной чертой спонтанных точек доступа в SAMs является спонтанной деполяризации во время диастолы , что приводит мембранный потенциал к порогу , чтобы вызвать следующую AP 1,2. Этот "кардиостимулятор потенциал" зависит от скоординированной деятельности многих различных мембранных токов в том числе "забавной тока" (I F), t- и L-типа токи кальция и обменник Curr натриево-кальциевоголор (I NCX), который приводится в действие Ca 2+ освобождения из саркоплазматического ретикулума 3,4.
В то время как остро изолированные мыши SAMs являются существенной экспериментальной подготовки для изучения pacemaking, выделение SAMs у мышей может быть сложным способом принять, потому что нечеткие анатомии и небольшой размер мыши SAN требует нюансированный микродиссекции и комбинированный ферментативных и механических диссоциации клеток требует тщательной оптимизации.
Мы предлагаем здесь подробное видео - демонстрацию протокола , который был успешно использован для выделения Sams от взрослых мышей для патч зажим записи 5-8. Насколько нам известно, нет такой визуальной демонстрации доступны из любого другого источника. Кроме того, новый метод демонстрируется , в котором изолированный Sams от взрослых мышей может поддерживаться в пробирке в течение нескольких дней, позволяя тем самым введение белков, генетически кодируемыхрепортерные молекулы или RNAi через аденовирусной инфекции 9.
протокол
Все процедуры на животных были проведены в соответствии с протоколами, утвержденными Institutional Animal Care и использование комитета Университета Колорадо Медицинский центр Anschutz мимо. Стандартный протокол ниже был оптимизирован с использованием самцов C57BL / 6J 2-3-месячного возраста.
1. Подготовка запасов и расходных материалов Solution в преддверии экспериментов
Примечание: Обратитесь к материалам таблице для необходимого оборудования и расходных материалов.
- Готовят 1 л каждого из следующих растворов , как указано в таблице 1: Низкая, Ca 2+ / Mg 2+ Тирода, модифицированная сульфатная-Brühe (KB) Раствор, и бычьего сывороточного альбумина (БСА) Раствор Complete Тирода. Использование сверхчистых фильтруется деионизованной воды для всех растворов. Разделите каждое решение на аликвоты по 50 мл и хранят при температуре 20 ° С в течение до шести месяцев. Оттепель отдельные аликвоты непосредственно перед экспериментами, и хранить до одной недели на 46; С.
- Приготовьте 50 мл 10 мМ NaCl и 1,8 мМ CaCl 2 Адаптации раствора путем растворения NaCl и CaCl 2 в сверхчистой фильтруется деионизированной воды (таблица 1). Хранить при комнатной температуре на срок до шести месяцев.
- Подготовка 4,75 фермента единица активности (U) аликвот эластазы пипеткой в микроцентрифужных пробирках. Хранить при температуре 4 ° С в течение до трех месяцев.
- Приготовьте 375 мкг аликвот (сверхчистых H 2 O) коллагеназы-фермента протеазы смесь с помощью пипетки в микроцентрифужных пробирках. Хранить при температуре -20 ° С в течение до трех месяцев.
- Приготовьте два пожарных полировкой пипетки Пастера, один для переноса ткани (~ 1,5 мм Окончательный диаметр отверстия; Рисунок 1Aiv и рисунок 1С) и один для диссоциации (~ 2 мм в диаметре; рис и 1Aiii Рисунок 1C).
- Score пипетки Пастера с резаком стекла и сменной вдоль счет, чтобы произвести отверстие немного больше, чем требуемый размер. Огонь-Польское обрезанный конец каждого пипетку в течение ~ 30-60 сек на слабом огне на горелку, чтобы произвести толстую полированную стенку и отверстие нужного диаметра. Убедитесь, что открытие огня полированного свободен от каких-либо трещин или шероховатостей.
- Подготовьте два рассечение блюда путем добавления ~ 25 мл силиконового эластомера смешивают в соответствии с инструкциями производителя к каждому 100 мм чашки Петри (рис 1ai и рис 1В). Дайте отвердеть при комнатной температуре в течение 48 ч.
- Для культуры только: подготовить 25-50 мл каждый Покрытие среднего и культура Средние согласно Таблице 2 Хранение до двух недель при температуре 4 ° С..
2. Готовят растворы для использования на День карцер
Примечание: Следующие суммы предназначены для изоляции синоатриальной миоцитов от одной мыши.
- Добавить 2,5 мл Низкий Ca 2+ / Mg 2+ Тирода (рН 6,9) к каждому из трех небольших, с круглым дном трубки культурыs. Место труб в ванне 35 ± 1 ° C воды.
- Добавить 2,5 мл Low Ca 2+ / Mg 2+ Тирода в один большой с круглым дном культуры трубки. Для этой трубки, добавьте 1 аликвоты (4,75 U) эластазы и одну аликвоту (375 мкг) коллагеназы-протеазы фермента смесь. Вихревой перемешать. Место трубки в 35 ± 1 ° С водяной бане.
- Добавить 2,5 мл KB средней до трех дополнительных небольших, с круглым дном пробирки культуры и один дополнительный большой, с круглым дном трубки культуры. Место труб в ванне 35 ± 1 ° C воды.
- Добавить ~ 7 мл раствора БСА в одну большую Bottomed культуральную пробирку. Держите эту трубку при комнатной температуре.
- Поместите 20-40 мл раствора Complete Тироде в 50 мл стакане (рис 1Aii). Добавьте 10 USP / мл гепарина, вихрем перемешать и поместить стакан в C водяной бане в 35 ° ± 1.
3. Подготовить дополнительные решения и материалы для культивируемых клеток (пропустить эти шаги для Остротоксичные изолированных клеток)
- В стерильной культуре ткани капот, поместите два 12 мм круглые покровные стекла на мышь в отдельные лунки 24-луночного планшета.
Примечание: Пластина 24 также используется, поскольку колодцы представляют собой удобный размер, который служит для ограничения объема для последующих вирусных инфекций. - Пипетка приблизительно 200 мкл 100 нг / мл раствора ламинин мыши, разведенного в стерильный физиологический раствор с фосфатным буфером (PBS), на каждом покровном.
- Инкубируйте покровные с ламинин на время изоляции (по крайней мере 1 ч) в термостате при 37 ° С.
- Предварительно теплый гальванического покрытия среднего и культуральную среду (с шага 1.7 и таблице 3) до 37 ° С.
4. САУ Изоляция
- В химическом вытяжном шкафу, поместите курсор в одной камере коробки двухкамерной и обезболить с ~ 200 мкл жидкого изофлуран, введенного с помощью ватного тампона в другую камеру. Подтверждение анестезии (обычно в пределах ~ 30-60 сек) с носком крайнем случае. Эвтаназиимышь шейным смещением.
Примечание: пустой 1 мл пипетки коробка может быть использована для формирования коробки двухкамерным; повернуть стойку вниз головой в коробке, чтобы создать отдельный отсек для изофлуран, чтобы предотвратить мышь от контакта его непосредственно. - Удалить мех из груди с ножницами и разрезам грудной клетки , чтобы разоблачить грудной полости с помощью щипцов внешние ткани (рис 1Aviii) и рассечение ножницами (рис 1Avix). Купайтесь грудной полости с ~ 2 мл нагретый Complete Тирода с гепарин с использованием пипетки передачи.
ПРИМЕЧАНИЕ: Продолжайте купания грудной полости, когда это необходимо, не позволяют препарат высохнуть. - Под микроскопом рассекает, тщательно удалить легкие и тимуса с использованием внутренних ножниц (рис 1Avi) и рассечение пинцет (рис 1Avii).
- В то время как нежно держа верхушку сердца с внутренними щипцов рассечение, тщательно вырезать нижнюю полую вену и Aорта с внутренними ножницами, чтобы удалить сердце из полости грудной клетки. Перенести сердце одному из рассечение блюд силиконовых и омыться ~ 4 мл утепленные гепарин Полная Тирода с помощью пипетки передачи.
- Orient сердце таким образом, что задние сосуды видны и лицевой стороной вверх, с правом предсердии животного на правом экспериментатора и левого предсердия на левом экспериментатора. После того, как ориентированные, иммобилизации сердце закрепив через вершину в силиконовую рассечение блюдо.
- Расположить паз между желудочками и предсердиями (прозрачный кольца над желудочками).
- Используя внутренние ножницы рассечение, сделать надрез в канавке, держа ближе к желудочков, чем предсердия. Промыть канавку и надрез с дополнительным нагретый гепарин Полная Тирода по мере необходимости, чтобы обеспечить четкое представление о предсердия и клапанов. Продолжайте разрезать вдоль канавки, чтобы отделить предсердия от желудочков.
- Передача предсердной ткани ко второму силиконовое рассечение блюдо и омыться ~ 3 мл утепленные гепарин Полная Тирода.
- Orient ткань так, что правое предсердие животного находится теперь на левом экспериментатора, а левое предсердие справа.
Примечание: правое предсердие является более прозрачным, в то время как левое предсердие имеет больше темно-красного тона. - Закрепление ткани через нижнюю и верхнюю полую cavae и правого и левого предсердия придатков, растягивая препарат осторожно. Удалите все оставшиеся жир или другие ткани, чтобы обеспечить четкое представление о подготовке (будьте осторожны, чтобы не врезаться в стенку предсердия, как синусовый узел является весьма сложным и может быть легко повреждена).
- Откройте переднюю стенку предсердия путем перерезания полых вен. Повторно установите штифты по мере необходимости визуализировать межпредсердной перегородки.
- Разрежьте вдоль межпредсердной перегородки, чтобы удалить левое предсердие. Re-контактный препарат, растяжка мягко.
- Удалить тон в правом предсердии придаток и освободить САУ путем разрезания вдоль крист, которая терминальной появляется в виде темно-оранжевой полосой, граничащей с ушка предсердия.
- Повторно придавить узловую ткань и вырежьте его в поперечном направлении (перпендикулярно кристе терминальной) производить три одинаковых по размеру полос.
5. САУ Переваривание
- Использование узкой огневой полировкой пипетка (рис 1Aiv), передают три полоски ткани синусового узла в первый из трех небольших, с круглым дном пробирку , содержащую 2,5 мл низкой Са 2+ / Mg 2+ Тироде в 35 ± 1 ° водяная баня C. Инкубировать в течение 5 мин.
- Передача тканевых полосок на второй маленький, с круглым дном пробирку , содержащую 2,5 мл низкой Са 2+ / Mg 2+ Тироде в C водяной бане в 35 ° ± 1, используя ту же узкую пипетку. Вымойте полоски ткани, осторожно вращая трубку или осторожно пипеткой с узким пипеткой. Не Инверт трубку.
- Передача ткани полосы к третьей маленькой, с круглым дном пробирку , содержащую 2,5 мл низкой Са 2+ / Mg 2+ Тирода, и повторите стадии промывки , описанную в пункте 5.2.
- Передача полосы в большом круглым дном пробирку , содержащую 2,5 мл низкой Са 2+ / Mg 2+ Тироде с ферментами (эластаза плюс коллагеназы-протеазы , смесь) в водяной бане от 35 & deg ; C. Убедитесь в том, что все три полоски ткани присутствуют. Выдержите в течение 10-15 мин при температуре 35 ± 1 ° С. Смешайте каждые 5 минут, осторожно взбалтывая трубку. Не инвертировать трубку.
6. САУ миоцитов диссоциация
- После ферментативного расщепления, использовать узкий огневой полировкой пипетки, чтобы аккуратно перенести полоски ткани на первой маленькой, с круглым дном пробирку, содержащую 2,5 мл раствора КБ при 35 ± 1 ° С. Вымойте ткань, осторожно вращая трубку.
Примечание: Тканевые полоски будут выглядеть несколько полупрозрачным и могут слипаться в гоявляется точка. Ручка очень осторожно после ферментативного расщепления, чтобы избежать потери клеток. - Передача ткани ко второму небольшим круглым дном пробирку, содержащую 2,5 мл кБ при 35 ± 1 ° С. Вихревой аккуратно мыть.
- Передача ткани к третьему небольшим круглым дном пробирку, содержащую 2,5 мл кБ при 35 ± 1 ° С. Вихревой аккуратно мыть.
- Передача ткани в большой, с круглым дном пробирку, содержащую 2,5 мл кБ при 35 ± 1 ° С.
- Используя больший огневой полировкой пипетка (рис 1Aiii и рис 1C), диссоциируют клетки в большом круглым дном трубы с постоянным растиранием приблизительно 0,5-1 Гц в течение 5-10 мин, следя за тем, чтобы держать диссоциации трубки , погруженной в 35 ± 1 ° с и водяную баню, чтобы избежать введения пузырьков в раствор.
Примечание: растирание время изменяется в зависимости от диаметра диссоциации пипеткой и силы пипеткой. Время должно быть отрегулировано таким образом, чтобы кусочки ткани оставаясь при Тон конец диссоциации появляются тонкие, прозрачные и тонкие. Если ткань сохраняет любой цвет, диссоциация, вероятно, будет неполным. Частота (0,5-1 Гц) определяется вручную. - Удалить с круглым дном трубки, содержащей диссоциирует Sams из водяной бани и уравновешивают при комнатной температуре в течение 5 мин.
7. САУ кальция реадаптации (Выполняется при комнатной температуре)
ПРИМЕЧАНИЕ: Для ЗУР, предназначенных для экспериментов культуры, процедуры, описанные в следующем разделе должны быть выполнены в стерильной капот культуры ткани. Если МССП должны использоваться для острых опытах, нет необходимости выполнять действия в стерильной среде.
- Добавить 75 мкл NaCl / CaCl 2 раствора адаптации (таблица 2). Вихревой аккуратно перемешать и инкубировать в течение 5 мин.
- Добавьте 160 мкл NaCl / CaCl раствора 2 адаптации. Вихревой аккуратно перемешать и инкубировать в течение 5 мин.
- Добавить 390 мкл BSA зольсоциологическое загрязнение (таблица 2). Вихревой аккуратно перемешать и инкубировать в течение 4 мин.
- Добавить 1,25 мл раствора БСА. Вихревой аккуратно перемешать и инкубировать в течение 4 мин.
- Добавить 4,37 мл раствора БСА. Вихревой аккуратно перемешать и инкубировать в течение 4 мин.
Примечание: Конечная концентрация кальция будет 1,8 мМ. - После кальция реадаптации, собирать Sams, позволяя осесть под действием силы тяжести в течение ~ 10 мин или центрифугированием при ~ 2000 мкг в течение 3 мин.
- Для остро выделенные клетки, осторожно удалить и выбросить примерно 5 мл надосадочной жидкости с помощью стеклянной пипетки Пастера, в результате чего клетки в объеме ~ 2 мл. Храните эти клетки при комнатной температуре в течение до ~ 8 часов для патч зажим записи.
- Для культивируемых клеток, удалить как можно больше супернатанта, как это возможно с помощью стерильной стеклянной пипетки Пастера. Осадок Ресуспендируют клеток в 1 мл подогретого (37 ° С) Покрытие Средний (Таблица 2).
8. Покрытие и культура синоатриальном Миоcytes (Пропустить для Остротоксичные изолированных клеток)
- Удалить ламинин решение от покровных из шага 3.3 с помощью пипетки Пастера. Сразу семян 500 мкл (~ 50-100 клеток) на каждом покровном ламининовым покрытием (со стадии 3).
Примечание: Ингибитор сократительной 2,3-бутандион моноксима (БДМ) входит в осажденных и питательные среды , чтобы предотвратить сжатие, что приводит к убыли клеток 9. - Возвращение 24-луночный планшет , содержащий вновь высевают Sams в инкубатор и выдерживают при 37 ° С в атмосфере 95% воздуха / 5% CO 2. Разрешить клетки придерживаться покровные в течение 4-6 ч в осажденном средах (таблица 2).
- Осторожно удалите Покрытие среды с использованием стерильной пипетки Пастера. Заменить на 500 мкл на лунку предварительно нагретом (37 ° С) , культуральная среда (таблица 2).
9. аденовируса трансдукция взрослых Синусовый миоцитов культур (Пропустить для Остротоксичные изолированных клеток)
- Расчетный показатель числа керамзитобLLS на покровное непосредственно перед нанесением аденовируса путем подсчета клеток в поле зрения под микроскопом, регулируя для увеличения. Подсчет всех клеток, а не только Sams.
- Развести аденовирус в среде 199 и регулировать разбавление для титра вируса, так что применение 1-10 мкл требуется для достижения конечной кратности инфекции (MOI) 100 вирусных единиц на клетку. Добавить аденовирусной раствор по каплям моды непосредственно на гальванопокрытием ЗУР.
- Инкубируйте клетки с вирусом среде, содержащей в течение ночи (~ 12-14 ч). Затем обмен свежей культуральной средой. Поддерживать клетки в инкубаторе, изменение культуральной среды каждые 48 ч, до тех пор, пока не будет получено желаемое экспрессии белка.
10. Функциональная оценка высокотоксичных изолированной или культивированный SAMs
Примечание: Следующий протокол является примером функциональных оценок изолированной ЗУР с использованием амфотерицина техники просечно-патч для записи как спонтанные точки доступа и I F из той же ячейки (см ссылку 9).
- Подготовка записи решения , как описано в таблице 3.
- Подготовка исходного раствора 20 мг / мл амфотерицина-В в ДМСО свежий в день записи. Хранить запас при комнатной температуре и защищать от света. Развести амфотерицина-В запас внутриклеточной растворе до конечной концентрации 200 мкг / мл непосредственно перед использованием. Поддерживать окончательное решение пипетки на льду и защищенном от света месте.
Примечание: амфотерицин раствор, содержащий пипетка для экспериментов следует приготовить свежую ежечасно путем разбавления аликвоту исходного раствора во внутриклеточное раствора и встряхиванием в течение не менее 1 мин. - Перелить Аликвоту остро диссоциированы клеточной суспензии SAM или фрагмент покровного стекла, несущего культивируемой Sams к записи камеру, содержащую раствор Тироде при 35 ± 1 ° С. Заливать клеток с раствором Тироде в течение по крайней мере 2 мин до электрофизиологического recordinГ.С., чтобы удалить остатки BDM оставшейся от культуральной среды.
Примечание: спонтанных сокращений должно быть очевидно, сразу же после передачи в растворе в Тирода. SAMs для записи могут быть идентифицированы с помощью комбинации функций , включая спонтанную сократительную активность, характерную морфологию (например, рис . 2), отсутствие страт, экспрессия белка HCN4, наличие I F тока, мембранная емкость <50 пФ, и спонтанные ApS с формами волны, которые включают в диастолическую фазу деполяризации и медленный ход вверх. - Использование боросиликатного стекла пипетки с сопротивлениями 1,5-3,0 МОм, заполнить наконечник с внутриклеточным раствором амфотерицина ИМЕЮЩИМ путем погружения в течение 10-30 сек. Затем обратно заполнить пипетку с амфотерицином раствором, содержащим. Клеточноподобное прилагается уплотнение ГОм должно быть получено как можно быстрее. Если формирование уплотнения трудно, увеличьте время кончик заполнения.
Примечание: Сопротивление доступа должно быть непрерывномониторинг после образования клеточного прилагается уплотнение, и все записи должны быть начаты только после получения стабильного сопротивления доступа <10 МОм. - Для записи спонтанные точек доступа, переключить усилитель в ускоренном режиме ток-зажим, без инжекции тока.
Примечание: 1 нМ изопротеренол входит в растворе Внеклеточный Тироде при записи точек доступа для стабилизации скорости стрельбы, как сообщалось ранее 10.
Результаты
Протоколы , описанные здесь , были ранее использованы для выделения спонтанно активных МССП от взрослых мышей, которые подходят для множества различных накладными исследований зажим 5-8. Кроме того, протоколы позволяют изолированных SAMs, которые можно поддерживать в культуре в течение одной недели. Перенос генов в культивируемые клетки может быть осуществлено с помощью аденовирусной инфекции 9. Результаты, представленные в этом разделе, вытекают из нашей предыдущей работы и приведены здесь в качестве примеров характеристик остро выделенных и культивируемых ЗУР.
Как показано на рисунке 2, спонтанно активные SAMs можно поддерживать в культуре в течение до 6 дней. Культивируемые клетки сохраняют общую морфологию, который очень похож на остро изолированной ЗУР, без каких-либо существенных изменений в средней длины, ширины, площади поперечного сечения или мембранной емкости культивируютклетки по сравнению с остро изолированных клеток (Фигура 2В - Е). Был однако истирание числа жизнеспособных SAMs с течением времени в культуре. Следовательно, рекомендуется, чтобы культуры быть получены из клеток объединенных из нескольких животных, если план эксперимента требует обширных наборов данных.
Основной целью при разработке протокола о культуре синоатриальной миоцитов от взрослых мышей было создать систему, которая позволила бы экспрессию экзогенных белков в нативном сотовой связи для взрослых SAMs. Примером такого типа экспрессии белка показана на рисунке 3 для случая клеток , коинфицированных вирусами , выражающих флуоресцентным маркером белки GFP и mCherry. Мы обнаружили , что экспрессия белка явно проявляется в течение 24 часов аденовирусной инфекции, и был максимальным для испытуемых белков в течение 48 ч (рисунок 3). Вирусная MOI 100 привело к почти 100% инфЭффективность прогиб без признаков клеточной токсичности. В противоположность этому , трансфекцию с использованием реагентов на основе липидов не привели к каким - либо обнаруживаемого переноса генов во взрослую SAMs, даже после того, как 72 ч 9.
Функциональная характеристика с помощью патч-зажим электрофизиологии имеет решающее значение для оценки как остро изолированном и культивируемого SAMs. На рисунке 4A показаны типичные записи ток-зажим спонтанных потенциалов действия , записанных с острой изолированной или культивированного ЗУР с использованием конфигурации записи просечно-патч амфотерицин. Действие потенциальные формы волны были подобны в остро изолированном и культивируемого ЗУР и не было никакой разницы в средней скорости стрельбы AP (рис 4В).
Я ж является отличительной чертой ЗУР и HCN4 каналов , которые производят I F используются в качестве иммуноцитохимических маркеров синусового узла. Следовательно, прesence из I F в накладными записей зажим может быть использован , чтобы поддержать идею о том , что клетки на самом деле ЗУР. Все спонтанно активных острых и культивируемых SAMs описанные здесь также выставлены I F> 100 мкА в ответ на шаг напряжения от 1 сек до -120 мВ. Для получения репрезентативных результатов , показанных здесь, клетки перфузия раствором Тироде , содержащего 1 мМ BaCl 2 блокировать K + токи (таблица 3) , и зависимость напряжения активации I F анализировали на 3 сек гиперполяризационных ступеней напряжения от -60 до -160 мВ от удерживающей потенциала -50 мВ, как мы уже ранее описанных 5-8. Плотность тока оценивали в ответ на 3 сек гиперпол тестовых импульсов до -150 мВ от удерживающей потенциала -50 мВ. Там не было никаких существенных различий ни в вольт-зависимости активации I F или I F плотности тока между остро изолированной и культивируют ЗУР (рисунок 4C - D). Эти совместные записи спонтанных точек доступа и I F от индивидуальных SAMs требуется примерно 9 мин в общей сложности (включая 2 мин начальной промывки, 30-60 сек спонтанных точек доступа в режиме текущего зажима, изменение раствор 2 мин, и приблизительно 5 мин до собрать достаточное количество данных хомута напряжения для описания напряжения зависимость активации I F). Следовательно, данные , представленные на фигуре 4C иллюстрируют также устойчивость клеточного препарата.

Рисунок 1: Препарирование инструменты для выделения и диссоциации мыши ЗУР (A) Я два 10 см чашки Петри , содержащие ~ 25 мл вылеченные силиконового эластомера... Каждое блюдо с предустановленными 6-10 небольших рассечение булавки для иммобилизации ткани. II. 100 мл мензурку для проведения Полная Тирода в 35 &# 176;... Водяная баня C III Широкий (~ 2 мм в диаметре), пожарно-полированная диссоциация пипетка IV Узкая (~ 1,5 мм в диаметре) огневой полировкой пипетки передачи v Пластиковые пипетки передачи для приготовления купания с полной Тирода с... гепарин. VI. саморазмыкающиеся микро ножницы для внутренних процедур резания. VII. тонкий пинцет (размер наконечника 0,06 х 0,02 мм) для манипулирования внутренней ткани. VIII. пинцет хирургический, 5.5, 1 х 2 зубья для манипуляций внешней ткани. IX. Изогнутые ножницы радужной оболочки 4.3 в для внешних процедур резания. (B) крупным планом фото выделяя небольшие рассечение булавки , помещенные в рассечение блюдо. (C) крупным планом фото подсветка огневой полировкой узкой пипетки передачи (слева) и пожарно-полированную с широким горлышком пипетку для механического растирания (справа). Пожалуйста , нажмите здесь , чтобы увидеть увеличенное Versioп этой фигуры.
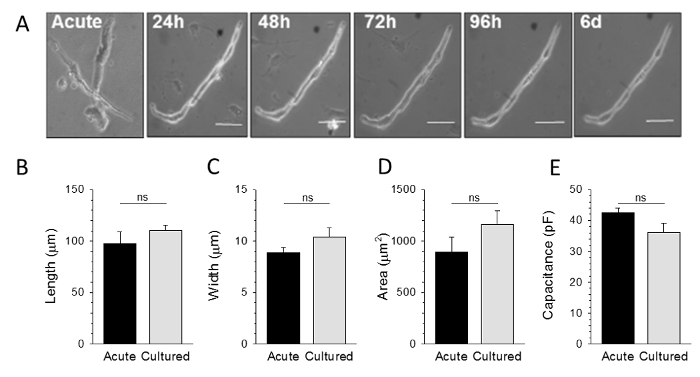
. Рисунок 2: Остро выделяют и культивированный SAMs морфологически неотличимы A:. Светлое поле изображения репрезентативной SAMs либо сразу после изоляции (острый) или через 24 ч, 48 ч, 72 ч, 96 ч, или 6 дней в пробирке B - D : среднее (± SEM) максимальная длина, ширина и площадь поперечного сечения для остро изолированы по сравнению с 48 часов культивируемых SAMs E:. Средняя (± SEM) мембранной емкости от напряжения зажим записи от острой изолированной или культивированного ЗУР. Все сравнения не являются значимыми: р> 0,05 по сравнению с острой. Взято из ссылки 9. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3: аденовируса экспрессия экзогенных белков в культивируемых ЗУР светлом поле и эпифлуоресцентной образы репрезентативного культивируемых ЗУР , которые были инфицированы при MOI 100 для аденовирусов , экспрессирующих EGFP (зеленый) и mCherry (красный), либо на 24 или 48 часов после того, как . двойная инфекция. Шкала бар = 20 мкм. Воспроизведено из работы 9.
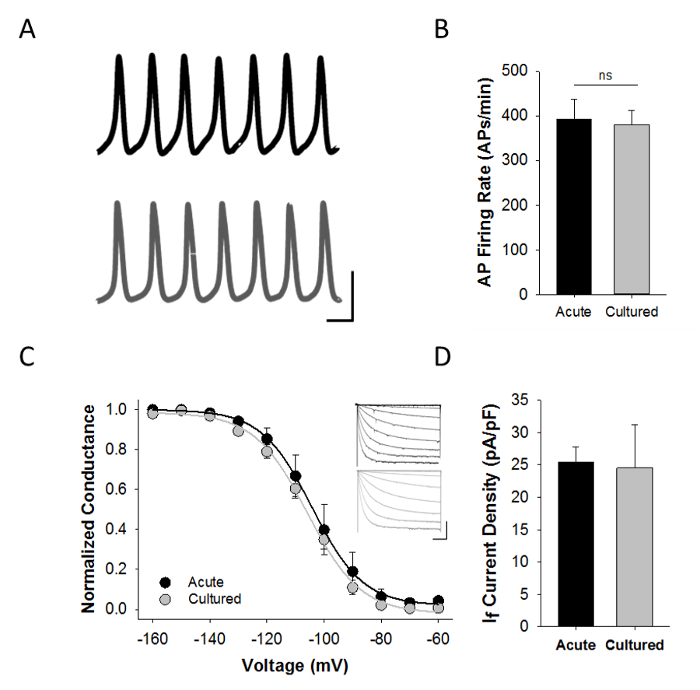
Рисунок 4: Электрофизиологические характеристика культивируемых SAMs A:. Репрезентативных текущих записей зажим с острой изолированные (черный) или культивированного (серый) SAMs в растворе Тирода , содержащем 1 нМ изопротеренол. Шкала баров: 40 мВ, 100 мс B:. Средняя (± SEM) мгновеннаястреляя частоту остро изолированных (черный, п = 6) или 48 ч культивируют (серый; п = 14) SAMs C:. нормализованное среднее (± SEM) отношения проводимости напряжения для I F в остро изолированных (черный, п = 8) или культивированный (серый; п = 14) SAMs Вставки:.. представительные семьи в настоящее время от острой (черный) или культивированный (серые) ЗУР , вызываемый 3 сек гиперполяризационных испытательных импульсов от -60 до -160 мВ с шагом 10 мВ D: Средняя ( ± SEM) Я ж плотность тока при -150 мВ в остро изолированных (черный, п = 7) и культивированного (серый; N = 8) ЗУР. Взято из ссылки 9. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Полная Tyrode-х | низкое Ca 2+ / Mg 2+ Тирода | KB Средний | Решение БСА | NaCl / CaCl 2 Адаптация Решение | |
| NaCl | 140 | 140 | 140 | 10 | |
| KCl | 5.4 | 5.4 | 25 | 5.4 | |
| KH 2 PO 4 | 1.2 | 1.2 | 10 | 1.2 | |
| HEPES | 5 | 5 | 5 | 5 | |
| глюкоза | 5,55 | 18,5 | 20 | 5,55 | |
| MgCl 2 | 1 | 1 | |||
| CaCl 2 | 1.8 | 0.066 | 1.8 | 1.8 | |
| таурин | 50 | 20 | |||
| БСА | 1 мг / мл | 1 мг / мл | 1 мг / мл | ||
| K-глутамата | 100 | ||||
| К-аспартат | 10 | ||||
| MgSO 4 | 2 | ||||
| креатин | 5 | ||||
| EGTA | 0,5 | ||||
| рН доводили до | 7,4 с помощью NaOH | 6.9 с помощью NaOH | 7.2 с KOH | 7,4 с помощью NaOH |
Таблица 1:. растворы диссоциации Составы растворов , используемых при диссоциации САУ миоцитов. Концентрации приведены в мм, за исключением особо оговоренных случаев.
| Покрытие Medium | Культура Средняя | |
| Media199 | база | база |
| 2,3-бутандион моноксима (БДМ) | 10 мМ | 10 мМ |
| Фетальной бычьей сыворотки (FBS), | 5% | - |
| Бычьим сывороточным альбумином (БСА) | 0,1 мг / мл | |
| инсулином | 10 мкг / мл | |
| Transferrin | 5,5 мкг / мл | |
| Селен | 5 нг / мл | |
| Пенициллин | 100 ед / мл | 100 ед / мл |
| Стрептомицин | 100 мг / мл | 100 мг / мл |
Таблица 2: Покрытие и культура растворы Составы растворов , используемых для покрытия и культуры САУ миоцитов..
| Тирода | PP внутриклеточный | |
| NaCl | 140 | 5 |
| KCl | 5.4 | 135 |
| KH 2 PO 4 | 1.2 | |
| HEPES | 5 | 10 |
| глюкоза | 5,55 | |
| MgCl 2 | 1 | 1 |
| CaCl 2 | 1.8 | 0,1 |
| EGTA | 10 | |
| Mg-АТФ | 4 | |
| Амфотерицин-B | 200 мкг / мл по мере необходимости | |
| Isoproterenol | 1 нМ при необходимости | |
| рН доводили до | 7,4 с помощью NaOH | 7.2 с KOH |
Таблица 3: записи решения электрофизиологии Композиции внеклеточный (Тирода) и внутриклеточной (ПП) растворы , используемые для записи амфотерицин просечно-патч от САУ миоцитов..
Обсуждение
В настоящем документе представлены подробные протоколы для изоляции и культуры полностью дифференцированных САУ миоцитов от взрослых мышей. Протокол изоляции надежно производит спонтанно активные Sams мыши, подходящие для любого немедленного электрофизиологического анализа или последующей культуры. Подобные протоколы были зарегистрированы многими другими группами (например, см ссылки 11,12,10,13-17). Тем не менее, наш протокол для поддержания взрослой мыши Sams в пробирке сохраняет характерную морфологию, спонтанную активность и электрофизиологические свойства клеток и позволяет аденовирусной доставки белков 9.
Для модификации и поиска неисправностей протоколов, следует отметить несколько важных шагов. Первый критический фактор является существенным вариабельность от партии к партии в активности энзимов (шаг 1.4), которые могут значительно изменить количество и качество SAMs изолированы в данном ДГОвания. Эта изменчивость особенно верно в отношении эластазы, которая, как правило, требует много конкретных оптимизации, в которых концентрация и время экспонирования должно быть брекетинга в течение нескольких препаратов (часто делается параллельно), чтобы максимально увеличить количество клеток и здоровья. Некоторые протоколы для выделения SAMs из различных видов используют индивидуальные коллагеназы и протеаз ферменты вместо коллагеназы-протеазы фермента смеси в настоящем протоколе. Однако вариабельность от партии к партии для каждого из этих ферментов достаточно высока (аналогично эластазы), что вызывает необходимость повторных раундов совместной оптимизации. Смесь ферментов обеспечивает большую согласованность между большим и требует меньше шагов оптимизации.
Второй критический, и неочевидно, фактор для устранения изоляции SAM является целостность пожарно-полированного стекла диссоциации пипеткой (рис 1C). Если обод пипетки содержит каких-либо острых кромок, трещин и накопленное Cellular мусора, механический этап растирание может привести к повреждению клеток, что приводит к токсичности кальция. Огонь полировкой диссоциации пипетки следует заменить по крайней мере каждые 2 месяца регулярного использования, или в любое время, что выход или качество клеток заметно снижается в течение нескольких препаратов.
Время и сила механической диссоциации является третьим важным шагом для устранения неполадок протокола изоляции. Растирания требует медленно (примерно 0,5-1 Гц), но турбулентность силового в течение 5-10 мин. Более высокие скорости и уменьшение времени также может быть использован, но важно, чтобы избежать введения пузырьков или генерации пены в растворе. Когда синусового узла образцы были полностью диссоциированы, остальные полоски ткани должны появляться тонкие и белого цвета; тонкий розово-иш окраска указывает на неполное растирание. При исследовании при увеличении 200-400X, клетки из оптимально подготовленных образцов имеют гладкие клеточные мембраны, в то время как клетки MembRanes из более чем расщепленный или более-растирают образцов имеют кратерами и исчерчена внешний вид. В здоровых клетках, схваток наблюдаются в первую очередь, как тонкий подергивание концы ячеек. Волны сжатия являются признаком поврежденных клеток, которые можно наблюдать энергично сокращаться в течение короткого промежутка времени, перед тем сальников вверх. Трещины диссоциации пипетка является наиболее распространенной причиной такого повреждения клеток. В образцах, которые были под переваренной или под растирают, клетки присутствуют в виде комков или агрегатов вместо одиночных клеток, а также значительное количество договаривающейся ЗУР можно наблюдать в оставшихся кусков ткани.
Каждый пользователь должен будет индивидуально оптимизировать диссоциации. Несмотря на то, ферментативное расщепление и механические раз диссоциации оба должны быть скорректированы, рекомендуется сначала сохранить время ферментативного расщепления постоянной при изменении времени диссоциации. Дополнительная тонкая настройка опирается в основном на способности пользователя признать Appearance из кусков ткани, остающейся в завершении растирании - когда куски тонкими и беловатые, затем растирание в порошок должен быть остановлен. Оптимизация также необходимо, чтобы приспособить изменения в САУ, которые сопровождают различия по возрасту, полу, или штамма мышей. Например, диссоциация клеток от старых животных 7 требует снижение как ферментативному расщеплению и механические времена диссоциации. В качестве общей рекомендации, типичного препарата из 2-3 месячного возраста мужчин урожайность C57BL / 6 мышей примерно 50-200 жизнеспособными Sams, из которых, возможно, 5-10 может быть успешно патч-зажаты в сессии хороший день, в зависимости от экспериментов , Выход значительно (~ 30%) ниже , когда старых мышей используются 7.
Успех протокола культуры также опирается на несколько ключевых шагов. В первую очередь, успех первичной культуры клеток требует высокого качества диссоциации, как обсуждалось выше. Рекомендуется йпри подготовке остро изолированной камере быть оптимизированы перед тем, чтобы поддерживать клетки в культуре. Вторым важным фактором для культивируемых клеток заключается в отборе клеток для электрофизиологических записей. Для достижения наилучших результатов, культивируемые SAMs выбранные для записи должны проявлять спонтанные сокращения сразу после смыва БДМ-содержащих культуральной среды. Медленное начало спонтанных сокращений при смыв БДМ является признаком нездоровых клеток.
Система культуры SAM имеет некоторые ограничения, прежде всего очень маленький размер мыши SAN. В то время как методы продемонстрированные здесь позволяют достаточное количество клеток для электрофизиологических и визуализации исследований, ограниченное количество ткани не позволяет биохимических анализов культивируемых ЗУР. Другим ограничением метода является то, что МССП должен быть культивируют в присутствии ингибитора реверсивного миозин АТФазы, БДМ. Это потенциальная озабоченность, поскольку БДМ имеет другие клеточные эффекты, в том численеспецифический фосфатаза активность, ингибирование сердечной факторов транскрипции 19, и ингибирование натриевых каналов, кальциевых каналов и рианодиновых рецепторов 20. Тем не менее, данные показывают, что БДМ имеет минимальное воздействие на морфологические и электрофизиологические свойства SAMs проанализированных здесь.
В будущих приложениях, представляется вероятным, что методы, описанные здесь, могут быть адаптированы для подготовки SAM культур от крупных млекопитающих. В сочетании с аденовирусной переноса генов, такие культуры могут позволить генетические манипуляции pacemaking в больших моделях животных. Способность представить интерес белков также обеспечивает для будущих применений, в которых генетически кодируемых репортерные молекулы, могут быть использованы для исследования внутриклеточных сигнальных путей в SAMs.
Раскрытие информации
None.
Благодарности
We thank Dr. Christian Rickert for critical reading of the manuscript. This work was supported by a grant from the National Heart Lung and Blood Institute (R01-HL088427) to CP. EJS was supported by 5T32-AG000279 from the National Institute on Aging. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Материалы
| Name | Company | Catalog Number | Comments |
| Sylgruard/Elastomer Kit | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Borosilicate 9" pasteur pipettes | Fisher Scientific | 13-678-20C | |
| Small, round bottomed culture tubes | Fisher Scientific | 352059 | |
| Large, round bottomed culture tubes | Corning | 14-959-11B | |
| Elastase | Worthington Biochemical | LS002279 | |
| Liberase TM | Roche | 5401119001 | Tissue dissociation solution |
| Heparin | SAGENT Pharmaceuticals | NDC 25021-400-10 | |
| Mouse Laminin | Corning | CB-354232 | |
| 12 mm round glass coverslips | Fisher | 12-545-80 | |
| 24-well culture plate | Fisher | 08-772-1 | |
| Ad-mCherry | Vector Biolabs | 1767 | |
| Ad-eGFP | Vector Biolabs | 1060 | |
| Plastic, disposable transfer pipette | Fisher Scientific | ||
| Micro scissors | Fisher Scientific | 17-467-496 | |
| Dumont #4 Forceps | Roboz Instruments | RS-4904 | |
| Tissue Forceps | Roboz Instruments | RS-8164 | |
| Dissecting Iris Scissors | WPI, Inc. | 501264 | |
| Dissecting Pins | Fine Science Tools | 26002-20 | |
| NaCl | Sigma | 71376 | |
| KCl | Sigma | 60128 | |
| KH2PO4 | Sigma | 60353 | |
| HEPES | Sigma | 54457 | |
| glucose | Sigma | G0350500 | |
| MgCl2 | Sigma | M8266 | |
| CaCl2 | Sigma | C1016 | |
| taurine | Sigma | T0625 | |
| BSA | Sigma | A2153 | |
| K-glutamate | Sigma | G1501 | |
| K-aspartate | Sigma | A6558 | |
| MgSO4 | Sigma | M7506 | |
| creatine | Sigma | C0780 | |
| EGTA | Sigma | E3889 | |
| Mg-ATP | Sigma | A9187 | |
| Amphotericin-B | Fisher Scientific | 1397-89-3 | |
| Isoproterenol | Calbiochem | 420355 | |
| Media199 | Sigma | M4530 | |
| 2,3-butanedione monoxime (BDM) | Sigma | B0753 | |
| Fetal Bovine Serum (FBS) | Sigma | SH30071 | |
| Bovine Serum Albumin (BSA) | Sigma | A5611 | |
| Insulin | Sigma | I3146 | |
| Transferrin | Sigma | I3146 | |
| Selenium | Sigma | I3146 | |
| Penicillin | GE Healthcare | SV30010 | |
| Streptomycin | Hyclone | SV30010 |
Ссылки
- Irisawa, H., Noma, A. Pacemaker currents in mammalian nodal cells. J Mol Cell Cardiol. 16 (9), 777-781 (1984).
- DiFrancesco, D. Pacemaker mechanisms in cardiac tissue. Annu Rev Physiol. 55, 455-472 (1993).
- Mangoni, M., Nargeot, J. Genesis and regulation of the heart automaticity. Physiol Rev. 88 (3), 919-982 (2008).
- Lakatta, E. G., DiFrancesco, D. What keeps us ticking: a funny current, a calcium clock, or both. J Mol Cell Cardiol. 47 (2), 157-170 (2009).
- Liao, Z., Lockhead, D., Larson, E., Proenza, C. Phosphorylation and modulation of hyperpolarization-activated HCN4 channels by protein kinase A in the mouse sinoatrial node. J Gen Physiol. 136 (3), 247-258 (2010).
- Liao, Z., St Clair, J. R., Larson, E. D., Proenza, C. Myristoylated peptides potentiate the funny current (I(f)) in sinoatrial myocytes. Channels. 5 (2), 115-119 (2011).
- Larson, E. D., Clair, J. R. S., Sumner, W. A., Bannister, R. A., Proenza, C. Depressed pacemaker activity of sinoatrial node myocytes contributes to the age-dependent decline in maximum heart rate. Proc Nat Acad Sci. 110 (44), 18011-18016 (2013).
- St. Clair, J. R., Liao, Z., Larson, E. D., Proenza, C. PKA-independent activation of I(f) by cAMP in mouse sinoatrial myocytes. Channels. 7 (4), 318-321 (2013).
- St. Clair, J. R., Sharpe, E. J., Proenza, C. Culture and adenoviral infection of sinoatrial node myocytes from adult mice. Am J Physiol Heart Circ Physiol. , (2015).
- Clark, R. B., Mangoni, M. E., Lueger, A., Couette, B., Nargeot, J., Giles, W. R. A rapidly activating delayed rectifier K+ current regulates pacemaker activity in adult mouse sinoatrial node cells. Am J Physiol Heart Circ Physiol. 286 (5), H1757-H1766 (2004).
- Mangoni, M., Nargeot, J. Properties of the hyperpolarization-activated current (I(f)) in isolated mouse sino-atrial cells. Cardiovasc Res. 52 (1), 51-64 (2001).
- Cho, H. S., Takano, M., Noma, A. The electrophysiological properties of spontaneously beating pacemaker cells isolated from mouse sinoatrial node. J Physiol. 550 (Pt 1), 169-180 (2003).
- Rose, R. A., Lomax, A. E., Kondo, C. S., Anand-Srivastava, M. B., Giles, W. R. Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node: a role for the NPR-C receptor. Am J Physiol Heart Circ Physiol. 286 (5), H1970-H1977 (2004).
- Rose, R. A., Kabir, M. G., Backx, P. H. Altered Heart Rate and Sinoatrial Node Function in Mice Lacking the cAMP Regulator Phosphoinositide 3-Kinase-\gamma\. Circ Res. 101 (12), 1274-1282 (2007).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PloS ONE. 7 (10), e47652(2012).
- Groenke, S., Larson, E. D., et al. Complete atrial-specific knockout of sodium-calcium exchange eliminates sinoatrial node pacemaker activity. PloS ONE. 8 (11), e81633(2013).
- Torrente, A. G., Zhang, R., et al. Burst pacemaker activity of the sinoatrial node in sodium-calcium exchanger knockout mice. Proc Nat Acad Sci USA. 112 (31), 9769-9774 (2015).
- Denyer, J. C., Brown, H. F. Rabbit sino-atrial node cells: isolation and electrophysiological properties. J Physiol. 428 (1), 405-424 (1990).
- Thum, T., Borlak, J. Butanedione monoxime increases the viability and yield of adult cardiomyocytes in primary cultures. Cardiovasc Toxicol. 1 (1), 61-72 (2001).
- Borlak, J., Zwadlo, C. The myosin ATPase inhibitor 2,3-butanedione monoxime dictates transcriptional activation of ion channels and Ca(2+)-handling proteins. Molec Pharmacol. 66 (3), 708-717 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены