Method Article
Verfahren zur Isolierung, Kultur, und funktionelle Charakterisierung von Sinoatrialknoten Myozyten aus erwachsenen Mäusen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Es sind Verfahren zur Isolierung von Sinusknoten Myozyten (SAMs) von erwachsenen Mäusen für Patch-Clamp-Elektrophysiologie oder Bildgebungsstudien demonstriert. Isolierte Zellen können direkt oder aufrechterhalten werden kann in Kultur zu ermöglichen, die Expression von Proteinen von Interesse, beispielsweise genetisch codierten Reporter verwendet.
Zusammenfassung
Sinoatrialknoten Myozyten (SAMs) fungieren als natürliche Schrittmacher des Herzens, jedes Herz durch die Erzeugung spontanen Aktionspotentiale (APs) schlagen zu initiieren. Diese Schrittmacher APs reflektieren die koordinierte Aktivität zahlreicher Membranströme und intrazellulären Calcium Radfahren. Allerdings sind die genauen Mechanismen, die eine spontane Schrittmacheraktivität in SAMs fahren bleiben schwer zu fassen. Akut isoliert SAMs sind eine wesentliche Vorbereitung für Experimente, die molekulare Basis von Herzschrittmacher zu sezieren. Allerdings ist die undeutliche Anatomie, komplexe Mikrodissektion und pingelig enzymatische Verdauung Bedingungen haben eine weit verbreitete Verwendung von akut isolierten SAMs verhindert. Außerdem wurden Verfahren erst kürzlich längerfristige Kultur von SAMs für die Proteinexpression Studien zu ermöglichen. Hier bieten wir eine Schritt-für-Schritt-Protokoll und Video-Demonstration für die Isolierung von SAMs von erwachsenen Mäusen. Ein Verfahren ist auch für die Aufrechterhaltung der erwachsenen Maus SAMs in vitro und für expressi demonstriertauf exogener Proteine über Adenovirus-Infektion. Akut isoliert und mittels dieser Verfahren hergestellt SAMs sind für eine Vielzahl von elektrophysiologischen und Bildgebungsuntersuchungen geeignet.
Einleitung
Schrittmachers Myozyten im Sinusknoten des Herzens (sinoatrial myocytes "SAMs") erzeugen spontane rhythmische Aktionspotentiale (APs), die durch das Myokard ausbreiten jedem Herzschlag zu initiieren. Experimente mit akut isoliert SAMs aus vielen Arten zur Aufklärung von Mechanismen wesentlich gewesen, die auf die Erzeugung von Schrittmacheraktivität beitragen. SAMs sind hoch spezialisierte Kardiomyozyten, die im Wesentlichen von ihren Kollegen in der atriale und ventrikuläre Myokard in Bezug auf die Morphologie, Funktion und Proteinexpression unterscheiden. Das Markenzeichen der spontanen APs in SAMs ist eine spontane Depolarisation während der Diastole, die das Membranpotential zu Schwelle treibt die nächste AP 1,2 auszulösen. Dieses "Schrittmacher Potential" hängt von der koordinierten Aktivität vieler verschiedener Membranströme , einschließlich der "lustige Strom" (I f), T- und L-Typ - Calciumströme und der Natrium-Kalzium - Austauscher current (I NCX), die 3,4 von Ca 2+ Freisetzung aus dem Retikulum angetrieben wird.
Während akut isolierten Maus SAMs eine wesentliche experimentelle Vorbereitung für die Untersuchung von Schrittmacher- sind, kann die Isolierung von SAMs von Mäusen ein herausforderndes Methode zu übernehmen, weil die undeutliche Anatomie und die geringe Größe des Maus-SAN eine nuancierte Mikrodissektion und das kombinierte enzymatische und mechanische erfordert Dissoziation der Zellen erfordert eine sorgfältige Optimierung.
Wir bieten hier eine detaillierte Video - Demonstration eines Protokolls, das für Patch - Clamp - Aufnahmen erfolgreich zur Isolierung 5-8 von erwachsenen Mäusen SAMs wurde. Unseres Wissens gibt es keine solche visuelle Demonstration zur Verfügung aus einer anderen Quelle. Zusätzlich wird ein neues Verfahren gezeigt , in denen getrennt SAMs von erwachsenen Mäusen können in vitro für einige Tage aufrechterhalten werden, wodurch die Einführung von Proteinen, genetisch kodierteReportermoleküle oder RNAi über Adenovirus - Infektion 9.
Protokoll
Alle Tier Verfahren wurden in Übereinstimmung mit den Protokollen von der Institutional Animal Care und Use Committee der University of Colorado Anschutz Medical Campus genehmigt durchgeführt. Das Standardprotokoll unten wurde unter Verwendung von männlichen C57BL / 6J-Mäuse von 2-3 Monate alt optimiert.
1. Bereiten Lösung Stocks und Zubehör im Vorfeld der Experimente
HINWEIS: Siehe Werkstoff - Tabelle für die notwendige Ausrüstung und Zubehör.
- Bereiten Sie 1 L jeder der folgenden Lösungen , wie in Tabelle 1 angegeben: Komplette Tyrode, Low Ca 2+ / Mg 2+ Tyrode, modifizierte Kraft-Brühe (KB) Lösung und Rinderserumalbumin (BSA) Lösung. Verwenden Sie Reinst-VE-Wasser für alle Lösungen gefiltert. Teilen Sie jede Lösung in 50 ml Aliquots und lagern bei 20 ° C für bis zu sechs Monate. Tauen Sie sofort einzelne Aliquots vor Experimenten und speichern bis zu einer Woche bei 46; C.
- Vorbereitung 50 ml 10 mM NaCl und 1,8 mM CaCl 2 Adaptation Lösung durch NaCl und CaCl 2 in ultrareinem gefiltertes entionisiertes Wasser gelöst (Tabelle 1). Lagerung bei Raumtemperatur für bis zu sechs Monate.
- Bereiten 4,75 Enzymaktivität (U) Aliquots von Elastase durch Pipettieren in Mikrozentrifugenröhrchen. Lagerung bei 4 ° C für bis zu drei Monaten.
- Bereiten 375 ug Aliquoten (in ultrareinem H 2 O) von Kollagenase-Protease - Enzym - Mischung durch Pipettieren in Mikrozentrifugenröhrchen. Lagerung bei -20 ° C für bis zu drei Monaten.
- Bereiten Sie zwei feuerpolierten Pasteur - Pipetten, eine für Gewebetransfer (~ 1,5 mm Abschlussöffnungsdurchmesser, Figur 1Aiv und 1C) und eine für Dissoziation (~ 2 mm Durchmesser; Abbildung 1Aiii und 1C).
- Score Pasteurpipetten mit einem Glasschneider und Snap entlang der Partitur eine Öffnung etwas größer ist als die gewünschte Größe zu erzeugen. Feuer-Polnisch das abgeschnittene Ende jeder Pipette für ~ 30-60 sec auf kleiner Flamme auf einem Bunsenbrenner eine dicke polierte Wand und eine Öffnung des gewünschten Durchmesser zu erzeugen. Sicherstellen, dass die feuerpolierte Öffnung frei von Rissen oder Ecken und Kanten ist.
- Bereiten Sie zwei Dissektion Gerichte durch Zugabe von ~ 25 ml Silikon - Elastomer gemäß den Anweisungen des Herstellers zu jeweils 100 mm Petrischale (Abbildung 1Ai und 1B). Man lässt 48 Stunden bei Raumtemperatur aushärten.
- Für Kultur nur: Vorbereitung 25-50 ml je Plating Medium und Kulturmedium gemäß Tabelle 2 Speicher für bis zu zwei Wochen bei 4 ° C..
2. Bereiten Sie Lösungen zu verwenden zum Tag der Zellisolation
HINWEIS: Die folgenden Mengen sind für die Isolierung von sinoatrial Myozyten von einer Maus.
- Hinzufügen 2,5 ml Low Ca 2+ / Mg 2+ Kulturröhrchen Tyrode-(pH 6,9) in jede von drei kleinen, Rundbodens. Die Röhrchen in 35 ± 1 ° C Wasserbad.
- In 2,5 ml Low Ca 2+ / Mg 2+ Tyrode zu einem großen Rundbodenkulturröhrchen. Zu diesem Rohr, fügen Sie 1 Aliquot (4,75 U) Elastase und eine aliquote Menge (375 ug) Kollagenase-Protease-Enzym-Mischung. Swirl zu mischen. Das Röhrchen in 35 ± 1 ° C Wasserbad.
- In 2,5 ml KB Medium zu drei weitere kleine, runde Bodenkulturröhrchen und einem zusätzlichen großen Rundbodenkulturröhrchen. Die Röhrchen in 35 ± 1 ° C Wasserbad.
- In ~ 7 ml BSA-Lösung zu einem großen Boden versehenen Kulturröhrchen. Halten Sie dieses Rohr bei Raumtemperatur.
- Platzieren 20-40 ml komplettem Tyrode-Lösung in einem 50 ml Becherglas (Abbildung 1Aii). In 10 USP / ml Heparin, Wirbel zu mischen, und das Becherglas in der C-Wasserbad 35 ± 1 °.
3. Bereiten Weitere Lösungen und Materialien für die kultivierten Zellen (für Akut isolierte Zellen diese Schritte überspringen)
- In einer sterilen Kultur Haube Gewebe, indem Sie zwei 12 mm runden Glasplättchen pro Maus in einzelne Vertiefungen einer 24-Well-Platte.
HINWEIS: Die 24-Well-Platte verwendet wird, da die Vertiefungen eine bequeme Größe sind, die das Volumen für eine nachfolgende virale Infektionen zu begrenzen, dient. - Pipette etwa 200 ul einer 100 ng / ml Lösung von Laminin der Maus verdünnt in steriler phosphatgepufferter Salzlösung (PBS) auf jedem Deckglas.
- Inkubieren Deckgläser mit Laminin für die Dauer der Trennung (mindestens 1 Stunde) in einem Inkubator bei 37 ° C.
- Vorwärmen die Plating Medium und Kulturmedium (aus Schritt 1.7 und Tabelle 3) bis 37 ° C.
4. Sinoatrialknoten Isolation
- In einer chemischen Abzugshaube, legen Sie eine Maus in einer Kammer eines Zweikammer-Box und betäuben mit ~ 200 & mgr; l Flüssigkeit Isofluran über ein Wattestäbchen in die andere Kammer eingeführt. Bestätigen Anästhesie (in der Regel innerhalb von ~ 30-60 sec) mit einer Zehe Prise. euthanizeMaus durch zervikale Dislokation.
HINWEIS: Eine leere 1 ml Pipettenspitze Box kann die Zwei-Kammer-Box zu bilden, verwendet werden; drehen Sie das Rack den Kopf in der Box das separate Fach für die Isofluran erstellen, um die Maus zu verhindern, dass es direkt zu kontaktieren. - Entfernen Pelz von der Brust mit einer Schere und transect Brustkorb der Brusthöhle mit externen Gewebezange (Abbildung 1Aviii) und Dissektion Schere (Abbildung 1Avix) aussetzen. Bathe die Brusthöhle mit ~ 2 ml Komplett Tyrode mit Heparin unter Verwendung einer Transferpipette erwärmt.
HINWEIS: Badebrusthöhle Weiter, wenn nötig, nicht zulassen, dass die Zubereitung zu trocknen. - Unter einem Binokular, entfernen Sie sorgfältig in die Lunge und Thymus mit internen Schere (Abbildung 1Avi) und Dissektion Pinzette (Abbildung 1Avii).
- Während sanft die Spitze des Herzens mit den internen Dissektion Pinzette, schneiden Sie vorsichtig die untere Hohlvene und die eineorta mit den inneren Schere das Herz aus der Brusthöhle zu entfernen. Übertragen Sie das Herz eines der Silikon-Dissektion Gerichte und baden mit ~ 4 ml Komplett Tyrode mit der Transferpipette heparinisiert erwärmt.
- Richten Sie das Herz, so dass die hinteren Gefäße sichtbar sind und nach oben, mit dem rechten Vorhof des Tieres auf der rechten Abwehr Experimentator und linken Vorhof auf der linken Seite des Experimentators. Einmal ausgerichtet ist, zu immobilisieren Gericht das Herz durch Pinning durch die Spitze in die Silikon-Dissektion.
- Suchen Sie die Nut zwischen den Ventrikeln und den Vorhöfen (clear Ring über dem Ventrikel).
- Unter Verwendung der internen Dissektion Schere, machen einen Schnitt an der Nut, halten näher an den Ventrikel als die Vorhöfe. Spülen Sie die Nut und Schnitt mit zusätzlichen gewärmt heparinisiert komplette Tyrode bei Bedarf einen klaren Blick auf die Vorhöfe und die Ventile zu ermöglichen. Weiter entlang der Nut zu schneiden die Vorhöfe von den Ventrikeln zu trennen.
- Übertragen Sie das Vorhofgewebe in die zweite Silikon-Dissektion Schüssel und baden mit ~ 3 ml komplette Tyrode-heparinisiert gewärmt.
- Richten Sie das Gewebe, so dass der rechte Vorhof des Tieres ist nun auf der linken Seite des Experimentators, und der linke Vorhof ist auf der rechten Seite.
HINWEIS: Der rechte Vorhof mehr transparent ist, während der linke Vorhof mehr von einem dunkelroten Ton hat. - Pin das Gewebe durch die untere und obere Hohlvene und den rechten und linken Vorhof Anhängsel, Stretching die Vorbereitung sanft. Entfernen Sie alle verbleibenden Fett oder andere Gewebe eine klare Sicht auf die Vorbereitung zu ermöglichen (Vorsicht, nicht in die Vorhofwand geschnitten, wie der Sinusknoten recht empfindlich ist und leicht beschädigt werden kann).
- Öffnen Sie die vordere Wand der Vorhöfe durch Schneiden durch die Hohlvenen. Re-Positionierung der Stifte als notwendig, um die Vorhofscheidewand zu visualisieren.
- Schneiden Sie entlang der Vorhofscheidewand des linken Vorhofs zu entfernen. Re-Pin die Vorbereitung, Stretching sanft.
- entfernen ter im rechten Vorhof Anhängsel und befreien den Sinusknoten durch entlang der Cristae terminalis Schneiden, die als dunkelorange Streifen erscheint das Herzohrs angrenzt.
- Re-Pin über den Knotengewebe und schneiden Sie es seitlich (senkrecht zur Crista terminalis) drei gleich große Streifen zu erzeugen.
5. Sinoatrialknoten Verdauung
- Mit dem schmalen feuerpolierte Pipette (Abbildung 1Aiv), übertragen Sie die drei Streifen von Sinoatrialknoten Gewebe in die erste von drei kleinen, Röhrchen mit rundem Boden 2,5 ml niedrigen Ca 2+ enthält / Mg 2+ Tyrode in der 35 ± 1 ° C Wasserbad. Inkubieren für 5 min.
- Übertragen Gewebestreifen auf den zweiten kleinen Röhrchen mit rundem Boden 2,5 ml niedrigen Ca 2+ / Mg 2+ Tyrode in der 35 ± 1 ° C Wasserbad, unter Verwendung der gleichen schmalen Pipette enthält. Waschen Sie die Gewebestreifen durch sanftes das Rohr oder durch vorsichtiges Pipettieren mit dem schmalen Pipette wirbeln. Nicht Invert die Röhre.
- Übertragen Gewebestreifen mit dem dritten kleinen Röhrchen mit rundem Boden 2,5 ml niedrigen Ca 2+ / Mg 2+ Tyrode, und wiederholen Sie den Waschschritt beschrieben in Schritt 5.2 enthält.
- Übertragungsstreifen in den großen Rundboden Röhrchen mit 2,5 ml niedrigen Ca 2+ enthält / Mg 2+ Tyrode mit Enzymen (Elastase und Kollagenase-Protease - Mischung) in dem 35 ° C warmen Wasserbad. Stellen Sie sicher, dass alle drei Gewebestreifen vorhanden sind. Inkubieren für 10-15 min bei 35 ± 1 ° C. Mischen Sie alle 5 min durch das Rohr sanft wirbeln. Das Röhrchen nicht invertieren.
6. Sinoatrialknoten Muskelzellen Distanzierung
- Im Anschluss an das Enzym die Verdauung, verwenden Sie die schmale feuerpolierte Pipette vorsichtig auf die Gewebestreifen an der ersten kleinen, Rundboden Röhrchen mit 2,5 ml KB-Lösung bei 35 ± 1 ° C übertragen. Waschen Sie Gewebe durch das Rohr sanft wirbeln.
Hinweis: Gewebestreifen wird etwas durchscheinend erscheinen und bei th verklumpen kannPunkt. Griff sehr sanft nach der enzymatischen Verdauung zu verlieren Zellen zu vermeiden. - Übertragen, um das Gewebe zu der zweiten kleinen Rundbodenröhrchen mit 2,5 ml KB bei 35 ± 1 ° C. Swirl sanft zu waschen.
- Übertragen, um das Gewebe zu dem dritten kleinen Rundbodenröhrchen mit 2,5 ml KB bei 35 ± 1 ° C. Swirl sanft zu waschen.
- Übertragen, um das Gewebe zu dem großen Rundbodenröhrchen mit 2,5 ml KB bei 35 ± 1 ° C.
- Mit dem größeren feuerpolierte Pipette (Abbildung 1Aiii und 1C), distanzieren die Zellen in der großen Rundbodenrohr durch konstante Verreiben bei ca. 0,5-1 Hz für 5-10 min, wobei darauf geachtet , die Dissoziation Röhre in die unter Wasser zu halten 35 ± 1 ° C Wasserbad und Blasen zu vermeiden, in die Lösung einführt.
Hinweis: Das Verreiben Zeit variiert mit dem Durchmesser der Dissoziation Pipette und die Kraft der Pipettieren. Die Zeit sollte so eingestellt werden, dass die Gewebestücke bei t Rester Ende der Dissoziation erscheinen dünne, transparente und wispy. Wenn Gewebe jede Farbe behält, ist die Dissoziation wahrscheinlich unvollständig. Frequency (0,5-1 Hz) wird von Hand bestimmt. - Entfernen Rundbodenrohr dissoziiert SAMs aus dem Wasserbad enthält, und Äquilibrieren für 5 min bei Raumtemperatur.
7. Sinoatrialknoten Calcium Re-Anpassung (bei Raumtemperatur)
HINWEIS: Für SAMs für Kulturexperimente bestimmt, sollten die Verfahren im folgenden Abschnitt in einer sterilen Gewebekulturhaube durchgeführt werden. Wenn SAMs sind bei akuten Experimenten verwendet werden, besteht keine Notwendigkeit, diese Schritte in einer sterilen Umgebung durchzuführen.
- Hinzufügen , 75 & mgr; l NaCl / CaCl 2 Anpassungslösung (Tabelle 2). Vorsichtig schwenken zu mischen und 5 min inkubiert.
- In 160 ul NaCl / CaCl 2 Anpassung Lösung. Vorsichtig schwenken zu mischen und 5 min inkubiert.
- In 390 ul BSA solution (Tabelle 2). Vorsichtig schwenken zu mischen und für 4 min inkubiert.
- Hinzufügen 1,25 ml BSA-Lösung. Vorsichtig schwenken zu mischen und für 4 min inkubiert.
- In 4,37 ml BSA-Lösung. Vorsichtig schwenken zu mischen und für 4 min inkubiert.
Anmerkung: Die Endkonzentration an Calcium 1,8 mM sein wird. - Im Anschluss an Kalzium Neuanpassung, sammeln SAMs, indem sie durch die Schwerkraft zu regeln für ~ 10 min oder durch Zentrifugation bei ~ 2.000 × g für 3 min.
- Für akut isolierten Zellen, sanft zu entfernen und etwa 5 ml des Überstands unter Verwendung einer Glaspasteurpipette, so dass Zellen in einem Volumen von ~ 2 ml verwerfen. Bewahren Sie diese Zellen bei Raumtemperatur für bis zu ~ 8 h für Patch-Clamp-Aufnahmen.
- Für kultivierten Zellen, zu entfernen, so viel von dem Überstand wie möglich eine sterile Glaspasteurpipette. Resuspendieren Zellpellet in 1 ml vorgewärmtes (37 ° C) Plating Medium (Tabelle 2).
8. Auflage und Kultur von Sinuatriale Myozyten (überspringen für Akut isolierte Zellen)
- Entfernen Laminin Lösung von Deckgläsern aus Schritt 3.3 mit einer Pasteurpipette. Sofort 500 & mgr; l von Saatgut (~ 50-100 Zellen) auf jedes Laminin beschichteten Deckglas (aus Schritt 3).
HINWEIS: Die Kontraktions Inhibitor 2,3-butandion Monoxim (BAW) in der Plattierung und Kulturmedien enthalten Kontraktion zu verhindern, die 9 Abrieb von Zellen verursacht. - Bringen Sie die 24-Well - Platte neu ausgesät SAMs in den Inkubator enthält , und halten bei 37 ° C in einer Atmosphäre von 95% Luft / 5% CO 2. Erlauben Zellen Deckgläser für 4-6 h in plating Medien (Tabelle 2) zu haften.
- Entfernen Sie vorsichtig Plating Medium mit einer sterilen Pasteurpipette. Ersetzen mit 500 & mgr; l pro Vertiefung vorgewärmten (37 ° C) Kulturmedium (Tabelle 2).
9. adenovirale Transduktion von Adult Sinuatriale Muskelzellen-Kulturen (überspringen für Akut isolierte Zellen)
- Schätzung Anzahl der cells pro Deckglas unmittelbar vor Adenovirus Anwendung, indem die Zellen in einem Sichtfeld unter einem Mikroskop gezählt, für eine Vergrößerung eingestellt wird. Zählen Sie alle Zellen, nicht nur SAMs.
- Verdünnte Adenovirus in Medium 199 und der Verdünnung für die Virustiter einzustellen, so dass die Anwendung von 1-10 & mgr; l erforderlich, um eine endgültige Multiplizität der Infektion (MOI) von 100 Viruseinheiten pro Zelle zu erreichen. In adenoviralen Lösung in tropfenweise direkt auf plattiert SAMs.
- Inkubiere Zellen mit dem Virus enthaltende Medium über Nacht (~ 12-14 h). Dann tauschen mit frischem Kulturmedium. Pflegen Zellen im Inkubator, wechselnde Kulturmedium alle 48 Stunden, bis die gewünschte Proteinexpression erhalten wird.
10. Funktionelle Bewertung von Akut Isolierte oder Cultured SAMs
HINWEIS: Das folgende Protokoll ist ein Beispiel für Funktionsprüfungen von isolierten SAMs mit dem Amphotericin perforiert-Patch-Technik sowohl spontane APs und ich aufzeichnen f von derselben Zelle (siehe Referenz 9).
- Bereiten Aufzeichnungslösungen , wie in Tabelle 3 beschrieben.
- Bereiten Sie eine Stammlösung von 20 mg / ml Amphotericin-B in DMSO frisch am Tag der Aufnahme. Halten Sie Lager bei Raumtemperatur und vor Licht schützen. Verdünnen Sie Amphotericin-B Lager in intrazellulären Lösung bis zu einer Endkonzentration von 200 ug / ml unmittelbar vor der Verwendung. Pflegen Sie die endgültige Pipettenlösung auf Eis und vor Licht schützen.
HINWEIS: Die Amphotericin enthaltenden Pipettenlösung für Experimente von stündlich frisch zubereitet werden sollte, einen aliquoten Teil der Stammlösung in den intrazellulären Lösung und Verwirbelung für mindestens 1 min verdünnt. - Übertragen eines aliquoten Teils der distanzierte akut SAM Zellsuspension oder ein Fragment von Deckglas Lager kultivierten SAMs zu einer Aufzeichnungskammer Tyrode-Lösung bei 35 ± 1 ° C enthält. Perfundieren Zellen mit Tyrode-Lösung für mindestens 2 min vor der elektrophysiologischen recordings restliche BDM zu entfernen aus dem Kulturmedium zu bleiben.
HINWEIS: Die spontane Kontraktionen unmittelbar nach Übertragung auf die Tyrode-Lösung offensichtlich sein sollte. SAMs zum Aufzeichnen kann durch eine Kombination von Merkmalen , einschließlich spontaner Kontraktionsaktivität, charakteristische Morphologie (z. B. Figur 2), das Fehlen von Riefen, die Expression von HCN4 Protein, das Vorhandensein von I f Strom, Membrankapazität <50 pF, und die spontane APs identifiziert werden mit Wellenformen, die eine diastolische Depolarisation Phase und eine langsame upstroke umfassen. - Mit Borosilikat-Glaspipetten mit Widerständen von 1,5-3,0 MOhm, füllen Sie die Spitze mit intrazellulären Lösung von 10-30 sec Tauchen Amphotericin fehlt. Dann wieder füllen die Pipette mit der Amphotericin-haltigen Lösung. Eine GOhm Cell-Attached-Dichtung sollte so schnell wie möglich erreicht werden. Wenn Dichtung Bildung schwierig ist, erhöhen Sie die Spitze-fill Zeit.
HINWEIS: Der Zugang Widerstand sollte kontinuierlich seinnach der Bildung der Zell befestigt Dichtung überwacht und Aufnahmen sollte nur nach Erhalt einer stabilen Zugangswiderstand von <10 M & OHgr; begonnen werden. - Um spontane APs aufnehmen, schalten Sie den Verstärker mit schnellen Current-Clamp-Modus ohne Stromeinspeisung.
ANMERKUNG: 1 nM Isoproterenol ist in der extrazellulären Tyrode-Lösung enthalten , wenn APs Aufzeichnen der Befeuerungsrate zu stabilisieren, wie zuvor 10 gemeldet.
Ergebnisse
Die Protokolle hier beschrieben wurden bisher eingesetzt zu isolieren spontan aktiven SAMs aus erwachsenen Mäusen , die 5-8 für eine Vielzahl von verschiedenen Patch - Clamp - Studien geeignet sind. Darüber hinaus ermöglichen die Protokolle für isolierte SAMs, die für bis zu einer Woche in Kultur gehalten werden können. Gentransfer in den kultivierten Zellen kann über adenovirale Infektion 9 erreicht werden. Die Ergebnisse in diesem Abschnitt leiten sich aus unserer bisherigen Arbeit und werden hier als Beispiele für die Eigenschaften von akut isolierten und kultivierten SAMs gezeigt.
Wie in 2 gezeigt ist , spontan aktive SAMs kann für bis zu 6 Tage in Kultur gehalten werden. Die kultivierten Zellen behalten eine Gesamtmorphologie, die zu der von akut isolierten SAMs sehr ähnlich ist, ohne wesentliche Änderungen in der durchschnittlichen Länge, Breite, Querschnittsfläche oder Membrankapazität kultivierterZellen im Vergleich zu akut isolierten Zellen (2B - E). Es gab jedoch Abreibung der Zahl der lebensfähigen SAMs im Laufe der Zeit in Kultur. Daher ist es empfehlenswert, dass Kulturen aus gepoolten Zellen von mehreren Tieren hergestellt werden, wenn das experimentelle Design umfangreiche Datenmengen erfordert.
Ein wichtiges Ziel, das Protokoll für die Kultur von sinoatrial Myozyten aus erwachsenen Mäusen bei der Entwicklung war es, ein System zu schaffen, die die Expression von exogenen Proteinen im nativen zellulären Kontext der Erwachsenen SAMs ermöglichen würde. Ein Beispiel für diese Art von Protein - Expression wird in Figur 3 für den Fall von Zellen gemeinsam mit Viren infiziert Expression der fluoreszierenden Markerproteine GFP und mCherry gezeigt. Wir fanden , dass die Proteinexpression innerhalb von 24 h von adenoviralen Infektion deutlich erkennbar war, und war maximal für die Testproteine in weniger als 48 h (Figur 3). Eine virale MOI von 100 führte zu nahezu 100% infection Effizienz ohne Anzeichen zellulärer Toxizität. Im Gegensatz dazu ist die Transfektion auf Lipidbasis unter Verwendung von Reagenzien versagt in jeder nachweisbaren Gentransfer in erwachsenen SAMs, auch nach 72 Stunden 9 zu erzeugen.
Funktionelle Charakterisierung über Patch-Clamp - Elektrophysiologie ist von entscheidender Bedeutung für die Bewertung der beiden akut isolierten und kultivierten SAMs. 4A zeigt typische Strom-Clamp - Aufnahmen der spontanen Aktionspotentiale aufgezeichnet von akut isolierten oder kultivierten SAMs mit dem Amphotericin perforiert-Patch - Aufnahme - Konfiguration. Aktionspotentialwellenformen waren ähnlich in akut isolierten und kultivierten SAMs und es gab keinen Unterschied in der durchschnittlichen AP Feuerungsrate (4B).
I f ist ein Markenzeichen von SAMs und den HCN4 Kanäle , die ich f produzieren als immunzytochemische Marker des Sinusknotens verwendet. Daraus ergibt sich die prEsence von I f in Patch - Clamp - Aufnahmen kann die Idee zu unterstützen , dass die Zellen in der Tat sind SAMs verwendet werden. Alle der spontan aktiven akuten und kultiviert SAMs hierin auch beschrieben , I f> 100 pA in Reaktion auf eine auf -120 mV Schritt 1 sec Spannung zeigte. Für den repräsentativen hier gezeigten Ergebnisse wurden die Zellen mit Tyrode-Lösung perfundiert , enthaltend 1 mM BaCl 2 K + -Ströme (Tabelle 3) und die Spannungsabhängigkeit der Aktivierung von I f getestet wurde von 3 sec hyperpolarisierenden Spannungsschritte von -60 bis -160 zu blockieren mV von einem Haltepotential von -50 mV, wie wir vorher 5-8 beschrieben. Die Stromdichte wurde als Reaktion auf 3 sec hyperpolarisierender Testimpulse bis -150 mV von einem Haltepotential von -50 mV ausgewertet. Es gab keine signifikanten Unterschiede in entweder der Spannungsabhängigkeit der Aktivierung von I f oder I f Stromdichte zwischen akut isolierten und kultivierten SAMs (Abbildung 4C - D). Diese Co-Aufnahmen der spontanen APs und I f aus einzelnen SAMs benötigen ca. 9 min insgesamt (einschließlich einer 2 min Anfangs waschen, 30-60 sec spontaner APs in current clamp Modus, eine 2 min Lösung ändern und ca. 5 min zu ausreichende Spannungsklemmdaten sammeln , um die Spannungsabhängigkeit der Aktivierung von I f) zu beschreiben. Daraus ergibt sich die in Figur 4C gezeigten Daten veranschaulichen auch die Robustheit der Zellpräparation.

Abbildung 1: Dissection Instrumente zur Isolierung und Dissoziation von Maus SAMs (A) i Zwei 10 cm Petrischalen , enthaltend ~ 25 ml Siliconelastomer gehärtet... Jedes Gericht wird zur Immobilisierung von Gewebe mit 6-10 kleinen Dissektion Stifte vorbelastet. Ii. 100 - ml - Becher zum Halten komplette Tyrode in der 35 &# 176;... C Wasserbad iii Wide (~ 2 mm Durchmesser), feuerpolierte Dissoziation Pipette iv Narrow (~ 1,5 mm Durchmesser) , feuerpolierten Transferpipette v Kunststoff Transferpipette für Badepräparat mit Complete Tyrode mit... Heparin. vi. Selbst Öffnung Mikroscheren für innere Schneidverfahren. vii. feinen Pinzette (Spitze Größe 0,06 x 0,02 mm) für die interne Gewebemanipulation. viii. Tissue Pinzette, 5,5 in, 1 x 2 Zähne für externe Gewebemanipulation. ix. Curved Iris Schere 4.3 für externe Schneidverfahren. (B) Close-up - Foto Hervorhebung kleinen Dissektion Stifte in Dissektion Schale gelegt. (C) Close-up - Foto Hervorhebung feuerpolierte schmalen Transferpipette (links) und feuerpolierte Weithals Pipette zur mechanischen Zerreiben (rechts). Bitte hier klicken , um eine größere versio anzuzeigenn dieser Figur.
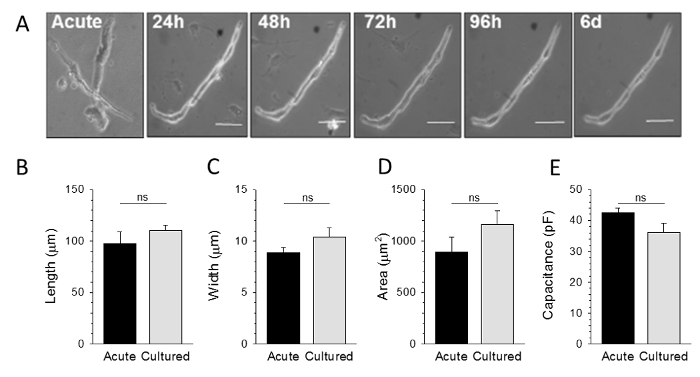
. Abbildung 2: Akut isoliert und kultiviert SAMs sind morphologisch nicht zu unterscheiden . A: Hellfeldbilder von repräsentativen SAMs entweder unmittelbar nach der Isolierung (akut) oder nach 24 h, 48 h, 72 h, 96 h, oder 6 Tage in vitro B - D : Mittelwert (± SEM) maximale Länge, Breite und Querschnittsfläche für im Vergleich zu 48 h kultiviert SAMs akut isoliert . E: Durchschnitt (± SEM) Membrankapazität von Voltage-Clamp - Aufnahmen von akut isolierten oder kultivierten SAMs. Alle Vergleiche sind nicht signifikant: p> 0,05 vs. akut. Angepasst von Referenz 9. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 3: Adenovirale Expression von exogenen Proteinen in gezüchteten SAMs Hellfeld- und Epifluoreszenz Bilder von repräsentativen kultiviert SAMs , die eGFP (grün) und mCherry exprimierende (rot), entweder bei 24 oder 48 Stunden bei einer MOI von 100 für Adenoviren infiziert wurden , nach. Doppelinfektion. Maßstabsbalken = 20 & mgr; m. Wiedergabe aus Lit. 9.
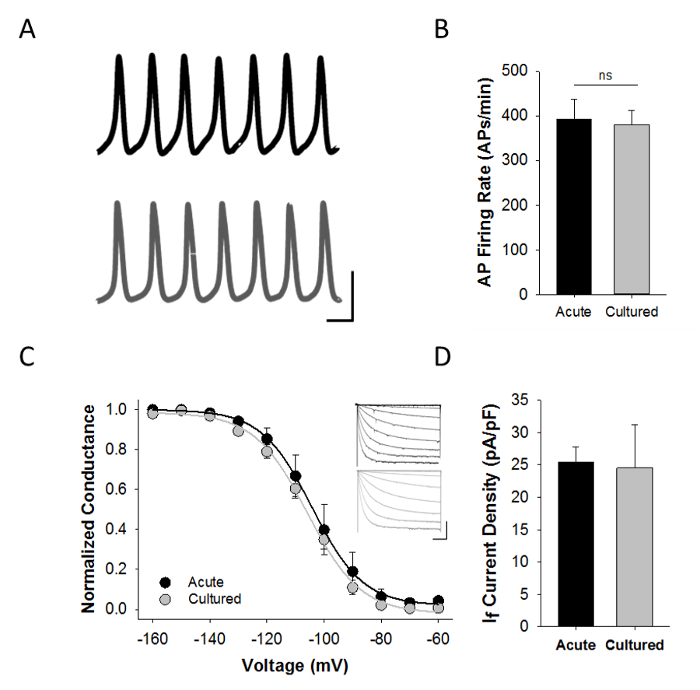
Abbildung 4: Elektrophysiologische Charakterisierung von gezüchteten SAMs . A: Repräsentative Stromzangenaufnahmen von akut isoliert (schwarz) oder kultiviert (grau) SAMs in Tyrode-Lösung , die 1 nM Isoproterenol. Maßstabsbalken: 40 mV, 100 ms . B: Mittelwert (± SEM) Momentanbei akut isoliert Brennen Frequenz (schwarz; n = 6) oder 48 Stunden kultiviert (grau; n = 14) SAMs . C: Normalized Durchschnitt (± SEM) Leitwert-Spannungs - Beziehungen für I f in akut isoliert (schwarz; n = 8) oder kultiviert (grau; n = 14) SAMs Einschübe:.. Vertreter aktuellen Familien von akuten (schwarz) oder kultiviert (grau) SAMs um 3 Sek hyperpolarisierender Testimpulse von -60 bis -160 mV in 10 mV - Schritten ausgelöst D: Average ( ± SEM) I f Stromdichte bei -150 mV bei akut isoliert (schwarz; n = 7) und kultiviert (grau; n = 8) SAMs. Angepasst von Referenz 9. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| Komplette Tyrode des | niedrige Ca 2+ / Mg 2+ Tyrode | KB Medium | BSA - Lösung | NaCl / CaCl 2 Anpassung Lösung | |
| NaCl | 140 | 140 | 140 | 10 | |
| KCl | 5.4 | 5.4 | 25 | 5.4 | |
| KH 2 PO 4 | 1.2 | 1.2 | 10 | 1.2 | |
| HEPES | 5 | 5 | 5 | 5 | |
| Glucose | 5.55 | 18.5 | 20 | 5.55 | |
| MgCl 2 | 1 | 1 | |||
| CaCl 2 | 1.8 | 0,066 | 1.8 | 1.8 | |
| Taurin | 50 | 20 | |||
| BSA | 1 mg / ml | 1 mg / ml | 1 mg / ml | ||
| K-glutamat | 100 | ||||
| K-Aspartat | 10 | ||||
| MgSO 4 | 2 | ||||
| Kreatin | 5 | ||||
| EGTA | 0,5 | ||||
| pH eingestellt auf | 7,4 mit NaOH | 6.9 mit NaOH | 7,2 mit KOH | 7,4 mit NaOH |
Tabelle 1:. Dissociation Lösungen Zusammensetzungen von Lösungen in der Dissoziation von Sinoatrialknoten Myozyten verwendet. Die Konzentrationen werden in mM angegeben, außer wo angegeben.
| Plating Medium | Nährboden | |
| Media199 | Base | Base |
| 2,3-Butandion Monoxim (BDM) | 10 mM | 10 mM |
| Fetal Bovine Serum (FBS) | 5% | - |
| Rinderserumalbumin (BSA) | 0,1 mg / ml | |
| Insulin | 10 & mgr; g / ml | |
| Transferrin | 5,5 & mgr; g / ml | |
| Selen | 5 ng / ml | |
| Penicillin | 100 U / ml | 100 U / ml |
| Streptomycin | 100 mg / ml | 100 mg / ml |
Tabelle 2: Überzug und Kulturlösungen Zusammensetzungen von Lösungen für die Beschichtung und die Kultur des Sinusknotens Myozyten verwendet..
| Tyrode- | PP intrazellulärer | |
| NaCl | 140 | 5 |
| KCl | 5.4 | 135 |
| Kh & sub2 ; PO & sub4 ; | 1.2 | |
| HEPES | 5 | 10 |
| Glucose | 5.55 | |
| MgCl 2 | 1 | 1 |
| CaCl 2 | 1.8 | 0,1 |
| EGTA | 10 | |
| Mg-ATP | 4 | |
| Amphotericin-B | 200 & mgr; g / ml nach Bedarf | |
| Isoproterenol | 1 nM nach Bedarf | |
| pH eingestellt auf | 7,4 mit NaOH | 7,2 mit KOH |
Tabelle 3: Electrophysiology Aufzeichnungslösungen Zusammensetzungen der extrazellulären (Tyrode) und intrazelluläre (PP) Lösungen verwendet für Amphotericin perforiert-Patch - Aufnahmen von Sinoatrialknoten Myozyten..
Diskussion
Dieser Beitrag stellt detaillierte Protokolle für die Isolierung und Kultur von vollständig differenzierten Sinoatrialknoten Myozyten aus erwachsenen Mäusen. Die Isolierung Protokoll erzeugt zuverlässig spontan aktive Maus SAMs geeignet für entweder sofort elektro Analyse oder Folgekultur. Ähnliche Protokolle wurden von vielen anderen Gruppen (siehe beispielsweise die Referenzen 11,12,10,13-17) berichtet. Jedoch unser Protokoll für die in vitro erwachsenen Maus SAMs Aufrechterhaltung bewahrt die charakteristische Morphologie, spontane Aktivität und elektrophysiologischen Eigenschaften der Zellen und ermöglicht es für die adenovirale Verabreichung von Proteinen 9.
Für die Modifikation und Fehlerbehebung der Protokolle, sollten einige wichtige Schritte zu beachten. Der erste kritische Faktor ist ein wichtiger lot-to-lot Variabilität in der Aktivität der Verdauungsenzyme (Schritt 1.4), die dramatisch die Anzahl und Qualität der SAMs getrennt in einem gegebenen prepar verändernation. Diese Variabilität gilt insbesondere für die Elastase, die in der Regel chargenspezifische Optimierung, in denen die Konzentration und die Belichtung erfordert mal über den Verlauf von mehreren Zubereitungen Klammerung werden (oft parallel durchgeführt), um die Zellzahl und die Gesundheit zu maximieren. Einige Protokolle für die Isolierung von SAMs aus verschiedenen Spezies verwenden, um einzelne Kollagenase und Protease-Enzyme anstelle der Kollagenase-Protease-Enzym-Mischung in der vorliegenden Protokoll. Jedoch ist die Menge zu Charge Variabilität für jedes dieser Enzyme ziemlich hoch (ähnlich der Elastase), erfordert wiederholte Runden der Co-Optimierung. Das Enzym-Mischung sorgt für mehr Konsistenz in Lose und erfordert weniger Optimierungsschritte.
Ein zweiter kritischer, und nicht offensichtliche, Faktor für die SAM - Isolierung Fehlerbehebung ist die Integrität des feuerpolierten Glas Dissoziation Pipette (1C). Wenn der Rand der Pipette enthält keine scharfen Kanten, Risse oder akkumulierten czellulären Ablagerungen kann die mechanische Verreibung Schritt die Zellen schädigen, in Calcium Toxizität führt. Die feuerpolierte Dissoziation Pipette sollte alle 2 Monate regelmäßiger Anwendung zumindest ersetzt werden, oder zu jeder Zeit, dass die Zellausbeute oder Qualität deutlich über dem Kurs einiger Vorbereitungen ablehnt.
Der Zeitpunkt und die Kraft der mechanischen Dissoziation ist ein dritter wichtiger Schritt für die Isolierung Protokoll zur Fehlerbehebung. Das Verreiben erfordert langsam (ca. 0,5-1 Hz), aber kraftvolle Turbulenz für 5-10 min. Schnellere Raten und reduziert Zeiten könnten auch verwendet werden, aber es ist wichtig, Blasen oder Schaum zu erzeugen in der Lösung zu vermeiden einzuführen. Wenn die Sinusknoten Proben vollständig dissoziiert wurde, sollten die verbleibenden Gewebestreifen erscheinen wispy und weiß in der Farbe; subtile rosa-ish Färbung zeigt unvollständige Verreiben. Wenn bei 200-400X Vergrößerung untersucht, die aus Zellen optimal präparierten Proben haben glatte Zellmembranen, während Zelle membranes von über verdaute oder über verrieben Proben haben eine cratered und streifige Erscheinung. In gesunden Zellen sind Kontraktionen in erster Linie als subtile Zucken der Enden der Zellen beobachtet. Kontraktionswellen sind ein Zeichen von beschädigten Zellen, die beobachtet werden kann, kräftig für eine kurze Zeit zu kontrahieren, bevor Balling-up. Eine gebrochene Dissoziation Pipette ist die häufigste Ursache für eine solche Zellschäden. In Proben, die unter verdauten oder Unter verrieben wurden, sind Zellen vorhanden als Klumpen oder Aggregate anstelle von einzelnen Zellen und eine erhebliche Anzahl von Vertrags SAMs können in den verbleibenden Gewebebrocken zu beobachten.
Jeder Benutzer muss individuell die Dissoziation zu optimieren. Obwohl die enzymatische Verdauung und mechanische Dissoziation Zeiten beide eingestellt werden sollen, ist es empfehlenswert, zunächst die enzymatische Digestionszeit konstant zu halten, während die Dissoziation der Zeit ändern. Zusätzliche Feinabstimmung stützt sich hauptsächlich auf die Fähigkeit des Benutzers, die ein zu erkennen,ppearance der Stücke Gewebe am Ende der Verreibung verbleibenden - wenn die Stücke wispy und weißlich, dann sollte das Verreiben gestoppt werden. Optimierung ist auch erforderlich, Schwankungen der Sinusknoten unterzubringen, die Unterschiede in Alter, Geschlecht oder Stamm von Mäusen begleiten. Zum Beispiel die Dissoziation von Zellen von älteren Tieren 7 erfordert Reduktion sowohl enzymatische Verdauung und mechanische Dissoziation mal. Als allgemeine Richtlinie gilt, eine typische Zubereitung von 2-3 Monate alten männlichen C57BL / 6-Maus Erträge in etwa 50-200 tragfähige SAMs, von denen vielleicht 5-10 erfolgreich Patch-geklemmt ist in einem guten Tag Sitzung sein kann, abhängig von den Experimenten . Die Ausbeute ist beträchtlich (~ 30%) niedriger , wenn ältere Mäuse 7 verwendet werden.
Der Erfolg des Kulturprotokoll stützt sich auch auf ein paar wichtige Schritte. Foremost erfordert der Erfolg einer primären Zellkultur eine hochwertige Dissoziation, wie oben diskutiert. Es wird empfohlen, thbei der akut isolierten Zellpräparation optimiert werden, bevor die Zellen in Kultur zu halten. Ein zweiter kritischer Faktor für die kultivierten Zellen liegt in der Auswahl der Zellen für elektrophysiologische Aufzeichnungen. Für die besten Ergebnisse, kultiviert Aufnahmen ausgewählt SAMs sollten spontane Kontraktionen sofort nach Auswaschen des BDM-haltigen Kulturmedium aufweisen. Eine langsame Beginn der spontanen Kontraktionen beim Auswaschen von BDM ist ein Zeichen der kranken Zellen.
Die SAM-Kultursystem hat einige Einschränkungen, vor allem die sehr geringe Größe der Maus SAN. Während die hier demonstriert Methoden für eine ausreichende Zellzahlen für elektrophysiologische und bildgebenden Untersuchungen zu ermöglichen, schließt die begrenzte Menge an Gewebe biochemische Analysen von kultivierten SAMs. Eine weitere Einschränkung der Technik ist, dass SAMs in Gegenwart des reversiblen Myosin-ATPase-Inhibitor, BDM kultiviert werden müssen. Das stellt ein mögliches Problem, weil BDM andere zelluläre Wirkungen hat, einschließlichunspezifische Phosphatase - Aktivität, Hemmung der kardialen Transkriptionsfaktoren 19, und die Hemmung der Natrium - Kanäle, Calciumkanäle und Ryanodinrezeptoren 20. Jedoch zeigen die Daten, dass BDM minimale Auswirkungen auf die morphologischen und elektrophysiologische Eigenschaften von SAMs hier untersucht hat.
In zukünftigen Anwendungen scheint es wahrscheinlich, dass die hier beschriebenen Methoden angepasst werden könnten SAM Kulturen von größeren Säugetieren vorzubereiten. In Kombination mit adenoviralen Gentransfer könnten solche Kulturen genetische Manipulationen von Schrittmacher- in großen Tiermodellen ermöglichen. Die Fähigkeit, Proteine von Interesse einzuführen bietet auch für zukünftige Anwendungen, bei denen genetisch kodierten Reportermoleküle verwendet werden können, intrazelluläre Signalwege in SAMs zu sondieren.
Offenlegungen
None.
Danksagungen
We thank Dr. Christian Rickert for critical reading of the manuscript. This work was supported by a grant from the National Heart Lung and Blood Institute (R01-HL088427) to CP. EJS was supported by 5T32-AG000279 from the National Institute on Aging. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Sylgruard/Elastomer Kit | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Borosilicate 9" pasteur pipettes | Fisher Scientific | 13-678-20C | |
| Small, round bottomed culture tubes | Fisher Scientific | 352059 | |
| Large, round bottomed culture tubes | Corning | 14-959-11B | |
| Elastase | Worthington Biochemical | LS002279 | |
| Liberase TM | Roche | 5401119001 | Tissue dissociation solution |
| Heparin | SAGENT Pharmaceuticals | NDC 25021-400-10 | |
| Mouse Laminin | Corning | CB-354232 | |
| 12 mm round glass coverslips | Fisher | 12-545-80 | |
| 24-well culture plate | Fisher | 08-772-1 | |
| Ad-mCherry | Vector Biolabs | 1767 | |
| Ad-eGFP | Vector Biolabs | 1060 | |
| Plastic, disposable transfer pipette | Fisher Scientific | ||
| Micro scissors | Fisher Scientific | 17-467-496 | |
| Dumont #4 Forceps | Roboz Instruments | RS-4904 | |
| Tissue Forceps | Roboz Instruments | RS-8164 | |
| Dissecting Iris Scissors | WPI, Inc. | 501264 | |
| Dissecting Pins | Fine Science Tools | 26002-20 | |
| NaCl | Sigma | 71376 | |
| KCl | Sigma | 60128 | |
| KH2PO4 | Sigma | 60353 | |
| HEPES | Sigma | 54457 | |
| glucose | Sigma | G0350500 | |
| MgCl2 | Sigma | M8266 | |
| CaCl2 | Sigma | C1016 | |
| taurine | Sigma | T0625 | |
| BSA | Sigma | A2153 | |
| K-glutamate | Sigma | G1501 | |
| K-aspartate | Sigma | A6558 | |
| MgSO4 | Sigma | M7506 | |
| creatine | Sigma | C0780 | |
| EGTA | Sigma | E3889 | |
| Mg-ATP | Sigma | A9187 | |
| Amphotericin-B | Fisher Scientific | 1397-89-3 | |
| Isoproterenol | Calbiochem | 420355 | |
| Media199 | Sigma | M4530 | |
| 2,3-butanedione monoxime (BDM) | Sigma | B0753 | |
| Fetal Bovine Serum (FBS) | Sigma | SH30071 | |
| Bovine Serum Albumin (BSA) | Sigma | A5611 | |
| Insulin | Sigma | I3146 | |
| Transferrin | Sigma | I3146 | |
| Selenium | Sigma | I3146 | |
| Penicillin | GE Healthcare | SV30010 | |
| Streptomycin | Hyclone | SV30010 |
Referenzen
- Irisawa, H., Noma, A. Pacemaker currents in mammalian nodal cells. J Mol Cell Cardiol. 16 (9), 777-781 (1984).
- DiFrancesco, D. Pacemaker mechanisms in cardiac tissue. Annu Rev Physiol. 55, 455-472 (1993).
- Mangoni, M., Nargeot, J. Genesis and regulation of the heart automaticity. Physiol Rev. 88 (3), 919-982 (2008).
- Lakatta, E. G., DiFrancesco, D. What keeps us ticking: a funny current, a calcium clock, or both. J Mol Cell Cardiol. 47 (2), 157-170 (2009).
- Liao, Z., Lockhead, D., Larson, E., Proenza, C. Phosphorylation and modulation of hyperpolarization-activated HCN4 channels by protein kinase A in the mouse sinoatrial node. J Gen Physiol. 136 (3), 247-258 (2010).
- Liao, Z., St Clair, J. R., Larson, E. D., Proenza, C. Myristoylated peptides potentiate the funny current (I(f)) in sinoatrial myocytes. Channels. 5 (2), 115-119 (2011).
- Larson, E. D., Clair, J. R. S., Sumner, W. A., Bannister, R. A., Proenza, C. Depressed pacemaker activity of sinoatrial node myocytes contributes to the age-dependent decline in maximum heart rate. Proc Nat Acad Sci. 110 (44), 18011-18016 (2013).
- St. Clair, J. R., Liao, Z., Larson, E. D., Proenza, C. PKA-independent activation of I(f) by cAMP in mouse sinoatrial myocytes. Channels. 7 (4), 318-321 (2013).
- St. Clair, J. R., Sharpe, E. J., Proenza, C. Culture and adenoviral infection of sinoatrial node myocytes from adult mice. Am J Physiol Heart Circ Physiol. , (2015).
- Clark, R. B., Mangoni, M. E., Lueger, A., Couette, B., Nargeot, J., Giles, W. R. A rapidly activating delayed rectifier K+ current regulates pacemaker activity in adult mouse sinoatrial node cells. Am J Physiol Heart Circ Physiol. 286 (5), H1757-H1766 (2004).
- Mangoni, M., Nargeot, J. Properties of the hyperpolarization-activated current (I(f)) in isolated mouse sino-atrial cells. Cardiovasc Res. 52 (1), 51-64 (2001).
- Cho, H. S., Takano, M., Noma, A. The electrophysiological properties of spontaneously beating pacemaker cells isolated from mouse sinoatrial node. J Physiol. 550 (Pt 1), 169-180 (2003).
- Rose, R. A., Lomax, A. E., Kondo, C. S., Anand-Srivastava, M. B., Giles, W. R. Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node: a role for the NPR-C receptor. Am J Physiol Heart Circ Physiol. 286 (5), H1970-H1977 (2004).
- Rose, R. A., Kabir, M. G., Backx, P. H. Altered Heart Rate and Sinoatrial Node Function in Mice Lacking the cAMP Regulator Phosphoinositide 3-Kinase-\gamma\. Circ Res. 101 (12), 1274-1282 (2007).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PloS ONE. 7 (10), e47652(2012).
- Groenke, S., Larson, E. D., et al. Complete atrial-specific knockout of sodium-calcium exchange eliminates sinoatrial node pacemaker activity. PloS ONE. 8 (11), e81633(2013).
- Torrente, A. G., Zhang, R., et al. Burst pacemaker activity of the sinoatrial node in sodium-calcium exchanger knockout mice. Proc Nat Acad Sci USA. 112 (31), 9769-9774 (2015).
- Denyer, J. C., Brown, H. F. Rabbit sino-atrial node cells: isolation and electrophysiological properties. J Physiol. 428 (1), 405-424 (1990).
- Thum, T., Borlak, J. Butanedione monoxime increases the viability and yield of adult cardiomyocytes in primary cultures. Cardiovasc Toxicol. 1 (1), 61-72 (2001).
- Borlak, J., Zwadlo, C. The myosin ATPase inhibitor 2,3-butanedione monoxime dictates transcriptional activation of ion channels and Ca(2+)-handling proteins. Molec Pharmacol. 66 (3), 708-717 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten