Method Article
成体マウスから洞房結節筋細胞の単離、培養、および機能解析のための方法
要約
方法は、パッチクランプ電気生理学やイメージング研究のための成体マウスから洞房結節筋細胞(のSAM)の単離のために実証されています。単離された細胞を直接使用することができ、またはそのような遺伝的にコードされたレポーターとして、関心対象のタンパク質の発現を可能にするために、培養物中に維持することができます。
要約
洞房結節筋細胞(SAMは)自発的な活動電位(APを)を生成することにより、ビートそれぞれの心を開始し、心臓の自然のペースメーカーとして機能します。これらのペースメーカーAPは多数の膜電流と細胞内カルシウムサイクリングの協調活動を反映しています。しかし、SAMの中で自発的なペースメーカー活性を駆動する正確なメカニズムは、とらえどころのないまま。急性孤立したSAMは、心臓ペースメーカーの分子的基礎を分析するための実験のための不可欠な準備です。しかし、不明瞭な解剖学、複雑な顕微解剖、および気難しい酵素消化条件は急性孤立したSAMの普及を妨げてきました。また、方法は、タンパク質発現の研究のためにSAMの長期培養を可能にするために、最近まで利用できませんでした。ここでは、成体マウスからのSAMの単離のためのステップバイステップのプロトコルおよびビデオデモンストレーションを提供しています。この方法はまた、in vitroおよびin expressiのための成体マウスのSAMを維持するために実証されていますアデノウイルス感染を介した外因性タンパク質の上。これらの方法を介して調製急性単離し、培養したSAMは、電気生理学とイメージング研究の多様に適しています。
概要
ペースメーカー、心臓の洞房結節における筋細胞(洞房筋は、「SAMは」)、各ハートビートを開始するために、心筋を介して伝播自発的な、リズミカルな活動電位(APを)を生成します。多くの種から急性単離されたSAMを用いた実験は、ペースメーカー活性の発生に寄与メカニズムの解明のために不可欠でした。 SAMは、形態、機能、およびタンパク質発現の観点から、心房と心室の心筋での対応と実質的に異なる専門性の高い心筋細胞です。 SAMの中の自発的なAPの顕著な特徴は次のAP 1,2をトリガーするしきい値に膜電位を駆動する拡張期に自発的な脱分極です。この「ペースメーカー電位」は、「おかしな電流」(I f)は 、T-およびL型カルシウム電流、およびナトリウム-カルシウム交換体CURRを含む多くの異なった膜電流の協調活性に依存します筋小胞体3,4からのCa 2+放出によって駆動されるENT(I NCX)、。
急性単離したマウスのSAMはペースメーキングの研究に不可欠な実験の準備ですが、マウスSANの不明瞭な解剖学と小さいサイズが微妙な顕微解剖と組み合わせた酵素的および機械を必要とするため、マウスからのSAMの単離は、採用する挑戦的な方法することができます細胞の解離は慎重な最適化が必要。
ここでは正常にパッチクランプ記録5-8のための成体マウスからのSAMを単離するために使用されているプロトコルの詳細なデモビデオを提供しています。我々の知る限りでは、他のソースから入手できるそのような視覚的なデモンストレーションではありません。また、新たな方法は、成体マウスからのSAMの単離された実証される遺伝的にエンコードされ、それによってタンパク質の導入を可能にする、数日間インビトロで維持することができアデノウイルス感染9を介してレポーター分子またはRNAi。
プロトコル
全ての動物手順はコロラドアンシュッツメディカルキャンパスの大学の施設内動物管理使用委員会によって承認されたプロトコルに従って行われました。下記の標準プロトコルは、年齢の2-3ヶ月の雄のC57BL / 6Jマウスを使用して最適化されています。
1.実験の事前にソリューション株式と消耗品を準備します
注:必要な機器および消耗品のための材料表を参照してください。
- 完全なタイロード、ローのCa 2+ / Mgの2+タイロード、変更されたクラフト-Brühe(KB)ソリューション、およびウシ血清アルブミン(BSA)解決策: 表1に示すように1 L以下の各溶液を準備します。すべてのソリューションのために超純ろ過、脱イオン水を使用してください。最大6ヶ月間、20℃で各50ミリリットルのアリコートへの溶液とストアを分割します。実験の直前に、個々のアリコートを解凍し、そして4時までの1週間保存6; C。
- 超純ろ過し、脱イオン水( 表1)中のNaClとのCaCl 2を溶解することにより10mMのNaClおよび1.8 mMのCaCl 2を適応ソリューションの50ミリリットルを準備します。最長6ヶ月間室温で保管してください。
- マイクロチューブにピペットでエラスターゼの4.75酵素活性単位(U)のアリコートを準備します。までの3ヶ月間、4℃で保管してください。
- マイクロチューブにピペッティングすることによりコラゲナーゼプロテアーゼ酵素ブレンドの375μgのアリコート(超純H 2 O中)を準備します。までの3ヶ月間-20℃で保存。
- および解離のための1(〜2ミリメートルの直径; 図1Aiiiおよび図1C); 2火造りパスツールピペット、組織転送のための1つ( 図1Aivおよび図1C〜1.5ミリメートル、最終的な開口径)を準備します。
- ガラスカッターでパスツールピペットをスコアし、所望の大きさよりも僅かに大きい開口部を生成するためにスコアに沿ってスナップします。火災厚い研磨壁と所望の直径の開口部を生成するために、ブンゼンバーナーに弱火にわたって〜30-60秒間、各ピペットの切断端を - ポーランド。ファイアーポリッシュ開口部は、任意の亀裂や粗いエッジの自由であることを確認してください。
- 各100ミリメートルペトリ皿( 図1Aiおよび図1B)に製造業者の指示に従って混合〜25ミリリットルシリコーンエラストマーを加えることにより、2つの解剖皿を準備します。 48時間室温で硬化させます。
- 培養のためにのみ: 表2の通り25〜50ミリリットル各めっき培地および培養培地を準備し、4℃で2週間まで保管してください。
2.ソリューションは、細胞の単離の日に使用するための準備
注:以下の量は、1マウスから洞房筋細胞を単離するためのものです。
- 三つの小さな丸底培養管のそれぞれに低カルシウムの2.5ミリリットル2+ / Mgの2+タイロード液(pH 6.9)を追加秒。 35±1℃の水浴に入れチューブ。
- 低の Ca 2+ / Mgの2+タイロードに一つの大きな丸底培養管の2.5ミリリットルを追加します。このチューブに、1アリコート(4.75 U)エラスターゼおよび1つのアリコート(375μgの)コラゲナーゼプロテアーゼ酵素ブレンドを追加します。混合する渦巻。 35±1℃の水浴に入れチューブ。
- 3つの追加の小、丸底培養管と一つの追加大、丸底培養管にKB中の2.5ミリリットルを追加します。 35±1℃の水浴に入れチューブ。
- 一つの大きな底培養管にBSA溶液の〜7ミリリットルを追加します。室温で、このチューブを保管してください。
- 50ミリリットルのビーカー( 図1Aii)に完全なタイロード液20〜40 mlで配置します。 10 USP / mlのヘパリンを追加し、旋回混合し、35±1℃の水浴でビーカーを配置します。
3.培養細胞のためのその他のソリューションと材料を準備します(急性単離された細胞のためにこれらのステップをスキップ)
- 滅菌組織培養フードでは、24ウェルプレートの個々のウェルにマウスあたり2 12ミリメートルラウンドガラスカバースリップを配置。
注意:ウェルは、その後のウイルス感染の音量を制限するのに役立つ便利なサイズであるため、24ウェルプレートが使用されます。 - ピペット各カバースリップ上に滅菌リン酸緩衝食塩水(PBS)中に希釈したマウスラミニンの100ng / mlの溶液の約200μlの。
- 37℃のインキュベーター中で分離(少なくとも1時間)の期間中、ラミニンでカバースリップをインキュベートします。
- プリ暖かいめっき培地および培養培地を37℃まで(ステップ1.7及び表3から)。
4.洞結節の分離
- 化学ヒュームフードでは、2室のボックスの1室でマウスを置き、他のチャンバー内に綿棒を介して導入〜200μlの液体をイソフルランで麻酔。つま先のピンチで(通常は〜30-60秒以内)麻酔を確認してください。安楽死させます頚椎脱臼によりマウス。
注:空の1mLのピペットチップボックスは二チャンバーボックスを形成するために用いることができます。それを直接接触するマウスを防止するために、イソフルランのための別々の区画を作成するために、ボックス内に上下逆さまにラックの電源を入れます。 - 外部組織鉗子を使用して胸腔を露出するようにハサミと横断リブケージで胸から毛皮を取り外します( 図1Aviii)と解剖ハサミ( 図1Avix)。 〜2mlで胸腔を浴びるトランスファーピペットを用いて、ヘパリンとの完全タイロードを温めました。
注:必要なときに入浴胸腔を続行し、準備が乾燥することはできません。 - 解剖顕微鏡下で、慎重に肺を除去し、内部はさみ( 図1Avi)と解剖鉗子( 図1Avii)を使用して、胸腺。
- 優しく内部解剖ピンセットで心尖を保持しながら、慎重に下大静脈とAをカット胸腔から心臓を除去するための内部はさみでオルタ。シリコーン解剖皿の一つに心を移し、〜4mlで入浴トランスファーピペットを用いて、完全なタイロードをヘパリン化温めました。
- オリエント心臓など事後血管が見えると実験の左側の動物の実験の右に右心房と左心房と、上を向いていること。指向たら、シリコーン解剖皿に頂点を介して固定することによって心臓を固定化します。
- 心室と心房(心室上記の明確なリング)の間の溝を探します。
- 内部解剖ハサミを使用して、溝に切開を行い、心房より心室に近い保ちます。追加温めヘパリン化完全タイロードをとして、心房およびバルブのクリアな視界を可能にするために必要なのと溝と切開をフラッシュします。心室から心房を分離するために溝に沿って切断し続けます。
- 第二のシリコーン解剖皿に心房組織を移し、〜3ミリリットルが完全タイロードをヘパリン処理温めて入浴。
- オリエント組織、動物の右心房は、実験者の左側になりました、と左心房が右側になるように。
注:左心房が暗赤色のトーンの多くを持っていながら、右心房は、より透明です。 - 優しく準備を伸ばし、劣ると優れた大静脈と右と左心耳を介して組織をピン。 (洞房結節は非常に繊細であり、容易に損傷を受けることができますよう、心房壁にカットしないように注意してください)準備のクリアな視界を可能にするために、残りの脂肪や他の組織を削除します。
- venaの複数形のcavaeを切断することにより心房の前壁を開きます。心房中隔を可視化するために、必要に応じて、ピンを再配置します。
- 左心房を除去するために、心房中隔に沿ってカットします。再ピン軽くストレッチ、準備を。
- トンを削除します右心耳彼と心耳と国境を接する暗いオレンジスジとして現れクリステ終に沿って切断することにより、洞房結節を解放。
- 結節組織を再ピンと3等しいサイズのストリップを生成する(稜終に対して垂直)横方向にそれをカット。
5.洞房結節消化
- 狭いファイアーポリッシュピペット( 図1Aiv)を使用して、35±1℃で、低カルシウムの2.5ミリリットルを含む3つの小さな丸底チューブ2+ / Mgの2+タイロードの最初に洞房結節組織の3ストリップを転送しますCの水浴。 5分間インキュベートします。
- 同じ狭いピペットを用いて2.5 mlの低カルシウムを含む第二の小さな丸底チューブへ2+ / Mgの2+タイロード35±1℃の水浴中で組織片を移します。チューブを旋回やそっと狭いピペットでピペッティングすることにより穏やかによって組織片を洗ってください。しないでくださいインバーチューブはt。
- 2.5ミリリットルの低カルシウムを含む第三小、丸底チューブに移し組織片2+ / Mgの2+タイロードし、ステップ5.2で説明した洗浄工程を繰り返します。
- 低カルシウムの2.5ミリリットルを含む大型の丸底チューブに転送ストリップ2+ / Mgの2+タイロード35℃の水浴中の酵素(エラスターゼプラスコラゲナーゼプロテアーゼブレンド)を持ちます。すべての3つの組織片が存在することを確認してください。 35±1℃で10〜15分間インキュベートします。チューブを穏やかに渦巻くことにより、5分ごとに混ぜます。チューブを反転しないでください。
6.洞房結節筋細胞解離
- 酵素消化後、静かに35±1℃で2.5ミリリットルKB溶液を含む第1小、丸底チューブに組織片を転送するために、狭いファイアーポリッシュピペットを使用しています。優しくチューブを旋回することによって、組織を洗浄します。
注:組織片はやや半透明表示され、目で一緒に凝集することができますポイントです。細胞が失われないように酵素消化した後、非常に優しく扱います。 - 35±1℃で2.5ミリリットルKBを含む第2の小丸底チューブに組織を転送します。洗浄するために穏やかに渦巻。
- 35±1℃で2.5ミリリットルKBを含む第3の小さな丸底チューブに組織を転送します。洗浄するために穏やかに渦巻。
- 35±1℃で2.5ミリリットルKBを含む大きな丸底チューブに組織を転送します。
- より大きなファイアーポリッシュピペット( 図1Aiiiおよび図1C)を使用して、中に沈め解離管を保つように注意しながら、5〜10分間、約0.5から1 Hzで一定の磨砕による大の丸底チューブ内の細胞を解離35±1℃の水浴及び溶液中に気泡を導入しないようにします。
注:粉砕して時間が解離ピペットの直径、ピペッティングの力に応じて変化します。組織片がTに残存するように時間調整されるべきです彼は解離の終わりには、薄い透明とうっすらと表示されます。組織は任意の色を保持している場合は、解離が不完全である可能性が高いです。周波数は(0.5-1 Hz)で手によって決定されます。 - 水浴から解離したSAMを含有する丸底チューブを外し、5分間室温で平衡化。
7.洞房結節のカルシウム再適応(室温で行います)
注:SAMのは、培養実験宛ての場合は、次のセクションの手順は、無菌組織培養フード内で行われるべきです。 SAMを、急性実験のために使用する場合は、無菌環境にこれらのステップを実行する必要はありません。
- NaCl / CaCl 2を適応溶液( 表2)の75μLを加えます。混合し、5分間インキュベートし、穏やか渦巻。
- NaCl / CaCl 2を適応液の160μlのを追加します。混合し、5分間インキュベートし、穏やか渦巻。
- BSAゾルの390μLを追加ution( 表2)。混ぜると4分間インキュベート穏やかに渦巻。
- BSA溶液の1.25ミリリットルを追加します。混ぜると4分間インキュベート穏やかに渦巻。
- BSA溶液の4.37ミリリットルを追加します。混ぜると4分間インキュベート穏やかに渦巻。
注:カルシウムの最終濃度が1.8 mMのだろう。 - カルシウム再適応に続いて、10分〜、または3分間〜2,000×gで遠心分離することにより、重力によって沈降させることにより、SAMのを集めます。
- 急性単離された細胞は、穏やか〜2ミリリットルの容量で細胞を残し、ガラスパスツールピペットを用いて上清の約5mlを除去し、廃棄します。パッチクランプ記録のために〜8時間まで室温でこれらの細胞を保管してください。
- 培養細胞の場合は、滅菌ガラスパスツールピペットを用いて、可能な限り上清をできるだけ多く除去します。 1ミリリットル中に再懸濁し、細胞ペレットを予め温めた(37℃)めっき中( 表2)。
洞房ミオの8めっきと文化球(急性単離した細胞のためのスキップ)
- パスツールピペットでステップ3.3からカバースリップからラミニン溶液を除去。直後(ステップ3から)各ラミニン被覆カバースリップ上に500μlの(〜50-100細胞)を播種します。
注:収縮阻害剤2,3-ブタンジオンモノオキシム(BDM)は、細胞9の摩滅を引き起こす収縮を防止するためにメッキや文化メディアに含まれています。 - インキュベーターに新たに播種したSAMを含有する24ウェルプレートを戻し、95%空気/ 5%CO 2の雰囲気下で37℃で維持します。細胞は、めっきメディアで4-6時間( 表2)のためにカバースリップに付着することを可能にします。
- 静かに滅菌パスツールピペットを用いて、めっき中を削除します。予め温めた(37℃)培養培地( 表2)のウェルあたり500μlのと交換してください。
アダルト洞房筋細胞培養物の9アデノウイルス形質導入(急性単離した細胞のためのスキップ)
- CEの数を推定すぐに倍率を調整し、顕微鏡下で視野内の細胞を計数することによってアデノウイルスを適用する前に、カバースリップあたりLLS。すべてのセルだけでなく、SAMのをカウントします。
- 199培地にアデノウイルスを希釈し、1-10μlとアプリケーションは、細胞あたり100ウイルス単位の感染の最終的な多重度(MOI)を達成するために必要とされるように、ウイルス力価のための希釈を調整します。メッキのSAM上に直接滴下様式でアデノウイルスソリューションを追加します。
- ウイルス含有培地で一晩(〜12月14日時間)で細胞をインキュベートします。その後、新鮮な培地と交換します。所望のタンパク質発現が得られるまで、48時間ごとに培地を変え、インキュベーター中で細胞を維持します。
急性単離または培養SAMの10機能評価
注:以下のプロトコルは、自発的なAPと私の両方を記録するためにアムホテリシン穿孔パッチ技術を用いて分離されたSAMの機能評価の一例であり、 同一セルからF(参照9を参照してください)。
- 表3に記載の記録液を調製。
- 記録の日に新鮮なDMSO中の20mg / mlのアンホテリシンBのストック溶液を準備します。室温での在庫を維持し、光から保護します。使用直前に200 UG / mlの最終濃度まで細胞内液中のアンホテリシンBのストックを希釈します。氷の上で最終的なピペット溶液を維持し、光から保護します。
注:実験用アムホテリシン含有ピペット溶液は、少なくとも1分間、細胞内液とボルテックスに原液の一定量を希釈することにより、毎時新鮮な準備する必要があります。 - アリコートを転送するには、急性SAMの細胞懸濁液または35±1℃でタイロード液を含む記録チャンバーに培養したSAMを保有するカバーガラスの断片を解離しました。電気生理学的recordin前に、少なくとも2分間、タイロード液で細胞を灌流GSは、培養培地から残っている残留BDMを削除します。
注:自発収縮はすぐにタイロード液への転送時には明らかです。記録のためのSAMは特徴的な形態( 例えば 、 図2)、自発収縮活動を含む特徴の組み合わせにより同定することができる、細溝の欠如、HCN4タンパク質の発現、I F電流の有無、膜容量<50 pFの、自発APの拡張期脱分極相と遅い上昇行程を含む波形と。 - 1.5から3.0MΩの抵抗値とホウケイ酸ガラスピペットを用いて、10から30秒間浸漬することにより、アムホテリシンを欠く細胞内液で先端を埋めます。そして、アンホテリシンを含む溶液でピペットをバックフィル。 GΩセル付シールは、可能な限り迅速に得られるべきです。シールの形成が困難である場合に、先端充填時間を増加させます。
注:アクセス抵抗は、連続的でなければなりません細胞接着型のシールを形成した後、監視、および録画だけ<10MΩの安定したアクセス抵抗を得た後に開始されるべきです。 - 自発的APを記録するには、無電流注入と高速電流クランプモードにアンプを切り替えます。
注:以前に10を報告したように、燃焼速度を安定させるためにAPを記録する際に1 nMのイソプロテレノールは、細胞外タイロード液に含まれています。
結果
ここで説明するプロトコルは、以前に別のパッチクランプ研究5-8種々のに適している成体マウスから自発的に活性のSAMを単離するために使用されてきました。また、プロトコルは、最大1週間培養物中に維持することができる単離されたSAMを可能にします。培養細胞への遺伝子導入は、アデノウイルス感染9を介して達成することができます。このセクションに示された結果は、我々の以前の研究から派生し、急性単離し、培養したSAMの特性の例として示されています。
図2に示されるように 、自然発生的に活性なSAMは、最大6日間培養物中に維持することができます。培養した細胞は、有意な平均的な長さ、幅の変化、断面積、または培養の膜容量で、急性孤立したSAMのものと非常に類似している全体的な形態を保持します細胞は急性単離された細胞( - E 図2B)と比較します。培養時間にわたる生存可能なSAMの数のスレがありました。したがって、実験的なデザインは大規模なデータセットを必要とする場合培養は、複数の動物からプールされた細胞から調製することをお勧めします。
成体マウスから洞房筋細胞の培養のためのプロトコルを開発する上での主要な目標は、大人SAMのネイティブ細胞環境における外因性タンパク質の発現を可能にするシステムを作成することでした。タンパク質発現のこのタイプの例は、細胞の蛍光マーカータンパク質GFPとmCherryを発現するウイルスで同時感染の場合については、 図3に示されています。我々は、タンパク質の発現は、アデノウイルス感染の24時間以内に明らかであることがわかった、と48時間( 図3)内の試験タンパク質のために最大でした。ほぼ100%のinfをもたらした100のウイルスMOI細胞毒性の証拠とection効率。これとは対照的に、脂質ベースの試薬を用いてトランスフェクションは、さらに72時間9の後、大人のSAMへの任意の検出可能な遺伝子導入で生産することができませんでした。
パッチクランプ電気生理学を介した機能的特徴は、両方の急性単離し、培養したSAMの評価のために重要である。 図4Aは、アムホテリシン穿孔パッチ記録の設定を使用して、急性単離または培養したSAMから記録された自発的な活動電位の典型的な電流クランプ記録を示しています。活動電位波形は、急性単離し、培養したSAMに類似しており、平均AP発火率( 図4B)に差はなかったです。
私fは洞房結節の免疫細胞化学的マーカーとして使用されたSAMとI Fを生成HCN4チャネルの特徴です。したがって、PRパッチクランプ記録におけるI fのesenceは、細胞が実際のSAMであるという考えを支持するために使用することができます。自発的にアクティブな急性および培養SAMの全てがここでも-120 mVの1秒の電圧ステップに応答して、I F> 100 pAのを示した説明します。ここに示した代表的な結果を得るために、細胞は、-60から-160まで3秒の過分極電圧ステップによってアッセイしたK +電流( 表3)、I Fの活性化の電圧依存性をブロックするための1mMのBaCl 2を含むタイロード溶液で灌流しました。 -50 mVの保持電位からmVのは、として我々は以前に5-8を記載しています。電流密度は-50 mVの保持電位から-150 mVの3秒過分極化試験パルスに応答して評価しました。 F Iの活性化の電位依存性または急性単離し、培養したSAMとの間の電流密度F I( 図4のいずれかに有意差はなかったですC - D)。個々のSAMからFこれらの自発的なAPの同時録音と私は2分の最初の洗浄を含め合計で約9分(、電流クランプモードでの自発的なAPの30から60秒、2分のソリューションの変更を必要とし、約5分までI F)の活性化の電圧依存性を説明するのに十分な電圧クランプ・データを収集します。したがって、 図4Cに示されたデータはまた、細胞調製物のロバスト性を示します。

図1: マウスのSAMの単離および解離のための解剖器具 (A) 私は 2つの 10センチメートル〜25ミリリットル硬化シリコーンエラストマーを含むペトリ皿。。。各皿は、組織を固定するための6-10小さな切開ピンがプリロードされている。II。35&で完全タイロードを保持するための100ミリリットルビーカー#176; Cの水浴IIIワイド(〜2ミリメートルの直径)、ファイアーポリッシュ解離ピペットIV狭い(〜1.5ミリメートルの直径)ファイアーポリッシュトランスファーピペットVコンプリートタイロードでの入浴の準備のためのプラスチック製のトランスファーピペット。。。。。。内部組織操作のためのヘパリン。viの内部切断手順のためのマイクロはさみを開くセルフ。VII。ファイン鉗子(先端サイズ0.06 X 0.02ミリメートル)。VIII。組織鉗子、5.5、外部組織操作のための1×2の歯。IX。湾曲した虹彩のはさみ外部切断の手順については、4.3。 (B)クローズアップ写真は解剖皿に入れ、小さな切開ピンを強調します。 (C)クローズアップ写真は。ファイアーポリッシュ狭いホールピペット( 左 )と機械的摩砕( 右 )のための火造り広口ピペットを強調し、より大きな版?を表示するには、こちらをクリックしてください。この図のn個。
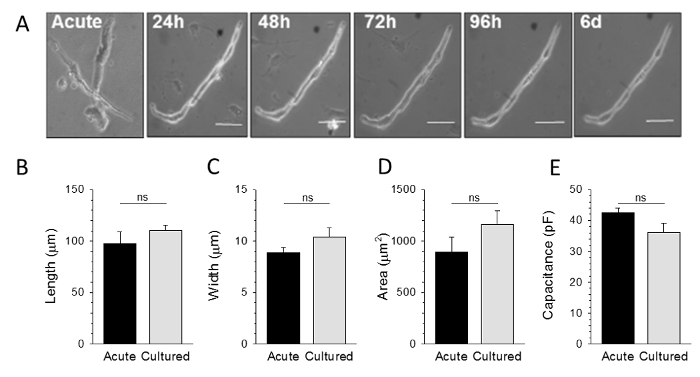
。 図2: 急性単離して培養したSAMは、形態学的に区別できない A:代表的なSAMの明視野画像のいずれかすぐに隔離(急性)後、または24時間、48時間、72時間、96時間、またはin vitroで 6日後にB - D :平均(±SEM)の最大長、急性48時間培養したSAM対単離しの幅と断面積E:急性単離または培養したSAMからの電圧クランプ記録からの平均(±SEM)膜容量。すべての比較は重要ではありません:急性対のp> 0.05。参照9から適応。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3: 培養したSAMにおける外因性タンパク質のアデノウイルス発現明視野および24時間または48時間で後、eGFPの(緑)、mCherryを(赤)を発現するアデノウイルスを100のMOIで感染している代表的な培養SAMのエピ蛍光画像。二重感染。 =20μmのスケールバー。参照9から再生。
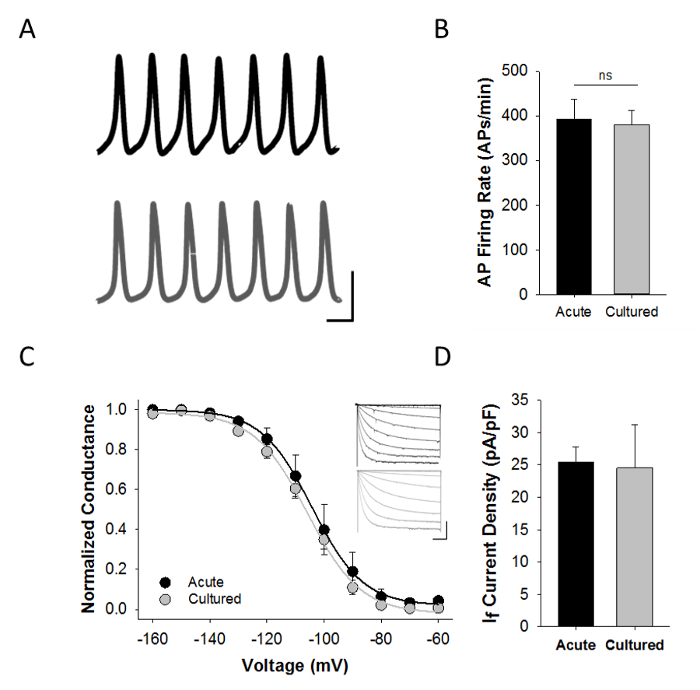
図4:培養したSAM A の電気生理学的特性評価 :急性単離した( 黒 )または1 nMのイソプロテレノールを含むタイロード液中で培養( 灰色 )のSAMからの代表的な現在のクランプ記録。スケールバー:40 mVで、100ミリ秒B:平均(±SEM)瞬間急性単離された周波数を発射( 黒 ; N = 6)または48時間培養した( 灰色であり; n = 14)のSAM C:急性単離した中のF Iのための正規化平均(±SEM)コンダクタンス-電圧関係( 黒はn = 8)。または培養( 灰色であり; n = 14)のSAM インセット :10 mVの増分で-60〜-160 mVのに3秒の過分極試験パルスによって誘発される急性( 黒 )または培養( 灰色 )のSAMからの代表電流家族D:平均( ±SEM)I急性(孤立黒で-150 mVの時の電流密度Fであり; n = 7)、培養( 灰色であり; n = 8)のSAM。参照9から適応。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 完全なTyrodeの | 低の Ca 2+ / Mgの2+タイロード | KBミディアム | BSAソリューション | NaCl / CaCl 2を適応ソリューション | |
| NaClを | 140 | 140 | 140 | 10 | |
| 塩化カリウム | 5.4 | 5.4 | 25 | 5.4 | |
| KH 2 PO 4 | 1.2 | 1.2 | 10 | 1.2 | |
| HEPES | 5 | 5 | 5 | 5 | |
| グルコース | 5.55 | 18.5 | 20 | 5.55 | |
| MgCl 2 | 1 | 1 | |||
| CaCl 2 | 1.8 | 0.066 | 1.8 | 1.8 | |
| タウリン | 50 | 20 | |||
| BSA | 1mg / mlの | 1mg / mlの | 1mg / mlの | ||
| K-グルタミン酸 | 100 | ||||
| K-アスパラギン酸 | 10 | ||||
| 硫酸マグネシウム | 2 | ||||
| クレアチン | 5 | ||||
| EGTA | 0.5 | ||||
| pHに調整 | NaOHで7.4 | NaOHで6.9 | KOHで7.2 | NaOHで7.4 |
表1:解離ソリューション洞房結節筋細胞の解離に使用される溶液の組成物。濃度は、特に注記した場合を除いmMの中で与えられています。
| メッキミディアム | 培養培地 | |
| Media199 | ベース | ベース |
| 2,3-ブタンジオンモノオキシム(BDM) | 10 mMの | 10 mMの |
| ウシ胎児血清(FBS) | 5% | - |
| ウシ血清アルブミン(BSA) | 0.1mg / mlの | |
| インスリン | 10μg/ mlの | |
| トランスフェリン | 5.5 / mlの | |
| セレン | 5 ngの/ mlの | |
| ペニシリン | 100 U / mlの | 100 U / mlの |
| ストレプトマイシン | 100 mg / mlで | 100 mg / mlで |
表2:洞房結節筋細胞のプレーティングおよび培養のために使用される溶液のめっきと培養液組成物。
| タイロード | PP細胞内 | |
| NaClを | 140 | 5 |
| 塩化カリウム | 5.4 | 135 |
| KH 2 PO 4 | 1.2 | |
| HEPES | 5 | 10 |
| グルコース | 5.55 | |
| MgCl 2 | 1 | 1 |
| CaCl 2 | 1.8 | 0.1 |
| EGTA | 10 | |
| Mg-ATP | 4 | |
| アンホテリシンB | 200μg/ mlで、必要に応じ | |
| イソプロテレノール | 必要に応じて1 nMの | |
| pHに調整 | NaOHで7.4 | KOHで7.2 |
表3:電気生理学記録ソリューション洞房結節筋細胞からアムホテリシン穿孔パッチ記録のために使用される細胞外(タイロード)および細胞内(PP)ソリューションの組成物。
ディスカッション
本論文では、成体マウスから完全に分化洞房結節筋細胞の単離および培養のための詳細なプロトコルを提示します。分離プロトコルは確実に即時の電気生理学的解析やその後の培養のいずれかに適した自然発生的にアクティブなマウスのSAMを生成します。同様のプロトコル(例えば、11,12,10,13-17参考文献を参照)、他の多くのグループによって報告されています。しかし、in vitroで成体マウスのSAMを維持するための我々のプロトコルは、特徴的な形態、自発的活動、および細胞の電気生理学的特性を保持し、タンパク質9のアデノウイルス送達を可能にします。
プロトコルの変更やトラブルシューティングのために、いくつかの重要なステップは、注意すべきです。最初の重要な要因は、劇的にSAMの数と質が与えられたpreparで単離し変更することができる消化酵素(ステップ1.4)の活性の有意なロット間変動であり、エーション。この変動は、典型的には、細胞数と健康を最大化するために、濃度および暴露時間は、いくつかの準備の過程でブラケットすべき多くの固有の最適化を、(多くの場合、並行して行う)が必要ですエラスターゼ、のために特に当てはまります。様々な種からのSAMの単離するためのいくつかのプロトコルではなく、本プロトコルにおけるコラゲナーゼプロテアーゼ酵素ブレンドの個々のコラゲナーゼおよびプロテアーゼ酵素を使用しています。しかし、これらの酵素の各々についてのロット間変動性は、同時最適化の反復ラウンドを必要と、かなり高い(エラスターゼと同様)です。酵素ブレンドは、多くの全体でより一貫性を提供し、より少ない最適化ステップを必要とします。
SAM分離のトラブルシューティングを行うための第二の、重要な、かつ非自明の要因は、火災研磨ガラス解離ピペット( 図1C)の整合性です。ピペットのリムは、任意の鋭いエッジ、亀裂や蓄積されたCが含まれている場合ellular破片、機械的摩砕ステップは、カルシウム毒性で、その結果、細胞を損傷することができます。ファイアーポリッシュ解離ピペットは、通常の使用の2ヶ月間、少なくとも毎、または細胞収量や品質は、いくつかの準備の過程で顕著に低下することをいつでも交換する必要があります。
タイミングと機械的解離の力が分離プロトコルのトラブルシューティングを行うための第三の重要なステップです。トリチュレーションは、5〜10分間(約0.5-1 Hz)と遅いが力強い乱流を必要とします。より速い速度および還元時間を用いることもできるが、気泡を導入するか、溶液中の泡の発生を回避することが重要です。洞房結節サンプルが完全に解離された場合には、残りの組織片の色はうっすらと白く見えるべきです。微妙なピンクっぽいカラーリングは、不完全なトリチュレーションを示しています。 200-400X倍率で検査した場合、最適に調製された試料からの細胞は、細胞MEMB一方、滑らかな細胞膜を持っています消化オーバーまたは過磨砕サンプルからranesはクレーターと横紋外観を有します。健康な細胞では、収縮は、主にセルの端部の微妙なけいれんとして観察されます。収縮の波が贅沢をアップする前に、短い時間激しく収縮するように観察することができる損傷を受けた細胞の兆候です。ひびの入った解離ピペットは、細胞損傷の最も一般的な原因です。消化されたアンダーまたはアンダー粉砕していたサンプルでは、細胞は、凝集塊または凝集体の代わりに単一細胞として存在する、とのSAMを収縮のかなりの数は、残りの組織の塊で観察することができます。
各ユーザーが個別に解離を最適化する必要があります。酵素消化および機械的解離時間は両方調整する必要がありますが、解離時間を変更しながら、最初に酵素消化時間を一定に保つことをお勧めします。追加の微調整はAを認識するユーザの能力に主に依存していますトリチュレーションが完了した時点で残りの組織片のppearance - 片がうっすらと色が白っぽいです、その後、粉砕して、停止する必要があります。最適化は、マウスの年齢、性別、または歪みの違いを伴う洞房結節の変動に対応するためにも必要です。例えば、古い動物からの細胞の解離7は、酵素消化および機械的解離時間の両方の低減が必要です。一般的なガイドラインは、おそらく5月10日は、実験に応じて、良い一日のセッションで正常にパッチクランプとすることができるの2-3ヶ月齢の雄のC57BL / 6マウスの利回りおよそ50-200生存したSAMからの典型的な製剤として、 。収率は、古いマウスが7を使用した場合、かなり(〜30%)以下です。
培養プロトコルの成功はまた、いくつかの重要なステップに依存しています。上述のようにまず、初代細胞培養の成功には、高品質の分離を必要とします。これは、番目のをお勧めします急性単離した細胞調製物で培養中の細胞を維持しようとする前に、最適化されます。培養細胞のための第二の重要な要因は、電気生理学的記録のための細胞の選択にあります。最良の結果を得るために、記録のために選択された培養されたSAMはBDM-含む培地の洗い出しとすぐに自発的な収縮を示すべきです。 BDMのウォッシュアウト時の自発的収縮の遅い開始は、不健康な細胞のサインです。
SAM培養系は、いくつかの制限、マウスSANの最も顕著な非常に小さいサイズを持っています。ここで実証された方法は、電気生理学とイメージング研究のために十分な細胞数を可能にする一方で、組織の限られた量は、培養されたSAMの生化学的分析を妨げます。技術の他の制限は、SAMの可逆ミオシンATPアーゼ阻害剤、BDMの存在下で培養されなければならないということです。 BDMを含む、他の細胞性効果を有するので、これは潜在的な問題です非特異的ホスファターゼ活性は、心臓の転写の阻害は、19因子 、およびナトリウムチャネル、カルシウムチャネルとリアノジン受容体20の阻害。しかし、データは、BDM、ここでアッセイしたSAMの形態学的および電気生理学的特性に最小限の影響を有することを示します。
将来のアプリケーションでは、ここに概説した方法は、より大きな哺乳動物からSAM培養物を調製するために適合させることができる可能性が高いと思われます。アデノウイルス遺伝子導入との組み合わせでは、このような培養物は、大型動物モデルにおけるペースメーキングの遺伝子操作を可能にすることができます。目的のタンパク質を導入する能力はまた、遺伝的にコードされたレポーター分子は、SAMの細胞内シグナル伝達経路を探索するために使用することができる将来の用途を提供します。
開示事項
None.
謝辞
We thank Dr. Christian Rickert for critical reading of the manuscript. This work was supported by a grant from the National Heart Lung and Blood Institute (R01-HL088427) to CP. EJS was supported by 5T32-AG000279 from the National Institute on Aging. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
資料
| Name | Company | Catalog Number | Comments |
| Sylgruard/Elastomer Kit | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Borosilicate 9" pasteur pipettes | Fisher Scientific | 13-678-20C | |
| Small, round bottomed culture tubes | Fisher Scientific | 352059 | |
| Large, round bottomed culture tubes | Corning | 14-959-11B | |
| Elastase | Worthington Biochemical | LS002279 | |
| Liberase TM | Roche | 5401119001 | Tissue dissociation solution |
| Heparin | SAGENT Pharmaceuticals | NDC 25021-400-10 | |
| Mouse Laminin | Corning | CB-354232 | |
| 12 mm round glass coverslips | Fisher | 12-545-80 | |
| 24-well culture plate | Fisher | 08-772-1 | |
| Ad-mCherry | Vector Biolabs | 1767 | |
| Ad-eGFP | Vector Biolabs | 1060 | |
| Plastic, disposable transfer pipette | Fisher Scientific | ||
| Micro scissors | Fisher Scientific | 17-467-496 | |
| Dumont #4 Forceps | Roboz Instruments | RS-4904 | |
| Tissue Forceps | Roboz Instruments | RS-8164 | |
| Dissecting Iris Scissors | WPI, Inc. | 501264 | |
| Dissecting Pins | Fine Science Tools | 26002-20 | |
| NaCl | Sigma | 71376 | |
| KCl | Sigma | 60128 | |
| KH2PO4 | Sigma | 60353 | |
| HEPES | Sigma | 54457 | |
| glucose | Sigma | G0350500 | |
| MgCl2 | Sigma | M8266 | |
| CaCl2 | Sigma | C1016 | |
| taurine | Sigma | T0625 | |
| BSA | Sigma | A2153 | |
| K-glutamate | Sigma | G1501 | |
| K-aspartate | Sigma | A6558 | |
| MgSO4 | Sigma | M7506 | |
| creatine | Sigma | C0780 | |
| EGTA | Sigma | E3889 | |
| Mg-ATP | Sigma | A9187 | |
| Amphotericin-B | Fisher Scientific | 1397-89-3 | |
| Isoproterenol | Calbiochem | 420355 | |
| Media199 | Sigma | M4530 | |
| 2,3-butanedione monoxime (BDM) | Sigma | B0753 | |
| Fetal Bovine Serum (FBS) | Sigma | SH30071 | |
| Bovine Serum Albumin (BSA) | Sigma | A5611 | |
| Insulin | Sigma | I3146 | |
| Transferrin | Sigma | I3146 | |
| Selenium | Sigma | I3146 | |
| Penicillin | GE Healthcare | SV30010 | |
| Streptomycin | Hyclone | SV30010 |
参考文献
- Irisawa, H., Noma, A. Pacemaker currents in mammalian nodal cells. J Mol Cell Cardiol. 16 (9), 777-781 (1984).
- DiFrancesco, D. Pacemaker mechanisms in cardiac tissue. Annu Rev Physiol. 55, 455-472 (1993).
- Mangoni, M., Nargeot, J. Genesis and regulation of the heart automaticity. Physiol Rev. 88 (3), 919-982 (2008).
- Lakatta, E. G., DiFrancesco, D. What keeps us ticking: a funny current, a calcium clock, or both. J Mol Cell Cardiol. 47 (2), 157-170 (2009).
- Liao, Z., Lockhead, D., Larson, E., Proenza, C. Phosphorylation and modulation of hyperpolarization-activated HCN4 channels by protein kinase A in the mouse sinoatrial node. J Gen Physiol. 136 (3), 247-258 (2010).
- Liao, Z., St Clair, J. R., Larson, E. D., Proenza, C. Myristoylated peptides potentiate the funny current (I(f)) in sinoatrial myocytes. Channels. 5 (2), 115-119 (2011).
- Larson, E. D., Clair, J. R. S., Sumner, W. A., Bannister, R. A., Proenza, C. Depressed pacemaker activity of sinoatrial node myocytes contributes to the age-dependent decline in maximum heart rate. Proc Nat Acad Sci. 110 (44), 18011-18016 (2013).
- St. Clair, J. R., Liao, Z., Larson, E. D., Proenza, C. PKA-independent activation of I(f) by cAMP in mouse sinoatrial myocytes. Channels. 7 (4), 318-321 (2013).
- St. Clair, J. R., Sharpe, E. J., Proenza, C. Culture and adenoviral infection of sinoatrial node myocytes from adult mice. Am J Physiol Heart Circ Physiol. , (2015).
- Clark, R. B., Mangoni, M. E., Lueger, A., Couette, B., Nargeot, J., Giles, W. R. A rapidly activating delayed rectifier K+ current regulates pacemaker activity in adult mouse sinoatrial node cells. Am J Physiol Heart Circ Physiol. 286 (5), H1757-H1766 (2004).
- Mangoni, M., Nargeot, J. Properties of the hyperpolarization-activated current (I(f)) in isolated mouse sino-atrial cells. Cardiovasc Res. 52 (1), 51-64 (2001).
- Cho, H. S., Takano, M., Noma, A. The electrophysiological properties of spontaneously beating pacemaker cells isolated from mouse sinoatrial node. J Physiol. 550 (Pt 1), 169-180 (2003).
- Rose, R. A., Lomax, A. E., Kondo, C. S., Anand-Srivastava, M. B., Giles, W. R. Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node: a role for the NPR-C receptor. Am J Physiol Heart Circ Physiol. 286 (5), H1970-H1977 (2004).
- Rose, R. A., Kabir, M. G., Backx, P. H. Altered Heart Rate and Sinoatrial Node Function in Mice Lacking the cAMP Regulator Phosphoinositide 3-Kinase-\gamma\. Circ Res. 101 (12), 1274-1282 (2007).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PloS ONE. 7 (10), e47652(2012).
- Groenke, S., Larson, E. D., et al. Complete atrial-specific knockout of sodium-calcium exchange eliminates sinoatrial node pacemaker activity. PloS ONE. 8 (11), e81633(2013).
- Torrente, A. G., Zhang, R., et al. Burst pacemaker activity of the sinoatrial node in sodium-calcium exchanger knockout mice. Proc Nat Acad Sci USA. 112 (31), 9769-9774 (2015).
- Denyer, J. C., Brown, H. F. Rabbit sino-atrial node cells: isolation and electrophysiological properties. J Physiol. 428 (1), 405-424 (1990).
- Thum, T., Borlak, J. Butanedione monoxime increases the viability and yield of adult cardiomyocytes in primary cultures. Cardiovasc Toxicol. 1 (1), 61-72 (2001).
- Borlak, J., Zwadlo, C. The myosin ATPase inhibitor 2,3-butanedione monoxime dictates transcriptional activation of ion channels and Ca(2+)-handling proteins. Molec Pharmacol. 66 (3), 708-717 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved