Method Article
Métodos para o isolamento, Cultura e caracterização funcional de SINOATRIAL Nó miócitos de ratos adultos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Métodos são demonstradas para o isolamento de miócitos do nó sinoatrial (SAM) a partir de ratinhos adultos por patch-clamp electrofisiologia ou imagiologia estudos. As células isoladas podem ser utilizadas directamente ou podem ser mantidas em cultura que permita a expressão de proteínas de interesse, tais como repórteres geneticamente codificados.
Resumo
miócitos nó sinusal (SAMs) atuam como os pacemakers naturais do coração, iniciando cada coração bater através da geração de potenciais de ação espontâneos (APs). Estes APs marcapasso refletem a atividade coordenada de numerosas correntes de membrana e ciclismo de cálcio intracelular. No entanto, os mecanismos precisos que impulsionam a atividade pacemaker espontânea em SAMs ainda imperceptíveis. Agudamente SAMs isolados são uma preparação essencial para experimentos para dissecar a base molecular da pacemaking cardíaca. No entanto, a anatomia indistinta, microdissection complexa, e as condições de digestão enzimática mimado ter evitado o uso difundido de forma aguda isolada SAMs. Além disso, os métodos não estavam disponíveis até recentemente para permitir a cultura de longo prazo de SAM para estudos de expressão proteica. Aqui nós fornecemos um passo-a-passo do protocolo e demonstração de vídeo para o isolamento de SAM a partir de ratinhos adultos. Um método também é demonstrada pela manutenção do rato adulto SAM in vitro e para Expressino de proteínas exógenas via infecção por adenovírus. Agudamente isolados e cultivados SAM preparados através destes métodos são adequados para uma variedade de estudos electrofisiológicos e de imagem.
Introdução
miócitos marcapasso no nó sinusal do coração (miócitos sinoatrial, "SAMs") geram, potenciais espontâneos rítmicas ação (APs) que se propagam através do miocárdio para iniciar a cada batimento cardíaco. Experiências utilizando SAM agudamente isolados a partir de muitas espécies têm sido essenciais para a elucidação dos mecanismos que contribuem para a geração da actividade de pacemaker. SAMs são cardiomiócitos altamente especializados que diferem substancialmente dos seus homólogos na atrial e ventricular miocárdio em termos de morfologia, função e expressão da proteína. A marca da APs espontâneos em SAMs é uma despolarização espontânea durante a diástole que impulsiona o potencial de membrana até o limiar para acionar o próximo AP 1,2. Este "potencial pacemaker" depende da actividade coordenada de muitas correntes diferentes de membrana, incluindo o "engraçado corrente" (I), F e G-T- tipo correntes de cálcio, e o permutador de sódio-cálcio CurrEnt (I NCX), que é accionado por libertação de Ca2 + a partir do retículo sarcoplasmático 3,4.
Enquanto intensamente isolado rato SAMs são uma preparação experimental essencial para o estudo da pacemaking, o isolamento de SAMs de camundongos pode ser um método desafiador para adotar, porque a anatomia indistinta e pequeno tamanho do SAN do mouse requer um microdissection diferenciada ea enzimática combinados e mecânica dissociação das células requer optimização cuidada.
Apresentamos aqui uma demonstração de vídeo detalhada de um protocolo que foi usado com sucesso para isolar SAM a partir de murganhos adultos por gravações patch clamp 5-8. Para nosso conhecimento, não existe tal demonstração visual disponível a partir de qualquer outra fonte. Além disso, um novo método é demonstrado em que SAM isolado a partir de ratinhos adultos podem ser mantidas in vitro durante vários dias, permitindo assim a introdução de proteínas, codificado geneticamentemoléculas repórter ou ARNi via infecção adenoviral 9.
Protocolo
Todos os procedimentos com animais foram realizados de acordo com protocolos aprovados pelo Comitê de Cuidado e Uso Institucional Animal da Universidade do Colorado Anschutz Medical Campus. O protocolo padrão abaixo foi optimizada usando macho C57BL 6J / de 2-3 meses de idade.
1. Prepare Stocks e Suprimentos Solução em adiantado de Experimentos
NOTA: Consulte a Tabela de Materiais para equipamentos e materiais necessários.
- Prepare 1 L de cada uma das soluções seguintes, tal como indicado na Tabela 1:, Baixo Ca2 + / Mg2 + de Tyrode, solução modificada de Kraft-Brühe (KB) e Albumina de Soro Bovino (BSA) a solução completa de Tyrode. Use ultrapura filtrada água deionizada para todas as soluções. Dividir cada solução em alíquotas de 50 ml e armazenar a 20 ° C durante até seis meses. Descongelar alíquotas individuais imediatamente antes dos experimentos e armazenar por até uma semana a 46; C.
- Preparar 50 ml de NaCl 10 mM e CaCl2 Solução Adaptação 1,8 por dissolução de NaCl e CaCl 2 em ultrapura filtrada água desionizada (Tabela 1). Armazenar à temperatura ambiente por até seis meses.
- Preparar alíquotas 4,75 unidade de actividade da enzima (U) de elastase por pipetagem em tubos de microcentrífuga. Armazenar a 4 ° C por até três meses.
- Preparar 375 ug (em alíquotas ultrapura H2O) de mistura de enzimas de colagenase-protease, pipetando em tubos de microcentrífuga. Armazenar a -20 ° C durante até três meses.
- Prepare duas pipetas de Pasteur polidas ao fogo, para a transferência de um tecido (-1,5 mm de diâmetro de abertura final; 1Aiv Figura e Figura 1C) e uma para a dissociação (~ 2 mm de diâmetro; 1Aiii Figura e Figura 1C).
- Marque pipetas de Pasteur com um cortador de vidro e encaixe ao longo do marcador para produzir uma abertura ligeiramente maior do que o tamanho desejado. Fogo-polish o corte final de cada pipeta para ~ 30-60 segundos em fogo baixo em um queimador de Bunsen para produzir uma parede polida de espessura e uma abertura do diâmetro desejado. Garantir a abertura polido-fogo está livre de todas as rachaduras ou arestas.
- Preparar dois pratos de dissecação por adição de ~ 25 mL de elastómero de silicone misturados de acordo com as instruções do fabricante para cada placa de Petri de 100 milímetros (Figura 1ai e Figura 1B). Deixa-se curar à temperatura ambiente durante 48 h.
- Para a cultura única: prepare 25-50 ml cada chapeamento Médio e Meio de Cultura de acordo com a Tabela 2 loja por até duas semanas a 4 ° C..
2. Preparar soluções para ser usado em dia de isolamento celular
NOTA: Os seguintes valores são para isolamento de miócitos sinoatrial de um mouse.
- Adicionar 2,5 ml de Baixa Ca2 + / Mg2 + de Tyrode (pH 6,9) a cada um de três tubos de cultura pequeno, de fundo redondos. Colocar os tubos no banho de água de 35 ± 1 ° C.
- Adicionar 2,5 ml de baixa Ca 2+ / para um grande tubo de cultura de fundo redondo de Mg 2+ Tyrode. A este tubo, adicionar uma alíquota (4,75 L) a elastase e uma alíquota (375 ug) de colagenase-protease de mistura de enzimas. Agite para misturar. Coloque o tubo em 35 ± 1 ° C banho de água.
- Adicionar 2,5 ml de KB médio para três tubos de cultura, adicionais pequenos de fundo redondo e um, tubo de cultura de fundo redondo de grande adicional. Colocar os tubos no banho de água de 35 ± 1 ° C.
- Adicionar ~ 7 ml de solução de BSA a um grande tubo de cultura assentada. Manter este tubo à temperatura ambiente.
- Coloque 20-40 ml de solução de Tyrode completa em um copo de 50 ml (Figura 1Aii). Adicionar 10 USP / ml de heparina, agite para misturar e colocar o copo no banho de água ° C 35 ± 1.
3. Preparar soluções e materiais adicionais para células cultivadas (ignorar essas etapas para Acutely isolaram células)
- Num capuz de cultura de tecido estéril, colocar dois 12 milímetros lamelas de vidro redondas por rato em poços individuais de uma placa de 24 poços.
NOTA: A placa 24 também é utilizado porque os poços são de um tamanho conveniente, que serve para limitar o volume de infecções virais posteriores. - Pipetar cerca de 200 ul de uma solução a 100 ng / ml de laminina de rato diluído em solução salina tamponada com fosfato estéril (PBS) em cada lamela.
- Incubar lamelas com laminina para a duração do isolamento (pelo menos, 1 h) em uma incubadora a 37 ° C.
- Pré-aquecer o chapeamento de médio e Meio de Cultura (do Passo 1.7 e Tabela 3) a 37 ° C.
Isolamento 4. Sinoatrial Node
- Em uma Cobertura de vapores químicos, coloque um rato em uma câmara de uma caixa de duas câmaras e anestesiar com ~ 200 mL de isoflurano líquido introduzido através de um cotonete de algodão para a outra câmara. Confirmar anestesia (geralmente dentro de ~ 30-60 seg) com uma pitada dedo do pé. Eutanásiado mouse por deslocamento cervical.
NOTA: Uma 1 ml caixa de ponteira vazio pode ser usado para formar a caixa de duas câmaras; transformar o rack de cabeça para baixo na caixa para criar o compartimento separado para o isoflurano para prevenir o mouse entrar em contato com ele diretamente. - Retire a pele do peito com uma tesoura e costela transecto gaiola para expor a cavidade torácica usando uma pinça externas de tecido (Figura 1Aviii) e tesouras de dissecação (Figura 1Avix). Banhar a cavidade torácica com ~ 2 ml aquecido completa Tyrode Com heparina utilizando uma pipeta de transferência.
NOTA: Continue cavidade torácica tomar banho, quando necessário, não permita que a preparação para secar. - Sob um microscópio de dissecação, remova cuidadosamente os pulmões e do timo com uma tesoura internos (Figura 1Avi) e uma pinça de dissecção (Figura 1Avii).
- Enquanto gentilmente segurando o ápice do coração com a pinça de dissecação internos, corte cuidadosamente a veia cava inferior ea umorta com a tesoura internos para remover o coração da cavidade torácica. Transferir o coração a um dos pratos de dissecação de silicone e banhar-se com ~ 4 ml aquecido heparinizado completo Tyrode do usando a pipeta de transferência.
- Oriente o coração de tal modo que os vasos posteriores são visíveis e voltado para cima, com o átrio direito do animal no lado direito do experimentador eo átrio esquerdo à esquerda do experimentador. Uma vez orientado, imobilizar o coração fixando através do ápice para o prato de silicone dissecção.
- Localize o sulco entre os ventrículos e as aurículas (anel clara acima do ventrículos).
- Usando as tesouras de dissecação internos, fazer uma incisão na ranhura, mantendo-se mais estreita para os ventrículos do que os átrios. Lave o groove e incisão com Tyrode completo heparinizado aquecido adicional da conforme necessário para permitir uma visão clara dos átrios e das válvulas. Continuar a cortar ao longo da ranhura para separar os átrios dos ventrículos.
- Transferir o tecido atrial para o segundo prato de silicone dissecção e tomar banho com ~ 3 ml aquecido heparinizado completo Tyrode do.
- Orient o tecido de modo que átrio direito do animal está agora no lado esquerdo do experimentador, eo átrio esquerdo é à direita.
NOTA: O átrio direito é mais transparente, enquanto o átrio esquerdo tem mais de um tom vermelho escuro. - Pin o tecido através da veia cava inferior e superior e à direita e apêndices atriais à esquerda, estendendo-se a preparação suavemente. Remover qualquer tecido adiposo ou outro restante para permitir uma visão clara da preparação (cuidado para não cortar na parede atrial, como o nó sinusal é bastante delicada e pode ser facilmente danificada).
- Abrir a parede anterior dos átrios cortando através das veias cavas. Re-posicionar os pinos, conforme necessário para visualizar o septo interatrial.
- O corte ao longo do septo interatrial para remover o átrio esquerdo. Re-pin a preparação, que se estende suavemente.
- Retirar tele direita aurícula e libertar o nó sinusal cortando ao longo da terminalis cristas, que aparece como uma faixa laranja escuro na fronteira com o apêndice atrial.
- Re-pin o tecido nodal e cortá-la lateralmente (perpendicular à crista terminal) para produzir três faixas de igual tamanho.
5. Sinoatrial Nó Digestão
- Utilizando a pipeta polida ao fogo estreita (Figura 1Aiv), transferir as três tiras de tecido do nódulo sino-auricular para o primeiro de três pequeno tubo, de fundo redondo contendo 2,5 ml de baixo Ca2 + / Mg2 + de Tyrode no 35 ° ± 1 banho de água C. Incubar durante 5 min.
- Tiras de tecido transferência para o segundo tubo pequeno, de fundo redondo contendo 2,5 ml de baixa Ca 2+ / Mg 2+ Tyrode está no banho de água ° C 35 ± 1, utilizando a mesma pipeta estreita. Lave as tiras de tecido por gentil rodando o tubo ou pipetando suavemente com a pipeta estreita. Não invert do tubo.
- Tiras de tecido de transferência para o tubo terceira pequeno, de fundo redondo contendo 2,5 ml de baixa Ca 2+ / Mg 2+ Tyrode de, e repita o passo de lavagem descrito no passo 5.2.
- Tiras de transferência para o tubo de fundo redondo de grande contendo 2,5 ml de baixo Ca2 + / Mg2 + de Tyrode com enzimas (elastase de mais mistura de colagenase-protease), em banho de água a 35 ° C. Certifique-se de que todas as três tiras de tecido estão presentes. Incubar durante 10-15 minutos a 35 ± 1 ° C. Misture a cada 5 min de agitação suave do tubo. Não inverter o tubo.
6. Sinoatrial Nó miócitos dissociação
- Após a digestão enzima, utilizar a pipeta estreita-fogo polido para transferir suavemente as tiras de tecido para o primeiro tubo pequeno, de fundo redondo contendo 2,5 ml de solução de KB a 35 ± 1 ° C. Lave o tecido suavemente agitando o tubo.
Nota: tiras de tecido vai aparecer um pouco translúcida e pode se aglutinarem em thé o ponto. Lidar com muito cuidado após a digestão enzimática para evitar células perder. - Transferir o tecido para o segundo tubo de fundo redondo de pequeno contendo 2,5 ml de KB a 35 ± 1 ° C. Homogeneizar suavemente para lavar.
- Transferir o tecido para o terceiro tubo de fundo redondo de pequeno contendo 2,5 ml de KB a 35 ± 1 ° C. Homogeneizar suavemente para lavar.
- Transferir o tecido para o tubo de grandes dimensões, de fundo redondo contendo 2,5 ml de KB a 35 ± 1 ° C.
- Utilizando a pipeta polida ao fogo maior (Figura 1Aiii e Figura 1C), dissociar as células do grande tubo de fundo redondo de trituração constante em aproximadamente 0,5-1 Hz durante 5-10 min, tendo o cuidado de manter o tubo submerso no dissociação 35 ± 1 ° C e banho de água para evitar a introdução de bolhas na solução.
Nota: O tempo trituração varia de acordo com o diâmetro da pipeta dissociação e força de pipetagem. O tempo deve ser ajustada de modo que os pedaços de tecido restante em tele final da dissociação parecem fina, transparente e rala. Se o tecido retém toda a cor, a dissociação é provável que seja incompleta. Frequência (0,5-1 Hz) é determinada pela mão. - Retirar o tubo de fundo redondo contendo SAM dissociada do banho de água e equilibrar à temperatura ambiente durante 5 min.
7. Sinoatrial cálcio Nó Re-adaptação (realizada na Sala de Temperatura)
NOTA: Para SAMs destinados a experiências de cultura, os procedimentos na seção seguinte deve ser realizada em uma capa de cultura de tecidos estéreis. Se SAM são para ser utilizados em experiências agudas, não há necessidade de efectuar estes passos, em um ambiente estéril.
- Adicionar 75 ul de NaCl / CaCl solução adaptação 2 (Tabela 2). Agitar suavemente o frasco para misturar e incubar durante 5 min.
- Adicionar 160 ul de NaCl / CaCl 2 solução de adaptação. Agitar suavemente o frasco para misturar e incubar durante 5 min.
- Adicionar 390 ul de BSA Solbuição (Tabela 2). Agitar suavemente o frasco para misturar e incubar durante 4 min.
- Adicionar 1,25 ml de solução de BSA. Agitar suavemente o frasco para misturar e incubar durante 4 min.
- Adicionar 4,37 ml de solução de BSA. Agitar suavemente o frasco para misturar e incubar durante 4 min.
Nota: A concentração final de cálcio será 1,8 mm. - Na sequência de cálcio re-adaptação, recolher SAMs, permitindo a resolver pela força da gravidade para ~ 10 min ou por centrifugação a ~ 2.000 xg por 3 min.
- Para as células agudamente isolados, suavemente remover e descartar cerca de 5 ml do sobrenadante, utilizando uma pipeta de Pasteur de vidro, deixando as células num volume de ~ 2 ml. Armazenar estas células à temperatura ambiente durante até ~ 8 h para gravações de patch clamp.
- Para células de cultura, remover tanto do sobrenadante quanto possível, utilizando uma pipeta de Pasteur de vidro estéril. Ressuspender o sedimento celular em 1 ml de pré-aquecido (37 ° C) chapeamento médio (Tabela 2).
8. Galvanização e Cultura da Sinoatrial Myocitos (Ir para Cells Acutely isolado)
- Remoção da solução de laminina de lamelas do Passo 3.3 com uma pipeta Pasteur. Imediatamente semear 500 ul (~ 50-100 células) em cada lamela revestida-laminina (do passo 3).
NOTA: O inibidor contráctil 2,3-butanodiona monoxima (BDM) está incluído nos meios de cultura e de revestimento para impedir a contracção, o que faz com que o atrito de células 9. - Retorno da placa de 24 poços contendo SAM recentemente semeadas para a incubadora e manter a 37 ° C numa atmosfera de 95% ar / 5% de CO 2. Permitir que as células a aderir a lamelas de 4-6 h em media chapeamento (Tabela 2).
- Remova cuidadosamente Galvanização Médio com uma pipeta de Pasteur estéril. Substituir com 500 ul por poço de pré-aquecido (37 ° C) meio de cultura (Tabela 2).
9. Transdução adenoviral de adultos culturas miócitos Sinoatrial (Ir para Acutely isolaram células)
- Estimar o número de cells por lamela imediatamente antes de aplicar adenovírus através da contagem de células em um campo de vista sob um microscópio, ajustando para a ampliação. Contagem de todas as células, não apenas SAMs.
- Diluir adenovírus em Meio 199 e ajustar a diluição para o título virai de modo que a aplicação de 1-10 ul é necessária para alcançar uma multiplicidade final da infecção (MOI) de 100 unidades virais por célula. Adicionar solução adenoviral de uma forma gota a gota, directamente para SAM plaqueadas.
- Incubar as células durante a noite com o meio contendo vírus (~ 12-14 h). Em seguida, trocar com meio de cultura fresco. Manter as células na incubadora, mudando o meio de cultura a cada 48 horas, até se obter a expressão da proteína desejada.
10. Avaliação Funcional de Acutely isolada ou cultivadas SAMs
NOTA: O protocolo a seguir é um exemplo de avaliações funcionais de isolado SAMs usando a anfotericina técnica-patch perfurada para gravar ambos os APs espontâneos e I f a partir da mesma célula (ver referência 9).
- Preparar soluções de gravação como descrito na Tabela 3.
- Prepara-se uma solução estoque de 20 mg / mL de anfotericina-B em DMSO fresco no dia da gravação. Manter o estoque em temperatura ambiente e proteger da luz. Diluir da anfotericina-B em solução intracelular até uma concentração final de 200 ug / ml, imediatamente antes da utilização. Manter a solução da pipeta final sobre gelo e proteger da luz.
NOTA: A solução da pipeta contendo anfotericina para experiências deve ser preparado fresco por hora por diluição de uma aliquota da solução de reserva para dentro da solução intracelular e vórtex durante pelo menos 1 min. - Transferir uma alíquota da suspensão de células dissociadas de forma aguda SAM ou um fragmento de lamela de vidro tendo SAM cultivadas para uma câmara de registo contendo solução de Tyrode a 35 ± 1 ° C. Perfundir as células com solução de Tyrode durante pelo menos dois minutos antes da recordin electrofisiológicogs para remover qualquer remanescente de BDM residual meio de cultura.
NOTA: contrações espontâneas deve ser evidente imediatamente após a transferência para a solução de Tyrode. SAM para a gravação pode ser identificado por uma combinação de características, incluindo a actividade contráctil espontânea, a morfologia característica (por ex., Figura 2), a falta de estrias, a expressão da proteína HCN4, presença da corrente If, a capacitância de membrana <50 pF, e espontâneas APs com formas de onda que incluem uma fase de despolarização diastólica e um movimento ascendente lento. - Usando pipetas de vidro de borosilicato com resistências de 1,5-3,0 mohms, preencha a ponta com a solução intracelular falta em anfotericina por imersão para 10-30 seg. Em seguida, volta a encher a pipeta com a solução contendo anfotericina. Uma vedação ligado à célula GÊ deve ser obtido tão rapidamente quanto possível. Se a formação de vedação é difícil, aumentar o tempo de ponta de enchimento.
NOTA: A resistência do acesso deve ser continuamentemonitorizados após a formação do selo ligado à célula, e as gravações só deve ser iniciado após a obtenção de uma resistência acesso estável <10 mohms. - Para gravar APs espontâneos, desligue o amplificador para o modo corrente de engate rápido sem injecção de corrente.
NOTA: 1 nM isoproterenol está incluído na solução de Tyrode a extracelular durante a gravação de APs para estabilizar a taxa de disparo, tal como previamente relatado 10.
Resultados
Os protocolos descritos aqui foram anteriormente empregues para isolar SAM espontaneamente activa a partir de ratinhos adultos que são adequadas para uma variedade de diferentes estudos de patch braçadeira 5-8. Além disso, os protocolos para permitir SAM isoladas que podem ser mantidas em cultura durante até uma semana. A transferência de genes para as células em cultura pode ser realizada através de infecção adenoviral 9. Os resultados apresentados nesta secção derivam do nosso trabalho anterior e são aqui apresentados como exemplos das características de SAM agudamente isolados e cultivados.
Como mostrado na Figura 2, SAM espontaneamente activa pode ser mantido em cultura durante até 6 dias. As células cultivadas reter uma morfologia global que é muito semelhante ao do isolado de forma aguda SAM, sem alterações significativas no comprimento médio, a largura, a área de secção transversal, ou capacitância de membrana cultivadascélulas em comparação com células agudamente isolados (Figura 2B - E). Não era no entanto de atrito do número de SAM viáveis ao longo do tempo na cultura. Portanto, recomenda-se que as culturas ser preparados a partir de células obtidos a partir de vários animais se o delineamento experimental requer extensas conjuntos de dados.
Um dos principais objectivos no desenvolvimento do protocolo para a cultura dos miócitos sinoatrial de ratinhos adultos foi o de criar um sistema que permita a expressão de proteínas exógenas no contexto celular nativo de adulto SAM. Um exemplo deste tipo de expressão da proteína é mostrada na Figura 3 para o caso das células co-infectadas com vírus que expressam as proteínas marcadoras fluorescentes GFP e mCherry. Descobrimos que a expressão da proteína foi claramente evidente ao fim de 24 horas de infecção adenoviral, e foi máxima para as proteínas de ensaio dentro de 48 horas (Figura 3). Uma MOI viral de 100 resultou em quase 100% infeficiência exão sem evidência de toxicidade celular. Em contraste, a transfecção utilizando reagentes baseados em lípidos não conseguiu produzir em qualquer transferência detectável do gene no adulto SAM, mesmo depois de 72 horas 9.
Caracterização funcional através de patch-clamp eletrofisiologia é fundamental para a avaliação de ambos agudamente isoladas e cultivadas SAMs. Figura 4A mostra gravações de corrente-clamp típicos de potenciais de ação espontâneos gravadas de forma aguda isolada ou cultivadas SAMs usando a configuração de gravação-patch perfurada anfotericina. Formas de onda do potencial de acção foram semelhantes em agudamente isolados e cultivados SAM e não houve diferença na taxa de disparo média AP (Figura 4B).
I f é uma característica da SAM e os canais HCN4 que produzem I f são utilizados como marcadores imunocitoquímicos do nó sinoatrial. Daí a presence de I f nas gravações patch clamp pode ser usado para apoiar a ideia de que as células são, de facto SAMs. Todos os SAM agudas e cultivadas espontaneamente activos aqui descritos também exibiu I f> 100 Pa, em resposta a uma tensão de 1 seg passo a -120 mV. Para os resultados representativos mostrados aqui, as células foram perfundidos com solução de Tyrode contendo 1 mM de BaCl 2 para bloquear correntes de K + (Tabela 3) e a dependência da voltagem da activação de f I foi ensaiada por 3 segundos degraus de tensão hiperpolarizantes de -60 a -160 mV a partir de um potencial de realização de -50 mV, como já descrito anteriormente 5-8. A densidade de corrente foi avaliada em resposta aos impulsos de teste 3 sec hiperpolarizante a -150 mV a partir de um potencial de manutenção de -50 mV. Não houve diferenças significativas quer na tensão de dependência da activação de f I ou a densidade de corrente I f entre agudamente isolados e cultivados MCS (Figura 4C - D). Estes co-gravações de APs espontâneos e I f de Sams individuais requerem cerca de 9 minutos, no total (incluindo uma lavagem inicial de 2 min, 30-60 seg de APs espontâneos em modo de grampo actual, uma mudança de solução de 2 min, e cerca de 5 min a recolher dados de fixador de tensão suficientes para descrever a dependência da tensão de activação do f I). Assim, os dados mostrados na Figura 4C ilustram também a robustez da preparação celular.

Figura 1: instrumentos de dissecção para o isolamento e dissociação do rato SAMs (A) i Dois 10 centímetros placas de Petri contendo ~ 25 ml curadas de elastômero de silicone... Cada prato é pré-carregado com 6-10 pequenos pinos de dissecação para imobilizar o tecido. Ii. 100 ml copo para a realização completa Tyrode do no 35 &# 176;... Banho de água C iii Wide (~ 2 mm de diâmetro), dissociação pipeta-fogo polido iv Narrow (~ 1,5 mm de diâmetro) polido-fogo transferência pipeta v pipeta de transferência de plástico para a preparação de banho com Tyrode do Completo com... heparina. vi. forceps Belas-Auto abrir micro tesouras para procedimentos de corte internas. vii. (tamanho da ponta 0,06 x 0,02 mm) para a manipulação de tecido interno. viii. pinça, 5.5 in, 1 x 2 dentes para manipulação do tecido externo. ix. curvos íris tesouras 4,3 por procedimentos de corte externas. (B) Foto do Close-up com destaque para pequenos pinos de dissecação colocados no prato de dissecação. (C) Foto do Close-up destacando pipeta de transferência estreita polido-fogo (à esquerda) e fogo-polido pipeta de boca larga para trituração mecânica (à direita). Por favor clique aqui para ver uma versio maiorn desta figura.
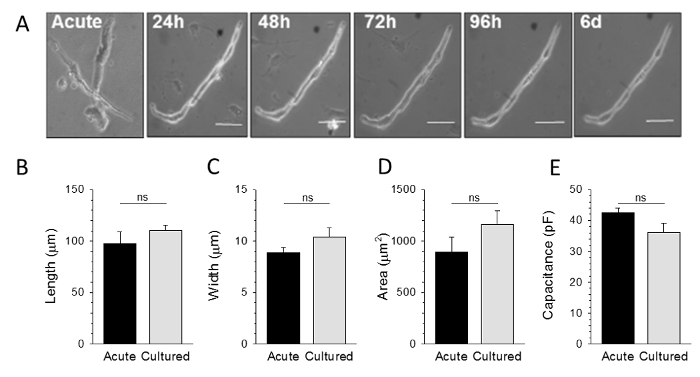
. Figura 2: Acutely isolado e SAMs cultivadas são morfologicamente indistinguíveis A:. Imagens de campo claro de SAMs representante ou imediatamente após o isolamento (aguda) ou depois de 24 h, 48 h, 72 h, 96 h, ou 6 dias in vitro B - D : média (± SEM) comprimento máximo, largura e área transversal de forma aguda isolada contra 48 hr cultivadas SAMs e:. média (± SEM) capacitância de membrana a partir de gravações de tensão-clamp de forma aguda isolada ou cultivadas SAMs. Todas as comparações não são significativas: p> 0,05 vs. aguda. Adaptado da referência 9. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: expressão adenoviral de proteínas exógenas em cultura SAMs Campo brilhante e imagens de epifluorescência do representante SAMs cultivadas que foram infectadas a uma MOI de 100 para adenovírus expressando eGFP (verde) e mCherry (vermelho), quer em 24 ou 48 horas depois. dupla infecção. Barra de escala = 20 mm. Reproduzido de referência 9.
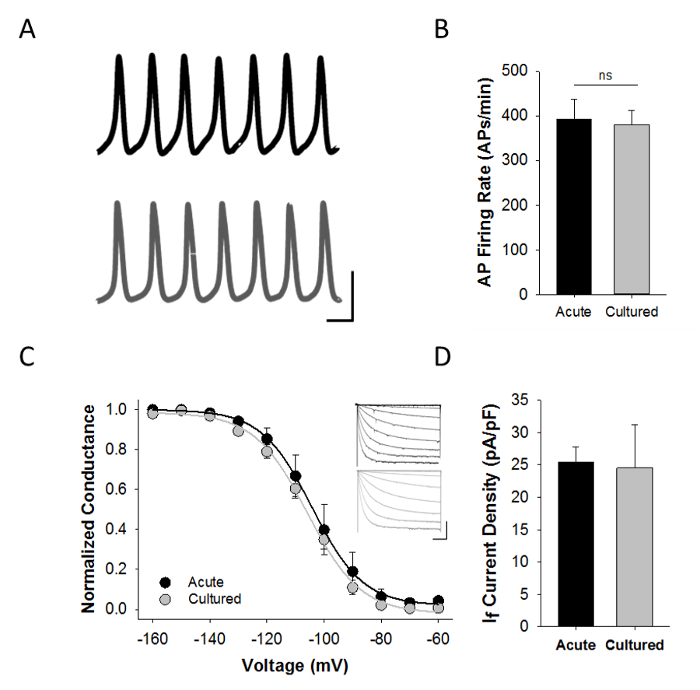
Figura 4: Caracterização eletrofisiológica da cultura SAMs A:. Gravações pinça de corrente representativos de agudamente isolado (preto) ou cultivadas (cinza) SAMs em solução de Tyrode contendo 1 nM isoproterenol. Barras de escala: 40 mV, 100 ms. B: Média (± SEM) instantâneadisparando frequência na forma aguda isolado (preto; n = 6) ou 48 horas de cultura (cinza; n = 14) SAMs C:. média Normalizada (± SEM) relações condutância tensão para I f no agudamente isolado (preto; n = 8) ou cultivadas (cinza; n = 14) SAMs Insets:.. famílias atuais representativos de aguda (preto) ou SAMs cultivadas (cinzento) provocada por 3 seg impulsos de teste hiperpolarizantes de -60 a -160 mV em incrementos de 10 mV D: Average ( ± SEM) I densidade de corrente f a -150 mV em intensamente isolado (preto; n = 7) e cultivadas (cinza; n = 8) SAMs. Adaptado da referência 9. Por favor clique aqui para ver uma versão maior desta figura.
| completa Tyrode de | baixo Ca 2+ / Mg 2+ Tyrode de | KB Médio | BSA Solution | NaCl / CaCl 2 Solução Adaptação | |
| NaCl | 140 | 140 | 140 | 10 | |
| KCl | 5.4 | 5.4 | 25 | 5.4 | |
| KH 2 PO 4 | 1.2 | 1.2 | 10 | 1.2 | |
| HEPES | 5 | 5 | 5 | 5 | |
| glicose | 5.55 | 18,5 | 20 | 5.55 | |
| MgCl2 | 1 | 1 | |||
| CaCl2 | 1.8 | 0,066 | 1.8 | 1.8 | |
| taurina | 50 | 20 | |||
| BSA | 1 mg / ml | 1 mg / ml | 1 mg / ml | ||
| K-glutamato | 100 | ||||
| K-aspartato | 10 | ||||
| MgSO4 | 2 | ||||
| creatina | 5 | ||||
| EGTA | 0,5 | ||||
| pH ajustado a | 7,4 com NaOH | 6,9 com NaOH | 7,2 com KOH | 7,4 com NaOH |
Tabela 1:. As composições de soluções de dissociação soluções utilizadas na dissociação dos miócitos do nó sinoatrial. As concentrações são dadas em mm, excepto onde indicado.
| chapeamento Médio | Cultura médium | |
| Media199 | base | base |
| monoxima de 2,3-butanodiona (BDM) | 10 mM | 10 mM |
| Soro Fetal de Bovino (FBS) | 5% | - |
| Albumina de Soro Bovino (BSA) | 0,1 mg / mL | |
| Insulina | 10 ug / ml | |
| transferrina | 5,5? G / ml | |
| Selênio | 5 ng / ml | |
| Penicilina | 100 U / mL | 100 U / mL |
| Estreptomicina | 100 mg / mL | 100 mg / mL |
Tabela 2: chapeamento e cultura soluções composições de soluções utilizadas para revestimento e cultura de miócitos nó sinusal..
| Tyrode de | PP intracelular | |
| NaCl | 140 | 5 |
| KCl | 5.4 | 135 |
| KH 2 PO 4 | 1.2 | |
| HEPES | 5 | 10 |
| glicose | 5.55 | |
| MgCl2 | 1 | 1 |
| CaCl2 | 1.8 | 0,1 |
| EGTA | 10 | |
| Mg-ATP | 4 | |
| A anfotericina-B | 200 ug / ml conforme necessário | |
| isoproterenol | 1 nM, conforme necessário | |
| pH ajustado a | 7,4 com NaOH | 7,2 com KOH |
Tabela 3: soluções de gravação de Eletrofisiologia Composições de extracelular soluções (de Tyrode) e intracelular (PP) utilizados para anfotericina gravações de patch perfurada de miócitos nó sinusal..
Discussão
Este artigo apresenta protocolos detalhados para o isolamento e cultura de totalmente diferenciadas miócitos nó sinusal de ratos adultos. O protocolo de isolamento produz de forma confiável SAMs rato espontaneamente activos adequados para qualquer análise eletrofisiológica imediato ou cultura subsequente. Protocolos semelhantes foram relatados por muitos outros grupos (por exemplo, ver referências 11,12,10,13-17). No entanto, o nosso protocolo para a manutenção do rato adulto in vitro SAM preserva a morfologia característica, a actividade espontânea, e propriedades electrofisiológicas das células e permite a entrega adenoviral de proteínas 9.
Para modificação e solução de problemas dos protocolos, a poucos passos críticos devem ser observados. O primeiro factor crítico é uma variabilidade significativa de lote para lote na actividade das enzimas digestivas (passo 1.4), que podem alterar dramaticamente o número e a qualidade de SAM isolado num dado preparção. Esta variabilidade é particularmente verdadeiro para a elastase, que tipicamente requer a optimização específica do lote, em que os tempos de concentração e de exposição deve ser de escalonamento ao longo de várias preparações (muitas vezes feito em paralelo) para maximizar o número de células e de saúde. Alguns protocolos para o isolamento de SAM a partir de várias espécies usar colagenase e protease enzimas individuais em vez da mistura de enzimas colagenase-protease no presente protocolo. No entanto, a variabilidade de lote para lote, para cada uma destas enzimas é bastante elevado (semelhante ao da elastase), necessitando de ciclos repetidos de co-optimização. A mistura de enzimas fornece mais consistência entre lotes e requer menos passos de otimização.
Uma segunda crítica, e não óbvia, fator para solucionar o isolamento SAM é a integridade da dissociação de vidro pipeta polido-fogo (Figura 1C). Se o aro da pipeta contém quaisquer arestas vivas, fissuras ou C acumuladaellular detritos, o passo de trituração mecânica pode danificar as células, resultando em toxicidade de cálcio. A pipeta dissociação fogo polido deve ser substituído pelo menos a cada 2 meses de uso regular, ou em qualquer momento que o rendimento das células ou a qualidade declina acentuadamente ao longo de várias preparações.
O momento ea força da dissociação mecânica é um terceiro passo crítico para a solução de problemas do protocolo de isolamento. A trituração exige lenta (cerca de 0,5-1 Hz), mas a turbulência forte para 5-10 min. taxas mais rápidas e tempos reduzidos pode também ser utilizado, mas é importante evitar a introdução de bolhas de espuma ou gerando na solução. Quando as amostras nó sinusal foram totalmente dissociados, as tiras de tecido restantes devem aparecer fino e de cor branca; sutil coloração rosa-ish indica trituração incompleto. Quando examinados no 200-400X ampliação, células de amostras preparadas de forma óptima têm membranas de células lisas, enquanto que memb célularanes de mais-digerida ou over-triturado amostras têm uma aparência de crateras e estriado. Em células saudáveis, as contracções são observados principalmente como espasmos subtil das extremidades das células. Ondas de contração são um sinal de células danificadas, que podem ser observados a contrair vigorosamente durante um curto período de tempo, antes de balling-up. Uma pipeta de dissociação rachado é a causa mais comum de tais danos celulares. Em amostras que foram sub-digerida ou sub-triturado, as células estão presentes como agregados ou aglomerados, em vez de células individuais, e um número significativo de contrair o SAM pode ser observado nas restantes pedaços de tecido.
Cada usuário terá que otimizar individualmente a dissociação. Embora a digestão enzimática e os tempos de dissociação mecânicas devem ser ajustados, é recomendável manter inicialmente o tempo de digestão enzimática constante ao modificar o tempo de dissociação. afinar adicional depende principalmente da capacidade do usuário para reconhecer a umppearance das peças de tecido remanescente no final de trituração - quando as peças são fino e de cor esbranquiçada, em seguida, a trituração deve ser interrompido. Optimization é também necessária para acomodar variações no nó sinusal que acompanham diferenças de idade, sexo ou linhagem de camundongos. Por exemplo, a dissociação de células de animais mais velhos 7 requer redução tanto da digestão enzimática e os tempos de dissociação mecânica. Como orientação geral, uma preparação típica de um 2-3 meses de idade rendimentos do sexo masculino C57BL / 6 do rato aproximadamente 50-200 SAMs viável, da qual talvez 5-10 pode ser sucesso em sessão um bom dia, dependendo das experiências apertado-patch . O rendimento é consideravelmente (~ 30%) inferior quando os ratinhos mais velhos são utilizadas 7.
O sucesso do protocolo de cultura também depende de alguns passos importantes. Acima de tudo, o sucesso de uma cultura primária de células requer uma dissociação de alta qualidade, tal como discutido acima. Recomenda-thna preparação de células agudamente isolado ser optimizado antes de tentar manter as células em cultura. Um segundo factor crítico para a cultura de células situa-se na selecção de células para registos electrofisiolicos. Para melhores resultados, SAM em cultura seleccionadas para gravações deve apresentar contracções espontâneas imediatamente após a lavagem do meio de cultura contendo BDM. Um início lento de contrações espontâneas sobre wash-out de BDM é um sinal de células saudáveis.
O sistema de cultura SAM tem algumas limitações, principalmente o tamanho muito pequeno do mouse SAN. Embora os métodos demonstrados aqui permitem números de células suficientes para estudos electrofisiológicos e de imagem, a quantidade limitada de tecido opõe-se análises bioquímicas de SAM cultivadas. Outra limitação da técnica é que SAM deve ser cultivado na presença do inibidor da ATPase miosina reversível, BDM. Esta é uma preocupação potencial porque BDM tem outros efeitos celulares, incluindonão específico a actividade de fosfatase, a inibição da transcrição cardíaca factores 19, e inibição dos canais de sódio, canais de cálcio e receptores de rianodina 20. No entanto, os dados mostram que BDM tem efeitos mínimos sobre as propriedades morfológicas e electrofisiológicas de SAM ensaiadas aqui.
Em futuras aplicações, parece provável que os métodos aqui descritos podem ser adaptados para preparar SAM culturas de mamíferos de maiores dimensões. Em combinação com a transferência de genes adenovirais, tais culturas pode permitir a manipulações genéticas de pacemaking em modelos animais de grande porte. A capacidade de introduzir as proteínas de interesse também fornece para futuras aplicações em que as moléculas repórter geneticamente codificados podem ser utilizados para sondar as vias de sinalização intracelulares em SAM.
Divulgações
None.
Agradecimentos
We thank Dr. Christian Rickert for critical reading of the manuscript. This work was supported by a grant from the National Heart Lung and Blood Institute (R01-HL088427) to CP. EJS was supported by 5T32-AG000279 from the National Institute on Aging. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Sylgruard/Elastomer Kit | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Borosilicate 9" pasteur pipettes | Fisher Scientific | 13-678-20C | |
| Small, round bottomed culture tubes | Fisher Scientific | 352059 | |
| Large, round bottomed culture tubes | Corning | 14-959-11B | |
| Elastase | Worthington Biochemical | LS002279 | |
| Liberase TM | Roche | 5401119001 | Tissue dissociation solution |
| Heparin | SAGENT Pharmaceuticals | NDC 25021-400-10 | |
| Mouse Laminin | Corning | CB-354232 | |
| 12 mm round glass coverslips | Fisher | 12-545-80 | |
| 24-well culture plate | Fisher | 08-772-1 | |
| Ad-mCherry | Vector Biolabs | 1767 | |
| Ad-eGFP | Vector Biolabs | 1060 | |
| Plastic, disposable transfer pipette | Fisher Scientific | ||
| Micro scissors | Fisher Scientific | 17-467-496 | |
| Dumont #4 Forceps | Roboz Instruments | RS-4904 | |
| Tissue Forceps | Roboz Instruments | RS-8164 | |
| Dissecting Iris Scissors | WPI, Inc. | 501264 | |
| Dissecting Pins | Fine Science Tools | 26002-20 | |
| NaCl | Sigma | 71376 | |
| KCl | Sigma | 60128 | |
| KH2PO4 | Sigma | 60353 | |
| HEPES | Sigma | 54457 | |
| glucose | Sigma | G0350500 | |
| MgCl2 | Sigma | M8266 | |
| CaCl2 | Sigma | C1016 | |
| taurine | Sigma | T0625 | |
| BSA | Sigma | A2153 | |
| K-glutamate | Sigma | G1501 | |
| K-aspartate | Sigma | A6558 | |
| MgSO4 | Sigma | M7506 | |
| creatine | Sigma | C0780 | |
| EGTA | Sigma | E3889 | |
| Mg-ATP | Sigma | A9187 | |
| Amphotericin-B | Fisher Scientific | 1397-89-3 | |
| Isoproterenol | Calbiochem | 420355 | |
| Media199 | Sigma | M4530 | |
| 2,3-butanedione monoxime (BDM) | Sigma | B0753 | |
| Fetal Bovine Serum (FBS) | Sigma | SH30071 | |
| Bovine Serum Albumin (BSA) | Sigma | A5611 | |
| Insulin | Sigma | I3146 | |
| Transferrin | Sigma | I3146 | |
| Selenium | Sigma | I3146 | |
| Penicillin | GE Healthcare | SV30010 | |
| Streptomycin | Hyclone | SV30010 |
Referências
- Irisawa, H., Noma, A. Pacemaker currents in mammalian nodal cells. J Mol Cell Cardiol. 16 (9), 777-781 (1984).
- DiFrancesco, D. Pacemaker mechanisms in cardiac tissue. Annu Rev Physiol. 55, 455-472 (1993).
- Mangoni, M., Nargeot, J. Genesis and regulation of the heart automaticity. Physiol Rev. 88 (3), 919-982 (2008).
- Lakatta, E. G., DiFrancesco, D. What keeps us ticking: a funny current, a calcium clock, or both. J Mol Cell Cardiol. 47 (2), 157-170 (2009).
- Liao, Z., Lockhead, D., Larson, E., Proenza, C. Phosphorylation and modulation of hyperpolarization-activated HCN4 channels by protein kinase A in the mouse sinoatrial node. J Gen Physiol. 136 (3), 247-258 (2010).
- Liao, Z., St Clair, J. R., Larson, E. D., Proenza, C. Myristoylated peptides potentiate the funny current (I(f)) in sinoatrial myocytes. Channels. 5 (2), 115-119 (2011).
- Larson, E. D., Clair, J. R. S., Sumner, W. A., Bannister, R. A., Proenza, C. Depressed pacemaker activity of sinoatrial node myocytes contributes to the age-dependent decline in maximum heart rate. Proc Nat Acad Sci. 110 (44), 18011-18016 (2013).
- St. Clair, J. R., Liao, Z., Larson, E. D., Proenza, C. PKA-independent activation of I(f) by cAMP in mouse sinoatrial myocytes. Channels. 7 (4), 318-321 (2013).
- St. Clair, J. R., Sharpe, E. J., Proenza, C. Culture and adenoviral infection of sinoatrial node myocytes from adult mice. Am J Physiol Heart Circ Physiol. , (2015).
- Clark, R. B., Mangoni, M. E., Lueger, A., Couette, B., Nargeot, J., Giles, W. R. A rapidly activating delayed rectifier K+ current regulates pacemaker activity in adult mouse sinoatrial node cells. Am J Physiol Heart Circ Physiol. 286 (5), H1757-H1766 (2004).
- Mangoni, M., Nargeot, J. Properties of the hyperpolarization-activated current (I(f)) in isolated mouse sino-atrial cells. Cardiovasc Res. 52 (1), 51-64 (2001).
- Cho, H. S., Takano, M., Noma, A. The electrophysiological properties of spontaneously beating pacemaker cells isolated from mouse sinoatrial node. J Physiol. 550 (Pt 1), 169-180 (2003).
- Rose, R. A., Lomax, A. E., Kondo, C. S., Anand-Srivastava, M. B., Giles, W. R. Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node: a role for the NPR-C receptor. Am J Physiol Heart Circ Physiol. 286 (5), H1970-H1977 (2004).
- Rose, R. A., Kabir, M. G., Backx, P. H. Altered Heart Rate and Sinoatrial Node Function in Mice Lacking the cAMP Regulator Phosphoinositide 3-Kinase-\gamma\. Circ Res. 101 (12), 1274-1282 (2007).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PloS ONE. 7 (10), e47652(2012).
- Groenke, S., Larson, E. D., et al. Complete atrial-specific knockout of sodium-calcium exchange eliminates sinoatrial node pacemaker activity. PloS ONE. 8 (11), e81633(2013).
- Torrente, A. G., Zhang, R., et al. Burst pacemaker activity of the sinoatrial node in sodium-calcium exchanger knockout mice. Proc Nat Acad Sci USA. 112 (31), 9769-9774 (2015).
- Denyer, J. C., Brown, H. F. Rabbit sino-atrial node cells: isolation and electrophysiological properties. J Physiol. 428 (1), 405-424 (1990).
- Thum, T., Borlak, J. Butanedione monoxime increases the viability and yield of adult cardiomyocytes in primary cultures. Cardiovasc Toxicol. 1 (1), 61-72 (2001).
- Borlak, J., Zwadlo, C. The myosin ATPase inhibitor 2,3-butanedione monoxime dictates transcriptional activation of ion channels and Ca(2+)-handling proteins. Molec Pharmacol. 66 (3), 708-717 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados