Method Article
Идентификация киназы-подложки пар Использование высокопроизводительного скрининга
В этой статье
Резюме
Protein phosphorylation is a central feature of how cells interpret and respond to information in their extracellular milieu. Here, we present a high throughput screening protocol using kinases purified from mammalian cells to rapidly identify kinases that phosphorylate a substrate(s) of interest.
Аннотация
Мы разработали платформу скрининга для выявления специальные протеинкиназы человека для фосфорилированных субстратов, которые могут быть использованы для выяснения новых путей передачи сигнала. Наш подход имеет применение библиотеки очищенных GST-меченый человека протеинкиназ и рекомбинантного белкового субстрата, представляющего интерес. Мы использовали эту технологию, чтобы идентифицировать MAP / микротрубочек сродства регулирования киназы 2 (Mark2), как киназы для глюкозы регулируется сайта на CREB-застройку транскрипционных коактиватора 2 (crtc2), белок, необходимый для пролиферации бета-клеток, а также Эксл семейство тирозинкиназ в качестве регуляторов клеточного метастазов по фосфорилирования белка адаптера ELMO. Мы описываем эту технологию и обсудить, как он может помочь создать комплексную карту, как клетки реагируют на стимулы окружающей среды.
Введение
Белковые посттрансляционных модификаций (PTMs) имеют важное значение для внутриклеточного связи. Возможно, лучше всего изучен всего PTMs является фосфорилирование, катализируемое протеинкиназ, которые регулируют множество белковых функций, в том числе их биохимической активности, субклеточном локализации, конформации и стабильности. Идентификация сайтов фосфорилирования на целевых белков может быть достигнуто путем трипсином отображения фосфопептидного либо теперь стандартными методами с использованием протеомическим образцы обогащенные для фосфорилированных пептидов 1,2. В то время как три четверти выраженной протеома, как ожидается, будет фосфорилируется 3 и определены сайты фосфорилирования 200000 5, с оценками до 1 млн 6, многие из них не имеют назначенного биологию, путь, или протеинкиназы сигнализации.
В то время как идентификация фосфорилированными сайтов является относительно простым, сравнительно больше, задача состоит вопределить родственный киназы (ы), что цели эти сайты, процесс мы называем отображения киназы: пар подложки. Существует несколько подходов для определения киназы: пары подложек были описаны, либо начиная с киназы интереса и ищет ее субстратами или начиная с подложкой интереса и пытается найти модифицирующий киназу экспериментально 7-11 или вычислительно 12. Чтобы определить киназы для известного фосфорилированного субстрата, биоинформатики могут быть использованы для идентификации белков, которые содержат короткий консервативную последовательность аминокислот, фланкирующих фосфорилированный остаток (консенсус-сайта), а также определение киназы, которые образуют осаждаемой комплекс с подложкой. Тем не менее, эти подходы требуют много времени и часто не увенчались успехом.
Мы разработали системный функциональный подход быстро определить киназы, которые могут фосфорилировать данную подложку 13. Экран анализа производит отличную специфику, с очень ясным отбора потенциальных родственных киназ ность. Учитывая центральное фосфорилирования биологического сигнализации, экран полезен для открытия практически во всех клеточных сигнальных путей 14-16. Экран включает в себя проведение крупномасштабной киназы с библиотекой протеинкиназ человека. Киназы были помечены бактериальной глутатион S-трансферазы (GST) белка и очищают от млекопитающих клеточных экстрактов, что означает, что рекомбинантные ферменты - в отличие от тех, полученного из бактерий - генерируются в присутствии вверх по течению протеинкиназ часто требуемых для рекомбинантных ферментов обладают активностью в пробирке. Действительно, в то время как серин, треонин и тирозин киназы для активации нижнего киназы присутствуют в дрожжах 10, геном дрожжей кодирует 122 протеинкиназы, указывая, что kinome млекопитающих, более 500 генов 17, стало значительно сложнее, чтобы Регулат.е процессы, уникальные для более высокого порядка организмов. Кроме того, влияние различных стимулов, имеющих отношение к клеточной биологии и болезни человека (например, небольших молекул, факторов роста, гормонов и т.д.) могут быть использованы для модулирования 14,15 киназной активности в соответствующем контексте.
протокол
1. Подготовка реактивов, тарелки, и клеток
- Сделать 500 мл буфера для лизиса: 25 мМ Трис рН 7,5, 150 мМ NaCl, 50 мМ NaF, 0,5 мМ ЭДТА, рН 8,0, 0,5% Тритон Х-100, 5 мМ бета-глицерофосфат, 5% глицерина. Хранить при 4 ° С. Непосредственно перед применением, добавьте 1 мМ дитиотреитола (DTT), 1 мМ фенилметил сульфонильную (ФМСФ), и 1 мМ ванадата натрия. После этого шага, ФМСФ не требуется в любом полоскания буфера.
- Сделать 20 мл 10х киназного буфера: 200 мМ Трис рН 7,5, 50 мМ бета-глицерофосфат (FW 216), 2 мМ ванадата натрия. Аликвоты по 1 мл пробирок и хранят при -20 ° С. Непосредственно перед использованием добавляют 5 мМ DTT.
- Сделать 20 мл 10х буфера М-АТФ: 300 мкМ аденозинтрифосфата (АТФ), 66 мМ MgCl 2, 33 мМ MnCl 2. Аликвоты в 1 мл пробирки и хранят при -20 ° С.
- Сделать 100 мл 2x додецилсульфата натрия (SDS) буфера для лизиса: 1,5 г Трис база, 20 мл глицерина, 30 мл Н 2 О. Растворить и довести рН до 6,8 с помощью HCl. Добавить 40мл 10% SDS, регулировки громкости до 100 мл. Добавить 25 мг бромфенолового синий.
- Пятно 4 мкл 25 нг / мкл плазмиды млекопитающих, кодирующие экспрессии в GST-киназы 14 на лунку в наборы 96-луночных планшетах и планшетах этикеток соответственно. Печать и замораживание пластины при температуре -20 ° С до использования.
- 1-2 дней до трансфекции культуры клетки HEK293T в модификации Дульбекко среде Игла полном (DMEM) + 10% фетальной бычьей сыворотки (FBS) и антибиотики в 37 ° C инкубаторе с добавлением CO 2 (конечная 5%). Прохождение трипсином и не позволяют фондовый стать> 80% сливающиеся в процессе расширения. Минимум 6 х 10 7 клеток необходимы для экрана (примерно 3 х 15 см блюда HEK293T клеток в 80% слияния).
2. Трансфекция
Примечание: На рисунке 1 блок-схемы всего протокола.
- Если пластины, содержащие плазмиды киназы были заморожены, оттепель при комнатной температурей центрифуге при 1900 мкг в течение 3 мин, чтобы собрать любую влагу на дне лунки.
- Смешайте 8,6 мл среды сывороточного пониженном (например, OPTI-MEM) с 312,7 мкл липидного основе реагента для трансфекции. Пусть сидят в течение 5 мин.
- Добавьте 10 мкл восстановленного среде сыворотки в каждую лунку с использованием автоматического дозатора жидкости, снабженного малого объема кассеты.
- Добавьте 10 мкл на лунку восстановленного сыворотки среды / трансфекции смеси реагентов со стадии 2.2 с использованием автоматического дозатора жидкости, снабженного малого объема кассеты. Дайте настояться в течение 20 до 45 мин.
- Ресуспендируют клетки 293Т 7,5 х 10 5 клеток / мл в 80 мл полной среды DMEM. Добавить 100 мкл клеточной суспензии (т.е. 7,5 х 10 4 клеток на лунку) с использованием автоматизированной дозатора жидкости, снабженного стандартной громкости кассеты.
- Проверка под микроскопом скважин для равномерного распределения клеток и вернуться к инкубаторе в течение 24 часов.
3. GST-киназы Понижения
- Сделайте преш: 4 мм pervanadate решение путем смешивания 60 мкл 0,2 М ванадатом натрия с 540 мкл H 2 O. Во втором смеси трубки 2,7 мкл 30% перекиси и 1,4 мл PBS. Добавить два решения вместе, и пусть сидят в течение 15 мин перед использованием.
- Использование многоканальной пипетки (не использовать автоматизированную дозатора жидкости, так как создает слишком много турбулентности в скважине) обойтись 2 мкл 0,25 М CaCl 2 в каждую лунку, после чего 2,5 мкл pervanadate, полученного на стадии 3.1. Инкубируют каждый планшет при 37 ° С в течение 10 мин, а затем поместить на льду.
- Подготовьте 35 мл буфера для лизиса, добавив DTT, ФМСФ и ванадат натрия, как указано в разделе 1 (Приготовление реагентов).
- Поддержание пластины на льду, удалить носитель из каждой лунки с помощью вакуумного аспиратора. Сразу добавить 50 мкл / лунку ледяной буфер лизиса с использованием автоматизированной дозатора жидкости, снабженного стандартной кассете. Пусть сидят 30 мин на льду лизировать (опционально: может останавливаться, если необходимо, уплотнения Platэлектронной и хранения при -80 ° С. Чтобы продолжить, оттепель пластины на льду).
- Побочные пластины в 1900 мкг в течение 3 мин при 4 ° С.
- Очистите клетки из каждой лунки с помощью многоканальной пипетки и передать все содержание надлежащим образом помечены пластины V-дно 96 также. Спин пластины при 1900 х г в течение 10 мин при 4 ° С.
- Во время спина, заполните глутатиона покрытием пластин (по одному для каждого 96-луночного планшета) с 100 мкл / лунку ледяной буфера для лизиса (без PMSF) в качестве полоскания. Хранить пластины на льду.
- Удалить пластины V-дно из центрифуги. По одному, инвертировать глутатиона пластины над раковиной, чтобы вытряхнуть буфер лизиса и пятном на бумажное полотенце. Передача буфера для лизиса с пластин V-нижней части, чтобы глутатион пластин, наклоняя пластину и с помощью многоканальной пипетки, следя, чтобы не мешать осадок на дне. Торцевые пластины и оставить на льду в течение 2 ч минимального связывать.
- Ближе к концу стадии связывания 2 ч, подготовить станцию радиоактивности, обеспечивая тон необходимые меры безопасности на месте для радиоактивных работы. Установите гибридизации духовку до 30 ° C.
- Подготовьте 200 мл буфера для лизиса, добавив DTT и натрия ванадатом, как указано в разделе 1. PMSF не требуется на данном этапе.
- Обратить глутатиона пластины над раковиной, чтобы вытряхнуть буфер лизиса и промокните на бумажном полотенце. Промыть лунки 3 раза с 100 мкл буфера для лизиса (без PMSF). Не позволяйте скважин сидеть сухой - не держать их в полоскании до готовности, чтобы продолжить.
- Подготовка 55 мл 1x киназного буфера (KB) путем разбавления 10x запас и добавление ДТТ, как указано в разделе 1. Промыть пластины один раз с помощью 50 мкл 1х КБ с использованием автоматического дозатора жидкости, снабженного стандартной объемной кассеты. Оставить 1x КБ в скважинах до раствор А не готова:
- Приготовьте раствор А, добавив 500 до 530 мкг субстрата интерес, 500 мкг основного белка миелина (ОБМ), 2,65 мл 10х KB, 13,25 мкл 1 М DTT, и H 2 O до 15,9 мл.
- По одному, инвертировать пластин над раковиной, чтобы удалить 1x KB полоскание, пятно на бумажное полотенце и сразу же добавить 30 мкл раствора А с использованием автоматического дозатора жидкости, снабженного малого объема кассеты. Хранить пластины на льду.
- Приготовьте раствор B в области радиоактивности работы, добавляя 2,5 мл 10x M-АТФ, 500 мкКи гамма 32 P АТФ, и H 2 O в 10 мл.
- Добавьте 20 мкл раствора В в каждую лунку с помощью пипетки ретранслятора, который помогает в смешивании из-за выброса силы. Накройте и инкубируйте в 30 ° C гибридизации печи в течение 30 мин.
- Через 30 мин, трансфер пластины обратно в лед. Добавить 50 мкл 2x буфера для лизиса SDS в каждую лунку с помощью многоканальной пипетки. Могут протекать при этой точке к следующему шагу, или не запечатать пластины с алюминиевой фольгой и хранят при -20 ° С до удобно.
4. Выполнение, окрашивание и сушка Гели
Примечание: Все работы должны быть выполнены в области DESIGNAТед радиоактивности.
- Включите гибридизации печи и установлен на 85 ° С. Оттаивания пластины при комнатной температуре. После того, как печь достигла температуры, передачи пластин печи и инкубировать в течение 10 мин для денатурации образцов.
- Нагрузка 26-а гели предварительно литые с 15 мкл каждого реакции с использованием многоканальной пипетки, чтобы заполнить несколько скважин сразу. Уход должны быть приняты, что все советы выравнивания с соответствующими перед добавлением образцов. Запустите гель при 150 В. Не позволяйте отслеживания краситель (синяя линия) бежать в нижней части геля, поскольку это содержит неинкорпорированную АТФ.
- Демонтаж гели и отрезать неинкорпорированную АТФ (синяя линия), используя скальпель или прямой край, как это будет передержать фильмы. Поместите гели маркированных контейнерах и накрыть Coomassie пятно в течение 15 мин.
- Удалить пятно Кумасси, кратко промыть водой гели с, и добавить destain решение. Destain гелей, пока белки не четко видны. Полоса для MBP и группа для подложки должныбудет видно для каждого образца.
- Чтобы высушить гели:
- Вырезать большой лист фильтровальной бумаги и поместите его на стол.
- Смочите лист целлофана в дистиллированной воде, пока она не является гладкой и морщины бесплатно, и поместите его в верхней части листа.
- Положите гели сверху целлофановую листа, принятия к сведению порядка гелей. Смочите второй целлофановой лист и поместите на вершине гелей.
- Раскатать все пузырьки (плита уплотнения ролика работает хорошо для этого) для хорошей однородной поверхностью. Закрыть крышку, включить вакууме и высушить гели в течение 3 ч при 80 ° С.
- После того, как гели сухой, не подвергайте их XAR фильма с помощью экрана, чтобы активизировать сигнал. Оберните кассету с пленкой или Саран полиэтиленовый пакет и запечатать лентой, чтобы не пустить мороз. Хранить кассету при -80 ° С в течение ночи.
5. Разработка Xar Фильмы
- На следующий день, удалить кассету из морозильника и пусть оттепель при комнатной температуре. Разработка пленку вфотолаборатории с использованием процессора пленки в соответствии с инструкциями изготовителя.
Примечание: Изучите фильмы для доказательства пар киназы-подложки. Второй больше экспозиции также может быть полезно для выявления слабых события фосфорилирования.
Результаты
Типичные результаты экране показаны на рисунке 2. 180 киназы, подвергали скринингу с использованием GST-меченый субстрат, соответствующий пептид АА 268-283 из crtc2 а также классический киназы субстрат основного белка миелина (МВР). Только два киназы, MARK2 и высоко связанные киназы фосфорилируется с Mark3 CRTC2 пептид. МВР входит в качестве внутреннего контроля во всех анализах, так как он содержит множество остатков phosphorylatable и работает на 18 кДа, в нижней части геля. Это позволяет для интерпретации специфики: некоторые киназы будет решительно фосфорилировать подложку и MBP. Следует отметить здесь то, что лунки, содержащие в одиночку GST (т.е. отсутствии контроля киназы) всегда очистить некоторые эндогенные активности киназы, таким образом, всегда есть фон фосфорилирования в анализе. Хотя это не исключает, что фосфорилирование субстрата реально, это предположить, что в в пробирке установки киназы может быть менее избирательным.Это особенно информативно включать в себя несколько подложек различной МВт сделать выводы относительно киназы-субстратной специфичности.
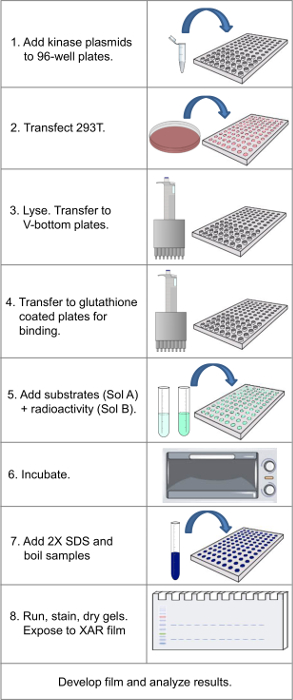
Рисунок 1. Блок-схема, показывающая основные этапы в протоколе. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2. Пример результатов экраном. Авторадиограмм из экрана Версия 1 (180 библиотеки человека протеинкиназ) осуществляется с помощью GST-пептидный субстрат, соответствующий аа 268-283 мышиного crtc2 (воспроизводится из Янссон и др., 2008). МВР, основной белок миелина указано. Высокая степень Substrate выбор связанными киназ является особенностью экрана. Каждая дорожка представляет продукты реакции из отдельной киназы. Mark3 (гель 1) и MARK2 (гель 16), только киназы фосфорилируют TORC2 268-283 пептид, указаны. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
С оригинальных публикаций, описывающих подход 14,15, оригинальная библиотека 180 GST-киназы был расширен до 420 членов, или ~ 80% от kinome белка человека. С расширенной библиотеки, протокол, как описано занимает 4-5 дней, а затем 1-4 дней, чтобы развивать фильмы (по мере необходимости), которая может быть сокращен за счет использования phosphorimaging и цифровых технологий сигнала. Есть несколько ключевых шагов, где должны быть учтены (рисунок 1 для обзора протокола). Во-первых, это здоровье запаса клеток (микоплазмы свободно, не позволило достичь слияния в процессе расширения, и обрабатывают трипсином в каждом проходе) на этапе периодического расширения и в луночных планшетах 96 в момент трансфекции. Клетки должны быть посеяны равномерно, и 80% сливной когда трансфекции происходит (этап 1.5).
Во-вторых, она идеально подходит во время трансфекции использовать автоматизированную дозатора жидкости, чтобы минимизировать объем Transfошибки ER, тем самым ограничивая коэффициент вариаций ("CVS") между скважинами. Для небольших объемов, Место дозатор с меньшим объемом потери пределы кассетные реагента из-за снижения объемов мертвых и увеличивается точность дозирования. Стадия обработки с pervanadate натрия, пан ингибитора тирозинфосфатазы, используется в качестве общего стимулом для увеличения статус фосфорилирования целевых киназ. Включение кальция на этом этапе возрастает клеток матрицы адгезию, предотвращая потерю клеток из-за округления, вызванное длительной обработке pervanadate. Этот шаг должен быть сделано в строгом соответствии с 10 минутной инкубации.
В-третьих, для самой киназы, Есть несколько соображений при выборе рекомбинантный субстрат: пептиды, белковые домены, или интактные белки такого размера, как 120 кДа могут быть использованы. Если конкретный сайт фосфорилирования известно, пептидный субстрат является наиболее прямо вперед подход, но должно быть достаточно большим, чтобы обнаружитьна SDS-PAGE геле. Таким образом, пептидных субстратов могут быть слиты с GST и очищали от бактерий, чтобы дать МВт> 25. Большие белки имеют то преимущество, что они, вероятно, сложенную и их phosphorylatable остатки подвергаются как они будут в клетке, пока идет с недостатком, что они будут включать дополнительные остатки, которые могут быть фосфорилируется и дают сигнал в анализе. Мы предпочитаем, чтобы запустить экран с помощью пептидного субстрата, состоящего из 15-20 аминокислот, окружающих остаток, который, как известно, фосфорилируется в естественных условиях и, как известно, регулируют биологическую событие, так как это делает проверку кандидата киназ с экрана и в пробирке и в естественных условиях гораздо быстрее.
Последнее, в идеале количество белка подходов или превышает 1 мкг на лунку; Это, конечно, меняется в зависимости от МВт подложки. Меньше белка на лунку может дать значимые хиты, но «больше, тем лучше" правило применяется, поскольку это увеличивает сигнал: НойSE. Стандартный, без градиент гели рекомендуются как градиентные гели трещины слишком часто во время сушки. После сушки гелей, обнаружение радиоактивного сигнала на фоне с счетчика Гейгера дает прекрасную индикацию успеха анализа.
Как экран в пробирке и дополнительные уровни сложности существуют в естественных условиях, кандидатом киназы (ы) для данной подложки должны быть проверены в клетках. В частности, экран может идентифицировать члена семьи, который имеет биохимическую способность фосфорилировать подложки в пробирке, пока не экспрессируется в клетках того же типа или в том же отсеке субклеточном в качестве субстрата. Например, в то время как MARK2 и Mark3 оба были удары при скрининге киназы, которые могут фосфорилирования crtc2 на Ser275, только MARK2 образуется комплекс с подложкой в клетках 14. Ниже приводится ряд дополнительных экспериментов, которые могут быть использованы для подтверждения физиологическое значение-кандидат киназы. Ельул, мобильность сдвиги подложки на SDS-PAGE следующие соэкспрессии кандидата киназы может быть использован в качестве управления подтверждением. Соответствующие управления, такие котрансфекции каталитически неактивной в киназы может подтвердить специфичность. Во-вторых, подложка может быть иммунопреципитации из клеточных экстрактов, которые были инкубированных с 32 Р-ортофосфата, чтобы подтвердить включение фосфата в субстрат в присутствии дикого типа и не каталитически неактивным киназы. В-третьих, phosphospecific антитела могут быть получены против последовательности phosphoacceptor (если они известны), и используется для подтверждения увеличение субстратного фосфорилирования, когда киназы избыточно экспрессируется. Вторичный экран с помощью мутантного подложку, несущую без остатка phosphorylatable на целевой сайт могут подтвердить специфичность до генерации phosphoantibody, особенно важной управления с большим домена и полноразмерного белка субстратов. Фармакологические подходы к ингибирование ингибировать КэндиДата киназы также может быть использован, пока необходимо проявлять осторожность, как ингибирование родственных киназ является недооцененной реальностью. Последнее, RNAi-обеспечиваемого молчания кандидата киназы (ов) в клетках следовать, и Вестерн-блоттинга для контроля потери целевого места фосфорилирования с phosphospecific антитела могут быть выполнены.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана грантом NSERC 386634. Мы хотели бы поблагодарить членов Screaton Lab за полезные обсуждения.
Материалы
| Name | Company | Catalog Number | Comments |
| Lysis buffer | Made in house | See Protocol step 1.1 | |
| 10x kinase buffer | Made in house | See Protocol step 1.2 | |
| 10x M-ATP | Made in house | See Protocol step 1.3 | |
| Human kinase plasmids | Orfeome, Invitrogen, Origene | GST-tagged in house | |
| 96 well plates | Fisher Scientific | CS003595 | |
| 293T cells | ATCC | CRL-11268 | |
| DMEM | Fisher Scientific | SH3002201 | supplement with 100 U/ml penicillin, 100 μg/ml streptomycin, 10% fetal calf serum. |
| CO2 incubator | Sanyo | MCO-17AIC | |
| 15 cm cell culture dishes | Fisher Scientific | 877224 | |
| Reduced serum medium | Invitrogen | 22600-050 | |
| Lipid-based transfection reagent | Invitrogen | 11668-019 | |
| Automated liquid dispenser | Thermo Scientific | 5840300 | |
| Small cassette attachment | Thermo Scientific | 24073295 | |
| Standard cassette attachment | Thermo Scientific | 14072670 | |
| 4 mM pervanadate | Made in house | See Protocol step 3.1 | |
| 0.25 M CaCl2 | Made in house | ||
| Multichannel pipette (20-200 μl) | Labnet | p4812-200 | |
| Multichannel pipette (1-10 μl) | Thermo Scientific | 4661040 | |
| V-bottom 6-well plates | Evergreen Scientific | 290-8116-01V | |
| Glutathione coated 96-well plates | Fisher Scientific | PI-15240 | |
| Hybridization oven | Biostad | 350355 | |
| GST tagged substrate | Made in house | ||
| Myelin Basic Protein (MBP) | Sigma | M1891 | |
| Repeater pipette (1 ml) | Eppendorf | 22266209 | |
| 32P gamma-ATP | Perkin Elmer | BLU502Z500UC | |
| 2x SDS lysis buffer (100 ml) | Made in house | See Protocol step 1.4 | |
| 26-well precast TGX gels | BioRad | 567-1045 | gel percentage required is dependent on the molecular weight of the substrate of interest |
| Coomassie stain | Made in house | 0.1% Coomassie R250, 10% acetic acid, 40% methanol | |
| Coomassie destain | Made in house | 10% acetic acid, 20% methanol | |
| Labeled gel containers | Made in house | Used plastic lids from empty tip boxes, just big enough to contain one gel | |
| Whatman filter paper | Fisher Scientific | 57144 | |
| Cellophane sheets (2) | BioRad | 165-0963 | |
| Gel dryer | Labconco | 4330150 | |
| Double emulsion autoradiography film | VWR | IB1651454 | |
| Film cassette | Fisher Scientific | FBAC-1417 | |
| Intensifying screen | Fisher Scientific | FBIS-1417 | |
| Plate sealing rubber roller | Sigma | R1275 |
Ссылки
- Meisenhelder, J., Hunter, T., van der Geer, P. Phosphopeptide mapping and identification of phosphorylation sites. Curr Protoc Mol Biol. 18, Unit 18 19 (2001).
- Doll, S., Burlingame, A. L. Mass spectrometry-based detection and assignment of protein posttranslational modifications. ACS chem. 10, 63-71 (2015).
- Sharma, K., et al. Ultradeep human phosphoproteome reveals a distinct regulatory nature of Tyr and Ser/Thr-based signaling. Cell rep. 8, 1583-1594 (2014).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends Biochem Sci. 25, 596-601 (2000).
- Walsh, C. T. . Posttranslation Modification of Proteins: Expanding Nature's Inventory. , (2006).
- Boersema, P. J., et al. In-depth qualitative and quantitative profiling of tyrosine phosphorylation using a combination of phosphopeptide immunoaffinity purification and stable isotope dimethyl labeling. Mol Cell Proteomics. 9, 84-99 (2010).
- Hutti, J. E., et al. A rapid method for determining protein kinase phosphorylation specificity. Nat Methods. 1, 27-29 (2004).
- Johnson, S. A., Hunter, T. Kinomics: methods for deciphering the kinome. Nat Methods. 2, 17-25 (2005).
- Pawson, T., Nash, P. Assembly of cell regulatory systems through protein interaction domains. Science. 300, 445-452 (2003).
- Zhu, H., et al. Analysis of yeast protein kinases using protein chips. Nat Genet. 26, 283-289 (2000).
- Shah, K., Shokat, K. M. A chemical genetic approach for the identification of direct substrates of protein kinases. Methods Mol Biol. 233, 253-271 (2003).
- Zou, L., et al. PKIS: computational identification of protein kinases for experimentally discovered protein phosphorylation sites. BMC bioinform. 14, 247 (2013).
- Varjosalo, M., et al. Application of active and kinase-deficient kinome collection for identification of kinases regulating hedgehog signaling. Cell. 133, 537-548 (2008).
- Jansson, D., et al. Glucose controls CREB activity in islet cells via regulated phosphorylation of TORC2. Proc Natl Acad Sci U S A. 105, 10161-10166 (2008).
- Fu, A., Screaton, R. A. Using kinomics to delineate signaling pathways: control of CRTC2/TORC2 by the AMPK family. Cell Cycle. 7, 3823-3828 (2008).
- Abu-Thuraia, A., et al. Axl phosphorylates elmo scaffold proteins to promote rac activation and cell invasion. Mol Cell Biol. 35, 76-87 (2015).
- Manning, G., Whyte, D. B., Martinez, R., Hunter, T., Sudarsanam, S. The protein kinase complement of the human genome. Science. 298, 1912-1934 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены