Method Article
激酶底物对鉴定使用高通量筛选
摘要
Protein phosphorylation is a central feature of how cells interpret and respond to information in their extracellular milieu. Here, we present a high throughput screening protocol using kinases purified from mammalian cells to rapidly identify kinases that phosphorylate a substrate(s) of interest.
摘要
我们已经开发出一种筛选平台,以确定专用人蛋白激酶磷酸化的底物,可用于阐明新的信号转导途径。我们的方法的特征是使用纯化的GST标记的人蛋白激酶的文库和感兴趣的重组蛋白衬底。我们已经用这种技术来识别的MAP /微管亲合性 - 调节激酶2(MARK2)作为激酶的葡萄糖调节站点上CREB稳压转录辅激活2(CRTC2),所需的β细胞增殖的蛋白质,以及AXL家族酪氨酸激酶的作为细胞转移的磷酸化的衔接蛋白ELMO的调节剂。我们描述这种技术,并讨论如何帮助建立细胞对环境刺激如何应对一个全面的地图。
引言
蛋白质的翻译后修饰(翻译后修饰)是细胞内的通信是必不可少的。也许最好的研究了所有翻译后修饰是磷酸化,由蛋白激酶,从而调节的蛋白质的功能,包括它们的生化活性,亚细胞定位,构象和稳定性无数催化。关于靶蛋白磷酸化位点的鉴定可以通过胰蛋白酶磷酸肽映射或通过使用富含磷酸化肽1,2-样品现在标准蛋白质组技术来完成。而四分之三的表达蛋白质组预计被磷酸和3所识别200000磷酸化位点5,据估计高达1 亿 6,许多这些没有分配的生物学,信号传导途径,或蛋白激酶。
虽然识别磷酸化位点是相对简单的,相对更大的挑战是,鉴定同源激酶(s)表示,针对这些网站,我们称为映射激酶的方法:基片对。几种方法用于鉴定激酶:基板对已经描述,无论是在开始用感兴趣的激酶和寻找其底物或开始与感兴趣的基板,并试图找到改性激酶实验7-11或计算12。为了鉴定激酶为已知的磷酸化底物,生物信息学可以用来识别包含氨基酸侧翼磷酸化残基(共识位点),以及识别形成沉淀络合物与基板激酶短保守序列的蛋白质。然而,这些方法是耗时,经常不与成功。
我们开发了一个系统功能的方法来迅速查明激酶磷酸化可以在给定基片13。屏幕试验产生优良的比性,具有非常明确的选择潜在的同源激酶。鉴于磷酸化生物信号的中心地位,画面中几乎所有的细胞信号通路14-16用于发现有用的。屏幕包括与人蛋白激酶的文库进行大规模激酶测定。所述激酶已被标记为细菌谷胱甘肽-S-转移酶(GST)蛋白和从哺乳动物细胞提取物纯化的,这意味着该重组酶 - 不同于那些来自细菌制备 - 将在上游蛋白激酶经常所需的存在而产生重组酶具有体外活性。实际上,虽然所需的下游激酶活化丝氨酸,苏氨酸,和酪氨酸激酶活性是存在于酵母10中,酵母基因组编码122蛋白激酶,指示所述哺乳动物激酶组,有超过500个基因17,已成为显著更加复杂,以边条忒独特高阶生物体的过程。此外,相关的细胞生物学和人类疾病(如小分子,生长因子,激素, 等等)不同的刺激的效果可以用来14,15调节激酶活性在一个适当的范围内。
研究方案
1.准备试剂,板,和细胞
- 制成500 ml的裂解缓冲液:25毫摩尔Tris pH值7.5,150mM的氯化钠,50mM的氟化钠,0.5mM EDTA的pH为8.0,0.5%的TritonX-100,5mM的β-内甘油,5%甘油。保存在4℃。使用,添加1mM的二硫苏糖醇(DTT),1mM的苯甲基磺酰氟(PMSF),和1mM钒酸钠之前立即。在该步骤之后,PMSF中不需要任何漂洗缓冲液中。
- 使将20ml 10×激酶缓冲液:200毫摩尔Tris pH为7.5,50mM的β-内甘油(FW 216),2mM的钒酸钠。分装在1ml试管并储存在-20℃。使用,加上5 mm DTT前夕。
- 使20ml中10倍的M-ATP的缓冲液:300μM三磷酸腺苷(ATP)的66mM的MgCl 2,33毫摩尔的MnCl 2,分装在1ml试管并储存在-20℃。
- 使100个毫升2×十二烷基硫酸钠(SDS)裂解缓冲液:1.5克的TRIS碱,将20ml甘油,加入30ml 的 H 2 O.溶解并调整pH至6.8,用HCl。添加40毫升10%SDS中,音量调节至100毫升。加入25毫克的溴酚蓝。
- 现货4微升25毫微克/微升哺乳动物表达质粒套96孔板和标签板相应的编码每一个GST激酶14家 。密封和冷冻板在-20℃下直到使用。
- 1-2天前,转染,培养HEK293T细胞中完整的Dulbecco改良的Eagle培养基(DMEM)+ 10%胎牛血清(FBS)和抗生素在37℃培养箱中补充有二氧化碳 (最终5%)。通道与胰蛋白酶和不允许的股票成为> 80%汇合膨胀的过程中。至少6×10 7个细胞的所需屏幕(约3×15厘米,在80%汇合HEK293T细胞的碗碟)。
2.转染
注: 图 1所示为整个协议的流程图。
- 如果包含激酶质粒板已被冻结,在室温下解冻一次离心在1900×g离心3分钟以收集任何湿气在孔的底部。
- 拌8.6 ml的低血清培养基(例如,OPTI-MEM)与312.7微升基于脂质的转染试剂的。让我们坐5分钟。
- 加10微升减少血清的培养基,每孔使用自动化液体分配器装配有小体积盒。
- 添加每降低血清培养基/转染试剂混合物从步骤2.2的井10微升用自动液体分配器装配有小体积盒。让我们坐20〜45分钟。
- 重悬293T细胞在在80ml完全DMEM的7.5×10 5个细胞/ ml。加入100微升细胞悬浮液(即7.5×10 4个细胞)的每使用自动化液体分配器装有标准量盒式良好。
- 检查井显微镜均匀细胞分布下并返回到培养箱24小时。
3. GST激酶下拉
- 让˚FRESH:4mM的通过混合60微升的0.2M钒酸钠与540微升H 2 O过钒酸盐溶液在第二管混合2.7微升过氧化氢的30%和1.4毫升的PBS。添加两种方法结合,让坐在使用前15分钟。
- 使用多道移液器(因为它在井产生太多的湍流不使用自动化液体分配器)分配2微升0.25M的氯化钙 2在各孔中,接着2.5微升在步骤3.1中制备的过钒酸盐的。孵育各板在37℃下进行10分钟,然后放置在冰上。
- 通过添加DTT,PMSF,和钒酸钠如第1(试剂的配制)所示制备的35ml裂解缓冲液。
- 保持板置于冰上,利用真空抽吸每孔删除网上平台。立即用自动液体分配器装有标准盒式添加50μl/孔的冰冷的裂解缓冲液。让我们坐30分钟,在冰上裂解(可选:可以在这里如果有必要通过密封高原停止e和储存在-80℃。要继续,解冻板冰)。
- 旋板在1900×g离心3分钟,在4℃。
- 使用多道移液器向各孔刮去细胞和转移所有内容以适当标记的V型底96孔板中。旋板在1900 xg离心在4℃下10分钟。
- 期间的旋转,填充谷胱甘肽包被的板(每个96孔板)用100μl/孔的冰冷裂解缓冲液(无PMSF),为漂洗。置于冰上板。
- 从离心机中取出V形底平板。一次一个,反转谷胱甘肽板在水槽上方,以摇出的纸巾裂解液和印迹。通过倾斜板,并使用多道移液器,小心不要在底部打扰颗粒移植自V-底板的谷胱甘肽板裂解液。盖板和置于冰上至少2小时进行绑定。
- 接近2小时的结合步骤的结束时,准备一个放射性工作站,确保吨他必要的安全防范措施到位放射性工作。设置杂交炉至30℃。
- 如在第1节PMSF表明不需要在该阶段制得200毫升裂解缓冲液加入DTT和钒酸钠。
- 反转的谷胱甘肽板在水槽上方,以摇出裂解液涂抹在纸巾上。冲洗孔3倍用100μl裂解缓冲液(无PMSF)。不要让井坐干 - 让他们在漂洗,直到准备进行。
- 通过稀释10倍的库存和添加DTT作为用自动液体分配器装有标准体积盒在第1指示的冲洗板一次用50μl的1×KB的制备55毫升1×激酶缓冲液(KB)。留1个KB的井,直到溶液中的准备:
- 通过添加500至530微克的兴趣将基片,500微克的髓鞘碱性蛋白(MBP),2.65毫升10×KB,13.25微升的1M DTT和H 2 O的高达15.9 ml的制备溶液A。
- 一次一个,翻转板在水槽上方,除去1个KB冲洗,涂抹在纸巾上,并立即使用自动液体分配器配有体积小纸盒加30微升溶液A。置于冰上板。
- 制备溶液B在放射性工作区域通过加入2.5 ml的10倍的M-ATP,500微居里的γ-32 p ATP和H 2 O的至10ml。
- 加入20微升溶液B每使用中继器吸管,它有助于混合,由于喷射力很好。盖上盖子进行培养在30℃杂交炉30分钟。
- 30分钟后,回转板,以冰。加入50微升2×SDS裂解缓冲液,使用多道移液器每个孔中。可以进行在这个点到下一个步骤,或密封用铝箔和存储所述板在-20℃直至方便。
4.运行,染色,干燥凝胶
注:所有工作都应该在一个地区DESIGNA进行泰德放射性。
- 打开杂交炉和设定为85℃。解冻板在室温下。一旦烘箱达到温度,传热板到烤箱并孵育10分钟以变性样品。
- 负载26孔预制胶与15微升使用多道移液器每一个反应,以填补多口井一次。必须注意,所有的技巧配合以及相对应先加样品。运行凝胶在150五,不要让示踪染料(蓝线)跑出凝胶的底部,因为这包含了未结合的ATP。
- 拆除凝胶和切断使用手术刀或直边,因为它会曝光过度,影片的未结合的ATP(蓝线)。将凝胶在标签的容器和盖用考马斯染色15分钟。
- 取出考马斯染色,简单地用清水冲洗凝胶,并添加脱色的解决方案。脱色的凝胶直至蛋白质都清晰可见。 A波段的MBP和基材带应对于每个样品可见。
- 以干燥的凝胶:
- 切滤波器一张大纸,并把它放在烘干机。
- 湿蒸馏水玻璃纸片,直到它是光滑,无皱,并将其放置在纸张的顶端。
- 躺在玻璃纸片材的顶部的凝胶,使得记凝胶的量级。湿的第二玻璃纸片和放在凝胶的顶部。
- 铺开所有的泡沫(一板的密封辊可以很好地用于本)的一个很好的均匀的表面。关闭挡板,打开真空,并在80℃干燥该凝胶3小时。
- 一旦凝胶干燥,用丝网加紧信号,将其暴露在XAR胶片。用保鲜保鲜膜或塑料袋磁带,并用胶带密封,保持了霜冻。存储盒在-80℃下过夜。
5.制定XAR电影
- 翌日,从冷冻库取出暗盒,并让在室温下解冻。发展中的膜使用薄膜处理器根据制造商的说明暗室。
注意:检查薄膜激酶底物对的证据。阿秒更长的曝光也可以是有用的检测更弱的磷酸化事件。
结果
来自屏幕代表性的结果示于图2。180激酶使用来自CRTC2以及经典激酶测定衬底髓鞘碱性蛋白(MBP)相应于氨基酸268-283一个GST-标记的肽底物进行筛选。只有两个激酶MARK2和高度相关激酶磷酸化MARK3的CRTC2肽。 MBP被包括在所有测定中的内部对照,因为它包含了许多可磷酸化的残基,并运行在18 kDa的,朝向所述凝胶的底部。这允许特异性的解释:有些激酶将有力磷酸化底物和MBP。这里注意到的是,包含单独的GST(即无激酶对照)的孔中总是净化一些内源性激酶的活性,因此总是有在测定背景磷酸化。虽然这并不排除该衬底的磷酸化是真实的,但它表明,在体外设置激酶可以是低选择性。它特别信息,包括不同兆瓦得出关于激酶底物特异性结论的多个基板。
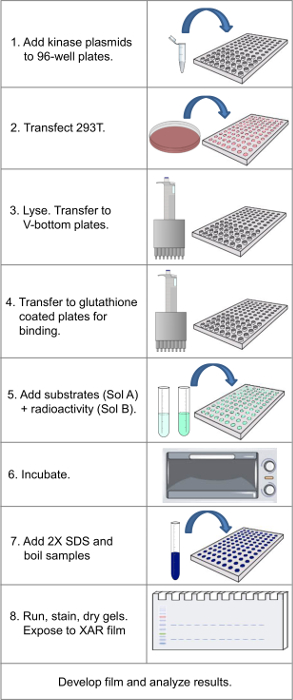
图1.流程图显示在协议的关键步骤 。 请点击此处查看该图的放大版本。

库(180人蛋白激酶)的版本1的屏幕的图的屏幕结果2。实施例。放射自显影进行使用对应于氨基酸268-283小鼠CRTC2(来自Jansson的再现。等,2008)的GST-肽底物。 MBP,髓鞘碱性蛋白表示。 s的高度ubstrate选择由相关激酶是屏幕的一个特征。各泳道表示的反应产物从一个不同的激酶测定法。 MARK3(凝胶1)和MARK2(凝胶16),唯一的激酶磷酸化TORC2 268-283肽表示。 请点击此处查看该图的放大版本。
讨论
由于原来的出版物描述的方法14,15,180 GST-激酶原库已扩大到420件,或约80%的人类蛋白质激酶组的。与膨胀的文库,如所描述的协议需要4-5天,然后1-4天来开发薄膜(认为必要),这可以通过使用磷光和数字信号增强的缩短。有些情况必须注意几个关键步骤( 见图 1协议的概述)。第一,是细胞的股票的健康(无支原体,决不允许在膨胀过程中达到汇合,并用胰蛋白酶在每次传代处理)在批量扩张阶段,并在96孔板在转染时。细胞应是均匀地加入晶种,80%铺满时转染发生(步骤1.5)。
其次,它是转染期间理想使用自动化的液体分配器,以尽量减少体积TRANSF呃错误,因而限制了变化的井之间系数("CVS")。对于小体积,配合以较小的体积限制磁带丢失试剂分配器由于减少了死体积并提高分配的准确性。的处理步骤与钠过钒酸盐,泛酪氨酸磷酸酶抑制剂,被用作普通的刺激,以增加靶激酶的磷酸化状态。钙在该步骤中纳入提高细胞基质粘附性,防止细胞损失由于四舍五入引起因长时间过钒酸盐处理。这一步应该严格遵守孵育10分钟的时间内完成。
第三,对于激酶测定本身,有选择重组衬底时几方面的考虑:肽,蛋白质结构域,或完整蛋白质一样大120 kDa的都可以使用。如果一个特定的磷酸化位点是已知的,肽底物是最直接的方法,但需要足够大,以检测在SDS-PAGE凝胶。因此,肽底物可以融合到GST和纯化从细菌,得到> 25兆瓦。较大的蛋白质具有它们很可能折叠和它们的磷酸化残基暴露因为他们将在细胞中,还配备了一个缺点,即它们将包括附加的残基可以是磷酸化并在测定得到的信号的优点。我们倾向于使用的周围,是已知在体内被磷酸化,并能够调节生物事件的残基15-20个氨基酸组成的肽底物来运行一个屏幕,因为这使得该候选激酶验证从屏幕既在体外和体内快得多。
最后,蛋白质的方法理想的量或超过每孔1微克;这门课程的变化与基材的兆瓦。每孔较少的蛋白质可以产生有意义的点击率,但"越多越好"的规则适用,因为它增加的信号:NOI东南。标准的,非梯度凝胶被推荐为梯度凝胶干燥过程中开裂过于频繁。干燥该凝胶后,检测放射性信号超过背景与盖革计数器给出测定的成功的一个极好的指示。
由于屏幕是在体外和复杂性的额外等级在体内存在,对于给定的衬底上的候选激酶(多个)必须在细胞中进行验证。具体地,屏幕可以标识一个家庭成员具有磷酸化在体外基板生化容量,但不表达在相同细胞类型或在同一个亚细胞区室作为基材。例如,虽然MARK2和MARK3均命中在一个屏幕激酶可能磷酸CRTC2上Ser275,只MARK2形成的复合物与细胞在14基板。以下是一系列可用于确认的候选激酶生理相关附加实验。杉木省,在SDS-PAGE基板的以下的候选激酶共表达迁移率改变,可作为一个确认控制。适当的控制催化活性的激酶的这种共转染可以证实特异性。第二,衬底可以从已经孵育32 P磷酸盐确认磷酸盐掺入在野生型的存在基板,而不是催化活性的激酶的细胞提取物免疫沉淀。第三,一个磷酸化抗体可针对磷酸受体序列生成(如果已知)和用于确认的增加底物磷酸化时激酶过度表达。使用突变体基板输送的非磷酸化残基在靶部位的二次屏幕可以确认特异性前一代phosphoantibody,具有较大的域和全长蛋白质底物的一个特别重要的控制。药理抑制方法来抑制坎迪日期激酶也可以使用,但必须谨慎作为抑制相关激酶是一个被低估的现实。最后,RNAi介导在细胞中的候选激酶(S)的沉默跟着和免疫印迹监控目标部位的磷酸化具有磷酸化抗体损失可以被执行。
披露声明
The authors have nothing to disclose.
致谢
这项工作是由NSERC经费资助 386634.我们想感谢Screaton实验室成员,有益的讨论。
材料
| Name | Company | Catalog Number | Comments |
| Lysis buffer | Made in house | See Protocol step 1.1 | |
| 10x kinase buffer | Made in house | See Protocol step 1.2 | |
| 10x M-ATP | Made in house | See Protocol step 1.3 | |
| Human kinase plasmids | Orfeome, Invitrogen, Origene | GST-tagged in house | |
| 96 well plates | Fisher Scientific | CS003595 | |
| 293T cells | ATCC | CRL-11268 | |
| DMEM | Fisher Scientific | SH3002201 | supplement with 100 U/ml penicillin, 100 μg/ml streptomycin, 10% fetal calf serum. |
| CO2 incubator | Sanyo | MCO-17AIC | |
| 15 cm cell culture dishes | Fisher Scientific | 877224 | |
| Reduced serum medium | Invitrogen | 22600-050 | |
| Lipid-based transfection reagent | Invitrogen | 11668-019 | |
| Automated liquid dispenser | Thermo Scientific | 5840300 | |
| Small cassette attachment | Thermo Scientific | 24073295 | |
| Standard cassette attachment | Thermo Scientific | 14072670 | |
| 4 mM pervanadate | Made in house | See Protocol step 3.1 | |
| 0.25 M CaCl2 | Made in house | ||
| Multichannel pipette (20-200 μl) | Labnet | p4812-200 | |
| Multichannel pipette (1-10 μl) | Thermo Scientific | 4661040 | |
| V-bottom 6-well plates | Evergreen Scientific | 290-8116-01V | |
| Glutathione coated 96-well plates | Fisher Scientific | PI-15240 | |
| Hybridization oven | Biostad | 350355 | |
| GST tagged substrate | Made in house | ||
| Myelin Basic Protein (MBP) | Sigma | M1891 | |
| Repeater pipette (1 ml) | Eppendorf | 22266209 | |
| 32P gamma-ATP | Perkin Elmer | BLU502Z500UC | |
| 2x SDS lysis buffer (100 ml) | Made in house | See Protocol step 1.4 | |
| 26-well precast TGX gels | BioRad | 567-1045 | gel percentage required is dependent on the molecular weight of the substrate of interest |
| Coomassie stain | Made in house | 0.1% Coomassie R250, 10% acetic acid, 40% methanol | |
| Coomassie destain | Made in house | 10% acetic acid, 20% methanol | |
| Labeled gel containers | Made in house | Used plastic lids from empty tip boxes, just big enough to contain one gel | |
| Whatman filter paper | Fisher Scientific | 57144 | |
| Cellophane sheets (2) | BioRad | 165-0963 | |
| Gel dryer | Labconco | 4330150 | |
| Double emulsion autoradiography film | VWR | IB1651454 | |
| Film cassette | Fisher Scientific | FBAC-1417 | |
| Intensifying screen | Fisher Scientific | FBIS-1417 | |
| Plate sealing rubber roller | Sigma | R1275 |
参考文献
- Meisenhelder, J., Hunter, T., van der Geer, P. Phosphopeptide mapping and identification of phosphorylation sites. Curr Protoc Mol Biol. 18, Unit 18 19 (2001).
- Doll, S., Burlingame, A. L. Mass spectrometry-based detection and assignment of protein posttranslational modifications. ACS chem. 10, 63-71 (2015).
- Sharma, K., et al. Ultradeep human phosphoproteome reveals a distinct regulatory nature of Tyr and Ser/Thr-based signaling. Cell rep. 8, 1583-1594 (2014).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends Biochem Sci. 25, 596-601 (2000).
- Walsh, C. T. . Posttranslation Modification of Proteins: Expanding Nature's Inventory. , (2006).
- Boersema, P. J., et al. In-depth qualitative and quantitative profiling of tyrosine phosphorylation using a combination of phosphopeptide immunoaffinity purification and stable isotope dimethyl labeling. Mol Cell Proteomics. 9, 84-99 (2010).
- Hutti, J. E., et al. A rapid method for determining protein kinase phosphorylation specificity. Nat Methods. 1, 27-29 (2004).
- Johnson, S. A., Hunter, T. Kinomics: methods for deciphering the kinome. Nat Methods. 2, 17-25 (2005).
- Pawson, T., Nash, P. Assembly of cell regulatory systems through protein interaction domains. Science. 300, 445-452 (2003).
- Zhu, H., et al. Analysis of yeast protein kinases using protein chips. Nat Genet. 26, 283-289 (2000).
- Shah, K., Shokat, K. M. A chemical genetic approach for the identification of direct substrates of protein kinases. Methods Mol Biol. 233, 253-271 (2003).
- Zou, L., et al. PKIS: computational identification of protein kinases for experimentally discovered protein phosphorylation sites. BMC bioinform. 14, 247 (2013).
- Varjosalo, M., et al. Application of active and kinase-deficient kinome collection for identification of kinases regulating hedgehog signaling. Cell. 133, 537-548 (2008).
- Jansson, D., et al. Glucose controls CREB activity in islet cells via regulated phosphorylation of TORC2. Proc Natl Acad Sci U S A. 105, 10161-10166 (2008).
- Fu, A., Screaton, R. A. Using kinomics to delineate signaling pathways: control of CRTC2/TORC2 by the AMPK family. Cell Cycle. 7, 3823-3828 (2008).
- Abu-Thuraia, A., et al. Axl phosphorylates elmo scaffold proteins to promote rac activation and cell invasion. Mol Cell Biol. 35, 76-87 (2015).
- Manning, G., Whyte, D. B., Martinez, R., Hunter, T., Sudarsanam, S. The protein kinase complement of the human genome. Science. 298, 1912-1934 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。