Method Article
זיהוי של זוגות קינאז-מצע שימוש הקרנת תפוקה גבוהה
In This Article
Summary
Protein phosphorylation is a central feature of how cells interpret and respond to information in their extracellular milieu. Here, we present a high throughput screening protocol using kinases purified from mammalian cells to rapidly identify kinases that phosphorylate a substrate(s) of interest.
Abstract
פיתחנו פלטפורמת הקרנה לזהות קינאזות חלבון האנושית ייעודית למצעי phosphorylated אשר יכול לשמש כדי להבהיר מסלולי העברת אותות רומן. הגישה שלנו כוללת שימוש בספרייה של קינאזות חלבון אנושי מתויג GST מטוהר ומצע חלבון רקומביננטי של עניין. השתמשנו בטכנולוגיה זו כדי לזהות קינאז MAP / microtubule ויסות זיקה 2 (MARK2) כקינאז לאתר מוסדר גלוקוז על-מוסדר CREB תעתיק Coactivator 2 (CRTC2), חלבון דרוש להתפשטות תאי ביתא, כמו גם משפחת אקסל של טירוזין קינאז כרגולטורים של גרורות תא על ידי זירחון של חלבון המתאם ELMO. אנו מתארים את הטכנולוגיה הזו ולדון איך זה יכול לעזור להקים מפה מקיפה של כמה תאים מגיבים לגירויים סביבתיים.
Introduction
שינויי חלבון לאחר translational (PTMs) חיוניים לתקשורת תאית. אולי הכי טוב למדו מכל PTMs הוא זרחון, מזורז על ידי קינאז חלבון, המסדיר את מספר עצום של פונקציות חלבון, כוללים הפעילות ביוכימית שלהם, לוקליזציה subcellular, קונפורמציה, ויציבות. זיהוי של אתרי זירחון על חלבוני יעד יכול להתבצע על ידי מיפוי phosphopeptide tryptic או על ידי טכניקות proteomic עכשיו סטנדרטיות באמצעות דגימות מועשרים לפפטידים phosphorylated 1,2. בעוד שלושה רבעים מproteome הביעה צפויים להיות phosphorylated 3 וזיהה 200,000 אתרי זירחון 5, עם הערכות עד 1 מ'6, רבים מהם אין לי ביולוגיה הוקצתה, מסלול איתות, או חלבון kinase.
בעוד זיהוי של אתרי פוספורילציה הוא יחסית פשוט, אתגר גדול יותר הוא יחסיתלזהות אותו מקור קינאז (ים) שמכוון את האתרים הללו, תהליך שאנו מכנים קינאז מיפוי: זוגות מצע. מספר גישות לזיהוי קינאז: זוגות מצע תוארו, או מתחיל עם קינאז של עניין ומחפש מצעים שלה או מתחיל עם מצע של עניין ומנסה למצוא קינאז שינוי בניסוי 7-11 או המחשוב 12. לזהות קינאזות למצע phosphorylated ידוע, ניתן להשתמש ביואינפורמטיקה לזהות חלבונים המכילים רצף נשמר קצר של חומצות אמינו משני צדי שאריות פוספורילציה (אתר הקונצנזוס), כמו גם זיהוי קינאז היוצרים מורכב precipitable עם המצע. עם זאת, גישות אלה הן זמן רב ולעתים קרובות אינו עומדות בהצלחה.
פיתחנו גישה פונקציונלית שיטתית לזהות במהירות קינאז שיכול phosphorylate מצע נתון 13. Assay המסך מייצר ספציפי מצוינתity, עם מבחר מאוד ברור לקינאז מקור הפוטנציאלי. בהתחשב במרכזיותה של זירחון לאיתות ביולוגית, המסך שימושי לגילוי במסלולי איתות כמעט בכל תא 14-16. המסך כולל ביצוע assay קינאז בקנה מידה גדולה עם ספרייה של קינאזות חלבון האנושית. קינאז תויג עם S-transferase גלוטתיון חיידקי חלבון (GST) והם מטוהרים מתמציות תאים יונקים, מה שאומר שאנזימי רקומביננטי - בניגוד לאלה שהוכנו מחיידקים - נוצרים בנוכחות חלבון קינאז במעלה הזרם לעתים קרובות נדרש ל אנזימי רקומביננטי יש פעילות במבחנה. ואכן, תוך פעילות קינאז סרין, תראונין, וטירוזין קינאז הנדרשת להפעלה במורד הזרם נמצא בשמרים 10, שמרי הגנום מקודד חלבון קינאז 122, המציין כי kinome היונקים, עם למעלה מ -500 גנים 17, הפך באופן משמעותי יותר מורכב כדי Regulate התהליכים ייחודיים לאורגניזמים מסדר גבוהים יותר. יתר על כן, ההשפעה של גירויים שונים רלוונטיים לביולוגיה של תא ומחלות של בני אדם (כגון מולקולות קטנות, גורמי גדילה, הורמונים, וכו ') יכולה לשמש לפעילות קינאז 14,15 לווסת בהקשר מתאים.
Protocol
1. הכנת ריאגנטים, צלחות, ותאים
- הפוך 500 מיליליטר חיץ תמוגה: 25 מ"מ טריס pH 7.5, 150 מ"מ NaCl, 50 מ"מ NAF, 0.5 mM EDTA pH 8.0, 0.5% TritonX-100, 5 מ"מ בטא glycerophosphate, גליצרול 5%. חנות ב 4 מעלות צלזיוס. מייד לפני השימוש, מוסיף dithiothreitol 1 מ"מ (DTT), פלואוריד 1 מ"מ sulfonyl phenylmethyl (PMSF), וvanadate נתרן 1 מ"מ. לאחר שלב זה, PMSF אינו נדרש בכל חיץ לשטוף.
- לעשות 20 מיליליטר של 10x קינאז מאגר: 200 מ"מ טריס pH 7.5, 50 בטא glycerophosphate מ"מ (FW 216), vanadate נתרן 2 מ"מ. Aliquot ב 1 מיליליטר צינורות ולאחסן ב -20 ° C. מייד לפני השימוש, מוסיף 5 מ"מ DTT.
- לעשות 20 מיליליטר של 10x חיץ M-ATP: 300 מיקרומטר אדנוזין טריפוספט (ATP), 66 מ"מ MgCl 2, 33 Aliquot מ"מ MnCl 2. ב 1 מיליליטר צינורות ולאחסן ב -20 ° C.
- הפוך של סולפט dodecyl נתרן 2x 100 מיליליטר (SDS) תמוגה חיץ: 1.5 בסיס גרם טריס, 20 מיליליטר גליצרול, H 30 מיליליטר 2 O. ממיסים ולהתאים את ה- pH 6.8 עם HCl. הוסף 40מיליליטר 10% SDS, להתאים את עוצמת קול עד 100 מיליליטר. הוסף 25 bromophenol הכחול מ"ג.
- מקום 4 μl של 25 ng / פלסמיד ביטוי היונקים μl קידוד GST-קינאז 14 לכל גם בקבוצות של 96 צלחות גם וצלחות תווית בהתאם. צלחות חותם והקפאה ב -20 ° C עד לשימוש.
- 1-2 ימים לפני transfection, תאי HEK293T התרבות בנשר הבינוני (DMEM) + 10% בסרום שור עוברי (FBS) שונה Dulbecco המלא ואנטיביוטיקה ב37 ° C חממה בתוספת CO 2 (5% סופיים). מעבר עם טריפסין ואינם מאפשר המניה להפוך> 80% ומחוברות בהרחבה. מינימום של 6 x 10 7 תאים נדרשים עבור המסך (3 x 15 סנטימטר מנות של תאי HEK293T כ בנקודת מפגש 80%).
2. Transfection
הערה: ראה איור 1 עבור תרשים זרימה של כל פרוטוקול.
- אם צלחות המכילות פלסמידים קינאז הוקפאו, הפשרה בטמפרטורת חדרND צנטריפוגות ב 1,900 XG במשך 3 דקות כדי לאסוף כל לחות בחלק התחתון של בארות.
- מערבבים 8.6 מיליליטר של מדיום מופחת בסרום (למשל, OPTI-MEM) עם 312.7 μl של מגיב transfection שומנים מבוסס. בואו לשבת במשך 5 דקות.
- הוסף 10 μl של מדיום סרום מופחת לכל גם באמצעות מצויד בקלטת נפח קטנה מנפק נוזל אוטומטי.
- הוסף 10 μl לכל גם בתמהיל מגיב בינוני סרום / transfection המופחת מצעד 2.2 באמצעות מצויד בקלטת נפח קטנה מנפק נוזל אוטומטי. בואו לשבת במשך 20 עד 45 דקות.
- תאי Resuspend 293T על 7.5 x 10 5 תאים / מיליליטר ב 80 מיליליטר של DMEM המלא. להוסיף השעיה תא (כלומר 7.5 x 10 4 תאים) 100 μl לכל גם באמצעות מצויד בקלטת נפח סטנדרטית מנפק נוזל אוטומטי.
- בדקו בארות תחת מיקרוסקופ לחלוקת תא אחיד ולחזור לחממה עבור 24 שעות.
הנפתח 3. GST-קינאז
- הפוך Fפתרון pervanadate 4 מ"מ על ידי ערבוב 60 μl של 0.2 M vanadate נתרן עם 540 μl של H 2 O.: ריש בשילוב צינור שני 2.7 μl של 30% חמצן ו -1.4 מיליליטר של PBS. להוסיף שני פתרונות יחד ולתת לשבת במשך 15 דקות לפני השימוש.
- בעזרת פיפטה רבה (לא משתמש במתקן נוזלי אוטומטי כפי שהוא יוצר יותר מדי מערבולת בבאר) לוותר על 2 μl של 0.25 מ 'CaCl 2 בכל טוב, ואחריו 2.5 μl של pervanadate מוכן בשלב 3.1. דגירה כל צלחת על 37 מעלות צלזיוס למשך 10 דקות ולאחר מכן למקם על קרח.
- הכן 35 מיליליטר של חיץ תמוגה ידי הוספת DTT, PMSF, וvanadate נתרן כפי שצוין בסעיף 1 (הכנת ריאגנטים).
- שמירה על צלחות על קרח, להסיר בינוני מכל גם באמצעות aspirator ואקום. מייד להוסיף 50 μl / טוב של חיץ תמוגה קר כקרח באמצעות מצויד בקלטת סטנדרטית מנפק נוזל אוטומטי. בואו לשבת 30 דקות על קרח לlyse (אופציונאלי: ניתן לעצור כאן במידת צורך על ידי איטום platדואר ואחסון ב -80 ° C. כדי להמשיך, צלחות הפשרה על קרח).
- צלחות ספין ב1,900 XG במשך 3 דקות ב 4 מעלות צלזיוס.
- לגרד תאים מכל טוב בעזרת פיפטה רבה ולהעביר את כל התוכן לכותרתו כראוי צלחות 96 גם V-תחתון. צלחות ספין ב1,900 XG במשך 10 דקות ב 4 מעלות צלזיוס.
- במהלך ספין, למלא צלחות גלוטתיון מצופים (אחד לכל צלחת 96-היטב) עם 100 μl / היטב חיץ קרח קר תמוגה (ללא PMSF) כשטיפה. שמור צלחות על קרח.
- הסר צלחות V-תחתון מצנטריפוגות. אחד בכל פעם, להפוך את צלחות גלוטתיון מעל כיור כדי לנער את מאגר תמוגה והכתם על מגבת נייר. העבר את מאגר תמוגה מהצלחות V-תחתון לצלחות גלוטתיון ידי הטיית הצלחת ובעזרת פיפטה רבה, להיות זהיר, כדי לא להפריע את הכדור בחלק התחתון. לכסות צלחות ולהשאיר על קרח עבור שעה 2 מינימום להיקשר.
- קרוב לסוף הצעד המחייב 2 שעות, להכין תחנת עבודה רדיואקטיביות, הבטחה לאהוא אמצעי בטיחות דרוש נמצא במקום עבודת רדיואקטיבי. תנור הכלאה להגדיר עד 30 מעלות צלזיוס.
- הכן 200 מיליליטר של חיץ תמוגה ידי vanadate DTT ונתרן הוספה כאמורה בסעיף 1. PMSF אינו נדרש בשלב זה.
- הפוך את צלחות גלוטתיון מעל כיור כדי לנער את מאגר תמוגה ולמחוק על מגבת נייר. בארות לשטוף 3x עם 100 חיץ תמוגה μl (ללא PMSF). אל תתנו לבארות לשבת יבשות - לשמור אותם בשטיפה עד מוכן להמשיך.
- הכן 55 מיליליטר של חיץ 1x קינאז (KB) על ידי דילול המניות 10x והוספת DTT כפי שצוין בסעיף 1. צלחות לשטוף פעם אחת עם 50 μl של 1x KB באמצעות מצויד בקלטת נפח סטנדרטית מנפק נוזל אוטומטי. השאר 1x KB בבארות עד פתרון מוכן:
- הכן פתרון על ידי הוספת 500-530 מיקרוגרם של המצע של עניין, 500 מיקרוגרם של חלבון המיאלין בסיסי (MBP), 2.65 מיליליטר של 10x KB, 13.25 μl של 1 M DTT, ו- H 2 O עד 15.9 מיליליטר.
- אחד בכל פעם, להפוך את הצלחות מעל כיור כדי להסיר שטיפת KB 1x, למחוק על מגבת נייר, ומייד להוסיף 30 μl של הפתרון באמצעות מצויד בקלטת נפח קטנה מנפק נוזל אוטומטי. שמור צלחות על קרח.
- הכן פתרון B באזור עבודת הרדיואקטיביות על ידי הוספת 2.5 מיליליטר 10x M-ATP, ATP 32 P 500 gamma- μCi, ו- H 2 O ל -10 מיליליטר.
- הוסף 20 μl של הפתרון B לכל גם באמצעות פיפטה מהדר אשר מסייעת בערבוב בשל כוח פליטה. מכסים ודגירה בתנור הכלאה 30 מעלות צלזיוס למשך 30 דקות.
- לאחר 30 דקות, להעביר צלחות בחזרה לקרח. הוסף 50 μl של חיץ תמוגה 2x SDS זה גם בעזרת פיפטה רבה. יכול להמשיך בשלב זה לשלב הבא, או לאטום את הצלחות בנייר אלומיניום ולאחסן ב -20 ° C עד נוח.
4. ריצה, מכתים, וג'לי ייבוש
הערה: כל העבודה צריכה להתבצע בdesigna אזורטד לרדיואקטיביות.
- הפעל תנור הכלאה ולהגדיר עד 85 מעלות צלזיוס. צלחות הפשרה בטמפרטורת חדר. ברגע שהתנור הגיע טמפרטורה, צלחות העברה לתנור ודגירה של 10 דקות ללפגל דגימות.
- עומס 26 היטב מראש יצוק ג'לי עם 15 μl של כל תגובה באמצעות פיפטה רבה כדי למלא כמה בארות ובעונה אחת. יש להקפיד שכל הטיפים ליישר עם מקביל היטב לפני הוספת דגימות. הפעל ג'ל ב 150 V. אל תתנו צבע המעקב (קו כחול) לברוח מתחתית הג'ל כזה מכיל ATP מאוגדים.
- לפרק את ג'לי ומנותק ATP מאוגדים (קו כחול) באמצעות אזמל או קצה ישר כפי שהוא יהיה לחשוף יותר מדי הסרטים. מניחים את ג'לי במכולות שכותרתו ולכסות עם כתם Coomassie במשך 15 דקות.
- להסיר את כתם Coomassie, בקצרה לשטוף את ג'לי עם מים, ולהוסיף destain פתרון. Destain ג'לי עד החלבונים נראים בבירור. להקה לMBP ולהקה למצע צריךיהיה גלוי לכל דגימה.
- לייבש את ג'לי:
- חותך גיליון גדול של נייר סינון ולמקם אותו במייבש.
- להרטיב גיליון צלופן במים מזוקקים עד שהוא חלק ולהתקמט בחינם, ומניח אותו על גבי הנייר.
- הנח את ג'לי על גבי גיליון נייר צלופן, מה שהופך את הערה של סדר ג'לי. להרטיב גיליון צלופן שני ומניח על גבי ג'לים.
- מרדדים כל הבועות (רולר איטום צלחת עובד היטב עבור זה) למשטח אחיד נחמד. סגור את הדש, להדליק את הוואקום, ולייבש את ג 'לים 3 שעות על 80 מעלות צלזיוס.
- ברגע שהג'לי הוא יבשים, לחשוף אותם לסרט XAR באמצעות מסך כדי להגביר את האות. עטוף את הקלטת עם ניילון נצמד או שקית ניילון ולאטום עם קלטת כדי לשמור את כפור. אחסן את הקלטת בלילה -80 ° C.
5. פיתוח XAR סרטים
- למחרת, להסיר קלטת מהמקפיא ולתת הפשרה בטמפרטורת חדר. לפתח את הסרט בחדר חושך באמצעות מעבד סרט על פי הוראות יצרן.
הערה: בדוק את הסרטים לראיות של זוגות קינאז-מצע. חשיפה ארוכה יותר שנייה יכולה להיות שימושית גם כדי לזהות אירועי זירחון חלשים.
תוצאות
נציגי תוצאות ממסך מוצגות באיור 2. 180 קינאז הוקרן באמצעות מצע פפטיד GST מתויג המתאים לaa 268-283 מCRTC2 כמו גם חלבון המיאלין מצע assay קינאז הקלאסי הבסיסי (MBP). רק שתי קינאזות, MARK2 וMARK3 קינאז הקשורים מאוד phosphorylated פפטיד CRTC2. MBP נכלל כבקרה פנימית בכל מבחני, כפי שהוא מכיל הרבה שאריות phosphorylatable ופועל ב -18 kDa, לכיוון החלק התחתון של הג'ל. זה מאפשר לפרשנות של סגוליות: כמה קינאז חסונה יהיה phosphorylate מצע וMBP. ראוי לציין כאן הוא שהבארות המכילות GST לבד (כלומר לא שולט קינאז) תמיד לטהר כמה פעילות קינאז אנדוגני, וכך תמיד יש זירחון רקע בassay. אמנם זה לא פוסל את זה זירחון של המצע הוא אמיתי, זה מצביע על כך שבמבחנה הגדרת קינאז עשוי להיות פחות בררן.זה במיוחד אינפורמטיבי לכלול מצעים מרובים של MW שונה כדי להסיק מסקנות לגבי סגוליות קינאז-מצע.
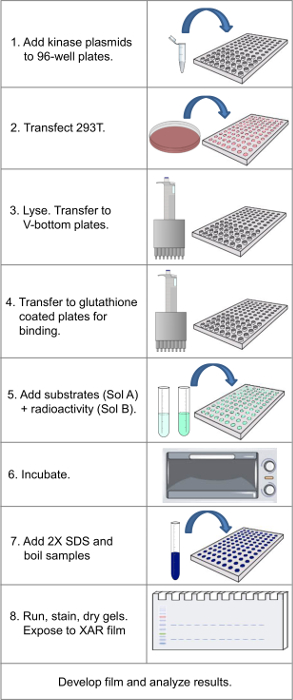
איור 1. תרשים זרימה המציגה שלבים עיקריים בפרוטוקול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. דוגמא של תוצאת מסך. Autoradiographs של מסך של גרסת 1 של הספרייה (180 קינאזות חלבון האנושית) בוצע באמצעות מצע GST-פפטיד המקביל לaa 268-283 של CRTC2 עכבר (לשכפל מJansson et al., 2008). MBP, חלבון המיאלין בסיסי מצויינים. הרמה הגבוהה של יםבחירת ubstrate ידי קינאז קשור היא תכונה של המסך. כל מסלול מייצג את המוצרים מתגובת assay קינאז מובחן. MARK3 (ג'ל 1) וMARK2 (ג'ל 16), קינאזות רק לphosphorylate TORC2 268-283 פפטיד, מצוינים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
מאז הפרסומים המקוריים המתארים את הגישה 14,15, הספרייה המקורית של 180 GST-קינאז הורחבה 420 חברים, או ~ 80% מkinome החלבון האנושי. עם הספרייה המורחבת, הפרוטוקול כפי שתואר לוקח 4-5 ימים ולאחר מכן 1-4 ימים כדי לפתח סרטים (כהכרחי), אשר יכול להתקצר על ידי שימוש בphosphorimaging ושיפור אותות דיגיטלי. יש כמה שלבים עיקריים שבו יש להקפיד (ראה איור 1 לסקירה של פרוטוקול). ראשון, היא הבריאות של המניה של תאים (mycoplasma חופשי, לא אפשר להגיע למפגש בהרחבה, וטופל בטריפסין בכל קטע) בשלב ההרחבה אצווה וב96 הצלחות גם בזמן של transfection. תאים צריכים להיות אחיד זרע, ומחוברות 80% כאשר transfection מתרחש (שלב 1.5).
שנית, הוא אידיאלי במהלך transfection להשתמש מנפק נוזל אוטומטי כדי למזער transf נפחטעויות אה, ובכך להגביל מקדם של וריאציות ("cvs") בין בארות. לנפחים קטנים, מתאימים מנפק עם אובדן מגיב גבולות קלטת נפח קטן יותר בשל כרכים מתים מופחתים ועלייה מחלק דיוק. צעד הטיפול בpervanadate נתרן, מעכב phosphatase טירוזין מחבת, משמש כגירוי כללי להגדיל מעמד זירחון של קינאזות היעד. הכללה של סידן בשלב זה מגבירה הידבקות התא-מטריקס, מניעת אובדן תא בגלל עיגול שהושרו על ידי טיפול pervanadate ממושך. צעד זה צריך להיעשות עם הקפדה על זמן דגירה של 10 דקות.
שלישית, לassay קינאז עצמו, יש כמה שיקולים בעת בחירת מצע רקומביננטי: פפטידים, תחומים חלבון, או חלבונים שלמים גדולים כמו 120 kDa ניתן להשתמש בכל. אם אתר זירחון ספציפי ידוע, מצע פפטיד הוא הגישה הכי ישר קדימה, אבל צריך להיות גדול מספיק כדי לזהותעל ג'ל SDS-PAGE. לפיכך, ניתן התמזגו מצעי פפטיד לGST ומטוהרים מחיידקים לתת MW של> 25. יש חלבונים גדולים יותר היתרון כי הם סביר מקופלים ושאריות phosphorylatable נחשפו כפי שהם יהיו בתא, עדיין מגיעים עם החסרון שהם יכללו שאריות נוספות שיכול להיות פוספורילציה ולתת אות בassay. ההעדפה שלנו היא להפעיל מסך באמצעות מצע פפטיד המורכב מחומצות אמינו המקיפות 15-20 שאריות שידועה שphosphorylated in vivo וידוע להסדיר אירוע ביולוגי, כמו זה הופך אימות של קינאזות המועמד מהמסך שני במבחנת in vivo הרבה יותר מהר.
אחרון, באופן אידיאלי הסכום של גישות חלבון או עולה 1 מיקרוגרם לכל גם; זה כמובן משתנה עם MW של המצע. חלבון פחות לכל גם יכול להניב להיטים משמעותיים, אבל "יותר הוא טוב יותר" כלל חל כפי שהוא מגביר אות: NOISE. סטנדרטי, ג'לי ללא שיפוע מומלץ כג'לי שיפוע לפצח לעתים קרובות מדי במהלך ייבוש. לאחר ייבוש ג'ל, זיהוי של אות רדיואקטיבי על רקע עם מונה גייגר נותן אינדיקציה מצוינת להצלחה של assay של.
כמסך הוא במבחנה ורמות נוספות של מורכבות קיימות in vivo, קינאז מועמד (ים) למצע נתון חייב להיות מאומת בתאים. באופן ספציפי, המסך עשוי מבני משפחה שיש לו את היכולת ביוכימיים לphosphorylate המצע במבחנה, עדיין לא באה לידי ביטוי באותו סוג התא או בתא subcellular כמצע לזהות. לדוגמא, בעוד MARK2 וMARK3 היו שני הלהיטים במסך לקינאז שיכול phosphorylate CRTC2 על Ser275, רק MARK2 יצר מורכב עם המצע בתאים 14. להלן סדרה של ניסויים נוספים שניתן להשתמש בי כדי לאשר את הרלוונטיות הפיזיולוגיות של קינאז מועמד. אשוחרח, משמרות ניידות של המצע על SDS-PAGE הבא Coexpression של קינאז המועמד יכול לשמש כביקורת אישור. בקרות מתאימות כגון cotransfection של קינאז catalytically פעיל יכולות לאשר סגוליות. שנית, את המצע ניתן immunoprecipitated מתמציות תא שכבר מודגרות עם 32 P-orthophosphate כדי לאשר התאגדות של פוספט לתוך המצע בנוכחות wildtype ולא קינאז catalytically לא פעיל. שלישית, נוגדן phosphospecific יכול להיות שנוצר נגד רצף phosphoacceptor (אם ידוע) ומשמש כדי לאשר עלייה בזירחון מצע כאשר קינאז מבוטא ביתר. מסך המשני באמצעות מצע מוטציה נושא שאריות הלא phosphorylatable באתר היעד יכול לאשר סגוליות לפני הדור של phosphoantibody, שליטה חשובה במיוחד עם מצעי תחום גדול וחלבון באורך מלא. עיכוב תרופתי גישות לעכב קנדייכול לשמש גם קינאז תאריך, עדיין יש להיזהר כמו עיכוב של קינאזות קשורה הוא מציאות אינה מוערכת. אחרון, RNAi בתיווך ההשתקה של קינאז המועמד (ים) בתאים ואחרי ומערבי סופג לפקח אובדן זירחון אתר היעד עם נוגדן phosphospecific יכול להתבצע.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מענק NSERC 386634. ברצוננו להודות לחברי המעבדה Screaton לדיונים מועילים.
Materials
| Name | Company | Catalog Number | Comments |
| Lysis buffer | Made in house | See Protocol step 1.1 | |
| 10x kinase buffer | Made in house | See Protocol step 1.2 | |
| 10x M-ATP | Made in house | See Protocol step 1.3 | |
| Human kinase plasmids | Orfeome, Invitrogen, Origene | GST-tagged in house | |
| 96 well plates | Fisher Scientific | CS003595 | |
| 293T cells | ATCC | CRL-11268 | |
| DMEM | Fisher Scientific | SH3002201 | supplement with 100 U/ml penicillin, 100 μg/ml streptomycin, 10% fetal calf serum. |
| CO2 incubator | Sanyo | MCO-17AIC | |
| 15 cm cell culture dishes | Fisher Scientific | 877224 | |
| Reduced serum medium | Invitrogen | 22600-050 | |
| Lipid-based transfection reagent | Invitrogen | 11668-019 | |
| Automated liquid dispenser | Thermo Scientific | 5840300 | |
| Small cassette attachment | Thermo Scientific | 24073295 | |
| Standard cassette attachment | Thermo Scientific | 14072670 | |
| 4 mM pervanadate | Made in house | See Protocol step 3.1 | |
| 0.25 M CaCl2 | Made in house | ||
| Multichannel pipette (20-200 μl) | Labnet | p4812-200 | |
| Multichannel pipette (1-10 μl) | Thermo Scientific | 4661040 | |
| V-bottom 6-well plates | Evergreen Scientific | 290-8116-01V | |
| Glutathione coated 96-well plates | Fisher Scientific | PI-15240 | |
| Hybridization oven | Biostad | 350355 | |
| GST tagged substrate | Made in house | ||
| Myelin Basic Protein (MBP) | Sigma | M1891 | |
| Repeater pipette (1 ml) | Eppendorf | 22266209 | |
| 32P gamma-ATP | Perkin Elmer | BLU502Z500UC | |
| 2x SDS lysis buffer (100 ml) | Made in house | See Protocol step 1.4 | |
| 26-well precast TGX gels | BioRad | 567-1045 | gel percentage required is dependent on the molecular weight of the substrate of interest |
| Coomassie stain | Made in house | 0.1% Coomassie R250, 10% acetic acid, 40% methanol | |
| Coomassie destain | Made in house | 10% acetic acid, 20% methanol | |
| Labeled gel containers | Made in house | Used plastic lids from empty tip boxes, just big enough to contain one gel | |
| Whatman filter paper | Fisher Scientific | 57144 | |
| Cellophane sheets (2) | BioRad | 165-0963 | |
| Gel dryer | Labconco | 4330150 | |
| Double emulsion autoradiography film | VWR | IB1651454 | |
| Film cassette | Fisher Scientific | FBAC-1417 | |
| Intensifying screen | Fisher Scientific | FBIS-1417 | |
| Plate sealing rubber roller | Sigma | R1275 |
References
- Meisenhelder, J., Hunter, T., van der Geer, P. Phosphopeptide mapping and identification of phosphorylation sites. Curr Protoc Mol Biol. 18, Unit 18 19 (2001).
- Doll, S., Burlingame, A. L. Mass spectrometry-based detection and assignment of protein posttranslational modifications. ACS chem. 10, 63-71 (2015).
- Sharma, K., et al. Ultradeep human phosphoproteome reveals a distinct regulatory nature of Tyr and Ser/Thr-based signaling. Cell rep. 8, 1583-1594 (2014).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends Biochem Sci. 25, 596-601 (2000).
- Walsh, C. T. . Posttranslation Modification of Proteins: Expanding Nature's Inventory. , (2006).
- Boersema, P. J., et al. In-depth qualitative and quantitative profiling of tyrosine phosphorylation using a combination of phosphopeptide immunoaffinity purification and stable isotope dimethyl labeling. Mol Cell Proteomics. 9, 84-99 (2010).
- Hutti, J. E., et al. A rapid method for determining protein kinase phosphorylation specificity. Nat Methods. 1, 27-29 (2004).
- Johnson, S. A., Hunter, T. Kinomics: methods for deciphering the kinome. Nat Methods. 2, 17-25 (2005).
- Pawson, T., Nash, P. Assembly of cell regulatory systems through protein interaction domains. Science. 300, 445-452 (2003).
- Zhu, H., et al. Analysis of yeast protein kinases using protein chips. Nat Genet. 26, 283-289 (2000).
- Shah, K., Shokat, K. M. A chemical genetic approach for the identification of direct substrates of protein kinases. Methods Mol Biol. 233, 253-271 (2003).
- Zou, L., et al. PKIS: computational identification of protein kinases for experimentally discovered protein phosphorylation sites. BMC bioinform. 14, 247 (2013).
- Varjosalo, M., et al. Application of active and kinase-deficient kinome collection for identification of kinases regulating hedgehog signaling. Cell. 133, 537-548 (2008).
- Jansson, D., et al. Glucose controls CREB activity in islet cells via regulated phosphorylation of TORC2. Proc Natl Acad Sci U S A. 105, 10161-10166 (2008).
- Fu, A., Screaton, R. A. Using kinomics to delineate signaling pathways: control of CRTC2/TORC2 by the AMPK family. Cell Cycle. 7, 3823-3828 (2008).
- Abu-Thuraia, A., et al. Axl phosphorylates elmo scaffold proteins to promote rac activation and cell invasion. Mol Cell Biol. 35, 76-87 (2015).
- Manning, G., Whyte, D. B., Martinez, R., Hunter, T., Sudarsanam, S. The protein kinase complement of the human genome. Science. 298, 1912-1934 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved