Aplicação da Teoria dos Grupos à Espectroscopia de IV
Visão Geral
Fonte: Tamara M. Powers, Departamento de Química da Texas A&M University
Complexos de carbonyl metálico são usados como precursores metálicos para a síntese de complexos organomelólicos, bem como catalisadores. A espectroscopia infravermelha (IR) é um dos métodos de caracterização mais utilizados e informativos dos compostos de CO. A teoria do grupo, ou o uso da matemática para descrever a simetria de uma molécula, fornece um método para prever o número de modos vibracionais C-O ativos de IR dentro de uma molécula. Observar experimentalmente o número de trechos de C-O no IR é um método direto para estabelecer a geometria e estrutura do complexo de carbonyl metálico.
Neste vídeo, sintetizaremos o complexo de carbonyl molbdenum Mo(CO)4[P(OPh)3]2, que pode existir nas formas cis e trans(Figura 1). Usaremos a teoria do grupo e a espectroscopia de IR para determinar qual isômero está isolado.
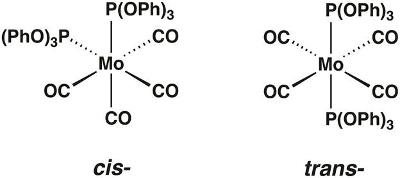
Figura 1. Os cis- e trans-isômeros de Mo(CO)4[P(OPh)3]2.
Princípios
Regras de seleção:
As regras de seleção ditam o número de transições eletrônicas, de um estado quântico para outro, que são possíveis para uma determinada molécula. Espectroscopia de RI sonda transições vibracionais do estado terrestre da molécula, v = 0, para o primeiro estado animado, v = 1. O número de graus de liberdade vibracional (modos normais de vibração) para moléculas lineares e não lineares pode ser calculado usando a Equação 1 e a Equação 2, respectivamente.
3N - 5 (1)
3N - 6 (2)
onde N = o número de átomos na molécula
Para que um modo normal de vibração seja ativo de IR, o dipolo da molécula deve mudar. Portanto, quaisquer modos normais de vibração onde uma mudança no dipolo não ocorra são inativos do IR. O número de modos de IR ativos pode ser determinado usando a teoria do grupo.
Teoria do Grupo:
Os químicos usam a teoria do grupo para entender a relação entre a simetria e as propriedades físicas de umamolécula. Embora o escopo da teoria do grupo seja muito amplo para cobrir rigorosamente neste vídeo, forneceremos as ferramentas necessárias para aplicar a teoria do grupo a complexos de coordenação simples e mostrar como ela pode ser usada para prever o número de modos vibracionais ativos de RI. Para demonstrar, caminharemos através da aplicação da teoria do grupo à molécula cis-Mo(CO)4[P(OPh)3]2.
Primeiro, precisamos determinar o grupo pontual da molécula. Grupos pontuais são usados para descrever os elementos de simetria presentes em uma determinada molécula. Para determinar o grupo de pontos cis-Mo(CO)4[P(OPh)3]2, podemos usar um fluxograma chamado árvore de simetria, que faz uma série de perguntas sobre os elementos de simetria presentes na molécula(Figura 2). A Tabela 1 resume todos os elementos de simetria incluídos na árvore de simetria. Usando a árvore simetria, e assumindo que os ligantes P(OPh)3 são ligantes de ponto (ignorando a simetria desses ligantes), descobrimos que cis-Mo(CO)4[P(OPh)3]2 está no grupo de pontos C2v.

Figura 2. Árvore simetria usada para determinação de grupo de ponto.
Mesa 1. Elementos de simetria usados na determinação do grupo de ponto.
| Elemento simetria | Símbolo usado | Exemplo* |
| Identidade | E |  |
| Eixo de rotação (rotação por 360°/n) |
Cn |  |
| Plano espelho horizontal (reflexão sobre o plano xy) |
σh | 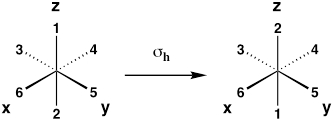 |
| Plano espelho vertical (reflexão sobre xz ou avião yz) |
σv | 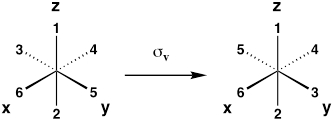 |
| Plano espelho diagonal (reflexão entre aviões xz e yz) |
σd | 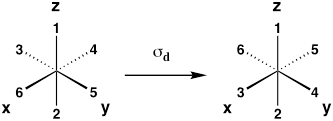 |
| Centro de Inversão | eu | 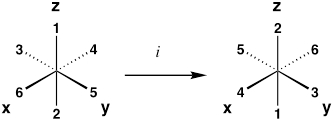 |
| Eixo de rotação inadequado (rotação de 360°/n seguida de reflexão perpendicular ao eixo de rotação) |
Sn |  |
| *Exemplos são para um complexo octaédrico, onde os ligantes 1–6 são equivalentes. Ao realizar a operação, a molécula resultante deve ser indistinguível de sua configuração original. | ||
Para o próximo passo, precisamos introduzir tabelas de caracteres, que descrevem toda a simetria presente dentro de um determinado grupo de pontos. A tabela de caracteres para o grupo de pontos C2v é mostrada abaixo.
| C2v | E | C2 | σv(xz) | σv'(yz) | ||
| Um1 | 1 | 1 | 1 | 1 | z | x2, y2, z2 |
| Um2 | 1 | 1 | −1 | −1 | Rz | xy |
| B1 | 1 | −1 | 1 | −1 | x, Ry | xz |
| B2 | 1 | −1 | −1 | 1 | y, Rx | yz |
O grupo de pontos é indicado no canto superior esquerdo da tabela de caracteres. À direita do grupo de pontos, todas as operações de simetria inerentes a esse grupo de pontos estão listadas. As linhas subsequentes listam todas as representações de simetria (representações irredutíveis, representadas por símbolos mulliken, ou seja, A1) contidas nesse grupo de pontos, juntamente com a simetria das funções, que podem nos dizer sobre a simetria dos orbitais atômicos, bem como o movimento linear ao longo do eixo x-, y-, e z.
Utilizando a tabela de caracteres para o grupo de pontos C2v,geramos uma representação redutível (Γvermelho) dos modos de alongamento C-O na molécula cis-Mo(CO)4[P(OPh)3]2 (Figura 3). A representação redutível, ou a combinação linear de representações irredutíveis, pode ser gerada aplicando cada uma das operações de simetria dentro da tabela de caracteres às vibrações dentro da molécula e registrando o número de vibrações C-O que permanecem inalteradas (na mesma posição no espaço). Por exemplo, ao aplicar o elemento simetria de identidade às vibrações C-O em cis-Mo(CO)4[P(OPh)3]2, todas as quatro setas vibracionais permanecem na mesma posição. Portanto, o primeiro valor em nossa representação redutível é 4. Se continuarmos este exercício, geraremos a representação redutível mostrada abaixo.
| C2v | E | C2 | σv(xz) | σv'(yz) |
| vermelho Γ | 4 | 0 | 2 | 2 |
Em seguida, usamos a tabela de caracteres C2v para encontrar a combinação linear de representações irredutíveis que gera Γvermelho para as vibrações C-O dentro cis-Mo(CO)4[P(OPh)3]2. A redução da representação redutível pode ser alcançada utilizando a fórmula de redução mostrada na Equação 3.
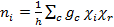 (3)
(3)
onde:
ni = número de vezes que a representação irredutível i ocorre na representação redutível
h = ordem do grupo (número total de operações de simetria)
c = a classe de operação
gc = número de operações na classe
χi = caráter da representação irredutível para as operações da classe
χr = caráter da representação redutível para as operações da classe
Usando a Equação 3 para cada uma das representações irredutíveis na tabela de caracteres C2v,descobrimos que Γvermelho = 2A1 + B1 + B2. Todas as três representações irredutíveis contribuintes, A1, B1e B2,são ir ativas porque se transformam como o eixo x,y ou z (ver a simetria das funções na tabela do personagem). Portanto, prevemos que cis-Mo(CO)4[P(OPh)3]2 exibirá modos de alongamento de 4 C-O em seu espectro ir.
Para resumir, são necessárias as seguintes etapas para determinar o número de modos vibracionais ativos de IR em uma molécula:
1. Determine o grupo pontual da molécula.
2. Gerar uma representação redutível das vibrações de alongamento C-O dentro da molécula.
3. Reduza a representação redutível usando a Equação 3.
4. Identifique o número de representações irredutíveis translacionais presentes na representação reduzida da etapa 3.
Se seguirmos esses 4 passos com trans-Mo(CO)4[P(OPh)3]2, descobrimos que a molécula possui apenas 1 modo vibracional C-O ativo.

Figura 3. Estiramento vibracional CO em cis-Mo(CO)4[P(OPh)3]2.
Procedimento
1. Configuração da Linha Schlenk (para um procedimento mais detalhado, por favor, revise o vídeo "Schlenk Lines Transfer of Solvent" na série Essentials of Organic Chemistry). A segurança da linha Schlenk deve ser revista antes de realizar este experimento. Os vidros devem ser inspecionados para ver rachaduras estelares antes de usar. Deve-se tomar cuidado para garantir que o O2 não seja condensado na armadilha da linha Schlenk se usar o líquido N2. Na temperatura líquida N2, O2 condensa e é explosivo na presença de solventes orgânicos. Se suspeita-se que O2 foi condensado ou um líquido azul é observado na armadilha fria, deixe a armadilha fria sob vácuo dinâmico. NÃO remova a armadilha n2 líquida ou desligue a bomba de vácuo. Com o tempo, o líquido O2 sublimerá na bomba; só é seguro remover a armadilha n2 líquida uma vez que todo o O2 tenha sublimedo.
- Feche a válvula de liberação de pressão.
- Ligue o gás N2 e a bomba de vácuo.
- À medida que o vácuo da linha Schlenk atinge sua pressão mínima, prepare a armadilha fria com gelo/acetona líquido N2 ou gelo seco/acetona.
- Montar a armadilha fria.
2. Síntese de Mo(CO)4[P(OPh)3]2 (Figura 4)1
Nota: Use técnicas padrão de linha Schlenk para a síntese de Mo(CO)4[P(OPh)3]2 (veja o vídeo "Síntese de um Ti(III) Metalloceno Usando técnica de linha Schlenk"). Complexos de carbonyl metálico são uma fonte de CO grátis, que é altamente tóxico. O envenenamento por monóxido de carbono ocorre quando a CO se liga à hemoglobina, resultando em redução significativa do fornecimento de oxigênio ao corpo. Por isso, é extremamente importante tomar as medidas de segurança adequadas ao manusear e trabalhar com complexos de carbonyl metálico. Reações que geram CO grátis precisam ser conduzidas em um capô bem ventilado para evitar a exposição ao gás tóxico.
- Adicionar 1,6 g (4,92 mmol) Mo(CO)4(nbd) (nbd = 2,5-Norbornadiene) e 1,6 mL (9,9 84 mmol) fosfito triphenyl (P(OPh)3) a um frasco schlenk de 100 mL e prepare o frasco schlenk para a transferência de cânula do solvente.
Nota: Mo(CO)4(nbd) ((Bicyclo[2.2.1]hepta-2,5-diene)tetracarbonilmolybdenum(0)) pode ser adquirido da Sigma Aldrich ou sintetizado usando métodos de literatura. 2 - Adicione 20 mL de dichlorometano desgaseado ao frasco de Schlenk via transferência de cânula.
- Mexa a mistura de reação por 4h à temperatura ambiente abaixo de N2.
- Remova os voláteis sob vácuo e lave o precipitado resultante com hexanos frios (duas lavagens cada uma com 10 mL, −78 °C).
- Seque o produto sólido sob vácuo por 15 minutos.
- Meça o espectro de RI do produto em uma solução de hexanos.
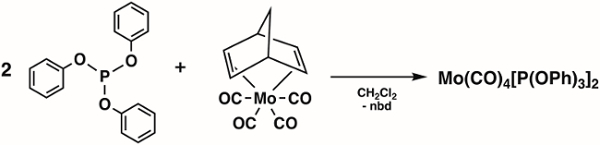
Figura 4. Síntese de Mo(CO)4[P(OPh)3]2.
Resultados

Figura 5. IR de Mo(CO)4[P(OPh)3]2.
Solução IR em hidrocarboneto saturado (cm-1): 2046 (s), 1958 (s), 1942 (vs).
A quarta ressonância só pode ser vista em condições de alta resolução. Portanto, é possível, como neste caso, que apenas 3 das 4 ressonâncias sejam observadas.
Com base no IR obtido, podemos concluir que cis-isômero de Mo(CO)4[P(OPh)3]2 foi isolado.
Aplicação e Resumo
Neste vídeo, aprendemos a usar a teoria do grupo para prever o número de modos vibracionais ativos de IR em uma molécula. Sintetizamos a molécula Mo(CO)4[P(OPh)3]2 e usamos IR para determinar qual isômero foi isolado. Observamos que o produto tinha três vibrações C-O em seu espectro IR, o que é consistente com o cis-isômero.
A teoria do grupo é uma ferramenta poderosa que é usada pelos químicos para não apenas prever modos vibracionais ativos de IR, mas também modos vibracionais, rotacionais e outros modos de baixa frequência observados na espectroscopia de Raman. Além disso, a teoria do grupo é implementada na teoria orbital molecular (MO), que é o modelo mais utilizado para descrever a ligação dentro de complexos metálicos de transição. Os diagramas de MO, usados por químicos orgânicos e inorgânicos, podem prever e explicar a reatividade observada por uma molécula.
1º,2ºe3º linha de complexos de carbonismo metálico são amplamente utilizados na síntese inorgânica como precursores metálicos para compostos organometálicos mais complexos. Alguns dos tipos mais comuns de reações com complexos de carbonyl metálico incluem substituição de ligantes de CO, redox no centro metálico e ataque nucleofílico na unidade de CO. Os próprios complexos de carbonyl metálicos são amplamente utilizados na catálise. Por exemplo, a hidroformiização, a produção industrial de aldeídos a partir de alques, é catalisada pelo complexo de carbonismo metálico HCo(CO)3 (Figura 6).
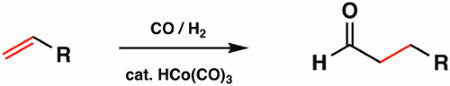
Figura 6. Hidroformiação pelo complexo de carbonyl metálico HCo(CO)3.
Pular para...
Vídeos desta coleção:

Now Playing
Aplicação da Teoria dos Grupos à Espectroscopia de IV
Inorganic Chemistry
45.9K Visualizações

Síntese de um metaloceno de Ti(III) usando a técnica da linha de Schlenk
Inorganic Chemistry
31.7K Visualizações

GloveBox e Sensores de Impurezas
Inorganic Chemistry
18.7K Visualizações

Purificação do ferroceno por sublimação
Inorganic Chemistry
54.7K Visualizações

O Método Evans
Inorganic Chemistry
68.7K Visualizações

Difração de Raios-X de Monocristais e de Pó
Inorganic Chemistry
105.2K Visualizações

Espectroscopia de ressonância paramagnética eletrônica (EPR)
Inorganic Chemistry
25.6K Visualizações

Espectroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizações

Interação Ácido-Base de Lewis em Ph3P-BH3
Inorganic Chemistry
39.0K Visualizações

Estrutura do ferroceno
Inorganic Chemistry
79.8K Visualizações

Teoria do Orbital Molecular (TOM)
Inorganic Chemistry
35.5K Visualizações

Pás de Roda Quádrupla com Ligação Metal-Metal
Inorganic Chemistry
15.3K Visualizações

Células solares sensibilizadas por corante
Inorganic Chemistry
16.0K Visualizações

Síntese de um Complexo de Cobalto(II) Transportador de Oxigênio
Inorganic Chemistry
51.8K Visualizações

Iniciação fotoquímica de reações de polimerização radical
Inorganic Chemistry
17.1K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados