Aplicación de la teoría de grupos a la espectroscopía infrarroja
Visión general
Fuente: Tamara M. Powers, Departamento de química, Texas A & M University
Complejos de metal carbonilo se utilizan como metal precursores para la síntesis de complejos organometálicos como catalizadores. Espectroscopia infrarroja (IR) es uno de los métodos de caracterización más utilizada e informativo de CO que contienen compuestos. Teoría de grupos, o el uso de las matemáticas para describir la simetría de una molécula, proporciona un método para predecir el número de modos vibracionales activos de C O IR dentro de una molécula. Observar experimentalmente que el número de C-O se extiende en el IR es un método directo para establecer la geometría y estructura del carbonilo de metal complejo.
En este video, sintetizamos el molibdeno carbonilo complejo Mo(CO)4[P(OPh)3]2, que pueden existir en las formas cis y trans(figura 1). Usaremos teoría del grupo y la espectroscopia IR para determinar qué isómero aislado.
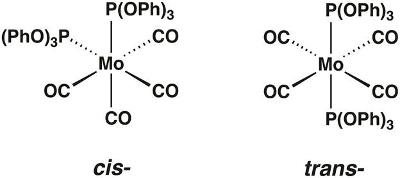
Figura 1. El cis- y trans-isómeros de Mo(CO)4[P(OPh)3]2.
Principios
Reglas de selección:
Reglas de selección determinan el número de transiciones electrónicas de un estado cuántico a otro, que es posible para una molécula dada. Espectroscopia IR sondas transiciones vibracionales de la molécula tierra, v = 0, al primer estado excitado, v = 1. El número de grados de libertad vibracional (modos normales de vibración) para moléculas lineales y no lineales puede calcularse usando la ecuación 1 y ecuación 2, respectivamente.
3N - 5 (1)
3N - 6 (2)
donde N = el número de átomos en la molécula de
De un modo normal de vibración que IR activo, dipolo de la molécula debe cambiar. Por lo tanto, cualquier modos normales de vibración donde no se produce un cambio en el dipolo son IR inactivo. El número de modos de IR activados puede ser determinado mediante teoría de grupos.
Teoría del grupo:
Químicos utilizan teoría de grupos para entender la relación entre la simetría y propiedades físicas de una molécula de. Mientras que el alcance de la teoría del grupo es demasiado amplio para cubrir rigurosamente en este vídeo, nos proporcionará las herramientas necesarias para aplicar teoría de grupos complejos de coordinación simple y mostrar cómo puede utilizarse para predecir el número de modos vibracionales activos IR. Para demostrar, caminaremos a través de la aplicación de la teoría de grupos en la molécula cis -Mo(CO)4[P(OPh)3]2.
En primer lugar, debemos determinar el grupo de punto de la molécula. Grupos de puntos se utilizan para describir los elementos de simetría presentes en una molécula dada. Para determinar el grupo de punto de cis -Mo(CO)4[P(OPh)3]2, podemos usar un diagrama de flujo que se llama un árbol de simetría, que pide una serie de preguntas acerca de los elementos de simetría presentes en la molécula (figura 2). La tabla 1 resume todos los elementos de simetría en el árbol de la simetría. Usando el árbol de la simetría y suponiendo que los ligandos P(OPh)3 son punto de ligandos (ignorando al mismo tiempo la simetría de los ligandos), encontramos cis -Mo(CO)4[P(OPh)3]2 está en el grupo del punto C 2v.

Figura 2. Árbol de simetría utilizado para la determinación del punto de grupo.
Tabla 1. Elementos de simetría utilizan en el punto determinación de grupo.
| Elemento de simetría | Símbolo utilizado | Ejemplo * |
| Identidad | E |  |
| Eje de rotación (rotación de 360 ° /n) |
C n |  |
| Plano de espejo horizontal (reflexión sobre el plano xy) |
Σ h | 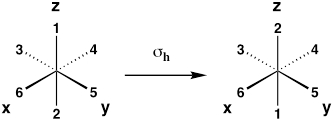 |
| Plano de espejo vertical (reflexión sobre el plano xz o yz) |
Σ v | 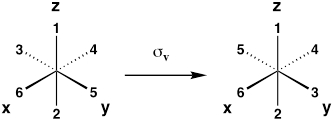 |
| Plano del espejo diagonal (reflexión entre planos xz y yz) |
Σ d | 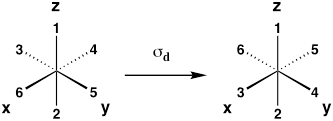 |
| Centro de la inversión | me | 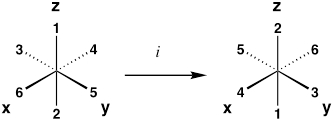 |
| Eje de rotación impropio (rotación de 360 /n ° seguido de reflexión perpendicular al eje de rotación) |
S n |  |
| * Los ejemplos son para un complejo octaédrico, donde ligandos 1–6 son equivalentes. Al efectuar la operación, la molécula resultante debe ser indistinguible de su configuración original. | ||
Para el siguiente paso, tenemos que introducir tablas de caracteres, que describen todas la simetría presente dentro de un grupo determinado. A continuación se muestra la tabla de caracteres para el punto grupo C2v .
| C 2v | E | C 2 | Σ v (xz) | Σ v ' (yz) | ||
| A 1 | 1 | 1 | 1 | 1 | z | x2, y2, z2 |
| A 2 | 1 | 1 | −1 | −1 | Rz | XY |
| B 1 | 1 | −1 | 1 | −1 | x, Ry | XZ |
| B 2 | 1 | −1 | −1 | 1 | y, Rx | YZ |
El grupo punto se indica en la esquina superior izquierda de la tabla de caracteres. A la derecha del punto de grupo, se enumeran todas las operaciones de simetría inherentes a ese grupo de punto.Las filas posteriores la lista todas las representaciones de la simetría (las representaciones irreducibles, representadas por símbolos Mulliken, i.e.,A1) contenida en ese grupo de puntos, junto con la simetría de las funciones, que nos puede decir sobre la simetría de orbitales atómicos como movimiento lineal a lo largo de los ejes x, y y z.
Utilizando la tabla de caracteres para el punto grupo C2v, generar una representación reducible (Γrojo) de los modos de estiramiento C-oh en la molécula cis -Mo(CO)4[P(OPh)3]2 (figura 3 ). La representación reducible, o la combinación lineal de las representaciones irreducibles, puede ser generada por la aplicación de cada una de las operaciones de simetría en la tabla de caracteres a las vibraciones dentro de la molécula y registrar el número de vibraciones O C que permanecen inalterados (en la misma posición en el espacio). Por ejemplo, al aplicar el elemento de simetría de la identidad a las vibraciones de la C O en cis -Mo(CO)4[P(OPh)3]2, cuatro de las flechas vibracionales permanece en la misma posición. Por lo tanto, el primer valor de la representación reducible es 4. Si seguimos este ejercicio, se genera la representación reducible que se muestra a continuación.
| C 2v | E | C 2 | Σ v (xz) | Σ v ' (yz) |
| Γ rojo | 4 | 0 | 2 | 2 |
A continuación, utilizamos la tabla de caracteres C2v para encontrar la combinación lineal de las representaciones irreducibles que genera Γroja para las vibraciones de la C O en cis -Mo(CO)4[P(OPh)3]2. Reducción de la representación reducible puede lograrse utilizando la fórmula de reducción que se muestra en la ecuación 3.
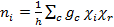 (3)
(3)
donde:
n = número de veces que la representación irreducible ocurre en la representación reducible
h = orden del grupo (número total de operaciones de simetría)
c = la clase de operación
gc = número de operaciones en la clase
Χ = carácter de la representación irreducible para las operaciones de la clase
Χ r = carácter de la representación reducible para las operaciones de la clase
Utilizando la ecuación 3 para cada una de las representaciones irreducibles en la tabla de caracteres C2v, encontramos que Γrojo = 2A1 + B1 + B2. Los tres de las representaciones irreducibles que contribuye, A1, B1y B2, son IR activo porque transforman como el x, y o eje z (ver la simetría de las funciones en el tabla de caracteres). Por lo tanto, podemos predecir que cis -Mo(CO)4[P(OPh)3]2 presenta 4 modos de estiramiento C O en su espectro IR.
Para resumir, los pasos siguientes son necesarios para determinar el número de modos vibracionales activos de IR en una molécula:
1. determinar el grupo de punto de la molécula.
2. generar una representación reducible de las vibraciones de estiramiento C O dentro de la molécula.
3. reducir la representación reducible mediante la ecuación 3.
4. identificar el número de representaciones irreducibles traslacionales presentes en la representación reducida del paso 3.
Siguiendo estos 4 pasos con trans -Mo(CO)4[P(OPh)3]2, encontramos que la molécula posee sólo 1 activo C-O modo vibracional.

Figura 3. CO vibracional se extiende en cis-Mo(CO)4[P(OPh)3]2.
Procedimiento
1. configuración de la línea de Schlenk (para un procedimiento más detallado, por favor revisar el video "Schlenk líneas transferencia de disolvente" de la serie de fundamentos de química orgánica ). Seguridad de línea de Schlenk debe revisarse antes de realizar este experimento. Vidrio debe ser inspeccionado para estrellas grietas antes de su uso. Debe tenerse cuidado para asegurar que el O2 no se condensa en la trampa de la línea de Schlenk si utiliza líquido N2. Temperaturas líquido N2 , O2 se condensa y es explosivo en presencia de solventes orgánicos. Si se sospecha que ha sido condensado O2 o un líquido de color azul se observa en la trampa de frío, deje que la trampa fría bajo vacío dinámico. No retire el líquido N2 purgador o apagar la bomba de vacío. Con el tiempo el líquido O2 se sublime en la bomba; sólo es seguro remover la trampa de2 N líquida una vez de O2 ha sublimado.
- Cierre la válvula de liberación de presión.
- Encienda el gas de N2 y la bomba de vacío.
- Como el Schlenk línea vacío alcanza su presión mínima, preparar la trampa de frío con hielo seco/acetona o líquido N2 .
- Montar la trampa de frío.
2. síntesis de Mo(CO)4[P(OPh)3]2 (Figura 4)1
Nota: Utilizar técnicas de línea de Schlenk estándar para la síntesis de Mo(CO)4[P(OPh)3]2 (ver el video de "Síntesis de una línea de Schlenk de uso de metaloceno Ti(III) técnica"). Complejos de metal carbonilo son una fuente de CO libre, que es altamente tóxico. Intoxicación por monóxido de carbono se produce cuando el CO se une a la hemoglobina, resultando en una reducción significativa del suministro de oxígeno al cuerpo. Por lo tanto, es muy importante tomar medidas de seguridad apropiadas durante la manipulación y trabajo con complejos carbonilo de metal. Reacciones que generan CO libre deban llevarse a cabo en una campana bien ventilada para evitar la exposición al gas tóxico.
- Añadir 1,6 g (4.92 mmol) Mo(CO)4(nbd) (nbd = 2,5-p) y 1.6 mL (9.84 mmol) trifenil fosfito (P(OPh)3) a un matraz de 100 mL Schlenk y preparar el matraz Schlenk para la transferencia de la cánula de solvente.
Nota: Mo(CO)4(nbd) ((Bicyclo[2.2.1]hepta-2,5-diene)tetracarbonylmolybdenum(0)) pueden comprarse en Sigma Aldrich o sintetizado usando métodos de la literatura. 2 - Añadir 20 mL de diclorometano desgasificada al matraz Schlenk vía transferencia de la cánula.
- Revuelva la mezcla de reacción durante 4 h a temperatura ambiente bajo N2.
- Eliminar los volátiles bajo vacío y el resultante lavado precipitan con frío hexanes (dos lavados con 10 mL, 78 ° C).
- Secar el sólido producto bajo vacío durante 15 minutos.
- Medir el espectro IR del producto en una solución de hexanes.
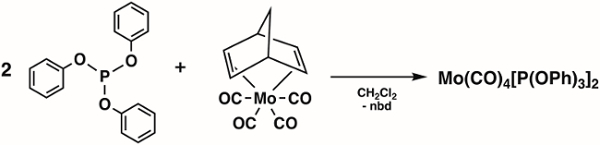
Figura 4. Síntesis de Mo(CO)4[P(OPh)3]2.
Resultados

Figura 5. IR de Mo(CO)4[P(OPh)3]2.
Solución IR en hidrocarburos saturados (cm-1): 2046 (s), 1958 (s), 1942 (vs).
La cuarta resonancia puede verse sólo bajo condiciones de alta resolución. Por lo tanto, es posible, como en este caso, que sólo 3 de las 4 resonancias se observan.
Basado en lo IR obtenido, podemos concluir que cis-isómero de Mo(CO)4[P(OPh)3]2 fue aislado.
Aplicación y resumen
En este video, aprendimos a utilizar teoría de grupos para predecir el número de modos vibracionales activos de IR en una molécula. Había sintetizado la molécula Mo(CO)4[P(OPh)3]2 y usa IR para determinar qué isómero aislado. Observamos que el producto tenía tres vibraciones de la C O en su espectro de IR, que es consistente con el cis-isómero.
Teoría de grupos es una poderosa herramienta que es usada por los químicos predecir no sólo modos vibracionales activos IR, pero también vibracional, rotacional y otros modos de baja frecuencia en espectroscopia de Raman. Además, teoría de grupos se aplica en teoría (MO) orbital molecular, que es el modelo más ampliamente utilizado para describir la vinculación dentro de complejos de metales de transición. Diagramas de MO, utilizadas por químicos orgánicos e inorgánicos, pueden predecir y explicar la reactividad observada de la molécula.
1st, 2ndy 3rd fila metal carbonilo complejos se utilizan ampliamente en síntesis inorgánica como precursores metálicos para compuestos organometálicos más complejos. Algunos de los tipos más comunes de reacciones con complejos carbonilo de metal incluyen sustitución de ligando CO redox en el centro de metal y ataque nucleofílico en la unidad de CO. Carbonilo de metal complejos se utilizan ampliamente en catálisis. Por ejemplo, hidroformilación, la producción industrial de aldehídos de los alkenes, es catalizada por metal carbonilo complejo HCo(CO)3 (figura 6).
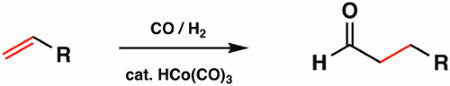
Figura 6. Hidroformilación por el carbonilo de metal complejo HCo(CO)3.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Aplicación de la teoría de grupos a la espectroscopía infrarroja
Inorganic Chemistry
45.9K Vistas

Síntesis de un metaloceno Ti(III) utilizando la técnica de línea de Schlenk
Inorganic Chemistry
31.7K Vistas

Guantera y sensores de impureza
Inorganic Chemistry
18.7K Vistas

Purificación de ferroceno por sublimación
Inorganic Chemistry
54.8K Vistas

El método de Evans
Inorganic Chemistry
68.8K Vistas

Difracción de rayos X de monocristal y de polvos
Inorganic Chemistry
105.2K Vistas

Espectroscopía de resonancia paramagnética electrónica (EPR)
Inorganic Chemistry
25.6K Vistas

Espectroscopía de Mössbauer
Inorganic Chemistry
22.0K Vistas

Interacción ácido-base de Lewis en Ph3P-BH3
Inorganic Chemistry
39.0K Vistas

Estructura del ferroceno
Inorganic Chemistry
79.8K Vistas

Teoría del orbital molecular (MO)
Inorganic Chemistry
35.5K Vistas

Enlance cuadruple de metal a metal en complejos de tipo rueda de paletas
Inorganic Chemistry
15.4K Vistas

Celdas solares teñidas con colorante
Inorganic Chemistry
16.0K Vistas

Síntesis de un complejo de cobalto (II) que transporta oxígeno
Inorganic Chemistry
51.8K Vistas

Iniciación fotoquímica de reacciones de polimerización por radicales libres
Inorganic Chemistry
17.1K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados