O Método Evans
Visão Geral
Fonte: Tamara M. Powers, Departamento de Química da Texas A&M University
Enquanto a maioria das moléculas orgânicas são diamagnéticas, onde todos os seus elétrons são emparelhados em ligações, muitos complexos metálicos de transição são paramagnéticos, que tem estados terrestres com elétrons não pagos. Lembre-se da regra de Hund, que afirma que para orbitais de energias semelhantes, os elétrons preencherão os orbitais para maximizar o número de elétrons não danificados antes de emparelhar. Metais de transição têm orbitais dparcialmente povoados cujas energias são perturbadas em diferentes extensões por coordenação de ligantes ao metal. Assim, os d-orbitais são semelhantes em energia uns aos outros, mas nem todos são degenerados. Isso permite que os complexos sejam diamagnéticos, com todos os elétrons emparelhados, ou paramagnéticos, com elétrons não pagos.
Conhecer o número de elétrons não recados em um complexo metálico pode fornecer pistas sobre o estado de oxidação e geometria do complexo metálico, bem como para a força do campo de ligante (campo cristalino) dos ligantes. Essas propriedades impactam muito a espectroscopia e a reatividade dos complexos metálicos de transição, e por isso são importantes de entender.
Uma maneira de contar o número de elétrons não analisados é medir a suscetibilidade magnética, χ,do composto de coordenação. Suscetibilidade magnética é a medida de magnetização de um material (ou composto) quando colocado em um campo magnético aplicado. Elétrons emparelhados são ligeiramente repelidos por um campo magnético aplicado, e essa repulsa aumenta linearmente à medida que a força do campo magnético aumenta. Por outro lado, elétrons não pagos são atraídos (em maior medida) para um campo magnético, e a atração aumenta linearmente com a força do campo magnético. Portanto, qualquer composto com elétrons não ressarcidos será atraído para um campo magnético. 1
Quando medimos a suscetibilidade magnética, obtemos informações sobre o número de elétrons não ressarrados a partir do momento magnético, μ. A suscetibilidade magnética está relacionada ao momento magnético, μ pela Equação 12:
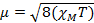 (1)
(1)
A constante  = [(3kB)/Nβ2)], onde β= ímã bohr do elétron (0,93 x 10-20 erg gauss-1), N = número de Avogadro, e kB = Boltzmann constante
= [(3kB)/Nβ2)], onde β= ímã bohr do elétron (0,93 x 10-20 erg gauss-1), N = número de Avogadro, e kB = Boltzmann constante
XM= suscetibilidade magnética molar (cm3/mol)
T = temperatura (K)
μ = momento magnético, medido em unidades de bohr magneton, μB = 9,27 x 10-24 JT-1
O momento magnético para complexos é dado pela Equação 21:
 (2)
(2)
g = razão gyrommagnética = 2,00023 μB
S = número quântico de spin = ∑ms = [número de elétrons não pagos, n]/2
L = número quântico orbital = ∑ml
Esta equação tem contribuições orbitais e de rotação. Para complexos metálicos de transição de primeira linha, a contribuição orbital é pequena e, portanto, pode ser omitida, de modo que o momento magnético somente de spin é dado pela Equação 3:
 (3)
(3)
O momento magnético somente de spin pode, assim, dar diretamente o número de elétrons não verificados. Esta aproximação também pode ser feita para metais mais pesados, embora as contribuições orbitais possam ser significativas para metais de transição de segunda e terceira fileiras. Essa contribuição pode ser tão significativa que infla o momento magnético suficiente para que o composto pareça ter mais elétrons não pagos do que ele. Portanto, pode ser necessária uma caracterização adicional para esses complexos.
Neste experimento, a solução do momento magnético de tris (acetylacetonato)ferro(III) (Fe(acac)3) é determinada experimentalmente usando o método Evans em clorofórmio.
Princípios
Existem muitos métodos para medir a suscetibilidade magnética. No final do séculoXIX, Louis Georges Gouy desenvolveu o equilíbrio gouy, que é um método altamente preciso para medir a suscetibilidade magnética. Nesta abordagem, um equilíbrio analítico é usado para massa de um ímã, e a mudança de massa observada ao colocar uma amostra paramagnética entre os polos do ímã está relacionada à suscetibilidade magnética. Este método não é prático, pois suspender a amostra entre os polos do ímã não é trivial. Isso requer quatro medições de massa entre as quais o ímã não pode se mover, e para amostras sensíveis ao ar, esta medida deve ser conduzida dentro de um porta-luvas. Saldos de suscetibilidade magnética mais modernos estão disponíveis, mas isso requer a compra de tal saldo.
Outro método é usar um magnetômetro SQUID (Dispositivo de Interferência Quântica Supercondutor). Isso requer vários mg de amostra sólida, e a menos que outras medidas magnéticas sejam feitas na amostra, não é prático ou econômico para complexos paramagnéticos que podem ser transformados em soluções.
Finalmente, e o que será demonstrado aqui, é o uso de um espectrômetro NMR para medir a suscetibilidade magnética. Esta abordagem foi desenvolvida por Dennis Evans em 1959. É simples e se baseia no efeito que uma paranímagneta na solução tem sobre a mudança química de um composto de referência, geralmente o solvente. A coleta de dados pode ser feita em qualquer espectrômetro de RMN, os dados são fáceis de interpretar e a preparação da amostra é simples e requer pouco material. Tornou-se o método padrão para obter dados de suscetibilidade magnética para complexos inorgânicos.
A medição da suscetibilidade magnética pelo método Evans baseia-se no fato de que os elétrons não persitizados da solução paramagneta resultarão em uma mudança da mudança química de todas as espécies em solução(Figura 1). Assim, observando a diferença de mudança química de uma molécula solvente na presença e ausência de uma espécie paramagnética, a suscetibilidade magnética pode ser obtida através da Equação 4 (para um espectrômetro de RN de alto campo)3
 (4)
(4)
Δf = diferença de frequência em Hz entre a ressonância deslocada e a ressonância pura do solvente
F = radiofrequência de espectrômetro em Hz
c = concentração de espécies paramagnéticas (mol/mL)
Os dados são prontamente obtidos coletando um espectro de 1H NMR de uma amostra que contém um capilar de solvente puro, com uma solução da paramueta em torno do capilar dentro do tubo NMR(Figura 2).

Figura 1. Exemplo 1H espectro NMR do experimento

Figura 2. Imagem de um capilar na configuração do tubo NMR
Procedimento
1. Preparação da Inserção Capilar
- Usando um isqueiro ou outra chama de gás, derreta a ponta de uma pipeta pasteur longa. Gire suavemente a ponta da pipeta na chama até formar uma pequena lâmpada. Deixe o vidro esfriar.
- Em um frasco de cintilação, prepare uma solução de 50:1 (volume) de clorofórmio deuterado:proteo. Pipeta 2 mL de solvente deuterado, e a este adicionar 40 μL de solvente proteo. Tampe o frasco.
- Adicione cuidadosamente algumas gotas da mistura de solvente à pipeta de vidro selada. Gire suavemente a ponta da pipeta selada para que o líquido entre no capilar. Repita até que a solução tenha uma profundidade de ~ 2 polegadas da parte inferior do capilar. Certifique-se de que não há bolhas de ar.
- Tampe a pipeta com um septo de borracha 14/20. Usando uma seringa de 3 mL tampada com uma agulha, insira a agulha na pipeta e retire 3 mL de ar. Isso cria um vácuo parcial, facilitando o próximo passo.
- Sele o topo do capilar. Fixar horizontalmente a pipeta em um suporte de anel. Use um isqueiro para suavizar o vidro acima da solução na parte inferior da pipeta. Uma vez que o vidro amoleça, comece a girar a ponta da pipeta e puxe a ponta da pipeta para longe da base presa. Deixe o capilar selado esfriar.
2. Preparação da Solução Paramagnética
- Utilizando um equilíbrio analítico, massa um frasco de cintilação e tampa. Note a massa.
- Masse 5-10 mgs do Fe(acac)3 no frasco de cintilação, e note a massa. Fe(acac)3 tem um momento magnético de solução muito alta. Portanto, 5-10 mgs gerará uma grande mudança da mudança química. Normalmente, 10 - 15 mgs é uma massa mais apropriada para usar para amostras do método Evans.
- Pipeta ~600 μL da mistura de solvente preparado no frasco contendo as espécies paramagnéticas. Tampe o frasco, e note a massa. Certifique-se de que o sólido se dissolva completamente.
3. Preparação da Amostra de NMR
- Em um tubo NMR padrão, solte cuidadosamente a inserção capilar em um ângulo, para garantir que ela não o quebre.
- Pipeta na solução contendo as espécies paramagnéticas.
- Tampe o tubo NMR. Para amostras sensíveis ao ar, enrole Parafilm em torno da tampa.
4. Coleta de dados
- Adquira e salve um espectro NMR padrão de 1H.
- Note a temperatura da sonda.
- Note a radiofrequência.
5. Análise e Resultados de Dados
- Utilizando a massa e a densidade do solvente, calcule o volume do solvente utilizado para preparar a solução paramagnética.
- Calcule a concentração (M) da solução paramagnética.
- Calcule o pico de separação da ressonância solvente entre a de solvente puro (no capilar) e que mudou pela paramuense (fora do capilar) (Δppm). Se isso for feito em ppm, converta-o em Hz pela Equação 5:
 (5)
(5)
F = radiofrequência de espectrômetro em Hz - Calcule a suscetibilidade magnética usando a Equação 4.
- Calcule o momento magnético usando a Equação 1.
- Compare o momento magnético obtido com o previsto para n elétrons não verificados da Equação 3. A suscetibilidade magnética será ligeiramente maior do que o valor esperado apenas de spin dado na tabela, mas deve ser menor do que o que corresponde a elétrons n+1 não verificados.
- Dê o número de elétrons não pagos para as espécies paramagnéticas.
6. Solução de problemas
- Se dois picos de solventes bem resolvidos não forem observados, tente o seguinte:
- Use um espectrômetro com maior força de campo para aumentar a diferença de mudança química (em ppm) dos dois picos.
- Faça a amostra mais concentrada, para que a mudança seja maior.
- Às vezes, o valor não faz sentido. Se um valor muito baixo for obtido, tente o seguinte:
- Repito, tomando maior cuidado na massia das espécies solventes e paramagnéticas.
- Certifique-se de que a espécie paramagnética que está sendo usada é pura. Mesmo impurezas solventes em cristais afetarão a massa e, consequentemente, a concentração.
- Para moléculas grandes, o diamagnetismo pode ser tão significativo que uma correção diamagnética deve ser feita. Este termo é subtraído para a Equação 4:

- Às vezes, o valor não faz sentido. Se um valor muito alto for obtido, tente o seguinte:
- Siga os mesmos passos de 6.2.1-6.2.3.
- Para metais mais pesados, a inclusão de contribuições orbitais pode ser necessária.
7. Amostras sensíveis ao ar
- Amostras sensíveis ao ar podem ser facilmente analisadas usando essa técnica. As etapas 1.2-1.4, passo 2 e passo 3 são simplesmente realizadas dentro de um porta-luvas.
Resultados
Experimental Resultados
| Fe(acac)3 | Clorofórmio | |
| m (g) | 0.0051 | 0.874 |
| MW (g/mol) | 353.17 | n/a |
| n (mol) | 1.44⋅10-5 | n/a |
| Densidade (g/mL) | n/a | 1.49* |
| Volume (mL) | n/a | 0.587 |
| c (mol/mL) | 2.45⋅10-5 | |
| Mudanças de NMR | Pico 1 | Pico 2 |
| δ (ppm) | 7.26 | 5.85 |
| Δppm | 1.41 | |
| Instrumento NMR | ||
| Temperatura (K) | 296.3 | |
| Campo, F (Hz) | 500⋅106 |
* a densidade do solvente pode ser aproximada à densidade do solvente utilizado
Cálculos:

 = 0,0137 cm3/mol
= 0,0137 cm3/mol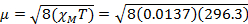 = 5,70 μB
= 5,70 μB
Resultados Teóricos para Valores S e n Dados:
| S | n | μS |
| 1/2 | 1 | 1.73 |
| 1 | 2 | 2.83 |
| 3/2 | 3 | 3.87 |
| 2 | 4 | 4.90 |
| 5/2 | 5 | 5.92 |
Para 4,5 mg de Fe(acac)3 dissolvido em solvente de 0,58 mL, com um instrumento de 300 MHz é observada uma separação máxima de 1,41 ppm, o que dá XM= 1,37 x 10-2 e μeff = 5,70. Este μ valoreff é consistente com um complexo S = 5/2, que tem 5 elétrons não pagos.
Aplicação e Resumo
O método Evans é um método simples e prático para obter a suscetibilidade magnética de complexos metálicos solúveis. Isso fornece o número de elétrons não ressequerados em um complexo metálico, que é pertinente à espectroscopia, propriedades magnéticas e reatividade do complexo.
Medir a suscetibilidade magnética de espécies paramagnéticas dá o número de elétrons não ressarrados, que é uma propriedade fundamental dos complexos metálicos. Como a reatividade dos complexos metálicos é influenciada por sua estrutura eletrônica - ou seja, como os orbitais d são povoados - é importante estabelecer o número de elétrons não verificados. A suscetibilidade magnética pode ser usada para determinar a geometria do complexo metálico em solução, dar uma visão da força do campo ligante, e pode fornecer evidências para a correta atribuição formal de estado de oxidação do complexo metálico. Nos módulos de "Teoria do Grupo" e "Teoria mo dos complexos metálicos de transição", apresentaremos como prever diagramas de divisão d-orbital, bem como como usar dados do método Evans para ajudar a determinar a geometria de um complexo metálico e fornecer evidências para o estado de oxidação do centro metálico.
Existem vários instrumentos que podem ser usados para medir a suscetibilidade magnética de uma espécie paramagnética, incluindo um equilíbrio gouy, lula ou instrumento NMR. O método Evans é uma técnica simples e prática que usa NMR para determinar o momento magnético da solução de uma paranímagneta. Embora o método Evans seja uma ferramenta poderosa no campo do magnetismo, há várias desvantagens na técnica. Primeiro, a molécula deve ser solúvel no solvente usado no experimento. Se a amostra paramagnética não estiver totalmente dissolvida, a concentração da solução será incorreta, o que levará a erros no momento magnético da solução experimentalmente determinada. Outros erros de concentração podem surgir se a amostra paramagnética tiver impurezas diamagnéticas (solventes) ou paramagnéticas.
Referências
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry. 5 ed. Pearson. (2014).
- Drago, R. S. Physical Methods for Chemists. 2 ed. Saunders College Publishing. (1992).
- Girolami, G. S., Rauchfuss, T. B., Angelici, R. J. Synthesis and Technique in Inorganic Chemistry: A Laboratory Manual. 3 ed. University Science Books. Sausalito, CA, (1999).
Pular para...
Vídeos desta coleção:

Now Playing
O Método Evans
Inorganic Chemistry
68.7K Visualizações

Síntese de um metaloceno de Ti(III) usando a técnica da linha de Schlenk
Inorganic Chemistry
31.6K Visualizações

GloveBox e Sensores de Impurezas
Inorganic Chemistry
18.6K Visualizações

Purificação do ferroceno por sublimação
Inorganic Chemistry
54.7K Visualizações

Difração de Raios-X de Monocristais e de Pó
Inorganic Chemistry
104.8K Visualizações

Espectroscopia de ressonância paramagnética eletrônica (EPR)
Inorganic Chemistry
25.6K Visualizações

Espectroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizações

Interação Ácido-Base de Lewis em Ph3P-BH3
Inorganic Chemistry
39.0K Visualizações

Estrutura do ferroceno
Inorganic Chemistry
79.6K Visualizações

Aplicação da Teoria dos Grupos à Espectroscopia de IV
Inorganic Chemistry
45.6K Visualizações

Teoria do Orbital Molecular (TOM)
Inorganic Chemistry
35.4K Visualizações

Pás de Roda Quádrupla com Ligação Metal-Metal
Inorganic Chemistry
15.3K Visualizações

Células solares sensibilizadas por corante
Inorganic Chemistry
15.8K Visualizações

Síntese de um Complexo de Cobalto(II) Transportador de Oxigênio
Inorganic Chemistry
51.7K Visualizações

Iniciação fotoquímica de reações de polimerização radical
Inorganic Chemistry
16.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados