Method Article
Otimizando a entrega de vesículas extracelulares usando um andaime bioimpresso em 3D com bainha central para tratamento de feridas crônicas
Neste Artigo
Resumo
Este estudo apresenta um protocolo para a fabricação de andaimes bioimpressos em 3D para cicatrização de feridas crônicas. As vesículas extracelulares são isoladas de células-tronco mesenquimais e carregadas no núcleo (alginato) com a bainha feita de carboximetilcelulose e alginato liase. Este projeto permite a degradação controlada do andaime e a liberação eficiente de EVs.
Resumo
Este estudo descreve um protocolo detalhado para a fabricação de andaimes bioimpressos em 3D com bainha central projetados para melhorar a cicatrização de feridas crônicas. O protocolo envolve o isolamento de vesículas extracelulares (EVs) de células-tronco mesenquimais (MSCs), conhecidas por suas propriedades regenerativas e imunomoduladoras. Esses EVs são então incorporados em uma estrutura de andaime exclusiva. O andaime apresenta um núcleo composto de alginato carregado com EVs, cercado por uma bainha feita de carboximetilcelulose e alginato liase. Este design inovador garante a degradação controlada do andaime, promovendo a liberação eficiente e controlada de EVs no local da ferida. O protocolo abrange as principais etapas, incluindo a preparação e caracterização dos EVs, a formulação de biotintas para bioimpressão 3D e a otimização dos parâmetros de impressão para alcançar a arquitetura de revestimento central desejada. Ao combinar integridade estrutural e bioatividade, o andaime visa abordar as limitações dos curativos convencionais, oferecendo uma abordagem direcionada para acelerar a regeneração do tecido e reduzir a inflamação em feridas crônicas. Este método fornece uma estratégia reprodutível e escalável para o desenvolvimento de biomateriais avançados com potenciais aplicações clínicas no tratamento de feridas crônicas. O protocolo também destaca considerações críticas para alcançar resultados consistentes, garantindo adaptabilidade para futuras aplicações terapêuticas.
Introdução
Feridas crônicas, muitas vezes ligadas à inflamação excessiva, requerem tratamento oportuno para evitar complicações graves, como infecções e necrose tecidual, que podem levar a amputações. Apesar dos avanços, os tratamentos atuais permanecem caros, inconvenientes, com efeitos colaterais e eficácia limitada, destacando a necessidade de curativos mais curativos 1,2,3. O desenvolvimento de uma nova geração de curativos projetados especificamente para feridas crônicas é essencial para enfrentar esses desafios. Além disso, a natureza complexa da cicatrização de feridas exige materiais de curativos com uma variedade de propriedades, incluindo hidratação, flexibilidade, adesão, bioatividade e biodegradabilidade4. Este estudo tem como objetivo desenvolver um curativo de bioengenharia que integre vesículas extracelulares (EVs) com um andaime bioimpresso em 3D para fornecer um ambiente terapêutico controlado e acelerar a cicatrização crônica de feridas.
As EVs derivadas de células-tronco auxiliam na cicatrização de feridas crônicas, promovendo respostas anti-inflamatórias, crescimento celular, migração e formação de vasos sanguíneos5. Além disso, os EVs podem fornecer moléculas bioativas, incluindo medicamentos de moléculas pequenas, construções de genes e proteínas para o tratamento de feridas crônicas6. Além disso, sua capacidade de proteger a carga da degradação enzimática melhora a estabilidade e a biodisponibilidade dos agentes terapêuticos, oferecendo vantagens distintas sobre os fatores de crescimento convencionais e os medicamentos de moléculas pequenas, que muitas vezes se degradam rapidamente in vivo7. Apesar dessas vantagens, a entrega eficiente e sustentada de EVs aos tecidos-alvo continua sendo um desafio significativo.
Os andaimes de bioimpressão 3D podem servir como uma plataforma de entrega para EVs para aumentar seus efeitos terapêuticos8. Esses andaimes imitam ambientes celulares naturais e permitem a liberação controlada de EVs 9,10. Eles também protegem os EVs da degradação, aumentando a estabilidade de seus microRNAs e proteínas11. Han et al. demonstraram que os EVs podem ser efetivamente liberados de andaimes GelMA bioimpressos em 3D. Essa liberação levou a uma melhor fixação celular e maior expressão gênica relacionada às vias de mecanotransdução em células-tronco mesenquimais da almofada de gordura bucal humana (hBFP-MSCs) semeadas nos andaimes12. Born et al., otimizando a concentração do reticulador, alcançaram uma liberação controlada dos EVs. Essa abordagem demonstrou eficácia na promoção da angiogênese e oferece um método promissor para a entrega regulada de EVs13.
A bioimpressão 3D com bainha central permite a criação de estruturas complexas e multimateriais, imprimindo um material central envolto em uma bainha. O núcleo pode incluir células, fatores de crescimento ou drogas, enquanto a bainha oferece suporte mecânico e proteção ou atua como uma barreira. Este método tem aplicações em engenharia de tecidos e medicina regenerativa, como o desenvolvimento de redes vasculares, imitação de estruturas de tecidos naturais e criação de sistemas de administração de medicamentos. Permite um controle preciso sobre a distribuição e composição do material, aumentando a funcionalidade e a relevância biológica dos construtos. Em comparação com técnicas alternativas, a bioimpressão 3D com bainha de núcleo fornece controle preciso sobre a distribuição e composição do material, melhorando a funcionalidade e a relevância biológica das construções14,15.
A degradação projetada em curativos oferece benefícios como redução do desconforto durante as trocas, um ambiente úmido para cicatrização e controle de infecção, administração terapêutica oportuna e regeneração tecidual ideal 16,17,18. Os hidrogéis de alginato (Alg) e carboximetilcelulose (CMCh) são biocompatíveis e eficazes para fornecer vesículas extracelulares (EVs) a feridas, melhorando a cicatrização por meio da comunicação celular e redução da inflamação18. Neste estudo, os EVs foram integrados em um núcleo de Alg, enquanto uma bainha de CMCh e AlgLiase (AlgLiase) foi usada para permitir a rápida degradação do curativo e a entrega de EVs. Este design de bainha central facilita a liberação rápida de EVs em resposta à degradação do andaime, aumentando sua eficácia terapêutica e abordando as limitações dos tratamentos de feridas crônicas existentes. O objetivo principal deste estudo é desenvolver um curativo de bioengenharia que melhore a cicatrização de feridas, integrando a liberação controlada de EVs com um andaime degradável responsivo, melhorando os resultados do tratamento para feridas crônicas.
Protocolo
A pesquisa com animais foi conduzida em total conformidade com os padrões éticos estabelecidos pelo Comitê Nacional de Bioética e pelo Comitê de Ética Animal da Universidade de Nizwa. A aprovação ética para este estudo foi concedida sob autorização ID: VCGSR, AREC/01/2023. Todos os animais foram alojados em condições laboratoriais padrão, garantindo controles ambientais ideais, nutrição adequada e cuidados abrangentes para salvaguardar seu bem-estar durante todo o estudo. Todos os procedimentos envolvendo animais aderiram estritamente às políticas institucionais, aos padrões internacionais de cuidados com os animais e às diretrizes ARRIVE.
1. Cultura de células
- Recupere um frasco de MSCs (passagem # 2) do armazenamento de nitrogênio líquido e manuseie-o com técnicas assépticas para evitar contaminação. Descongele rapidamente as células em banho-maria a 37 °C, certificando-se de removê-las assim que restar um pequeno fragmento de gelo.
- Prepare um meio completo, incluindo MSC SFM Basal Medium, suplementado com 1% (v/v) de suplemento MSC SFM XenoFree, 1% (v/v) de GlutaMAX e 0,01% (v/v) de gentamicina. Adicione 1 ml de meio completo pré-aquecido (37 °C) a uma taxa de 3 a 5 gotas de 5 em 5 segundos ao frasco para injetáveis e, em seguida, misture suavemente. Transfira todo o conteúdo do frasco para injetáveis de MSCs em um tubo cônico de 15 mL contendo 4 mL de meio completo pré-aquecido, sob condições assépticas em um gabinete de biossegurança Classe II.
- Centrifugue as células a 200 x g por 5 min em temperatura ambiente. Certifique-se de que a centrífuga esteja balanceada adequadamente.
- Aspire o sobrenadante e ressuspenda as células em 1 mL de meio completo pré-aquecido. Em seguida, transfira as células para um frasco T25 contendo 4 mL de meio completo.
- Incline suavemente o frasco para garantir que as células estejam uniformemente distribuídas. Incubar o balão a 37 °C com 5% de CO2.
- Troque o meio a cada 2 dias, substituindo-o por meio novo, pré-aquecido e completo. Use pipetagem suave para evitar a ruptura celular. Ao atingir 70%-80% de confluência, aspirar o meio gasto do balão T25.
- Lave as células com 3 mL de PBS fresco para remover os resíduos. Assegurar uma cobertura completa do balão durante a lavagem.
- Adicione 1 mL de solução de tripsina a 0,25% ao frasco T25, incube-o a 37 ° C por 3-7 min e monitore cuidadosamente o descolamento ao microscópio com aumento de 4x.
- Bata suavemente no balão, se necessário, para garantir o desprendimento completo das células. Adicione meio completo pré-aquecido ao frasco e pipete para cima e para baixo sobre a superfície para ajudar a separar as células. Em seguida, transfira a suspensão celular para um tubo de centrífuga de 15 mL.
- Centrifugue o tubo a 200 x g por 5 min em temperatura ambiente. Suspenda o pellet celular em um meio fresco e completo e conte as células usando um hemocitômetro Neubauer. Transferir as células para um balão T75. Garanta uma densidade de semeadura de 5.000 células/cm2 para um crescimento ideal.
- Incubar as células a 37 °C com 5% de CO2. Após 72 h de incubação celular, coletar o meio condicionado das células para isolamento de EVs. Use imediatamente após a coleta.
2. Isolamento de EVs
- Centrifugue os 13 mL do meio condicionado coletado a 800 x g por 15 min para remover os detritos celulares. Filtrar o sobrenadante suavemente utilizando um filtro de seringa de 0,22 μm para remover partículas grandes.
- Adicione 5 mL de tampão de precipitação ao meio condicionado filtrado e vortex completamente para misturar. Certifique-se de que a solução seja homogênea.
- Incubar a mistura durante a noite a 4 °C para permitir que os EVs precipitem. Centrifugar a mistura a 3.220 x g durante 30 min a 20 °C. Verifique o equilíbrio dos tubos.
- Rejeitar cuidadosamente o sobrenadante sem perturbar o sedimento. Centrifugue o pellet mais uma vez a 3.220 x g por 5 s para remover o líquido residual.
- Pipete suavemente o pellet EV em 200 μL de PBS para evitar danos aos EVs. Meça a concentração de proteína EVs seguindo as instruções do fabricante (Kit de ensaio de proteína BCA).
- Realize Western blotting para detectar marcadores específicos de EV (CD63, CD81 e CD9), para verificar o fenótipoEV 18. A análise confirmou a presença desses marcadores, validando a identidade das VEs19.
- Para minimizar o risco de contaminação por RNase, recomenda-se usá-lo diretamente sem armazenamento adicional. Caso seja necessário, armazene os EVs a -80 °C para uso posterior. Alicote a suspensão dos EVs em volumes de 40 μL para evitar ciclos repetidos de congelamento e descongelamento.
3. Rotulagem de EVs com PKH-26
- Preparação do tampão
- Dissolva 0,238 g de HEPES em aproximadamente 90 mL de água ultrapura estéril em um recipiente estéril. Use uma solução HEPES recém-preparada. Adicione 0,85 g de NaCl à solução HEPES.
- Ajuste o pH para 7.4 usando 1 M NaOH ou HCl, conforme necessário, usando um medidor de pH calibrado. Adicione água deionizada para elevar o volume total para 100 mL. Filtrar a solução através de um filtro de 0,22 μm para a esterilizar.
- Dilua 4 μL de corante PKH-26 em 1 mL de tampão preparado. Misture bem com pipeta para garantir a homogeneidade.
- Ressuspenda EVs purificados em 1 mL de PBS a uma concentração de 700 μg / mL. Adicione 1 mL da suspensão EVs a 1 mL da solução PKH-26 preparada. Para o grupo de controle somente corante, adicione 1 mL de meio completo sem EVs a 1 mL da solução de PKH-26. Todas as etapas subsequentes são realizadas para o grupo de controle, bem como para levar em conta a possível agregação inespecífica ou formação de micelas.
- Misture bem os EVs invertendo suavemente o tubo 10x-15x. Incube a mistura por 3-5 min em temperatura ambiente, garantindo uma exposição uniforme dos EVs ao corante.
- Prepare uma solução fresca de 2 mL de BSA a 1% usando água ultrapura estéril e adicione-a aos 2 mL da mistura resultante para extinguir a reação de rotulagem. Misture delicadamente para evitar a agregação.
- Concentre os EVs marcados com PKH-26 de acordo com o protocolo acima mencionado (etapas 2.2-2.7). Ressuspenda os EVs marcados em 300 μL de PBS. Pipete a amostra de EVs marcados com PKH-26 em um tubo de filtro de 30 kDa.
- Centrifugar a amostra a 3.220 x g durante 30 min a 4 °C. Durante esta etapa, o corante PKH-26 livre e pequenas moléculas passarão pela membrana para o filtrado, enquanto os EVs marcados com PKH-26 serão retidos no retentado.
- Após a centrifugação inicial, rejeitar o filtrado e adicionar 300 μl de PBS ao retentado. Ressuspenda suavemente os EVs no PBS pipetando para cima e para baixo.
- Centrifugar novamente a amostra a 3.220 x g durante 30 min a 4 °C para eliminar qualquer corante livre restante ou pequenas moléculas.
- Confirmar a ausência de PKH-26 na solução filtrada por um microscópio fluorescente. Se algum corante for detectado, repita as etapas de lavagem.
- Recolher a solução superior com uma micropipeta e retirar o filtro do tubo de recolha. Inverta cuidadosamente o filtro (vire-o de cabeça para baixo).
- Centrifugue o filtro invertido a 800 x g durante 5 min a 4 °C. Isso ajudará a coletar os PKH-26-EVs retidos da membrana do filtro para o novo tubo de coleta. Use diretamente os PKH-26-EVs para a próxima etapa.
4. 3D Bioimpressão
- Preparação de biotintas
- Prepare uma solução fresca de Alg de sódio a 4,5% (p / v) usando água ultrapura estéril. Agitar durante a noite a 60 °C para permitir que a solução se dissolva completamente.
- Dissolva o CMCh em água ultrapura estéril para obter uma solução a 3,8% (p / v). Prepare fresco. Mexa durante a noite a 60 °C para dissolver completamente.
- Centrifugue as biotintas preparadas a 3.220 x g por 10 min a 25°C para remover quaisquer bolhas que possam interferir no processo de impressão.
- Misture os 3 mL preparados de solução de Alg com os EVs rotulados ou o controle somente de corante usando um misturador de seringa para atingir a concentração de 0,01% (p / v) de EVs. Garanta uma distribuição uniforme por meio de uma mistura suave.
- Usando um misturador de seringas, combine 1 mL de CMCh com uma solução de AlgLiase recém-preparada em água ultrapura estéril para atingir uma concentração final de 0,5 mU/mL.
- Conforme ilustrado na Figura 1A, carregue simultaneamente a biotinta Alg/Exo na parte central e a biotinta CMCh/AlgLiase na parte da bainha da configuração da seringa núcleo/bainha.
- Deixe as biotintas descansarem por 15 minutos antes de imprimir.
- Configuração da impressora biológica 3D
- Usando o software de bioimpressora 3D, crie a estrutura do andaime selecionando uma forma cilíndrica com um padrão de preenchimento diagonal. Para isso, defina o diâmetro e a altura do cilindro para 20 mm e 1.1 mm, respectivamente. Configure o tamanho do poro para 1 mm.
- Defina as velocidades de bombeamento do núcleo e do bico da bainha para 1 mm/s com uma espessura de 0.25 mm por camada e defina a velocidade de movimento para 6 mm/s. Imprima quatro camadas com uma espessura de 0,25 mm por camada à temperatura ambiente.
- Comece a imprimir em filme de poliéster.
- Use o umidificador com cloreto de cálcio em aerossol (2.2%) para reticular o andaime durante o processo de extrusão. Posicione o bico do umidificador a aproximadamente 20 cm de distância do cabeçote de extrusão para garantir uma reticulação eficaz sem comprometer a estrutura do andaime. Para reticulação adicional, mergulhe o andaime em solução de cloreto de cálcio (2.2%) por 10 min.
- Enxágue o andaime 3x com água ultrapura estéril para remover qualquer excesso de cloreto de cálcio e bioink não ligado.
- Certifique-se de que o andaime seja armazenado em um ambiente estéril a 4 °C para manter a integridade e a funcionalidade do andaime por até três meses.
5. Rastreamento do lançamento de EVs
- Criação de modelo de ferida cutânea circular
- Anestesie camundongos diabéticos heterozigotos Akita machos (8 semanas) administrando uma injeção intraperitoneal de cetamina (70 mg / kg) e xilazina (10 mg / kg). Confirme a anestesia adequada avaliando a ausência de respostas reflexas (por exemplo, pinça do dedo do pé) e monitore a frequência respiratória. Para evitar o ressecamento da córnea durante a anestesia, aplique pomada oftálmica veterinária estéril nos olhos.
- Prepare a área da pele dorsal raspando-a primeiro usando um aparador elétrico. Evite irritação ou lesões na pele. Esterilize a área depilada com uma solução de iodopovidona.
- Usando um aparador estéril, crie uma ferida cutânea circular de 6 mm de espessura total na superfície dorsal de cada camundongo.
- Coloque suavemente o andaime bioimpresso em 3D contendo EVs com etiqueta PKH diretamente no leito da ferida. Certifique-se de que o andaime cubra totalmente a superfície da ferida com bolsas de ar mínimas, pressionando levemente usando uma pinça estéril. Certifique-se de que o animal seja observado de perto após o procedimento e permaneça atendido até que recupere totalmente a consciência e possa manter a decúbito esternal.
- Imagem fluorescente
- Às 2 h, 4 h, 8 h, 24 h pós-implantação, anestesiar os camundongos usando isoflurano. Para indução da anestesia, coloque os camundongos na câmara do sistema de imagem in vivo (IVIS) e exponha-os a 2%-3% de isoflurano em oxigênio. Aplique pomada oftálmica nos olhos dos camundongos para evitar o ressecamento. Uma vez anestesiados, transfira os camundongos para o sistema IVIS e mantenha-os com 1% -2% de isoflurano em oxigênio fornecido pelos canais nasais. Verifique se os animais estão totalmente anestesiados e estáveis antes de prosseguir com a imagem.
- Use o sistema IVIS para capturar os sinais fluorescentes dos EVs marcados com PKH liberados do andaime. No assistente de imagem, selecione a opção Imagem de fluorescência e ative os filtros de excitação e emissão para o corante PKH. Ajuste as configurações da câmera, incluindo o campo de visão e a altura do assunto, para otimizar a detecção do sinal. Garanta um posicionamento consistente em todos os pontos de tempo da imagem para permitir comparações precisas. Comece a adquirir imagens e salve os dados resultantes.
- Quantifique as intensidades do sinal fluorescente usando o software IVIS. Isso permitirá o rastreamento do lançamento de EVs ao longo do tempo.
Resultados
A liberação in vivo de EVs dos andaimes Alg-EVs/CMCh e Alg-EVs/CMCh-AlgLiase é representada na Figura 1B,C. Como previsto, o andaime Alg-EVs/CMCh-AlgLiase exibiu um perfil de liberação mais rápida em comparação com Alg-EVs/CMCh, particularmente nos pontos de tempo de 2 h e 4 h. A liberação de EVs dos hidrogéis é governada por uma combinação de mecanismos físico-químicos, incluindo difusão, inchaço, erosão e degradação20. Ao alavancar o Alglyase, o andaime facilita a quebra do Alg, acelerando a liberação de EVs para controlar com eficiência a inflamação crônica nos estágios iniciais da cicatrização de feridas. A liberação precoce de EVs é fundamental para mitigar a inflamação excessiva, o que pode atrasar a cicatrização 21,22,23. Para explicar a potencial agregação inespecífica ou formação de micelas, o grupo controle também foi analisado, revelando sinais fluorescentes insignificantes. Esta observação confirma que os sinais detectados se originam predominantemente dos EVs rotulados.
Esses resultados refletem o papel crítico da composição do andaime na modulação das taxas de liberação de EVs. A liberação mais rápida observada no andaime Alg-EVs/CMCh-AlgLiase é atribuída à quebra enzimática de Alg pela Alglyase, que aumenta a degradação do hidrogel. Essa liberação rápida de EVs é particularmente vantajosa para abordar a fase inflamatória da cicatrização de feridas24. As feridas crônicas geralmente sofrem de inflamação prolongada, o que prejudica a cicatrização; a liberação precoce e controlada de EVs pode mitigar isso, modulando as respostas inflamatórias e promovendo um ambiente pró-regenerativo22,25.
Para analisar esses resultados, os pesquisadores devem quantificar a intensidade de fluorescência capturada usando o sistema IVIS, correlacionando a intensidade do sinal com a concentração de EVs ao longo do tempo. Os dados devem ser plotados para ilustrar a cinética de liberação, permitindo comparações entre diferentes formulações de andaimes. Variações nos perfis de liberação também podem ser avaliadas em relação à integridade do andaime e à atividade enzimática, fornecendo mais informações sobre os mecanismos de liberação subjacentes.
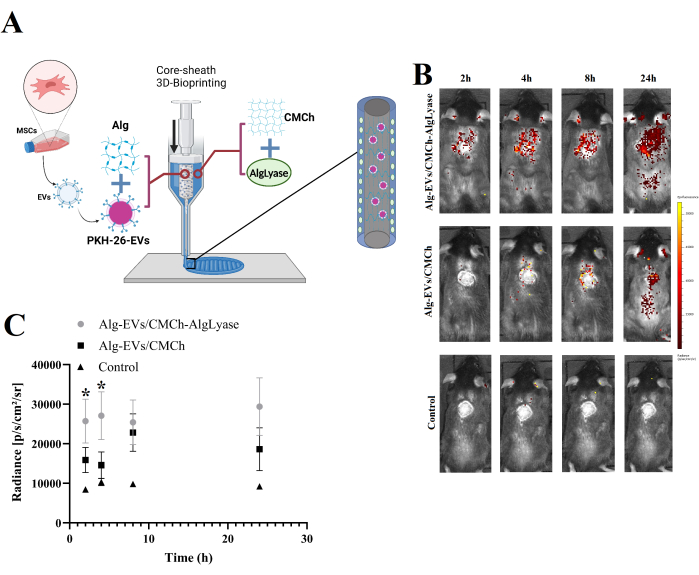
Figura 1: Visão geral da fabricação de andaimes e perfil de liberação de EVs in vivo . (A) Representação esquemática do processo de fabricação para o andaime bioimpresso em 3D Alg-EVs/CMCh-AlgLiase. (B) Perfil de liberação in vivo de EVs marcados com PKH do andaime Alg-EVs/CMCh-AlgLiase em comparação com o andaime Alg-EVs/CMCh e o andaime de controle somente de corante (controle). As barras de cores indicam os níveis de intensidade de fluorescência. (C) Análise quantitativa da intensidade de liberação de PKH-EVs (n=3). As barras de erro representam o desvio padrão e a ANOVA de uma via foi usada para avaliar a significância estatística. Clique aqui para ver uma versão maior desta figura.
Discussão
Um aspecto fundamental do protocolo é o projeto do andaime da bainha central, que é essencial para alcançar uma entrega eficiente de EVs. O design incorpora Alg como material principal e uma combinação de CMCh com Alglyase como bainha. Essa configuração facilita a liberação controlada e rápida de EVs. O material do núcleo, Alg, encapsula os EVs, garantindo sua proteção e entrega localizada. A bainha, composta por CMCh e Alglyase, permite a degradação acelerada do núcleo de Alg, o que é crítico para a liberação oportuna dos EVs. Em nossa publicação anterior18, avaliamos a cinética de liberação in vitro de EVs de um sistema de andaime semelhante e demonstramos um perfil de liberação controlada por um período prolongado, destacando o potencial dessa abordagem para efeitos terapêuticos sustentados. Essa degradação e liberação controladas são alcançadas por meio de técnicas precisas de formulação e encapsulamento. Esses dados permitirão a correlação da dinâmica de liberação de EVs com a progressão da cicatrização de feridas, oferecendo insights mais profundos sobre o potencial clínico do andaime.
Um sistema de liberação mais lenta oferece vantagens em aplicações terapêuticas em que concentrações sustentadas e mais baixas de um medicamento ou fator de crescimento podem melhorar a eficácia e reduzir o risco de efeitos colaterais. Por exemplo, uma liberação gradual pode garantir a estimulação contínua dos processos celulares por um período mais longo26, evitando as altas concentrações que podem levar à toxicidade27. No entanto, as necessidades específicas do aplicativo determinam o perfil de lançamento ideal. Em alguns casos, uma liberação rápida pode ser preferida para fornecer um efeito terapêutico imediato28.
As etapas críticas dentro do protocolo incluem a preparação e estratificação dos materiais de biotinta para o andaime da bainha do núcleo. Manter as concentrações precisas de Alg, CMCh e Alglyase durante a preparação da biotinta garante estabilidade estrutural e encapsulamento eficaz de EVs. Outra etapa crítica é a otimização dos parâmetros de bioimpressão 3D, incluindo velocidades de bicos e condições de reticulação, para garantir a geometria uniforme do andaime e o desempenho funcional. A otimização do processo de rotulagem do PKH-26 é essencial para se livrar do corante livre e das partículas indesejadas. Esse processo melhoraria a precisão do rastreamento dos EVs.
O protocolo foi otimizado para aumentar a estabilidade do andaime e a consistência da liberação do EV. Por exemplo, o excesso de corante PKH-26 livre durante a rotulagem foi mitigado otimizando a proporção de corante para EV e usando o método alternativo de isolamento de EVs com PKH-26. Ajustes regulares para parâmetros de bioimpressão 3D foram empregados para manter a eficácia do andaime.
A viscosidade das biotintas deve ser otimizada para evitar entupimento durante a impressão. O ajuste da concentração de Algliase é necessário para controlar a taxa de degradação. A solução de problemas das propriedades mecânicas do andaime envolveu o balanceamento das durações de reticulação do cloreto de cálcio para evitar andaimes quebradiços ou excessivamente macios. Durante as etapas de rotulagem, filtração e centrifugação dos EVs mitigaram a contaminação por corante livre e melhoraram a precisão dos resultados da imagem.
Além dos benefícios diretos do uso de curativos degradáveis para a cicatrização de feridas crônicas, a taxa de degradação do andaime influencia significativamente a cinética de liberação dos EVs. Essa taxa de degradação pode ser ajustada para atender às necessidades específicas da ferida. Ao otimizar a concentração de AlgLiase na bainha, a taxa de degradação do núcleo de Alg pode ser ajustada, permitindo um perfil de liberação personalizado29. No entanto, a eficácia do método em condições fisiológicas variadas ainda não é totalmente compreendida, pois fatores como pH e atividade enzimática em diferentes tipos de feridas podem afetar o desempenho do andaime. Portanto, a variabilidade no desempenho do andaime sob diferentes condições fisiológicas deve ser considerada. Fatores como pH, atividade enzimática e variações de temperatura em feridas crônicas podem afetar a degradação do andaime e a cinética de liberação de EVs, reduzindo potencialmente a eficácia terapêutica.
Embora os curativos à base de hidrogel sejam amplamente utilizados por sua biocompatibilidade e capacidade de manter um ambiente úmido da ferida, eles geralmente não têm a capacidade de fornecer entrega controlada e localizada de moléculas bioativas, como EVs. A incorporação de EVs no sistema de andaimes oferece uma vantagem única ao combinar suporte estrutural com um componente terapêutico derivado de células biologicamente ativo que pode modular as respostas imunes e aumentar a regeneração do tecido.
Da mesma forma, os sistemas de entrega mediados por nanopartículas são altamente eficientes no direcionamento de vias celulares específicas; no entanto, eles podem enfrentar desafios na contenção no local da ferida e muitas vezes requerem agentes estabilizadores adicionais para manter a bioatividade30. Em contraste, o sistema de andaime apresentado fornece um microambiente protetor que preserva a bioatividade dos EVs durante a entrega24.
Embora este protocolo esteja oferecendo resultados promissores, existem algumas limitações que devem ser consideradas. Um desafio está em alcançar uma distribuição uniforme de EVs dentro do andaime. Variações no processo de mistura podem levar a inconsistências na concentração de EVs no andaime, o que pode afetar a reprodutibilidade. Para superar esse desafio, a técnica de mistura de seringas é uma vantagem. Além disso, o controle preciso sobre as condições de gelificação e reticulação, como a concentração de íons cálcio para andaimes de alginato, é fundamental para garantir propriedades mecânicas ideais e integridade estrutural. Desvios nesses parâmetros podem comprometer o desempenho do andaime. Outra limitação é a perda potencial de EVs durante a preparação do andaime, pois eles podem aderir ao plástico durante as etapas de lavagem. Por fim, a vida útil dos andaimes preparados é relativamente curta, pois as matrizes de hidrogel podem se degradar ou perder funcionalidade com o tempo. Portanto, recomenda-se o uso imediato ou armazenamento de curto prazo a 4 °C. Um teste periódico de bioatividade dos EVs encapsulados é necessário para confirmar sua estabilidade18. Ao abordar essas limitações e empregar as estratégias de solução de problemas sugeridas, os pesquisadores podem melhorar a reprodutibilidade e a eficácia desse protocolo em suas aplicações.
O método de projeto de andaime de bainha central apresenta um avanço significativo para a administração de medicamentos em relação aos projetos tradicionais de andaimes que não possuem mecanismos de liberação controlada31. Ao contrário dos andaimes monofásicos que podem não fornecer liberação adequada ou oportuna de agentes terapêuticos, este método oferece uma abordagem dinâmica para a entrega de EVs com maior precisão. O uso de um material central de degradação rápida e uma bainha funcional permite uma intervenção terapêutica mais direcionada e eficaz em comparação com os métodos convencionais, que muitas vezes requerem ajustes manuais ou sequenciais.
Embora os materiais de andaime usados neste estudo, como Alg e CMCh, sejam conhecidos por sua biocompatibilidade, uma avaliação mais completa de sua biocompatibilidade a longo prazo em ambientes de feridas crônicas é necessária para a tradução clínica. Em nosso trabalho anterior, investigamos os efeitos in vivo do scaffold em um modelo animal pré-clínico e não observamos efeitos tóxicos ou respostas imunes significativas, sugerindo que os materiais são bem tolerados em curto prazo18. No entanto, a biocompatibilidade a longo prazo, incluindo as potenciais respostas imunes e os efeitos dos subprodutos da degradação, requer mais exploração. A degradação dos materiais do andaime pode potencialmente liberar subprodutos que podem influenciar o processo de cicatrização de feridas ou provocar inflamação crônica, particularmente no contexto de modelos diabéticos ou idosos, onde a resposta imune pode ser alterada. Portanto, é crucial realizar estudos adicionais para avaliar como os produtos de degradação afetam o microambiente da ferida e a regeneração geral do tecido. Reconhecemos que mais testes de biocompatibilidade, incluindo estudos in vivo de longo prazo com foco em respostas imunes e degradação de andaimes, são essenciais para entender a segurança e a relevância clínica dessa abordagem para a cicatrização de feridas crônicas.
Este projeto de andaime é particularmente importante nas áreas de engenharia de tecidos e medicina regenerativa. Sua capacidade de fornecer EVs rapidamente e de maneira controlada o torna valioso para aplicações como cicatrização crônica de feridas, reparo de cartilagem e outros esforços de regeneração de tecidos32. Ao abordar questões relacionadas à degradação do andaime e à liberação de EVs, o método promete melhorar os resultados dos pacientes nessas áreas. Além disso, seu potencial de personalização e adaptação a diferentes tipos de tecidos ressalta sua versatilidade e relevância no avanço da medicina personalizada.
O uso do modelo de camundongo diabético Akita neste estudo fornece uma plataforma valiosa para investigar a cicatrização de feridas crônicas em condições diabéticas. Este modelo mimetiza as principais características fisiopatológicas das feridas diabéticas humanas, incluindo hiperglicemia persistente, angiogênese tardia e reparo tecidual prejudicado33,34. Além disso, oferece a vantagem de consistência genética e início espontâneo de diabetes sem a necessidade de indução química externa e, portanto, reduzindo a variabilidade nos resultados experimentais33. No entanto, é importante reconhecer as limitações desse modelo ao traduzir os achados para feridas crônicas humanas. A arquitetura da pele murina difere da pele humana, particularmente em sua epiderme mais fina, estrutura dérmica mais frouxa e o papel predominante da contração da ferida em vez da reepitelização durante a cicatrização35. Além disso, as respostas imunes murinas e os perfis inflamatórios não são totalmente representativos daqueles observados em humanos, o que pode afetar a interpretação das terapias de modulação imunológica36. Apesar dessas diferenças, o modelo Akita continua sendo uma ferramenta amplamente aceita e eficaz para estudos pré-clínicos devido à sua capacidade de recapitular complicações diabéticas sistêmicas centrais para a patogênese crônica da ferida. Para validar ainda mais o potencial translacional da abordagem terapêutica proposta, estudos futuros são necessários para complementar os achados do modelo Akita. Sistemas adicionais relevantes para humanos, como modelos de pele humana ex vivo ou modelos diabéticos de animais de grande porte, seriam altamente favoráveis.
Em conclusão, o projeto de andaime proposto com liberação controlada de EVs marca um avanço significativo na entrega de agentes terapêuticos. Apesar das complexidades técnicas, essa abordagem inovadora oferece vantagens significativas sobre os métodos existentes e possui grande potencial para melhorar os curativos crônicos.
Divulgações
Os autores declaram não ter conflitos de interesse.
Agradecimentos
Agradecimentos especiais a Said Al-Hashmi e Abdulrahman Almharbi da Happy Production por seu excelente trabalho nas filmagens. Também estendemos nossa gratidão ao Ministério do Ensino Superior, Pesquisa e Inovação e à Universidade de Nizwa por seu apoio financeiro e por fornecer os recursos necessários.
Materiais
| Name | Company | Catalog Number | Comments |
| 23 G Purple precision conical Nozzle | Cellink | KT0000002000 | To provide precise extrusion of bioinks with minimal clogging |
| Alginate lyase (AlgLyase) | Sigma Aldrich | A1603-100MG | Algyase is an enzyme that degrades alginate. |
| Amicon Ultra Centrifugal Filter, 30 kDa MWCO | Merck | UFC9030 | Used to wash PKH-26 labeled-EVs |
| BCA assay Kit | Thermo Scientific | 10678484 | To determine the protein/EVs concentration |
| Bioprinting System | Regemat | V1 | To fabricate core-sheath scaffold |
| Bovine serum albumin (BSA) | sigma-aldrich | 05470-5G | To stop PKH 26 reaction |
| Calcium chloride | Sigma Aldrich | C3306-100G | To crosslink and stabilize bioinks in tissue engineering |
| Centrifuge | Sigma | 2-16P | Used for EVs isolation |
| Centrifuge 5810 R | Eppendorf | 22625101 | Used for cell culture |
| Class II Biological Safety Cabinet | Telstar | Bio II Advance | Cell culture |
| CryoCube F570 Series - ULT Freezer | Eppendorf | F571240035 | To store EVs |
| fluorescent microscope | OLYMPUS | IX73P1F | Used to check the residual PKH-26 in the filtrate |
| Gentamicin (50 mg/mL) | Thermofisher | 15750 | Antibiotic for cell culture media |
| GlutaMAX-I CTS, (100X), liquid | Thermofisher | A12860 | Cell culture media supplement |
| HCl | Sigma Aldrich | 7647-01-0 | Buffer preparation |
| HEPES | Carl Roth | Art. No. 6763.3 | Buffer preparation |
| High viscous carboxymethyl cellulose (CMCh) | BDH | 27929 4T | CMCh is a water-soluble cellulose derivative. |
| Incubator | New Brunswick | NB-170R | Cell culture |
| Invivo imaging | PerkinElmer | IVIS Lumina XRMS Series III | To track EVs release, in vivo |
| Magnet stirer | SalvisLAB | MC35 | For Bioinks preparation |
| miRCURY Exosome Kits for Exosome Isolation | Qiagen | 76743 | Evs isolation |
| NaOh | Daejung | 1310-73-2 | Buffer preparation |
| phosphate buffered saline(PBS) | Thermo Scientific | J61196.AP | Cell culture |
| PKH 26 | MCE | 154214-55-8 | Red fluorescent dye for labeling theEVs |
| Sodium alginate (Alg) | Sigma Aldrich | A0682-100G | Natural polysaccharide derived from brown seaweed. |
| Sodium chloride (NaCl) | Carl Roth | Art-Nr-P029.1 | Buffer preparation |
| StemPro BM Mesenchymal Stem Cells | Thermofisher | A1382901 | Mesenchymal stem cells |
| StemPro MSC SFM XenoFree | Thermofisher | A1067501 | Cell culture media |
| Trypsin 0.25% | Thermofisher | 25050014 | Cell dissociation |
| Vortex-Mixer | Daihan Scientific | VM-10 | Used to mix precipitation buffer with the conditioned media |
Referências
- Falanga, V., et al. Chronic wounds. Nat Rev Disease Primers. 8 (1), 50 (2022).
- Tran, H. Q., Shahriar, S. S., Yan, Z., Xie, J. Recent advances in functional wound dressings. Adv Wound Care. 12 (7), 399-427 (2023).
- Shao, M., et al. Emerging trends in therapeutic algorithm of chronic wound healers: Recent advances in drug delivery systems, concepts-to-clinical application and future prospects. Crit Rev Ther Drug Carrier Syst. 34 (5), 385-452 (2017).
- Rezvani Ghomi, E., Khalili, S., Nouri Khorasani, S., Esmaeely Neisiany, R., Ramakrishna, S. Wound dressings: Current advances and future directions. J Appl Poly Sci. 136 (27), 47738 (2019).
- Ding, J. Y., et al. Mesenchymal stem cell-derived extracellular vesicles in skin wound healing: Roles, opportunities and challenges. Military Med Res. 10 (1), 36 (2023).
- Sharma, D., Kumar, A., Mostafavi, E. Extracellular vesicle-based biovectors in chronic wound healing: Biogenesis and delivery approaches. Mol Ther Nucleic Acids. 32, 822-840 (2023).
- Vader, P., Mol, E. A., Pasterkamp, G., Schiffelers, R. M. Extracellular vesicles for drug delivery. Adv Drug Delivery Rev. 106, 148-156 (2016).
- Han, P., Ivanovski, S. 3d bioprinted extracellular vesicles for tissue engineering-a perspective. Biofabrication. 15 (1), 013001 (2022).
- Annabi, N., et al. 25th anniversary article: Rational design and applications of hydrogels in regenerative medicine. Adv Mater. 26 (1), 85-124 (2014).
- Zheng, Y., Pan, C., Xu, P., Liu, K. Hydrogel-mediated extracellular vesicles for enhanced wound healing: The latest progress, and their prospects for 3d bioprinting. J Nanobiotechnol. 22 (1), 57 (2024).
- Keener, A. B. How extracellular vesicles can enhance drug delivery. Nature. 582 (7812), S14-S14 (2020).
- Han, P., et al. 3d bioprinted small extracellular vesicles from periodontal cells enhance mesenchymal stromal cell function. Biomater Adv. 158, 213770 (2024).
- Born, L. J., et al. Sustained released of bioactive mesenchymal stromal cell-derived extracellular vesicles from 3d-printed gelatin methacrylate hydrogels. J Biomed Mater Res A. 110 (6), 1190-1198 (2022).
- Kjar, A., Mcfarland, B., Mecham, K., Harward, N., Huang, Y. Engineering of tissue constructs using coaxial bioprinting. Bioact Mater. 6 (2), 460-471 (2021).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3d bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Deshayes, S., Kasko, A. M. Polymeric biomaterials with engineered degradation. J Poly Sci A Poly Chem. 51 (17), 3531-3566 (2013).
- Xu, Q., et al. Injectable hyperbranched poly (β-amino ester) hydrogels with on-demand degradation profiles to match wound healing processes. Chem Sci. 9 (8), 2179-2187 (2018).
- Vakilian, S., et al. Engineered local delivery of extracellular vesicles loaded with si-tnf-α, via a core-sheath 3d-bio-printed scaffold as an effective wound dressing. J Drug Delivery Sci Technol. 101, 106189 (2024).
- Mirsanei, Z., et al. Synergistic effects of mesenchymal stem cell-derived extracellular vesicles and dexamethasone on macrophage polarization under inflammatory conditions. Inflammopharmacology. 32 (2), 1317-1332 (2024).
- Ma, Y., Brocchini, S., Williams, G. R. Extracellular vesicle-embedded materials. J Controlled Release. 361, 280-296 (2023).
- Jia, Q., Zhao, H., Wang, Y., Cen, Y., Zhang, Z. Mechanisms and applications of adipose-derived stem cell-extracellular vesicles in the inflammation of wound healing. Front Immunol. 14, 1214757 (2023).
- Lou, P., et al. Extracellular vesicle-based therapeutics for the regeneration of chronic wounds: Current knowledge and future perspectives. Acta Biomater. 119, 42-56 (2021).
- Cai, Y., Chen, K., Liu, C., Qu, X. Harnessing strategies for enhancing diabetic wound healing from the perspective of spatial inflammation patterns. Bioactive Mater. 28, 243-254 (2023).
- Li, Z., et al. Multifunctional hydrogel-based engineered extracellular vesicles delivery for complicated wound healing. Theranostics. 14 (11), 4198 (2024).
- Cabral, J., Ryan, A. E., Griffin, M. D., Ritter, T. Extracellular vesicles as modulators of wound healing. Adv Drug Delivery Rev. 129, 394-406 (2018).
- Moghadasi Boroujeni, S., Mashayekhan, S., Vakilian, S., Ardeshirylajimi, A., Soleimani, M. The synergistic effect of surface topography and sustained release of tgf-β1 on myogenic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 104 (7), 1610-1621 (2016).
- Jayaraman, P., et al. Controlled release of drugs in electrosprayed nanoparticles for bone tissue engineering. Adv Drug Delivery Rev. 94, 77-95 (2015).
- Huang, X., Brazel, C. S. On the importance and mechanisms of burst release in matrix-controlled drug delivery systems. J Controlled Release. 73 (2-3), 121-136 (2001).
- Smith, A. M., Senior, J. J. Alginate hydrogels with tuneable properties. Adv Biochem Eng Biotechnol. 178, 37-61 (2021).
- Yan, X., Sha, X. Nanoparticle-mediated strategies for enhanced drug penetration and retention in the airway mucosa. Pharmaceutics. 15 (10), 2457 (2023).
- Pant, B., Park, M., Park, S. -. J. Drug delivery applications of core-sheath nanofibers prepared by coaxial electrospinning: A review. Pharmaceutics. 11 (7), 305 (2019).
- Pinheiro, A., et al. Extracellular vesicles: Intelligent delivery strategies for therapeutic applications. J Controlled Release. 289, 56-69 (2018).
- Yoshioka, M., Kayo, T., Ikeda, T., Koizuni, A. A novel locus, mody4, distal to d7mit189 on chromosome 7 determines early-onset niddm in nonobese c57bl/6 (akita) mutant mice. Diabetes. 46 (5), 887-894 (1997).
- Fang, R. C., et al. Limitations of the db/db mouse in translational wound healing research: Is the noncnzo10 polygenic mouse model superior. Wound Repair Regen. 18 (6), 605-613 (2010).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. J Dermatol Sci. 90 (1), 3-12 (2018).
- Sellers, R. S. Translating mouse models: Immune variation and efficacy testing. Toxicol Pathol. 45 (1), 134-145 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.