Method Article
Optimisation de l’administration de vésicules extracellulaires à l’aide d’un échafaudage bio-imprimé en 3D pour la gestion des plaies chroniques
Dans cet article
Résumé
Cette étude présente un protocole de fabrication d’échafaudages bio-imprimés en 3D pour la cicatrisation des plaies chroniques. Les vésicules extracellulaires sont isolées à partir de cellules souches mésenchymateuses et chargées dans le noyau (alginate) avec la gaine fabriquée à partir de carboxyméthylcellulose et d’alginate lyase. Cette conception permet une dégradation contrôlée de l’échafaudage et une libération efficace des VE.
Résumé
Cette étude décrit un protocole détaillé pour la fabrication d’échafaudages bio-imprimés en 3D conçus pour améliorer la cicatrisation des plaies chroniques. Le protocole consiste à isoler des vésicules extracellulaires (VE) à partir de cellules souches mésenchymateuses (CSM), connues pour leurs propriétés régénératives et immunomodulatrices. Ces véhicules électriques sont ensuite incorporés dans une structure d’échafaudage unique. L’échafaudage comporte un noyau composé d’alginate chargé de VE, entouré d’une gaine faite de carboxyméthylcellulose et d’alginate lyase. Cette conception innovante assure une dégradation contrôlée de l’échafaudage tout en favorisant une libération efficace et contrôlée des VE au site de la plaie. Le protocole couvre des étapes clés, notamment la préparation et la caractérisation des VE, la formulation de bio-encres pour la bio-impression 3D et l’optimisation des paramètres d’impression pour obtenir l’architecture cœur-gaine souhaitée. En combinant l’intégrité structurelle et la bioactivité, l’échafaudage vise à remédier aux limites des pansements conventionnels, en offrant une approche ciblée pour accélérer la régénération des tissus et réduire l’inflammation dans les plaies chroniques. Cette méthode fournit une stratégie reproductible et évolutive pour le développement de biomatériaux avancés avec des applications cliniques potentielles dans la gestion des plaies chroniques. Le protocole met également en évidence les considérations essentielles pour obtenir des résultats cohérents, garantissant l’adaptabilité aux applications thérapeutiques futures.
Introduction
Les plaies chroniques, souvent liées à une inflammation excessive, nécessitent une prise en charge rapide pour prévenir des complications graves telles que les infections et la nécrose des tissus, qui peuvent entraîner des amputations. Malgré les progrès, les traitements actuels restent coûteux, peu pratiques, ont des effets secondaires et ont une efficacité limitée, ce qui souligne la nécessité de plus de pansements curatifs 1,2,3. Le développement d’une nouvelle génération de pansements spécialement conçus pour les plaies chroniques est essentiel pour relever ces défis. De plus, la nature complexe de la cicatrisation des plaies exige des matériaux de pansement dotés d’une gamme de propriétés, notamment l’hydratation, la flexibilité, l’adhérence, la bioactivité et la biodégradabilité4. Cette étude vise à développer un pansement bio-conçu qui intègre des vésicules extracellulaires (VE) avec un échafaudage bio-imprimé en 3D pour fournir un environnement thérapeutique contrôlé et accélérer la cicatrisation des plaies chroniques.
Les VE dérivées des cellules souches aident à la cicatrisation chronique des plaies en favorisant les réponses anti-inflammatoires, la croissance cellulaire, la migration et la formation de vaisseaux sanguins5. De plus, les VE peuvent délivrer des molécules bioactives, y compris des médicaments à petites molécules, des constructions de gènes et de protéines pour la gestion des plaies chroniques6. De plus, leur capacité à protéger la cargaison de la dégradation enzymatique améliore la stabilité et la biodisponibilité des agents thérapeutiques, offrant des avantages distincts par rapport aux facteurs de croissance conventionnels et aux médicaments à petites molécules, qui se dégradent souvent rapidement in vivo7. Malgré ces avantages, l’administration efficace et durable de VE aux tissus cibles reste un défi important.
Les échafaudages de bio-impression 3D peuvent servir de plate-forme d’administration aux VE pour renforcer leurs effets thérapeutiques8. Ces échafaudages imitent les environnements cellulaires naturels et permettent la libération contrôlée des VE 9,10. Ils protègent également les VE de la dégradation, améliorant ainsi la stabilité de leurs microARN et protéines11. Han et al. ont démontré que les VE peuvent être efficacement libérés à partir d’échafaudages GelMA bio-imprimés en 3D. Cette libération a conduit à une meilleure fixation cellulaire et à une expression génique accrue liée aux voies de mécanotransduction dans les cellules souches mésenchymateuses du coussinet adipeux buccal humain (hBFP-MSCs) ensemencées sur les échafaudages12. Born et al., en optimisant la concentration de l’agent de réticulation, ont obtenu une libération contrôlée des VE. Cette approche a démontré son efficacité dans la promotion de l’angiogenèse et offre une méthode prometteuse pour l’administration régulée des VE13.
La bio-impression 3D à gaine centrale permet de créer des structures complexes et multi-matériaux en imprimant un matériau de base enveloppé dans une gaine. Le noyau peut inclure des cellules, des facteurs de croissance ou des médicaments, tandis que la gaine offre un soutien mécanique et une protection ou agit comme une barrière. Cette méthode a des applications dans l’ingénierie tissulaire et la médecine régénérative, telles que le développement de réseaux vasculaires, l’imitation de structures tissulaires naturelles et la création de systèmes d’administration de médicaments. Il permet un contrôle précis de la distribution et de la composition des matériaux, améliorant ainsi la fonctionnalité et la pertinence biologique des constructions. Par rapport aux techniques alternatives, la bio-impression 3D à gaine de noyau offre un contrôle précis de la distribution et de la composition des matériaux, améliorant ainsi la fonctionnalité et la pertinence biologique des constructions14,15.
La dégradation artificielle des pansements offre des avantages tels que la réduction de l’inconfort lors des changements, un environnement humide pour la cicatrisation et le contrôle des infections, une administration thérapeutique rapide et une régénération optimale des tissus 16,17,18. Les hydrogels d’alginate (Alg) et de carboxyméthylcellulose (CMCh) sont biocompatibles et efficaces pour délivrer des vésicules extracellulaires (VE) aux plaies, améliorant la cicatrisation grâce à la communication cellulaire et à la réduction de l’inflammation18. Dans cette étude, les VE ont été intégrés dans un noyau d’Alg, tandis qu’une gaine de CMCh et d’AlgLyase (AlgLyase) a été utilisée pour permettre une dégradation rapide du pansement et la livraison des VE. Cette conception de gaine centrale facilite la libération rapide des VE en réponse à la dégradation de l’échafaudage, améliorant ainsi leur efficacité thérapeutique et remédiant aux limites des traitements existants des plaies chroniques. L’objectif principal de cette étude est de développer un pansement bio-conçu qui améliore la cicatrisation des plaies en intégrant la libération contrôlée des VE avec un échafaudage dégradable réactif, améliorant ainsi les résultats du traitement des plaies chroniques.
Protocole
La recherche sur les animaux a été menée en pleine conformité avec les normes éthiques établies par le Comité national de bioéthique et le Comité d’éthique animale de l’Université de Nizwa. L’approbation éthique de cette étude a été accordée sous l’autorisation ID : VCGSR, AREC/01/2023. Tous les animaux ont été logés dans des conditions de laboratoire standard, assurant des contrôles environnementaux optimaux, une nutrition appropriée et des soins complets pour préserver leur bien-être tout au long de l’étude. Toutes les procédures impliquant des animaux ont respecté strictement les politiques de l’établissement, les normes internationales de soins aux animaux et les directives ARRIVE.
1. Culture cellulaire
- Récupérer un flacon de CSM (passage #2) du stockage d’azote liquide et le manipuler avec des techniques aseptiques pour éviter la contamination. Décongelez rapidement les cellules dans un bain d’eau à 37 °C, en veillant à les retirer dès qu’il reste un petit fragment de glace.
- Préparez un milieu complet comprenant le milieu de base MSC SFM, complété par 1 % (v/v) de supplément MSC SFM XenoFree, 1 % (v/v) de GlutaMAX et 0,01 % (v/v) de gentamicine. Ajouter 1 mL de milieu complet préchauffé (37 °C) à raison de 3 à 5 gouttes toutes les 5 s dans le flacon, puis mélanger délicatement. Transvaser tout le contenu du flacon des CSM dans un tube conique de 15 mL contenant 4 mL de milieu complet préchauffé, dans des conditions aseptiques dans une enceinte de biosécurité de classe II.
- Centrifuger les cellules à 200 x g pendant 5 min à température ambiante. Assurez-vous que la centrifugeuse est correctement équilibrée.
- Aspirer le surnageant et remettre les cellules en suspension dans 1 mL de milieu complet préchauffé. Ensuite, transférez les cellules dans une fiole T25 contenant 4 mL de milieu complet.
- Inclinez doucement le ballon pour vous assurer que les cellules sont uniformément réparties. Incuber le ballon à 37 °C avec 5 % de CO2.
- Changez le milieu tous les 2 jours, en le remplaçant par un milieu frais, préchauffé et complet. Utilisez un pipetage doux pour éviter de perturber les cellules. Lorsque vous atteignez une confluence de 70 % à 80 %, aspirez le milieu usé de la fiole T25.
- Lavez les cellules avec 3 ml de PBS frais pour éliminer les résidus. Assurez-vous que la gourde est complètement couverte pendant le lavage.
- Ajouter 1 mL de solution de trypsine à 0,25 % dans la fiole T25, l’incuber à 37 °C pendant 3 à 7 minutes et surveiller attentivement le détachement au microscope à un grossissement de 4x.
- Tapotez doucement le ballon si nécessaire pour assurer un détachement complet de la cellule. Ajoutez un milieu complet préchauffé dans le ballon et pipetez de haut en bas sur la surface pour aider à détacher les cellules. Ensuite, transférez la suspension cellulaire dans un tube à centrifuger de 15 ml.
- Centrifugez le tube à 200 x g pendant 5 min à température ambiante. Mettez en suspension la pastille cellulaire dans un milieu frais et complet et comptez les cellules à l’aide d’un hémocytomètre Neubauer. Transférez les cellules dans une fiole T75. Assurer une densité de semis de 5 000 cellules/cm2 pour une croissance optimale.
- Incuber les cellules à 37 °C avec 5 % de CO2. Après 72 h d’incubation cellulaire, prélever les milieux conditionnés des cellules pour l’isolement des VE. Utiliser immédiatement après le prélèvement.
2. Isolation des VE
- Centrifuger les 13 mL du milieu conditionné collecté à 800 x g pendant 15 min pour éliminer les débris cellulaires. Filtrez doucement le surnageant à l’aide d’un filtre à seringue de 0,22 μm pour éliminer les grosses particules.
- Ajouter 5 mL de tampon de précipitation dans le média filtré conditionné et bien mélanger au tourbillon. Assurez-vous que la solution est homogène.
- Incuber le mélange pendant la nuit à 4 °C pour permettre aux VE de précipiter. Centrifuger le mélange à 3 220 x g pendant 30 min à 20 °C. Vérifiez l’équilibre des tubes.
- Jetez soigneusement le surnageant sans déranger la pastille. Centrifugez à nouveau la pastille à 3 220 x g pendant 5 s pour éliminer le liquide résiduel.
- Pipetez doucement la pastille de VE dans 200 μL de PBS pour éviter d’endommager les VE. Mesurez la concentration en protéines des VE en suivant les instructions du fabricant (kit de dosage des protéines BCA).
- Effectuer un transfert Western pour détecter les marqueurs spécifiques des VE (CD63, CD81 et CD9), afin de vérifier le phénotype18 des VE. L’analyse a confirmé la présence de ces marqueurs, validant l’identité des VE19.
- Pour minimiser le risque de contamination par la RNase, il est recommandé de l’utiliser directement sans stockage supplémentaire. En cas de besoin, stockez les VE à -80 °C pour une utilisation ultérieure. Aliquote la suspension des VE dans des volumes de 40 μL pour éviter les cycles répétés de gel-dégel.
3. Étiquetage des VE avec PKH-26
- Préparation du tampon
- Dissoudre 0,238 g de HEPES dans environ 90 mL d’eau stérile ultra-pure dans un récipient stérile. Utilisez une solution HEPES fraîchement préparée. Ajouter 0,85 g de NaCl à la solution HEPES.
- Ajustez le pH à 7,4 à l’aide de 1 M de NaOH ou de HCl, au besoin, à l’aide d’un pH-mètre étalonné. Ajouter de l’eau déminéralisée pour porter le volume total à 100 ml. Filtrez la solution à travers un filtre de 0,22 μm pour la stériliser.
- Diluer 4 μL de colorant PKH-26 dans 1 mL de tampon préparé. Bien mélanger à l’aide d’une pipette pour assurer l’homogénéité.
- Remettre en suspension les VE purifiés dans 1 mL de PBS à une concentration de 700 μg/mL. Ajouter 1 mL de suspension EVs à 1 mL de solution PKH-26 préparée. Pour le groupe témoin à colorant seul, ajouter 1 mL de support complet sans VE à 1 mL de solution PKH-26. Toutes les étapes suivantes sont également effectuées pour le groupe témoin afin de tenir compte d’une agrégation non spécifique potentielle ou de la formation de micelles.
- Mélangez soigneusement les VE en inversant doucement le tube 10x-15x. Incuber le mélange pendant 3 à 5 minutes à température ambiante, en assurant une exposition uniforme des VE au colorant.
- Préparez une solution fraîche de 2 ml de BSA à 1 % en utilisant de l’eau ultrapure stérile et ajoutez-la aux 2 ml du mélange résultant pour éteindre la réaction d’étiquetage. Mélangez doucement pour éviter l’agrégation.
- Concentrez les VE marqués PKH-26 selon le protocole mentionné ci-dessus (étapes 2.2-2.7). Remettez en suspension les VE marqués dans 300 μL de PBS. Pipetez l’échantillon de VE étiqueté PKH-26 dans un tube filtrant de 30 kDa.
- Centrifuger l’échantillon à 3 220 x g pendant 30 min à 4 °C. Au cours de cette étape, le colorant PKH-26 libre et les petites molécules passeront à travers la membrane dans le filtrat, tandis que les VE marquées au PKH-26 seront retenues dans le rétentat.
- Après la centrifugation initiale, jeter le filtrat et ajouter 300 μL de PBS au rétentat. Remettez doucement les VE en suspension dans le PBS en les pipetant de haut en bas.
- Centrifugez à nouveau l’échantillon à 3 220 x g pendant 30 min à 4 °C pour éliminer tout colorant libre ou petites molécules restantes.
- Confirmer l’absence de PKH-26 dans la solution de filtrat à l’aide d’un microscope fluorescent. Si un colorant est détecté, répétez les étapes de lavage.
- Prélever la solution supérieure à l’aide d’une micropipette et retirer le filtre du tube de collecte. Retournez soigneusement le filtre (retournez-le).
- Centrifuger le filtre inversé à 800 x g pendant 5 min à 4 °C. Cela aidera à collecter les PKH-26-EV retenus de la membrane filtrante dans le nouveau tube de collecte. Utilisez directement les PKH-26-EV pour l’étape suivante.
4. 3D Bio-impression
- Préparation des bio-encres
- Préparez une solution fraîche d’Alg sodique à 4,5 % (p/v) en utilisant de l’eau stérile ultra-pure. Remuez toute la nuit à 60 °C pour permettre à la solution de se dissoudre complètement.
- Dissoudre le CMCh dans de l’eau stérile ultra-pure pour obtenir une solution à 3,8 % (p/v). Préparez frais. Remuer toute la nuit à 60 °C pour dissoudre complètement.
- Centrifugez les bio-encres préparées à 3 220 x g pendant 10 min à 25 °C pour éliminer toutes les bulles qui pourraient interférer avec le processus d’impression.
- Mélanger les 3 mL de solution d’Alg préparés avec les VE étiquetés ou le témoin à colorant seul à l’aide d’un mélangeur à seringue pour obtenir la concentration de 0,01 % (p/v) des VE. Assurez une distribution uniforme en mélangeant doucement.
- À l’aide d’un mélangeur à seringue, combiner 1 mL de CMCh avec une solution d’AlgLyase fraîchement préparée dans de l’eau stérile ultra-pure pour obtenir une concentration finale de 0,5 mU/mL.
- Comme illustré à la figure 1A, chargez simultanément la bio-encre Alg/Exo dans la partie centrale et la bio-encre CMCh/AlgLyase dans la partie gaine de la seringue cœur/gaine.
- Laissez reposer les bio-encres pendant 15 minutes avant d’imprimer.
- Configuration de la bio-imprimante 3D
- À l’aide du logiciel de bio-impression 3D, créez la structure de l’échafaudage en sélectionnant une forme cylindrique avec un motif de remplissage diagonal. Pour ce faire, réglez le diamètre et la hauteur du cylindre sur 20 mm et 1,1 mm, respectivement. Configurez la taille des pores à 1 mm.
- Réglez la vitesse de pompage du noyau et de la buse de la gaine à 1 mm/s avec une épaisseur de 0,25 mm par couche et réglez la vitesse de déplacement à 6 mm/s. Imprimez quatre couches d’une épaisseur de 0,25 mm par couche à température ambiante.
- Commencez à imprimer sur un film polyester.
- Utilisez l’humidificateur avec du chlorure de calcium en aérosol (2,2 %) pour réticuler l’échafaudage pendant le processus d’extrusion. Positionnez la buse de l’humidificateur à environ 20 cm de la tête d’extrusion pour assurer une réticulation efficace sans compromettre la structure de l’échafaudage. Pour une réticulation supplémentaire, immergez l’échafaudage dans une solution de chlorure de calcium (2,2 %) pendant 10 min.
- Rincez l’échafaudage 3 fois avec de l’eau stérile ultra-pure pour éliminer tout excès de chlorure de calcium et de bio-encre non liée.
- Assurez-vous que l’échafaudage est stocké dans un environnement stérile à 4 °C afin de maintenir l’intégrité et la fonctionnalité de l’échafaudage jusqu’à trois mois.
5. Suivi de la sortie des VE
- Création d’un modèle de plaie cutanée circulaire
- Anesthésier des souris diabétiques hétérozygotes Akita mâles (8 semaines) par injection intrapéritonéale de kétamine (70 mg/kg) et de xylazine (10 mg/kg). Confirmez la bonne anesthésie en évaluant l’absence de réponses réflexes (par exemple, pincement des orteils) et surveillez la fréquence respiratoire. Pour prévenir la sécheresse de la cornée pendant l’anesthésie, appliquez une pommade ophtalmique vétérinaire stérile sur les yeux.
- Préparez la zone de la peau dorsale en la rasant d’abord à l’aide d’une tondeuse électrique. Évitez les irritations ou les blessures cutanées. Stérilisez la zone rasée à l’aide d’une solution de povidone iodée.
- À l’aide d’un appareil de saisie stérile, créez une plaie cutanée circulaire de 6 mm sur toute l’épaisseur sur la surface dorsale de chaque souris.
- Placez délicatement l’échafaudage bio-imprimé en 3D contenant des VE marqués au PKH directement sur le lit de la plaie. Assurez-vous que l’échafaudage recouvre entièrement la surface de la plaie avec un minimum de poches d’air en appuyant légèrement à l’aide d’une pince stérile. Assurez-vous que l’animal est surveillé de près après l’intervention et qu’il reste surveillé jusqu’à ce qu’il ait complètement repris conscience et puisse maintenir une déposition sternale.
- Imagerie fluorescente
- À 2 h, 4 h, 8 h, 24 h après l’implantation, anesthésier les souris à l’aide d’isoflurane. Pour l’induction de l’anesthésie, placez les souris dans la chambre du système d’imagerie in vivo (IVIS) et exposez-les à 2 % à 3 % d’isoflurane dans l’oxygène. Appliquez une pommade ophtalmique sur les yeux des souris pour prévenir la sécheresse. Une fois anesthésiées, transférez les souris dans le système IVIS et maintenez-les avec 1 % à 2 % d’isoflurane dans l’oxygène délivré par les canaux nasaux. Vérifiez que les animaux sont complètement anesthésiés et stables avant de procéder à l’imagerie.
- Utilisez le système IVIS pour capturer les signaux fluorescents des VE marqués PKH libérés de l’échafaudage. Dans l’assistant d’imagerie, sélectionnez l’option Imagerie de fluorescence et activez les filtres d’excitation et d’émission pour le colorant PKH. Ajustez les paramètres de l’appareil photo, y compris le champ de vision et la hauteur du sujet, pour optimiser la détection du signal. Assurez un positionnement cohérent à tous les points temporels de l’imagerie pour permettre des comparaisons précises. Commencez à acquérir des images et enregistrez les données résultantes.
- Quantifiez l’intensité des signaux fluorescents à l’aide du logiciel IVIS. Cela permettra de suivre la sortie des VE au fil du temps.
Résultats
La libération in vivo de VE à partir des échafaudages Alg-EVs/CMCh et Alg-EVs/CMCh-AlgLyase est illustrée aux figures 1B et C. Comme prévu, l’échafaudage Alg-EVs/CMCh-AlgLyase a présenté un profil de libération plus rapide par rapport aux Alg-EVs/CMCh, en particulier aux points de temps de 2 h et 4 h. La libération de VE par les hydrogels est régie par une combinaison de mécanismes physicochimiques, notamment la diffusion, le gonflement, l’érosion et la dégradation20. En tirant parti de l’Alglyase, l’échafaudage facilite la dégradation de l’Alg, accélérant la libération des VE pour contrôler efficacement l’inflammation chronique dans les premiers stades de la cicatrisation des plaies. La libération précoce des VE est essentielle pour atténuer l’inflammation excessive, qui peut retarder la guérison 21,22,23. Pour tenir compte d’une agrégation non spécifique potentielle ou de la formation de micelles, le groupe témoin a également été analysé, révélant des signaux fluorescents négligeables. Cette observation confirme que les signaux détectés proviennent principalement des VE marqués.
Ces résultats reflètent le rôle essentiel de la composition de l’échafaudage dans la modulation des taux de libération des VE. La libération plus rapide observée dans l’échafaudage Alg-EVs/CMCh-AlgLyase est attribuée à la dégradation enzymatique d’Alg par l’Alglyase, qui améliore la dégradation de l’hydrogel. Cette libération rapide des VE est particulièrement avantageuse pour traiter la phase inflammatoire de la cicatrisation des plaies24. Les plaies chroniques souffrent souvent d’une inflammation prolongée, ce qui nuit à la cicatrisation ; la libération précoce et contrôlée de VE peut atténuer ce phénomène en modulant les réponses inflammatoires et en favorisant un environnement pro-régénérateur22,25.
Pour analyser ces résultats, les chercheurs doivent quantifier l’intensité de fluorescence capturée à l’aide du système IVIS, en corrélant l’intensité du signal avec la concentration des VE au fil du temps. Les données doivent être tracées de manière à illustrer la cinétique de rejet, ce qui permet des comparaisons entre différentes formulations d’échafaudage. Les variations dans les profils de libération peuvent également être évaluées en ce qui concerne l’intégrité de l’échafaudage et l’activité enzymatique, ce qui permet de mieux comprendre les mécanismes de libération sous-jacents.
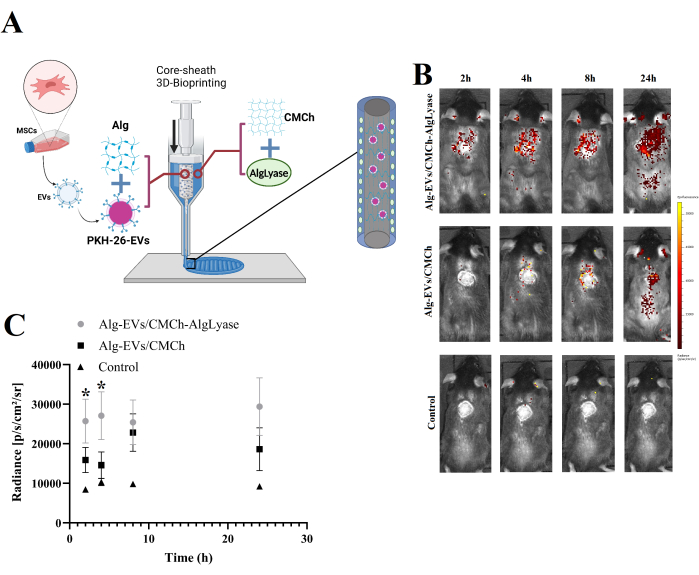
Figure 1 : Vue d’ensemble de la fabrication de l’échafaudage et du profil de libération des VE in vivo. (A) Représentation schématique du processus de fabrication de l’échafaudage bio-imprimé en 3D Alg-EVs/CMCh-AlgLyase. (B) Profil de libération in vivo des VE marquées à la PTH à partir de l’échafaudage Alg-EVs/CMCh-AlgLyase par rapport à l’échafaudage Alg-EVs/CMCh et à l’échafaudage de contrôle à colorant seul (contrôle). Les barres de couleur indiquent les niveaux d’intensité de fluorescence. (C) Analyse quantitative de l’intensité de libération des PKH-EV (n=3). Les barres d’erreur représentent l’écart-type, et l’ANOVA à un facteur a été utilisée pour évaluer la signification statistique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Un aspect central du protocole est la conception de l’échafaudage à gaine centrale, qui est essentielle pour obtenir une livraison efficace des VE. La conception intègre l’Alg comme matériau de base et une combinaison de CMCh et d’Alglyase comme gaine. Cette configuration facilite la libération contrôlée et rapide des VE. Le matériau de base, Alg, encapsule les VE, assurant leur protection et leur livraison localisée. La gaine, composée de CMCh et d’Alglyase, permet la dégradation accélérée du cœur d’Alg, ce qui est essentiel pour la libération rapide des VE. Dans notre publication précédente18, nous avons évalué la cinétique de libération in vitro des VE à partir d’un système d’échafaudage similaire et démontré un profil de libération contrôlée sur une longue période, soulignant le potentiel de cette approche pour des effets thérapeutiques durables. Cette dégradation et cette libération contrôlées sont obtenues grâce à des techniques de formulation et d’encapsulation précises. Ces données permettront de corréler la dynamique de libération des VE avec la progression de la cicatrisation des plaies, offrant ainsi des informations plus approfondies sur le potentiel clinique de l’échafaudage.
Un système à libération plus lente offre des avantages dans les applications thérapeutiques où des concentrations soutenues et plus faibles d’un médicament ou d’un facteur de croissance peuvent améliorer l’efficacité tout en réduisant le risque d’effets secondaires. Par exemple, une libération progressive peut assurer une stimulation continue des processus cellulaires sur une période plus longue26, évitant ainsi les concentrations élevées qui pourraient conduire à une toxicité27. Cependant, les besoins spécifiques de l’application dictent le profil de version idéal. Dans certains cas, une libération rapide peut être préférée pour avoir un effet thérapeutique immédiat28.
Les étapes critiques du protocole comprennent la préparation et la stratification des matériaux de bio-encre pour l’échafaudage de la gaine centrale. Le maintien des concentrations précises d’Alg, de CMCh et d’Alglyase pendant la préparation de la bioencre garantit la stabilité structurelle et l’encapsulation efficace des VE. Une autre étape critique est l’optimisation des paramètres de bio-impression 3D, y compris la vitesse des buses et les conditions de réticulation, afin de garantir une géométrie d’échafaudage uniforme et des performances fonctionnelles. L’optimisation du processus de marquage PKH-26 est essentielle pour se débarrasser des colorants libres et des particules indésirables. Ce processus améliorerait la précision du suivi des VE.
Le protocole a été optimisé pour améliorer la stabilité de l’échafaudage et la cohérence de la libération de l’EV. Par exemple, l’excès de colorant PKH-26 libre lors du marquage a été atténué par l’optimisation du rapport colorant/VE et l’utilisation d’une autre méthode d’isolement des VE étiquetées PKH-26. Des ajustements réguliers des paramètres de bio-impression 3D ont été utilisés pour maintenir l’efficacité de l’échafaudage.
La viscosité des bio-encres doit être optimisée pour éviter le colmatage lors de l’impression. Il est nécessaire d’ajuster la concentration d’AlgLyase pour contrôler le taux de dégradation. Le dépannage des propriétés mécaniques de l’échafaudage impliquait d’équilibrer les durées de réticulation du chlorure de calcium pour éviter les échafaudages cassants ou trop mous. Au cours des étapes d’étiquetage, de filtration et de centrifugation des VE, la contamination par les colorants libres a permis d’atténuer la contamination par les colorants libres et d’améliorer la précision des résultats d’imagerie.
En plus des avantages directs de l’utilisation de pansements dégradables pour la cicatrisation chronique des plaies, le taux de dégradation de l’échafaudage influence considérablement la cinétique de libération des VE. Ce taux de dégradation peut être ajusté pour répondre aux besoins spécifiques de la plaie. En optimisant la concentration d’AlgLyase dans la gaine, le taux de dégradation du noyau d’Alg peut être affiné, ce qui permet d’obtenir un profil de libération personnalisé29. Cependant, l’efficacité de la méthode dans des conditions physiologiques variables n’est pas encore entièrement comprise, car des facteurs tels que le pH et l’activité enzymatique dans différents types de plaies pourraient affecter les performances de l’échafaudage. Par conséquent, la variabilité des performances de l’échafaudage dans différentes conditions physiologiques doit être prise en compte. Des facteurs tels que le pH, l’activité enzymatique et les variations de température dans les plaies chroniques peuvent affecter la dégradation de l’échafaudage et les VE libèrent des cinétiques, réduisant potentiellement l’efficacité thérapeutique.
Bien que les pansements à base d’hydrogel soient largement utilisés pour leur biocompatibilité et leur capacité à maintenir un environnement humide de la plaie, ils n’ont souvent pas la capacité de fournir une administration contrôlée et localisée de molécules bioactives telles que les VE. L’incorporation de VE dans le système d’échafaudage offre un avantage unique en combinant un soutien structurel avec un composant thérapeutique biologiquement actif, dérivé de cellules, qui peut moduler les réponses immunitaires et améliorer la régénération des tissus.
De même, les systèmes d’administration médiés par des nanoparticules sont très efficaces pour cibler des voies cellulaires spécifiques ; Cependant, ils peuvent rencontrer des problèmes de rétention au site de la plaie et nécessitent souvent des agents stabilisants supplémentaires pour maintenir la bioactivité30. En revanche, le système d’échafaudage présenté fournit un microenvironnement protecteur qui préserve la bioactivité des VE lors de la livraison24.
Bien que ce protocole offre des résultats prometteurs, il y a certaines limites qui doivent être prises en compte. L’un des défis consiste à obtenir une distribution uniforme des VE au sein de l’échafaudage. Les variations dans le processus de mélange peuvent entraîner des incohérences dans la concentration des VE à travers l’échafaudage, ce qui pourrait affecter la reproductibilité. Pour surmonter ce défi, la technique de mélange des seringues est un avantage. De plus, un contrôle précis des conditions de gélification et de réticulation, telles que la concentration d’ions calcium pour les échafaudages d’alginates, est essentiel pour garantir des propriétés mécaniques et une intégrité structurelle optimales. Les écarts dans ces paramètres peuvent compromettre les performances de l’échafaudage. Une autre limitation est la perte potentielle de VE lors de la préparation de l’échafaudage, car ils peuvent adhérer à la vaisselle en plastique pendant les étapes de lavage. Enfin, la durée de conservation des échafaudages préparés est relativement courte, car les matrices d’hydrogel peuvent se dégrader ou perdre de leur fonctionnalité au fil du temps. Il est donc recommandé d’utiliser immédiatement ou de stocker à court terme à 4 °C. Un test périodique de bioactivité des VE encapsulés est nécessaire pour confirmer leur stabilité18. En s’attaquant à ces limites et en utilisant les stratégies de dépannage suggérées, les chercheurs peuvent améliorer la reproductibilité et l’efficacité de ce protocole dans leurs applications.
La méthode de conception d’échafaudages à gaine centrale présente une avancée significative pour l’administration de médicaments par rapport aux conceptions d’échafaudages traditionnelles qui manquent de mécanismes de libération contrôlés31. Contrairement aux échafaudages monophasés qui peuvent ne pas fournir une libération adéquate ou opportune des agents thérapeutiques, cette méthode offre une approche dynamique de l’administration des VE avec une précision accrue. L’utilisation d’un matériau de base à dégradation rapide et d’une gaine fonctionnelle permet une intervention thérapeutique plus ciblée et efficace par rapport aux méthodes conventionnelles, qui nécessitent souvent des ajustements manuels ou séquentiels.
Bien que les matériaux d’échafaudage utilisés dans cette étude, tels que l’Alg et le CMCh, soient connus pour leur biocompatibilité, une évaluation plus approfondie de leur biocompatibilité à long terme dans les environnements de plaies chroniques est nécessaire pour l’application clinique. Dans nos travaux précédents, nous avons étudié les effets in vivo de l’échafaudage dans un modèle animal préclinique et n’avons observé aucun effet toxique ou réponse immunitaire significative, suggérant que les matériaux sont bien tolérés à court terme18. Cependant, la biocompatibilité à long terme, y compris les réponses immunitaires potentielles et les effets des sous-produits de dégradation, nécessite une exploration plus approfondie. La dégradation des matériaux de l’échafaudage pourrait potentiellement libérer des sous-produits susceptibles d’influencer le processus de cicatrisation des plaies ou de provoquer une inflammation chronique, en particulier dans le contexte de modèles diabétiques ou âgés, où la réponse immunitaire peut être altérée. Par conséquent, il est crucial de mener des études supplémentaires pour évaluer comment les produits de dégradation affectent le microenvironnement de la plaie et la régénération globale des tissus. Nous reconnaissons que d’autres tests de biocompatibilité, y compris des études in vivo à long terme axées sur les réponses immunitaires et la dégradation de l’échafaudage, sont essentiels pour comprendre l’innocuité et la pertinence clinique de cette approche pour la cicatrisation chronique des plaies.
Cette conception d’échafaudage est particulièrement importante dans les domaines de l’ingénierie tissulaire et de la médecine régénérative. Sa capacité à délivrer des VE rapidement et de manière contrôlée le rend précieux pour des applications telles que la cicatrisation chronique des plaies, la réparation du cartilage et d’autres efforts de régénération tissulaire32. En s’attaquant aux problèmes liés à la dégradation de l’échafaudage et à la libération de VE, la méthode est prometteuse pour améliorer les résultats des patients dans ces domaines. De plus, son potentiel de personnalisation et d’adaptation à différents types de tissus souligne sa polyvalence et sa pertinence dans l’avancement de la médecine personnalisée.
L’utilisation du modèle de souris diabétique Akita dans cette étude fournit une plate-forme précieuse pour étudier la cicatrisation chronique des plaies dans des conditions diabétiques. Ce modèle imite les principales caractéristiques physiopathologiques des plaies diabétiques humaines, notamment l’hyperglycémie persistante, l’angiogenèse retardée et l’altération de la réparation tissulaire33,34. De plus, il offre l’avantage d’une cohérence génétique et d’une apparition spontanée du diabète sans avoir besoin d’induction chimique externe, ce qui réduit la variabilité des résultats expérimentaux33. Cependant, il est important de reconnaître les limites de ce modèle lors de l’application des résultats aux plaies chroniques humaines. L’architecture de la peau murine diffère de la peau humaine, en particulier par son épiderme plus mince, sa structure dermique plus lâche et le rôle prédominant de la contraction de la plaie plutôt que de la réépithélialisation pendant la cicatrisation35. De plus, les réponses immunitaires et les profils inflammatoires murins ne sont pas entièrement représentatifs de ceux observés chez l’homme, ce qui peut affecter l’interprétation des thérapies de modulation immunitaire36. Malgré ces différences, le modèle Akita reste un outil largement accepté et efficace pour les études précliniques en raison de sa capacité à récapituler les complications systémiques du diabète au cœur de la pathogenèse chronique des plaies. Afin de valider davantage le potentiel translationnel de l’approche thérapeutique proposée, des études futures sont nécessaires pour compléter les résultats du modèle Akita. D’autres systèmes pertinents pour l’homme, tels que des modèles de peau humaine ex vivo ou des modèles de grands animaux diabétiques, seraient d’un grand soutien.
En conclusion, la conception d’échafaudage proposée avec libération contrôlée de VE marque une avancée significative dans l’administration d’agents thérapeutiques. Malgré les complexités techniques, cette approche innovante offre des avantages significatifs par rapport aux méthodes existantes et présente un grand potentiel pour améliorer les pansements chroniques.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts.
Remerciements
Un merci spécial à Said Al-Hashmi et Abdulrahman Almharbi de Happy Production pour leur excellent travail de tournage. Nous exprimons également notre gratitude au ministère de l’Enseignement supérieur, de la Recherche et de l’Innovation et à l’Université de Nizwa pour leur soutien financier et pour avoir fourni les ressources nécessaires.
matériels
| Name | Company | Catalog Number | Comments |
| 23 G Purple precision conical Nozzle | Cellink | KT0000002000 | To provide precise extrusion of bioinks with minimal clogging |
| Alginate lyase (AlgLyase) | Sigma Aldrich | A1603-100MG | Algyase is an enzyme that degrades alginate. |
| Amicon Ultra Centrifugal Filter, 30 kDa MWCO | Merck | UFC9030 | Used to wash PKH-26 labeled-EVs |
| BCA assay Kit | Thermo Scientific | 10678484 | To determine the protein/EVs concentration |
| Bioprinting System | Regemat | V1 | To fabricate core-sheath scaffold |
| Bovine serum albumin (BSA) | sigma-aldrich | 05470-5G | To stop PKH 26 reaction |
| Calcium chloride | Sigma Aldrich | C3306-100G | To crosslink and stabilize bioinks in tissue engineering |
| Centrifuge | Sigma | 2-16P | Used for EVs isolation |
| Centrifuge 5810 R | Eppendorf | 22625101 | Used for cell culture |
| Class II Biological Safety Cabinet | Telstar | Bio II Advance | Cell culture |
| CryoCube F570 Series - ULT Freezer | Eppendorf | F571240035 | To store EVs |
| fluorescent microscope | OLYMPUS | IX73P1F | Used to check the residual PKH-26 in the filtrate |
| Gentamicin (50 mg/mL) | Thermofisher | 15750 | Antibiotic for cell culture media |
| GlutaMAX-I CTS, (100X), liquid | Thermofisher | A12860 | Cell culture media supplement |
| HCl | Sigma Aldrich | 7647-01-0 | Buffer preparation |
| HEPES | Carl Roth | Art. No. 6763.3 | Buffer preparation |
| High viscous carboxymethyl cellulose (CMCh) | BDH | 27929 4T | CMCh is a water-soluble cellulose derivative. |
| Incubator | New Brunswick | NB-170R | Cell culture |
| Invivo imaging | PerkinElmer | IVIS Lumina XRMS Series III | To track EVs release, in vivo |
| Magnet stirer | SalvisLAB | MC35 | For Bioinks preparation |
| miRCURY Exosome Kits for Exosome Isolation | Qiagen | 76743 | Evs isolation |
| NaOh | Daejung | 1310-73-2 | Buffer preparation |
| phosphate buffered saline(PBS) | Thermo Scientific | J61196.AP | Cell culture |
| PKH 26 | MCE | 154214-55-8 | Red fluorescent dye for labeling theEVs |
| Sodium alginate (Alg) | Sigma Aldrich | A0682-100G | Natural polysaccharide derived from brown seaweed. |
| Sodium chloride (NaCl) | Carl Roth | Art-Nr-P029.1 | Buffer preparation |
| StemPro BM Mesenchymal Stem Cells | Thermofisher | A1382901 | Mesenchymal stem cells |
| StemPro MSC SFM XenoFree | Thermofisher | A1067501 | Cell culture media |
| Trypsin 0.25% | Thermofisher | 25050014 | Cell dissociation |
| Vortex-Mixer | Daihan Scientific | VM-10 | Used to mix precipitation buffer with the conditioned media |
Références
- Falanga, V., et al. Chronic wounds. Nat Rev Disease Primers. 8 (1), 50 (2022).
- Tran, H. Q., Shahriar, S. S., Yan, Z., Xie, J. Recent advances in functional wound dressings. Adv Wound Care. 12 (7), 399-427 (2023).
- Shao, M., et al. Emerging trends in therapeutic algorithm of chronic wound healers: Recent advances in drug delivery systems, concepts-to-clinical application and future prospects. Crit Rev Ther Drug Carrier Syst. 34 (5), 385-452 (2017).
- Rezvani Ghomi, E., Khalili, S., Nouri Khorasani, S., Esmaeely Neisiany, R., Ramakrishna, S. Wound dressings: Current advances and future directions. J Appl Poly Sci. 136 (27), 47738 (2019).
- Ding, J. Y., et al. Mesenchymal stem cell-derived extracellular vesicles in skin wound healing: Roles, opportunities and challenges. Military Med Res. 10 (1), 36 (2023).
- Sharma, D., Kumar, A., Mostafavi, E. Extracellular vesicle-based biovectors in chronic wound healing: Biogenesis and delivery approaches. Mol Ther Nucleic Acids. 32, 822-840 (2023).
- Vader, P., Mol, E. A., Pasterkamp, G., Schiffelers, R. M. Extracellular vesicles for drug delivery. Adv Drug Delivery Rev. 106, 148-156 (2016).
- Han, P., Ivanovski, S. 3d bioprinted extracellular vesicles for tissue engineering-a perspective. Biofabrication. 15 (1), 013001 (2022).
- Annabi, N., et al. 25th anniversary article: Rational design and applications of hydrogels in regenerative medicine. Adv Mater. 26 (1), 85-124 (2014).
- Zheng, Y., Pan, C., Xu, P., Liu, K. Hydrogel-mediated extracellular vesicles for enhanced wound healing: The latest progress, and their prospects for 3d bioprinting. J Nanobiotechnol. 22 (1), 57 (2024).
- Keener, A. B. How extracellular vesicles can enhance drug delivery. Nature. 582 (7812), S14-S14 (2020).
- Han, P., et al. 3d bioprinted small extracellular vesicles from periodontal cells enhance mesenchymal stromal cell function. Biomater Adv. 158, 213770 (2024).
- Born, L. J., et al. Sustained released of bioactive mesenchymal stromal cell-derived extracellular vesicles from 3d-printed gelatin methacrylate hydrogels. J Biomed Mater Res A. 110 (6), 1190-1198 (2022).
- Kjar, A., Mcfarland, B., Mecham, K., Harward, N., Huang, Y. Engineering of tissue constructs using coaxial bioprinting. Bioact Mater. 6 (2), 460-471 (2021).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3d bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Deshayes, S., Kasko, A. M. Polymeric biomaterials with engineered degradation. J Poly Sci A Poly Chem. 51 (17), 3531-3566 (2013).
- Xu, Q., et al. Injectable hyperbranched poly (β-amino ester) hydrogels with on-demand degradation profiles to match wound healing processes. Chem Sci. 9 (8), 2179-2187 (2018).
- Vakilian, S., et al. Engineered local delivery of extracellular vesicles loaded with si-tnf-α, via a core-sheath 3d-bio-printed scaffold as an effective wound dressing. J Drug Delivery Sci Technol. 101, 106189 (2024).
- Mirsanei, Z., et al. Synergistic effects of mesenchymal stem cell-derived extracellular vesicles and dexamethasone on macrophage polarization under inflammatory conditions. Inflammopharmacology. 32 (2), 1317-1332 (2024).
- Ma, Y., Brocchini, S., Williams, G. R. Extracellular vesicle-embedded materials. J Controlled Release. 361, 280-296 (2023).
- Jia, Q., Zhao, H., Wang, Y., Cen, Y., Zhang, Z. Mechanisms and applications of adipose-derived stem cell-extracellular vesicles in the inflammation of wound healing. Front Immunol. 14, 1214757 (2023).
- Lou, P., et al. Extracellular vesicle-based therapeutics for the regeneration of chronic wounds: Current knowledge and future perspectives. Acta Biomater. 119, 42-56 (2021).
- Cai, Y., Chen, K., Liu, C., Qu, X. Harnessing strategies for enhancing diabetic wound healing from the perspective of spatial inflammation patterns. Bioactive Mater. 28, 243-254 (2023).
- Li, Z., et al. Multifunctional hydrogel-based engineered extracellular vesicles delivery for complicated wound healing. Theranostics. 14 (11), 4198 (2024).
- Cabral, J., Ryan, A. E., Griffin, M. D., Ritter, T. Extracellular vesicles as modulators of wound healing. Adv Drug Delivery Rev. 129, 394-406 (2018).
- Moghadasi Boroujeni, S., Mashayekhan, S., Vakilian, S., Ardeshirylajimi, A., Soleimani, M. The synergistic effect of surface topography and sustained release of tgf-β1 on myogenic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 104 (7), 1610-1621 (2016).
- Jayaraman, P., et al. Controlled release of drugs in electrosprayed nanoparticles for bone tissue engineering. Adv Drug Delivery Rev. 94, 77-95 (2015).
- Huang, X., Brazel, C. S. On the importance and mechanisms of burst release in matrix-controlled drug delivery systems. J Controlled Release. 73 (2-3), 121-136 (2001).
- Smith, A. M., Senior, J. J. Alginate hydrogels with tuneable properties. Adv Biochem Eng Biotechnol. 178, 37-61 (2021).
- Yan, X., Sha, X. Nanoparticle-mediated strategies for enhanced drug penetration and retention in the airway mucosa. Pharmaceutics. 15 (10), 2457 (2023).
- Pant, B., Park, M., Park, S. -. J. Drug delivery applications of core-sheath nanofibers prepared by coaxial electrospinning: A review. Pharmaceutics. 11 (7), 305 (2019).
- Pinheiro, A., et al. Extracellular vesicles: Intelligent delivery strategies for therapeutic applications. J Controlled Release. 289, 56-69 (2018).
- Yoshioka, M., Kayo, T., Ikeda, T., Koizuni, A. A novel locus, mody4, distal to d7mit189 on chromosome 7 determines early-onset niddm in nonobese c57bl/6 (akita) mutant mice. Diabetes. 46 (5), 887-894 (1997).
- Fang, R. C., et al. Limitations of the db/db mouse in translational wound healing research: Is the noncnzo10 polygenic mouse model superior. Wound Repair Regen. 18 (6), 605-613 (2010).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. J Dermatol Sci. 90 (1), 3-12 (2018).
- Sellers, R. S. Translating mouse models: Immune variation and efficacy testing. Toxicol Pathol. 45 (1), 134-145 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon