Method Article
Ottimizzazione dell'erogazione di vescicole extracellulari utilizzando un'impalcatura biostampata in 3D con guaina centrale per la gestione delle ferite croniche
In questo articolo
Riepilogo
Questo studio presenta un protocollo per la fabbricazione di scaffold stampati in 3D con guaina centrale per la guarigione cronica delle ferite. Le vescicole extracellulari sono isolate dalle cellule staminali mesenchimali e caricate nel nucleo (alginato) con la guaina in carbossimetilcellulosa e alginato liasi. Questo design consente il degrado controllato dell'impalcatura e il rilascio efficiente delle vescicole extracellulari.
Abstract
Questo studio delinea un protocollo dettagliato per la fabbricazione di scaffold biostampati in 3D con guaina centrale progettati per migliorare la guarigione delle ferite croniche. Il protocollo prevede l'isolamento di vescicole extracellulari (EV) da cellule staminali mesenchimali (MSC), note per le loro proprietà rigenerative e immunomodulatorie. Queste vescicole extracellulari vengono quindi incorporate in un'unica struttura di impalcatura. L'impalcatura è caratterizzata da un nucleo composto da alginato caricato con EV, circondato da una guaina in carbossimetilcellulosa e alginato liasi. Questo design innovativo garantisce una degradazione controllata dell'impalcatura, promuovendo al contempo un rilascio efficiente e controllato delle vescicole extracellulari nel sito della ferita. Il protocollo copre passaggi chiave, tra cui la preparazione e la caratterizzazione delle vescicole extracellulari, la formulazione di bio-inchiostri per il bioprinting 3D e l'ottimizzazione dei parametri di stampa per ottenere l'architettura core-sheath desiderata. Combinando integrità strutturale e bioattività, lo scaffold mira ad affrontare i limiti delle medicazioni convenzionali per ferite, offrendo un approccio mirato per accelerare la rigenerazione dei tessuti e ridurre l'infiammazione nelle ferite croniche. Questo metodo fornisce una strategia riproducibile e scalabile per lo sviluppo di biomateriali avanzati con potenziali applicazioni cliniche nella gestione delle ferite croniche. Il protocollo evidenzia anche considerazioni critiche per ottenere risultati coerenti, garantendo l'adattabilità per future applicazioni terapeutiche.
Introduzione
Le ferite croniche, spesso legate a un'infiammazione eccessiva, richiedono una gestione tempestiva per prevenire gravi complicazioni come infezioni e necrosi tissutale, che possono portare ad amputazioni. Nonostante i progressi, i trattamenti attuali rimangono costosi, scomodi, hanno effetti collaterali e hanno un'efficacia limitata, evidenziando la necessità di medicazioni più curative 1,2,3. Lo sviluppo di una nuova generazione di medicazioni specificamente progettate per le ferite croniche è essenziale per affrontare queste sfide. Inoltre, la natura complessa della guarigione delle ferite richiede materiali di medicazione con una gamma di proprietà, tra cui idratazione, flessibilità, adesione, bioattività e biodegradabilità4. Questo studio mira a sviluppare una medicazione per ferite bioingegnerizzata che integri vescicole extracellulari (EV) con un'impalcatura biostampata in 3D con guaina centrale per fornire un ambiente terapeutico controllato e accelerare la guarigione delle ferite croniche.
Le vescicole extracellulari derivate dalle cellule staminali aiutano la guarigione cronica delle ferite promuovendo le risposte antinfiammatorie, la crescita cellulare, la migrazione e la formazione dei vasi sanguigni5. Inoltre, le vescicole extracellulari possono fornire molecole bioattive, tra cui farmaci a piccole molecole, costrutti genici e proteici per la gestione delle ferite croniche6. Inoltre, la loro capacità di proteggere il carico dalla degradazione enzimatica migliora la stabilità e la biodisponibilità degli agenti terapeutici, offrendo vantaggi distinti rispetto ai fattori di crescita convenzionali e ai farmaci a piccole molecole, che spesso si degradano rapidamente in vivo7. Nonostante questi vantaggi, la somministrazione efficiente e prolungata di vescicole extracellulari ai tessuti bersaglio rimane una sfida significativa.
Gli scaffold di bioprinting 3D possono fungere da piattaforma di consegna per le vescicole extracellulari per potenziarne gli effetti terapeutici8. Questi scaffold imitano gli ambienti cellulari naturali e consentono il rilascio controllato di vescicole extracellulari 9,10. Inoltre, proteggono le vescicole extracellulari dalla degradazione, migliorando la stabilità dei loro microRNA e delle loro proteine11. Han et al. hanno dimostrato che le vescicole extracellulari possono essere efficacemente rilasciate da scaffold GelMA biostampati in 3D. Questo rilascio ha portato a un migliore attaccamento cellulare e a un aumento dell'espressione genica correlata alle vie di meccanotrasduzione nelle cellule staminali mesenchimali del cuscinetto adiposo buccale umano (hBFP-MSC) seminate sugli scaffold12. Born et al., ottimizzando la concentrazione del reticolante, hanno ottenuto un rilascio controllato delle vescicole extracellulari. Questo approccio si è dimostrato efficace nel promuovere l'angiogenesi e offre un metodo promettente per la somministrazione regolata di EV13.
La biostampa 3D Core-sheath consente la creazione di strutture complesse e multi-materiale stampando un materiale di base racchiuso in una guaina. Il nucleo può includere cellule, fattori di crescita o farmaci, mentre la guaina offre supporto meccanico e protezione o funge da barriera. Questo metodo ha applicazioni nell'ingegneria tissutale e nella medicina rigenerativa, come lo sviluppo di reti vascolari, l'imitazione delle strutture tissutali naturali e la creazione di sistemi di somministrazione di farmaci. Consente un controllo preciso sulla distribuzione e la composizione dei materiali, migliorando la funzionalità e la rilevanza biologica dei costrutti. Rispetto alle tecniche alternative, il bioprinting 3D core-sheath fornisce un controllo preciso sulla distribuzione e la composizione del materiale, migliorando la funzionalità e la rilevanza biologica dei costrutti14,15.
La degradazione ingegnerizzata nelle medicazioni delle ferite offre vantaggi quali la riduzione del disagio durante i cambi, un ambiente umido per la guarigione e il controllo delle infezioni, una somministrazione terapeutica tempestiva e una rigenerazione tissutale ottimale 16,17,18. Gli idrogel di alginato (Alg) e carbossimetilcellulosa (CMCh) sono biocompatibili ed efficaci per vescicole extracellulari (EV) sulle ferite, migliorando la guarigione attraverso la comunicazione cellulare e la riduzione dell'infiammazione18. In questo studio, le vescicole extracellulari sono state integrate in un nucleo di Alg, mentre una guaina di CMCh e AlgLiasi (AlgLiasi) è stata utilizzata per consentire una rapida degradazione della medicazione e la somministrazione di vescicole extracellulari. Questo design della guaina centrale facilita il rilascio rapido delle vescicole extracellulari in risposta alla degradazione dell'impalcatura, migliorandone l'efficacia terapeutica e affrontando i limiti dei trattamenti esistenti per le ferite croniche. L'obiettivo principale di questo studio è sviluppare una medicazione bioingegnerizzata che migliori la guarigione delle ferite integrando il rilascio controllato di vescicole extracellulari con un'impalcatura degradabile in modo reattivo, migliorando in ultima analisi i risultati del trattamento per le ferite croniche.
Protocollo
La ricerca sugli animali è stata condotta in piena conformità con gli standard etici stabiliti dal Comitato Nazionale di Bioetica e dal Comitato di Etica Animale dell'Università di Nizwa. L'approvazione etica per questo studio è stata concessa con l'autorizzazione ID: VCGSR, AREC/01/2023. Tutti gli animali sono stati alloggiati in condizioni di laboratorio standard, garantendo controlli ambientali ottimali, una corretta alimentazione e cure complete per salvaguardare il loro benessere durante lo studio. Tutte le procedure che coinvolgono gli animali hanno aderito rigorosamente alle politiche istituzionali, agli standard internazionali per la cura degli animali e alle linee guida ARRIVE.
1. Coltura cellulare
- Recuperare una fiala di MSC (passaggio #2) dallo stoccaggio di azoto liquido e maneggiarla con tecniche asettiche per prevenire la contaminazione. Scongelare rapidamente le cellule a bagnomaria a 37 °C, assicurandosi di rimuoverle non appena rimane un piccolo frammento di ghiaccio.
- Preparare un terreno completo che includa MSC SFM Basal Medium, integrato con l'integratore MSC SFM XenoFree all'1% (v/v), GlutaMAX all'1% (v/v) e gentamicina allo 0,01% (v/v). Aggiungere 1 ml di terreno completo preriscaldato (37 °C) alla velocità di 3-5 gocce ogni 5 s, nella fiala e quindi mescolarlo delicatamente. Trasferire l'intero contenuto del flaconcino di MSC in una provetta conica da 15 mL contenente 4 mL di terreno completo preriscaldato, in condizioni asettiche in una cappa di biosicurezza di Classe II.
- Centrifugare le celle a 200 x g per 5 minuti a temperatura ambiente. Assicurarsi che la centrifuga sia bilanciata correttamente.
- Aspirare il surnatante e risospendere le cellule in 1 mL di terreno completo preriscaldato. Quindi, trasferire le cellule in un pallone T25 contenente 4 mL di terreno completo.
- Inclinare delicatamente il pallone per assicurarsi che le celle siano distribuite uniformemente. Incubare il matraccio a 37 °C con CO2 al 5%.
- Cambiare il substrato ogni 2 giorni, sostituendolo con un substrato fresco, preriscaldato e completo. Utilizzare un pipettaggio delicato per evitare la rottura delle cellule. Al raggiungimento del 70%-80% di confluenza, aspirare il terreno esaurito dal pallone T25.
- Lavare le cellule con 3 ml di PBS fresco per rimuovere i residui. Garantire la copertura completa del pallone durante il lavaggio.
- Aggiungere 1 mL di soluzione di tripsina allo 0,25% al pallone T25, incubarlo a 37 °C per 3-7 minuti e monitorare attentamente il distacco al microscopio con un ingrandimento di 4x.
- Se necessario, picchiettare delicatamente il pallone per garantire il completo distacco della cella. Aggiungere il terreno completo preriscaldato al pallone e pipettare su e giù sulla superficie per facilitare il distacco delle cellule. Quindi, trasferire la sospensione cellulare in una provetta da centrifuga da 15 mL.
- Centrifugare la provetta a 200 x g per 5 minuti a temperatura ambiente. Sospendere il pellet cellulare in un terreno fresco e completo e contare le cellule utilizzando un emocitometro Neubauer. Trasferire le cellule in un matraccio T75. Garantire una densità di semina di 5.000 cellule/cm2 per una crescita ottimale.
- Incubare le cellule a 37 °C con CO2 al 5%. Dopo 72 ore di incubazione cellulare, raccogliere il terreno condizionato dalle cellule per l'isolamento delle vescicole extracellulari. Utilizzare immediatamente dopo la raccolta.
2. Isolamento delle vescicole extracellulari
- Centrifugare i 13 mL del terreno condizionato raccolto a 800 x g per 15 minuti per rimuovere i detriti cellulari. Filtrare delicatamente il surnatante utilizzando un filtro per siringa da 0,22 μm per rimuovere le particelle di grandi dimensioni.
- Aggiungere 5 mL di tampone di precipitazione al terreno condizionato filtrato e agitare accuratamente per mescolare. Assicurarsi che la soluzione sia omogenea.
- Incubare la miscela per una notte a 4 °C per consentire alle vescicole extracellulari di precipitare. Centrifugare la miscela a 3,220 x g per 30 minuti a 20 °C. Controllare il bilanciamento dei tubi.
- Scartare con cura il surnatante senza disturbare il pellet. Centrifugare nuovamente il pellet a 3.220 x g per 5 s per rimuovere il liquido residuo.
- Pipettare delicatamente il pellet EV in 200 μL di PBS per evitare danni ai EV. Misurare la concentrazione proteica delle EV seguendo le istruzioni del produttore (BCA Protein Assay Kit).
- Eseguire il Western blotting per rilevare i marcatori specifici delle vescicole extracellulari (CD63, CD81 e CD9), per verificare il fenotipoEV 18. L'analisi ha confermato la presenza di questi marcatori, convalidando l'identità delle EVs19.
- Per ridurre al minimo il rischio di contaminazione da RNasi, si consiglia di utilizzarlo direttamente senza ulteriore stoccaggio. In caso di necessità, conservare le EV a -80 °C per un ulteriore utilizzo. Aliquotare la sospensione dei veicoli elettrici in volumi di 40 μl per evitare ripetuti cicli di gelo-scongelamento.
3. Etichettatura dei veicoli elettrici con PKH-26
- Preparazione del tampone
- Sciogliere 0,238 g di HEPES in circa 90 ml di acqua ultrapura sterile in un contenitore sterile. Utilizzare una soluzione HEPES preparata al momento. Aggiungere 0,85 g di NaCl alla soluzione HEPES.
- Regolare il pH a 7,4 utilizzando 1 M NaOH o HCl, a seconda delle esigenze, utilizzando un pHmetro calibrato. Aggiungere acqua deionizzata per portare il volume totale a 100 ml. Filtrare la soluzione attraverso un filtro da 0,22 μm per sterilizzarla.
- Diluire 4 μL di colorante PKH-26 in 1 mL di tampone preparato. Mescolare accuratamente con la pipetta per garantire l'omogeneità.
- Risospendere le EV purificate in 1 mL di PBS a una concentrazione di 700 μg/mL. Aggiungere 1 mL della sospensione EVs a 1 mL della soluzione PKH-26 preparata. Per il gruppo di controllo con solo colorante, aggiungere 1 mL di terreno completo senza EV a 1 mL della soluzione PKH-26. Tutti i passaggi successivi vengono eseguiti anche per il gruppo di controllo per tenere conto della potenziale aggregazione aspecifica o della formazione di micelle.
- Mescolare accuratamente le EV capovolgendo delicatamente il tubo 10x-15x. Incubare la miscela per 3-5 minuti a temperatura ambiente, garantendo un'esposizione uniforme delle vescicole extracellulari al colorante.
- Preparare 2 mL di soluzione fresca di BSA all'1% utilizzando acqua ultrapura sterile e aggiungerla ai 2 mL della miscela risultante per estinguere la reazione di marcatura. Mescolare delicatamente per evitare l'aggregazione.
- Concentrare le vescicole extracellulari marcate con PKH-26 secondo il protocollo sopra menzionato (passaggi 2.2-2.7). Risospendere le EV marcate in 300 μL di PBS. Pipettare il campione di EVs marcato PKH-26 in una provetta filtrante da 30 kDa.
- Centrifugare il campione a 3.220 x g per 30 minuti a 4 °C. Durante questa fase, il colorante libero PKH-26 e le piccole molecole passeranno attraverso la membrana nel filtrato, mentre le EV marcate con PKH-26 saranno trattenute nel retentato.
- Dopo la centrifugazione iniziale, scartare il filtrato e aggiungere 300 μl di PBS al retentato. Risospendere delicatamente le EV nel PBS pipettando su e giù.
- Centrifugare nuovamente il campione a 3.220 x g per 30 minuti a 4 °C per lavare via eventuali residui di colorante libero o piccole molecole.
- Confermare la mancanza di PKH-26 nella soluzione filtrata con un microscopio a fluorescenza. Se viene rilevato del colorante, ripetere i passaggi di lavaggio.
- Raccogliere la soluzione di testa con una micropipetta e rimuovere il filtro dalla provetta di raccolta. Capovolgere con cautela il filtro (capovolgerlo).
- Centrifugare il filtro invertito a 800 x g per 5 minuti a 4 °C. Ciò contribuirà a raccogliere i PKH-26-EV trattenuti dalla membrana del filtro nel nuovo tubo di raccolta. Usa direttamente il PKH-26-EV per il passaggio successivo.
4. 3D Bio-stampa
- Preparazione Bioinks
- Preparare una soluzione fresca di Alg sodica al 4,5% (p/v) utilizzando acqua ultrapura sterile. Agitare per una notte a 60 °C per consentire alla soluzione di sciogliersi completamente.
- Sciogliere la CMCh in acqua sterile ultrapura per ottenere una soluzione al 3,8% (p/v). Preparare fresco. Mescolare per una notte a 60 °C per sciogliere completamente.
- Centrifugare i bioink preparati a 3.220 x g per 10 minuti a 25°C per rimuovere eventuali bolle che potrebbero interferire con il processo di stampa.
- Miscelare i 3 mL preparati di soluzione di Alg con le EV marcate o il controllo del solo colorante utilizzando un miscelatore a siringa per ottenere la concentrazione dello 0,01% (p/v) di EV. Garantire una distribuzione uniforme grazie a una miscelazione delicata.
- Utilizzando un miscelatore a siringa, combinare 1 mL di CMCh con una soluzione di AlgLyase appena preparata in acqua ultrapura sterile per ottenere una concentrazione finale di 0,5 mU/mL.
- Come illustrato nella Figura 1A, caricare contemporaneamente il bioink Alg/Exo nella parte centrale e il bioink CMCh/AlgLyase nella parte della guaina della configurazione della siringa core/guaina.
- Lasciare riposare i bioink per 15 minuti prima di stampare.
- Configurazione della stampante 3D-bio
- Utilizzando il software 3D-bioprinter, crea la struttura dell'impalcatura selezionando una forma cilindrica con un modello di riempimento diagonale. A tale scopo, impostare il diametro e l'altezza del cilindro rispettivamente su 20 mm e 1,1 mm. Configurare la dimensione dei pori su 1 mm.
- Impostare la velocità di pompaggio dell'anima e dell'ugello della guaina a 1 mm/s con uno spessore di 0,25 mm per strato e impostare la velocità di movimento a 6 mm/s. Stampa quattro strati con uno spessore di 0,25 mm per strato a temperatura ambiente.
- Inizia a stampare su pellicola di poliestere.
- Utilizzare l'umidificatore con aerosol di cloruro di calcio (2,2%) per reticolare lo scaffold durante il processo di estrusione. Posizionare l'ugello dell'umidificatore a circa 20 cm di distanza dalla testa di estrusione per garantire un'efficace reticolazione senza compromettere la struttura dell'impalcatura. Per un'ulteriore reticolazione, immergere lo scaffold in una soluzione di cloruro di calcio (2,2%) per 10 minuti.
- Sciacquare l'impalcatura 3 volte con acqua sterile ultrapura per rimuovere l'eccesso di cloruro di calcio e bioink non legato.
- Assicurarsi che l'impalcatura sia conservata in un ambiente sterile a 4 °C per mantenere l'integrità e la funzionalità dell'impalcatura per un massimo di tre mesi.
5. Monitoraggio del rilascio dei veicoli elettrici
- Creazione di un modello circolare di ferita cutanea
- Anestetizzare i topi diabetici eterozigoti maschi Akita (8 settimane) somministrando un'iniezione intraperitoneale di ketamina (70 mg/kg) e xilazina (10 mg/kg). Confermare la corretta anestesia valutando l'assenza di risposte riflesse (ad esempio, pizzicamento delle dita dei piedi) e monitorare la frequenza respiratoria. Per prevenire la secchezza corneale durante l'anestesia, applicare un unguento oftalmico veterinario sterile sugli occhi.
- Preparare la zona della pelle dorsale rasandola prima con un tagliacapelli elettrico. Evitare irritazioni o lesioni alla pelle. Sterilizzare l'area rasata utilizzando una soluzione di iodio povidone.
- Utilizzando un sequestro sterile, creare una ferita cutanea circolare a tutto spessore di 6 mm sulla superficie dorsale di ciascun topo.
- Posiziona delicatamente l'impalcatura biostampata in 3D contenente EV marcate con PKH direttamente sul letto della ferita. Assicurarsi che l'impalcatura copra completamente la superficie della ferita con sacche d'aria minime premendo leggermente con una pinza sterile. Assicurarsi che l'animale sia attentamente osservato dopo la procedura e rimanga assistito fino a quando non ha ripreso completamente conoscenza e può mantenere la decubito sternale.
- Imaging fluorescente
- A 2 ore, 4 ore, 8 ore, 24 ore dopo l'impianto, anestetizzare i topi usando isoflurano. Per l'induzione dell'anestesia, posizionare i topi nella camera del sistema di imaging in vivo (IVIS) ed esporli al 2%-3% di isoflurano nell'ossigeno. Applicare un unguento oftalmico sugli occhi dei topi per prevenire la secchezza. Una volta anestetizzati, trasferire i topi nel sistema IVIS e mantenerli con l'1%-2% di isoflurano in ossigeno erogato attraverso i canali nasali. Verificare che gli animali siano completamente anestetizzati e stabili prima di procedere con l'imaging.
- Utilizza il sistema IVIS per catturare i segnali fluorescenti dalle vescicole extracellulari marcate con PKH rilasciate dall'impalcatura. Nella procedura guidata di imaging, selezionare l'opzione Imaging a fluorescenza e attivare i filtri di eccitazione ed emissione per il colorante PKH. Regola le impostazioni della fotocamera, incluso il campo visivo e l'altezza del soggetto, per ottimizzare il rilevamento del segnale. Garantisci un posizionamento coerente in tutti i punti temporali dell'imaging per consentire confronti accurati. Inizia ad acquisire le immagini e salva i dati risultanti.
- Quantificare l'intensità del segnale fluorescente utilizzando il software IVIS. Ciò consentirà di monitorare il rilascio di veicoli elettrici nel tempo.
Risultati
Il rilascio in vivo di EV sia dagli scaffold Alg-EVs/CMCh che da Alg-EVs/CMCh-AlgLyase è illustrato nella Figura 1B, C. Come anticipato, l'impalcatura Alg-EVs/CMCh-AlgLyase ha mostrato un profilo di rilascio più rapido rispetto ad Alg-EVs/CMCh, in particolare nei punti temporali di 2 h e 4 h. Il rilascio di vescicole extracellulari dagli idrogel è governato da una combinazione di meccanismi fisico-chimici, tra cui diffusione, rigonfiamento, erosione e degradazione20. Sfruttando l'Alglyase, l'impalcatura facilita la scomposizione dell'Alg, accelerando il rilascio di EV per controllare efficacemente l'infiammazione cronica nelle prime fasi della guarigione delle ferite. Il rilascio precoce di EV è fondamentale per mitigare l'infiammazione eccessiva, che può ritardare la guarigione 21,22,23. Per tenere conto della potenziale aggregazione aspecifica o della formazione di micelle, è stato analizzato anche il gruppo di controllo, rivelando segnali fluorescenti trascurabili. Questa osservazione conferma che i segnali rilevati provengono prevalentemente dalle vescicole extracellulari etichettate.
Questi risultati riflettono il ruolo critico della composizione dell'impalcatura nella modulazione dei tassi di rilascio delle vescicole extracellulari. Il rilascio più rapido osservato nell'impalcatura Alg-EVs/CMCh-AlgLyase è attribuito alla degradazione enzimatica di Alg da parte dell'Alglyase, che migliora la degradazione dell'idrogel. Questo rilascio rapido di vescicole extracellulari è particolarmente vantaggioso per affrontare la fase infiammatoria della guarigione delle ferite24. Le ferite croniche spesso soffrono di un'infiammazione prolungata, che compromette la guarigione; il rilascio precoce e controllato di vescicole extracellulari può mitigare questo fenomeno modulando le risposte infiammatorie e promuovendo un ambiente pro-rigenerativo22,25.
Per analizzare questi risultati, i ricercatori dovrebbero quantificare l'intensità di fluorescenza catturata utilizzando il sistema IVIS, correlando la potenza del segnale con la concentrazione di vescicole extracellulari nel tempo. I dati devono essere tracciati per illustrare la cinetica di rilascio, consentendo confronti tra diverse formulazioni di scaffold . Le variazioni nei profili di rilascio possono anche essere valutate per quanto riguarda l'integrità dell'impalcatura e l'attività enzimatica, fornendo ulteriori informazioni sui meccanismi di rilascio sottostanti.
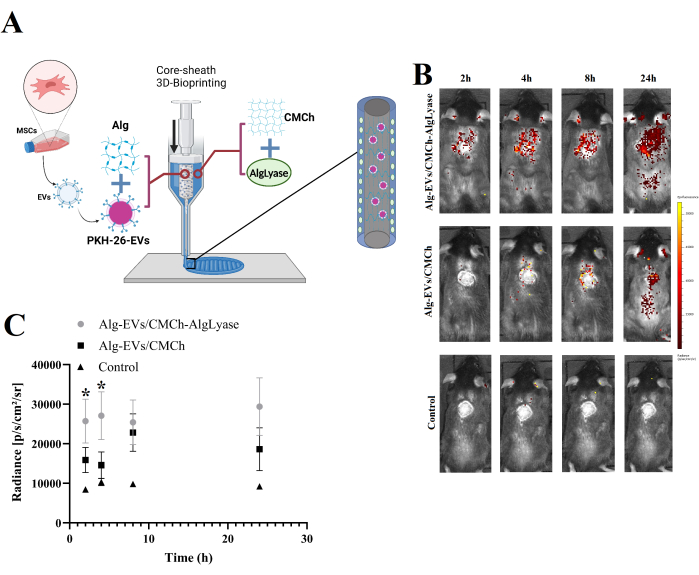
Figura 1: Panoramica della fabbricazione dello scaffold e del profilo di rilascio delle EV in vivo . (A) Rappresentazione schematica del processo di fabbricazione per lo scaffold biostampato in 3D Alg-EVs/CMCh-AlgLyase. (B) Profilo di rilascio in vivo di EV marcate con PKH dallo scaffold Alg-EVs/CMCh-AlgLyase rispetto allo scaffold Alg-EVs/CMCh e allo scaffold di controllo del solo colorante (controllo). Le barre colorate indicano i livelli di intensità della fluorescenza. (C) Analisi quantitativa dell'intensità di rilascio di PKH-EV (n=3). Le barre di errore rappresentano la deviazione standard e l'ANOVA unidirezionale è stata utilizzata per valutare la significatività statistica. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Un aspetto fondamentale del protocollo è il design dell'impalcatura core-sheath, che è essenziale per ottenere un'erogazione efficiente dei veicoli elettrici. Il design incorpora l'Alg come materiale di base e una combinazione di CMCh con Algliasi come guaina. Questa configurazione facilita il rilascio controllato e rapido dei veicoli elettrici. Il materiale di base, Alg, incapsula i veicoli elettrici, garantendone la protezione e l'erogazione localizzata. La guaina, composta da CMCh e Alglyase, consente la degradazione accelerata del nucleo di Alg, che è fondamentale per il rilascio tempestivo delle vescicole extracellulari. Nella nostra precedente pubblicazione18, abbiamo valutato la cinetica di rilascio in vitro di vescicole extracellulari da un sistema di scaffold simile e abbiamo dimostrato un profilo di rilascio controllato per un periodo prolungato, evidenziando il potenziale di questo approccio per effetti terapeutici prolungati. Questa degradazione e rilascio controllati si ottengono attraverso tecniche di formulazione e incapsulamento precise. Questi dati consentiranno di correlare le dinamiche di rilascio delle vescicole extracellulari con la progressione della guarigione delle ferite, offrendo informazioni più approfondite sul potenziale clinico dell'impalcatura.
Un sistema a rilascio più lento offre vantaggi nelle applicazioni terapeutiche in cui concentrazioni più basse e prolungate di un farmaco o di un fattore di crescita possono migliorare l'efficacia riducendo al contempo il rischio di effetti collaterali. Ad esempio, un rilascio graduale può garantire una stimolazione continua dei processi cellulari per un periodo più lungo26, evitando le alte concentrazioni che potrebbero portare alla tossicità27. Tuttavia, le esigenze specifiche dell'applicazione determinano il profilo di rilascio ideale. In alcuni casi, si può preferire un rilascio rapido per fornire un effetto terapeutico immediato28.
Le fasi critiche all'interno del protocollo includono la preparazione e la stratificazione dei materiali bioink per l'impalcatura della guaina centrale. Il mantenimento delle concentrazioni precise di Alg, CMCh e Alglyase durante la preparazione del bioink garantisce la stabilità strutturale e l'efficace incapsulamento delle vescicole extracellulari. Un altro passo fondamentale è l'ottimizzazione dei parametri di bioprinting 3D, comprese le velocità degli ugelli e le condizioni di reticolazione, per garantire una geometria uniforme dell'impalcatura e prestazioni funzionali. L'ottimizzazione del processo di etichettatura PKH-26 è essenziale per eliminare il colorante libero e le particelle indesiderate. Questo processo migliorerebbe la precisione del tracciamento dei veicoli elettrici.
Il protocollo è stato ottimizzato per migliorare la stabilità dell'impalcatura e la coerenza del rilascio dell'EV. Ad esempio, l'eccesso di colorante libero PKH-26 durante la marcatura è stato mitigato ottimizzando il rapporto colorante/EV e utilizzando un metodo alternativo di isolamento delle EV basato su PKH-26. Sono state impiegate regolazioni regolari per i parametri di bioprinting 3D per mantenere l'efficacia dell'impalcatura.
La viscosità dei bioink deve essere ottimizzata per evitare l'intasamento durante la stampa. La regolazione della concentrazione di AlgLiasi è necessaria per controllare il tasso di degradazione. La risoluzione dei problemi relativi alle proprietà meccaniche dell'impalcatura ha comportato il bilanciamento della durata della reticolazione del cloruro di calcio per evitare impalcature fragili o eccessivamente morbide. Durante le fasi di etichettatura, filtrazione e centrifugazione delle vescicole extracellulari hanno mitigato la contaminazione da colorante libero e migliorato l'accuratezza dei risultati di imaging.
Oltre ai vantaggi diretti dell'utilizzo di medicazioni degradabili per la guarigione cronica delle ferite, il tasso di degradazione dell'impalcatura influenza in modo significativo la cinetica di rilascio delle vescicole extracellulari. Questo tasso di degradazione può essere regolato per soddisfare le esigenze specifiche della ferita. Ottimizzando la concentrazione di AlgLyase nella guaina, il tasso di degradazione del nucleo di Alg può essere regolato con precisione, consentendo un profilo di rilascio personalizzato29. Tuttavia, l'efficacia del metodo in condizioni fisiologiche variabili non è ancora del tutto chiara, poiché fattori come il pH e l'attività enzimatica in diversi tipi di ferite potrebbero influenzare le prestazioni dell'impalcatura. Pertanto, è necessario considerare la variabilità delle prestazioni dell'impalcatura in diverse condizioni fisiologiche. Fattori come il pH, l'attività enzimatica e le variazioni di temperatura nelle ferite croniche possono influenzare la degradazione dell'impalcatura e la cinetica di rilascio delle vescicole extracellulari, riducendo potenzialmente l'efficacia terapeutica.
Sebbene le medicazioni per ferite a base di idrogel siano ampiamente utilizzate per la loro biocompatibilità e capacità di mantenere un ambiente umido della ferita, spesso mancano della capacità di fornire una somministrazione controllata e localizzata di molecole bioattive come le vescicole extracellulari. L'incorporazione delle vescicole extracellulari nel sistema di scaffold offre un vantaggio unico combinando il supporto strutturale con un componente terapeutico biologicamente attivo, derivato dalle cellule, in grado di modulare le risposte immunitarie e migliorare la rigenerazione dei tessuti.
Allo stesso modo, i sistemi di rilascio mediati da nanoparticelle sono altamente efficienti nel mirare a specifici percorsi cellulari; Tuttavia, possono incontrare problemi di ritenzione nel sito della ferita e spesso richiedono agenti stabilizzanti aggiuntivi per mantenere la bioattività30. Al contrario, il sistema di scaffold presentato fornisce un microambiente protettivo che preserva la bioattività delle vescicole extracellulari durante il parto24.
Sebbene questo protocollo offra risultati promettenti, ci sono alcune limitazioni che dovrebbero essere considerate. Una sfida consiste nel raggiungere una distribuzione uniforme dei veicoli elettrici all'interno dell'impalcatura. Le variazioni nel processo di miscelazione possono portare a incongruenze nella concentrazione di EVs attraverso lo scaffold, che potrebbero influire sulla riproducibilità. Per superare questa sfida, la tecnica di miscelazione della siringa è un vantaggio. Inoltre, il controllo preciso delle condizioni di gelificazione e reticolazione, come la concentrazione di ioni calcio per gli scaffold in alginato, è fondamentale per garantire proprietà meccaniche ottimali e integrità strutturale. Deviazioni di questi parametri possono compromettere le prestazioni dell'impalcatura. Un'altra limitazione è la potenziale perdita di vescicole elettriche durante la preparazione dell'impalcatura, in quanto possono aderire alla plastica durante le fasi di lavaggio. Infine, la durata di conservazione degli scaffold preparati è relativamente breve, poiché le matrici di idrogel possono degradarsi o perdere funzionalità nel tempo. Pertanto, si consiglia l'uso immediato o la conservazione a breve termine a 4 °C. Per confermarne la stabilità è necessario un test periodico di bioattività delle vescicole extracellulari incapsulate18. Affrontando queste limitazioni e utilizzando le strategie di risoluzione dei problemi suggerite, i ricercatori possono migliorare la riproducibilità e l'efficacia di questo protocollo nelle loro applicazioni.
Il metodo di progettazione dell'impalcatura core-sheath presenta un progresso significativo per la somministrazione di farmaci rispetto ai tradizionali design di scaffold privi di meccanismi di rilascio controllati31. A differenza degli scaffold monofase che potrebbero non fornire un rilascio adeguato o tempestivo di agenti terapeutici, questo metodo offre un approccio dinamico alla somministrazione di vescicole extracellulari con maggiore precisione. L'utilizzo di un materiale di base a rapida degradazione e di una guaina funzionale consente un intervento terapeutico più mirato ed efficace rispetto ai metodi convenzionali, che spesso richiedono regolazioni manuali o sequenziali.
Mentre i materiali per scaffold utilizzati in questo studio, come Alg e CMCh, sono noti per la loro biocompatibilità, per la traduzione clinica è necessaria una valutazione più approfondita della loro biocompatibilità a lungo termine in ambienti di ferite croniche. Nel nostro lavoro precedente, abbiamo studiato gli effetti in vivo dello scaffold in un modello animale preclinico e non abbiamo osservato effetti tossici o risposte immunitarie significative, suggerendo che i materiali sono ben tollerati a breve termine18. Tuttavia, la biocompatibilità a lungo termine, comprese le potenziali risposte immunitarie e gli effetti dei sottoprodotti della degradazione, richiede ulteriori esplorazioni. La degradazione dei materiali dell'impalcatura potrebbe potenzialmente rilasciare sottoprodotti che possono influenzare il processo di guarigione delle ferite o provocare infiammazione cronica, in particolare nel contesto di modelli diabetici o anziani, dove la risposta immunitaria può essere alterata. Pertanto, è fondamentale condurre ulteriori studi per valutare in che modo i prodotti di degradazione influenzano il microambiente della ferita e la rigenerazione tissutale complessiva. Riconosciamo che ulteriori test di biocompatibilità, compresi studi in vivo a lungo termine incentrati sulle risposte immunitarie e sulla degradazione dell'impalcatura, sono essenziali per comprendere la sicurezza e la rilevanza clinica di questo approccio per la guarigione cronica delle ferite.
Questo design dell'impalcatura è particolarmente importante nei campi dell'ingegneria tissutale e della medicina rigenerativa. La sua capacità di erogare vescicole extracellulari in modo rapido e controllato lo rende prezioso per applicazioni come la guarigione di ferite croniche, la riparazione della cartilagine e altri sforzi di rigenerazione dei tessuti32. Affrontando i problemi relativi alla degradazione dell'impalcatura e al rilascio di vescicole extracellulari, il metodo promette di migliorare i risultati dei pazienti in queste aree. Inoltre, il suo potenziale di personalizzazione e adattamento a diversi tipi di tessuto sottolinea la sua versatilità e rilevanza nel progresso della medicina personalizzata.
L'uso del modello murino diabetico Akita in questo studio fornisce una preziosa piattaforma per studiare la guarigione cronica delle ferite in condizioni diabetiche. Questo modello imita le principali caratteristiche fisiopatologiche delle ferite diabetiche umane, tra cui iperglicemia persistente, angiogenesi ritardata e riparazione tissutale compromessa33,34. Inoltre, offre il vantaggio della coerenza genetica e dell'insorgenza spontanea del diabete senza la necessità di induzione chimica esterna e, quindi, riduce la variabilità nei risultati sperimentali33. Tuttavia, è importante riconoscere i limiti di questo modello quando si traducono i risultati in ferite croniche umane. L'architettura cutanea murina differisce da quella umana, in particolare per l'epidermide più sottile, la struttura dermica più rilassata e il ruolo predominante della contrazione della ferita piuttosto che della riepitelizzazione durante la guarigione35. Inoltre, le risposte immunitarie murine e i profili infiammatori non sono completamente rappresentativi di quelli osservati nell'uomo, il che può influenzare l'interpretazione delle terapie di modulazione immunitaria36. Nonostante queste differenze, il modello Akita rimane uno strumento ampiamente accettato ed efficace per gli studi preclinici grazie alla sua capacità di ricapitolare le complicanze diabetiche sistemiche centrali della patogenesi cronica delle ferite. Per convalidare ulteriormente il potenziale traslazionale dell'approccio terapeutico proposto, sono necessari studi futuri per integrare i risultati del modello di Akita. Ulteriori sistemi rilevanti per l'uomo, come i modelli di pelle umana ex vivo o i modelli di animali diabetici di grandi dimensioni, sarebbero di grande supporto.
In conclusione, il design proposto per lo scaffold con rilascio controllato di vescicole extracellulari segna un progresso significativo nella somministrazione di agenti terapeutici. Nonostante le complessità tecniche, questo approccio innovativo offre vantaggi significativi rispetto ai metodi esistenti e ha un grande potenziale per migliorare le medicazioni delle ferite croniche.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Un ringraziamento speciale a Said Al-Hashmi e Abdulrahman Almharbi di Happy Production per il loro eccellente lavoro nelle riprese. Estendiamo inoltre la nostra gratitudine al Ministero dell'Istruzione Superiore, della Ricerca e dell'Innovazione e all'Università di Nizwa per il loro sostegno finanziario e per aver fornito le risorse necessarie.
Materiali
| Name | Company | Catalog Number | Comments |
| 23 G Purple precision conical Nozzle | Cellink | KT0000002000 | To provide precise extrusion of bioinks with minimal clogging |
| Alginate lyase (AlgLyase) | Sigma Aldrich | A1603-100MG | Algyase is an enzyme that degrades alginate. |
| Amicon Ultra Centrifugal Filter, 30 kDa MWCO | Merck | UFC9030 | Used to wash PKH-26 labeled-EVs |
| BCA assay Kit | Thermo Scientific | 10678484 | To determine the protein/EVs concentration |
| Bioprinting System | Regemat | V1 | To fabricate core-sheath scaffold |
| Bovine serum albumin (BSA) | sigma-aldrich | 05470-5G | To stop PKH 26 reaction |
| Calcium chloride | Sigma Aldrich | C3306-100G | To crosslink and stabilize bioinks in tissue engineering |
| Centrifuge | Sigma | 2-16P | Used for EVs isolation |
| Centrifuge 5810 R | Eppendorf | 22625101 | Used for cell culture |
| Class II Biological Safety Cabinet | Telstar | Bio II Advance | Cell culture |
| CryoCube F570 Series - ULT Freezer | Eppendorf | F571240035 | To store EVs |
| fluorescent microscope | OLYMPUS | IX73P1F | Used to check the residual PKH-26 in the filtrate |
| Gentamicin (50 mg/mL) | Thermofisher | 15750 | Antibiotic for cell culture media |
| GlutaMAX-I CTS, (100X), liquid | Thermofisher | A12860 | Cell culture media supplement |
| HCl | Sigma Aldrich | 7647-01-0 | Buffer preparation |
| HEPES | Carl Roth | Art. No. 6763.3 | Buffer preparation |
| High viscous carboxymethyl cellulose (CMCh) | BDH | 27929 4T | CMCh is a water-soluble cellulose derivative. |
| Incubator | New Brunswick | NB-170R | Cell culture |
| Invivo imaging | PerkinElmer | IVIS Lumina XRMS Series III | To track EVs release, in vivo |
| Magnet stirer | SalvisLAB | MC35 | For Bioinks preparation |
| miRCURY Exosome Kits for Exosome Isolation | Qiagen | 76743 | Evs isolation |
| NaOh | Daejung | 1310-73-2 | Buffer preparation |
| phosphate buffered saline(PBS) | Thermo Scientific | J61196.AP | Cell culture |
| PKH 26 | MCE | 154214-55-8 | Red fluorescent dye for labeling theEVs |
| Sodium alginate (Alg) | Sigma Aldrich | A0682-100G | Natural polysaccharide derived from brown seaweed. |
| Sodium chloride (NaCl) | Carl Roth | Art-Nr-P029.1 | Buffer preparation |
| StemPro BM Mesenchymal Stem Cells | Thermofisher | A1382901 | Mesenchymal stem cells |
| StemPro MSC SFM XenoFree | Thermofisher | A1067501 | Cell culture media |
| Trypsin 0.25% | Thermofisher | 25050014 | Cell dissociation |
| Vortex-Mixer | Daihan Scientific | VM-10 | Used to mix precipitation buffer with the conditioned media |
Riferimenti
- Falanga, V., et al. Chronic wounds. Nat Rev Disease Primers. 8 (1), 50 (2022).
- Tran, H. Q., Shahriar, S. S., Yan, Z., Xie, J. Recent advances in functional wound dressings. Adv Wound Care. 12 (7), 399-427 (2023).
- Shao, M., et al. Emerging trends in therapeutic algorithm of chronic wound healers: Recent advances in drug delivery systems, concepts-to-clinical application and future prospects. Crit Rev Ther Drug Carrier Syst. 34 (5), 385-452 (2017).
- Rezvani Ghomi, E., Khalili, S., Nouri Khorasani, S., Esmaeely Neisiany, R., Ramakrishna, S. Wound dressings: Current advances and future directions. J Appl Poly Sci. 136 (27), 47738 (2019).
- Ding, J. Y., et al. Mesenchymal stem cell-derived extracellular vesicles in skin wound healing: Roles, opportunities and challenges. Military Med Res. 10 (1), 36 (2023).
- Sharma, D., Kumar, A., Mostafavi, E. Extracellular vesicle-based biovectors in chronic wound healing: Biogenesis and delivery approaches. Mol Ther Nucleic Acids. 32, 822-840 (2023).
- Vader, P., Mol, E. A., Pasterkamp, G., Schiffelers, R. M. Extracellular vesicles for drug delivery. Adv Drug Delivery Rev. 106, 148-156 (2016).
- Han, P., Ivanovski, S. 3d bioprinted extracellular vesicles for tissue engineering-a perspective. Biofabrication. 15 (1), 013001 (2022).
- Annabi, N., et al. 25th anniversary article: Rational design and applications of hydrogels in regenerative medicine. Adv Mater. 26 (1), 85-124 (2014).
- Zheng, Y., Pan, C., Xu, P., Liu, K. Hydrogel-mediated extracellular vesicles for enhanced wound healing: The latest progress, and their prospects for 3d bioprinting. J Nanobiotechnol. 22 (1), 57 (2024).
- Keener, A. B. How extracellular vesicles can enhance drug delivery. Nature. 582 (7812), S14-S14 (2020).
- Han, P., et al. 3d bioprinted small extracellular vesicles from periodontal cells enhance mesenchymal stromal cell function. Biomater Adv. 158, 213770 (2024).
- Born, L. J., et al. Sustained released of bioactive mesenchymal stromal cell-derived extracellular vesicles from 3d-printed gelatin methacrylate hydrogels. J Biomed Mater Res A. 110 (6), 1190-1198 (2022).
- Kjar, A., Mcfarland, B., Mecham, K., Harward, N., Huang, Y. Engineering of tissue constructs using coaxial bioprinting. Bioact Mater. 6 (2), 460-471 (2021).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3d bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Deshayes, S., Kasko, A. M. Polymeric biomaterials with engineered degradation. J Poly Sci A Poly Chem. 51 (17), 3531-3566 (2013).
- Xu, Q., et al. Injectable hyperbranched poly (β-amino ester) hydrogels with on-demand degradation profiles to match wound healing processes. Chem Sci. 9 (8), 2179-2187 (2018).
- Vakilian, S., et al. Engineered local delivery of extracellular vesicles loaded with si-tnf-α, via a core-sheath 3d-bio-printed scaffold as an effective wound dressing. J Drug Delivery Sci Technol. 101, 106189 (2024).
- Mirsanei, Z., et al. Synergistic effects of mesenchymal stem cell-derived extracellular vesicles and dexamethasone on macrophage polarization under inflammatory conditions. Inflammopharmacology. 32 (2), 1317-1332 (2024).
- Ma, Y., Brocchini, S., Williams, G. R. Extracellular vesicle-embedded materials. J Controlled Release. 361, 280-296 (2023).
- Jia, Q., Zhao, H., Wang, Y., Cen, Y., Zhang, Z. Mechanisms and applications of adipose-derived stem cell-extracellular vesicles in the inflammation of wound healing. Front Immunol. 14, 1214757 (2023).
- Lou, P., et al. Extracellular vesicle-based therapeutics for the regeneration of chronic wounds: Current knowledge and future perspectives. Acta Biomater. 119, 42-56 (2021).
- Cai, Y., Chen, K., Liu, C., Qu, X. Harnessing strategies for enhancing diabetic wound healing from the perspective of spatial inflammation patterns. Bioactive Mater. 28, 243-254 (2023).
- Li, Z., et al. Multifunctional hydrogel-based engineered extracellular vesicles delivery for complicated wound healing. Theranostics. 14 (11), 4198 (2024).
- Cabral, J., Ryan, A. E., Griffin, M. D., Ritter, T. Extracellular vesicles as modulators of wound healing. Adv Drug Delivery Rev. 129, 394-406 (2018).
- Moghadasi Boroujeni, S., Mashayekhan, S., Vakilian, S., Ardeshirylajimi, A., Soleimani, M. The synergistic effect of surface topography and sustained release of tgf-β1 on myogenic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 104 (7), 1610-1621 (2016).
- Jayaraman, P., et al. Controlled release of drugs in electrosprayed nanoparticles for bone tissue engineering. Adv Drug Delivery Rev. 94, 77-95 (2015).
- Huang, X., Brazel, C. S. On the importance and mechanisms of burst release in matrix-controlled drug delivery systems. J Controlled Release. 73 (2-3), 121-136 (2001).
- Smith, A. M., Senior, J. J. Alginate hydrogels with tuneable properties. Adv Biochem Eng Biotechnol. 178, 37-61 (2021).
- Yan, X., Sha, X. Nanoparticle-mediated strategies for enhanced drug penetration and retention in the airway mucosa. Pharmaceutics. 15 (10), 2457 (2023).
- Pant, B., Park, M., Park, S. -. J. Drug delivery applications of core-sheath nanofibers prepared by coaxial electrospinning: A review. Pharmaceutics. 11 (7), 305 (2019).
- Pinheiro, A., et al. Extracellular vesicles: Intelligent delivery strategies for therapeutic applications. J Controlled Release. 289, 56-69 (2018).
- Yoshioka, M., Kayo, T., Ikeda, T., Koizuni, A. A novel locus, mody4, distal to d7mit189 on chromosome 7 determines early-onset niddm in nonobese c57bl/6 (akita) mutant mice. Diabetes. 46 (5), 887-894 (1997).
- Fang, R. C., et al. Limitations of the db/db mouse in translational wound healing research: Is the noncnzo10 polygenic mouse model superior. Wound Repair Regen. 18 (6), 605-613 (2010).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. J Dermatol Sci. 90 (1), 3-12 (2018).
- Sellers, R. S. Translating mouse models: Immune variation and efficacy testing. Toxicol Pathol. 45 (1), 134-145 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon