Method Article
만성 상처 관리를 위한 Core-sheath 3D-Bioprinted Scaffold를 사용한 세포외 소포 전달 최적화
요약
이 연구는 만성 상처 치유를 위한 코어피(core-sheath) 3D 바이오 프린팅 골격을 제작하기 위한 프로토콜을 제시합니다. 세포외 소포체는 중간엽 줄기세포에서 분리되어 카르복시메틸 셀룰로오스와 알기네이트 리아제로 만든 칼집을 통해 코어(알긴산)에 적재됩니다. 이 설계는 제어된 비계 성능 저하와 효율적인 EV 방출을 가능하게 합니다.
초록
이 연구는 만성 상처 치유를 향상시키기 위해 설계된 코어피스 3D 바이오프린팅 골격 제작을 위한 자세한 프로토콜을 설명합니다. 이 프로토콜에는 재생 및 면역 조절 특성으로 알려진 중간엽 줄기세포(MSC)에서 세포외 소포체(EV)를 분리하는 것이 포함됩니다. 그런 다음 이러한 EV는 고유한 비계 구조로 통합됩니다. 이 골격은 EV가 적재된 알긴산으로 구성된 코어를 특징으로 하며, 그 주변은 카르복시메틸 셀룰로오스와 알기네이트 리아제로 만든 외피로 둘러싸여 있습니다. 이 혁신적인 설계는 통제된 골격 저하를 보장하는 동시에 상처 부위에서 EV의 효율적이고 통제된 방출을 촉진합니다. 이 프로토콜은 EV의 준비 및 특성화, 3D 바이오프린팅을 위한 바이오 잉크 제형, 원하는 코어 시스 아키텍처를 달성하기 위한 프린팅 매개변수 최적화를 포함한 주요 단계를 다룹니다. 구조적 무결성과 생체 활성을 결합함으로써 이 골격은 기존 상처 드레싱의 한계를 해결하는 것을 목표로 하며, 조직 재생을 가속화하고 만성 상처의 염증을 줄이기 위한 표적 접근 방식을 제공합니다. 이 방법은 만성 상처 관리에서 잠재적인 임상 응용 분야를 가진 고급 생체 재료를 개발하기 위한 재현 가능하고 확장 가능한 전략을 제공합니다. 이 프로토콜은 또한 일관된 결과를 달성하기 위한 중요한 고려 사항을 강조하여 향후 치료 응용 분야에 대한 적응성을 보장합니다.
서문
종종 과도한 염증과 관련된 만성 상처는 절단으로 이어질 수 있는 감염 및 조직 괴사와 같은 심각한 합병증을 예방하기 위해 적시에 관리해야 합니다. 이러한 발전에도 불구하고 현재의 치료법은 여전히 비용이 많이 들고, 불편하며, 부작용이 있고, 효능이 제한적이기 때문에 더 많은 치료용 드레싱의 필요성이 강조되고 있다 1,2,3. 이러한 문제를 해결하기 위해서는 만성 상처를 위해 특별히 고안된 차세대 상처 드레싱의 개발이 필수적입니다. 더욱이 상처 치유의 복잡한 특성으로 인해 보습, 유연성, 접착력, 생체 활성, 생분해성 등 다양한 특성을 가진 드레싱 재료가 필요합니다4. 이 연구는 세포외 소포체(EV)와 코어피부 3D 바이오프린팅 골격을 통합하여 통제된 치료 환경을 제공하고 만성 상처 치유를 가속화하는 생명공학 상처 드레싱을 개발하는 것을 목표로 합니다.
줄기세포에서 유래한 EV는 항염증 반응, 세포 성장, 이동 및 혈관 형성을 촉진하여 만성 상처 치유를 돕습니다5. 또한 EV는 만성 상처 관리를 위한 소분자 약물, 유전자 및 단백질 구조를 포함한 생체 활성 분자를 전달할 수 있습니다6. 또한, 효소 분해로부터 화물을 보호하는 능력은 치료제의 안정성과 생체이용률을 향상시켜 종종 생체 내에서 빠르게 분해되는 기존 성장 인자 및 저분자 약물에 비해 뚜렷한 이점을 제공합니다 7. 이러한 장점에도 불구하고 EV를 대상 조직에 효율적이고 지속적으로 전달하는 것은 여전히 중요한 과제로 남아 있습니다.
3D 바이오프린팅 스캐폴드는 EV의 치료 효과를 높이기 위한 전달 플랫폼 역할을 할 수 있습니다8. 이러한 골격은 자연적인 세포 환경을 모방하고 EV(9,10)의 제어된 방출을 허용합니다. 또한 EV의 분해를 방지하여 microRNA와 단백질의 안정성을 향상시킵니다11. Han 등은 EV가 3D 바이오프린팅 GelMA 스캐폴드에서 효과적으로 분리될 수 있음을 입증했습니다. 이 방출은 골격에 파종된 인간 협측 지방 패드 중간엽 줄기세포(hBFP-MSC)에서 세포 부착을 개선하고 기계 전달 경로와 관련된 유전자 발현을 향상시켰습니다12. Born 등은 교차결합제의 농도를 최적화하여 EV의 통제된 방출을 달성했습니다. 이 접근법은 혈관신생을 촉진하는 효능을 입증했으며 EV의 조절된 전달을 위한 유망한 방법을 제공합니다13.
코어 시스 3D 바이오프린팅은 시스에 둘러싸인 코어 소재를 프린팅하여 복잡한 다중 재료 구조를 만들 수 있습니다. 코어에는 세포, 성장 인자 또는 약물이 포함될 수 있으며, 칼집은 기계적 지지 및 보호를 제공하거나 장벽 역할을 합니다. 이 방법은 혈관 네트워크 개발, 자연 조직 구조 모방, 약물 전달 시스템 생성과 같은 조직 공학 및 재생 의학에 응용됩니다. 이를 통해 재료 분포 및 구성을 정밀하게 제어할 수 있어 구조물의 기능과 생물학적 관련성을 향상시킬 수 있습니다. 대체 기술과 비교하여 코어 피복 3D 바이오프린팅은 재료 분포 및 구성을 정밀하게 제어하여 구조물의 기능과 생물학적 관련성을 향상시킵니다14,15.
상처 드레싱의 공학적 분해는 변화 시 불편함 감소, 치유 및 감염 통제를 위한 습한 환경, 적시 치료 전달, 최적의 조직 재생과 같은 이점을 제공합니다 16,17,18. 알긴산염(Alg) 및 카르복시메틸셀룰로오스(CMCh) 하이드로겔은 생체 적합성이 있으며 상처에 세포외 소포체(EV)를 전달하여 세포 소통 및 염증 감소를 통한 치유를 향상시키는 데 효과적입니다18. 이 연구에서는 EV를 Alg의 코어에 통합하고 CMCh 및 AlgLyase(AlgLyase)의 외피를 사용하여 빠른 드레싱 분해 및 EV 전달을 가능하게 했습니다. 이 코어시스 설계는 골격 분해에 대응하여 EV의 신속한 방출을 촉진하여 치료 효능을 향상시키고 기존 만성 상처 치료의 한계를 해결합니다. 이 연구의 주요 목적은 제어된 EV 방출을 반응적으로 분해 가능한 골격과 통합하여 상처 치유를 향상시키는 생명공학 드레싱을 개발하여 궁극적으로 만성 상처의 치료 결과를 개선하는 것입니다.
프로토콜
동물 연구는 니즈와 대학의 국가 생명 윤리 위원회와 동물 윤리 위원회가 수립한 윤리 기준에 따라 완전히 수행되었습니다. 이 연구에 대한 윤리적 승인은 허가 ID: VCGSR, AREC/01/2023에 따라 부여되었습니다. 모든 동물은 표준 실험실 조건에서 사육되어 최적의 환경 관리, 적절한 영양 및 포괄적인 관리를 보장하여 연구 기간 동안 동물의 복지를 보호했습니다. 동물과 관련된 모든 절차는 제도적 정책, 국제 동물 관리 표준 및 ARRIVE 지침을 엄격하게 준수했습니다.
1. 세포 배양
- 액체 질소 저장소에서 MSC 바이알(통로 #2)을 회수하고 무균 기술로 처리하여 오염을 방지합니다. 37°C 수조에서 셀을 빠르게 해동하여 작은 얼음 조각이 남는 즉시 제거합니다.
- 1%(v/v) MSC SFM XenoFree 보충제, 1%(v/v) GlutaMAX 및 0.01%(v/v) 겐타마이신이 보충된 MSC SFM 기초 배지를 포함한 완전한 배지를 준비합니다. 예열된 1mL(37°C) 완전 배지를 5초마다 3-5방울의 비율로 바이알에 첨가한 다음 부드럽게 혼합합니다. MSC 바이알의 전체 내용물을 Class II 생물 안전성 작업대에서 무균 상태로 4mL의 예열된 완전 배지가 들어 있는 15mL 코니컬 튜브로 옮깁니다.
- 실온에서 200 x g 에서 5분 동안 셀을 원심분리합니다. 원심분리기가 적절하게 균형을 이루었는지 확인하십시오.
- 상층액을 흡인하고 예열된 완전한 배지 1mL에 세포를 재현탁합니다. 그런 다음 세포를 4mL의 완전한 배지가 들어 있는 T25 플라스크로 옮깁니다.
- 플라스크를 부드럽게 기울여 세포가 고르게 분포되도록 합니다. 37 ° C에서 5 % CO2로 플라스크를 배양합니다.
- 2일마다 배지를 교체하고 신선하고 예열된 완전한 배지로 교체하십시오. 세포 파괴를 방지하기 위해 부드러운 피펫팅을 사용하십시오. 70%-80% 합류점에 도달하면 T25 플라스크에서 사용된 매체를 흡입합니다.
- 3mL의 새 PBS로 세포를 세척하여 잔여물을 제거합니다. 세탁하는 동안 플라스크가 완전히 덮이는지 확인하십시오.
- T25 플라스크에 0.25% 트립신 용액 1mL를 첨가하고 37°C에서 3-7분 동안 배양한 다음 4배 배율로 현미경으로 분리를 주의 깊게 모니터링합니다.
- 세포가 완전히 분리되도록 필요한 경우 플라스크를 가볍게 두드립니다. 예열된 완전한 배지를 플라스크에 추가하고 표면 위아래로 피펫을 사용하여 세포를 분리하는 데 도움을 줍니다. 그런 다음 세포 현탁액을 15mL 원심분리 튜브로 옮깁니다.
- 실온에서 200 x g 으로 튜브를 5분 동안 원심분리합니다. 세포 펠릿을 신선하고 완전한 배지에 현탁시키고 Neubauer 혈구계를 사용하여 세포를 계수합니다. 세포를 T75 플라스크로 옮깁니다. 최적의 성장을 위해 5,000 cells/cm2 의 파종 밀도를 보장합니다.
- 37 ° C에서 5 % CO2로 세포를 배양합니다. 세포 배양 72시간 후, EV 분리를 위해 세포에서 컨디셔닝된 배지를 수집합니다. 채취 후 즉시 사용하십시오.
2. EV 절연
- 수집된 컨디셔닝 배지 13mL를 800 x g 에서 15분 동안 원심분리하여 세포 파편을 제거합니다. 0.22μm 주사기 필터를 사용하여 상층액을 부드럽게 여과하여 큰 입자를 제거합니다.
- 여과된 컨디셔닝 매체에 5mL의 침전 버퍼를 추가하고 완전히 혼합하도록 와류시킵니다. 솔루션이 동질적인지 확인합니다.
- EV가 침전될 수 있도록 4°C에서 밤새 혼합물을 배양합니다. 혼합물을 3,220 x g 에서 20°C에서 30분 동안 원심분리합니다. 튜브의 균형을 확인하십시오.
- 펠릿을 방해하지 않고 상등액을 조심스럽게 버리십시오. 펠릿을 3,220 x g 에서 5초 동안 다시 한 번 원심분리하여 잔류 액체를 제거합니다.
- EV 펠릿을 200μL의 PBS에 부드럽게 피펫팅하여 EV 손상을 방지합니다. 제조업체의 지침(BCA 단백질 분석 키트)에 따라 EV 단백질 농도를 측정합니다.
- EV 표현형18을 검증하기 위해 EV 특이적 마커(CD63, CD81 및 CD9)를 검출하기 위해 웨스턴 블로팅을 수행합니다. 분석을 통해 이러한 마커의 존재를 확인하여 EV의 정체성을 검증했습니다19.
- RNase 오염의 위험을 최소화하기 위해 추가 저장 공간 없이 직접 사용하는 것이 좋습니다. 필요한 경우 나중에 사용할 수 있도록 EV를 -80°C에서 보관하십시오. 반복되는 동결-해동 주기를 피하기 위해 EV 현탁액을 40μL 부피로 분취합니다.
3. PKH-26으로 라벨링하는 EV
- 완충액 준비
- 멸균 용기에 약 90mL의 멸균 초순수에 0.238g의 HEPES를 용해시킵니다. 갓 준비된 HEPES 용액을 사용하십시오. Hepes 용액에 0.85g의 NaCl을 첨가하십시오.
- 보정된 pH 측정기를 사용하여 필요에 따라 1M NaOH 또는 HCl을 사용하여 pH를 7.4로 조정합니다. 탈이온수를 추가하여 총 부피를 100mL로 만듭니다. 0.22μm 필터를 통해 용액을 여과하여 멸균합니다.
- 준비된 완충액 1mL에 PKH-26 염료 4μL를 희석합니다. 균질성을 보장하기 위해 피펫으로 철저히 혼합하십시오.
- 정제된 EV를 1mL의 PBS에 700μg/mL의 농도로 재현탁합니다. 제조된 PKH-26 용액 1mL에 EV 현탁액 1mL를 추가합니다. 염료 단독 대조군의 경우 PKH-26 용액 1mL에 EV가 없는 완전 배지 1mL를 추가합니다. 모든 후속 단계는 잠재적인 비특이적 응집 또는 미셀 형성을 설명하기 위해 대조군에 대해 수행됩니다.
- 튜브를 10x-15x를 부드럽게 뒤집어 EV를 철저히 혼합합니다. 혼합물을 실온에서 3-5분 동안 배양하여 EV가 염료에 균일하게 노출되도록 합니다.
- 멸균 초순수를 사용하여 2mL의 신선한 1% BSA 용액을 준비하고 생성된 혼합물 2mL에 첨가하여 라벨링 반응을 소멸시킵니다. 응집을 방지하기 위해 부드럽게 섞습니다.
- 위에서 언급한 프로토콜에 따라 PKH-26 라벨이 부착된 EV를 농축합니다(단계 2.2-2.7). 라벨링된 EV를 300μL의 PBS에 재현탁합니다. PKH-26 라벨이 부착된 EV 샘플을 30kDa 필터 튜브에 피펫팅합니다.
- 3,220 x g 에서 4°C에서 30분 동안 시료를 원심분리합니다. 이 단계에서 유리 PKH-26 염료와 소분자는 멤브레인을 통해 여과액으로 들어가고 PKH-26 표지된 EV는 잔류물에 유지됩니다.
- 초기 원심분리 후 여과액을 버리고 잔류액에 PBS 300μL를 첨가합니다. 위아래로 피펫팅하여 PBS에 EV를 부드럽게 다시 매달아 놓습니다.
- 시료를 3,220 x g 에서 4°C에서 30분 동안 다시 원심분리하여 남아 있는 유리 염료 또는 저분자를 씻어냅니다.
- 형광 현미경으로 여과액 용액에 PKH-26이 없는지 확인합니다. 염료가 감지되면 세척 단계를 반복하십시오.
- 마이크로피펫으로 상단 용액을 수집하고 수집 튜브에서 필터를 제거합니다. 필터를 조심스럽게 뒤집습니다(거꾸로 뒤집기).
- 인버티드 필터를 800 x g 에서 4°C에서 5분 동안 원심분리합니다. 이렇게 하면 필터 멤브레인에서 잔류된 PKH-26-EV를 새 수집 튜브로 수집하는 데 도움이 됩니다. 다음 단계에서 PKH-26-EV를 직접 사용하십시오.
4. 3D 바이오 프린팅
- 바이오잉크 준비
- 멸균 초순수를 사용하여 신선한 4.5%(w/v) 나트륨 Alg 용액을 준비합니다. 용액이 완전히 용해될 수 있도록 60°C에서 밤새 저어줍니다.
- CMCh를 멸균 초순수에 용해시켜 3.8%(w/v) 용액을 얻습니다. 새로 준비하십시오. 60°C에서 밤새 저어 완전히 녹입니다.
- 준비된 바이오잉크를 3,220 x g 에서 25°C에서 10분 동안 원심분리하여 인쇄 공정을 방해할 수 있는 기포를 제거합니다.
- 주사기 믹서를 사용하여 준비된 3mL의 Alg 용액을 라벨링된 EV 또는 염료 전용 대조군과 혼합하여 EV의 0.01%(w/v) 농도를 달성합니다. 부드러운 혼합으로 균일한 분포를 보장합니다.
- 주사기 믹서를 사용하여 1mL의 CMCh를 멸균 초순수에 갓 준비한 AlgLyase 용액과 결합하여 0.5mU/mL의 최종 농도를 달성합니다.
- 그림 1A에서 볼 수 있듯이 Alg/Exo 바이오잉크를 코어 부분에 동시에 로드하고 CMCh/AlgLyase 바이오잉크를 코어/시스 실린지 설정의 피복 부분에 로드합니다.
- 인쇄하기 전에 바이오잉크를 15분 동안 그대로 두십시오.
- 3D-바이오 프린터 설정
- 3D-바이오프린터 소프트웨어를 사용하여 대각선 채우기 패턴이 있는 원통형 모양을 선택하여 스캐폴드 구조를 만듭니다. 이를 위해 실린더 지름과 높이를 각각 20mm와 1.1mm로 설정합니다. 기공 크기를 1mm로 구성합니다.
- 코어와 시스 노즐 펌핑 속도를 레이어당 두께가 0.25mm인 1mm/s로 설정하고 이동 속도를 6mm/s로 설정합니다. 실온에서 층당 두께가 0.25mm인 4개의 층을 인쇄합니다.
- 폴리에스터 필름에 인쇄를 시작합니다.
- 에어로졸 염화칼슘(2.2%)이 있는 가습기를 사용하여 압출 공정 중에 골격을 가교하십시오. 가습기 노즐을 압출 헤드에서 약 20cm 떨어진 곳에 배치하여 비계 구조를 손상시키지 않으면서 효과적인 가교를 보장하십시오. 추가 가교를 위해 골격을 염화칼슘 용액(2.2%)에 10분 동안 담그십시오.
- 스캐폴드 3x를 멸균 초순수로 헹구어 과도한 염화칼슘과 결합되지 않은 바이오잉크를 제거합니다.
- 최대 3개월 동안 지지체의 무결성과 기능을 유지하기 위해 지지체를 4°C의 멸균 환경에 보관해야 합니다.
5. EV 출시 추적
- 원형 피부 상처 모델 제작
- 수컷 아키타 이형접합 당뇨병 마우스(8주)를 케타민(70mg/kg)과 자일라진(10mg/kg)의 복강 내 주사를 투여하여 마취합니다. 반사 반응(예: 발가락 꼬집음)의 부재를 평가하여 적절한 마취를 확인하고 호흡수를 모니터링합니다. 마취 중 각막 건조를 예방하려면 멸균 수의학 안과 연고를 눈에 바르십시오.
- 먼저 전기 가위를 사용하여 등 피부 부위를 면도하여 준비합니다. 피부 자극이나 부상을 피하십시오. 포비돈 요오드 용액을 사용하여 면도한 부위를 소독합니다.
- 멸균 압착기를 사용하여 각 마우스의 등쪽 표면에 6mm의 원형 전체 두께 피부 상처를 만듭니다.
- PKH 표지 EV가 포함된 3D 바이오프린팅 골격을 상처 부위에 직접 부드럽게 놓습니다. 멸균 집게를 사용하여 가볍게 눌러 골격이 최소한의 공기 주머니로 상처 표면을 완전히 덮도록 합니다. 시술 후 동물을 면밀히 관찰하고 의식을 완전히 회복하고 흉골 누운 자세를 유지할 수 있을 때까지 계속 보살핌을 받습니다.
- 형광 이미징
- 이식 후 2시간, 4시간, 8시간, 24시간에 이소플루란을 사용하여 마우스를 마취합니다. 마취 유도를 위해 생쥐를 생체 내 이미징 시스템(IVIS)의 챔버에 놓고 산소 중 2%-3% 이소플루란에 노출시킵니다. 건조를 방지하기 위해 쥐의 눈에 안과 연고를 바르십시오. 마취가 끝나면 마우스를 IVIS 시스템으로 옮기고 코 채널을 통해 전달되는 산소에 1%-2% 이소플루란으로 유지합니다. 이미징을 진행하기 전에 동물이 완전히 마취되고 안정적인지 확인합니다.
- IVIS 시스템을 사용하여 스캐폴드에서 방출된 PKH 표지 EV의 형광 신호를 캡처합니다. 이미징 마법사에서 Fluorescence Imaging(형광 이미징 ) 옵션을 선택하고 PKH 염료에 대한 excitation 및 emission filter를 활성화합니다. 시야각과 피사체 높이를 포함한 카메라 설정을 조정하여 신호 감지를 최적화합니다. 정확한 비교가 가능하도록 모든 이미징 시점에 걸쳐 일관된 포지셔닝을 보장합니다. 이미지 수집을 시작하고 결과 데이터를 저장합니다.
- IVIS 소프트웨어를 사용하여 형광 신호 강도를 정량화합니다. 이를 통해 시간 경과에 따른 EV 출시를 추적할 수 있습니다.
결과
Alg-EVs/CMCh 및 Alg-EVs/CMCh-AlgLyase 스캐폴드 모두에서 EV의 생체 내 방출은 그림 1B, C에 나와 있습니다. 예상대로 Alg-EVs/CMCh-AlgLyase 스캐폴드는 특히 2시간 및 4시간 시점에서 Alg-EVs/CMCh에 비해 더 빠른 방출 프로파일을 보여주었습니다. 하이드로겔에서 EV의 방출은 확산, 팽창, 침식 및 분해를 포함한 물리화학적 메커니즘의 조합에 의해 제어됩니다20. Alglyase를 활용함으로써 골격은 Alg의 분해를 촉진하고 EV의 방출을 가속화하여 상처 치유의 초기 단계에서 만성 염증을 효율적으로 제어합니다. EV의 조기 방출은 치유를 지연시킬 수 있는 과도한 염증을 완화하는 데 중요합니다 21,22,23. 잠재적인 비특이적 응집 또는 미셀 형성을 설명하기 위해 대조군도 분석하여 무시할 수 있는 형광 신호를 밝혔습니다. 이 관찰은 감지된 신호가 주로 라벨링된 EV에서 비롯되었음을 확인합니다.
이러한 결과는 EV 방출 속도를 조절하는 데 있어 스캐폴드 구성의 중요한 역할을 반영합니다. Alg-EVs/CMCh-AlgLyase 스캐폴드에서 관찰된 더 빠른 방출은 하이드로겔 분해를 향상시키는 Alglyase에 의한 Alg의 효소 분해에 기인합니다. 이러한 빠른 EV의 방출은 상처 치유의 염증 단계를 해결하는 데 특히 유리합니다24. 만성 상처는 종종 치유를 방해하는 장기간의 염증으로 고통받습니다. EV의 조기에 통제된 방출은 염증 반응을 조절하고 재생 친화적 환경을 촉진함으로써 이를 완화할 수 있습니다22,25.
이러한 결과를 분석하기 위해 연구자들은 IVIS 시스템을 사용하여 캡처한 형광 강도를 정량화하여 시간 경과에 따른 EV 농도와 신호 강도를 연관시켜야 합니다. 데이터는 방출 역학을 설명하기 위해 플롯되어야 하며, 이를 통해 서로 다른 스캐폴드 제형을 비교할 수 있어야 합니다. 또한 스캐폴드 무결성 및 효소 활성과 관련하여 방출 프로파일의 변화를 평가할 수 있으며, 이를 통해 기본 방출 메커니즘에 대한 추가 통찰력을 얻을 수 있습니다.
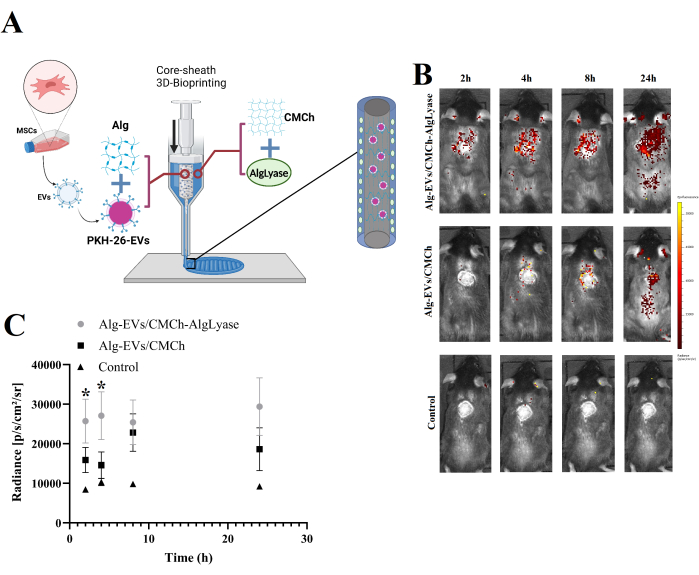
그림 1: 스캐폴드 제작 개요 및 in vivo EV 릴리스 프로파일. (A) Alg-EVs/CMCh-AlgLyase 3D 바이오프린팅 스캐폴드 제조 공정의 개략도. (B) Alg-EVs/CMCh-AlgLyase 스캐폴드에서 PKH 표지 EV의 생체 내 방출 프로파일을 Alg-EVs/CMCh 스캐폴드 및 염료 전용 제어 스캐폴드(대조군)와 비교. 색상 막대는 형광 강도 수준을 나타냅니다. (C) PKH-EV 방출 강도의 정량 분석(n=3). 오차 막대는 표준 편차를 나타내며, 통계적 유의성을 평가하기 위해 일원 분산 분석이 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
프로토콜의 중추적인 측면은 효율적인 EV 전달을 달성하는 데 필수적인 코어 피복 스캐폴드 설계입니다. 이 설계는 Alg를 핵심 재료로 통합하고 CMCh와 Alglyase를 외피로 결합합니다. 이 설정은 EV의 제어되고 신속한 릴리스를 용이하게 합니다. 핵심 소재인 Alg는 EV를 캡슐화하여 EV를 보호하고 현지화된 배송을 보장합니다. CMCh와 Alglyase로 구성된 피복은 Alg 코어의 성능 저하를 가속화할 수 있으며, 이는 EV의 적시 출시에 매우 중요합니다. 이전 간행물18에서는 유사한 스캐폴드 시스템에서 EV의 체외 방출 역학을 평가하고 장기간에 걸쳐 제어된 방출 프로파일을 입증하여 지속적인 치료 효과에 대한 이 접근 방식의 잠재력을 강조했습니다. 이러한 제어된 분해 및 방출은 정밀한 배합 및 캡슐화 기술을 통해 이루어집니다. 이러한 데이터는 EV의 방출 역학과 상처 치유 진행의 상관 관계를 가능하게 하여 골격의 임상 잠재력에 대한 더 깊은 통찰력을 제공합니다.
서방형 시스템은 약물 또는 성장 인자의 농도를 지속적으로 낮추면 부작용의 위험을 줄이면서 효능을 향상시킬 수 있는 치료 응용 분야에서 이점을 제공합니다. 예를 들어, 점진적 방출은 장기간에 걸쳐 세포 과정의 지속적인 자극을 보장할 수 있으며26 독성27을 유발할 수 있는 고농도를 피할 수 있습니다. 그러나 응용 프로그램의 특정 요구 사항에 따라 이상적인 릴리스 프로필이 결정됩니다. 일부 경우에는, 즉각적인 치료 효과를 제공하기 위해 신속한 방출이 선호될 수 있다28.
프로토콜 내의 중요한 단계에는 코어-피복 스캐폴드를 위한 바이오잉크 재료의 준비 및 계층화가 포함됩니다. 바이오잉크를 준비하는 동안 Alg, CMCh 및 Alglyase의 정확한 농도를 유지하면 구조적 안정성과 효과적인 EV 캡슐화가 보장됩니다. 또 다른 중요한 단계는 노즐 속도 및 가교 조건을 포함한 3D 바이오프린팅 매개변수를 최적화하여 균일한 스캐폴드 형상과 기능 성능을 보장하는 것입니다. PKH-26 라벨링 공정의 최적화는 유리 염료와 원치 않는 입자를 제거하는 데 필수적입니다. 이 프로세스는 EV 추적 정확도를 향상시킵니다.
이 프로토콜은 스캐폴드의 안정성과 EV 릴리스의 일관성을 향상시키기 위해 최적화되었습니다. 예를 들어, 라벨링 중 과도한 유리 PKH-26 염료는 염료 대 EV 비율을 최적화하고 대체 PKH-26 라벨 EV 분리 방법을 사용하여 완화되었습니다. 스캐폴드의 효과를 유지하기 위해 3D 바이오프린팅 매개변수에 대한 정기적인 조정이 사용되었습니다.
바이오잉크의 점도는 인쇄 중 막힘을 방지하기 위해 최적화되어야 합니다. 분해 속도를 제어하려면 AlgLyase 농도를 조정해야 합니다. 골격의 기계적 특성 문제 해결에는 부서지기 쉽거나 지나치게 부드러운 골격을 피하기 위해 염화칼슘 가교 지속 시간의 균형을 맞추는 것이 포함되었습니다. EV 라벨링 중 여과 및 원심분리 단계는 유리 염료 오염을 완화하고 이미징 결과의 정확도를 개선했습니다.
만성 상처 치유를 위해 분해성 드레싱을 사용하는 직접적인 이점 외에도 골격의 분해 속도는 EV의 방출 역학에 큰 영향을 미칩니다. 이 분해 속도는 상처의 특정 요구 사항에 맞게 조정할 수 있습니다. 칼집에서 AlgLyase의 농도를 최적화함으로써 Alg 코어의 분해 속도를 미세 조정하여 맞춤형 방출 프로파일을 허용할 수 있습니다29. 그러나 다양한 유형의 상처에서 pH 및 효소 활성과 같은 요인이 골격의 성능에 영향을 미칠 수 있기 때문에 다양한 생리학적 조건에서 이 방법의 효과는 아직 완전히 이해되지 않았습니다. 따라서 다양한 생리학적 조건에서 스캐폴드 성능의 가변성을 고려해야 합니다. pH, 효소 활성 및 만성 상처의 온도 변화와 같은 요인은 골격의 분해에 영향을 미칠 수 있으며 EV는 역학을 방출하여 잠재적으로 치료 효능을 감소시킬 수 있습니다.
하이드로겔 기반 상처 드레싱은 생체 적합성과 습한 상처 환경을 유지하는 능력으로 인해 널리 사용되지만, EV와 같은 생체 활성 분자의 제어되고 국소적인 전달을 제공하는 능력이 부족한 경우가 많습니다. EV를 스캐폴드 시스템에 통합하면 면역 반응을 조절하고 조직 재생을 향상시킬 수 있는 생물학적 활성의 세포 유래 치료 구성 요소와 구조적 지지를 결합함으로써 고유한 이점을 얻을 수 있습니다.
유사하게, 나노 입자 매개 전달 시스템은 특정 세포 경로를 표적으로 삼는 데 매우 효율적입니다. 그러나 상처 부위에서 잔류하는 데 어려움을 겪을 수 있으며 종종 생체 활성을 유지하기 위해 추가 안정화제가 필요합니다30. 대조적으로, 제시된 스캐폴드 시스템은 분만 중 EV의 생체 활성을 보존하는 보호 미세환경을 제공합니다24.
이 프로토콜은 유망한 결과를 제공하지만 고려해야 할 몇 가지 제한 사항이 있습니다. 한 가지 과제는 스캐폴드 내에서 EV의 균일한 분포를 달성하는 것입니다. 혼합 공정의 변화로 인해 골격 전체의 EV 농도가 일치하지 않을 수 있으며, 이는 재현성에 영향을 미칠 수 있습니다. 이 문제를 극복하기 위해서는 주사기 혼합 기술이 장점입니다. 또한 알기네이트 스캐폴드의 칼슘 이온 농도와 같은 겔화 및 가교 조건에 대한 정밀한 제어는 최적의 기계적 특성과 구조적 무결성을 보장하는 데 중요합니다. 이러한 매개 변수의 편차는 스캐폴드 성능을 손상시킬 수 있습니다. 또 다른 제한 사항은 세척 단계에서 플라스틱 용기에 달라붙을 수 있기 때문에 비계 준비 중에 EV가 손실될 수 있다는 것입니다. 마지막으로, 준비된 스캐폴드의 저장 수명은 하이드로겔 매트릭스가 시간이 지남에 따라 기능을 저하시키거나 잃을 수 있기 때문에 상대적으로 짧습니다. 따라서 즉시 사용하거나 4°C에서 단기간 보관하는 것이 좋습니다. 안정성을 확인하기 위해 캡슐화된 EV에 대한 주기적인 생체 활성 테스트가 필요합니다18. 이러한 제한 사항을 해결하고 제안된 문제 해결 전략을 사용함으로써 연구원은 애플리케이션에서 이 프로토콜의 재현성과 효율성을 개선할 수 있습니다.
코어-시스 스캐폴드 설계 방법은 제어된 방출 메커니즘이 없는 기존 스캐폴드 설계에 비해 약물 전달에 있어 상당한 발전을 이뤘습니다31. 치료제의 적절하거나 시기적절한 방출을 제공하지 못할 수 있는 단상 골격과 달리, 이 방법은 향상된 정밀도로 EV 전달에 대한 동적 접근 방식을 제공합니다. 빠르게 분해되는 핵심 물질과 기능적 피복을 사용하면 종종 수동 또는 순차적 조정이 필요한 기존 방법에 비해 보다 표적화되고 효과적인 치료 개입이 가능합니다.
이 연구에 사용된 Alg 및 CMCh와 같은 골격 재료는 생체 적합성으로 알려져 있지만, 임상 번역을 위해서는 만성 상처 환경에서 장기적인 생체 적합성에 대한 보다 철저한 평가가 필요합니다. 이전 연구에서는 전임상 동물 모델에서 골격의 생체 내 효과를 조사한 결과 독성 효과나 유의미한 면역 반응이 관찰되지 않았으며, 이는 물질이 단기적으로 내약성이 우수함을 시사합니다18. 그러나 잠재적인 면역 반응 및 분해 부산물의 영향을 포함한 장기적인 생체 적합성은 추가 연구가 필요합니다. 골격 재료의 분해는 상처 치유 과정에 영향을 미치거나 만성 염증을 유발할 수 있는 부산물을 잠재적으로 방출할 수 있으며, 특히 면역 반응이 변경될 수 있는 당뇨병 또는 노화 모델의 맥락에서 발생할 수 있습니다. 따라서 분해 산물이 상처 미세환경과 전체 조직 재생에 어떤 영향을 미치는지 평가하기 위해 추가 연구를 수행하는 것이 중요합니다. 우리는 면역 반응 및 골격 분해에 초점을 맞춘 장기 생체 내 연구를 포함한 추가 생체 적합성 테스트가 만성 상처 치유를 위한 이 접근 방식의 안전성과 임상적 관련성을 이해하는 데 필수적임을 인정합니다.
이 골격 설계는 조직 공학 및 재생 의학 분야에서 특히 중요합니다. EV를 빠르고 통제된 방식으로 전달할 수 있는 능력은 만성 상처 치유, 연골 복구 및 기타 조직 재생 노력과 같은 응용 분야에 가치가 있습니다32. 스캐폴드 성능 저하 및 EV 출시와 관련된 문제를 해결함으로써 이 방법은 이러한 영역에서 환자 결과를 개선할 수 있는 가능성을 제공합니다. 또한 다양한 조직 유형에 대한 맞춤화 및 적응 가능성은 맞춤형 의학을 발전시키는 데 있어 다양성과 관련성을 강조합니다.
이 연구에서 아키타 당뇨병 마우스 모델을 사용하면 당뇨병 상태에서 만성 상처 치유를 조사하기 위한 귀중한 플랫폼을 제공할 수 있습니다. 이 모델은 지속적인 고혈당증, 지연성 혈관 신생, 손상된 조직 복구를 포함한 인간 당뇨병성 상처의 주요 병태생리학적 특성을 모방합니다33,34. 더욱이, 유전적 일관성과 외부 화학적 유도 없이 당뇨병의 자발적 발병이라는 이점을 제공하므로 실험 결과의 변동성을 줄일 수 있다33. 그러나 연구 결과를 인간의 만성 상처로 해석할 때 이 모델의 한계를 인정하는 것이 중요합니다. 쥐 피부 구조는 인간의 피부와 다른데, 특히 표피가 얇고, 피부 구조가 느슨하며, 치유 중 재상피화보다는 상처 수축이 우세한 역할을 한다는 점이 다르다35. 또한, 쥐의 면역 반응 및 염증 프로파일은 인간에서 관찰된 것과 완전히 일치하지 않으며, 이는 면역 조절 요법의 해석에 영향을 미칠 수 있습니다36. 이러한 차이점에도 불구하고 Akita 모델은 만성 상처 발병의 핵심인 전신 당뇨병 합병증을 요약할 수 있는 능력으로 인해 전임상 연구에서 널리 받아들여지고 효과적인 도구로 남아 있습니다. 제안된 치료적 접근법의 중개 가능성을 더욱 검증하기 위해, 아키타 모델 연구 결과를 보완하기 위한 향후 연구가 필요하다. 체외 인간 피부 모델 또는 당뇨병성 대형 동물 모델과 같은 추가적인 인간 관련 시스템은 큰 도움이 될 것입니다.
결론적으로, EV의 방출이 통제된 제안된 골격 설계는 치료제 전달의 상당한 발전을 나타냅니다. 기술적 복잡성에도 불구하고 이 혁신적인 접근 방식은 기존 방법에 비해 상당한 이점을 제공하며 만성 상처 드레싱을 개선할 수 있는 큰 잠재력을 가지고 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
훌륭한 촬영 작업을 해준 Happy Production의 Said Al-Hashmi와 Abdulrahman Almharbi에게 특별한 감사를 전합니다. 우리는 또한 고등교육연구혁신부(Ministry of Higher Education, Research and Innovation)와 니즈와대학교(University of Nizwa)의 재정적 지원과 필요한 자원을 제공한 것에 대해 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 23 G Purple precision conical Nozzle | Cellink | KT0000002000 | To provide precise extrusion of bioinks with minimal clogging |
| Alginate lyase (AlgLyase) | Sigma Aldrich | A1603-100MG | Algyase is an enzyme that degrades alginate. |
| Amicon Ultra Centrifugal Filter, 30 kDa MWCO | Merck | UFC9030 | Used to wash PKH-26 labeled-EVs |
| BCA assay Kit | Thermo Scientific | 10678484 | To determine the protein/EVs concentration |
| Bioprinting System | Regemat | V1 | To fabricate core-sheath scaffold |
| Bovine serum albumin (BSA) | sigma-aldrich | 05470-5G | To stop PKH 26 reaction |
| Calcium chloride | Sigma Aldrich | C3306-100G | To crosslink and stabilize bioinks in tissue engineering |
| Centrifuge | Sigma | 2-16P | Used for EVs isolation |
| Centrifuge 5810 R | Eppendorf | 22625101 | Used for cell culture |
| Class II Biological Safety Cabinet | Telstar | Bio II Advance | Cell culture |
| CryoCube F570 Series - ULT Freezer | Eppendorf | F571240035 | To store EVs |
| fluorescent microscope | OLYMPUS | IX73P1F | Used to check the residual PKH-26 in the filtrate |
| Gentamicin (50 mg/mL) | Thermofisher | 15750 | Antibiotic for cell culture media |
| GlutaMAX-I CTS, (100X), liquid | Thermofisher | A12860 | Cell culture media supplement |
| HCl | Sigma Aldrich | 7647-01-0 | Buffer preparation |
| HEPES | Carl Roth | Art. No. 6763.3 | Buffer preparation |
| High viscous carboxymethyl cellulose (CMCh) | BDH | 27929 4T | CMCh is a water-soluble cellulose derivative. |
| Incubator | New Brunswick | NB-170R | Cell culture |
| Invivo imaging | PerkinElmer | IVIS Lumina XRMS Series III | To track EVs release, in vivo |
| Magnet stirer | SalvisLAB | MC35 | For Bioinks preparation |
| miRCURY Exosome Kits for Exosome Isolation | Qiagen | 76743 | Evs isolation |
| NaOh | Daejung | 1310-73-2 | Buffer preparation |
| phosphate buffered saline(PBS) | Thermo Scientific | J61196.AP | Cell culture |
| PKH 26 | MCE | 154214-55-8 | Red fluorescent dye for labeling theEVs |
| Sodium alginate (Alg) | Sigma Aldrich | A0682-100G | Natural polysaccharide derived from brown seaweed. |
| Sodium chloride (NaCl) | Carl Roth | Art-Nr-P029.1 | Buffer preparation |
| StemPro BM Mesenchymal Stem Cells | Thermofisher | A1382901 | Mesenchymal stem cells |
| StemPro MSC SFM XenoFree | Thermofisher | A1067501 | Cell culture media |
| Trypsin 0.25% | Thermofisher | 25050014 | Cell dissociation |
| Vortex-Mixer | Daihan Scientific | VM-10 | Used to mix precipitation buffer with the conditioned media |
참고문헌
- Falanga, V., et al. Chronic wounds. Nat Rev Disease Primers. 8 (1), 50 (2022).
- Tran, H. Q., Shahriar, S. S., Yan, Z., Xie, J. Recent advances in functional wound dressings. Adv Wound Care. 12 (7), 399-427 (2023).
- Shao, M., et al. Emerging trends in therapeutic algorithm of chronic wound healers: Recent advances in drug delivery systems, concepts-to-clinical application and future prospects. Crit Rev Ther Drug Carrier Syst. 34 (5), 385-452 (2017).
- Rezvani Ghomi, E., Khalili, S., Nouri Khorasani, S., Esmaeely Neisiany, R., Ramakrishna, S. Wound dressings: Current advances and future directions. J Appl Poly Sci. 136 (27), 47738 (2019).
- Ding, J. Y., et al. Mesenchymal stem cell-derived extracellular vesicles in skin wound healing: Roles, opportunities and challenges. Military Med Res. 10 (1), 36 (2023).
- Sharma, D., Kumar, A., Mostafavi, E. Extracellular vesicle-based biovectors in chronic wound healing: Biogenesis and delivery approaches. Mol Ther Nucleic Acids. 32, 822-840 (2023).
- Vader, P., Mol, E. A., Pasterkamp, G., Schiffelers, R. M. Extracellular vesicles for drug delivery. Adv Drug Delivery Rev. 106, 148-156 (2016).
- Han, P., Ivanovski, S. 3d bioprinted extracellular vesicles for tissue engineering-a perspective. Biofabrication. 15 (1), 013001 (2022).
- Annabi, N., et al. 25th anniversary article: Rational design and applications of hydrogels in regenerative medicine. Adv Mater. 26 (1), 85-124 (2014).
- Zheng, Y., Pan, C., Xu, P., Liu, K. Hydrogel-mediated extracellular vesicles for enhanced wound healing: The latest progress, and their prospects for 3d bioprinting. J Nanobiotechnol. 22 (1), 57 (2024).
- Keener, A. B. How extracellular vesicles can enhance drug delivery. Nature. 582 (7812), S14-S14 (2020).
- Han, P., et al. 3d bioprinted small extracellular vesicles from periodontal cells enhance mesenchymal stromal cell function. Biomater Adv. 158, 213770 (2024).
- Born, L. J., et al. Sustained released of bioactive mesenchymal stromal cell-derived extracellular vesicles from 3d-printed gelatin methacrylate hydrogels. J Biomed Mater Res A. 110 (6), 1190-1198 (2022).
- Kjar, A., Mcfarland, B., Mecham, K., Harward, N., Huang, Y. Engineering of tissue constructs using coaxial bioprinting. Bioact Mater. 6 (2), 460-471 (2021).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3d bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Deshayes, S., Kasko, A. M. Polymeric biomaterials with engineered degradation. J Poly Sci A Poly Chem. 51 (17), 3531-3566 (2013).
- Xu, Q., et al. Injectable hyperbranched poly (β-amino ester) hydrogels with on-demand degradation profiles to match wound healing processes. Chem Sci. 9 (8), 2179-2187 (2018).
- Vakilian, S., et al. Engineered local delivery of extracellular vesicles loaded with si-tnf-α, via a core-sheath 3d-bio-printed scaffold as an effective wound dressing. J Drug Delivery Sci Technol. 101, 106189 (2024).
- Mirsanei, Z., et al. Synergistic effects of mesenchymal stem cell-derived extracellular vesicles and dexamethasone on macrophage polarization under inflammatory conditions. Inflammopharmacology. 32 (2), 1317-1332 (2024).
- Ma, Y., Brocchini, S., Williams, G. R. Extracellular vesicle-embedded materials. J Controlled Release. 361, 280-296 (2023).
- Jia, Q., Zhao, H., Wang, Y., Cen, Y., Zhang, Z. Mechanisms and applications of adipose-derived stem cell-extracellular vesicles in the inflammation of wound healing. Front Immunol. 14, 1214757 (2023).
- Lou, P., et al. Extracellular vesicle-based therapeutics for the regeneration of chronic wounds: Current knowledge and future perspectives. Acta Biomater. 119, 42-56 (2021).
- Cai, Y., Chen, K., Liu, C., Qu, X. Harnessing strategies for enhancing diabetic wound healing from the perspective of spatial inflammation patterns. Bioactive Mater. 28, 243-254 (2023).
- Li, Z., et al. Multifunctional hydrogel-based engineered extracellular vesicles delivery for complicated wound healing. Theranostics. 14 (11), 4198 (2024).
- Cabral, J., Ryan, A. E., Griffin, M. D., Ritter, T. Extracellular vesicles as modulators of wound healing. Adv Drug Delivery Rev. 129, 394-406 (2018).
- Moghadasi Boroujeni, S., Mashayekhan, S., Vakilian, S., Ardeshirylajimi, A., Soleimani, M. The synergistic effect of surface topography and sustained release of tgf-β1 on myogenic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 104 (7), 1610-1621 (2016).
- Jayaraman, P., et al. Controlled release of drugs in electrosprayed nanoparticles for bone tissue engineering. Adv Drug Delivery Rev. 94, 77-95 (2015).
- Huang, X., Brazel, C. S. On the importance and mechanisms of burst release in matrix-controlled drug delivery systems. J Controlled Release. 73 (2-3), 121-136 (2001).
- Smith, A. M., Senior, J. J. Alginate hydrogels with tuneable properties. Adv Biochem Eng Biotechnol. 178, 37-61 (2021).
- Yan, X., Sha, X. Nanoparticle-mediated strategies for enhanced drug penetration and retention in the airway mucosa. Pharmaceutics. 15 (10), 2457 (2023).
- Pant, B., Park, M., Park, S. -. J. Drug delivery applications of core-sheath nanofibers prepared by coaxial electrospinning: A review. Pharmaceutics. 11 (7), 305 (2019).
- Pinheiro, A., et al. Extracellular vesicles: Intelligent delivery strategies for therapeutic applications. J Controlled Release. 289, 56-69 (2018).
- Yoshioka, M., Kayo, T., Ikeda, T., Koizuni, A. A novel locus, mody4, distal to d7mit189 on chromosome 7 determines early-onset niddm in nonobese c57bl/6 (akita) mutant mice. Diabetes. 46 (5), 887-894 (1997).
- Fang, R. C., et al. Limitations of the db/db mouse in translational wound healing research: Is the noncnzo10 polygenic mouse model superior. Wound Repair Regen. 18 (6), 605-613 (2010).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. J Dermatol Sci. 90 (1), 3-12 (2018).
- Sellers, R. S. Translating mouse models: Immune variation and efficacy testing. Toxicol Pathol. 45 (1), 134-145 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유