Method Article
Optimierung der extrazellulären Vesikelabgabe mit einem 3D-biogedruckten Gerüst für die Behandlung chronischer Wunden
In diesem Artikel
Zusammenfassung
In dieser Studie wird ein Protokoll zur Herstellung von 3D-bio-gedruckten Gerüsten für die chronische Wundheilung vorgestellt. Extrazelluläre Vesikel werden aus mesenchymalen Stammzellen isoliert und mit der Hülle aus Carboxymethylcellulose und Alginat-Lyase in den Kern (Alginat) geladen. Dieses Design ermöglicht eine kontrollierte Degradation des Gerüsts und eine effiziente Freisetzung von Elektrofahrzeugen.
Zusammenfassung
Diese Studie skizziert ein detailliertes Protokoll für die Herstellung von 3D-biogedruckten Gerüsten mit Kernhülle, die die Heilung chronischer Wunden verbessern sollen. Das Protokoll beinhaltet die Isolierung extrazellulärer Vesikel (EVs) aus mesenchymalen Stammzellen (MSCs), die für ihre regenerativen und immunmodulatorischen Eigenschaften bekannt sind. Diese Elektrofahrzeuge werden dann in eine einzigartige Gerüststruktur integriert. Das Gerüst besteht aus einem Kern aus Alginat, das mit EVs beladen ist, und ist von einem Mantel aus Carboxymethylcellulose und Alginatlyase umgeben. Dieses innovative Design gewährleistet einen kontrollierten Gerüstabbau und fördert gleichzeitig eine effiziente und kontrollierte Freisetzung von EVs an der Wundstelle. Das Protokoll umfasst wichtige Schritte, darunter die Vorbereitung und Charakterisierung der EVs, die Formulierung von Biotinten für das 3D-Bioprinting und die Optimierung der Druckparameter, um die gewünschte Kern-Hüllen-Architektur zu erreichen. Durch die Kombination von struktureller Integrität und Bioaktivität zielt das Gerüst darauf ab, die Einschränkungen herkömmlicher Wundauflagen zu überwinden und einen gezielten Ansatz zur Beschleunigung der Geweberegeneration und zur Reduzierung von Entzündungen bei chronischen Wunden zu bieten. Diese Methode bietet eine reproduzierbare und skalierbare Strategie für die Entwicklung fortschrittlicher Biomaterialien mit potenziellen klinischen Anwendungen in der chronischen Wundversorgung. Das Protokoll hebt auch kritische Überlegungen hervor, um konsistente Ergebnisse zu erzielen und die Anpassungsfähigkeit für zukünftige therapeutische Anwendungen zu gewährleisten.
Einleitung
Chronische Wunden, die oft mit übermäßigen Entzündungen verbunden sind, müssen rechtzeitig behandelt werden, um schwerwiegende Komplikationen wie Infektionen und Gewebenekrosen zu vermeiden, die zu Amputationen führen können. Trotz der Fortschritte sind die derzeitigen Behandlungen nach wie vor kostspielig, unbequem, haben Nebenwirkungen und sind nur begrenzt wirksam, was den Bedarf an mehr heilenden Verbänden unterstreicht 1,2,3. Die Entwicklung einer neuen Generation von Wundauflagen, die speziell für chronische Wunden entwickelt wurden, ist unerlässlich, um diese Herausforderungen zu bewältigen. Darüber hinaus erfordert die komplexe Natur der Wundheilung Verbandsmaterialien mit einer Reihe von Eigenschaften, darunter Befeuchtung, Flexibilität, Adhäsion, Bioaktivität und biologische Abbaubarkeit4. Diese Studie zielt darauf ab, einen biotechnologisch hergestellten Wundverband zu entwickeln, der extrazelluläre Vesikel (EVs) mit einem 3D-biogedruckten Gerüst aus der Kernhülle integriert, um eine kontrollierte therapeutische Umgebung zu schaffen und die chronische Wundheilung zu beschleunigen.
EVs, die aus Stammzellen gewonnen werden, unterstützen die chronische Wundheilung, indem sie entzündungshemmende Reaktionen, Zellwachstum, Migration und Blutgefäßbildung fördern5. Darüber hinaus können Elektrofahrzeuge bioaktive Moleküle liefern, darunter niedermolekulare Medikamente, Gen- und Proteinkonstrukte für die Behandlung chronischer Wunden6. Darüber hinaus verbessert ihre Fähigkeit, die Fracht vor enzymatischem Abbau zu schützen, die Stabilität und Bioverfügbarkeit von Therapeutika und bietet deutliche Vorteile gegenüber herkömmlichen Wachstumsfaktoren und niedermolekularen Medikamenten, die in vivo oft schnell abgebaut werden 7. Trotz dieser Vorteile bleibt die effiziente und nachhaltige Verabreichung von EVs an das Zielgewebe eine große Herausforderung.
3D-Bioprinting-Gerüste können als Verabreichungsplattform für Elektrofahrzeuge dienen, um deren therapeutische Wirkung zu verstärken8. Diese Gerüste ahmen die natürliche zelluläre Umgebung nach und ermöglichen die kontrollierte Freisetzung von EVs 9,10. Sie schützen EVs auch vor Degradation und erhöhen die Stabilität ihrer microRNAs und Proteine11. Han et al. zeigten, dass EVs effektiv aus 3D-biogedruckten GelMA-Gerüsten freigesetzt werden können. Diese Freisetzung führte zu einer verbesserten Zelladhäsion und einer erhöhten Genexpression im Zusammenhang mit Mechanotransduktionswegen in humanen mesenchymalen Stammzellen (hBFP-MSCs) des bukkalen Fettpolsters, die auf die Gerüste ausgesät wurden12. Born et al. erreichten durch die Optimierung der Konzentration des Vernetzers eine kontrollierte Freisetzung der EVs. Dieser Ansatz hat sich als wirksam bei der Förderung der Angiogenese erwiesen und bietet eine vielversprechende Methode für die regulierte Verabreichung von EVs13.
Der 3D-Biodruck von Kernhülle ermöglicht die Herstellung komplexer Strukturen aus mehreren Materialien, indem ein Kernmaterial gedruckt wird, das von einer Hülle umhüllt ist. Der Kern kann Zellen, Wachstumsfaktoren oder Medikamente enthalten, während die Hülle mechanischen Halt und Schutz bietet oder als Barriere fungiert. Diese Methode findet Anwendung im Tissue Engineering und in der regenerativen Medizin, z. B. bei der Entwicklung von Gefäßnetzwerken, der Nachahmung natürlicher Gewebestrukturen und der Entwicklung von Arzneimittelverabreichungssystemen. Es ermöglicht eine präzise Kontrolle über die Materialverteilung und -zusammensetzung und verbessert so die Funktionalität und biologische Relevanz der Konstrukte. Im Vergleich zu alternativen Techniken bietet der 3D-Biodruck der Kernhülle eine präzise Kontrolle über die Materialverteilung und -zusammensetzung, wodurch die Funktionalität und biologische Relevanz der Konstrukte verbessertwird 14,15.
Die technische Degradation in Wundauflagen bietet Vorteile wie reduzierte Beschwerden während des Wechsels, eine feuchte Umgebung für die Heilung und Infektionskontrolle, eine rechtzeitige therapeutische Verabreichung und eine optimale Geweberegeneration 16,17,18. Hydrogele aus Alginat (Alg) und Carboxymethylcellulose (CMCh) sind biokompatibel und wirksam für die Verabreichung extrazellulärer Vesikel (EVs) an Wunden, verbessern die Heilung durch zelluläre Kommunikation und reduzieren Entzündungen18. In dieser Studie wurden EVs in einen Kern aus Alg integriert, während eine Hülle aus CMCh und AlgLyase (AlgLyase) verwendet wurde, um einen schnellen Verbandsabbau und die Abgabe von EVs zu ermöglichen. Dieses Kern-Hüllen-Design erleichtert die schnelle Freisetzung von EVs als Reaktion auf den Gerüstabbau, verbessert ihre therapeutische Wirksamkeit und überwindet die Einschränkungen bestehender chronischer Wundbehandlungen. Das primäre Ziel dieser Studie ist es, einen biotechnologisch hergestellten Verband zu entwickeln, der die Wundheilung verbessert, indem er die kontrollierte Freisetzung von EVs mit einem reaktionsschnell abbaubaren Gerüst integriert und so letztendlich die Behandlungsergebnisse für chronische Wunden verbessert.
Protokoll
Die Tierversuche wurden in voller Übereinstimmung mit den ethischen Standards durchgeführt, die vom Nationalen Komitee für Bioethik und der Tierethikkommission der Universität Nizwa festgelegt wurden. Die ethische Zulassung für diese Studie wurde unter der Freigabe-ID: VCGSR, AREC/01/2023 erteilt. Alle Tiere wurden unter Standardlaborbedingungen untergebracht, um optimale Umweltkontrollen, die richtige Ernährung und eine umfassende Pflege zu gewährleisten, um ihr Wohlergehen während der gesamten Studie zu gewährleisten. Alle Verfahren mit Tieren hielten sich strikt an die institutionellen Richtlinien, die internationalen Tierhaltungsstandards und die ANARRIVE-Richtlinien.
1. Zellkultur
- Entnehmen Sie ein Fläschchen mit MSCs (Passage #2) aus dem Flüssigstickstofflager und behandeln Sie es mit aseptischen Techniken, um eine Kontamination zu verhindern. Tauen Sie die Zellen schnell in einem 37 °C warmen Wasserbad auf und stellen Sie sicher, dass sie entfernt werden, sobald ein kleines Eisfragment übrig bleibt.
- Bereiten Sie ein komplettes Medium vor, das MSC SFM Basalmedium enthält, ergänzt mit 1 % (v/v) MSC SFM XenoFree Supplement, 1 % (v/v) GlutaMAX und 0,01 % (v/v) Gentamicin. Geben Sie 1 ml vorgewärmtes (37 °C) vollständiges Medium in einer Geschwindigkeit von 3 bis 5 Tropfen alle 5 s in das Fläschchen und mischen Sie es dann vorsichtig. Den gesamten Inhalt der Durchstechflasche MSC in ein konisches 15-ml-Röhrchen mit 4 mL vorgewärmtem Vollmedium unter aseptischen Bedingungen in eine Biosicherheitswerkbank der Klasse II überführen.
- Zentrifugieren Sie die Zellen bei 200 x g für 5 min bei Raumtemperatur. Stellen Sie sicher, dass die Zentrifuge richtig ausbalanciert ist.
- Aspirieren Sie den Überstand und resuspendieren Sie die Zellen in 1 ml vorerwärmtem vollständigem Medium. Anschließend werden die Zellen in einen T25-Kolben mit 4 ml vollständigem Medium überführt.
- Kippen Sie den Kolben vorsichtig, um sicherzustellen, dass die Zellen gleichmäßig verteilt sind. Der Kolben wird bei 37 °C mit 5 % CO2 inkubiert.
- Wechseln Sie das Medium alle 2 Tage und ersetzen Sie es durch frisches, vorgewärmtes, vollständiges Medium. Verwenden Sie schonendes Pipettieren, um Zellstörungen zu vermeiden. Bei Erreichen einer Konfluenz von 70 % bis 80 % wird das verbrauchte Medium aus dem T25-Kolben abgesaugt.
- Waschen Sie die Zellen mit 3 ml frischem PBS, um Rückstände zu entfernen. Stellen Sie sicher, dass der Kolben während des Waschens vollständig bedeckt ist.
- Geben Sie 1 ml 0,25%ige Trypsinlösung in den T25-Kolben, inkubieren Sie ihn 3-7 Minuten lang bei 37 °C und überwachen Sie die Ablösung sorgfältig unter dem Mikroskop bei 4-facher Vergrößerung.
- Klopfen Sie bei Bedarf vorsichtig auf den Kolben, um eine vollständige Zellablösung zu gewährleisten. Geben Sie vorgewärmtes Vollmedium in den Kolben und pipettieren Sie es auf und ab über die Oberfläche, um die Zellen zu lösen. Übertragen Sie dann die Zellsuspension in ein 15-ml-Zentrifugenröhrchen.
- Zentrifugieren Sie das Röhrchen bei 200 x g für 5 min bei Raumtemperatur. Suspendieren Sie das Zellpellet in einem frischen, vollständigen Medium und zählen Sie die Zellen mit einem Neubauer-Hämozytometer. Übertragen Sie die Zellen in einen T75-Kolben. Stellen Sie eine Aussaatdichte von 5.000 Zellen/cm2 für ein optimales Wachstum sicher.
- Inkubieren Sie die Zellen bei 37 °C mit 5 % CO2. Nach 72 Stunden Zellinkubation sammeln Sie das konditionierte Medium aus den Zellen für die Isolierung der EVs. Sofort nach der Entnahme verwenden.
2. Isolierung von Elektrofahrzeugen
- Zentrifugieren Sie die 13 mL des gesammelten konditionierten Mediums bei 800 x g für 15 Minuten, um Zelltrümmer zu entfernen. Filtrieren Sie den Überstand vorsichtig mit einem 0,22 μm Spritzenvorsatzfilter, um große Partikel zu entfernen.
- Geben Sie 5 mL Fällungspuffer in das gefilterte konditionierte Medium und wirbeln Sie es gründlich durch, um es zu mischen. Stellen Sie sicher, dass die Lösung homogen ist.
- Inkubieren Sie die Mischung über Nacht bei 4 °C, damit die Elektrofahrzeuge ausfallen können. Die Mischung bei 3.220 x g für 30 min bei 20 °C zentrifugieren. Überprüfen Sie die Balance der Röhren.
- Entsorgen Sie den Überstand vorsichtig, ohne das Pellet zu stören. Zentrifugieren Sie das Pellet erneut bei 3.220 x g für 5 s, um die Restflüssigkeit zu entfernen.
- Pipettieren Sie das EV-Pellet vorsichtig in 200 μl PBS, um Schäden an den EVs zu vermeiden. Messen Sie die Proteinkonzentration der EVs gemäß den Anweisungen des Herstellers (BCA Protein Assay Kit).
- Führen Sie Western Blotting durch, um EV-spezifische Marker (CD63, CD81 und CD9) zu erkennen, um den EV-Phänotyp18 zu überprüfen. Die Analyse bestätigte das Vorhandensein dieser Marker und bestätigte die Identität des Elektrofahrzeugs19.
- Um das Risiko einer RNase-Kontamination zu minimieren, wird empfohlen, es ohne zusätzliche Lagerung direkt zu verwenden. Falls es benötigt wird, lagern Sie die EVs für die weitere Verwendung bei -80 °C. Aliquotieren Sie die Suspension des EVs in ein Volumen von 40 μl, um wiederholte Gefrier-Tau-Zyklen zu vermeiden.
3. Kennzeichnung von Elektrofahrzeugen mit PKH-26
- Vorbereitung des Puffers
- 0,238 g HEPES in ca. 90 ml sterilem Reinstwasser in einem sterilen Behälter auflösen. Verwenden Sie frisch zubereitete HEPES-Lösung. Geben Sie 0,85 g NaCl in die HEPES-Lösung.
- Stellen Sie den pH-Wert je nach Bedarf mit 1 M NaOH oder HCl mit einem kalibrierten pH-Messgerät auf 7,4 ein. Fügen Sie deionisiertes Wasser hinzu, um das Gesamtvolumen auf 100 ml zu bringen. Filtrieren Sie die Lösung durch einen 0,22 μm Filter, um sie zu sterilisieren.
- 4 μl PKH-26-Farbstoff in 1 ml vorbereitetem Puffer verdünnen. Mit der Pipette gründlich mischen, um die Homogenität zu gewährleisten.
- Resuspendieren Sie gereinigte EVs in 1 ml PBS in einer Konzentration von 700 μg/ml. Geben Sie 1 mL der EVs-Suspension zu 1 mL der vorbereiteten PKH-26-Lösung. Für die Nur-Farbstoff-Kontrollgruppe fügen Sie 1 mL des vollständigen Mediums ohne EVs zu 1 mL der PKH-26-Lösung hinzu. Alle nachfolgenden Schritte werden auch für die Kontrollgruppe durchgeführt, um eine mögliche unspezifische Aggregation oder Mizellenbildung zu berücksichtigen.
- Mischen Sie die EVs gründlich, indem Sie das Rohr vorsichtig 10x-15x umdrehen. Inkubieren Sie die Mischung 3-5 Minuten lang bei Raumtemperatur, um eine gleichmäßige Exposition der EVs gegenüber dem Farbstoff zu gewährleisten.
- Bereiten Sie eine 2 ml frische 1%ige BSA-Lösung mit sterilem Reinstwasser vor und fügen Sie sie zu den 2 ml der resultierenden Mischung hinzu, um die Markierungsreaktion zu löschen. Vorsichtig mischen, um eine Aggregation zu vermeiden.
- Konzentrieren Sie die PKH-26-markierten Elektrofahrzeuge gemäß dem oben genannten Protokoll (Schritte 2.2-2.7). Resuspendieren Sie die markierten EVs in 300 μl PBS. Pipettieren Sie die mit PKH-26 markierte EVs-Probe in ein 30-kDa-Filterröhrchen.
- Die Probe wird bei 3.220 x g für 30 min bei 4 °C zentrifugiert. Während dieses Schritts gelangen der freie PKH-26-Farbstoff und kleine Moleküle durch die Membran in das Filtrat, während die PKH-26-markierten EVs im Retentat zurückgehalten werden.
- Nach der ersten Zentrifugation wird das Filtrat verworfen und 300 μl PBS zum Retentat gegeben. Suspendieren Sie die EVs im PBS vorsichtig wieder, indem Sie auf und ab pipettieren.
- Zentrifugieren Sie die Probe erneut bei 3.220 x g für 30 min bei 4 °C, um alle verbleibenden freien Farbstoffe oder kleinen Moleküle wegzuspülen.
- Bestätigen Sie das Fehlen von PKH-26 in der Filtratlösung durch ein Fluoreszenzmikroskop. Wenn ein Farbstoff festgestellt wird, wiederholen Sie die Waschschritte.
- Sammeln Sie die obere Lösung mit einer Mikropipette und entfernen Sie den Filter aus dem Auffangröhrchen. Drehen Sie den Filter vorsichtig um (drehen Sie ihn auf den Kopf).
- Zentrifugieren Sie den Invertfilter bei 800 x g für 5 min bei 4 °C. Dies wird dazu beitragen, die zurückgehaltenen PKH-26-EVs aus der Filtermembran in das neue Sammelrohr zu sammeln. Verwenden Sie die PKH-26-EVs direkt für den nächsten Schritt.
4. 3D Bio-Druck
- Vorbereitung der Biotinten
- Bereiten Sie eine frische 4,5%ige Natrium-Alg-Lösung mit sterilem Reinstwasser vor. Über Nacht bei 60 °C umrühren, damit sich die Lösung vollständig auflösen kann.
- CMCh in sterilem Reinstwasser auflösen, um eine 3,8%ige (w/v) Lösung zu erhalten. Frisch zubereiten. Über Nacht bei 60 °C umrühren, bis es sich vollständig aufgelöst hat.
- Zentrifugieren Sie die vorbereiteten Biotinten bei 3.220 x g für 10 min bei 25 °C, um Blasen zu entfernen, die den Druckprozess beeinträchtigen könnten.
- Mischen Sie die vorbereiteten 3 ml Alg-Lösung mit den markierten EVs oder der Nur-Farbstoff-Kontrolle mit einem Spritzenmischer, um die Konzentration von 0,01 % (w/v) der EVs zu erreichen. Sorgen Sie für eine gleichmäßige Verteilung durch schonendes Mischen.
- Mischen Sie mit einem Spritzenmischer 1 ml CMCh mit einer frisch zubereiteten AlgLyase-Lösung in sterilem Reinstwasser, um eine Endkonzentration von 0,5 mU/ml zu erreichen.
- Wie in Abbildung 1A dargestellt, laden Sie gleichzeitig die Alg/Exo-Biotinte in den Kernteil und die CMCh/AlgLyase-Biotinte in den Mantelteil des Kern-/Schleusenspritzenaufbaus.
- Lassen Sie die Biotinten vor dem Druck 15 Minuten ruhen.
- 3D-Biodrucker einrichten
- Erstellen Sie mit der 3D-Bioprinter-Software die Gerüststruktur, indem Sie eine zylindrische Form mit einem diagonalen Füllmuster auswählen. Stellen Sie dazu den Zylinderdurchmesser und die Zylinderhöhe auf 20 mm bzw. 1,1 mm ein. Konfigurieren Sie die Porengröße auf 1 mm.
- Stellen Sie das Saugvermögen des Kerns und der Manteldüse auf 1 mm/s bei einer Dicke von 0,25 mm pro Schicht ein und stellen Sie die Bewegungsgeschwindigkeit auf 6 mm/s ein. Drucken Sie vier Schichten mit einer Dicke von 0,25 mm pro Schicht bei Raumtemperatur.
- Beginnen Sie mit dem Druck auf Polyesterfolie.
- Verwenden Sie den Luftbefeuchter mit Aerosol Calciumchlorid (2,2 %), um das Gerüst während des Extrusionsprozesses zu vernetzen. Positionieren Sie die Befeuchterdüse ca. 20 cm vom Extrusionskopf entfernt, um eine effektive Vernetzung zu gewährleisten, ohne die Gerüststruktur zu beeinträchtigen. Zur weiteren Vernetzung das Gerüst 10 min in Calciumchloridlösung (2,2%) tauchen.
- Spülen Sie das Gerüst 3x mit sterilem Reinstwasser ab, um überschüssiges Calciumchlorid und ungebundene Biotinte zu entfernen.
- Stellen Sie sicher, dass das Gerüst in einer sterilen Umgebung bei 4 °C gelagert wird, um die Integrität und Funktionalität des Gerüsts bis zu drei Monate lang zu erhalten.
5. Verfolgung der Veröffentlichung von Elektrofahrzeugen
- Erstellung eines zirkulären kutanen Wundmodells
- Anästhesieren Sie männliche Akita-heterozygote diabetische Mäuse (8 Wochen) durch Verabreichung einer intraperitonealen Injektion von Ketamin (70 mg/kg) und Xylazin (10 mg/kg). Bestätigen Sie die ordnungsgemäße Anästhesie, indem Sie das Fehlen von Reflexreaktionen (z. B. Zehenkneifen) beurteilen und die Atemfrequenz überwachen. Um Hornhauttrockenheit während der Narkose zu verhindern, tragen Sie sterile veterinärmedizinische Augensalbe auf die Augen auf.
- Bereiten Sie den Bereich der dorsalen Haut vor, indem Sie ihn zuerst mit einer elektrischen Haarschneidemaschine rasieren. Vermeiden Sie Hautreizungen oder Verletzungen. Sterilisieren Sie den rasierten Bereich mit einer Povidon-Jod-Lösung.
- Erzeugen Sie mit einem sterilen Seizer eine 6 mm große, kreisförmige Hautwunde in voller Dicke auf der dorsalen Oberfläche jeder Maus.
- Platzieren Sie das 3D-biogedruckte Gerüst mit PKH-markierten EVs vorsichtig direkt auf dem Wundbett. Stellen Sie sicher, dass das Gerüst die Wundoberfläche vollständig und mit minimalen Lufteinschlüssen bedeckt, indem Sie leicht mit einer sterilen Pinzette drücken. Stellen Sie sicher, dass das Tier nach dem Eingriff genau beobachtet wird und betreut bleibt, bis es das Bewusstsein vollständig wiedererlangt hat und das Brustbein aufrechterhalten kann.
- Fluoreszierende Bildgebung
- Nach 2 h, 4 h, 8 h, 24 h nach der Implantation betäuben Sie die Mäuse mit Isofluran. Zur Einleitung der Anästhesie legen Sie die Mäuse in die Kammer des In-vivo-Bildgebungssystems (IVIS) und setzen Sie sie 2%-3% Isofluran in Sauerstoff aus. Tragen Sie eine Augensalbe auf die Augen der Mäuse auf, um Trockenheit zu verhindern. Nach der Betäubung werden die Mäuse in das IVIS-System überführt und mit 1 % bis 2 % Isofluran im Sauerstoff versorgt, der über die Nasenkanäle abgegeben wird. Stellen Sie sicher, dass die Tiere vollständig betäubt und stabil sind, bevor Sie mit der Bildgebung fortfahren.
- Verwenden Sie das IVIS-System, um die Fluoreszenzsignale von den PKH-markierten EVs zu erfassen, die vom Gerüst freigesetzt werden. Wählen Sie im Imaging-Assistenten die Option Fluoreszenzbildgebung und aktivieren Sie die Anregungs- und Emissionsfilter für den PKH-Farbstoff. Passen Sie die Kameraeinstellungen an, einschließlich des Sichtfelds und der Höhe des Motivs, um die Signalerkennung zu optimieren. Stellen Sie eine konsistente Positionierung über alle Bildgebungszeitpunkte sicher, um genaue Vergleiche zu ermöglichen. Beginnen Sie mit der Aufnahme von Bildern und speichern Sie die resultierenden Daten.
- Quantifizieren Sie die Intensitäten des Fluoreszenzsignals mit der IVIS-Software. Dies wird es ermöglichen, die Freisetzung von Elektrofahrzeugen im Laufe der Zeit zu verfolgen.
Ergebnisse
Die In-vivo-Freisetzung von EVs sowohl aus den Alg-EVs/CMCh- als auch aus den Alg-EVs/CMCh-AlgLyase-Gerüsten ist in Abbildung 1B,C dargestellt. Wie erwartet zeigte das Alg-EVs/CMCh-AlgLyase-Gerüst im Vergleich zu Alg-EVs/CMCh ein schnelleres Freisetzungsprofil, insbesondere zu den Zeitpunkten 2 h und 4 h. Die Freisetzung von EVs aus Hydrogelen wird durch eine Kombination physikalisch-chemischer Mechanismen gesteuert, darunter Diffusion, Quellung, Erosion und Abbau20. Durch die Nutzung der Alglyase erleichtert das Gerüst den Abbau von Alg und beschleunigt die Freisetzung von EVs, um chronische Entzündungen in den frühen Stadien der Wundheilung effizient zu kontrollieren. Die frühe Freisetzung von EVs ist entscheidend für die Linderung übermäßiger Entzündungen, die die Heilung verzögern können 21,22,23. Um eine mögliche unspezifische Aggregation oder Mizellenbildung zu berücksichtigen, wurde auch die Kontrollgruppe analysiert, die vernachlässigbare Fluoreszenzsignale zeigte. Diese Beobachtung bestätigt, dass die detektierten Signale überwiegend von den markierten EVs stammen.
Diese Ergebnisse spiegeln die entscheidende Rolle der Gerüstzusammensetzung bei der Modulation der Freisetzungsraten von Elektrofahrzeugen wider. Die schnellere Freisetzung, die im Alg-EVs/CMCh-AlgLyase-Gerüst beobachtet wurde, wird auf den enzymatischen Abbau von Alg durch Alglyase zurückgeführt, der den Hydrogelabbau verbessert. Diese schnelle Freisetzung von EVs ist besonders vorteilhaft, um die entzündliche Phase der Wundheilungzu behandeln 24. Chronische Wunden leiden oft unter anhaltenden Entzündungen, die die Heilung beeinträchtigen; Die frühe und kontrollierte Freisetzung von EVs kann dies abschwächen, indem sie Entzündungsreaktionen moduliert und ein pro-regeneratives Umfeld fördert22,25.
Um diese Ergebnisse zu analysieren, sollten die Forscher die mit dem IVIS-System erfasste Fluoreszenzintensität quantifizieren und die Signalstärke mit der EV-Konzentration über die Zeit korrelieren. Die Daten sollten grafisch dargestellt werden, um die Freisetzungskinetik zu veranschaulichen und Vergleiche zwischen verschiedenen Gerüstformulierungen zu ermöglichen. Variationen in den Freisetzungsprofilen können auch hinsichtlich der Integrität des Gerüsts und der Enzymaktivität bewertet werden, was weitere Einblicke in die zugrunde liegenden Freisetzungsmechanismen bietet.
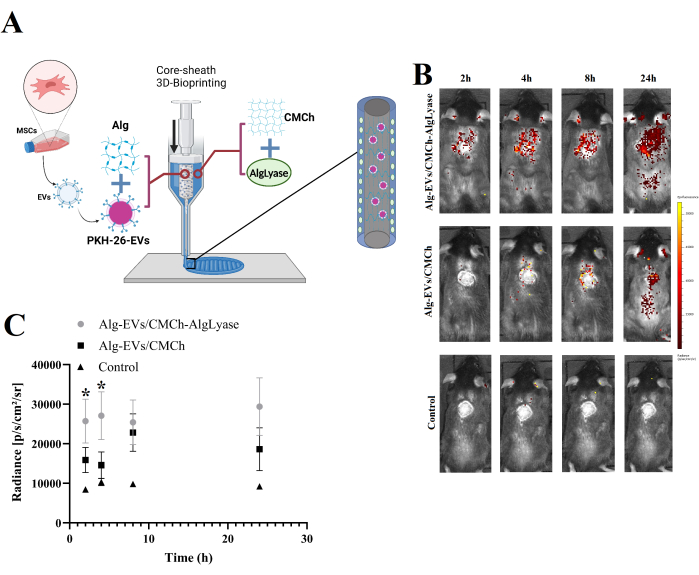
Abbildung 1: Überblick über die Herstellung von Gerüsten und das Freigabeprofil von in vivo EVs. (A) Schematische Darstellung des Herstellungsprozesses für das 3D-biogedruckte Gerüst Alg-EVs/CMCh-AlgLyase. (B) In-vivo-Freisetzungsprofil von PKH-markierten EVs aus dem Alg-EVs/CMCh-AlgLyase-Gerüst im Vergleich zum Alg-EVs/CMCh-Gerüst und dem reinen Farbstoff-Kontrollgerüst (Kontrolle). Farbige Balken zeigen die Fluoreszenzintensität an. (C) Quantitative Analyse der Freisetzungsintensität von PKH-EVs (n=3). Fehlerbalken stellen die Standardabweichung dar, und zur Bewertung der statistischen Signifikanz wurde eine unidirektionale ANOVA verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Ein zentraler Aspekt des Protokolls ist das Kern-Mantel-Gerüstdesign, das für eine effiziente Lieferung von Elektrofahrzeugen unerlässlich ist. Das Design besteht aus Alg als Kernmaterial und einer Kombination aus CMCh und Alglyase als Mantel. Dieser Aufbau ermöglicht eine kontrollierte und schnelle Freigabe von Elektrofahrzeugen. Das Kernmaterial, Alg, verkapselt die Elektrofahrzeuge und gewährleistet ihren Schutz und ihre lokale Abgabe. Die Hülle, bestehend aus CMCh und Alglyase, ermöglicht den beschleunigten Abbau des Alg-Kerns, der für die rechtzeitige Freisetzung der EVs entscheidend ist. In unserer vorherigen Veröffentlichung18 haben wir die in vitro Freisetzungskinetik von EVs aus einem ähnlichen Gerüstsystem untersucht und ein kontrolliertes Freisetzungsprofil über einen längeren Zeitraum gezeigt, was das Potenzial dieses Ansatzes für nachhaltige therapeutische Effekte unterstreicht. Dieser kontrollierte Abbau und diese Freisetzung werden durch präzise Formulierungs- und Verkapselungstechniken erreicht. Diese Daten werden die Korrelation der Freisetzungsdynamik von EVs mit dem Fortschreiten der Wundheilung ermöglichen und bieten tiefere Einblicke in das klinische Potenzial des Gerüsts.
Ein langsameres Freisetzungssystem bietet Vorteile in therapeutischen Anwendungen, bei denen anhaltende, niedrigere Konzentrationen eines Medikaments oder Wachstumsfaktors die Wirksamkeit verbessern und gleichzeitig das Risiko von Nebenwirkungen verringern können. So kann beispielsweise eine allmähliche Freisetzung eine kontinuierliche Stimulation zellulärer Prozesse über einen längeren Zeitraum gewährleisten26, wodurch hohe Konzentrationen vermieden werden, die zu Toxizität führen könnten27. Die spezifischen Anforderungen der Anwendung geben jedoch das ideale Release-Profil vor. In einigen Fällen kann eine schnelle Freisetzung bevorzugt werden, um eine unmittelbare therapeutische Wirkung zu erzielen28.
Zu den kritischen Schritten innerhalb des Protokolls gehören die Vorbereitung und Schichtung der Biotintenmaterialien für das Kern-Mantel-Gerüst. Die Beibehaltung der präzisen Konzentrationen von Alg, CMCh und Alglyase während der Biotintenvorbereitung gewährleistet strukturelle Stabilität und eine effektive Verkapselung von EVs. Ein weiterer wichtiger Schritt ist die Optimierung der 3D-Bioprinting-Parameter, einschließlich Düsengeschwindigkeiten und Vernetzungsbedingungen, um eine einheitliche Gerüstgeometrie und Funktionsleistung zu gewährleisten. Die Optimierung des PKH-26-Markierungsprozesses ist unerlässlich, um freien Farbstoff und unerwünschte Partikel loszuwerden. Dieser Prozess würde die Tracking-Genauigkeit der Elektrofahrzeuge verbessern.
Das Protokoll wurde optimiert, um die Stabilität des Gerüsts und die Konsistenz der EV-Freisetzung zu verbessern. Zum Beispiel wurde ein Überschuss an freiem PKH-26-Farbstoff während der Markierung durch die Optimierung des Farbstoff-zu-EV-Verhältnisses und die Verwendung einer alternativen Isolationsmethode für PKH-26-gekennzeichnete EVs gemildert. Es wurden regelmäßige Anpassungen für die 3D-Bioprinting-Parameter vorgenommen, um die Wirksamkeit des Gerüsts zu erhalten.
Die Viskosität der Biotinten sollte optimiert werden, um ein Verstopfen während des Drucks zu verhindern. Die Abstimmung der AlgLyase-Konzentration ist erforderlich, um die Abbaurate zu kontrollieren. Die Fehlerbehebung für die mechanischen Eigenschaften des Gerüsts umfasste das Ausbalancieren der Calciumchlorid-Vernetzungsdauer, um spröde oder zu weiche Gerüste zu vermeiden. Bei Elektrofahrzeugen verringerten Markierungs-, Filtrations- und Zentrifugationsschritte die Kontamination durch freie Farbstoffe und verbesserten die Genauigkeit der Bildgebungsergebnisse.
Neben den direkten Vorteilen der Verwendung von abbaubaren Verbänden für die chronische Wundheilung beeinflusst die Abbaurate des Gerüsts die Freisetzungskinetik von EVs erheblich. Diese Abbaurate kann an die spezifischen Bedürfnisse der Wunde angepasst werden. Durch die Optimierung der Konzentration von AlgLyase in der Hülle kann die Abbaurate des Alg-Kerns fein abgestimmt werden, was ein individuelles Freisetzungsprofil ermöglicht29. Die Wirksamkeit der Methode unter unterschiedlichen physiologischen Bedingungen ist jedoch noch nicht vollständig verstanden, da Faktoren wie der pH-Wert und die enzymatische Aktivität in verschiedenen Arten von Wunden die Leistung des Gerüsts beeinflussen können. Daher sollte die Variabilität der Gerüstleistung unter verschiedenen physiologischen Bedingungen berücksichtigt werden. Faktoren wie pH-Wert, enzymatische Aktivität und Temperaturschwankungen bei chronischen Wunden können den Abbau des Gerüsts beeinflussen und EVs setzen Kinetik frei, was möglicherweise die therapeutische Wirksamkeit verringert.
Während Wundauflagen auf Hydrogelbasis aufgrund ihrer Biokompatibilität und ihrer Fähigkeit, ein feuchtes Wundmilieu aufrechtzuerhalten, weit verbreitet sind, fehlt ihnen oft die Fähigkeit, eine kontrollierte und lokalisierte Abgabe von bioaktiven Molekülen wie EVs zu gewährleisten. Die Integration von EVs in das Gerüstsystem bietet einen einzigartigen Vorteil, indem sie strukturelle Unterstützung mit einer biologisch aktiven, zellbasierten therapeutischen Komponente kombiniert, die Immunreaktionen modulieren und die Geweberegeneration verbessern kann.
In ähnlicher Weise sind Nanopartikel-vermittelte Verabreichungssysteme hocheffizient, wenn es darum geht, auf bestimmte zelluläre Signalwege abzuzielen. Sie können jedoch auf Herausforderungen bei der Retention an der Wundstelle stoßen und benötigen oft zusätzliche Stabilisatoren, um die Bioaktivität aufrechtzuerhalten30. Im Gegensatz dazu bietet das vorgestellte Gerüstsystem eine schützende Mikroumgebung, die die Bioaktivität von Elektrofahrzeugen während der Auslieferung24 bewahrt.
Obwohl dieses Protokoll vielversprechende Ergebnisse bietet, gibt es einige Einschränkungen, die berücksichtigt werden sollten. Eine Herausforderung besteht darin, eine gleichmäßige Verteilung der Elektrofahrzeuge innerhalb des Gerüsts zu erreichen. Schwankungen im Mischprozess können zu Inkonsistenzen in der EV-Konzentration auf dem Gerüst führen, was die Reproduzierbarkeit beeinträchtigen könnte. Um diese Herausforderung zu meistern, ist die Spritzenmischtechnik von Vorteil. Darüber hinaus ist eine präzise Kontrolle der Gelierungs- und Vernetzungsbedingungen, wie z. B. der Kalziumionenkonzentration für Alginatgerüste, entscheidend, um optimale mechanische Eigenschaften und strukturelle Integrität zu gewährleisten. Abweichungen bei diesen Parametern können die Leistung des Gerüsts beeinträchtigen. Eine weitere Einschränkung ist der mögliche Verlust von Elektrofahrzeugen bei der Gerüstvorbereitung, da sie während der Waschschritte an Kunststoffen haften bleiben können. Schließlich ist die Haltbarkeit der vorbereiteten Gerüste relativ kurz, da sich Hydrogelmatrizen im Laufe der Zeit verschlechtern oder ihre Funktionalität verlieren können. Es empfiehlt sich also eine sofortige Anwendung oder kurzfristige Lagerung bei 4 °C. Eine periodische Bioaktivitätsprüfung der verkapselten Elektrofahrzeuge ist erforderlich, um ihre Stabilitätzu bestätigen 18. Durch die Behebung dieser Einschränkungen und den Einsatz der vorgeschlagenen Fehlerbehebungsstrategien können Forscher die Reproduzierbarkeit und Effektivität dieses Protokolls in ihren Anwendungen verbessern.
Die Methode des Kernmantel-Gerüstdesigns stellt einen signifikanten Fortschritt für die Wirkstoffverabreichung gegenüber herkömmlichen Gerüstkonstruktionen dar, bei denen es an kontrollierten Freisetzungsmechanismen mangelt31. Im Gegensatz zu einphasigen Gerüsten, die möglicherweise keine ausreichende oder rechtzeitige Freisetzung von Therapeutika bieten, bietet diese Methode einen dynamischen Ansatz für die Verabreichung von Elektrofahrzeugen mit erhöhter Präzision. Die Verwendung eines sich schnell abbauenden Kernmaterials und einer Funktionshülle ermöglicht einen gezielteren und effektiveren therapeutischen Eingriff im Vergleich zu herkömmlichen Methoden, die oft manuelle oder sequentielle Anpassungen erfordern.
Während die in dieser Studie verwendeten Gerüstmaterialien wie Alg und CMCh für ihre Biokompatibilität bekannt sind, ist für die klinische Umsetzung eine gründlichere Bewertung ihrer Langzeitbiokompatibilität in chronischen Wundumgebungen erforderlich. In unseren früheren Arbeiten untersuchten wir die in vivo Effekte des Gerüsts in einem präklinischen Tiermodell und beobachteten keine toxischen Wirkungen oder signifikante Immunantworten, was darauf hindeutet, dass die Materialien kurzfristig gut vertragen werden18. Die langfristige Biokompatibilität, einschließlich der potenziellen Immunreaktionen und der Auswirkungen von Abbaunebenprodukten, muss jedoch weiter erforscht werden. Durch den Abbau der Gerüstmaterialien könnten möglicherweise Nebenprodukte freigesetzt werden, die den Wundheilungsprozess beeinflussen oder chronische Entzündungen hervorrufen können, insbesondere im Zusammenhang mit Diabetiker- oder Altenmodellen, bei denen die Immunantwort verändert sein kann. Daher ist es wichtig, zusätzliche Studien durchzuführen, um zu beurteilen, wie sich Abbauprodukte auf die Wundmikroumgebung und die allgemeine Geweberegeneration auswirken. Wir erkennen an, dass weitere Biokompatibilitätstests, einschließlich Langzeit-In-vivo-Studien , die sich auf Immunantworten und Gerüstabbau konzentrieren, für das Verständnis der Sicherheit und klinischen Relevanz dieses Ansatzes für die chronische Wundheilung unerlässlich sind.
Diese Gerüstkonstruktion ist besonders wichtig in den Bereichen Tissue Engineering und regenerative Medizin. Seine Fähigkeit, Elektrofahrzeuge schnell und kontrolliert zu liefern, macht es wertvoll für Anwendungen wie die chronische Wundheilung, die Knorpelreparatur und andere Geweberegenerationsbemühungen32. Durch die Lösung von Problemen im Zusammenhang mit der Degradation von Gerüsten und der Freisetzung von EVs verspricht die Methode eine Verbesserung der Patientenergebnisse in diesen Bereichen. Darüber hinaus unterstreicht sein Potenzial zur Individualisierung und Anpassung an verschiedene Gewebetypen seine Vielseitigkeit und Relevanz für die Weiterentwicklung der personalisierten Medizin.
Die Verwendung des Akita-Diabetiker-Mausmodells in dieser Studie bietet eine wertvolle Plattform für die Untersuchung der chronischen Wundheilung unter diabetischen Bedingungen. Dieses Modell ahmt wichtige pathophysiologische Merkmale menschlicher diabetischer Wunden nach, einschließlich persistierender Hyperglykämie, verzögerter Angiogenese und beeinträchtigter Gewebereparatur33,34. Darüber hinaus bietet es den Vorteil der genetischen Konsistenz und des spontanen Auftretens von Diabetes, ohne dass eine externe chemische Induktion erforderlich ist, und reduziert somit die Variabilität der experimentellen Ergebnisse33. Es ist jedoch wichtig, die Grenzen dieses Modells zu berücksichtigen, wenn die Befunde auf chronische Wunden beim Menschen übertragen werden. Die Hautarchitektur von Mäusen unterscheidet sich von der menschlichen Haut, insbesondere durch ihre dünnere Epidermis, die lockerere Hautstruktur und die vorherrschende Rolle der Wundkontraktion anstelle der Reepithelisierung während der Heilung35. Darüber hinaus sind die Immunantworten und Entzündungsprofile der Maus nicht vollständig repräsentativ für die beim Menschen beobachteten, was die Interpretation von Immunmodulationstherapien beeinflussen kann36. Trotz dieser Unterschiede bleibt das Akita-Modell ein weithin akzeptiertes und wirksames Instrument für präklinische Studien, da es in der Lage ist, systemische diabetische Komplikationen, die für die Pathogenese chronischer Wunden von zentraler Bedeutung sind, zu rekapitulieren. Um das translationale Potenzial des vorgeschlagenen therapeutischen Ansatzes weiter zu validieren, sind zukünftige Studien gerechtfertigt, um die Ergebnisse des Akita-Modells zu ergänzen. Zusätzliche humanrelevante Systeme, wie z. B. ex vivo menschliche Hautmodelle oder diabetische Großtiermodelle, würden diese sehr unterstützen.
Zusammenfassend lässt sich sagen, dass das vorgeschlagene Gerüstdesign mit kontrollierter Freisetzung von EVs einen bedeutenden Fortschritt bei der Verabreichung von Therapeutika darstellt. Trotz der technischen Komplexität bietet dieser innovative Ansatz deutliche Vorteile gegenüber bestehenden Methoden und birgt ein großes Potenzial zur Verbesserung chronischer Wundauflagen.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Besonderer Dank geht an Said Al-Hashmi und Abdulrahman Almharbi von Happy Production für ihre hervorragende Arbeit bei den Dreharbeiten. Wir danken auch dem Ministerium für Hochschulbildung, Forschung und Innovation und der Universität Nizwa für ihre finanzielle Unterstützung und die Bereitstellung der erforderlichen Ressourcen.
Materialien
| Name | Company | Catalog Number | Comments |
| 23 G Purple precision conical Nozzle | Cellink | KT0000002000 | To provide precise extrusion of bioinks with minimal clogging |
| Alginate lyase (AlgLyase) | Sigma Aldrich | A1603-100MG | Algyase is an enzyme that degrades alginate. |
| Amicon Ultra Centrifugal Filter, 30 kDa MWCO | Merck | UFC9030 | Used to wash PKH-26 labeled-EVs |
| BCA assay Kit | Thermo Scientific | 10678484 | To determine the protein/EVs concentration |
| Bioprinting System | Regemat | V1 | To fabricate core-sheath scaffold |
| Bovine serum albumin (BSA) | sigma-aldrich | 05470-5G | To stop PKH 26 reaction |
| Calcium chloride | Sigma Aldrich | C3306-100G | To crosslink and stabilize bioinks in tissue engineering |
| Centrifuge | Sigma | 2-16P | Used for EVs isolation |
| Centrifuge 5810 R | Eppendorf | 22625101 | Used for cell culture |
| Class II Biological Safety Cabinet | Telstar | Bio II Advance | Cell culture |
| CryoCube F570 Series - ULT Freezer | Eppendorf | F571240035 | To store EVs |
| fluorescent microscope | OLYMPUS | IX73P1F | Used to check the residual PKH-26 in the filtrate |
| Gentamicin (50 mg/mL) | Thermofisher | 15750 | Antibiotic for cell culture media |
| GlutaMAX-I CTS, (100X), liquid | Thermofisher | A12860 | Cell culture media supplement |
| HCl | Sigma Aldrich | 7647-01-0 | Buffer preparation |
| HEPES | Carl Roth | Art. No. 6763.3 | Buffer preparation |
| High viscous carboxymethyl cellulose (CMCh) | BDH | 27929 4T | CMCh is a water-soluble cellulose derivative. |
| Incubator | New Brunswick | NB-170R | Cell culture |
| Invivo imaging | PerkinElmer | IVIS Lumina XRMS Series III | To track EVs release, in vivo |
| Magnet stirer | SalvisLAB | MC35 | For Bioinks preparation |
| miRCURY Exosome Kits for Exosome Isolation | Qiagen | 76743 | Evs isolation |
| NaOh | Daejung | 1310-73-2 | Buffer preparation |
| phosphate buffered saline(PBS) | Thermo Scientific | J61196.AP | Cell culture |
| PKH 26 | MCE | 154214-55-8 | Red fluorescent dye for labeling theEVs |
| Sodium alginate (Alg) | Sigma Aldrich | A0682-100G | Natural polysaccharide derived from brown seaweed. |
| Sodium chloride (NaCl) | Carl Roth | Art-Nr-P029.1 | Buffer preparation |
| StemPro BM Mesenchymal Stem Cells | Thermofisher | A1382901 | Mesenchymal stem cells |
| StemPro MSC SFM XenoFree | Thermofisher | A1067501 | Cell culture media |
| Trypsin 0.25% | Thermofisher | 25050014 | Cell dissociation |
| Vortex-Mixer | Daihan Scientific | VM-10 | Used to mix precipitation buffer with the conditioned media |
Referenzen
- Falanga, V., et al. Chronic wounds. Nat Rev Disease Primers. 8 (1), 50 (2022).
- Tran, H. Q., Shahriar, S. S., Yan, Z., Xie, J. Recent advances in functional wound dressings. Adv Wound Care. 12 (7), 399-427 (2023).
- Shao, M., et al. Emerging trends in therapeutic algorithm of chronic wound healers: Recent advances in drug delivery systems, concepts-to-clinical application and future prospects. Crit Rev Ther Drug Carrier Syst. 34 (5), 385-452 (2017).
- Rezvani Ghomi, E., Khalili, S., Nouri Khorasani, S., Esmaeely Neisiany, R., Ramakrishna, S. Wound dressings: Current advances and future directions. J Appl Poly Sci. 136 (27), 47738 (2019).
- Ding, J. Y., et al. Mesenchymal stem cell-derived extracellular vesicles in skin wound healing: Roles, opportunities and challenges. Military Med Res. 10 (1), 36 (2023).
- Sharma, D., Kumar, A., Mostafavi, E. Extracellular vesicle-based biovectors in chronic wound healing: Biogenesis and delivery approaches. Mol Ther Nucleic Acids. 32, 822-840 (2023).
- Vader, P., Mol, E. A., Pasterkamp, G., Schiffelers, R. M. Extracellular vesicles for drug delivery. Adv Drug Delivery Rev. 106, 148-156 (2016).
- Han, P., Ivanovski, S. 3d bioprinted extracellular vesicles for tissue engineering-a perspective. Biofabrication. 15 (1), 013001 (2022).
- Annabi, N., et al. 25th anniversary article: Rational design and applications of hydrogels in regenerative medicine. Adv Mater. 26 (1), 85-124 (2014).
- Zheng, Y., Pan, C., Xu, P., Liu, K. Hydrogel-mediated extracellular vesicles for enhanced wound healing: The latest progress, and their prospects for 3d bioprinting. J Nanobiotechnol. 22 (1), 57 (2024).
- Keener, A. B. How extracellular vesicles can enhance drug delivery. Nature. 582 (7812), S14-S14 (2020).
- Han, P., et al. 3d bioprinted small extracellular vesicles from periodontal cells enhance mesenchymal stromal cell function. Biomater Adv. 158, 213770 (2024).
- Born, L. J., et al. Sustained released of bioactive mesenchymal stromal cell-derived extracellular vesicles from 3d-printed gelatin methacrylate hydrogels. J Biomed Mater Res A. 110 (6), 1190-1198 (2022).
- Kjar, A., Mcfarland, B., Mecham, K., Harward, N., Huang, Y. Engineering of tissue constructs using coaxial bioprinting. Bioact Mater. 6 (2), 460-471 (2021).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3d bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Deshayes, S., Kasko, A. M. Polymeric biomaterials with engineered degradation. J Poly Sci A Poly Chem. 51 (17), 3531-3566 (2013).
- Xu, Q., et al. Injectable hyperbranched poly (β-amino ester) hydrogels with on-demand degradation profiles to match wound healing processes. Chem Sci. 9 (8), 2179-2187 (2018).
- Vakilian, S., et al. Engineered local delivery of extracellular vesicles loaded with si-tnf-α, via a core-sheath 3d-bio-printed scaffold as an effective wound dressing. J Drug Delivery Sci Technol. 101, 106189 (2024).
- Mirsanei, Z., et al. Synergistic effects of mesenchymal stem cell-derived extracellular vesicles and dexamethasone on macrophage polarization under inflammatory conditions. Inflammopharmacology. 32 (2), 1317-1332 (2024).
- Ma, Y., Brocchini, S., Williams, G. R. Extracellular vesicle-embedded materials. J Controlled Release. 361, 280-296 (2023).
- Jia, Q., Zhao, H., Wang, Y., Cen, Y., Zhang, Z. Mechanisms and applications of adipose-derived stem cell-extracellular vesicles in the inflammation of wound healing. Front Immunol. 14, 1214757 (2023).
- Lou, P., et al. Extracellular vesicle-based therapeutics for the regeneration of chronic wounds: Current knowledge and future perspectives. Acta Biomater. 119, 42-56 (2021).
- Cai, Y., Chen, K., Liu, C., Qu, X. Harnessing strategies for enhancing diabetic wound healing from the perspective of spatial inflammation patterns. Bioactive Mater. 28, 243-254 (2023).
- Li, Z., et al. Multifunctional hydrogel-based engineered extracellular vesicles delivery for complicated wound healing. Theranostics. 14 (11), 4198 (2024).
- Cabral, J., Ryan, A. E., Griffin, M. D., Ritter, T. Extracellular vesicles as modulators of wound healing. Adv Drug Delivery Rev. 129, 394-406 (2018).
- Moghadasi Boroujeni, S., Mashayekhan, S., Vakilian, S., Ardeshirylajimi, A., Soleimani, M. The synergistic effect of surface topography and sustained release of tgf-β1 on myogenic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 104 (7), 1610-1621 (2016).
- Jayaraman, P., et al. Controlled release of drugs in electrosprayed nanoparticles for bone tissue engineering. Adv Drug Delivery Rev. 94, 77-95 (2015).
- Huang, X., Brazel, C. S. On the importance and mechanisms of burst release in matrix-controlled drug delivery systems. J Controlled Release. 73 (2-3), 121-136 (2001).
- Smith, A. M., Senior, J. J. Alginate hydrogels with tuneable properties. Adv Biochem Eng Biotechnol. 178, 37-61 (2021).
- Yan, X., Sha, X. Nanoparticle-mediated strategies for enhanced drug penetration and retention in the airway mucosa. Pharmaceutics. 15 (10), 2457 (2023).
- Pant, B., Park, M., Park, S. -. J. Drug delivery applications of core-sheath nanofibers prepared by coaxial electrospinning: A review. Pharmaceutics. 11 (7), 305 (2019).
- Pinheiro, A., et al. Extracellular vesicles: Intelligent delivery strategies for therapeutic applications. J Controlled Release. 289, 56-69 (2018).
- Yoshioka, M., Kayo, T., Ikeda, T., Koizuni, A. A novel locus, mody4, distal to d7mit189 on chromosome 7 determines early-onset niddm in nonobese c57bl/6 (akita) mutant mice. Diabetes. 46 (5), 887-894 (1997).
- Fang, R. C., et al. Limitations of the db/db mouse in translational wound healing research: Is the noncnzo10 polygenic mouse model superior. Wound Repair Regen. 18 (6), 605-613 (2010).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. J Dermatol Sci. 90 (1), 3-12 (2018).
- Sellers, R. S. Translating mouse models: Immune variation and efficacy testing. Toxicol Pathol. 45 (1), 134-145 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten