Method Article
Impacto glicêmico nos sintomas da osteoartrite do joelho em marcadores físicos, radiográficos e inflamatórios entre indivíduos com 50 anos ou mais com diabetes
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para avaliar o controle glicêmico usando os níveis de glicemia capilar (CBG) e hemoglobina glicada A1C (HbA1C). Este estudo investiga o impacto da hiperglicemia nos sintomas da osteoartrite do joelho (OAJ), desempenho físico, nível de atividade física, gravidade radiográfica e inflamação em idosos com diabetes.
Resumo
Este estudo explora a influência da hiperglicemia nos sintomas relacionados à osteoartrite do joelho (OAJ), desempenho físico, nível de atividade física, gravidade radiográfica e inflamação em adultos mais velhos. Os estados hiperglicêmicos prolongados contribuem para a formação do produto final da glicação avançada (AGE), o que piora os sintomas de OAJ. Os níveis de glicemia capilar (CBG) e hemoglobina glicada A1C (HbA1C) são comumente usados em testes laboratoriais para avaliação glicêmica, oferecendo vantagens e limitações distintas. Os participantes foram divididos em grupos de controle glicêmico bom e ruim com base em seus níveis de CBG e HbA1C. A gravidade clínica da OAJ e a atividade física foram medidas usando o escore de desfecho de lesão e osteoartrite do joelho (KOOS) e o questionário internacional de atividade física. O desempenho físico foi medido com força de preensão manual, velocidade da marcha, tempo de levantar (TUG) e 5 vezes sentar e levantar (5STST). Radiografias do joelho foram realizadas e a análise do ensaio imunoenzimático sérico (ELISA) foi realizada para IL-1β, IL-4, PCR, NF-κB e AGE. Trezentos participantes recrutados (idade média [DP] = 66,40 anos (5,938) com CBG, de glicemia de jejum > 7,0 mmol/L e glicemia aleatória > 11,1 mmol/L, (N = 254) foram comparados com dor KOOS (p=0,008) e sintomas (p=0,017) e 5STST (p=0,015); enquanto HbA1c > 6,3% (N = 93) foi comparado com 5STST (p=0,002), e AGEs (p=0,022) com base no teste U de Mann Whitney. A regressão logística revelou associações significativas entre o controle glicêmico e a força muscular dos membros inferiores, gravidade radiológica, marcadores laboratoriais e entre o estado glicêmico e a dor e sintomas do KOOS. No entanto, essas associações não permaneceram significativas após o ajuste para o IMC. O estado glicêmico ruim por si só foi associado a uma melhor função nos domínios esportivo e recreativo após o ajuste da medicação antidiabética, sugerindo efeitos anti-inflamatórios e analgésicos que mascararam o efeito do açúcar elevado no sangue. Estudos futuros podem explorar a capacidade preditiva da avaliação glicêmica para má função do joelho e desempenho físico, levando em conta os efeitos da medicação.
Introdução
A osteoartrite do joelho (OAJ) aumenta em prevalência com a idade, sendo o joelho uma importante articulação de sustentação de peso1. A OAJ geralmente se manifesta com rigidez e dor crônica na articulação do joelho, o que limita a mobilidade, reduz a qualidade de vida e aumenta o risco de doença cardiovascular2. O diabetes mellitus, que também está relacionado à idade, contribui para o risco de desenvolvimento de OAJ, pois níveis elevados de glicose e lipídios promovem a formação de produto final de glicação avançada (AGE), levando à inflamação crônica das articulações e degeneração da cartilagem3. Apesar da disponibilidade de serviços de saúde, dois em cada cinco malaios com diabetes mellitus desconhecem seu diagnóstico, enquanto 56% dos diagnosticados não conseguiram manter um bom controle do açúcar no sangue4. A hiperglicemia aguda pode levar a um estado hiperosmolar hiperglicêmico, que é fatal, enquanto a hiperglicemia crônica leva à neuropatia periférica, nefropatia, retinopatia e doença cardiovascular5.
A neuropatia periférica, que é uma complicação microvascular resultante do mau controle glicêmico e leva a mecanismos alterados de dor, pode exagerar a dor no joelho na OAJ6. A presença de diabetes em indivíduos com OAJ está associada a uma redução da amplitude de movimento na articulação do joelho, redução da função do joelho, aumento das alterações radiográficas e pior qualidade de vida7. A redução do desempenho físico decorrente dos efeitos do diabetes sobre a OAJ é caracterizada por comprometimento da força muscular e dacoordenação8. A ressonância magnética evidencia alterações degenerativas associadas a danos cartilaginosos e meniscais, como redução do espaço articular e desalinhamento, parece ser mais grave em indivíduos com diabetes9.
O controle glicêmico deficiente está ligado a enzimas degenerativas reguladas positivamente e fatores inflamatórios no líquido sinovial do joelho. Citocinas e proteínas elevadas no diabetes, como IL-1β, IL-4, IL-6, fator nuclear-κB (NF-κB) e fator de necrose tumoral-alfa (TNF-α), estão associadas à fisiopatologia da OAJ10,11. Enquanto nos condrócitos, o transportador de glicose defeituoso leva à glicólise regulada positivamente, vias de poliol, proteínas quinase C e vias de pentose e, eventualmente, alta produção de espécies reativas de oxigênio10.
A glicemia em jejum e a glicemia aleatória fornecem uma estimativa do estado glicêmico atual, bem como da capacidade de manipulação da glicose relacionada à resistência à insulina12. A hemoglobina glicada A (HbA1c) é uma medida do controle glicêmico nos últimos três meses. No entanto, isso não fornece detalhes de flutuações agudas13. A glicemia capilar fornece avaliações imediatas do estado glicêmico à beira do leito ou da clínica, o que tem gerado debates sobre seu valor na determinação do controle glicêmico, bem como na predição do risco de complicações 14,15. Assim, este estudo tem como objetivo elucidar a associação entre o controle glicêmico determinado com HbA1c e a glicemia elevada determinada com glicemia capilar (CBG) com o Knee Injury and Osteoarthritis Outcome Scores (KOOS), desempenho físico, nível de atividade física, gravidade radiográfica e marcadores inflamatórios em indivíduos com OAJ.
Protocolo
O protocolo do estudo estava em conformidade com a Declaração de Helsinque e foi aprovado pelo Comitê de Ética da Universiti Kebangsaan Malaysia (número de referência: JEP-2022-001).
1. Recrutamento de participantes
- Por meio de amostragem de conveniência, selecione a população do estudo entre adultos residentes na comunidade com OAJ com 50 anos ou mais em Kuala Lumpur e Selangor. Recrutou participantes de organizações de idosos e clínicas de diabetes e ortopedia.
NOTA: A presença de OAJ é definida com OAJ auto-relatada por médico diagnosticada ou aqueles em cumprimento aos critérios de exame clínico do American College of Rheumatology (ACR)16. - Exclua idosos institucionalizados ou aqueles que sofrem de comprometimento psicológico grave e diabetes tipo 1.
- Consultando a literatura publicada sobre coortes transversais de ambientes semelhantes, identifique o tamanho do efeito, que neste estudo é a razão ímpar. Calcule o tamanho da amostra, que fornecerá um poder de 80% para rejeitar a hipótese nula, usando G*Power 3.117.
- Explique os objetivos da pesquisa e obtenha o consentimento informado antes da coleta de dados.
2. Recolha de dados - Questionário
- Aplicar questionários, que incluem dados sociodemográficos, KOOS18 e o Questionário Internacional de Atividade Física (IPAQ)19.
- Calcule as pontuações totais para cada um dos cinco domínios KOOS derivados dos 42 itens e transforme as pontuações em uma escala percentual de 0 a 100, com zero representando nenhum problema e 100 indicando problemas extremos para cada domínio.
- Calcule o equivalente metabólico da tarefa (MET) para os domínios do IPAQ multiplicando o tempo gasto em minutos e o número de dias por semana, considerando o padrão de cada domínio.
NOTA: O MET total indicativo dos níveis de atividade física é 3,3 (atividade de caminhada MET), + 4 (atividade de intensidade moderada MET), + 8 (intensidade vigorosa MET).
3. Recolha de dados - Desempenho físico
- Meça a altura com um estadiômetro. Obtenha o peso corporal e o índice de massa corporal (IMC) com um analisador de composição corporal. Certifique-se de que os participantes removam roupas pesadas, acessórios metálicos e sapatos.
- Meça a circunferência da cintura, quadril e panturrilha usando uma fita métrica. Registre a medida em centímetros ao nível do umbigo em repouso para a circunferência da cintura e a medida ao nível da protrusão posterior máxima das nádegas para a circunferência do quadril20. Meça a circunferência da panturrilha na maior dimensão do eixo longo com os participantes sentados com as costas retas e os dois pés no chão21.
- Fornecer instruções aos participantes sobre como realizar os testes de desempenho físico: teste de força de preensão manual (FPM)22, teste timed up and go (TUG)23, teste de caminhada de seis metros24 e teste de cinco vezes sentar para levantar (5STST)25.
- Certifique-se de que a configuração de desempenho esteja livre de obstáculos e perigos. Permita períodos de descanso padronizados de 1 minuto entre os testes26.
- Realize o teste de força de preensão manual.
- Instrua o participante a sentar-se com os ombros aduzidos na posição neutra, com o cotovelo flexionado a 90°.
- Informe-os para não realizar nenhum movimento rápido de torção ou solavanco durante o teste.
- Meça a força máxima com o dinamômetro de punho para cada mão três vezes e selecione a maior medida em kg.
- Execute o teste cronometrado.
- Instrua o participante a sentar-se ereto com as costas em contato com o encosto da cadeira, os braços apoiados nos apoios de braços e os pés apoiados no chão.
- Usando um cronômetro, registre o tempo necessário para se levantar, caminhar 3 m, fazer uma inversão de marcha, voltar para a cadeira e sentar-se novamente. Comece a cronometrar quando as costas do participante perderem o contato com o encosto da cadeira e pare de cronometrar assim que as costas do participante tocarem o encosto da cadeira.
- Repita duas vezes e registre o menor tempo em segundos tomado como resultado final.
- Avalie a velocidade da marcha.
- Meça uma passarela de 10 m e coloque marcadores com fita adesiva a 2 m de cada extremidade da passarela para indicar os pontos em que as medições começarão e terminarão.
- Peça aos participantes que caminhem em seu ritmo normal ao longo de uma passarela de 10 m.
- Inicie o cronômetro assim que o participante cruzar os primeiros 2 m e pare o cronômetro na linha de 8 m.
- Calcule a velocidade da marcha usando a fórmula da velocidade (m/s), onde 6 m é dividido pelo tempo gasto em segundos.
- Realize o teste de sentar e levantar cinco vezes.
- Instrua os participantes a se levantarem e sentarem 5 vezes mais rápido que puderem com equilíbrio.
- Registre o tempo necessário para completar 5 repetições e selecione o menor tempo em segundos das três tentativas.
4. Coleta de dados - Radiografia do Joelho
- Defina uma data e hora para os participantes visitarem o hospital para um exame radiográfico de ambos os joelhos usando a visão de sustentação de peso anteroposterior em pé.
- Envie as imagens radiográficas ao radiologista, que determinará e atribuirá a classificação de Kellgren e Lawrence a cada joelho27.
NOTA: O sistema de classificação tem notas de 0 a 4, com notas mais altas indicando gravidade crescente de OAJ com base nas características: formação de osteófitos, ossículos periarticulares, forma alterada das extremidades ósseas, estreitamento do espaço articular e esclerose subcondral. - Registre a nota atribuída, garantindo que a pontuação seja atribuída ao joelho correto.
5. Coleta de dados - Coleta de sangue capilar para avaliação do estado glicêmico
- Lave as mãos e coloque luvas cirúrgicas. Limpe o dedo do participante com um cotonete embebido em álcool e deixe o dedo secar ao ar.
- Prepare o glicosímetro inserindo a tira de teste.
- Selecione um dispositivo de lanceta e certifique-se de que ele não seja usado e selado.
- Quebre o selo da lanceta e pique o dedo com o novo dispositivo de lanceta, aperte o dedo para produzir uma pequena bolha de sangue e toque a gota de sangue com a tira de teste.
- Use soluções de controle para garantia de qualidade, solte a solução na tira de teste e verifique se está na faixa esperada de acordo com o fabricante.
- Registre o nível de glicose no sangue exibido pelo glicosímetro. Pergunte ao participante quando foi sua última refeição e registre se ela foi tomada mais de 8 h antes do momento da amostragem.
NOTA: O açúcar no sangue em jejum exige que os participantes jejuem por pelo menos 8 h antes deste procedimento, enquanto o açúcar no sangue aleatório não. - Descarte a lanceta com segurança em uma caixa de objetos cortantes e forneça ao participante um cotonete para aplicar pressão na área de punção do dedo para garantir a hemostasia.
- Lave as mãos após o procedimento. Limpe qualquer derramamento de sangue.
6. Coleta de dados - Coleta de sangue venoso para avaliação do controle glicêmico
- Lave as mãos e coloque luvas cirúrgicas.
- Identifique uma veia adequada da fossa antecubital direita ou esquerda. Aplique um torniquete na parte superior do braço do braço selecionado e identifique uma veia adequada por palpação.
- Limpe a pele ao redor da veia selecionada com um cotonete embebido em álcool e deixe secar ao ar.
- Colete amostras de sangue venoso com uma agulha borboleta de 23 G usando dois frascos de tubos de sangue simples de 6 mL. Rotule os tubos com o código de identificação exclusivo do participante.
- Descarte objetos perfurocortantes e resíduos clínicos com segurança e lave as mãos.
- Transporte amostras de sangue para o laboratório em um refrigerador com uma bolsa de gelo. Coloque as amostras de sangue em seus tubos de coleta em uma centrífuga e centrifugue a 604 x g por 10 min.
- Alicote o soro em tubos de microcentrífuga de 1,5 mL com uma micropipeta e rotule os tubos com data, código de identificação e tipo de amostra antes de armazenar a -80 °C.
7. Ensaio ELISA
- Calcule o volume sérico necessário para o ensaio ELISA com base no manual do fabricante. Execute um ensaio de otimização para determinar a concentração ideal; repita para IL-1β, IL-4, PCR, NF-κB e AGEs, respectivamente.
- Descongele o soro e leve os reagentes ELISA à temperatura ambiente (RT). Enquanto isso, rotule os tubos de microcentrífuga para padrões, amostras e blank.
- Prepare soluções de trabalho de acordo com as instruções do fabricante para o diluente, anticorpos de detecção, substrato e tampão de lavagem das soluções de estoque, se necessário.
- Execute diluições seriais duplas para os padrões com o diluente padrão fornecido. Padrão de referência de cada marcador: IL-1β = 500 pg/mL, IL-4 = 2000 pg/mL, PCR = 25 ng/mL, NF-κB = 10 ng/mL, AGEs = 4800 ng/L. O diluente padrão também serve como um branco.
- Dilua a amostra de soro para ensaio otimizado, se necessário.
- Para o ensaio ELISA de IL-1β, IL-4 e NF-κB, use amostras de soro puras. Para PCR, diluir em 1000x com diluente de referência. Pipetar amostras de 100 μL para o poço e duplicar cada uma delas.
- Para o ensaio AGEs ELISA, use uma amostra de soro de diluição 2x, pipete 40 μL de amostra no poço e duplique cada uma.
- Troque as pontas das pipetas entre diferentes amostras ou reagentes. Use uma pipeta multicanal para evitar efeitos de borda.
- Incube de acordo com o tempo e a temperatura sugeridos pelo manual do fabricante e sele a placa com uma nova capa adesiva para cada incubação.
- Para este ELISA sanduíche, incube a amostra e o padrão nos poços pré-revestidos, seguido de anticorpo de detecção, anticorpo secundário conjugado, substrato e, finalmente, solução de parada. Adicione cada solução na mesma ordem anterior.
- Decantar e lavar os poços usando tampão de lavagem entre a incubação de acordo com o manual do fabricante. Bata os poços contra papel absorvente limpo para remover o tampão de lavagem, mas certifique-se de que os poços não sequem antes que a próxima solução seja adicionada.
- Leia os poços com um leitor de microplacas a 450 nm. Registre e calcule usando a curva logística de quatro parâmetros (4PL), um método quantitativo para plotar e determinar a concentração de calibradores sigmoidais simétricos28. Use a média de cada amostra para análise.
8. Análise estatística
NOTA: Analise os dados usando o software de análise de dados apropriado (SPSS versão 20 foi usado aqui). Categorize a população do estudo em dois grupos: 1) bom controle glicêmico, 2) controle glicêmico ruim (estado glicêmico ruim = açúcar no sangue em jejum superior a 7,0 mmol/L ou açúcar no sangue aleatório superior a 11,1 mmol/L; Controle glicêmico ruim = HbA1c maior que 6,3%).
- Abra o software para criar variáveis com base na data, código de identificação dos participantes, variáveis sociodemográficas, itens do questionário e parâmetros medidos.
- Selecione Exibição variável. Insira na coluna Nome, insira a descrição ou o nome de exibição na coluna Rótulo.
- Selecione Tipo > medida. Para variáveis categóricas codificadas, corresponda ao código numérico representativo e seu valor na coluna Valores. Selecione Ok.
- Digite os dados coletados no software em que cada linha representa um participante.
- Selecione Exibição de dados. Digite os códigos numéricos representativos na coluna para o tipo numérico e nomes ou descrições para o tipo de cadeia de caracteres.
- Verifique a normalidade das variáveis contínuas para determinar as suposições do teste paramétrico.
- Selecione Analisar > Estatísticas descritivas > Explorar. Insira variáveis contínuas no campo Lista de dependentes.
- Selecione Plotagens > Plotagens de normalidade com testes > Continuar > OK. Para um tamanho de amostra maior que 50, consulte o valor de p no teste de Kolmogorov-Smirnov; Um valor de p significativo rejeita a hipótese nula em que os dados são normalmente distribuídos.
- Execute o teste U de Mann-Whitney para variáveis não paramétricas para testar diferenças significativas entre os grupos.
- Selecione Analisar > testes não paramétricos > Configurações > Escolher Testes > Personalizar testes > Mann-Whitney U (2 amostras).
- Vá para Campos e insira variáveis contínuas no campo Campos de teste.
- Insira o grupo categórico para CBG ou HbA1c no campo Grupos > Executar.
- Execute um teste qui-quadrado para variáveis categóricas para testar diferenças significativas entre os grupos.
- Selecione Analisar > Estatísticas descritivas > Tabulações cruzadas > Estatísticas > Qui-quadrado > Continuar.
- Selecione Exibição de células. Selecione Observado no campo Contagens e selecione Coluna no campo Porcentagem. Em seguida, selecione Continuar.
- Insira variáveis categóricas no campo Linha(s) e grupo categórico para CBG ou HbA1c no(s) campo(s) Coluna(s) > OK.
- Transforme variáveis dependentes contínuas em grupos binários para se preparar para a regressão logística.
- Selecione Transformar > recodificar em variáveis diferentes e insira variáveis contínuas no campo Variáveis de entrada > Variáveis de saída.
- Insira o novo nome da variável no campo Nome. Insira um novo rótulo no campo Rótulo > Alterar > valores antigos e novos.
- Insira abaixo do valor limite do ponto de corte no campo Intervalo, valor MAIS BAIXO até e emparelhe-o com zero no campo Valor de Novo Valor se isso indicar um bom resultado.
- Selecione Adicionar > insira o ponto de corte no campo Intervalo, valor embora MAIS ALTO e emparelhe-o com um no campo Valor de Novo Valor > Adicionar > Continuar > OK.
- Pontos de corte para variáveis dependentes:
- Domínio KOOS dor < 86,1%, Sintomas < 85,7%, Atividade de vida diária <86,8%, Esporte < 85,0%, Qualidade de vida < 87,5%
- HGS ruim: Masculino < 28 kg, Feminino < 18 kg
- Rebocador ruim > 8,00 s
- Velocidade de marcha ruim < 1,13 ms-1
- Fraco 5TSTS >12,80 s
- Baixa atividade física, IPAQ MET < 3000
- Escala de classificação radiográfica moderada a grave de KOA, Kellgren e Lawrence > 2
- Alta IL-1β > 11,9 pg/mL
- IL-4 alta > 5 pg / mL
- PCR alta > 8 ng/mL
- Alta IDADE > 900 ng/L
- NF-κB alto > 3 ng/mL - Execute a regressão logística múltipla para obter razões de chances. Ajuste o modelo logístico com fatores de confusão com base nas características dos participantes significativos.
- Selecione Analisar > Regressão > Logística Binária. Insira a variável dependente binária no campo Dependente.
- Insira a variável CBG ou HbA1c no campo Covariáveis.
- Selecione Categórica e transfira variáveis categóricas para o campo Covariáveis categóricas. Em seguida, selecione Categoria de referência como Primeira > Alterar > Continuar.
- Selecione Opções > CI para exp(B): 95% > Continuar > OK.
- Repita o procedimento para modelos ajustados, mas adicione fatores de confusão significativos ao campo Covariáveis.
- Apresentar as variáveis como média (desvio padrão) para variáveis contínuas ou mediana (intervalo interquartil) se for utilizado um teste não paramétrico, e número (porcentagem) para variáveis categóricas. Relate as razões de chances (OR) com intervalos de confiança (IC) de 95% e rotule o valor de p abaixo de 0,05 como estatisticamente significativo.
Resultados
Características dos participantes
A Tabela 1 resume as características dos participantes de acordo com o estado glicêmico com FPBS e HbA1c. A Figura 1 ilustra o número total de participantes incluídos em cada estágio com base nos critérios de inclusão das variáveis. Do total de 300 participantes recrutados, a amostragem de glicemia capilar foi obtida de 254 indivíduos para FPBS, enquanto a amostragem de sangue venoso foi obtida de 93 para HbA1c. Das 254 amostras capilares, 45 (17,7%) preencheram os critérios para hiperglicemia. Enquanto das 93 amostras venosas, 42 (45,2%) preencheram os critérios de mau controle glicêmico. A idade média dos participantes foi de 65,98 ± 5,41 anos naqueles em que a FPBS estava disponível e 66,41 ± 6,02 anos para os quais a HbA1c estava disponível. Foram encontradas diferenças significativas na etnia, nível de escolaridade, IMC e doença renal crônica entre os grupos euglicêmico e hiperglicêmico com base no CBG, enquanto apenas o IMC foi significativamente maior naqueles com controle glicêmico ruim em comparação com aqueles com bom controle glicêmico com base na HbA1c (p < 0,05). Além disso, a proporção de participantes que receberam medicação antidiabética contínua foi significativamente diferente entre os dois grupos para CBG (p < 0,001) e HbA1c, respectivamente (p < 0,001) (Tabela 1).
Comparação dos sintomas de osteoartrite do joelho, desempenho físico, nível de atividade física, gravidade radiográfica e inflamação entre os grupos euglicêmico e hiperglicêmico
A Figura 2 apresentou uma matriz de correlação que ilustrou as relações entre as principais variáveis, fornecendo informações sobre possíveis interdependências. A comparação dos escores dos domínios KOOS entre os grupos euglicêmicos e hiperglicêmicos usando Mann Whitney U revelou diferenças nos escores dos domínios dor (p = 0,008) e sintomas (p = 0,017). Também foram observadas diferenças significativas entre o 5STST e o estado glicêmico (p=0,015), bem como o controle glicêmico (p=0,002) (Tabela 2).
Dezoito participantes que consentiram com a amostragem de glicose no sangue capilar tiveram marcadores laboratoriais medidos a partir de amostras de sangue venoso, dos quais apenas dois indivíduos apresentaram hiperglicemia. Conclusões estatísticas não foram, portanto, possíveis. Marcadores laboratoriais estavam disponíveis para um total de 30 indivíduos dos quais a HbA1c foi medida: 18 com controle glicêmico ruim e 12 com bom controle glicêmico. Os grupos de controle glicêmico diferiram significativamente em seus níveis séricos de AGE (p = 0,022) (Tabela 2).
Análises de regressão logística múltipla
Modelos de regressão logística múltipla foram usados para avaliar associações entre o estado glicêmico e o controle glicêmico com a gravidade da OAJ, desempenho físico, atividade física, gravidade radiográfica e marcadores laboratoriais. Para descartar efeitos de confusão, modelos ajustados foram desenvolvidos adicionando covariáveis etnia, nível de escolaridade, presença de doença renal crônica e IMC no modelo de estado glicêmico não ajustado e IMC no modelo de controle glicêmico não ajustado. O Modelo 2 ajustado com um segundo ajuste foi aplicado adicionando medicamentos antidiabéticos em ambas as listas de fatores de confusão.
Dos cinco domínios do KOOS, dor (OR = 3,56, IC 95% = 1,40, 9,09), sintomas (OR = 2,77, IC 95% = 1,21, 6,32) e esporte (OR = 0,27, IC 95% = 0,10, 0,72) foram significativamente associados apenas ao estado glicêmico, mas isso foi anulado após ajuste para potenciais fatores de confusão, exceto o domínio esporte (OR = 0,19, IC 95% = 0,04, 0,85) (Tabela 3). Nenhuma variação significativa na pontuação foi relatada para o domínio AVD entre os grupos do estado glicêmico. Entre os testes de desempenho físico, apenas o 5STST foi significativamente associado ao estado glicêmico (OR = 3,22, IC 95% = 1,62, 6,39); no entanto, a associação não resistiu ao ajuste. Tanto a velocidade da marcha (OR = 2,46, IC 95% = 1,05, 5,78) quanto a 5ª (OR = 3,83, IC 95% = 1,10, 13,35) foram associadas ao controle glicêmico, mas as associações foram atenuadas após o ajuste para o IMC (velocidade da marcha (OR = 2,01, IC 95% = 0,82, 4,88); e 5ª (OR = 3,08, IC 95% = 0,85, 11,13) (Tabela 3).
A regressão logística foi realizada para marcadores laboratoriais apenas pelo controle glicêmico. A associação bruta entre AGE e controle glicêmico (OR = 0,19, IC 95% = 0,04, 0,94) perdeu significância após o ajuste do IMC (OR = 0,20, IC 95% = 0,04, 1,09) (Tabela 3). Da mesma forma, a evidência radiográfica de OAJ foi significativamente associada ao controle glicêmico antes do ajuste para o IMC (OR = 4,12, IC 95% = 1,33, 12,78). O nível de atividade física não relatou associação significativa entre o estado glicêmico e o controle glicêmico (Tabela 3).
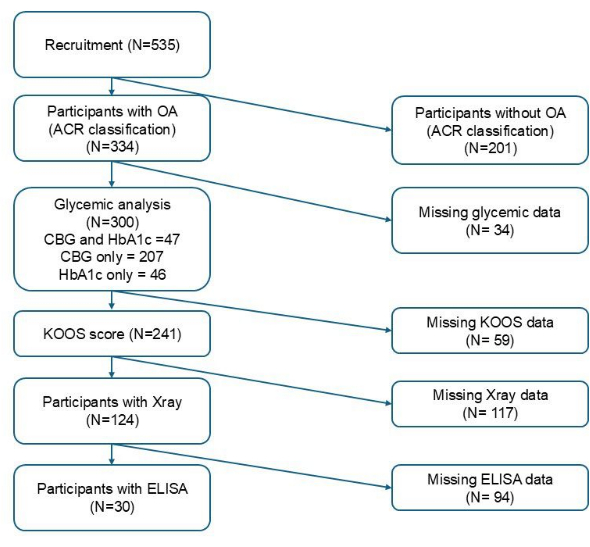
Figura 1: Fluxograma do recrutamento de participantes. Clique aqui para ver uma versão maior desta figura.
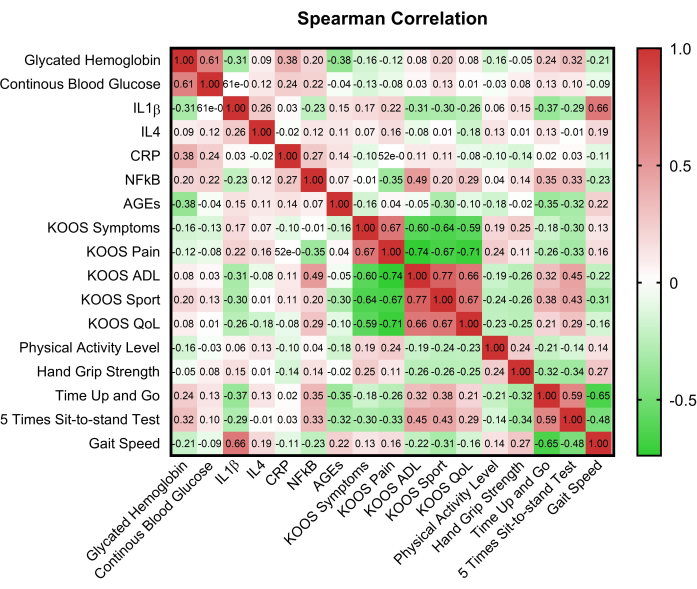
Figura 2: Matriz de correlação das variáveis-chave. HbA1c: hemoglobina glicada A1C; CBG: Glicemia capilar; KOOS: Lesão no joelho e pontuação de resultado de osteoartrite; AVD: Atividades de vida diária; QV: Qualidade de vida; PCR: proteína C reativa; AGEs: produtos finais de glicação avançada; IL-1β: Interleucina-1β; IL-4: Interleucina-4; NF-κB: fator nuclear-κB. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Características dos participantes. Os valores de p foram obtidos com o teste U de Mann-Whitney para as variáveis contínuas da tabela, e as variáveis categóricas foram analisadas com o Qui-quadrado entre os grupos. O asterisco '*' indica significância no valor de α < 0,05. Abreviaturas: CBG: Glicemia capilar; HbA1c: hemoglobina glicada A1C; IIQ: Intervalo interquartil; N: Número de casos. Clique aqui para baixar esta tabela.
Tabela 2: Comparação dos sintomas de osteoartrite do joelho, desempenho físico, nível de atividade física, gravidade radiográfica e inflamação entre os grupos euglicêmico e hiperglicêmico. Os valores de p foram obtidos com o teste U de Mann-Whitney para as variáveis da tabela. O asterisco '*' indica significância no valor de α < 0,05. Abreviaturas: IIQ: Intervalo interquartil; N: Número de casos; HbA1c: hemoglobina glicada A1C; KOOS: Lesão no joelho e pontuação de resultado de osteoartrite; AVD: Atividades de vida diária; QV: Qualidade de vida; IPAQ: Questionários Internacionais de Atividade Física; MET: Tarefa Equivalente Metabólico; FPM: Força de preensão manual; TUG: Cronometrado-para-e-ir; 5TSTS: Cinco vezes sentar para levantar; ELISA: Ensaio de imunoadsorção enzimática; PCR: proteína C reativa; AGEs: produtos finais de glicação avançada; IL-1β: Interleucina-1β; IL-4: Interleucina-4; NF-κB: fator nuclear-κB. Clique aqui para baixar esta tabela.
Tabela 3: Análises de regressão logística múltipla de acordo com o estado glicêmico e controle. Modelo 1 ajustado: Glicemia capilar ajustada para etnia, nível de escolaridade, doença renal crônica e índice de massa corporal, HbA1c ajustada para índice de massa corporal. Modelo 2 ajustado: Modelo 1 ajustado com medicação antidiabética adicionada ao ajuste de fatores de confusão. A glicemia capilar e a HbA1c foram testadas como variáveis independentes em cada parâmetro. O asterisco '*' indica significância no valor de α < 0,05. Abreviaturas: IPAQ: Questionários Internacionais de Atividade Física; MET: Tarefa Equivalente Metabólico; ELISA: Ensaio de imunoadsorção enzimática; PCR: proteína C reativa; AGEs: produtos finais de glicação avançada; IL-1β: Interleucina-1β; IL-4: Interleucina-4; NF-κB: fator nuclear-κB; UTC: Não é possível calcular. Clique aqui para baixar esta tabela.
Discussão
A coleta de sangue venoso é frequentemente preferida para exames laboratoriais em relação à coleta de sangue capilar em termos de acurácia dos resultados29. A HbA1c está fortemente associada a complicações do diabetes, natureza química estável e testes laboratoriais bem padronizados. Como a HbA1c reflete o controle glicêmico ao longo de 3 meses, ela não requer amostras de jejum, enquanto a amostragem única de sangue capilar pode refletir o estado glicêmico de um ponto, que é influenciado pelo horário e pelo conteúdo das refeições recentes. Ambas as avaliações glicêmicas, no entanto, têm seus prós e contras. Os resultados da glicemia capilar são influenciados pela microcirculação prejudicada, hipotensão, desidratação grave, edema e cetoacidose diabética, e pela função do glicosímetro comercial e das tiras de teste utilizadas30. No entanto, a amostragem de sangue capilar pode fornecer resultados imediatos, oferecer maior acessibilidade e capturar o estado glicêmico agudo; Isso atende a diferentes necessidades de pesquisa e potencialmente aumenta a capacidade de pesquisa em ambientes de poucos recursos.
Neste estudo, a associação entre força de membros inferiores, gravidade radiológica e marcadores laboratoriais com controle glicêmico foi confundida pelo IMC, que é um marcador de obesidade. Da mesma forma, a associação entre o estado glicêmico com dor e sintomas de KOOS foi parcialmente atribuída ao efeito de confusão do IMC, enquanto a associação com a força dos membros inferiores foi mediada por medicamentos antidiabéticos. Os medicamentos antidiabéticos também foram encontrados anteriormente para afetar tanto a massa muscular quanto a força muscular31,32. Por outro lado, o estado glicêmico ruim em indivíduos com OAJ foi independentemente associado a uma melhor função em esportes e recreação. A significância recuperada no domínio da função esportiva e recreativa KOOS após o ajuste para o fator de confusão de medicamentos antidiabéticos sugere que o tratamento pode ter mascarado a influência do estado glicêmico nas avaliações subjetivas dos participantes sobre sua agilidade e função. Isso está de acordo com a melhora do escore KOOS após a administração de metformina, meloxicam e pioglitazona em um ensaio clínico33. No entanto, ao contrário da HbA1c, o estado glicêmico pode refletir picos de glicose de curto prazo, que são menos propensos a afetar negativamente a limitação funcional, levando a pontuações mais altas em suas respostas.
Um estudo anterior também descobriu que as pontuações do domínio KOOS foram negativamente correlacionadas com o controle glicêmico7. Da mesma forma, a HbA1c prediz significativamente os escores do domínio de dor KOOS em indivíduos submetidos à artroplastia total do joelho. No entanto, a presença de dor insuportável naqueles que optaram pela artroplastia total do joelho também deve ser levada em consideração34,35. As medidas instantâneas da glicemia capilar podem não estar associadas aos escores do KOOS, pois refletem o estado glicêmico em um determinado momento e não levam em consideração o controle glicêmico durante um período de tempo36. No entanto, a associação entre hiperglicemia com escolaridade, etnia, doença renal crônica e IMC sugere que o teste aleatório de glicemia capilar reflete o controle glicêmico, pois esses são fatores de risco estabelecidos para o mau controle glicêmico. Além disso, o conhecimento do automanejo do joelho, estilo de vida e ingestão alimentar influenciados pela etnia também podem afetar a dor e os sintomas da OAJ 37,38,39. A doença renal crônica em indivíduos com diabetes geralmente é um indicador da presença de doença microvascular, que é uma complicação a longo prazo do mau controle glicêmico40,41. O aumento do IMC leva ao aumento da carga mecânica na articulação do joelho, além de sua associação bem estabelecida com a resistência à insulina e, portanto, um papel importante no controle glicêmico42. O efeito de confusão do IMC na relação entre o controle glicêmico e a gravidade radiológica da OAJ pode ser um reflexo da relação entre obesidade e resistência à insulina, bem como da carga mecânica induzida pelo peso na articulação do joelho43. Um estudo anterior sugeriu que o tratamento com insulina leva à proteção contra a formação de osteófitos, sugerindo que um melhor controle glicêmico pode levar à redução das alterações estruturais da OAJ44. Olhando para os marcadores ELISA, a modificação não enzimática do colágeno, que forma o AGE, é irreversível e reflete hiperglicemia cumulativa45; Isso potencialmente explicará a relação entre o controle glicêmico e o estado não glicêmico neste estudo46. A associação diminuída após o ajuste do IMC também foi encontrada em outros estudos47.
Existem algumas etapas críticas descritas nos protocolos, como aquelas durante a administração do questionário e a explicação das etapas. Os pesquisadores devem estar atentos à compreensão dos participantes de adultos mais velhos devido ao potencial declínio da função cognitiva; As instruções dadas devem ser claras e em termos leigos para evitar confusão. Durante a amostragem de sangue, os participantes devem ser informados sobre o risco de complicações e obter consentimento antes do procedimento, pois é invasivo. Após a centrifugação do sangue, as amostras de soro devem ser aliquotadas em vários tubos de microcentrífuga antes do congelamento para evitar a repetição de processos de congelamento e descongelamento que causarão degradação de proteínas e perda de sinal no ensaio ELISA48. O procedimento passo a passo do ELISA varia entre os fabricantes, é importante ler o manual completamente e otimizar o tempo de incubação, diluição e temperatura de acordo com a amostra do estudo48.
As limitações deste estudo incluem a presença de fatores de confusão não mensurados, como hábitos alimentares e predisposições genéticas. Além disso, a coleta de amostras foi restrita às áreas de Kuala Lumpur e Selangor, que podem não capturar variações entre diferentes populações para considerar o impacto do estilo de vida e do acesso aos cuidados de saúde no estado glicêmico ou controle. Além disso, o KOOS, como um questionário retrospectivo auto-relatado, é inerentemente subjetivo; Avaliações futuras dos sintomas e funcionalidade do joelho podem incorporar avaliação biomecânica para mitigar possíveis vieses. Para uma melhor reflexão sobre o desempenho físico dos participantes com OAJ com diabetes, medidas repetidas podem ser obtidas em futuras metodologias de estudo. Em termos de mediadores inflamatórios, este estudo mediu apenas cinco biomarcadores, mas um perfil mais extenso poderia mapear melhor o mecanismo subjacente. Um pequeno tamanho de amostra também pode ser uma das preocupações. A falta de dados de glicemia capilar da população total da amostra foi devido ao esgotamento das tiras de teste durante a coleta de dados no local da comunidade e à relutância por parte do participante em comparecer a uma segunda visita. A coleta de sangue venoso para o teste de HbA1c, por outro lado, foi realizada durante a segunda visita ao hospital ao mesmo tempo que a radiografia do joelho, o que exigiu comprometimento adicional dos participantes. O tamanho da amostra foi calculado com base no poder de 80% para obter a razão de chances (OR = 2,010, IC 95% 1,003, 4,026), que foi identificada a partir da literatura publicada e resultou em um tamanho amostral estimado de72,49. Neste estudo, agrupamos o açúcar no sangue em jejum e o açúcar no sangue aleatório em uma variável, a saber, CBG; no entanto, os achados sugeriram sensibilidade reduzida, na qual a vantagem da medida individual poderia ser mascarada por outra. Portanto, é preferível analisar as associações do estado glicêmico com os parâmetros por meio da glicemia de jejum e da glicemia aleatória, respectivamente. Estudos futuros devem agora avaliar as tendências glicêmicas de longo prazo para determinar o efeito da hiperglicemia crônica na OAJ.
Os protocolos envolvidos neste estudo podem ser modificados para estudo longitudinal ou ensaio clínico randomizado para coleta de dados por meio de questionários, testes físicos, medidas de glicemia e ensaio ELISA. Os métodos de avaliação glicêmica, amostragem de sangue capilar e coleta de sangue venoso devem ser selecionados com base nos parâmetros investigados e na natureza do estudo. Tendo o diabetes mellitus como fator de risco para doença cardiovascular, retinopatia, neuropatia periférica e doença renal diabética, os métodos de avaliação glicêmica são inegavelmente essenciais para serem adotados na metodologia de pesquisa 5,50. Além disso, melhorias no controle do diabetes e aumento da expectativa de vida prepararam o terreno para complicações emergentes do diabetes, como câncer, doença hepática e incapacidade funcional e cognitiva51. Estes são antecipados em futuras tendências de pesquisa.
Divulgações
Todos os autores não têm conflito de interesses a declarar.
Agradecimentos
Este estudo foi financiado pelo Esquema de Bolsas de Pesquisa Fundamental, Ministério do Ensino Superior, Malásia, Número do Prêmio: FRGS/1/2021/SKK0/UKM/02/15.
Materiais
| Name | Company | Catalog Number | Comments |
| Butterfly needle | BD Vacutainer | 367282 | |
| G*Power 3.1 | Heinrich-Heine-University | https://www.psychologie.hhu.de/arbeitsgruppen/allgemeine-psychologie-und-arbeitspsychologie/gpower | Heinrich-Heine-University, Düsseldorf |
| Glucometer and test strips | Contour plus | https://www.diabetes.ascensia.my/en/products/contour-plus/ | Basel, Switzerland |
| Human CRP(C-Reactive Protein) ELISA Kit | Elabscience | E-EL-H0043-96T | ELISA kit |
| Human IL-1β(Interleukin 1 Beta) ELISA Kit | Elabscience | E-EL-H0149-96T | ELISA kit |
| Human IL-4(Interleukin 4) ELISA Kit | Elabscience | E-EL-H0101-96T | ELISA kit |
| Human NF-κB-p105 subunit | Bioassay Technology Laboratory | E0003Hu | ELISA kit |
| Human NF-κBp105(Nuclear factor NF-kappa-B p105 subunit) | Elabscience | E-EL-H1386-96T | ELISA kit |
| Manual hand dynamometer | Jamar | 5030J1 | Warrenville, Illinois, USA |
| Portable Body Composition Analyzer | InBody ASIA | https://inbodyasia.com/products/inbody-270/ | Inbody 270, Cheonan, Chungcheongnam-do |
| Portable stadiometer | Seca | 213 1821 009 | SECA 213, Hamburg, Germany |
Referências
- Allen, K. D., Thoma, L. M., Golightly, Y. M. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 30 (2), 184-195 (2022).
- Mat, S., et al. Factors influencing quality of life among older persons living with osteoarthritis using 3 different definitions. Top Geriatr Rehabil. 38 (1), 26-34 (2022).
- Berenbaum, F. Diabetes-induced osteoarthritis: From a new paradigm to a new phenotype. Ann Rheum Dis. 70 (8), 1354 (2011).
- Institute for Public Health. . National health and morbidity survey (NHMS) 2023: Non-communicable diseases and healthcare demand - key findings. , (2024).
- Harding, J. L., Pavkov, M. E., Magliano, D. J., Shaw, J. E., Gregg, E. W. Global trends in diabetes complications: A review of current evidence. Diabetologia. 62 (1), 3-16 (2019).
- Eitner, A., Culvenor, A. G., Wirth, W., Schaible, H. -. G., Eckstein, F. Impact of diabetes mellitus on knee osteoarthritis pain and physical and mental status: Data from the osteoarthritis initiative. Arthritis Care Res (Hoboken). 73 (4), 540-548 (2021).
- Aykan, S. A., Kaymaz, S. The association between diabetes mellitus and functionality in knee osteoarthritis: A cross-sectional study. J Health Sci Med. 5 (4), 1114-1118 (2022).
- Alenazi, A. M., Alqahtani, B. A. Diabetes is associated with longitudinal declined physical performance measures in persons with or at risk of knee osteoarthritis: Data from the osteoarthritis initiative. Eur J Phys Rehabil Med. 60 (3), 496-504 (2024).
- Neumann, J., et al. Diabetics show accelerated progression of knee cartilage and meniscal lesions: Data from the osteoarthritis initiative. Skeletal Radiol. 48 (6), 919-930 (2019).
- Courties, A., Gualillo, O., Berenbaum, F., Sellam, J. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthritis Cartilage. 23 (11), 1955-1965 (2015).
- Wei, G., et al. Risk of metabolic abnormalities in osteoarthritis: A new perspective to understand its pathological mechanisms. Bone Res. 11 (1), 63 (2023).
- Sriwimol, W., Choosongsang, P., Choosongsang, P., Petkliang, W., Treerut, P. Associations between hba1c-derived estimated average glucose and fasting plasma glucose in patients with normal and abnormal hemoglobin patterns. Scand J Clin Lab Invest. 82 (3), 192-198 (2022).
- Papachristoforou, E., Lambadiari, V., Maratou, E., Makrilakis, K. Association of glycemic indices (hyperglycemia, glucose variability, and hypoglycemia) with oxidative stress and diabetic complications. J Diabetes Res. 2020 (1), 7489795 (2020).
- Matsushita, Y., et al. A comparison of the association of fasting plasma glucose and hba1c levels with diabetic retinopathy in japanese men. J Diabetes Res. 2020 (1), 3214676 (2020).
- Baig, M. A. Comparative evaluation of efficiency of hba1c, fasting & post prandial blood glucose levels, in the diagnosis of type-2 diabetes mellitus and its prognostic outcome. Int J Res Med Sci. 3 (11), 3245-3249 (2015).
- Altman, R., et al. Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthritis Rheum. 29 (8), 1039-1049 (1986).
- Kang, H. Sample size determination and power analysis using the G* power software. J Educ Eval Health Prof. 18, (2021).
- Roos, E. M., Lohmander, L. S. The knee injury and osteoarthritis outcome score (koos): From joint injury to osteoarthritis. Health Qual Life Outcomes. 1, 64 (2003).
- Ipaq Research Committee. . Guidelines for data processing and analysis of the international physical activity questionnaire (IPAQ)-short and long forms. , (2005).
- Perissinotto, E., Pisent, C., Sergi, G., Grigoletto, F., Enzi, G. Anthropometric measurements in the elderly: Age and gender differences. Br J Nutr. 87 (2), 177-186 (2002).
- Sun, Y. -. S., et al. Calf circumference as a novel tool for risk of disability of the elderly population. Sci Rep. 7 (1), 16359 (2017).
- Chen, L. -. K., et al. Asian working group for sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment. J Am Med Dir Assoc. 21 (3), 300-307 (2020).
- Samah, Z. A., et al. Discriminative and predictive ability of physical performance measures in identifying fall risk among older adults. Sains Malays. 47 (11), 2769-2776 (2018).
- Bohannon, R. W., Williams Andrews, A. Normal walking speed: A descriptive meta-analysis. Physiotherapy. 97 (3), 182-189 (2011).
- Kim, M., Won, C. W. Cut points of chair stand test for poor physical function and its association with adverse health outcomes in community-dwelling older adults: A cross-sectional and longitudinal study. J Am Med Dir Assoc. 23 (8), 1375-1382.e3 (2022).
- Parcell, A. C., Sawyer, R. D., Tricoli, V. A., Chinevere, T. D. Minimum rest period for strength recovery during a common isokinetic testing protocol. Med Sci Sports Exerc. 34 (6), (2002).
- Kohn, M. D., Sassoon, A. A., Fernando, N. D. Classifications in brief: Kellgren-lawrence classification of osteoarthritis. Clin Orthop Relat Res. 474 (8), 1886-1893 (2016).
- Gottschalk, P. G., Dunn, J. R. Measuring parallelism, linearity, and relative potency in bioassay and immunoassay data. J Biopharm Stat. 15 (3), 437-463 (2005).
- Das, S., Swain, M., Pradhan, R. Evaluating the relationship of fasting capillary and venous blood sugar level in self-glucose monitoring device, fasting plasma glucose level and glycosylated hemoglobin (HbA1c). Nurs Care Open Access J. 1 (2), 00011 (2016).
- Bao, Y., Zhu, D. Clinical application guidelines for blood glucose monitoring in china (2022 edition). Diabetes Metab Res Rev. 38 (8), e3581 (2022).
- Wu, C. -. N., Tien, K. -. J. The impact of antidiabetic agents on sarcopenia in type 2 diabetes: A literature review. J Diabetes Res. 2020 (1), 9368583 (2020).
- Kalaitzoglou, E., Fowlkes, J. L., Popescu, I., Thrailkill, K. M. Diabetes pharmacotherapy and effects on the musculoskeletal system. Diabetes Metab Res Rev. 35 (2), e3100 (2019).
- Mohammed, M. M., Al-Shamma, K. J., Jassim, N. A. Evaluation of the clinical use of metformin or pioglitazone in combination with meloxicam in patients with knee osteoarthritis; using knee injury and osteoarthritis outcome score. Iraqi J Pharm Sci. 23 (2), 13-23 (2014).
- Vervullens, S., et al. Preoperative glycaemic control, number of pain locations, structural knee damage, self-reported central sensitisation, satisfaction and personal control are predictive of 1-year postoperative pain, and change in pain from pre- to 1-year posttotal knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. , (2024).
- Eitner, A., et al. Pain sensation in human osteoarthritic knee joints is strongly enhanced by diabetes mellitus. Pain. 158 (9), 1743-1753 (2017).
- Li, H., George, D. M., Jaarsma, R. L., Mao, X. Metabolic syndrome and components exacerbate osteoarthritis symptoms of pain, depression and reduced knee function. Ann Transl Med. 4 (7), 133 (2016).
- Khachian, A., Seyedoshohadaei, M., Haghani, H., Amiri, F. Effect of self-management program on outcome of adult knee osteoarthritis. Int J Orthop Trauma Nurs. 39, 100797 (2020).
- Mat, S., et al. Ethnic differences in the prevalence, socioeconomic and health related risk factors of knee pain and osteoarthritis symptoms in older malaysians. PLoS One. 14 (11), e0225075 (2019).
- Cruz-Almeida, Y., et al. Racial and ethnic differences in older adults with knee osteoarthritis. Arthritis Rheumatol. 66 (7), 1800-1810 (2014).
- Kalantar-Zadeh, K., et al. Patient-centred approaches for the management of unpleasant symptoms in kidney disease. Nat Rev Nephrol. 18 (3), 185-198 (2022).
- Hsu, H. -. J., et al. Factors associated with chronic musculoskeletal pain in patients with chronic kidney disease. BMC Nephrol. 15 (1), 6 (2014).
- Larsen, P., Engberg, A. S., Motahar, I., Ostgaard, S. E., Elsoe, R. Obesity influences the knee injury and osteoarthritis outcome score. Joints. 7 (01), 008-012 (2019).
- Solanki, P., et al. Association between weight gain and knee osteoarthritis: A systematic review. Osteoarthritis Cartilage. 31 (3), 300-316 (2023).
- Al-Jarallah, K., Shehab, D., Abdella, N., Al Mohamedy, H., Abraham, M. Knee osteoarthritis in type 2 diabetes mellitus: Does insulin therapy retard osteophyte formation. Med Princ Pract. 25 (1), 12-17 (2016).
- Suzuki, A., Yabu, A., Nakamura, H. Advanced glycation end products in musculoskeletal system and disorders. Methods. 203, 179-186 (2022).
- Wang, M., Hng, T. M. Hba1c: More than just a number. Aust J Gen Pract. 50 (9), 628-632 (2021).
- Kalousova, M., Skrha, J., Zima, T. Advanced glycation end-products and advanced oxidation protein products in patients with diabetes mellitus. Physiol Res. 51 (6), 597-604 (2002).
- Shah, K., Maghsoudlou, P. Enzyme-linked immunosorbent assay (elisa): The basics. Br J Hosp Med. 77 (7), C98-C101 (2016).
- Nakanishi, S., et al. The impact of hand strength on hba1c, body mass index and body composition by group according to sedentary behaviour: Cross-sectional study in japanese patients with type 2 diabetes mellitus. Malays J Med Sci. 31 (3), 185-193 (2024).
- Joseph, J. J., et al. Comprehensive management of cardiovascular risk factors for adults with type 2 diabetes: A scientific statement from the american heart association. Circulation. 145 (9), e722-e759 (2022).
- Tomic, D., Shaw, J. E., Magliano, D. J. The burden and risks of emerging complications of diabetes mellitus. Nat Rev Endocrinol. 18 (9), 525-539 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados