Method Article
Impact glycémique sur les symptômes de l’arthrose du genou sur les marqueurs physiques, radiographiques et inflammatoires chez les personnes âgées de 50 ans et plus atteintes de diabète
Dans cet article
Résumé
Ici, nous présentons un protocole pour évaluer le contrôle glycémique à l’aide de la glycémie capillaire (CBG) et des taux d’hémoglobine glyquée A1C (HbA1C). Cette étude examine l’impact de l’hyperglycémie sur les symptômes de l’arthrose du genou, la performance physique, le niveau d’activité physique, la gravité radiographique et l’inflammation chez les personnes âgées atteintes de diabète.
Résumé
Cette étude explore l’influence de l’hyperglycémie sur les symptômes liés à l’arthrose du genou (KOA), la performance physique, le niveau d’activité physique, la gravité radiographique et l’inflammation chez les personnes âgées. Les états hyperglycémiques prolongés contribuent à la formation d’un produit final de glycation avancée (AGE), ce qui aggrave les symptômes de KOA. Les taux de glucose dans le sang capillaire (CBG) et d’hémoglobine glyquée A1C (HbA1C) sont couramment utilisés dans les tests de laboratoire pour l’évaluation glycémique, offrant des avantages et des limites distincts. Les participants ont été divisés en groupes de contrôle de la glycémie bonne et mauvaise en fonction de leurs taux de CBG et d’HbA1C. La gravité clinique de l’arthrose et l’activité physique ont été mesurées à l’aide du score KOOS (Knee Injury and Osteoarthritis Outcome Score) et du questionnaire international sur l’activité physique. La performance physique a été mesurée avec la force de préhension, la vitesse de marche, le temps de montée et de sortie (TUG) et 5 fois la position assise-debout (5STST). Des radiographies du genou ont été effectuées et une analyse ELISA (sérum enzyme linked immunosorbent test) a été effectuée pour l’IL-1β, l’IL-4, la CRP, le NF-κB et l’AGE. Trois cents participants recrutés (âge moyen [ET] = 66,40 ans (5,938) avec CBG, glycémie à jeun > 7,0 mmol/L et glycémie aléatoire > 11,1 mmol/L (N = 254) ont été comparés à la douleur (p = 0,008) et aux symptômes (p = 0,017) et au 5STST (p = 0,015) ; tandis que l’HbA1c > 6,3 % (N = 93) a été comparée au 5STST (p = 0,002), et AGE (p = 0,022) basé sur le test U de Mann Whitney. La régression logistique a révélé des associations significatives entre le contrôle glycémique et la force musculaire des membres inférieurs, la gravité radiologique, les marqueurs de laboratoire, et entre l’état glycémique et la douleur et les symptômes KOOS. Cependant, ces associations ne sont pas demeurées significatives après ajustement pour l’IMC. Un mauvais état glycémique à lui seul était associé à une meilleure fonction dans les domaines du sport et des loisirs après l’ajustement des médicaments antidiabétiques, suggérant des effets anti-inflammatoires et analgésiques qui masquaient l’effet de l’hyperglycémie. Des études futures pourraient explorer la capacité prédictive de l’évaluation de la glycémie pour une mauvaise fonction du genou et des performances physiques tout en tenant compte des effets du médicament.
Introduction
La prévalence de l’arthrose du genou augmente avec l’âge, le genou étant une articulation portante majeure1. L’AOC se manifeste généralement par une raideur et une douleur chronique au niveau de l’articulation du genou, ce qui limite la mobilité, réduit la qualité de vie et augmente le risque de maladie cardiovasculaire2. Le diabète sucré, qui est également lié à l’âge, contribue au risque de développement de KOA, car des niveaux élevés de glucose et de lipides favorisent la formation de produits finaux de glycation avancée (AGE), entraînant une inflammation articulaire chronique et une dégénérescence du cartilage3. Malgré la disponibilité des services de santé, deux Malaisiens sur cinq atteints de diabète sucré ne sont pas au courant de leur diagnostic, tandis que 56 % des personnes diagnostiquées n’ont pas réussi à maintenir un bon contrôle de la glycémie4. L’hyperglycémie aiguë peut entraîner un état hyperosmolaire hyperglycémique, qui met la vie en danger, tandis que l’hyperglycémie chronique entraîne une neuropathie périphérique, une néphropathie, une rétinopathie et une maladie cardiovasculaire5.
La neuropathie périphérique, qui est une complication microvasculaire résultant d’un mauvais contrôle de la glycémie et entraîne une altération des mécanismes de la douleur, peut exagérer la douleur au genou dans le KOA6. La présence de diabète chez les personnes atteintes de KOA est associée à une réduction de l’amplitude de mouvement de l’articulation du genou, à une réduction de la fonction du genou, à une augmentation des modifications radiographiques et à une moins bonne qualité de vie7. La réduction des performances physiques résultant des effets du diabète sur le KOA se caractérise par une diminution de la force musculaire et de la coordination8. L’imagerie par résonance magnétique met en évidence des changements dégénératifs associés à des lésions cartilagineuses et méniscales, telles que la réduction de l’espace articulaire et le désalignement, semble être plus grave chez les personnes atteintes de diabète9.
Un mauvais contrôle glycémique est lié à des enzymes dégénératives régulées à la hausse et à des facteurs inflammatoires dans le liquide synovial du genou. Des cytokines et des protéines élevées dans le diabète, telles que l’IL-1β, l’IL-4, l’IL-6, le facteur nucléaire-κB (NF-κB) et le facteur de nécrose tumorale-alpha (TNF-α), sont associées à la physiopathologie de KOA10,11. Alors que dans les chondrocytes, un transporteur de glucose défectueux conduit à une glycolyse régulée à la hausse, aux voies des polyols, aux voies de la protéine kinase C et de la pentose, et finalement à une production élevée d’espèces réactives de l’oxygène10.
La glycémie à jeun et la glycémie aléatoire fournissent une estimation de l’état glycémique actuel ainsi que de la capacité de gestion du glucose liée à la résistance à l’insuline12. L’hémoglobine A glyquée (HbA1c) est une mesure du contrôle glycémique au cours des trois derniers mois. Cela ne fournit toutefois pas de détails sur les fluctuations aiguës13. Le test de glycémie capillaire fournit des évaluations immédiates de l’état glycémique au chevet du patient ou à la clinique, ce qui a conduit à des débats sur leur valeur dans la détermination du contrôle glycémique ainsi que dans la prédiction du risque de complications14,15. Ainsi, cette étude vise à élucider l’association entre le contrôle glycémique déterminé par HbA1c et l’élévation de la glycémie déterminée par la glycémie capillaire (CBG) avec les scores de résultats des lésions du genou et de l’arthrose (KOOS), la performance physique, le niveau d’activité physique, la sévérité radiographique et les marqueurs inflammatoires chez les personnes atteintes de KOA.
Protocole
Le protocole de l’étude était conforme à la Déclaration d’Helsinki et a été approuvé par le comité d’éthique de l’Universiti Kebangsaan Malaysia (numéro de référence : JEP-2022-001).
1. Recrutement des participants
- Par échantillonnage de commodité, sélectionnez la population étudiée parmi les adultes de 50 ans et plus atteints de KOA vivant dans la communauté à Kuala Lumpur et à Selangor. Recrutement de participants dans des organisations de personnes âgées et des cliniques de diabète et d’orthopédie.
REMARQUE : La présence d’un KOA est définie par rapport aux KOA auto-déclarés diagnostiqués par un médecin ou ceux qui répondent aux critères d’examen clinique de l’American College of Rheumatology (ACR)16. - Exclure les personnes âgées institutionnalisées ou celles qui souffrent de troubles psychologiques majeurs et de diabète de type 1.
- En se référant à la littérature publiée sur des cohortes transversales provenant de milieux similaires, identifiez l’ampleur de l’effet, qui dans cette étude est le rapport de cotes impair. Calculez la taille de l’échantillon, qui fournira une puissance de 80 % pour rejeter l’hypothèse nulle, en utilisant G*Power 3.117.
- Expliquer les objectifs de la recherche et obtenir un consentement éclairé avant la collecte des données.
2. Collecte de données - Questionnaire
- Administrer des questionnaires, qui comprennent des questionnaires sociodémographiques, KOOS18 et le Questionnaire international sur l’activité physique (IPAQ)19.
- Calculez les scores totaux pour chacun des cinq domaines KOOS dérivés des 42 éléments et transformez les scores en une échelle de 0 à 100 pour cent, zéro représentant aucun problème et 100 indiquant des problèmes extrêmes pour chaque domaine.
- Calculez l’équivalent métabolique de la tâche (MET) pour les domaines IPAQ en multipliant le temps pris en minutes et le nombre de jours par semaine, en tenant compte de la norme de chaque domaine.
REMARQUE : Le MET total indicatif des niveaux d’activité physique est de 3,3 (MET d’activité de marche), + 4 (MET d’activité d’intensité modérée), + 8 (MET d’intensité vigoureuse).
3. Collecte de données - Performance physique
- Mesurez la hauteur à l’aide d’un stadiomètre. Obtenez le poids corporel et l’indice de masse corporelle (IMC) à l’aide d’un analyseur de composition corporelle. Assurez-vous que les participants enlèvent leurs vêtements lourds, leurs accessoires métalliques et leurs chaussures.
- Mesurez la circonférence de la taille, des hanches et du mollet à l’aide d’un ruban à mesurer. Enregistrez la mesure en centimètres au niveau de l’ombilic au repos pour le tour de taille et la mesure au niveau de la saillie postérieure maximale des fesses pour le tour de hanche20. Mesurez la circonférence du mollet à la plus grande dimension de l’axe long, les participants étant assis, le dos droit et les deux pieds au sol21.
- Donnez des instructions aux participants sur la façon d’effectuer les tests de performance physique : test de force de préhension (HGS)22, test de montée et de départ chronométré (TUG)23, test de marche de six mètres24 et test de cinq fois assis à debout (5STST)25.
- Assurez-vous que le réglage de performance est exempt d’obstacles et de dangers. Prévoir 1 minute de repos normalisé entre les tests26.
- Effectuez le test de force de préhension.
- Demandez au participant de s’asseoir avec les épaules en position neutre, le coude fléchi à 90°.
- Informez-les de ne pas effectuer de mouvement de torsion ou de secousse rapide tout au long de l’essai.
- Mesurez trois fois la force maximale avec le dynamomètre de poignée pour chaque main et sélectionnez la plus grande mesure en kg.
- Effectuez le test de montée et de sortie chronométrées.
- Demandez au participant de s’asseoir droit, le dos en contact avec le dossier de la chaise, les bras reposant sur les accoudoirs et les pieds positionnés à plat sur le sol.
- À l’aide d’un chronomètre, notez le temps qu’il a fallu pour se lever, marcher 3 m, faire demi-tour, revenir à la chaise et se rasseoir. Commencez le chronométrage lorsque le dos du participant perd le contact avec le dossier de la chaise et arrêtez le chronométrage dès que le dos du participant touche le dossier de la chaise.
- Répétez l’opération deux fois et enregistrez le temps le plus bas en secondes comme résultat final.
- Évaluez la vitesse de démarche.
- Mesurez une allée de 10 m et placez des marqueurs avec du ruban adhésif à 2 m de chaque extrémité de la passerelle pour indiquer les points où les mesures commenceront et se termineront.
- Demandez aux participants de marcher à leur rythme habituel le long d’une passerelle de 10 m.
- Démarrez le chronomètre dès que le participant franchit les 2 premiers m et arrêtez le chronomètre à la ligne des 8 m.
- Calculez la vitesse de marche à l’aide de la formule de la vitesse (m/s), où 6 m est divisé par le temps pris en secondes.
- Effectuez le test cinq fois assis-debout.
- Demandez aux participants de se lever et de s’asseoir 5 fois plus vite qu’ils le peuvent avec l’équilibre.
- Notez le temps nécessaire pour effectuer 5 répétitions et sélectionnez le temps le plus bas en secondes parmi les trois essais.
4. Collecte de données - Radiographie du genou
- Fixez une date et une heure de rendez-vous pour que les participants se rendent à l’hôpital pour un examen radiographique des deux genoux en utilisant la vue antéropostérieure debout.
- Soumettez les images radiographiques au radiologiste, qui déterminera et attribuera les grades Kellgren et Lawrence à chaque genou27.
REMARQUE : Le système de classification comporte des notes de 0 à 4, les notes supérieures indiquant une gravité croissante de l’AOG en fonction des caractéristiques : formation d’ostéophytes, osselets périarticulaires, forme modifiée des extrémités osseuses, rétrécissement de l’espace articulaire et sclérose sous-chondrale. - Enregistrez la note attribuée, en vous assurant que le score est attribué au bon genou.
5. Collecte de données - Prélèvement de sang capillaire pour l’évaluation de l’état glycémique
- Lavez-vous les mains et mettez des gants chirurgicaux. Nettoyez le doigt du participant avec un tampon imbibé d’alcool et laissez le doigt sécher à l’air libre.
- Préparez le glucomètre en insérant la bandelette de test.
- Sélectionnez un dispositif de lancette et assurez-vous qu’il est inutilisé et scellé.
- Brisez le sceau de la lancette et piquez le doigt avec le nouveau dispositif de lancette, pressez le doigt pour produire une petite bulle de sang et touchez la goutte de sang avec la bandelette de test.
- Utilisez des solutions de contrôle pour l’assurance qualité, déposez la solution sur la bandelette de test et vérifiez si elle se situe dans la plage attendue selon le fabricant.
- Enregistrez la glycémie affichée par le glucomètre. Demandez au participant quand a eu lieu son dernier repas et notez si celui-ci a été pris plus de 8 heures avant l’heure de l’échantillonnage.
REMARQUE : La glycémie à jeun oblige les participants à jeûner pendant au moins 8 heures avant cette procédure, alors que la glycémie aléatoire ne le fait pas. - Jetez la lancette en toute sécurité dans un bac pour objets pointus et tranchants et fournissez au participant un coton-tige pour appliquer une pression sur la zone de ponction du doigt afin d’assurer l’hémostase.
- Lavez-vous les mains après l’intervention. Nettoyez tout déversement de sang.
6. Collecte de données - Prélèvement de sang veineux pour l’évaluation du contrôle glycémique
- Lavez-vous les mains et mettez des gants chirurgicaux.
- Identifiez une veine appropriée à partir de la fosse antécubitale droite ou gauche. Appliquez un garrot sur le haut du bras du bras sélectionné et identifiez une veine appropriée par palpation.
- Nettoyez la peau autour de la veine sélectionnée avec un tampon d’alcool et laissez-la sécher à l’air libre.
- Prélever des échantillons de sang veineux à l’aide d’une aiguille papillon de 23 g à l’aide de deux flacons de tubes de sang ordinaire de 6 ml. Étiquetez les tubes avec le code d’identification unique du participant.
- Jetez les objets pointus et tranchants et les déchets cliniques en toute sécurité et lavez-vous les mains.
- Transportez les échantillons de sang au laboratoire dans une glacière avec un sac de glace. Placez les échantillons de sang dans leurs tubes de prélèvement dans une centrifugeuse et centrifugez à 604 x g pendant 10 min.
- Aliquote le sérum dans des tubes de microcentrifugation de 1,5 mL à l’aide d’une micropipette, et étiquete les tubes avec la date, le code d’identification et le type d’échantillon avant de le stocker à -80 °C.
7. Dosage ELISA
- Calculez le volume sérique nécessaire pour le test ELISA en vous basant sur le manuel du fabricant. Exécuter un test d’optimisation pour déterminer la concentration optimale ; répéter l’opération pour l’IL-1β, l’IL-4, la CRP, le NF-κB et l’AGE, respectivement.
- Décongelez le sérum et amenez les réactifs ELISA à température ambiante (RT). Pendant ce temps, étiquetez les tubes de microcentrifugation pour les étalons, les échantillons et les blancs.
- Préparez des solutions de travail selon les instructions du fabricant pour le diluant, les anticorps de détection, le substrat et le tampon de lavage à partir des solutions mères si nécessaire.
- Exécutez des dilutions en série deux fois pour les étalons avec le diluant étalon donné. Étalon de référence de chaque marqueur : IL-1β = 500 pg/mL, IL-4 = 2000 pg/mL, CRP = 25 ng/mL, NF-κB = 10 ng/mL, AGEs = 4800 ng/L. Le diluant standard sert également de blank.
- Diluer l’échantillon de sérum pour un dosage optimisé si nécessaire.
- Pour les tests ELISA IL-1β, IL-4 et NF-κB, utilisez des échantillons de sérum purs. Pour la CRP, diluer par 1000x avec le diluant de référence. Pipetez des échantillons de 100 μL dans le puits et dupliquez chacun d’eux.
- Pour le test ELISA AGEs, utilisez un échantillon de sérum de dilution 2x, pipetez 40 μL d’échantillon dans le puits et dupliquez chacun.
- Changez les pointes de pipette entre différents échantillons ou réactifs. Utilisez une pipette multicanaux pour éviter les effets de bord.
- Incuber selon le temps et la température suggérés par le manuel du fabricant, et sceller la plaque avec un nouveau couvercle adhésif pour chaque incubation.
- Pour cet ELISA sandwich, incubez l’échantillon et l’étalon dans les puits pré-enrobés, puis l’anticorps de détection, l’anticorps secondaire conjugué, le substrat et enfin la solution d’arrêt. Ajoutez chaque solution dans le même ordre que précédemment.
- Décanter et laver les puits à l’aide d’un tampon de lavage entre les incubations conformément au manuel du fabricant. Tapotez les puits contre du papier absorbant propre pour retirer le tampon de lavage, mais assurez-vous que les puits ne se dessèchent pas avant d’ajouter la solution suivante.
- Lire les puits avec un lecteur de microplaques à 450 nm. Enregistrez et calculez à l’aide de la courbe logistique à quatre paramètres (4PL), une méthode quantitative permettant de tracer et de déterminer la concentration à partir de calibrateurs sigmoïdaux symétriques28. Utilisez la moyenne de chaque échantillon pour l’analyse.
8. Analyse statistique
REMARQUE : Analysez les données à l’aide d’un logiciel d’analyse de données approprié (SPSS version 20 a été utilisé ici). Classez la population étudiée en deux groupes : 1) bon contrôle glycémique, 2) mauvais contrôle glycémique (mauvais état glycémique = glycémie à jeun supérieure à 7,0 mmol/L ou glycémie aléatoire supérieure à 11,1 mmol/L ; Mauvais contrôle glycémique = HbA1c supérieure à 6,3 %).
- Ouvrez le logiciel pour créer des variables basées sur la date, le code d’identification des participants, les variables sociodémographiques, les éléments du questionnaire et les paramètres mesurés.
- Sélectionnez Vue variable. Insérez-le dans la colonne Nom, insérez la description ou le nom d’affichage dans la colonne Libellé.
- Sélectionnez Type > mesure. Pour les variables catégorielles codées, faites correspondre le code numérique représentatif et sa valeur dans la colonne Valeurs. Sélectionnez OK.
- Saisissez les données collectées dans le logiciel où chaque ligne représente un participant.
- Sélectionnez Vue des données. Saisissez les codes numériques représentatifs dans la colonne pour le type numérique et les noms ou descriptions pour le type de chaîne.
- Vérifiez la normalité des variables continues pour déterminer les hypothèses de test paramétriques.
- Sélectionnez Analyser > Statistiques descriptives > Explorer. Insérez des variables continues dans le champ Liste des dépendants.
- Sélectionnez Tracés > Tracés de normalité avec tests > Continuer > OK. Pour une taille d’échantillon supérieure à 50, reportez-vous à la valeur p du test de Kolmogorov-Smirnov ; Une valeur p significative rejette l’hypothèse nulle où les données sont normalement distribuées.
- Exécutez le test U de Mann-Whitney pour les variables non paramétriques afin de tester les différences significatives entre les groupes.
- Sélectionnez Analyser > tests non paramétriques > paramètres > Choisissez Tests > personnaliser les tests > Mann-Whitney U (2 échantillons).
- Allez dans Champs et insérez des variables continues dans le champ Champs de test.
- Insérez le groupe catégoriel pour CBG ou HbA1c dans le champ Groupes > Exécuter.
- Exécutez un test du khi-deux pour les variables catégorielles afin de tester les différences significatives entre les groupes.
- Sélectionnez Analyser > Statistiques descriptives > Tableaux croisés > Statistiques > le khi-deux > Continuer.
- Sélectionnez Affichage des cellules. Sélectionnez Observé dans le champ Nombres et sélectionnez Colonne dans le champ Pourcentage. Ensuite, sélectionnez Continuer.
- Insérez les variables catégorielles dans le (s) champ(s) Ligne(s) et le groupe catégoriel pour CBG ou HbA1c dans le (s) champ(s) Colonne(s) > OK.
- Transformez des variables dépendantes continues en groupes binaires pour préparer la régression logistique.
- Sélectionnez Transformer > Recoder en différentes variables et insérez des variables continues dans le champ Variables d’entrée > Variables de sortie.
- Insérez le nouveau nom de variable dans le champ Nom. Insérez une nouvelle étiquette dans le champ Étiquette > Modifiez > Anciennes et Nouvelles valeurs.
- Insérez-la en dessous de la valeur seuil du point de coupure au niveau de la zone Plage, valeur LOWEST through et associez-la à zéro au champ Valeur de la nouvelle valeur si cela indique un bon résultat.
- Sélectionnez Ajouter > insérez le point de coupure dans le champ Plage, valeur par HIGHEST et associez-le à un point dans le champ Valeur de la nouvelle valeur > Ajouter > Continuer > OK.
- Points de coupure pour les variables dépendantes :
- Domaine de la douleur KOOS < 86,1 %, Domaine des symptômes < 85,7 %, Domaine de l’activité de la vie quotidienne <86,8 %, Domaines du sport < 85,0 %, Domaine de la qualité de vie < 87,5 %
- Faible HGS : Mâle < 28 kg, Femelle < 18 kg
- Pauvre remorqueur > 8.00 s
- Faible vitesse de marche < 1,13 ms-1
- Médiocre 5TSTS >12,80 s
- Faible activité physique, IPAQ MET < 3000
- Échelle de classification radiographique KOA, Kellgren et Lawrence modérée à sévère > 2
- IL-1β élevé > 11,9 pg/mL
- IL-4 élevée > 5 pg/mL
- CRP élevée > 8 ng/mL
- AGE élevé > 900 ng/L
- NF-κB élevé > 3 ng/mL - Exécutez plusieurs régressions logistiques pour obtenir des rapports de cotes. Ajustez le modèle logistique à l’aide de facteurs de confusion basés sur les caractéristiques significatives des participants.
- Sélectionnez Analyser > régression > logistique binaire. Insérez une variable binaire dépendante dans le champ Dependent.
- Insérez la variable CBG ou HbA1c dans le champ Covariables.
- Sélectionnez Catégorique et transférez les variables catégorielles dans le champ Covariables catégorielles. Ensuite, sélectionnez Catégorie de référence comme Première > Modifier > Continuer.
- Sélectionnez Options > CI pour exp(B) : 95 % > Continuer > OK.
- Répétez la procédure pour les modèles ajustés, mais ajoutez des facteurs de confusion importants dans le champ Covariables.
- Présentez les variables sous forme de moyenne (écart-type) pour les variables continues ou de médiane (intervalle interquartile) si vous utilisez un test non paramétrique, et en nombre (pourcentage) pour les variables catégorielles. Indiquez les rapports de cotes (RC) avec des intervalles de confiance (IC) à 95 % et étiquetez la valeur p inférieure à 0,05 comme statistiquement significative.
Résultats
Caractéristiques des participants
Le tableau 1 résume les caractéristiques des participants en fonction de leur état glycémique avec FPBS et HbA1c. La figure 1 illustre le nombre total de participants inclus à chaque étape en fonction de critères d’inclusion variables. Sur un total de 300 participants recrutés, un prélèvement de glycémie capillaire a été obtenu chez 254 personnes pour le FPBS, tandis qu’un prélèvement de sang veineux a été obtenu chez 93 pour l’HbA1c. Sur les 254 échantillons capillaires, 45 (17,7 %) remplissaient les critères d’hyperglycémie. Alors que sur les 93 échantillons veineux, 42 (45,2 %) remplissaient les critères d’un mauvais contrôle glycémique. L’âge moyen des participants était de 65,98 ± 5,41 ans chez ceux chez qui le FPBS était disponible et de 66,41 ± 6,02 ans pour lesquels l’HbA1c était disponible. Des différences significatives ont été observées en termes d’origine ethnique, de niveau d’éducation, d’IMC et d’insuffisance rénale chronique entre les groupes euglycémiques et hyperglycémiques basés sur le CBG, tandis que seul l’IMC était significativement plus élevé chez les personnes ayant un mauvais contrôle glycémique par rapport à celles ayant un bon contrôle glycémique basé sur l’HbA1c (p < 0,05). De plus, la proportion de participants recevant des médicaments antidiabétiques continus était significativement différente entre les deux groupes pour le CBG (p < 0,001) et l’HbA1c, respectivement (p < 0,001) (tableau 1).
Comparaison des symptômes de l’arthrose du genou, de la performance physique, du niveau d’activité physique, de la gravité radiographique et de l’inflammation entre les groupes euglycémiques et hyperglycémiques
La figure 2 présente une matrice de corrélation qui illustre les relations entre les variables clés, donnant ainsi un aperçu des interdépendances potentielles. La comparaison des scores du domaine KOOS entre les groupes euglycémiques et hyperglycémiques à l’aide de l’étude Mann Whitney U a révélé des différences dans les scores du domaine de la douleur (p = 0,008) et des symptômes (p = 0,017). Des différences significatives ont également été observées entre le 5STST et l’état glycémique (p = 0,015), ainsi que le contrôle glycémique (p = 0,002) (tableau 2).
Dix-huit participants qui ont consenti à un prélèvement de glycémie capillaire avaient des marqueurs de laboratoire mesurés à partir d’échantillons de sang veineux, dont seulement deux personnes présentaient une hyperglycémie. Il n’était donc pas possible de tirer des conclusions statistiques. Des marqueurs de laboratoire étaient disponibles pour un total de 30 personnes chez lesquelles l’HbA1c a été mesurée : 18 avec un mauvais contrôle glycémique et 12 avec un bon contrôle glycémique. Les groupes témoins glycémiques différaient significativement dans leurs taux sériques d’AGE (p = 0,022) (tableau 2).
Analyses de régression logistique multiples
De multiples modèles de régression logistique ont été utilisés pour évaluer les associations entre l’état glycémique et le contrôle glycémique avec la sévérité de la KOA, la performance physique, l’activité physique, la gravité radiographique et les marqueurs de laboratoire. Pour exclure les effets confusionnels, des modèles ajustés ont été élaborés en ajoutant les covariables ethnicité, niveau d’éducation, présence d’une maladie rénale chronique et IMC dans le modèle d’état glycémique non ajusté et l’IMC dans le modèle de contrôle glycémique non ajusté. Le modèle 2 ajusté avec un deuxième ajustement a été appliqué en ajoutant des médicaments antidiabétiques dans les deux listes de confusion.
Dans les cinq domaines de l’étude KOOS, la douleur (RC = 3,56, IC à 95 % = 1,40, 9,09), les symptômes (RC = 2,77, IC à 95 % = 1,21, 6,32) et le sport (RC = 0,27, IC à 95 % = 0,10, 0,72) étaient significativement associés à l’état glycémique seulement, mais cela a été annulé après ajustement pour tenir compte des facteurs de confusion potentiels, sauf dans le domaine du sport (RC = 0,19, IC à 95 % = 0,04, 0,85) (tableau 3). Aucune variation significative du score n’a été signalée pour le domaine des AVQ entre les groupes d’état glycémique. Parmi les tests de performance physique, seul le 5STST s’est avéré être significativement associé à l’état glycémique (RC = 3,22, IC à 95 % = 1,62, 6,39) ; Cependant, l’association n’a pas résisté à l’ajustement. La vitesse de marche (RC = 2,46, IC à 95 % = 1,05, 5,78) et la 5STST (RC = 3,83, IC à 95 % = 1,10, 13,35) étaient associées au contrôle de la glycémie, mais les associations étaient atténuées après ajustement de l’IMC (RC = 2,01, IC à 95 % = 0,82, 4,88) et 5STST (RC = 3,08, IC à 95 % = 0,85, 11,13) (tableau 3).
Une régression logistique a été effectuée pour les marqueurs de laboratoire par contrôle glycémique uniquement. L’association grossière entre l’AGE et le contrôle de la glycémie (RC = 0,19, IC à 95 % = 0,04, 0,94) a perdu de sa signification après ajustement de l’IMC (RC = 0,20, IC à 95 % = 0,04, 1,09) (tableau 3). De même, les signes radiographiques de KOA étaient significativement associés au contrôle de la glycémie avant l’ajustement de l’IMC (RC = 4,12, IC à 95 % = 1,33, 12,78). Le niveau d’activité physique n’a pas signalé de lien significatif entre l’état glycémique et le contrôle glycémique (tableau 3).
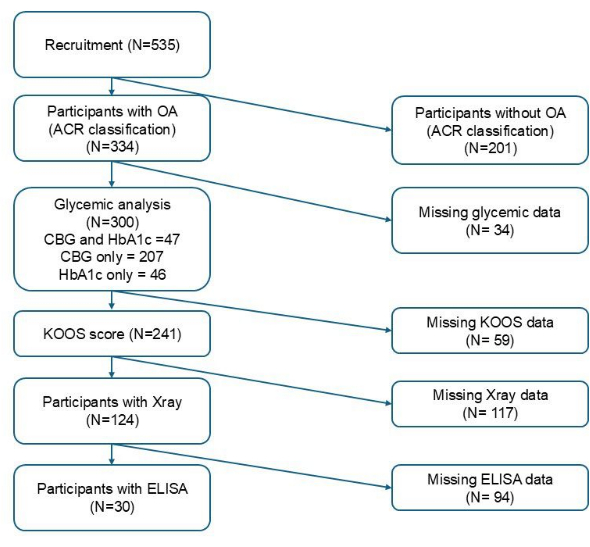
Figure 1 : Organigramme du recrutement des participants. Veuillez cliquer ici pour voir une version agrandie de cette figure.
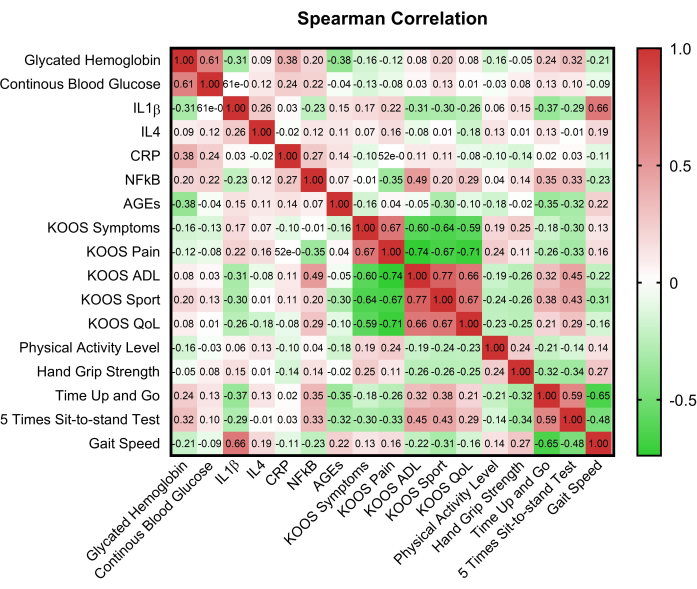
Figure 2 : Matrice de corrélation des variables clés. HbA1c : hémoglobine glyquée A1C ; CBG : Glycémie capillaire ; KOOS : Score de résultat des blessures au genou et de l’arthrose ; AVQ : Activités de la vie quotidienne ; QoL : Qualité de vie ; CRP : protéine C réactive ; AGEs : produits finaux de glycation avancée ; IL-1β : Interleukine-1β ; IL-4 : Interleukine-4 ; NF-κB : facteur nucléaire-κB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Caractéristiques des participants. Les valeurs p ont été obtenues à l’aide du test U de Mann-Whitney pour les variables continues du tableau, et les variables catégorielles ont été analysées avec le khi-deux entre les groupes. L’astérisque '*' indique une signification à la valeur α < 0,05. Abréviations : CBG : Glycémie capillaire ; HbA1c : hémoglobine glyquée A1C ; IQR : Écart interquartile ; N : Nombre de cas. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Comparaison des symptômes de l’arthrose du genou, de la performance physique, du niveau d’activité physique, de la gravité radiographique et de l’inflammation entre les groupes euglycémiques et hyperglycémiques. Les valeurs p ont été obtenues à l’aide du test U de Mann-Whitney pour les variables du tableau. L’astérisque '*' indique une signification à la valeur α < 0,05. Abréviations : IQR : écart interquartile ; N : Nombre de cas ; HbA1c : hémoglobine glyquée A1C ; KOOS : Score de résultat des blessures au genou et de l’arthrose ; AVQ : Activités de la vie quotidienne ; QoL : Qualité de vie ; IPAQ : Questionnaires internationaux sur l’activité physique ; MET : Tâche Métabolique Équivalente ; HGS : Force de préhension ; TUG : Timed-up-and-go ; 5TSTS : Cinq fois assis-debout ; ELISA : Dosage immuno-enzymatique ; CRP : protéine C réactive ; AGEs : produits finaux de glycation avancée ; IL-1β : Interleukine-1β ; IL-4 : Interleukine-4 ; NF-κB : facteur nucléaire-κB. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Analyses de régression logistique multiples en fonction de l’état glycémique et du contrôle. Modèle 1 ajusté : Glycémie capillaire ajustée en fonction de l’origine ethnique, du niveau d’éducation, de l’insuffisance rénale chronique et de l’indice de masse corporelle, HbA1c ajustée en fonction de l’indice de masse corporelle. Modèle ajusté 2 : Modèle 1 ajusté avec des médicaments antidiabétiques ajoutés à l’ajustement du facteur de confusion. La glycémie capillaire et l’HbA1c ont été testées en tant que variables indépendantes sur chaque paramètre. L’astérisque '*' indique une signification à la valeur α < 0,05. Abréviations : IPAQ : Questionnaires internationaux sur l’activité physique ; MET : Tâche Métabolique Équivalente ; ELISA : Dosage immuno-enzymatique ; CRP : protéine C réactive ; AGEs : produits finaux de glycation avancée ; IL-1β : Interleukine-1β ; IL-4 : Interleukine-4 ; NF-κB : facteur nucléaire-κB ; UTC : Impossible de calculer. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le prélèvement de sang veineux est souvent préféré pour les tests de laboratoire au prélèvement de sang capillaire en termes de précision des résultats29. L’HbA1c est fortement associée aux complications du diabète, à la nature chimique stable et à des tests de laboratoire bien standardisés. Comme l’HbA1c reflète le contrôle glycémique sur 3 mois, il ne nécessite pas d’échantillons à jeun, tandis qu’un prélèvement capillaire unique pourrait refléter un état glycémique ponctuel, qui est influencé par le moment et le contenu des repas récents. Les deux évaluations glycémiques, cependant, ont leurs avantages et leurs inconvénients. Les résultats de la glycémie capillaire sont influencés par une microcirculation altérée, l’hypotension, une déshydratation sévère, un œdème et une acidocétose diabétique, ainsi que par la fonction du glucomètre commercial et des bandelettes de test utilisées30. Néanmoins, le prélèvement de sang capillaire pourrait fournir des résultats immédiats, offrir une plus grande accessibilité et capturer l’état glycémique aigu ; Cela répond à différents besoins de recherche et peut améliorer la capacité de recherche dans les milieux à faibles ressources.
Dans cette étude, l’association entre la force des membres inférieurs, la gravité radiologique et les marqueurs de laboratoire avec le contrôle glycémique a été confondue par l’IMC, qui est un marqueur de l’obésité. De même, l’association entre l’état glycémique et la douleur et les symptômes de KOOS a été partiellement attribuée à l’effet confondant de l’IMC, tandis que l’association avec la force des membres inférieurs a été médiée par les médicaments antidiabétiques. Il a également été constaté que les médicaments antidiabétiques affectent à la fois la masse musculaire et la force musculaire31,32. D’autre part, un mauvais état glycémique chez les personnes atteintes de KOA était indépendamment associé à une meilleure fonction dans les sports et les loisirs. Le regain d’importance dans le domaine des fonctions sportives et récréatives de KOOS après ajustement pour le facteur de confusion des médicaments antidiabétiques suggère que le traitement pourrait avoir masqué l’influence de l’état glycémique sur les évaluations subjectives de l’agilité et de la fonction des participants. Cela correspond à l’amélioration du score KOOS après l’administration de metformine, de méloxicam et de pioglitazone dans un essai clinique33. Néanmoins, contrairement à l’HbA1c, l’état glycémique peut refléter des pics de glucose à court terme, qui sont moins susceptibles d’affecter négativement la limitation fonctionnelle, conduisant à des scores plus élevés dans leurs réponses.
Une étude antérieure a également révélé que les scores du domaine KOOS étaient négativement corrélés avec le contrôle glycémique7. De même, l’HbA1c prédit de manière significative les scores du domaine de la douleur KOOS chez les personnes subissant une arthroplastie totale du genou. Cependant, la présence de douleurs insupportables chez ceux qui ont opté pour une arthroplastie totale du genou doit également être prise en compte34,35. Les mesures instantanées de la glycémie capillaire peuvent ne pas être associées aux scores KOOS car elles reflètent l’état glycémique à un moment donné et ne prennent pas en compte le contrôle glycémique sur une période de temps36. Cependant, l’association entre l’hyperglycémie et le niveau d’éducation, l’origine ethnique, l’insuffisance rénale chronique et l’IMC suggère que les tests de glycémie capillaires aléatoires reflètent le contrôle glycémique, car il s’agit de facteurs de risque établis de mauvais contrôle glycémique. De plus, la connaissance de l’autogestion du genou, du mode de vie et de l’apport alimentaire influencée par l’origine ethnique peut également affecter la douleur et les symptômes du KOA 37,38,39. L’insuffisance rénale chronique chez les personnes atteintes de diabète est généralement un indicateur de la présence d’une maladie microvasculaire, qui est une complication à long terme d’un mauvais contrôle glycémique40,41. L’augmentation de l’IMC entraîne une augmentation de la charge mécanique sur l’articulation du genou en plus de son association bien établie avec la résistance à l’insuline et, par conséquent, un rôle important dans le contrôle de la glycémie42. L’effet confondant de l’IMC sur la relation entre le contrôle glycémique et la gravité de l’AAS radiologique peut être le reflet de la relation entre l’obésité et la résistance à l’insuline ainsi que la charge mécanique induite par le poids sur l’articulation du genou43. Une étude antérieure a suggéré que le traitement à l’insuline entraîne une protection contre la formation d’ostéophytes, suggérant qu’un meilleur contrôle glycémique peut entraîner une réduction des changements structurels du KOA44. En ce qui concerne les marqueurs ELISA, la modification non enzymatique du collagène, qui forme l’AGE, est irréversible et reflète une hyperglycémie cumulative45 ; Cela expliquera potentiellement la relation entre le contrôle glycémique et non l’état glycémique dans cette étude46. La diminution de l’association après ajustement de l’IMC a également été observée dans d’autres études47.
Certaines étapes essentielles sont décrites dans les protocoles, comme celles lors de l’administration du questionnaire et l’explication des étapes. Les chercheurs doivent être attentifs à la compréhension des participants âgés en raison du déclin potentiel de la fonction cognitive ; Les instructions données doivent être claires et rédigées en termes simples afin d’éviter toute confusion. Lors du prélèvement sanguin, les participants doivent être informés du risque de complications et obtenir le consentement avant l’intervention, car celle-ci est invasive. Après la centrifugation du sang, les échantillons de sérum doivent être alicités dans plusieurs tubes de microcentrifugation avant la congélation afin d’éviter la répétition des processus de congélation-décongélation qui entraîneront une dégradation des protéines et une perte de signal dans le test ELISA48. La procédure ELISA étape par étape varie d’un fabricant à l’autre, il est important de lire attentivement le manuel et d’optimiser le temps d’incubation, la dilution et la température en fonction de l’échantillon d’étude48.
Les limites de cette étude incluent la présence de facteurs de confusion non mesurés, tels que les habitudes alimentaires et les prédispositions génétiques. De plus, la collecte d’échantillons a été limitée aux régions de Kuala Lumpur et de Selangor, qui peuvent ne pas saisir les variations entre les différentes populations pour tenir compte de l’impact du mode de vie et de l’accès aux soins de santé sur l’état glycémique ou le contrôle de la glycémie. Au-delà de cela, KOOS, en tant que questionnaire auto-déclaré rétrospectif, est intrinsèquement subjectif ; Les évaluations futures des symptômes et de la fonctionnalité du genou pourraient intégrer une évaluation biomécanique pour atténuer les biais potentiels. Pour une meilleure réflexion sur les performances physiques des participants atteints de KOA avec diabète, des mesures répétées pourraient être obtenues dans la méthodologie d’étude future. En termes de médiateurs inflammatoires, cette étude n’a mesuré que cinq biomarqueurs, mais un profilage plus étendu pourrait mieux cartographier le mécanisme sous-jacent. La petite taille de l’échantillon pourrait également être l’une des préoccupations. L’absence de données sur la glycémie capillaire dans l’ensemble de l’échantillon était due à l’épuisement des bandelettes de test lors de la collecte de données sur le site communautaire et à la réticence du participant à assister à une deuxième visite. Le prélèvement de sang veineux pour le test HbA1c, en revanche, a été effectué lors de la deuxième visite à l’hôpital en même temps que la radiographie du genou, ce qui a nécessité un engagement de temps supplémentaire de la part des participants. La taille de l’échantillon a été calculée sur la base de la puissance de 80 % pour obtenir le rapport de cotes (RC = 2,010, IC à 95 % 1,003, 4,026), qui a été identifié dans la littérature publiée et a donné une taille d’échantillon estimée à 7249. Dans cette étude, nous avons regroupé la glycémie à jeun et la glycémie aléatoire en une seule variable, à savoir le CBG ; Cependant, les résultats suggèrent une sensibilité réduite, dans laquelle l’avantage de la mesure individuelle pourrait être masqué par un autre. Par conséquent, il est préférable d’analyser les associations de l’état glycémique avec les paramètres par la glycémie à jeun et la glycémie aléatoire, respectivement. Les études futures devraient maintenant évaluer les tendances glycémiques à long terme afin de déterminer l’effet de l’hyperglycémie chronique sur le KOA.
Les protocoles impliqués dans cette étude peuvent être modifiés pour une étude longitudinale ou un essai clinique randomisé pour la collecte de données à l’aide de questionnaires, de tests physiques, de mesures de glycémie et de tests ELISA. Les méthodes d’évaluation glycémique, de prélèvement de sang capillaire et de prélèvement de sang veineux doivent être choisies en fonction des paramètres étudiés et de la nature de l’étude. Le diabète sucré étant un facteur de risque de maladie cardiovasculaire, de rétinopathie, de neuropathie périphérique et de maladie rénale diabétique, les méthodes d’évaluation glycémique sont indéniablement essentielles à adopter dans la méthodologie de recherche 5,50. En plus de cela, l’amélioration de la gestion du diabète et l’augmentation de l’espérance de vie ont ouvert la voie à de nouvelles complications du diabète, telles que le cancer, les maladies du foie et les handicaps fonctionnels etcognitifs51. Celles-ci sont anticipées dans les tendances futures de la recherche.
Déclarations de divulgation
Tous les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Cette étude a été financée par le Fundamental Research Grant Scheme, ministère de l’Enseignement supérieur, Malaisie, numéro de subvention/récompense : FRGS/1/2021/SKK0/UKM/02/15.
matériels
| Name | Company | Catalog Number | Comments |
| Butterfly needle | BD Vacutainer | 367282 | |
| G*Power 3.1 | Heinrich-Heine-University | https://www.psychologie.hhu.de/arbeitsgruppen/allgemeine-psychologie-und-arbeitspsychologie/gpower | Heinrich-Heine-University, Düsseldorf |
| Glucometer and test strips | Contour plus | https://www.diabetes.ascensia.my/en/products/contour-plus/ | Basel, Switzerland |
| Human CRP(C-Reactive Protein) ELISA Kit | Elabscience | E-EL-H0043-96T | ELISA kit |
| Human IL-1β(Interleukin 1 Beta) ELISA Kit | Elabscience | E-EL-H0149-96T | ELISA kit |
| Human IL-4(Interleukin 4) ELISA Kit | Elabscience | E-EL-H0101-96T | ELISA kit |
| Human NF-κB-p105 subunit | Bioassay Technology Laboratory | E0003Hu | ELISA kit |
| Human NF-κBp105(Nuclear factor NF-kappa-B p105 subunit) | Elabscience | E-EL-H1386-96T | ELISA kit |
| Manual hand dynamometer | Jamar | 5030J1 | Warrenville, Illinois, USA |
| Portable Body Composition Analyzer | InBody ASIA | https://inbodyasia.com/products/inbody-270/ | Inbody 270, Cheonan, Chungcheongnam-do |
| Portable stadiometer | Seca | 213 1821 009 | SECA 213, Hamburg, Germany |
Références
- Allen, K. D., Thoma, L. M., Golightly, Y. M. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 30 (2), 184-195 (2022).
- Mat, S., et al. Factors influencing quality of life among older persons living with osteoarthritis using 3 different definitions. Top Geriatr Rehabil. 38 (1), 26-34 (2022).
- Berenbaum, F. Diabetes-induced osteoarthritis: From a new paradigm to a new phenotype. Ann Rheum Dis. 70 (8), 1354 (2011).
- Institute for Public Health. . National health and morbidity survey (NHMS) 2023: Non-communicable diseases and healthcare demand - key findings. , (2024).
- Harding, J. L., Pavkov, M. E., Magliano, D. J., Shaw, J. E., Gregg, E. W. Global trends in diabetes complications: A review of current evidence. Diabetologia. 62 (1), 3-16 (2019).
- Eitner, A., Culvenor, A. G., Wirth, W., Schaible, H. -. G., Eckstein, F. Impact of diabetes mellitus on knee osteoarthritis pain and physical and mental status: Data from the osteoarthritis initiative. Arthritis Care Res (Hoboken). 73 (4), 540-548 (2021).
- Aykan, S. A., Kaymaz, S. The association between diabetes mellitus and functionality in knee osteoarthritis: A cross-sectional study. J Health Sci Med. 5 (4), 1114-1118 (2022).
- Alenazi, A. M., Alqahtani, B. A. Diabetes is associated with longitudinal declined physical performance measures in persons with or at risk of knee osteoarthritis: Data from the osteoarthritis initiative. Eur J Phys Rehabil Med. 60 (3), 496-504 (2024).
- Neumann, J., et al. Diabetics show accelerated progression of knee cartilage and meniscal lesions: Data from the osteoarthritis initiative. Skeletal Radiol. 48 (6), 919-930 (2019).
- Courties, A., Gualillo, O., Berenbaum, F., Sellam, J. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthritis Cartilage. 23 (11), 1955-1965 (2015).
- Wei, G., et al. Risk of metabolic abnormalities in osteoarthritis: A new perspective to understand its pathological mechanisms. Bone Res. 11 (1), 63 (2023).
- Sriwimol, W., Choosongsang, P., Choosongsang, P., Petkliang, W., Treerut, P. Associations between hba1c-derived estimated average glucose and fasting plasma glucose in patients with normal and abnormal hemoglobin patterns. Scand J Clin Lab Invest. 82 (3), 192-198 (2022).
- Papachristoforou, E., Lambadiari, V., Maratou, E., Makrilakis, K. Association of glycemic indices (hyperglycemia, glucose variability, and hypoglycemia) with oxidative stress and diabetic complications. J Diabetes Res. 2020 (1), 7489795 (2020).
- Matsushita, Y., et al. A comparison of the association of fasting plasma glucose and hba1c levels with diabetic retinopathy in japanese men. J Diabetes Res. 2020 (1), 3214676 (2020).
- Baig, M. A. Comparative evaluation of efficiency of hba1c, fasting & post prandial blood glucose levels, in the diagnosis of type-2 diabetes mellitus and its prognostic outcome. Int J Res Med Sci. 3 (11), 3245-3249 (2015).
- Altman, R., et al. Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthritis Rheum. 29 (8), 1039-1049 (1986).
- Kang, H. Sample size determination and power analysis using the G* power software. J Educ Eval Health Prof. 18, (2021).
- Roos, E. M., Lohmander, L. S. The knee injury and osteoarthritis outcome score (koos): From joint injury to osteoarthritis. Health Qual Life Outcomes. 1, 64 (2003).
- Ipaq Research Committee. . Guidelines for data processing and analysis of the international physical activity questionnaire (IPAQ)-short and long forms. , (2005).
- Perissinotto, E., Pisent, C., Sergi, G., Grigoletto, F., Enzi, G. Anthropometric measurements in the elderly: Age and gender differences. Br J Nutr. 87 (2), 177-186 (2002).
- Sun, Y. -. S., et al. Calf circumference as a novel tool for risk of disability of the elderly population. Sci Rep. 7 (1), 16359 (2017).
- Chen, L. -. K., et al. Asian working group for sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment. J Am Med Dir Assoc. 21 (3), 300-307 (2020).
- Samah, Z. A., et al. Discriminative and predictive ability of physical performance measures in identifying fall risk among older adults. Sains Malays. 47 (11), 2769-2776 (2018).
- Bohannon, R. W., Williams Andrews, A. Normal walking speed: A descriptive meta-analysis. Physiotherapy. 97 (3), 182-189 (2011).
- Kim, M., Won, C. W. Cut points of chair stand test for poor physical function and its association with adverse health outcomes in community-dwelling older adults: A cross-sectional and longitudinal study. J Am Med Dir Assoc. 23 (8), 1375-1382.e3 (2022).
- Parcell, A. C., Sawyer, R. D., Tricoli, V. A., Chinevere, T. D. Minimum rest period for strength recovery during a common isokinetic testing protocol. Med Sci Sports Exerc. 34 (6), (2002).
- Kohn, M. D., Sassoon, A. A., Fernando, N. D. Classifications in brief: Kellgren-lawrence classification of osteoarthritis. Clin Orthop Relat Res. 474 (8), 1886-1893 (2016).
- Gottschalk, P. G., Dunn, J. R. Measuring parallelism, linearity, and relative potency in bioassay and immunoassay data. J Biopharm Stat. 15 (3), 437-463 (2005).
- Das, S., Swain, M., Pradhan, R. Evaluating the relationship of fasting capillary and venous blood sugar level in self-glucose monitoring device, fasting plasma glucose level and glycosylated hemoglobin (HbA1c). Nurs Care Open Access J. 1 (2), 00011 (2016).
- Bao, Y., Zhu, D. Clinical application guidelines for blood glucose monitoring in china (2022 edition). Diabetes Metab Res Rev. 38 (8), e3581 (2022).
- Wu, C. -. N., Tien, K. -. J. The impact of antidiabetic agents on sarcopenia in type 2 diabetes: A literature review. J Diabetes Res. 2020 (1), 9368583 (2020).
- Kalaitzoglou, E., Fowlkes, J. L., Popescu, I., Thrailkill, K. M. Diabetes pharmacotherapy and effects on the musculoskeletal system. Diabetes Metab Res Rev. 35 (2), e3100 (2019).
- Mohammed, M. M., Al-Shamma, K. J., Jassim, N. A. Evaluation of the clinical use of metformin or pioglitazone in combination with meloxicam in patients with knee osteoarthritis; using knee injury and osteoarthritis outcome score. Iraqi J Pharm Sci. 23 (2), 13-23 (2014).
- Vervullens, S., et al. Preoperative glycaemic control, number of pain locations, structural knee damage, self-reported central sensitisation, satisfaction and personal control are predictive of 1-year postoperative pain, and change in pain from pre- to 1-year posttotal knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. , (2024).
- Eitner, A., et al. Pain sensation in human osteoarthritic knee joints is strongly enhanced by diabetes mellitus. Pain. 158 (9), 1743-1753 (2017).
- Li, H., George, D. M., Jaarsma, R. L., Mao, X. Metabolic syndrome and components exacerbate osteoarthritis symptoms of pain, depression and reduced knee function. Ann Transl Med. 4 (7), 133 (2016).
- Khachian, A., Seyedoshohadaei, M., Haghani, H., Amiri, F. Effect of self-management program on outcome of adult knee osteoarthritis. Int J Orthop Trauma Nurs. 39, 100797 (2020).
- Mat, S., et al. Ethnic differences in the prevalence, socioeconomic and health related risk factors of knee pain and osteoarthritis symptoms in older malaysians. PLoS One. 14 (11), e0225075 (2019).
- Cruz-Almeida, Y., et al. Racial and ethnic differences in older adults with knee osteoarthritis. Arthritis Rheumatol. 66 (7), 1800-1810 (2014).
- Kalantar-Zadeh, K., et al. Patient-centred approaches for the management of unpleasant symptoms in kidney disease. Nat Rev Nephrol. 18 (3), 185-198 (2022).
- Hsu, H. -. J., et al. Factors associated with chronic musculoskeletal pain in patients with chronic kidney disease. BMC Nephrol. 15 (1), 6 (2014).
- Larsen, P., Engberg, A. S., Motahar, I., Ostgaard, S. E., Elsoe, R. Obesity influences the knee injury and osteoarthritis outcome score. Joints. 7 (01), 008-012 (2019).
- Solanki, P., et al. Association between weight gain and knee osteoarthritis: A systematic review. Osteoarthritis Cartilage. 31 (3), 300-316 (2023).
- Al-Jarallah, K., Shehab, D., Abdella, N., Al Mohamedy, H., Abraham, M. Knee osteoarthritis in type 2 diabetes mellitus: Does insulin therapy retard osteophyte formation. Med Princ Pract. 25 (1), 12-17 (2016).
- Suzuki, A., Yabu, A., Nakamura, H. Advanced glycation end products in musculoskeletal system and disorders. Methods. 203, 179-186 (2022).
- Wang, M., Hng, T. M. Hba1c: More than just a number. Aust J Gen Pract. 50 (9), 628-632 (2021).
- Kalousova, M., Skrha, J., Zima, T. Advanced glycation end-products and advanced oxidation protein products in patients with diabetes mellitus. Physiol Res. 51 (6), 597-604 (2002).
- Shah, K., Maghsoudlou, P. Enzyme-linked immunosorbent assay (elisa): The basics. Br J Hosp Med. 77 (7), C98-C101 (2016).
- Nakanishi, S., et al. The impact of hand strength on hba1c, body mass index and body composition by group according to sedentary behaviour: Cross-sectional study in japanese patients with type 2 diabetes mellitus. Malays J Med Sci. 31 (3), 185-193 (2024).
- Joseph, J. J., et al. Comprehensive management of cardiovascular risk factors for adults with type 2 diabetes: A scientific statement from the american heart association. Circulation. 145 (9), e722-e759 (2022).
- Tomic, D., Shaw, J. E., Magliano, D. J. The burden and risks of emerging complications of diabetes mellitus. Nat Rev Endocrinol. 18 (9), 525-539 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon