Method Article
変形性膝関節症の症状に対するグリセミックの影響 50歳以上の糖尿病患者の身体的、X線写真、および炎症マーカーに対するマーカー
要約
ここでは、毛細血管血糖 (CBG) と糖化ヘモグロビン A1C (HbA1C) レベルを使用して血糖コントロールを評価するためのプロトコルを紹介します。この研究では、高血糖が変形性膝関節症 (KOA) の症状、身体能力、身体活動レベル、X 線撮影の重症度、および糖尿病の高齢者の炎症に及ぼす影響を調査しています。
要約
この研究では、高血糖が変形性膝関節症 (KOA) 関連の症状、身体能力、身体活動レベル、X 線撮影の重症度、および高齢者の炎症に及ぼす影響を調査しています。高血糖状態が長引くと、終末糖化産物(AGE)の形成に寄与し、KOAの症状が悪化します。毛細血管血糖値(CBG)および糖化ヘモグロビンA1C(HbA1C)レベルは、血糖評価のための臨床検査で一般的に使用されており、明確な利点と制限があります。参加者は、CBGおよびHbA1Cレベルに基づいて、良好な血糖コントロールグループと悪いグリセミックコントロールグループに分けられました。KOA の臨床的重症度と身体活動は、膝の損傷と変形性関節症の結果スコア (KOOS) と国際身体活動アンケートを使用して測定されました。身体能力は、握力、歩行速度、タイムアップ&ゴー(TUG)、および5回のシット・トゥ・スタンド(5STST)で測定されました。膝関節X線検査を行い、IL-1β、IL-4、CRP、NF-κB、AGEについて血清酵素結合免疫吸着アッセイ(ELISA)解析を行った。空腹時血糖値が7.0 mmol/L、ランダム血糖値が11.1 mmol/L>>、無作為血糖値が11.1 mmol/LのCBG患者300人の参加者300人(平均年齢[SD] = 66.40歳(5.938))をKOOS疼痛(p=0.008)および症状(p=0.017)および5STST(p=0.015)と比較した>。 AGEs(p = 0.022)はMann Whitney U検定に基づいています。ロジスティック回帰により、血糖コントロールと下肢筋力、放射線重症度、検査マーカーとの間に有意な関連が明らかになりました、および血糖状態とKOOSの痛みと症状との間に。しかし、これらの関連性はBMIを調整した後も有意ではありませんでした。血糖状態の悪さだけでも、抗糖尿病薬の調整後のスポーツおよびレクリエーション領域での機能の改善と関連しており、高血糖の影響を隠す抗炎症作用と鎮痛作用が示唆されています。今後の研究では、投薬の影響を考慮しながら、膝の機能低下と身体能力の低下に対する血糖評価の予測能力を探ることができるかもしれません。
概要
変形性膝関節症(KOA)は年齢とともに有病率が増加し、膝は主要な体重負荷関節です1。KOAは通常、膝関節のこわばりと慢性的な痛みを伴って現れ、可動性が制限され、生活の質が低下し、心血管疾患のリスクが高まります2。糖尿病は、加齢にも関連しており、グルコースや脂質レベルの上昇が進行糖化最終産物(AGE)の形成を促進し、慢性関節の炎症や軟骨の変性を引き起こすため、KOA発症のリスクに寄与しています3。医療サービスが利用できるにもかかわらず、糖尿病を患うマレーシア人の5人に2人は自分の診断に気づいておらず、診断された人の56%は良好な血糖コントロールを維持できていません4。急性高血糖は、生命を脅かす高血糖性高浸透圧状態を引き起こす可能性があり、慢性高血糖は末梢神経障害、腎症、網膜症、心血管疾患5につながります。
末梢神経障害は、血糖コントロール不良に起因する微小血管合併症であり、疼痛メカニズムの変化につながるため、KOA6 の膝の痛みが誇張される可能性があります。KOA患者における糖尿病の存在は、膝関節の可動域の縮小、膝機能の低下、X線写真による変化の増加、および生活の質の低下と関連しています7。糖尿病がKOAに及ぼす影響による身体能力の低下は、筋力と協調性の障害によって特徴付けられます8。関節腔の縮小やアライメントの乱れなど、軟骨および半月板の損傷に関連する変性変化の磁気共鳴画像法の証拠は、糖尿病患者でより深刻であるようです9。
血糖コントロール不良は、膝滑液中の異常性酵素と炎症因子のアップレギュレーションに関連しています。IL-1β、IL-4、IL-6、核因子-κB(NF-κB)、腫瘍壊死因子-α(TNF-α)などの糖尿病におけるサイトカインおよびタンパク質の上昇は、KOAの病態生理学と関連しています10,11。軟骨細胞では、グルコーストランスポーターの欠陥により、解糖系、ポリオール経路、プロテインキナーゼCおよびペントース経路のアップレギュレーションが起こり、最終的には活性酸素種が大量に産生されます10。
空腹時とランダム血糖は、現在の血糖状態とインスリン抵抗性に関連するグルコース処理能力の推定を提供します12。糖化ヘモグロビンA(HbA1c)は、過去3か月間の血糖コントロールの尺度です。しかし、これは急激な変動13の詳細を提供していません。毛細血管血糖検査は、ベッドサイドやクリニックで血糖状態を即座に評価できるため、血糖コントロールの決定や合併症のリスクの予測におけるその価値についての議論が行われています14,15。したがって、この研究は、HbA1c で決定された血糖コントロールと毛細血管血糖 (CBG) で測定された血糖値の上昇との関連を解明することを目的としています 膝の損傷および変形性関節症の転帰スコア (KOOS)、身体能力、身体活動レベル、X 線撮影の重症度、および KOA 患者の炎症マーカー。
プロトコル
この研究プロトコルは、ヘルシンキ宣言に準拠しており、Universiti Kebangsaan Malaysia Ethics Committee(参照番号:JEP-2022-001)によって承認されました。
1. 参加者募集
- コンビニエンスサンプリングを通じて、クアラルンプールとセランゴールの 50 歳以上の KOA を持つ地域に住む成人から研究集団を選択します。高齢者団体、糖尿病・整形外科クリニックから参加者を募集しました。
注: KOA の存在は、自己申告の医師が診断した KOA または米国リウマチ学会 (ACR) の臨床検査基準16 を満たしているものと定義されます。 - 施設に収容されている高齢者や、重大な精神障害や1型糖尿病を患っている人は除外します。
- 同様の設定からの横断的コホートに関する公開文献を参照することにより、この研究では奇数比である効果サイズを特定します。帰無仮説を棄却する80%の検出力を提供するサンプルサイズを、G*Power 3.117を使用して計算します。
- データ収集の前に、研究の目的を説明し、インフォームドコンセントを取得します。
2. データ収集 - アンケート
- 社会人口統計、KOOS18、および国際身体活動アンケート(IPAQ)19を含むアンケートを管理します。
- 42 の項目から導き出された 5 つの KOOS ドメインそれぞれの合計スコアを計算し、スコアを 0 から 100 のパーセンテージ スケールに変換します (0 は問題なし、100 は各ドメインの極端な問題を示します)。
- IPAQドメインの代謝当量タスク(MET)は、各ドメインの標準を考慮して、分単位の時間と週の日数を掛けて計算します。
注: 身体活動レベルを示す合計 MET は、3.3 (歩行活動 MET)、+ 4 (中強度の活動 MET)、+ 8 (激しい強度 MET) です。
3. データ収集 - 物理的パフォーマンス
4. データ収集 - 膝X線
- 参加者が立っている前後の体重負荷ビューを使用して、両膝のX線検査のために病院を訪れる予定の日時を設定します。
- 放射線科医にX線画像を提出し、放射線科医はケルグレンとローレンスの等級を決定し、各膝27に割り当てます。
注:分類システムには0から4までのグレードがあり、グレードが高いほど、骨棘の形成、関節周囲耳小骨、骨端の形状の変化、関節腔の狭窄、軟骨下硬化症などの特徴に基づいてKOAの重症度が増加することを示します。 - 割り当てられた成績を記録し、スコアが正しい膝に割り当てられていることを確認します。
5. データ収集 - 血糖状態評価のための毛細血管採血
- 手を洗い、手術用手袋を着用します。アルコール綿棒で参加者の指をきれいにし、指を自然乾燥させます。
- テストストリップを挿入して血糖値計を準備します。
- ランセットデバイスを選択し、未使用で密封されていることを確認してください。
- ランセットのシールを破り、新しいランセットデバイスで指を刺し、指を絞って小さな血の斑点を生成し、テストストリップで血の滴に触れます。
- 品質保証のために制御ソリューションを使用し、ソリューションをテストストリップにドロップして、メーカーによると予想される範囲内にあるかどうかを確認します。
- 血糖値計で表示される血糖値を記録します。参加者に最後の食事がいつだったかを尋ね、これがサンプリングの 8 時間以上前に行われたかどうかを記録します。
注:空腹時血糖値では、参加者はこの手順の前に少なくとも8時間絶食する必要がありますが、ランダムな血糖値は必要ありません。 - ランセットを安全に鋭利なビンに捨て、参加者に綿棒を提供して指の穿刺部分に圧力をかけ、止血を確保します。
- 施術後は手を洗ってください。こぼれた血液をきれいにします。
6. データ収集 - 血糖コントロール評価のための静脈血採取
- 手を洗い、手術用手袋を着用します。
- 右または左の肘前窩から適切な静脈を特定します。選択した腕の上腕に止血帯を当て、触診で適切な静脈を特定します。
- 選択した静脈の周りの皮膚をアルコール綿棒できれいにし、自然乾燥させます。
- 6mLのプレーン血液チューブの2本のボトルを使用して、23Gのバタフライニードルで静脈血サンプルを採取します。チューブに参加者の一意の識別コードでラベルを付けます。
- 鋭利物や臨床廃棄物は安全に廃棄し、手を洗ってください。
- 血液サンプルは、アイスパック付きのクーラーボックスで検査室に運びます。血液サンプルを採取チューブに入れ、遠心分離機に入れ、604 x g で10分間遠心分離します。
- マイクロピペットで血清を1.5 mLの微量遠心チューブに分注し、-80°Cで保存する前に、チューブに日付、識別コード、およびサンプルの種類をラベル付けします。
7. ELISAアッセイ
- ELISAアッセイに必要な血清量は、メーカーのマニュアルに基づいて計算してください。最適化アッセイを実施して、最適な濃度を決定します。IL-1β、IL-4、CRP、NF-κB、およびAGEsについてそれぞれ繰り返します。
- 血清を解凍し、ELISA試薬を室温(RT)に戻します。その間、標準、サンプル、およびブランクの微量遠心チューブにラベルを付けます。
- 希釈剤、検出抗体、基質、および必要に応じてストック溶液からの洗浄バッファーについて、製造元の指示に従って作業溶液を調製します。
- 所定の標準希釈液を使用して、標準試料の2倍段階希釈を実行します。各マーカーの参照標準:IL-1β = 500 pg/mL、IL-4 = 2000 pg/mL、CRP = 25 ng/mL、NF-κB = 10 ng/mL、AGEs = 4800 ng/L。標準希釈剤はブランクとしても機能します。
- 必要に応じて、最適化されたアッセイのために血清サンプルを希釈します。
- IL-1β、IL-4、およびNF-κB ELISAアッセイには、きちんとした血清サンプルを使用してください。CRPの場合は、参照希釈液で1000倍に希釈します。100 μLのサンプルをウェルにピペットで移し、それぞれを複製します。
- AGEs ELISAアッセイでは、2倍希釈の血清サンプルを使用し、40 μLのサンプルをウェルにピペットで注入し、それぞれを複製します。
- 異なるサンプルまたは試薬間でピペットチップを交換します。マルチチャンネルピペットを使用して、エッジの影響を回避します。
- メーカーのマニュアルの推奨時間と温度に従ってインキュベートし、インキュベーションごとに新しい接着カバーでプレートを密封します。
- このサンドイッチELISAでは、サンプルと標準試料をプレコートウェルにインキュベートし、続いて検出抗体、標識二次抗体、基質、そして最後に溶液を停止します。各ソリューションを前と同じ順序で追加します。
- インキュベーションの合間に洗浄バッファーを使用してウェルをデカントし、洗浄します。これは、メーカーのマニュアルに従って行われます。ウェルをきれいな吸収紙で軽くたたいて洗浄バッファーを取り除きますが、次の溶液を追加する前にウェルが乾かないようにしてください。
- マイクロプレートリーダーで450nmのウェルを読み取ります。対称的なシグモイドキャリブレータ28からの濃度をプロットし決定するための定量的方法である4パラメータロジスティック(4PL)曲線を使用して記録および計算する。分析には、各サンプルの平均を使用します。
8. 統計分析
注:適切なデータ分析ソフトウェアを使用してデータを分析します(ここではSPSSバージョン20を使用)。研究集団を 2 つのグループに分類します: 1) 良好な血糖コントロール、2) 血糖コントロール不良 (血糖状態が悪い = 空腹時血糖値が 7.0 mmol/L を超えるか、ランダムな血糖値が 11.1 mmol/L を超える;血糖コントロール不良 = HbA1c 6.3%)
- ソフトウェアを開いて、日付、参加者の識別コード、社会人口統計変数、アンケート項目、および測定されたパラメーターに基づいて変数を作成します。
- [変数ビュー] を選択します。[名前] 列に挿入し、ラベル列に説明または表示名を挿入します。
- [種類] > [メジャー] を選択します。コード化されたカテゴリー変数の場合、代表的な数値コードとその値を「値」列で一致させます。[OK] を選択します。
- 各行が 1 人の参加者を表すソフトウェアに収集されたデータを入力します。
- [データ ビュー] を選択します。数値タイプの場合は列に代表的な数値コードを入力し、文字列タイプの場合は名前または説明を入力します。
- 連続変数の正規性をチェックして、パラメトリック検定の仮定を決定します。
- 「Explore」>「Analyze」>「Descriptive statistics」を選択します。連続変数をフィールド [従属リスト] に挿入します。
- 「 プロット」>「検定のある正規性プロット」を選択し、「続行」>「OK」>選択します。サンプルサイズが50より大きい場合は、Kolmogorov-Smirnov検定のp値を参照してください。有意なp値は、データが正規分布している帰無仮説を棄却します。
- ノンパラメトリック変数のマンホイットニーU検定を実行して、グループ間の有意差を検定します。
- 「設定」>「ノンパラメトリック検定>解析」を選択し>「検定」を選択し、「>Mann-Whitney U (2 samples)」>「検定のカスタマイズ」を選択します。
- [フィールド] に移動し、連続変数を [テスト フィールド] フィールドに挿入します。
- CBG または HbA1c のカテゴリ グループを [実行] フィールドに挿入>。
- カテゴリ変数のカイ二乗検定を実行して、グループ間の有意差を検定します。
- 「クロス集計>統計>>「カイ二乗」>「Continue」>「Analyze Descriptive statistics」を選択します。
- [セル表示] を選択します。[カウント] フィールドで [観察] を選択し、[パーセンテージ] フィールドで [列] を選択します。次に、[続行] を選択します。
- カテゴリ変数をフィールド 行 に挿入し、CBG または HbA1c のカテゴリ グループをフィールド 列 > OK に挿入します。
- 連続従属変数をバイナリ グループに変換して、ロジスティック回帰に備えます。
- 「Transform > Recode into Different Variables」を選択し、「Input Variables」フィールド>「Output Variables」フィールドに連続変数を挿入します。
- 新しい変数名を [名前] フィールドに挿入します。[ ラベル] > [古い値と新しい値の変更] フィールドに新しいラベルを挿入>。
- カットオフポイントのしきい値を下回る値を Range の LOWEST through value に挿入し、これが良好な結果を示している場合は Value の New Value フィールドで 0 とペアにします。
- [追加] を選択し> [範囲] フィールドにカットオフ ポイントを挿入し、[新しい値] のフィールド > [追加] > [続行] > [OK] のフィールドとペアにします。
- 従属変数のカットオフポイント:
- KOOS疼痛領域 <86.1%、症状領域 <85.7%、日常生活動作領域 <86.8%、スポーツ領域 <85.0%、生活の質領域 < 87.5%
- 不良HGS:オス<28kg、メス<18kg
- 貧弱なタグボート > 8.00 秒
- 歩行速度の悪さ < 1.13 ms-1
- 貧弱な 5TSTS >12.80 秒
- 身体活動量が少ない、IPAQ MET < 3000
- 中等度から重度の X 線写真 KOA、ケルグレン、およびローレンス グレーディング スケール > 2
- 高IL-1β> 11.9 pg/mL
- 高IL-4 > 5 pg/mL
- 高CRP>8 ng/mL
- 高年齢>900 ng / L
- 高NF-κB>3 ng/mL - 重ロジスティック回帰を実行して、オッズ比を取得します。有意な参加者の特性に基づいて交絡因子を使用してロジスティックモデルを調整します。
- 「>回帰の分析」>「バイナリ・ロジスティック」を選択します。バイナリ従属変数を Dependent フィールドに挿入します。
- CBG または HbA1c 変数を「 共変量」フィールドに挿入します。
- 「カテゴリー」を選択し、カテゴリー変数を「カテゴリー共変量」フィールドに移します。次に、「参照カテゴリ」として「First > Change」を選択し、「Continue」>選択します。
- 「オプション > CI for exp(B): 95%, > Continue > OK] を選択します。
- 調整されたモデルについてもこの手順を繰り返しますが、有意な交絡因子を「 共変量」フィールドに追加します。
- 変数は、連続変数の場合は平均値 (標準偏差)、ノンパラメトリック テストを使用する場合は中央値 (四分位範囲)、カテゴリ変数の場合は数値 (パーセンテージ) として表示します。奇数比(OR)と95%信頼区間(CI)を報告し、0.05未満のp値を統計的に有意であるとラベル付けします。
結果
参加者の特徴
表1は、FPBSとHbA1cの血糖状態に応じた参加者の特徴をまとめたものです。 図1 は、変数の選択基準に基づいて、各ステージに含まれる参加者の総数を示しています。合計300人の募集参加者のうち、FPBSについては254人から毛細血管血糖値サンプリングが取得され、HbA1cについては93人から静脈血サンプリングが取得されました。254の毛細血管サンプルのうち、45(17.7%)が高血糖の基準を満たしていました。一方、93の静脈サンプルのうち、42(45.2%)が血糖コントロール不良の基準を満たしていました。参加者の平均年齢は、FPBSが利用可能な参加者で65.98歳から5.41歳±、HbA1cが利用可能な参加者で66.41歳から6.02歳±でした。CBGに基づくと、血糖コントロールが良好なグループと比較して、血糖コントロールが良好なグループと高血糖グループの間で、民族性、教育レベル、BMI、および慢性腎臓病に有意差が認められましたが、HbA1cに基づく血糖コントロールが良好なグループと比較して、血糖コントロールが良好なグループではBMIのみが有意に高かった(p < 0.05)。さらに、継続的な抗糖尿病薬を投与されている参加者の割合は、CBG(p < 0.001)とHbA1c(p < 0.001)の両方で、2つのグループ間で有意に異なっていました(表1)。
変形性膝関節症の症状、身体能力、身体活動レベル、X線撮影の重症度、および正常血糖群と高血糖群の間の炎症の比較
図2は、主要な変数間の関係を示す相関行列を示し、潜在的な相互依存性についての洞察を提供します。Mann Whitney Uを用いた正常血糖群と高血糖群のKOOSドメインスコアの比較により、疼痛(p = 0.008)と症状(p = 0.017)のドメインスコアに差が明らかになった。また、5STSTと血糖状態(p=0.015)、血糖コントロール(p=0.002)との間にも有意差が認められました(表2)。
毛細血管血糖サンプリングに同意した18人の参加者は、静脈血サンプルから検査マーカーを測定し、そのうち高血糖症は2人だけでした。したがって、統計的な結論を出すことは不可能でした。HbA1cを測定した合計30人の個人について、検査マーカーが利用可能でした:18人は血糖コントロールが不良で、12人は血糖コントロールが良好でした。血糖対照群は、血清AGEレベル(p = 0.022)で有意に異なっていました(表2)。
重ロジスティック回帰分析
重ロジスティック回帰モデルを使用して、血糖状態と血糖コントロールとの関連をKOAの重症度、身体能力、身体活動、X線写真の重症度、および検査マーカーと関連付けて評価しました。交絡効果を除外するために、民族性、教育レベル、慢性腎臓病の存在、およびBMIを未調整の血糖状態モデルに、BMIを未調整の血糖コントロールモデルに共変量を追加することにより、調整済みモデルを開発した。2回目の調整を加えた調整済みモデル2は、両方の交絡因子リストに抗糖尿病薬を追加することで適用した。
KOOSの5つの領域から、疼痛(OR = 3.56、95%CI = 1.40、9.09)、症状(OR = 2.77、95%CI = 1.21、6.32)、およびスポーツ(OR = 0.27、95%CI = 0.10、0.72)は血糖状態のみと有意に関連していたが、これは、スポーツ領域(OR = 0.19、95%CI = 0.04、0.85)を除く潜在的な交絡因子の調整後に無効になった(表3).ADLドメインのスコアは、血糖状態群間で有意な変動は報告されませんでした。身体パフォーマンステストの中で、5STSTのみが血糖状態と有意に関連していることがわかりました(OR = 3.22、95%CI = 1.62、6.39)。しかし、協会は調整に耐えられませんでした。歩行速度(OR = 2.46、95%CI = 1.05、5.78)と5STST(OR = 3.83、95%CI = 1.10、13.35)はどちらも血糖コントロールと関連していたが、BMI(歩行速度(OR = 2.01、95%CI = 0.82、4.88)および5STST(OR = 3.08、95%CI = 0.85、11.13))の調整後に関連性が減衰した(表3)。
ロジスティック回帰は、血糖コントロールのみによる検査マーカーに対して実施されました。AGEと血糖コントロール(OR = 0.19、95%CI = 0.04、0.94)との間の大まかな関連は、BMI調整後(OR = 0.20、95%CI = 0.04、1.09)で有意性を失った(表3)。同様に、KOAのX線写真による証拠は、BMIの調整前に血糖コントロールと有意に関連していました(OR = 4.12、95%CI = 1.33、12.78)。身体活動レベルは、血糖状態と血糖コントロールとの間に有意な関連性を報告しませんでした(表3)。
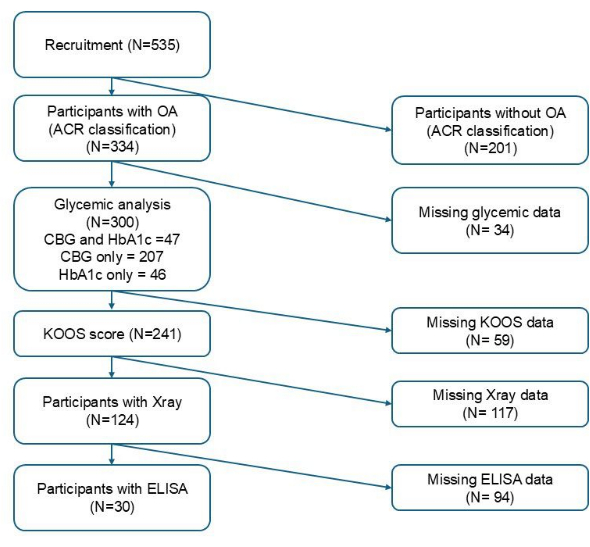
図1:参加者募集のフロー図。この図の拡大版を表示するには、ここをクリックしてください。
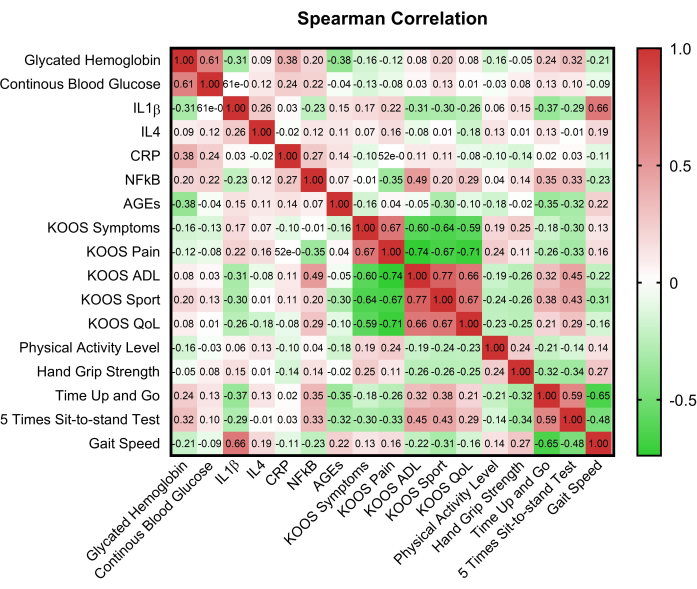
図2:主要な変数の相関行列。 HbA1c:糖化ヘモグロビンA1C;CBG:毛細血管血糖;KOOS:膝の怪我と変形性関節症の結果スコア。ADL:日常生活動作;QoL:生活の質;CRP:C反応性タンパク質;AGEs:終末糖化産物;IL-1β:インターロイキン-1β;IL-4:インターロイキン-4;NF-κB:核因子-κB。 この図の拡大版を表示するには、ここをクリックしてください。
表1:参加者の特徴。p値は、表の連続変数のMann-Whitney U検定で取得され、カテゴリ変数はグループ間のカイ2乗で分析されました。アスタリスク '*' は、α 値 0.05 <有意性を示します。略語:CBG:毛細血管血糖;HbA1c:糖化ヘモグロビンA1C;IQR:四分位範囲。N: ケースの数。 この表をダウンロードするには、ここをクリックしてください。
表2: 変形性膝関節症の症状、身体能力、身体活動レベル、X線撮影の重症度、および炎症の比較 真血糖グループと高血糖グループ。p値は、表の変数のMann-Whitney U検定で取得されました。アスタリスク '*' は、α 値 0.05 <有意性を示します。略語:IQR:四分位範囲。N: ケースの数。HbA1c:糖化ヘモグロビンA1C;KOOS:膝の怪我と変形性関節症の結果スコア。ADL:日常生活動作;QoL:生活の質;IPAQ:国際身体活動アンケート;MET:代謝当量タスク;HGS:ハンドグリップ強度;TUG:タイミングアップアンドゴー。5TSTS:5回のシット・トゥ・スタンド。ELISA:酵素結合免疫吸着アッセイ。CRP:C反応性タンパク質;AGEs:終末糖化産物;IL-1β:インターロイキン-1β;IL-4:インターロイキン-4;NF-κB:核因子-κB。 この表をダウンロードするには、ここをクリックしてください。
表3:血糖状態とコントロールに応じた重ロジスティック回帰分析。 調整されたモデル 1: 毛細血管血糖は、民族性、教育レベル、慢性腎臓病、およびボディマス指数に合わせて調整され、HbA1c はボディマス指数に合わせて調整されます。調整済みモデル 2: 交絡因子調整に抗糖尿病薬を追加した調整済みモデル 1。毛細血管血糖値とHbA1cは、各パラメータの独立変数としてテストされました。アスタリスク '*' は、α 値 0.05 <有意性を示します。略語:IPAQ:International Physical Activity Questionnaires;MET:代謝当量タスク;ELISA:酵素結合免疫吸着アッセイ。CRP:C反応性タンパク質;AGEs:終末糖化産物;IL-1β:インターロイキン-1β;IL-4:インターロイキン-4;NF-κB:核因子-κB;UTC: 計算できません。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
静脈採血は、結果の精度の点で、毛細血管血サンプリングよりも臨床検査に好まれることがよくあります29。HbA1cは、糖尿病の合併症、安定した化学的性質、および十分に標準化された臨床検査と強く関連しています。HbA1cは3ヶ月間の血糖コントロールを反映しているため、空腹時サンプルは必要ありませんが、1回限りの毛細血管採血は、最近の食事のタイミングと内容に影響される一点血糖状態を反映する可能性があります。ただし、どちらの血糖評価にも長所と短所があります。毛細血管血糖の結果は、微小循環障害、低血圧、重度の脱水症、浮腫、糖尿病性ケトアシドーシス、および市販の血糖値計と使用されるテストストリップの機能によって影響を受ける30。それにもかかわらず、毛細血管採血は即時の結果を提供し、より高いアクセス性を提供し、急性血糖状態を捕捉する可能性があります。これにより、さまざまな研究ニーズに対応し、リソースの少ない環境での研究能力が向上する可能性があります。
この研究では、下肢の筋力、放射線学的重症度、および検査マーカーと血糖コントロールとの関連は、肥満のマーカーであるBMIによって交絡されました。同様に、血糖状態とKOOS疼痛および症状との関連は、BMIの交絡効果に部分的に起因し、下肢の筋力との関連は抗糖尿病薬によって媒介されました。抗糖尿病薬は、筋肉量と筋力の両方に影響を与えることも以前にわかっています31,32。一方、KOA患者の血糖状態が悪いことは、スポーツやレクリエーションの機能向上と独立して関連していました。抗糖尿病薬の交絡を調整した後、KOOSスポーツおよびレクリエーション機能領域で重要性が回復したことは、治療が参加者の敏捷性と機能の主観的評価に対する血糖状態の影響を覆い隠した可能性があることを示唆しています。これは、臨床試験でメトホルミン、メロキシカム、およびピオグリタゾンを投与した後のKOOSスコアの改善と一致しています33。それにもかかわらず、HbA1cとは対照的に、血糖状態は短期的なグルコーススパイクを反映している可能性があり、機能制限に悪影響を与える可能性が低く、反応のスコアが高くなります。
以前の研究では、KOOSドメインスコアが血糖コントロールと負の相関があることもわかっています7。同様に、HbA1c は、人工膝関節全置換術を受ける個人の KOOS 疼痛領域スコアを有意に予測します。ただし、膝関節全置換術を選択した人の耐え難い痛みの存在も考慮に入れる必要があります34,35。毛細血管血糖のスナップショット測定値は、ある時点での血糖状態を反映し、一定期間の血糖コントロールを考慮していないため、KOOSスコアと関連付けられない可能性がある36。しかし、高血糖と教育レベル、民族性、慢性腎臓病、およびBMIとの関連は、ランダムな毛細血管グルコース検査が血糖コントロールを反映していることを示唆しています。さらに、膝の自己管理、ライフスタイル、および民族性の影響を受ける食物摂取に関する知識も、KOAの痛みと症状に影響を与える可能性があります37,38,39。糖尿病患者の慢性腎臓病は、通常、微小血管疾患の存在の指標であり、これは血糖コントロール不良の長期合併症である40,41。BMIの増加は、インスリン抵抗性との確立された関連に加えて、膝関節への機械的負荷の増加につながり、したがって、血糖コントロールに重要な役割を果たします42。血糖コントロールと放射線学的KOA重症度との関係に対するBMIの交絡効果は、肥満とインスリン抵抗性との関係、および膝関節43への体重誘発性機械的負荷を反映している可能性がある。以前の研究では、インスリン治療が骨棘形成に対する保護につながることが示唆されており、血糖コントロールの改善がKOAの構造変化の減少につながる可能性があることが示唆されています44。ELISAマーカーを調べると、AGEを形成するコラーゲンの非酵素的修飾は不可逆的であり、累積高血糖を反映しています45。これは、この研究における血糖コントロールと血糖状態ではないとの関係を説明する可能性があります46。BMI調整後の関連性の減少は、他の研究でも見られた47。
プロトコルには、アンケート管理中のステップやステップの説明など、いくつかの重要なステップが概説されています。研究者は、認知機能の低下の可能性による高齢者の参加者の理解に注意する必要があります。指示は、混乱を避けるために、明確で素人の言葉で書くべきです。採血中、参加者は合併症のリスクについて説明を受け、侵襲的であるため、手順の前に同意を得る必要があります。血液遠心分離後、ELISAアッセイ48でタンパク質の分解とシグナル損失を引き起こす凍結融解プロセスの繰り返しを防ぐために、凍結する前に血清サンプルを複数の微量遠心チューブに分注する必要があります。ELISAの段階的な手順はメーカーによって異なるため、マニュアルをよく読み、研究サンプル48に従ってインキュベーション時間、希釈、および温度を最適化することが重要です。
この研究の限界には、食生活や遺伝的素因などの測定されていない交絡因子の存在が含まれます。さらに、サンプル収集はクアラルンプールとセランゴール地域に限定されており、ライフスタイルや医療へのアクセスが血糖状態やコントロールに与える影響を考慮するために、異なる集団間のばらつきを捉えていない可能性があります。それ以上に、KOOSは、遡及的な自己申告アンケートとして、本質的に主観的です。膝の症状と機能の将来の評価には、潜在的なバイアスを軽減するための生体力学的評価が組み込まれる可能性があります。糖尿病のKOAの参加者の身体能力をよりよく反映するために、将来の研究方法論で繰り返し測定を得ることができます。炎症メディエーターに関しては、この研究では5つのバイオマーカーのみを測定しましたが、より広範なプロファイリングにより、根本的なメカニズムをより適切にマッピングできます。サンプルサイズが小さいことも懸念事項の1つである可能性があります。総サンプル集団から毛細血管血糖データが欠落していたのは、コミュニティサイトでのデータ収集中にテストストリップが不足し、参加者が2回目の訪問に参加するのをためらったためです。一方、HbA1c検査のための静脈血採取は、膝のX線撮影と同時に2回目の来院時に行われ、参加者に追加の時間的コミットメントが必要でした。サンプルサイズは、オッズ比(OR = 2.010、95%CI 1.003、4.026)を得るための80%の検出力に基づいて計算され、これは公開された文献から特定され、推定サンプルサイズは72:49でした。この研究では、空腹時血糖値とランダム血糖の両方を1つの変数、つまりCBGにグループ化しました。しかし、この知見は感度の低下を示唆しており、個々の測定の利点が別の測定によって隠される可能性があることが示唆されました。したがって、空腹時血糖とランダム血糖をそれぞれ行うことにより、血糖状態とパラメーターとの関連を分析することが望ましいです。今後の研究では、慢性高血糖がKOAに及ぼす影響を判断するために、長期的な血糖傾向を評価する必要があります。
この研究に関与するプロトコルは、アンケート、身体検査、血糖値測定、および ELISA アッセイを使用したデータ収集のために、縦断的研究または無作為化臨床試験用に変更できます。血糖評価方法、毛細血管採血、および静脈採血は、調査するパラメーターと研究の性質に基づいて選択する必要があります。心血管疾患、網膜症、末梢神経障害、および糖尿病性腎疾患の危険因子として糖尿病があるため、血糖評価法は研究方法論に採用することが不可欠であることは否定できません5,50。その上、糖尿病管理の改善と平均余命の延長は、癌、肝疾患、機能障害および認知障害などの新たな糖尿病合併症の舞台を設定しています51。これらは、今後の研究動向で予想されます。
開示事項
すべての著者は、宣言すべき利益相反はありません。
謝辞
この研究は、マレーシア高等教育省のFundamental Research Grant Scheme(助成金/授与番号:FRGS/1/2021/SKK0/UKM/02/15)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Butterfly needle | BD Vacutainer | 367282 | |
| G*Power 3.1 | Heinrich-Heine-University | https://www.psychologie.hhu.de/arbeitsgruppen/allgemeine-psychologie-und-arbeitspsychologie/gpower | Heinrich-Heine-University, Düsseldorf |
| Glucometer and test strips | Contour plus | https://www.diabetes.ascensia.my/en/products/contour-plus/ | Basel, Switzerland |
| Human CRP(C-Reactive Protein) ELISA Kit | Elabscience | E-EL-H0043-96T | ELISA kit |
| Human IL-1β(Interleukin 1 Beta) ELISA Kit | Elabscience | E-EL-H0149-96T | ELISA kit |
| Human IL-4(Interleukin 4) ELISA Kit | Elabscience | E-EL-H0101-96T | ELISA kit |
| Human NF-κB-p105 subunit | Bioassay Technology Laboratory | E0003Hu | ELISA kit |
| Human NF-κBp105(Nuclear factor NF-kappa-B p105 subunit) | Elabscience | E-EL-H1386-96T | ELISA kit |
| Manual hand dynamometer | Jamar | 5030J1 | Warrenville, Illinois, USA |
| Portable Body Composition Analyzer | InBody ASIA | https://inbodyasia.com/products/inbody-270/ | Inbody 270, Cheonan, Chungcheongnam-do |
| Portable stadiometer | Seca | 213 1821 009 | SECA 213, Hamburg, Germany |
参考文献
- Allen, K. D., Thoma, L. M., Golightly, Y. M. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 30 (2), 184-195 (2022).
- Mat, S., et al. Factors influencing quality of life among older persons living with osteoarthritis using 3 different definitions. Top Geriatr Rehabil. 38 (1), 26-34 (2022).
- Berenbaum, F. Diabetes-induced osteoarthritis: From a new paradigm to a new phenotype. Ann Rheum Dis. 70 (8), 1354 (2011).
- Institute for Public Health. . National health and morbidity survey (NHMS) 2023: Non-communicable diseases and healthcare demand - key findings. , (2024).
- Harding, J. L., Pavkov, M. E., Magliano, D. J., Shaw, J. E., Gregg, E. W. Global trends in diabetes complications: A review of current evidence. Diabetologia. 62 (1), 3-16 (2019).
- Eitner, A., Culvenor, A. G., Wirth, W., Schaible, H. -. G., Eckstein, F. Impact of diabetes mellitus on knee osteoarthritis pain and physical and mental status: Data from the osteoarthritis initiative. Arthritis Care Res (Hoboken). 73 (4), 540-548 (2021).
- Aykan, S. A., Kaymaz, S. The association between diabetes mellitus and functionality in knee osteoarthritis: A cross-sectional study. J Health Sci Med. 5 (4), 1114-1118 (2022).
- Alenazi, A. M., Alqahtani, B. A. Diabetes is associated with longitudinal declined physical performance measures in persons with or at risk of knee osteoarthritis: Data from the osteoarthritis initiative. Eur J Phys Rehabil Med. 60 (3), 496-504 (2024).
- Neumann, J., et al. Diabetics show accelerated progression of knee cartilage and meniscal lesions: Data from the osteoarthritis initiative. Skeletal Radiol. 48 (6), 919-930 (2019).
- Courties, A., Gualillo, O., Berenbaum, F., Sellam, J. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthritis Cartilage. 23 (11), 1955-1965 (2015).
- Wei, G., et al. Risk of metabolic abnormalities in osteoarthritis: A new perspective to understand its pathological mechanisms. Bone Res. 11 (1), 63 (2023).
- Sriwimol, W., Choosongsang, P., Choosongsang, P., Petkliang, W., Treerut, P. Associations between hba1c-derived estimated average glucose and fasting plasma glucose in patients with normal and abnormal hemoglobin patterns. Scand J Clin Lab Invest. 82 (3), 192-198 (2022).
- Papachristoforou, E., Lambadiari, V., Maratou, E., Makrilakis, K. Association of glycemic indices (hyperglycemia, glucose variability, and hypoglycemia) with oxidative stress and diabetic complications. J Diabetes Res. 2020 (1), 7489795 (2020).
- Matsushita, Y., et al. A comparison of the association of fasting plasma glucose and hba1c levels with diabetic retinopathy in japanese men. J Diabetes Res. 2020 (1), 3214676 (2020).
- Baig, M. A. Comparative evaluation of efficiency of hba1c, fasting & post prandial blood glucose levels, in the diagnosis of type-2 diabetes mellitus and its prognostic outcome. Int J Res Med Sci. 3 (11), 3245-3249 (2015).
- Altman, R., et al. Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthritis Rheum. 29 (8), 1039-1049 (1986).
- Kang, H. Sample size determination and power analysis using the G* power software. J Educ Eval Health Prof. 18, (2021).
- Roos, E. M., Lohmander, L. S. The knee injury and osteoarthritis outcome score (koos): From joint injury to osteoarthritis. Health Qual Life Outcomes. 1, 64 (2003).
- Ipaq Research Committee. . Guidelines for data processing and analysis of the international physical activity questionnaire (IPAQ)-short and long forms. , (2005).
- Perissinotto, E., Pisent, C., Sergi, G., Grigoletto, F., Enzi, G. Anthropometric measurements in the elderly: Age and gender differences. Br J Nutr. 87 (2), 177-186 (2002).
- Sun, Y. -. S., et al. Calf circumference as a novel tool for risk of disability of the elderly population. Sci Rep. 7 (1), 16359 (2017).
- Chen, L. -. K., et al. Asian working group for sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment. J Am Med Dir Assoc. 21 (3), 300-307 (2020).
- Samah, Z. A., et al. Discriminative and predictive ability of physical performance measures in identifying fall risk among older adults. Sains Malays. 47 (11), 2769-2776 (2018).
- Bohannon, R. W., Williams Andrews, A. Normal walking speed: A descriptive meta-analysis. Physiotherapy. 97 (3), 182-189 (2011).
- Kim, M., Won, C. W. Cut points of chair stand test for poor physical function and its association with adverse health outcomes in community-dwelling older adults: A cross-sectional and longitudinal study. J Am Med Dir Assoc. 23 (8), 1375-1382.e3 (2022).
- Parcell, A. C., Sawyer, R. D., Tricoli, V. A., Chinevere, T. D. Minimum rest period for strength recovery during a common isokinetic testing protocol. Med Sci Sports Exerc. 34 (6), (2002).
- Kohn, M. D., Sassoon, A. A., Fernando, N. D. Classifications in brief: Kellgren-lawrence classification of osteoarthritis. Clin Orthop Relat Res. 474 (8), 1886-1893 (2016).
- Gottschalk, P. G., Dunn, J. R. Measuring parallelism, linearity, and relative potency in bioassay and immunoassay data. J Biopharm Stat. 15 (3), 437-463 (2005).
- Das, S., Swain, M., Pradhan, R. Evaluating the relationship of fasting capillary and venous blood sugar level in self-glucose monitoring device, fasting plasma glucose level and glycosylated hemoglobin (HbA1c). Nurs Care Open Access J. 1 (2), 00011 (2016).
- Bao, Y., Zhu, D. Clinical application guidelines for blood glucose monitoring in china (2022 edition). Diabetes Metab Res Rev. 38 (8), e3581 (2022).
- Wu, C. -. N., Tien, K. -. J. The impact of antidiabetic agents on sarcopenia in type 2 diabetes: A literature review. J Diabetes Res. 2020 (1), 9368583 (2020).
- Kalaitzoglou, E., Fowlkes, J. L., Popescu, I., Thrailkill, K. M. Diabetes pharmacotherapy and effects on the musculoskeletal system. Diabetes Metab Res Rev. 35 (2), e3100 (2019).
- Mohammed, M. M., Al-Shamma, K. J., Jassim, N. A. Evaluation of the clinical use of metformin or pioglitazone in combination with meloxicam in patients with knee osteoarthritis; using knee injury and osteoarthritis outcome score. Iraqi J Pharm Sci. 23 (2), 13-23 (2014).
- Vervullens, S., et al. Preoperative glycaemic control, number of pain locations, structural knee damage, self-reported central sensitisation, satisfaction and personal control are predictive of 1-year postoperative pain, and change in pain from pre- to 1-year posttotal knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. , (2024).
- Eitner, A., et al. Pain sensation in human osteoarthritic knee joints is strongly enhanced by diabetes mellitus. Pain. 158 (9), 1743-1753 (2017).
- Li, H., George, D. M., Jaarsma, R. L., Mao, X. Metabolic syndrome and components exacerbate osteoarthritis symptoms of pain, depression and reduced knee function. Ann Transl Med. 4 (7), 133 (2016).
- Khachian, A., Seyedoshohadaei, M., Haghani, H., Amiri, F. Effect of self-management program on outcome of adult knee osteoarthritis. Int J Orthop Trauma Nurs. 39, 100797 (2020).
- Mat, S., et al. Ethnic differences in the prevalence, socioeconomic and health related risk factors of knee pain and osteoarthritis symptoms in older malaysians. PLoS One. 14 (11), e0225075 (2019).
- Cruz-Almeida, Y., et al. Racial and ethnic differences in older adults with knee osteoarthritis. Arthritis Rheumatol. 66 (7), 1800-1810 (2014).
- Kalantar-Zadeh, K., et al. Patient-centred approaches for the management of unpleasant symptoms in kidney disease. Nat Rev Nephrol. 18 (3), 185-198 (2022).
- Hsu, H. -. J., et al. Factors associated with chronic musculoskeletal pain in patients with chronic kidney disease. BMC Nephrol. 15 (1), 6 (2014).
- Larsen, P., Engberg, A. S., Motahar, I., Ostgaard, S. E., Elsoe, R. Obesity influences the knee injury and osteoarthritis outcome score. Joints. 7 (01), 008-012 (2019).
- Solanki, P., et al. Association between weight gain and knee osteoarthritis: A systematic review. Osteoarthritis Cartilage. 31 (3), 300-316 (2023).
- Al-Jarallah, K., Shehab, D., Abdella, N., Al Mohamedy, H., Abraham, M. Knee osteoarthritis in type 2 diabetes mellitus: Does insulin therapy retard osteophyte formation. Med Princ Pract. 25 (1), 12-17 (2016).
- Suzuki, A., Yabu, A., Nakamura, H. Advanced glycation end products in musculoskeletal system and disorders. Methods. 203, 179-186 (2022).
- Wang, M., Hng, T. M. Hba1c: More than just a number. Aust J Gen Pract. 50 (9), 628-632 (2021).
- Kalousova, M., Skrha, J., Zima, T. Advanced glycation end-products and advanced oxidation protein products in patients with diabetes mellitus. Physiol Res. 51 (6), 597-604 (2002).
- Shah, K., Maghsoudlou, P. Enzyme-linked immunosorbent assay (elisa): The basics. Br J Hosp Med. 77 (7), C98-C101 (2016).
- Nakanishi, S., et al. The impact of hand strength on hba1c, body mass index and body composition by group according to sedentary behaviour: Cross-sectional study in japanese patients with type 2 diabetes mellitus. Malays J Med Sci. 31 (3), 185-193 (2024).
- Joseph, J. J., et al. Comprehensive management of cardiovascular risk factors for adults with type 2 diabetes: A scientific statement from the american heart association. Circulation. 145 (9), e722-e759 (2022).
- Tomic, D., Shaw, J. E., Magliano, D. J. The burden and risks of emerging complications of diabetes mellitus. Nat Rev Endocrinol. 18 (9), 525-539 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved