Method Article
50 岁及以上糖尿病患者膝骨关节炎症状对身体、放射学和炎症标志物的血糖影响
摘要
在这里,我们提出了一种使用毛细血管血糖 (CBG) 和糖化血红蛋白 A1C (HbA1C) 水平评估血糖控制的方案。本研究调查了高血糖对老年糖尿病患者膝骨关节炎 (KOA) 症状、身体机能、身体活动水平、放射学严重程度和炎症的影响。
摘要
本研究探讨了高血糖对老年人膝骨关节炎 (KOA) 相关症状、身体机能、身体活动水平、影像学严重程度和炎症的影响。长期的高血糖状态会导致晚期糖基化终末产物 (AGE) 的形成,从而使 KOA 症状恶化。毛细血管血糖 (CBG) 和糖化血红蛋白 A1C (HbA1C) 水平通常用于实验室血糖评估测试,具有明显的优点和局限性。参与者根据他们的 CBG 和 HbA1C 水平分为良好和差的血糖对照组。使用膝关节损伤和骨关节炎结果评分 (KOOS) 和国际身体活动问卷测量 KOA 临床严重程度和体力活动。通过握力、步态速度、时间起跑 (TUG) 和 5 次坐立 (5STST) 来测量身体机能。行膝关节 X 线检查,血清酶联免疫吸附测定 (ELISA) 分析 IL-1β 、 IL-4 、 CRP 、 NF-κB 和 AGE。将 300 名招募的参与者 (平均年龄 [SD] = 66.40 岁 (5.938) 患有 CBG,空腹血糖> 7.0 mmol/L 和随机血糖 > 11.1 mmol/L,(N = 254) 与 KOOS 疼痛 (p=0.008) 和症状 (p=0.017) 和 5STST (p=0.015) 进行比较;而 HbA1c > 6.3% (N = 93) 与 5STST (p=0.002) 进行比较, 和基于 Mann Whitney U 检验的 AGEs (p=0.022)。Logistic 回归显示血糖控制与下肢肌肉力量、放射学严重程度、实验室标志物以及血糖状态与 KOOS 疼痛和症状之间的显着关联。然而,在调整 BMI 后,这些关联并不显著。调整抗糖尿病药物后,单独的低血糖状态与运动和娱乐领域的较好功能相关,表明抗炎和镇痛作用掩盖了高血糖的影响。未来的研究可以探索血糖评估对膝关节功能和身体机能不佳的预测能力,同时考虑药物的影响。
引言
膝骨关节炎 (KOA) 的患病率随着年龄的增长而增加,膝关节是主要的负重关节1。KOA 通常表现为膝关节僵硬和慢性疼痛,这限制了活动能力,降低了生活质量,并增加了患心血管疾病的风险2。糖尿病也与年龄有关,会增加 KOA 发展的风险,因为葡萄糖和脂质水平升高会促进晚期糖基化终末产物 (AGE) 的形成,导致慢性关节炎症和软骨退化3。尽管有医疗保健服务,但五分之二的马来西亚糖尿病患者不知道自己的诊断,而 56% 的确诊患者未能保持良好的血糖控制4。急性高血糖可导致高血糖高渗状态,危及生命,而慢性高血糖可导致周围神经病变、肾病、视网膜病变和心血管疾病5。
周围神经病变是由于血糖控制不佳引起的微血管并发症,并导致疼痛机制改变,可能会加剧 KOA6 中的膝关节疼痛。KOA 患者患有糖尿病与膝关节活动范围缩小、膝关节功能下降、影像学变化增加和生活质量变差有关7。糖尿病对 KOA 的影响导致身体机能下降,其特征是肌肉力量和协调能力受损8。与软骨和半月板损伤相关的退行性变化的磁共振成像证据,例如关节间隙缩小和对齐不良,在糖尿病患者中似乎更为严重9。
血糖控制不佳与膝关节滑液中退行性酶和炎症因子上调有关。糖尿病中细胞因子和蛋白质升高,如 IL-1β、IL-4、IL-6、核因子-κB (NF-κB) 和肿瘤坏死因子-α (TNF-α),与 KOA 病理生理学有关10,11。而在软骨细胞中,有缺陷的葡萄糖转运蛋白导致糖酵解、多元醇途径、蛋白激酶 C 和戊糖途径上调,最终导致活性氧的高产量10。
空腹和随机血糖提供了对当前血糖状态以及与胰岛素抵抗相关的葡萄糖处理能力的估计12。糖化血红蛋白 A (HbA1c) 是衡量过去三个月血糖控制的指标。然而,这并没有提供剧烈波动的细节13。毛细血管血糖测试可在床旁或诊所即时评估血糖状态,这导致了关于它们在确定血糖控制和预测并发症风险方面的价值的争论14,15。因此,本研究旨在阐明 HbA1c 测定的血糖控制和毛细血管血糖 (CBG) 测定的血糖升高与 KOA 个体膝关节损伤和骨关节炎结果评分 (KOOS)、身体机能、体力活动水平、影像学严重程度和炎症标志物之间的关联。
研究方案
该研究方案符合赫尔辛基宣言,并获得了马来西亚国民大学伦理委员会的批准(参考编号:JEP-2022-001)。
1. 参与者招募
- 通过便利抽样,从吉隆坡和雪兰莪州 50 岁及以上的社区居住的 KOA 成年人中选择研究人群。招募了来自老年人组织以及糖尿病和骨科诊所的参与者。
注意:KOA 的存在定义为自我报告的医生诊断的 KOA 或符合美国风湿病学会 (ACR) 临床检查标准16 的 KOA。 - 排除被收容的老年人或患有严重心理障碍和 1 型糖尿病的人。
- 通过参考来自类似设置的关于横断面队列的已发表文献,确定效应大小,在本研究中为奇数比。使用 G*Power 3.117 计算样本量,这将提供 80% 的功效来拒绝原假设。
- 在数据收集之前解释研究目标并获得知情同意。
2. 数据收集 - 问卷
- 管理问卷,包括社会人口统计学、KOOS18 和国际身体活动问卷 (IPAQ)19。
- 计算从 42 个项目中得出的五个 KOOS 领域中每个领域的总分,并将分数转换为 0-100 百分比等级,其中 0 表示没有问题,100 表示每个领域存在极端问题。
- 考虑每个域的标准,通过将以分钟为单位的时间乘以每周的天数来计算 IPAQ 结构域的任务代谢当量 (MET)。
注意:指示身体活动水平的总 MET 为 3.3(步行活动 MET)、+ 4(中等强度活动 MET)、+ 8(剧烈强度 MET)。
3. 数据收集 - 身体表现
- 用测距仪测量高度。使用身体成分分析仪获取体重和体重指数 (BMI)。确保参与者脱掉厚重的衣服、金属配饰和鞋子。
- 使用卷尺测量腰围、臀围和小腿围。记录腰围静止时脐部水平的测量值(以厘米为单位)和臀围臀部最大后突水平的测量值20。在长轴的最大尺寸处测量小腿围,参与者坐着,背部挺直,双脚放在地板上21。
- 向参与者提供有关如何进行身体机能测试的说明:握力测试 (HGS)22、计时和开始测试 (TUG)23、六米步行测试24 和五次坐立测试 (5STST)25。
- 确保性能设置没有障碍物和危险。在测试之间留出 1 分钟的标准化休息时间26.
- 执行握力测试。
- 指导参与者坐着,肩膀内收在中立位置,肘部弯曲 90°。
- 告诉他们在整个测试过程中不要进行任何快速的扭动或抽搐动作。
- 用手柄测力计测量每只手的最大力量三次,并选择以公斤为单位的最大测量值。
- 执行定时 up-and-go 测试。
- 指导参与者坐直,背部与椅背接触,手臂放在扶手上,双脚平放在地面上。
- 使用秒表记录站起来、走 3 m、掉头、走回椅子上然后坐下所需的时间。当参与者的背部与椅背失去接触时开始计时,并在参与者的背部接触椅背时立即停止计时。
- 重复两次并记录作为最终结果的最短时间(以秒为单位)。
- 评估步态速度。
- 测量一条 10 m 的人行道,并在距离人行道两端 2 m 处用胶带放置标记,以指示测量开始和结束的点。
- 让参与者以正常速度沿着 10 m 的人行道行走。
- 参与者越过前 2 m 后立即启动计时器,并在 8 m 线处停止计时器。
- 使用速度 (m/s) 公式计算步态速度,其中 6 m 除以以秒为单位的时间。
- 执行 5 次坐姿-站姿测试。
- 指导参与者以平衡速度以 5 倍的速度站起来和坐下。
- 记录完成 5 次重复所需的时间,并从 3 次试验中选择最低时间(以秒为单位)。
4. 数据收集 - 膝关节 X 光
- 为参与者设定预约日期和时间,让他们使用站立前后负重视图前往医院进行双膝放射学检查。
- 将放射学图像提交给放射科医生,放射科医生将确定并为每个膝关节分配 Kellgren 和 Lawrence 分级27.
注:分类系统分为 0 到 4 级,等级越高表示 KOA 的严重程度越高,具体取决于以下特征:骨赘形成、关节周围听小骨、骨端形状改变、关节间隙变窄和软骨下硬化。 - 记录分配的等级,确保将分数分配给正确的膝关节。
5. 数据收集 - 用于血糖状态评估的毛细血管血采集
- 洗手并戴上外科手套。用酒精棉签清洁参与者的手指,并让手指风干。
- 通过插入试纸准备血糖仪。
- 选择柳叶刀装置并确保其未使用且密封。
- 打破柳叶刀的密封,用新的柳叶刀装置刺破手指,挤压手指产生一小滴血,然后用试纸触摸血滴。
- 使用控制溶液进行质量保证,将溶液滴在试纸上,并根据制造商检查它是否在预期范围内。
- 记录血糖仪显示的血糖水平。询问参与者他们的最后一餐是什么时候,并记录是否在采样前 8 小时以上服用。
注意:空腹血糖要求参与者在此程序前至少禁食 8 小时,而随机血糖则不需要。 - 将柳叶刀安全地丢弃到锐器箱中,并为参与者提供棉签,以对手指的穿刺区域施加压力以确保止血。
- 手术后洗手。清理任何溢出的血液。
6. 数据收集 - 用于血糖控制评估的静脉采血
- 洗手并戴上外科手套。
- 从右侧或左侧肘前窝确定合适的静脉。将止血带系在所选手臂的上臂上,并通过触诊确定合适的静脉。
- 用酒精棉签清洁所选静脉周围的皮肤,然后风干。
- 用 23 G 蝶形针和两瓶 6 mL 普通血管采集静脉血样。用参与者的唯一识别码标记试管。
- 安全地丢弃锐器和医疗废物并洗手。
- 将血液样本运送到装有冰袋的冷却器中的实验室。将血液样品放入离心机中的收集管中,并以 604 x g 离心 10 分钟。
- 用微量移液器将血清分装到 1.5 mL 微量离心管中,并在 -80 °C 下储存前用日期、识别码和样品类型标记试管。
7. ELISA 检测
- 根据制造商的手册计算 ELISA 检测所需的血清体积。运行优化分析以确定最佳浓度;分别对 IL-1β、IL-4、CRP、NF-κB 和 AGEs 重复此作。
- 解冻血清并将 ELISA 试剂置于室温 (RT)。同时,标记微量离心管的标准品、样品和空白。
- 如果需要,根据制造商的说明从储备溶液中制备稀释剂、检测抗体、底物和洗涤缓冲液的工作溶液。
- 使用给定的标准稀释剂对标准品进行两倍连续稀释。每种标志物的参考标准:IL-1β = 500 pg/mL,IL-4 = 2000 pg/mL,CRP = 25 ng/mL,NF-κB = 10 ng/mL,AGEs = 4800 ng/L。标准稀释剂也可用作空白。
- 如果需要,稀释血清样品以优化分析。
- 对于 IL-1β、IL-4 和 NF-κB ELISA 测定,使用纯血清样品。对于 CRP,用参比稀释剂稀释 1000 倍。将 100 μL 样品移液到孔中并复制每个样品。
- 对于 AGEs ELISA 测定,使用 2 倍稀释的血清样品,将 40 μL 样品移液到孔中,然后复制每个样品。
- 在不同样品或试剂之间更换移液器吸头。使用多通道移液器以避免边缘效应。
- 根据制造商手册建议的时间和温度进行孵育,并在每次孵育时用新的粘合剂盖密封板。
- 对于这种夹心 ELISA,将样品和标准品孵育到预包被的孔中,然后孵育检测抗体、偶联二抗、底物,最后是终止液。按照与之前相同的顺序添加每个解决方案。
- 根据制造商的手册,在两次孵育之间使用洗涤缓冲液倾析和洗涤孔。用干净的吸水纸轻敲孔以去除洗涤缓冲液,但确保在添加下一种溶液之前孔不会变干。
- 用酶标仪在 450 nm 处读取孔。使用四参数 Logistic (4PL) 曲线进行记录和计算,这是一种绘制和确定对称 S 形校准品浓度的定量方法28。使用每个样本的平均值进行分析。
8. 统计分析
注意:使用适当的数据分析软件分析数据(此处使用 SPSS V20)。将研究人群分为两组:1) 血糖控制良好,2) 血糖控制不佳(血糖状况不佳 = 空腹血糖超过 7.0 mmol/L 或随机血糖高于 11.1 mmol/L;血糖控制不佳 = HbA1c 高于 6.3%)。
- 打开软件以根据日期、参与者的识别代码、社会人口统计变量、问卷项目和测量的参数创建变量。
- 选择 Variable view (变量视图)。在列 名称 中插入,在列 标签 中插入描述或显示名称。
- 选择 Type > Measure (度量类型)。对于编码的分类变量,匹配 Values 列中的代表性数值代码及其值。选择 Ok(确定)。
- 键入收集的数据到软件中,其中每行代表一个参与者。
- 选择 Data View(数据视图)。在数字类型的列中键入代表性数字代码,并为字符串类型键入名称或说明。
- 检查连续变量的正态性以确定参数检验假设。
- 选择 Analyze > Descriptive statistics > Explore 进行分析。将连续变量插入字段 Dependent list。
- 选择 带检验的正态性图>>继续>确定。对于大于 50 的样本数量,请参阅 Kolmogorov-Smirnov 检验中的 p 值;显著的 p 值拒绝数据呈正态分布的原假设。
- 对非参数变量运行 Mann-Whitney U 检验,以检验各组之间的显著差异。
- 选择 分析>非参数检验>设置>然后选择检验>自定义 Mann-Whitney U > (2 个样本)检验。
- 转到 Fields (字段 ) 并将连续变量插入字段 Test Fields (测试字段)。
- 将 CBG 或 HbA1c 的分类组插入到字段 Groups > Run 中。
- 对类别变量运行卡方检验,以检验各组之间的显著差异。
- 选择 分析>描述性统计量>交叉表>统计量>卡方>继续。
- 选择 Cells Display (单元格显示)。在字段 Counts 中选择 Observed ,然后在字段 Percentage 中选择 Column。然后,选择 Continue (继续)。
- 将分类变量插入字段 行 中,将 CBG 或 HbA1c 的分类组插入到字段 列>确定。
- 将连续因变量转换为二进制组,为 Logistic 回归做准备。
- 选择 Transform > Recode into Different Variables, 然后将连续变量插入到 Input Variables > Output Variables字段中。
- 在字段 Name 中插入新的变量名称。在字段 Label > Change > Old and New Values 中插入新标签。
- 在字段 Range 处插入截止点的阈值 以下,LOWEST through 值,并在字段 Value of New Value 处将其与零配对(如果这表示结果良好)。
- 选择 添加 > 在字段 Range, value though HIGHEST 处插入截点,并将其与字段 Value of New Value > Add > Continue > OK.
- 因变量的截止点:
- KOOS 疼痛领域 < 86.1%,症状领域 < 85.7%,日常生活活动领域 <86.8%,运动领域 < 85.0%,生活质量领域 < 87.5%
- 较差的 HGS:男性 < 28 公斤,女性 < 18 公斤
- 差的拖> 8.00 秒
- 步态速度差 < 1.13 ms-1
- 差 5TSTS >12.80 秒
- 体力活动少,IPAQ MET < 3000
- 中度至重度影像学 KOA、Kellgren 和 Lawrence 分级量表 > 2
- IL-1β >高 11.9 pg/mL
- IL-4 > 5 pg/mL
- CRP > 8 ng/mL
- 高龄> 900 ng/L
- NF-κB > 3 ng/mL - 运行多元 Logistic 回归以获得优势比。根据显著参与者的特征调整具有混杂因素的 logistic 模型。
- 选择 Analyze > Regression > Binary Logistic。将二进制因变量插入字段 Dependent 中。
- 将 CBG 或 HbA1c 变量插入字段 Covariates 中。
- 选择 分类 并将 分类变量转移到 分类协变量 字段。然后,选择 Reference Category (引用类别 ) 作为 First > Change (第一个更改) > Continue (继续)。
- 选择 选项 > exp(B) 的 CI):95% > 继续 > 确定。
- 对调整后的模型重复该过程,但将显著的混杂因子添加到字段 Covariates 中。
- 对于连续变量,将变量表示为平均值(标准差),如果使用非参数检验,则以中位数(四分位数范围)表示变量,对于分类变量,将变量表示为数字(百分比)。报告具有 95% 置信区间 (CI) 的比值比 (OR),并将低于 0.05 的 p 值标记为具有统计学意义。
结果
参与者的特点
表 1 根据 FPBS 和 HbA1c 的血糖状态总结了参与者的特征。 图 1 说明了基于可变纳入标准的每个阶段纳入的参与者总数。在总共 300 名招募的参与者中,从 254 名个体那里获得了毛细血管血糖采样以进行 FPBS,而从 93 名个体那里获得了静脉血采样以进行 HbA1c。在 254 个毛细血管样本中,45 个 (17.7%) 符合高血糖标准。而在 93 个静脉样本中,42 个 (45.2%) 符合血糖控制不佳的标准。有 FPBS 的参与者的平均年龄为 65.98 ± 5.41 岁,有 HbA1c 的参与者平均年龄为 66.41 ± 6.02 岁。基于 CBG 的正常血糖组和高血糖组之间在种族、教育水平、BMI 和慢性肾病方面存在显着差异,而与基于 HbA1c 的血糖控制良好的人相比,只有血糖控制不佳的人的 BMI 显着更高 (p < 0.05)。此外,两组接受持续抗糖尿病药物治疗的参与者比例在 CBG (p < 0.001) 和 HbA1c 方面分别存在显著差异 (p < 0.001)(表 1)。
膝骨关节炎症状、身体机能、体力活动水平、影像学严重程度和正常血糖组和高血糖组炎症的比较
图 2 显示了一个相关矩阵,该矩阵说明了关键变量之间的关系,从而提供了对潜在相互依赖关系的见解。使用 Mann Whitney U 比较正常血糖组和高血糖组之间的 KOOS 领域评分,揭示了疼痛 (p = 0.008) 和症状 (p = 0.017) 领域评分的差异。在 5STST 和血糖状态 (p=0.015) 以及血糖控制 (p = 0.002) 之间也观察到显着差异(表 2)。
18 名同意毛细血管血糖采样的参与者从静脉血样本中测量了实验室标志物,其中只有 2 人患有高血糖症。因此,不可能得出统计结论。共有 30 名测量了 HbA1c 的个体的实验室标志物: 18 名血糖控制不佳,12 名血糖控制良好。血糖对照组的血清 AGE 水平差异显著 (p = 0.022) (表 2)。
多元 logistic 回归分析
多元 logistic 回归模型用于评估血糖状态和血糖控制与 KOA 严重程度、身体机能、体力活动、影像学严重程度和实验室标志物之间的关联。为了排除混杂效应,通过将种族、教育水平、慢性肾病的存在和 BMI 的协变量添加到未调整的血糖状态模型中,将 BMI 添加到未调整的血糖控制模型中来开发调整后的模型。通过在两个混杂列表中添加抗糖尿病药物来应用带有第二次调整的调整模型 2。
在 KOOS 的五个领域中,疼痛 (OR = 3.56, 95% CI = 1.40, 9.09)、症状 (OR = 2.77, 95% CI = 1.21, 6.32) 和运动 (OR = 0.27, 95% CI = 0.10, 0.72) 仅与血糖状况显著相关,但在调整潜在混杂因素后,这一点被取消,运动领域除外 (OR = 0.19, 95% CI = 0.04, 0.85) (表 3).在血糖状态组中,ADL 域的评分没有显着变化。在身体机能测试中,仅发现 5STST 与血糖状态显著相关 (OR = 3.22,95% CI = 1.62,6.39);然而,该协会经不起调整。步态速度 (OR = 2.46, 95% CI = 1.05, 5.78) 和 5STST (OR = 3.83, 95% CI = 1.10, 13.35) 均与血糖控制相关,但在调整 BMI 后,相关性减弱 (步态速度 (OR = 2.01, 95% CI = 0.82, 4.88);和 5STST (OR = 3.08, 95% CI = 0.85, 11.13) (表 3)。
仅通过血糖控制对实验室标志物进行 Logistic 回归。调整 BMI 后,AGE 与血糖控制之间的粗略关联 (OR = 0.19, 95% CI = 0.04, 0.94) 失去意义 (OR = 0.20, 95% CI = 0.04, 1.09) (表 3)。同样,KOA 的影像学证据与调整 BMI 前的血糖控制显著相关 (OR = 4.12,95% CI = 1.33,12.78)。身体活动水平没有报告血糖状态与血糖控制之间有任何显着联系(表 3)。
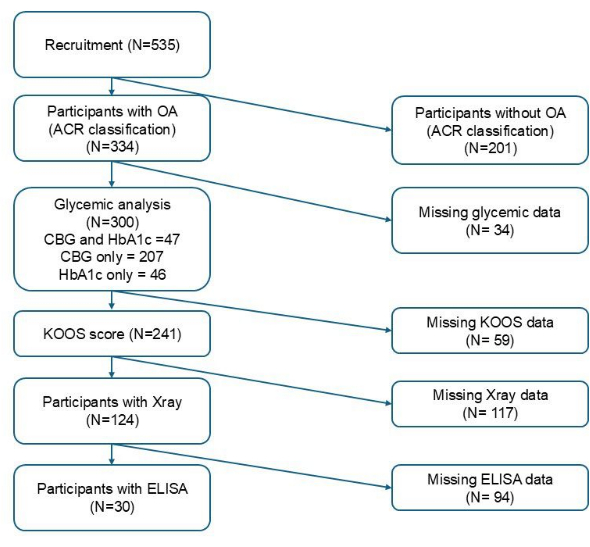
图 1:参与者招募流程图。请单击此处查看此图的较大版本。
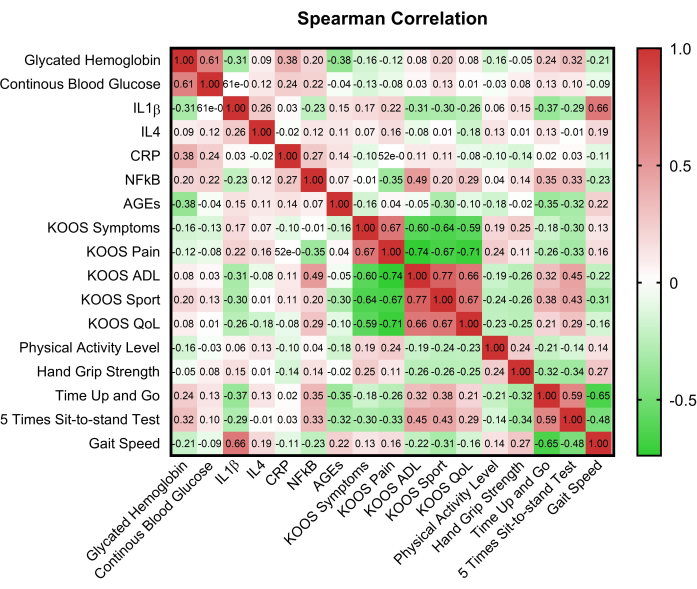
图 2:关键变量的相关矩阵。 HbA1c: 糖化血红蛋白 A1C;CBG: 毛细血管血糖;KOOS: 膝关节损伤和骨关节炎结果评分;ADL: 日常生活活动;QoL:生活质量;CRP: C 反应蛋白;AGEs: 晚期糖基化终末产物;IL-1β: 白细胞介素-1β;IL-4: 白细胞介素-4;NF-κB: 核因子-κB。 请单击此处查看此图的较大版本。
表 1:参与者的特点。使用表中连续变量的 Mann-Whitney U 检验获得 P 值,并使用组间卡方分析分类变量。星号 '*' 表示 α 值为 0.05 <显著性。缩写: CBG: 毛细血管血糖;HbA1c: 糖化血红蛋白 A1C;IQR: 四分位距;N:个案数。 请点击此处下载此表格。
表 2: 膝骨关节炎症状、身体机能、体力活动水平、放射学严重程度和正常血糖组和高血糖组之间的炎症比较。P 值是通过 Mann-Whitney U 检验对表中的变量获得的。星号 '*' 表示 α 值为 0.05 <显著性。缩写: IQR: 四分位距;N: 病例数;HbA1c: 糖化血红蛋白 A1C;KOOS: 膝关节损伤和骨关节炎结果评分;ADL: 日常生活活动;QoL:生活质量;IPAQ:国际身体活动问卷;MET:代谢等效任务;HGS: 握力;TUG:定时出发;5TSTS:五次坐姿到站姿;ELISA: 酶联免疫吸附测定;CRP: C 反应蛋白;AGEs: 晚期糖基化终末产物;IL-1β: 白细胞介素-1β;IL-4: 白细胞介素-4;NF-κB: 核因子-κB。 请点击此处下载此表格。
表 3:根据血糖状态和控制的多元 logistic 回归分析。 调整后的模型 1:根据种族、教育水平、慢性肾病和体重指数调整的毛细血管血糖,根据体重指数调整的 HbA1c。调整后的模型 2:调整后的模型 1 在混杂调整中添加了抗糖尿病药物。毛细血管血糖和 HbA1c 作为每个参数的自变量进行测试。星号 '*' 表示 α 值为 0.05 <显著性。缩写: IPAQ:国际身体活动问卷;MET:代谢等效任务;ELISA: 酶联免疫吸附测定;CRP: C 反应蛋白;AGEs: 晚期糖基化终末产物;IL-1β: 白细胞介素-1β;IL-4: 白细胞介素-4;NF-κB: 核因子-κB;UTC:无法计算。 请点击此处下载此表格。
讨论
就结果的准确性而言,静脉采血通常优于毛细血管采血进行实验室检测29。HbA1c 与糖尿病并发症、稳定的化学性质和标准化的实验室测试密切相关。由于 HbA1c 反映了 3 个月内的血糖控制情况,因此不需要空腹样本,而一次性毛细血管血样可以反映单点血糖状态,该状态受最近进餐的时间和内容的影响。然而,这两种血糖评估都有其优点和缺点。毛细血管血糖结果受微循环受损、低血压、严重脱水、水肿和糖尿病酮症酸中毒的影响,以及使用的商用血糖仪和试纸的功能30.尽管如此,毛细血管采血可以提供即时结果,提供更高的可及性,并捕获急性血糖状态;这迎合了不同的研究需求,并可能增强资源匮乏环境中的研究能力。
在这项研究中,下肢力量、放射学严重程度和实验室标志物与血糖控制之间的关联被 BMI 混淆,BMI 是肥胖的标志物。同样,血糖状态与 KOOS 疼痛和症状之间的关联部分归因于 BMI 的混杂效应,而与下肢力量的关联则由抗糖尿病药物介导。以前也发现抗糖尿病药物会影响肌肉质量和肌肉力量31,32。另一方面,KOA 患者血糖状况不佳与运动和娱乐功能较好独立相关。在调整了抗糖尿病药物的混杂因素后,KOOS 运动和娱乐功能领域的意义重新获得,这表明该治疗可能掩盖了血糖状态对参与者对其敏捷性和功能的主观评估的影响。这与临床试验中二甲双胍、美洛昔康和吡格列酮给药后 KOOS 评分的改善一致33。然而,与 HbA1c 相反,血糖状态可能反映了短期血糖峰值,这不太可能对功能受限产生负面影响,从而导致他们的反应得分更高。
之前的一项研究还发现,KOOS 领域分数与血糖控制呈负相关7。同样,HbA1c 显着预测接受全膝关节置换术的个体的 KOOS 疼痛域评分。然而,还应考虑那些选择全膝关节置换术的人存在难以忍受的疼痛34,35。毛细血管血糖的快照测量可能与 KOOS 评分无关,因为它反映了某个时间点的血糖状况,并且没有考虑一段时间内的血糖控制36。然而,高血糖与教育水平、种族、慢性肾病和 BMI 之间的关联确实表明随机毛细血管葡萄糖检测反映了血糖控制,因为这些是血糖控制不佳的既定危险因素。此外,受种族影响的膝关节自我管理、生活方式和食物摄入量的知识也可能影响 KOA 疼痛和症状 37,38,39。糖尿病患者的慢性肾病通常是存在微血管疾病的指标,微血管疾病是血糖控制不佳的长期并发症40,41。BMI 增加除了与胰岛素抵抗的公认关联外,还会导致膝关节的机械负荷增加,因此在血糖控制中起重要作用42。BMI 对血糖控制和放射学 KOA 严重程度之间关系的混杂效应可能反映了肥胖与胰岛素抵抗以及体重诱导的膝关节机械负荷之间的关系43。之前的一项研究表明,胰岛素治疗可以防止骨赘形成,这表明更好的血糖控制可能会减少 KOA 结构变化44。观察 ELISA 标志物,形成 AGE 的胶原蛋白的非酶修饰是不可逆的,反映了累积的高血糖45;这将潜在地解释本研究中血糖控制与非血糖状态之间的关系46。在其他研究中也发现了 BMI 调整后相关性的减弱47。
方案中概述了一些关键步骤,例如问卷管理和步骤解释期间的步骤。由于认知功能可能下降,研究人员应注意老年人参与者的理解能力;给出的指示应该清晰明了,用通俗易懂的语言避免混淆。在采血期间,应向参与者简要介绍并发症的风险,并在手术前获得同意,因为它是侵入性的。血液离心后,血清样品应在冷冻前分装到多个微量离心管中,以防止重复冻融过程,从而导致 ELISA 检测中的蛋白质降解和信号丢失48。ELISA 的分步程序因制造商而异,重要的是要仔细阅读手册并根据研究样品优化孵育时间、稀释度和温度48。
这项研究的局限性包括存在无法测量的混杂因素,例如饮食习惯和遗传易感性。此外,样本采集仅限于吉隆坡和雪兰莪地区,这些地区可能无法捕捉不同人群之间的差异,以考虑生活方式和医疗保健获取对血糖状况或控制的影响。除此之外,KOOS 作为一份回顾性的自我报告问卷,本质上是主观的;未来对膝关节症状和功能的评估可以纳入生物力学评估,以减少潜在的偏倚。为了更好地反映患有糖尿病的 KOA 参与者的身体表现,可以在未来的研究方法中获得重复测量。在炎症介质方面,本研究仅测量了 5 种生物标志物,但更广泛的分析可以更好地映射潜在机制。小样本量也可能是问题之一。总样本人群中缺少毛细血管血糖数据是由于在社区站点收集数据期间试纸用完以及参与者不愿意参加第二次访问。另一方面,用于 HbA1c 测试的静脉采血是在第二次就诊期间进行的,与膝关节 X 光检查同时进行,这需要参与者投入额外的时间。根据 80% 功效计算样本量以获得比值比 (OR = 2.010,95% CI 1.003, 4.026),该比值比是从已发表的文献中确定的,估计样本量为 7249。在这项研究中,我们将空腹血糖和随机血糖归为一个变量,即 CBG;然而,研究结果表明敏感性降低,其中单个测量的优势可能被另一个测量所掩盖。因此,最好分别通过空腹血糖和随机血糖来分析血糖状态与参数的关联。未来的研究现在应该评估长期血糖趋势,以确定慢性高血糖对 KOA 的影响。
本研究中涉及的方案可以修改为纵向研究或随机临床试验,以使用问卷、身体测试、血糖水平测量和 ELISA 测定进行数据收集。应根据研究的参数和研究的性质选择血糖评估方法、毛细血管采血和静脉采血。由于糖尿病是心血管疾病、视网膜病变、周围神经病变和糖尿病肾病的危险因素,不可否认,在研究方法中采用血糖评估方法是必不可少的 5,50。最重要的是,糖尿病管理的改进和预期寿命的延长为新出现的糖尿病并发症奠定了基础,例如癌症、肝病以及功能和认知障碍51。这些都是在未来研究趋势中预测的。
披露声明
所有作者都没有需要声明的利益冲突。
致谢
本研究由马来西亚高等教育部基础研究资助计划资助,资助/奖励编号:FRGS/1/2021/SKK0/UKM/02/15。
材料
| Name | Company | Catalog Number | Comments |
| Butterfly needle | BD Vacutainer | 367282 | |
| G*Power 3.1 | Heinrich-Heine-University | https://www.psychologie.hhu.de/arbeitsgruppen/allgemeine-psychologie-und-arbeitspsychologie/gpower | Heinrich-Heine-University, Düsseldorf |
| Glucometer and test strips | Contour plus | https://www.diabetes.ascensia.my/en/products/contour-plus/ | Basel, Switzerland |
| Human CRP(C-Reactive Protein) ELISA Kit | Elabscience | E-EL-H0043-96T | ELISA kit |
| Human IL-1β(Interleukin 1 Beta) ELISA Kit | Elabscience | E-EL-H0149-96T | ELISA kit |
| Human IL-4(Interleukin 4) ELISA Kit | Elabscience | E-EL-H0101-96T | ELISA kit |
| Human NF-κB-p105 subunit | Bioassay Technology Laboratory | E0003Hu | ELISA kit |
| Human NF-κBp105(Nuclear factor NF-kappa-B p105 subunit) | Elabscience | E-EL-H1386-96T | ELISA kit |
| Manual hand dynamometer | Jamar | 5030J1 | Warrenville, Illinois, USA |
| Portable Body Composition Analyzer | InBody ASIA | https://inbodyasia.com/products/inbody-270/ | Inbody 270, Cheonan, Chungcheongnam-do |
| Portable stadiometer | Seca | 213 1821 009 | SECA 213, Hamburg, Germany |
参考文献
- Allen, K. D., Thoma, L. M., Golightly, Y. M. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 30 (2), 184-195 (2022).
- Mat, S., et al. Factors influencing quality of life among older persons living with osteoarthritis using 3 different definitions. Top Geriatr Rehabil. 38 (1), 26-34 (2022).
- Berenbaum, F. Diabetes-induced osteoarthritis: From a new paradigm to a new phenotype. Ann Rheum Dis. 70 (8), 1354 (2011).
- Institute for Public Health. . National health and morbidity survey (NHMS) 2023: Non-communicable diseases and healthcare demand - key findings. , (2024).
- Harding, J. L., Pavkov, M. E., Magliano, D. J., Shaw, J. E., Gregg, E. W. Global trends in diabetes complications: A review of current evidence. Diabetologia. 62 (1), 3-16 (2019).
- Eitner, A., Culvenor, A. G., Wirth, W., Schaible, H. -. G., Eckstein, F. Impact of diabetes mellitus on knee osteoarthritis pain and physical and mental status: Data from the osteoarthritis initiative. Arthritis Care Res (Hoboken). 73 (4), 540-548 (2021).
- Aykan, S. A., Kaymaz, S. The association between diabetes mellitus and functionality in knee osteoarthritis: A cross-sectional study. J Health Sci Med. 5 (4), 1114-1118 (2022).
- Alenazi, A. M., Alqahtani, B. A. Diabetes is associated with longitudinal declined physical performance measures in persons with or at risk of knee osteoarthritis: Data from the osteoarthritis initiative. Eur J Phys Rehabil Med. 60 (3), 496-504 (2024).
- Neumann, J., et al. Diabetics show accelerated progression of knee cartilage and meniscal lesions: Data from the osteoarthritis initiative. Skeletal Radiol. 48 (6), 919-930 (2019).
- Courties, A., Gualillo, O., Berenbaum, F., Sellam, J. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthritis Cartilage. 23 (11), 1955-1965 (2015).
- Wei, G., et al. Risk of metabolic abnormalities in osteoarthritis: A new perspective to understand its pathological mechanisms. Bone Res. 11 (1), 63 (2023).
- Sriwimol, W., Choosongsang, P., Choosongsang, P., Petkliang, W., Treerut, P. Associations between hba1c-derived estimated average glucose and fasting plasma glucose in patients with normal and abnormal hemoglobin patterns. Scand J Clin Lab Invest. 82 (3), 192-198 (2022).
- Papachristoforou, E., Lambadiari, V., Maratou, E., Makrilakis, K. Association of glycemic indices (hyperglycemia, glucose variability, and hypoglycemia) with oxidative stress and diabetic complications. J Diabetes Res. 2020 (1), 7489795 (2020).
- Matsushita, Y., et al. A comparison of the association of fasting plasma glucose and hba1c levels with diabetic retinopathy in japanese men. J Diabetes Res. 2020 (1), 3214676 (2020).
- Baig, M. A. Comparative evaluation of efficiency of hba1c, fasting & post prandial blood glucose levels, in the diagnosis of type-2 diabetes mellitus and its prognostic outcome. Int J Res Med Sci. 3 (11), 3245-3249 (2015).
- Altman, R., et al. Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthritis Rheum. 29 (8), 1039-1049 (1986).
- Kang, H. Sample size determination and power analysis using the G* power software. J Educ Eval Health Prof. 18, (2021).
- Roos, E. M., Lohmander, L. S. The knee injury and osteoarthritis outcome score (koos): From joint injury to osteoarthritis. Health Qual Life Outcomes. 1, 64 (2003).
- Ipaq Research Committee. . Guidelines for data processing and analysis of the international physical activity questionnaire (IPAQ)-short and long forms. , (2005).
- Perissinotto, E., Pisent, C., Sergi, G., Grigoletto, F., Enzi, G. Anthropometric measurements in the elderly: Age and gender differences. Br J Nutr. 87 (2), 177-186 (2002).
- Sun, Y. -. S., et al. Calf circumference as a novel tool for risk of disability of the elderly population. Sci Rep. 7 (1), 16359 (2017).
- Chen, L. -. K., et al. Asian working group for sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment. J Am Med Dir Assoc. 21 (3), 300-307 (2020).
- Samah, Z. A., et al. Discriminative and predictive ability of physical performance measures in identifying fall risk among older adults. Sains Malays. 47 (11), 2769-2776 (2018).
- Bohannon, R. W., Williams Andrews, A. Normal walking speed: A descriptive meta-analysis. Physiotherapy. 97 (3), 182-189 (2011).
- Kim, M., Won, C. W. Cut points of chair stand test for poor physical function and its association with adverse health outcomes in community-dwelling older adults: A cross-sectional and longitudinal study. J Am Med Dir Assoc. 23 (8), 1375-1382.e3 (2022).
- Parcell, A. C., Sawyer, R. D., Tricoli, V. A., Chinevere, T. D. Minimum rest period for strength recovery during a common isokinetic testing protocol. Med Sci Sports Exerc. 34 (6), (2002).
- Kohn, M. D., Sassoon, A. A., Fernando, N. D. Classifications in brief: Kellgren-lawrence classification of osteoarthritis. Clin Orthop Relat Res. 474 (8), 1886-1893 (2016).
- Gottschalk, P. G., Dunn, J. R. Measuring parallelism, linearity, and relative potency in bioassay and immunoassay data. J Biopharm Stat. 15 (3), 437-463 (2005).
- Das, S., Swain, M., Pradhan, R. Evaluating the relationship of fasting capillary and venous blood sugar level in self-glucose monitoring device, fasting plasma glucose level and glycosylated hemoglobin (HbA1c). Nurs Care Open Access J. 1 (2), 00011 (2016).
- Bao, Y., Zhu, D. Clinical application guidelines for blood glucose monitoring in china (2022 edition). Diabetes Metab Res Rev. 38 (8), e3581 (2022).
- Wu, C. -. N., Tien, K. -. J. The impact of antidiabetic agents on sarcopenia in type 2 diabetes: A literature review. J Diabetes Res. 2020 (1), 9368583 (2020).
- Kalaitzoglou, E., Fowlkes, J. L., Popescu, I., Thrailkill, K. M. Diabetes pharmacotherapy and effects on the musculoskeletal system. Diabetes Metab Res Rev. 35 (2), e3100 (2019).
- Mohammed, M. M., Al-Shamma, K. J., Jassim, N. A. Evaluation of the clinical use of metformin or pioglitazone in combination with meloxicam in patients with knee osteoarthritis; using knee injury and osteoarthritis outcome score. Iraqi J Pharm Sci. 23 (2), 13-23 (2014).
- Vervullens, S., et al. Preoperative glycaemic control, number of pain locations, structural knee damage, self-reported central sensitisation, satisfaction and personal control are predictive of 1-year postoperative pain, and change in pain from pre- to 1-year posttotal knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. , (2024).
- Eitner, A., et al. Pain sensation in human osteoarthritic knee joints is strongly enhanced by diabetes mellitus. Pain. 158 (9), 1743-1753 (2017).
- Li, H., George, D. M., Jaarsma, R. L., Mao, X. Metabolic syndrome and components exacerbate osteoarthritis symptoms of pain, depression and reduced knee function. Ann Transl Med. 4 (7), 133 (2016).
- Khachian, A., Seyedoshohadaei, M., Haghani, H., Amiri, F. Effect of self-management program on outcome of adult knee osteoarthritis. Int J Orthop Trauma Nurs. 39, 100797 (2020).
- Mat, S., et al. Ethnic differences in the prevalence, socioeconomic and health related risk factors of knee pain and osteoarthritis symptoms in older malaysians. PLoS One. 14 (11), e0225075 (2019).
- Cruz-Almeida, Y., et al. Racial and ethnic differences in older adults with knee osteoarthritis. Arthritis Rheumatol. 66 (7), 1800-1810 (2014).
- Kalantar-Zadeh, K., et al. Patient-centred approaches for the management of unpleasant symptoms in kidney disease. Nat Rev Nephrol. 18 (3), 185-198 (2022).
- Hsu, H. -. J., et al. Factors associated with chronic musculoskeletal pain in patients with chronic kidney disease. BMC Nephrol. 15 (1), 6 (2014).
- Larsen, P., Engberg, A. S., Motahar, I., Ostgaard, S. E., Elsoe, R. Obesity influences the knee injury and osteoarthritis outcome score. Joints. 7 (01), 008-012 (2019).
- Solanki, P., et al. Association between weight gain and knee osteoarthritis: A systematic review. Osteoarthritis Cartilage. 31 (3), 300-316 (2023).
- Al-Jarallah, K., Shehab, D., Abdella, N., Al Mohamedy, H., Abraham, M. Knee osteoarthritis in type 2 diabetes mellitus: Does insulin therapy retard osteophyte formation. Med Princ Pract. 25 (1), 12-17 (2016).
- Suzuki, A., Yabu, A., Nakamura, H. Advanced glycation end products in musculoskeletal system and disorders. Methods. 203, 179-186 (2022).
- Wang, M., Hng, T. M. Hba1c: More than just a number. Aust J Gen Pract. 50 (9), 628-632 (2021).
- Kalousova, M., Skrha, J., Zima, T. Advanced glycation end-products and advanced oxidation protein products in patients with diabetes mellitus. Physiol Res. 51 (6), 597-604 (2002).
- Shah, K., Maghsoudlou, P. Enzyme-linked immunosorbent assay (elisa): The basics. Br J Hosp Med. 77 (7), C98-C101 (2016).
- Nakanishi, S., et al. The impact of hand strength on hba1c, body mass index and body composition by group according to sedentary behaviour: Cross-sectional study in japanese patients with type 2 diabetes mellitus. Malays J Med Sci. 31 (3), 185-193 (2024).
- Joseph, J. J., et al. Comprehensive management of cardiovascular risk factors for adults with type 2 diabetes: A scientific statement from the american heart association. Circulation. 145 (9), e722-e759 (2022).
- Tomic, D., Shaw, J. E., Magliano, D. J. The burden and risks of emerging complications of diabetes mellitus. Nat Rev Endocrinol. 18 (9), 525-539 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。