Method Article
تأثير نسبة السكر في الدم على أعراض هشاشة العظام في الركبة على العلامات الجسدية والشعاعية والالتهابية بين الأفراد الذين تبلغ أعمارهم 50 عاما فما فوق المصابين بداء السكري
In This Article
Summary
هنا ، نقدم بروتوكولا لتقييم التحكم في نسبة السكر في الدم باستخدام مستويات جلوكوز الدم الشعري (CBG) والهيموجلوبين السكري A1C (HbA1C). تبحث هذه الدراسة في تأثير ارتفاع السكر في الدم على أعراض هشاشة العظام في الركبة (KOA) ، والأداء البدني ، ومستوى النشاط البدني ، وشدة التصوير الشعاعي ، والالتهابات لدى كبار السن المصابين بداء السكري.
Abstract
تستكشف هذه الدراسة تأثير ارتفاع السكر في الدم على الأعراض المرتبطة بهشاشة العظام في الركبة (KOA) ، والأداء البدني ، ومستوى النشاط البدني ، وشدة التصوير الشعاعي ، والالتهاب لدى كبار السن. تساهم حالات ارتفاع السكر في الدم لفترات طويلة في تكوين المنتج النهائي المتقدم للجليكاسیون (AGE) ، مما يؤدي إلى تفاقم أعراض KOA. تستخدم مستويات جلوكوز الدم الشعري (CBG) والهيموجلوبين السكري A1C (HbA1C) بشكل شائع في الاختبارات المعملية لتقييم نسبة السكر في الدم ، مما يوفر مزايا وقيودا مميزة. تم تقسيم المشاركين إلى مجموعات تحكم جيدة وضعيفة في نسبة السكر في الدم بناء على مستويات CBG و HbA1C. تم قياس الشدة السريرية والنشاط البدني في KOA باستخدام درجة نتائج إصابة الركبة وهشاشة العظام (KOOS) واستبيان النشاط البدني الدولي. تم قياس الأداء البدني بقوة قبضة اليد ، وسرعة المشي ، ووقت الصعود والانتقال (TUG) ، و 5 مرات الجلوس إلى الوقوف (5STST). تم إجراء الأشعة السينية للركبة ، وتم إجراء تحليل مقايسة الممتز المناعي المرتبط بالإنزيم في الدم (ELISA) ل IL-1β و IL-4 و CRP و NF-κB و AGE. تمت مقارنة ثلاثمائة مشارك تم تجنيدهم (متوسط العمر [SD] = 66.40 سنة (5.938) مع CBG ، من سكر الدم الصائم > 7.0 مليمول / لتر وسكر الدم العشوائي > 11.1 مليمول / لتر ، (N = 254) مع ألم KOOS (p = 0.008) والأعراض (p = 0.017) و 5STST (p = 0.015) ؛ بينما تمت مقارنة HbA1c > 6.3٪ (N = 93) مع 5STST (p = 0.002) ، و AGEs (p = 0.022) بناء على اختبار Mann Whitney U. كشف الانحدار اللوجستي عن ارتباطات ذات دلالة إحصائية بين التحكم في نسبة السكر في الدم وقوة عضلات الأطراف السفلية ، والشدة الإشعاعية ، والعلامات المختبرية ، وبين حالة نسبة السكر في الدم وألم وأعراض KOOS. ومع ذلك ، لم تظل هذه الارتباطات مهمة بعد تعديل مؤشر كتلة الجسم. ارتبطت حالة نسبة السكر في الدم السيئة وحدها بوظيفة أفضل في مجالات الرياضة والترفيه بعد تعديل الأدوية المضادة لمرض السكري ، مما يشير إلى تأثيرات مضادة للالتهابات ومسكنات تخفي تأثير ارتفاع نسبة السكر في الدم. يمكن للدراسات المستقبلية استكشاف القدرة التنبؤية لتقييم نسبة السكر في الدم لضعف وظائف الركبة والأداء البدني مع حساب آثار الدواء.
Introduction
يزداد انتشار هشاشة العظام في الركبة (KOA) مع تقدم العمر ، حيث تكون الركبة مفصلا رئيسيا يحملالوزن 1. عادة ما يظهر KOA مع تصلب وألم مزمن في مفصل الركبة ، مما يحد من الحركة ويقلل من نوعية الحياة ويزيد من خطر الإصابة بأمراض القلبوالأوعية الدموية 2. يساهم داء السكري ، الذي يرتبط أيضا بالعمر ، في خطر تطور KOA ، حيث تعزز مستويات الجلوكوز والدهون المرتفعة تكوين المنتج النهائي المتقدم للجليكاز (AGE) ، مما يؤدي إلى التهاب المفاصل المزمن وتنكس الغضاريف3. على الرغم من توفر خدمات الرعاية الصحية ، فإن اثنين من كل خمسة ماليزيين مصابين بداء السكري غير مدركين لتشخيصهم ، بينما فشل 56٪ ممن تم تشخيصهم في الحفاظ على تحكم جيد في نسبة السكر فيالدم 4. يمكن أن يؤدي ارتفاع السكر في الدم الحاد إلى حالة فرط الأسمولية بارتفاع السكر في الدم ، والتي تهدد الحياة ، بينما يؤدي ارتفاع السكر في الدم المزمن إلى اعتلال الأعصاب المحيطية ، واعتلال الكلية ، واعتلال الشبكية ، وأمراض القلب والأوعيةالدموية 5.
قد يؤدي الاعتلال العصبي المحيطي ، وهو أحد المضاعفات الوعائية الدقيقة الناتجة عن ضعف التحكم في نسبة السكر في الدم ويؤدي إلى تغيير آليات الألم ، إلى المبالغة في آلام الركبة في KOA6. يرتبط وجود مرض السكري لدى الأفراد المصابين ب KOA بانخفاض نطاق الحركة في مفصل الركبة ، وانخفاض وظيفة الركبة ، وزيادة التغيرات الشعاعية ، وسوء نوعية الحياة7. يتميز انخفاض الأداء البدني الناتج عن آثار مرض السكري على KOA بضعف قوة العضلات والتنسيق8. يبدو أن دليل التصوير بالرنين المغناطيسي على التغيرات التنكسية المرتبطة بتلف الغضروف والغضروف المفصلي ، مثل انخفاض مساحة المفاصل وسوء المحاذاة ، أكثر حدة لدى الأفراد المصابين بداء السكري9.
يرتبط ضعف التحكم في نسبة السكر في الدم بالإنزيمات التنكسية المنظمة والعوامل الالتهابية في السائل الزليلي للركبة. ترتبط السيتوكينات والبروتينات المرتفعة في مرض السكري ، مثل IL-1β و IL-4 و IL-6 والعامل النووي κB (NF-κB) وعامل نخر الورم ألفا (TNF-α) ، بالفيزيولوجيا المرضية KOA10،11. أثناء وجوده في الخلايا الغضروفية ، يؤدي ناقل الجلوكوز المعيب إلى تحلل السكر ، ومسارات البوليول ، وبروتين كيناز C ومسارات البنتوز ، وفي النهاية إنتاج عالي لأنواع الأكسجينالتفاعلية 10.
يوفر الصيام وجلوكوز الدم العشوائي تقديرا لحالة نسبة السكر في الدم الحالية بالإضافة إلى القدرة على التعامل مع الجلوكوز المتعلقة بمقاومةالأنسولين 12. الهيموجلوبين السكري A (HbA1c) هو مقياس للتحكم في نسبة السكر في الدم خلال الأشهر الثلاثة الماضية. غير أن هذا لا يقدم تفاصيل عن التقلبات الحادة13. يوفر اختبار جلوكوز الدم الشعري تقييمات فورية لحالة نسبة السكر في الدم بجانب السرير أو العيادة ، مما أدى إلى مناقشات حول قيمتها في تحديد التحكم في نسبة السكر في الدم وكذلك التنبؤ بمخاطر حدوث مضاعفات14،15. وبالتالي ، تهدف هذه الدراسة إلى توضيح العلاقة بين التحكم في نسبة السكر في الدم المحدد مع HbA1c وارتفاع نسبة الجلوكوز في الدم المحدد مع جلوكوز الدم الشعري (CBG) مع درجات نتائج إصابة الركبة وهشاشة العظام (KOOS) ، والأداء البدني ، ومستوى النشاط البدني ، وشدة التصوير الشعاعي وعلامات الالتهابات لدى الأفراد المصابين ب KOA.
Protocol
كان بروتوكول الدراسة متوافقا مع إعلان هلسنكي وتمت الموافقة عليه من قبل لجنة الأخلاقيات بجامعة كيبانغسان ماليزيا (الرقم المرجعي: JEP-2022-001).
1. توظيف المشاركين
- من خلال أخذ العينات المريحة، اختر مجموعة الدراسة من البالغين الذين يعيشون في المجتمع المصابين ب KOA الذين تبلغ أعمارهم 50 عاما فما فوق في كوالالمبور وسيلانجور. تم توظيف مشاركين من منظمات كبار السن وعيادات السكري وجراحة العظام.
ملاحظة: يتم تعريف وجود KOA من خلال KOA الذي تم تشخيصه ذاتيا من قبل الطبيب أو تلك التي تفي بمعايير الفحص السريري للكلية الأمريكية لأمراض الروماتيزم (ACR) 16. - استبعاد كبار السن المودعين في المؤسسات أو الذين يعانون من إعاقة نفسية خطيرة ومرض السكري من النوع 1.
- من خلال الرجوع إلى الأدبيات المنشورة حول الأفواج المقطعية من إعدادات مماثلة ، حدد حجم التأثير ، وهو في هذه الدراسة النسبة الفردية. احسب حجم العينة ، والذي سيوفر قوة 80٪ لرفض الفرضية الصفرية ، باستخدام G * Power 3.117.
- شرح أهداف البحث والحصول على موافقة مستنيرة قبل جمع البيانات.
2. جمع البيانات - الاستبيان
- إدارة الاستبيانات ، والتي تشمل الاستبيانات الاجتماعية الديموغرافية ، KOOS18 ، واستبيان النشاط البدني الدولي (IPAQ) 19.
- احسب إجمالي الدرجات لكل مجال من مجالات KOOS الخمسة المشتقة من 42 عنصرا وقم بتحويل الدرجات إلى مقياس من 0 إلى 100 بالمائة ، مع عدم وجود مشاكل و 100 يشير إلى مشاكل شديدة لكل مجال.
- احسب المكافئ الأيضي للمهمة (MET) لمجالات IPAQ بضرب الوقت المستغرق بالدقائق وعدد الأيام في الأسبوع ، مع مراعاة معيار كل مجال.
ملاحظة: إجمالي مؤشر MET لمستويات النشاط البدني هو 3.3 (نشاط المشي MET) ، + 4 (نشاط MET متوسط الشدة) ، + 8 (MET شديد الشدة).
3. جمع البيانات - الأداء البدني
- قم بقياس الارتفاع باستخدام مقياس الثبات. الحصول على مؤشر وزن الجسم وكتلة الجسم (BMI) باستخدام محلل تكوين الجسم. تأكد من أن المشاركين يخلعون الملابس الثقيلة والإكسسوارات المعدنية والأحذية.
- قم بقياس محيط الخصر والورك والساق باستخدام شريط قياس. سجل القياس بالسنتيمتر على مستوى السرة عند الراحة لمحيط الخصر والقياس على مستوى الحد الأقصى للنتوء الخلفي للأرداف لمحيطالورك 20. قم بقياس محيط ربلة الساق عند أكبر بعد للمحور الطويل مع جلوس المشاركين وظهورهم مستقيمة وكلا القدمين على الأرض21.
- قدم تعليمات للمشاركين حول كيفية إجراء اختبارات الأداء البدني: اختبار قوة قبضة اليد (HGS) 22 ، اختبار التوقيت والذهاب (TUG) 23 ، اختبار المشي لمسافة ستة أمتار24 ، وخمس مرات اختبار الجلوس للوقوف (5STST) 25.
- تأكد من خلو إعداد الأداء من العوائق والمخاطر. اترك 1 دقيقة فترات راحة قياسية بين الاختبارات26.
- قم بإجراء اختبار قوة قبضة اليد.
- اطلب من المشارك الجلوس مع تثبيت الكتفين في الوضع المحايد ، مع ثني الكوع عند 90 درجة.
- أبلغهم بعدم أداء أي حركة ارتعاش أو رجيج سريعة طوال الاختبار.
- قم بقياس القوة القصوى باستخدام مقياس ديناميكية مقبض اليد لكل يد ثلاث مرات وحدد أكبر قياس بالكيلوغرام.
- قم بإجراء اختبار الصعود والذهاب.
- اطلب من المشارك الجلوس بشكل مستقيم مع ملامسة ظهره لظهر الكرسي ، ووضع الذراعين على مساند الذراعين ، ووضع القدمين بشكل مسطح على الأرض.
- باستخدام ساعة توقيت ، سجل الوقت المستغرق للوقوف ، والمشي 3 أمتار ، والانعطاف للخلف ، والعودة إلى الكرسي ، والجلوس مرة أخرى. ابدأ التوقيت عندما يفقد ظهر المشارك الاتصال بظهر الكرسي وتوقف عن التوقيت بمجرد أن يلمس ظهر المشارك ظهر الكرسي.
- كرر مرتين وسجل أقل وقت بالثواني التي تم أخذها كنتيجة نهائية.
- تقييم سرعة المشي.
- قم بقياس ممر بطول 10 أمتار وضع علامات بشريط لاصق على بعد 2 متر من كل طرف من طرفي الممشى للإشارة إلى النقاط التي ستبدأ عندها القياسات وتنتهي.
- اطلب من المشاركين المشي بالسرعة المعتادة على طول ممر بطول 10 أمتار.
- ابدأ المؤقت بمجرد أن يعبر المشارك أول 2 متر وأوقف المؤقت عند خط 8 أمتار.
- احسب سرعة المشي باستخدام صيغة السرعة (م / ث) ، حيث يتم قسمة 6 أمتار على الوقت المستغرق بالثواني.
- قم بإجراء اختبار الجلوس إلى الوقوف خمس مرات.
- اطلب من المشاركين الوقوف والجلوس 5 مرات أسرع قدر الإمكان مع التوازن.
- سجل الوقت المستغرق لإكمال 5 تكرارات وحدد أقل وقت بالثواني من التجارب الثلاث.
4. جمع البيانات - الأشعة السينية للركبة
- حدد موعدا ووقتا للمشاركين لزيارة المستشفى لإجراء فحص شعاعي لكلتا الركبتين باستخدام عرض حامل الوزن الأمامي الخلفي الدائم.
- أرسل الصور الشعاعية إلى أخصائي الأشعة ، الذي سيحدد ويعين درجات Kellgren و Lawrence لكل ركبة27.
ملاحظة: يحتوي نظام التصنيف على درجات من 0 إلى 4 ، مع درجات أعلى تشير إلى زيادة شدة KOA بناء على الميزات: تكوين العظم ، وعظيمات حول المفصل ، والشكل المتغير لنهايات العظام ، وتضييق مساحة المفصل ، والتصلب تحت الغضروف. - سجل الدرجة المخصصة ، مع التأكد من تعيين النتيجة للركبة الصحيحة.
5. جمع البيانات - جمع الدم الشعري لتقييم حالة نسبة السكر في الدم
- اغسل يديك وارتد قفازات جراحية. نظف إصبع المشارك بقطعة كحول واترك الإصبع يجف في الهواء.
- قم بإعداد جهاز قياس السكر عن طريق إدخال شريط الاختبار.
- حدد جهاز إبرة الوخز وتأكد من أنه غير مستخدم ومحكم الإغلاق.
- اكسر ختم إبرة الوخز وخز الإصبع بجهاز إبرة الوخز الجديد ، واضغط على الإصبع لإنتاج فقاعة صغيرة من الدم ، ولمس قطرة الدم بشريط الاختبار.
- استخدم حلول التحكم لضمان الجودة ، وقم بإسقاط المحلول على شريط الاختبار ، وتحقق مما إذا كان في النطاق المتوقع وفقا للشركة المصنعة.
- سجل مستوى الجلوكوز في الدم الذي يعرضه جهاز قياس السكر. اسأل المشارك عن آخر وجبة له وسجل ما إذا كان قد تم تناوله قبل أكثر من 8 ساعات من وقت أخذ العينة.
ملاحظة: يتطلب سكر الدم الصائم من المشاركين الصيام لمدة 8 ساعات على الأقل قبل هذا الإجراء ، بينما لا يتطلب سكر الدم العشوائي ذلك. - تخلص من إبرة الوخز بأمان في سلة الأدوات الحادة وزود المشارك بقطعة قطن للضغط على منطقة البزل على الإصبع لضمان الإرقاء.
- اغسل يديك بعد العملية. نظف أي انسكاب دم.
6. جمع البيانات - جمع الدم الوريدي لتقييم التحكم في نسبة السكر في الدم
- اغسل يديك وارتد قفازات جراحية.
- تحديد الوريد المناسب من الحفرة الأمامية اليمنى أو اليسرى. ضع عاصبة على الجزء العلوي من الذراع المحدد وحدد الوريد المناسب عن طريق الجس.
- نظف الجلد حول الوريد المحدد بقطعة كحول واتركه يجف في الهواء.
- اجمع عينات الدم الوريدية بإبرة فراشة 23 جم باستخدام زجاجتين من أنابيب دم عادي سعة 6 مل. قم بتسمية الأنابيب برمز التعريف الفريد للمشارك.
- تخلص من الأدوات الحادة والنفايات السريرية بأمان واغسل اليدين.
- انقل عينات الدم إلى المختبر في مبرد به كيس ثلج. ضع عينات الدم في أنابيب التجميع الخاصة بهم في جهاز طرد مركزي وجهاز طرد مركزي عند 604 × جم لمدة 10 دقائق.
- قم بتقسيم المصل إلى أنابيب طرد مركزي دقيق سعة 1.5 مل باستخدام ماصة دقيقة ، وقم بتسمية الأنابيب بالتاريخ ورمز التعريف ونوع العينة قبل تخزينها عند -80 درجة مئوية.
7. اختبار ELISA
- احسب حجم المصل المطلوب لاختبار ELISA بناء على دليل الشركة المصنعة. قم بإجراء اختبار تحسين لتحديد التركيز الأمثل ؛ كرر مع IL-1β و IL-4 و CRP و NF-κB و AGEs على التوالي.
- قم بإذابة المصل وإحضار كواشف ELISA إلى درجة حرارة الغرفة (RT). وفي الوقت نفسه ، قم بتسمية أنابيب الطرد المركزي الدقيقة للمعايير والعينات والفارغة.
- قم بإعداد حلول العمل وفقا لتعليمات الشركة المصنعة للأجسام المضادة المخففة والكشف والركيزة والمخزن المؤقت للغسيل من محاليل المخزون إذا لزم الأمر.
- قم بتشغيل التخفيفات التسلسلية ذات الطي للمعايير مع المخفف القياسي المحدد. المعيار المرجعي لكل علامة: IL-1β = 500 بيكوغرام / مل ، IL-4 = 2000 بيكوغرام / مل ، CRP = 25 نانوغرام / مل ، NF-κB = 10 نانوغرام / مل ، الأعمار = 4800 نانوغرام / لتر. يعمل المخفف القياسي أيضا كفارغ.
- تمييع عينة المصل لتحسين الفحص إذا لزم الأمر.
- بالنسبة لمقايسة IL-1β و IL-4 و NF-κB ELISA ، استخدم عينات مصل أنيقة. بالنسبة إلى CRP ، قم بتخفيفه بمقدار 1000x مع مخفف مرجعي. ماصة 100 ميكرولتر عينات في البئر وتكرار كل منها.
- بالنسبة لمقايسة AGEs ELISA ، استخدم عينة مصل من تخفيف 2x ، وماصة 40 ميكرولتر من العينة في البئر ، وقم بتكرار كل منها.
- قم بتغيير أطراف الماصة بين العينات أو الكواشف المختلفة. استخدم ماصة متعددة القنوات لتجنب تأثيرات الحواف.
- احتضن وفقا للوقت ودرجة الحرارة المقترحين من دليل الشركة المصنعة ، وأغلق اللوحة بغطاء لاصق جديد لكل حضانة.
- بالنسبة لهذه الشطيرة ELISA ، احتضان العينة والمعيار للآبار المطلية مسبقا ، متبوعا بالجسم المضاد للكشف ، والجسم المضاد الثانوي المترافق ، والركيزة ، وأخيرا توقف الحل. أضف كل حل بنفس الترتيب كما كان سابقا.
- صب الآبار وغسلها باستخدام مخزن الغسيل بين الحضانة وفقا لدليل الشركة المصنعة. اضغط على الآبار على ورق ماص نظيف لإزالة مخزن الغسيل ، ولكن تأكد من عدم جفاف الآبار قبل إضافة المحلول التالي.
- اقرأ الآبار باستخدام قارئ صفيحة دقيقة عند 450 نانومتر. سجل واحسب باستخدام منحنى لوجستي رباعي المعلمات (4PL) ، وهي طريقة كمية لرسم وتحديد التركيز من أجهزة المعايرة السيني المتماثلة28. استخدم المتوسط لكل عينة للتحليل.
8. التحليل الإحصائي
ملاحظة: تحليل البيانات باستخدام برنامج تحليل البيانات المناسب (تم استخدام SPSS الإصدار 20 هنا). صنف مجموعة الدراسة إلى مجموعتين: 1) التحكم الجيد في نسبة السكر في الدم ، 2) ضعف التحكم في نسبة السكر في الدم (ضعف نسبة السكر في الدم = سكر الدم الصائم أكثر من 7.0 مليمول / لتر أو سكر الدم العشوائي أعلى من 11.1 مليمول / لتر ؛ ضعف التحكم في نسبة السكر في الدم = HbA1c أعلى من 6.3٪).
- افتح البرنامج لإنشاء متغيرات بناء على التاريخ ورمز تعريف المشاركين والمتغيرات الاجتماعية الديموغرافية وعناصر الاستبيان والمعلمات المقاسة.
- حدد طريقة عرض متغيرة. أدخل في العمود الاسم أو أدخل الوصف أو اسم العرض في العمود التسمية.
- حدد Type > Measure. بالنسبة للمتغيرات الفئوية المشفرة، قم بمطابقة التعليمات البرمجية الرقمية التمثيلية وقيمتها في العمود القيم. حدد موافق.
- أدخل البيانات التي تم جمعها في البرنامج حيث يمثل كل صف مشاركا واحدا.
- حدد عرض البيانات. أدخل الرموز الرقمية التمثيلية في العمود للنوع الرقمي والأسماء أو الأوصاف لنوع السلسلة.
- تحقق من طبيعية المتغيرات المستمرة لتحديد افتراضات الاختبار البارامتري.
- حدد تحليل > الإحصائيات الوصفية > استكشاف. إدراج متغيرات مستمرة في القائمة التابعة للحقل.
- حدد مخططات Plots > Normality مع الاختبارات > متابعة > موافق. للحصول على حجم عينة أكبر من 50 ، راجع القيمة p في اختبار Kolmogorov-Smirnov ؛ ترفض قيمة p المهمة الفرضية الصفرية حيث يتم توزيع البيانات بشكل طبيعي.
- قم بتشغيل اختبار Mann-Whitney U للمتغيرات غير المعلمية لاختبار الاختلافات الدلالية بين المجموعات.
- حدد تحليل > الاختبارات غير المعلمية > الإعدادات > اختر الاختبارات > تخصيص الاختبارات > Mann-Whitney U (عينتان).
- انتقل إلى الحقول وأدخل المتغيرات المستمرة في حقل حقول الاختبار.
- إدراج مجموعة فئوية ل CBG أو HbA1c في الحقل مجموعات > تشغيل.
- قم بإجراء اختبار مربع كاي للمتغيرات الفئوية لاختبار الاختلافات المعنوية بين المجموعات.
- حدد تحليل > الإحصائيات الوصفية > علامات التجزئة المتقاطعة > الإحصائيات > مربع Chi > متابعة.
- حدد عرض الخلايا. حدد تمت ملاحظته في الحقل الأعداد وحدد عمود في الحقل النسبة المئوية. ثم حدد متابعة.
- قم بإدراج متغيرات فئوية في الحقل (الصفوف) والمجموعة الفئوية ل CBG أو HbA1c في الحقل أعمدة (أعمدة) > موافق.
- تحويل المتغيرات التابعة المستمرة إلى مجموعات ثنائية للتحضير للانحدار اللوجستي.
- حدد تحويل > إعادة ترميز إلى متغيرات مختلفة وأدخل متغيرات مستمرة في الحقل متغيرات الإدخال > متغيرات الإخراج.
- أدخل اسم متغير جديد في الحقل اسم. قم بإدراج تسمية جديدة في الحقل تسمية > تغيير > القيم القديمة والجديدة.
- أدخل أسفل قيمة الحد الأدنى لنقطة القطع في الحقل النطاق، الأدنى من خلال القيمة، وإقرانها بصفر في قيمة الحقل للقيمة الجديدة إذا كان هذا يشير إلى نتيجة جيدة.
- حدد إضافة > إدراج نقطة القطع في الحقل النطاق، القيمة على الرغم من HIGH وإقرانها بنقطة واحدة في الحقل قيمة القيمة الجديدة > إضافة > متابعة > موافق.
- نقاط القطع للمتغيرات التابعة:
- مجال الألم KOOS < 86.1٪ ، مجال الأعراض < 85.7٪ ، مجال نشاط الحياة اليومية <86.8٪ ، مجالات الرياضة < 85.0٪ ، مجال جودة الحياة < 87.5٪
- HGS الفقراء: < الذكور 28 كجم ، الإناث < 18 كجم
- البلطجة الفقيرة > 8.00 ثانية
- سرعة المشي الضعيفة < 1.13 مللي ثانية -1
- 5TSTS ضعيف >12.80 ثانية
- انخفاض النشاط البدني ، IPAQ MET < 3000
- مقياس درجات التصوير الشعاعي المعتدل إلى الشديد KOA و Kellgren و Lawrence > 2
- ارتفاع IL-1β > 11.9 بيكوغرام / مل
- IL-4 عالي > 5 بيكوغرام / مل
- CRP عالي > 8 نانوغرام / مل
- العمر العالي > 900 نانوغرام / لتر
- NF-κB عالي > 3 نانوغرام / مل - قم بتشغيل انحدار لوجستي متعدد للحصول على نسب الاحتمالات. اضبط النموذج اللوجستي بعوامل مربكة بناء على خصائص المشاركين المهمة.
- حدد تحليل > الانحدار > اللوجستيات الثنائية. أدخل متغير تابع ثنائي في الحقل تابع.
- أدخل متغير CBG أو HbA1c في حقل المتغيرات المشتركة.
- حدد الفئوية وانقل المتغيرات الفئوية إلى الحقل المتغيرات المشتركة الفئوية. ثم حدد الفئة المرجعية كأول > التغيير > متابعة.
- حدد خيارات > CI ل exp(B): 95٪ > متابعة > موافق.
- كرر الإجراء للنماذج المعدلة ولكن أضف عوامل مربكة كبيرة في المتغيرات المشتركة في المجال.
- اعرض المتغيرات كمتوسط (انحراف معياري) للمتغيرات المستمرة أو الوسيط (النطاق الربيعي) إذا كنت تستخدم اختبارا غير معلمي، ورقم (نسبة مئوية) للمتغيرات الفئوية. أبلغ عن نسب الفردية (OR) مع فترات ثقة 95٪ (CI) وقم بتصنيف القيمة الفردية أقل من 0.05 على أنها ذات دلالة إحصائية.
النتائج
خصائص المشاركين
يلخص الجدول 1 خصائص المشاركين وفقا لحالة نسبة السكر في الدم مع FPBS و HbA1c. يوضح الشكل 1 العدد الإجمالي للمشاركين المشمولين في كل مرحلة بناء على معايير التضمين المتغيرة. من إجمالي 300 مشارك تم تجنيدهم ، تم الحصول على عينات من جلوكوز الدم الشعري من 254 فردا ل FPBS ، بينما تم الحصول على عينات الدم الوريدية من 93 ل HbA1c. من بين 254 عينة شعرية ، استوفت 45 (17.7٪) معايير ارتفاع السكر في الدم. بينما من بين 93 عينة وريدية ، استوفت 42 عينة (45.2٪) معايير ضعف التحكم في نسبة السكر في الدم. كان متوسط عمر المشاركين 65.98 ± 5.41 سنوات في أولئك الذين كان FPBS متاحا لهم و 66.41 ± 6.02 سنوات الذين كان HbA1c متاحا لهم. تم العثور على اختلافات ذات دلالة إحصائية في العرق ومستوى التعليم ومؤشر كتلة الجسم وأمراض الكلى المزمنة بين المجموعات المصابة بالسكر في الدم وارتفاع السكر في الدم على أساس CBG ، في حين أن مؤشر كتلة الجسم فقط كان أعلى بشكل ملحوظ في أولئك الذين يعانون من ضعف التحكم في نسبة السكر في الدم مقارنة بأولئك الذين لديهم تحكم جيد في نسبة السكر في الدم بناء على HbA1c (ص < 0.05). بالإضافة إلى ذلك ، كانت نسبة المشاركين الذين يتلقون الأدوية المضادة لمرض السكري المختلفة اختلافا كبيرا بين المجموعتين لكل من CBG (p < 0.001) و HbA1c ، على التوالي (ص < 0.001) (الجدول 1).
مقارنة بين أعراض هشاشة العظام في الركبة والأداء البدني ومستوى النشاط البدني وشدة التصوير الشعاعي والالتهاب بين مجموعات euglycem وفرط السكر في الدم
قدم الشكل 2 مصفوفة ارتباط توضح العلاقات بين المتغيرات الرئيسية ، مما يوفر نظرة ثاقبة على الترابط المحتمل. كشفت مقارنة درجات مجال KOOS بين مجموعات euglycem وفرط السكر في الدم باستخدام Mann Whitney U عن اختلافات في درجات مجال الألم (p = 0.008) والأعراض (p = 0.017). لوحظت أيضا اختلافات ذات دلالة إحصائية بين 5STST وحالة نسبة السكر في الدم (p = 0.015) ، بالإضافة إلى التحكم في نسبة السكر في الدم (p = 0.002) (الجدول 2).
ثمانية عشر مشاركا وافقوا على أخذ عينات من جلوكوز الدم الشعري لديهم علامات معملية تم قياسها من عينات الدم الوريدية ، وكان هناك شخصان فقط يعانيان من ارتفاع السكر في الدم. ولذلك فإن الاستنتاجات الإحصائية غير ممكنة. كانت العلامات المختبرية متاحة لما مجموعه 30 فردا تم قياس HbA1c منهم: 18 يعانون من ضعف التحكم في نسبة السكر في الدم و 12 مع تحكم جيد في نسبة السكر في الدم. اختلفت مجموعات التحكم في نسبة السكر في الدم بشكل كبير في مستويات العمر في الدم (ص = 0.022) (الجدول 2).
تحليلات الانحدار اللوجستي المتعددة
تم استخدام نماذج التحوف اللوجستي المتعددة لتقييم الارتباطات بين حالة نسبة السكر في الدم والتحكم في نسبة السكر في الدم مع شدة KOA ، والأداء البدني ، والنشاط البدني ، وشدة التصوير الشعاعي ، وعلامات المختبر. لاستبعاد التأثيرات المربكة ، تم تطوير النماذج المعدلة عن طريق إضافة المتغيرات المشتركة والعرق ومستوى التعليم ووجود أمراض الكلى المزمنة ومؤشر كتلة الجسم في نموذج حالة نسبة السكر في الدم غير المعدل ومؤشر كتلة الجسم في نموذج التحكم في نسبة السكر في الدم غير المعدل. تم تطبيق النموذج 2 المعدل مع التعديل الثاني عن طريق إضافة الأدوية المضادة لمرض السكري في كلتا القائمتين المربكتين.
من المجالات الخمسة ل KOOS ، ارتبطت الألم (OR = 3.56 ، 95٪ CI = 1.40 ، 9.09) ، والأعراض (OR = 2.77 ، 95٪ CI = 1.21 ، 6.32) والرياضة (OR = 0.27 ، 95٪ CI = 0.10 ، 0.72) مرتبطة بشكل كبير بحالة نسبة السكر في الدم فقط ، ولكن تم إبطال هذا بعد التعديل للعوامل المربكة المحتملة ، باستثناء المجال الرياضي (OR = 0.19 ، 95٪ CI = 0.04 ، 0.85) (الجدول 3). لم يتم الإبلاغ عن أي اختلاف يعتد به في النتيجة لمجال ADL عبر مجموعات حالة نسبة السكر في الدم. من بين اختبارات الأداء البدني ، وجد أن 5STST فقط يرتبط ارتباطا كبيرا بحالة نسبة السكر في الدم (OR = 3.22 ، 95٪ CI = 1.62 ، 6.39) ؛ ومع ذلك ، لم تصمد الجمعية أمام التعديل. ارتبطت كل من سرعة المشي (OR = 2.46 ، 95٪ CI = 1.05 ، 5.78) و 5STST (OR = 3.83 ، 95٪ CI = 1.10 ، 13.35) بالتحكم في نسبة السكر في الدم ، ولكن تم تخفيف الارتباطات بعد تعديل مؤشر كتلة الجسم (سرعة المشي (OR = 2.01 ، 95٪ CI = 0.82 ، 4.88) ؛ و 5STST (OR = 3.08 ، 95٪ CI = 0.85 ، 11.13) (الجدول 3).
تم إجراء الانحدار اللوجستي للعلامات المختبرية عن طريق التحكم في نسبة السكر في الدم فقط. فقد الارتباط الخام بين AGE والتحكم في نسبة السكر في الدم (OR = 0.19 ، 95٪ CI = 0.04 ، 0.94) أهميته بعد تعديل مؤشر كتلة الجسم (OR = 0.20 ، 95٪ CI = 0.04 ، 1.09) (الجدول 3). وبالمثل ، ارتبطت الأدلة الشعاعية ل KOA بشكل كبير بالتحكم في نسبة السكر في الدم قبل تعديل مؤشر كتلة الجسم (OR = 4.12 ، 95٪ CI = 1.33 ، 12.78). لم يبلغ مستوى النشاط البدني عن أي صلة ذات دلالة إحصائية بين حالة نسبة السكر في الدم والتحكم في نسبة السكر في الدم (الجدول 3).
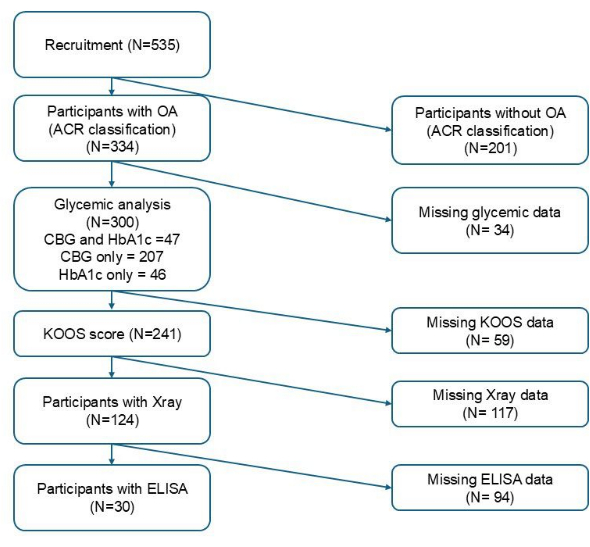
الشكل 1: مخطط تدفق تجنيد المشاركين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
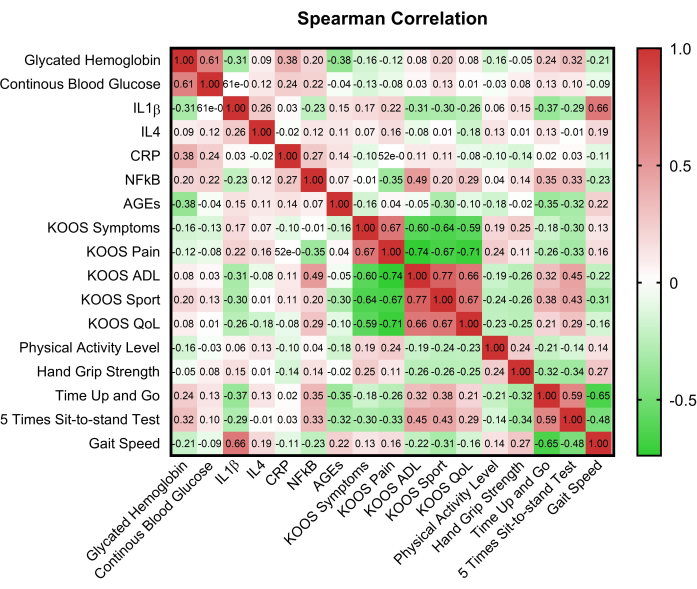
الشكل 2: مصفوفة الارتباط للمتغيرات الرئيسية. HbA1c: الهيموجلوبين السكري A1C; CBG: جلوكوز الدم الشعري. KOOS: إصابة الركبة ونتيجة هشاشة العظام. ADL: أنشطة الحياة اليومية. جودة الحياة: نوعية الحياة. CRP: بروتين تفاعلي C. AGEs: المنتجات النهائية المتقدمة للجليكوزيشن. IL-1β: إنترلوكين -1β ؛ IL-4: إنترلوكين -4 ؛ NF-κB: العامل النووي-κB. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: خصائص المشاركين. تم الحصول على قيم P من خلال اختبار Mann-Whitney U للمتغيرات المستمرة في الجدول ، وتم تحليل المتغيرات الفئوية باستخدام مربع كاي بين المجموعات. تشير العلامة النجمية "*" إلى الدلالة عند القيمة α < 0.05. الاختصارات: CBG: جلوكوز الدم الشعري. HbA1c: الهيموجلوبين السكري A1C; معدل الذكاء: النطاق الربيعي. N: عدد الحالات. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: مقارنة بين أعراض هشاشة العظام في الركبة ، والأداء البدني ، ومستوى النشاط البدني ، وشدة التصوير الشعاعي ، والالتهاب بين مجموعات السكر في الدم وفرط السكر في الدم. تم الحصول على قيم P من خلال اختبار Mann-Whitney U للمتغيرات في الجدول. تشير العلامة النجمية "*" إلى الدلالة عند القيمة α < 0.05. الاختصارات: IQR: النطاق الربيعي. N: عدد الحالات. HbA1c: الهيموجلوبين السكري A1C; KOOS: إصابة الركبة ونتيجة هشاشة العظام. ADL: أنشطة الحياة اليومية. جودة الحياة: نوعية الحياة. IPAQ: استبيانات النشاط البدني الدولي. MET: مهمة مكافئة لعملية التمثيل الغذائي. HGS: قوة قبضة اليد. التوغ: موقوت. 5TSTS: خمس مرات الجلوس للوقوف. ELISA: مقايسة الممتز المناعي المرتبط بالإنزيم. CRP: بروتين تفاعلي C. AGEs: المنتجات النهائية المتقدمة للجليكوزيشن. IL-1β: إنترلوكين -1β ؛ IL-4: إنترلوكين -4 ؛ NF-κB: العامل النووي-κB. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: تحليلات التحوف اللوجستي المتعددة وفقا لحالة نسبة السكر في الدم والسيطرة. النموذج المعدل 1: معدل نسبة الجلوكوز في الدم الشعرية حسب العرق ومستوى التعليم وأمراض الكلى المزمنة ومؤشر كتلة الجسم ، HbA1c المعدل لمؤشر كتلة الجسم. النموذج 2 المعدل: النموذج 1 المعدل مع إضافة الأدوية المضادة لمرض السكري إلى التعديل المربك. تم اختبار جلوكوز الدم الشعري و HbA1c كمتغيرات مستقلة في كل معلمة. تشير العلامة النجمية "*" إلى الدلالة عند القيمة α < 0.05. الاختصارات: IPAQ: استبيانات النشاط البدني الدولي. MET: مهمة مكافئة لعملية التمثيل الغذائي. ELISA: مقايسة الممتز المناعي المرتبط بالإنزيم. CRP: بروتين تفاعلي C. AGEs: المنتجات النهائية المتقدمة للجليكوزيشن. IL-1β: إنترلوكين -1β ؛ IL-4: إنترلوكين -4 ؛ NF-κB: العامل النووي-κB; UTC: يتعذر الحساب. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
غالبا ما يفضل جمع الدم الوريدي للاختبارات المعملية على أخذ عينات الدم الشعرية من حيث دقة النتائج29. يرتبط HbA1c ارتباطا وثيقا بمضاعفات مرض السكري والطبيعة الكيميائية المستقرة والاختبارات المعملية الموحدة جيدا. نظرا لأن HbA1c يعكس التحكم في نسبة السكر في الدم على مدى 3 أشهر ، فإنه لا يتطلب عينات صيام ، في حين أن أخذ عينات الدم الشعرية لمرة واحدة يمكن أن يعكس حالة نسبة السكر في الدم بنقطة واحدة ، والتي تتأثر بتوقيت ومحتويات الوجبات الحديثة. ومع ذلك ، فإن كلا تقييمي نسبة السكر في الدم له إيجابيات وسلبيات. تتأثر نتائج جلوكوز الدم الشعري بضعف دوران الأوعية الدقيقة ، وانخفاض ضغط الدم ، والجفاف الشديد ، والوذمة ، والحماض الكيتوني السكري ، ووظيفة مقياس السكر التجاري وشرائط الاختبار المستخدمة30. ومع ذلك ، يمكن أن يوفر أخذ عينات الدم الشعرية نتائج فورية ، ويوفر إمكانية وصول أعلى ، ويلتقط حالة نسبة السكر في الدم الحادة. هذا يلبي الاحتياجات البحثية المختلفة ويحتمل أن يعزز القدرة البحثية في البيئات منخفضة الموارد.
في هذه الدراسة ، تم الخلط بين قوة الأطراف السفلية ، والشدة الإشعاعية ، والعلامات المختبرية مع التحكم في نسبة السكر في الدم بسبب مؤشر كتلة الجسم ، وهو علامة على السمنة. وبالمثل ، يعزى الارتباط بين حالة نسبة السكر في الدم بألم KOOS وأعراضه جزئيا إلى التأثير المربك لمؤشر كتلة الجسم ، بينما تم التوسط في الارتباط بقوة الأطراف السفلية بواسطة الأدوية المضادة لمرض السكري. كما وجد سابقا أن الأدوية المضادة لمرض السكري تؤثر على كل من كتلة العضلات وقوةالعضلات 31،32. من ناحية أخرى ، ارتبطت حالة نسبة السكر في الدم الضعيفة لدى الأفراد المصابين بمرض KOA بشكل مستقل بوظيفة أفضل في الرياضة والترفيه. تشير الأهمية المستعادة في مجال وظيفة الرياضة والترفيه في KOOS بعد تعديل ارتباك الأدوية المضادة لمرض السكري إلى أن العلاج ربما يكون قد أخفى تأثير حالة نسبة السكر في الدم على التقييمات الذاتية للمشاركين لخفة حركتهم ووظيفتهم. يتماشى هذا مع درجة KOOS المحسنة بعد إعطاء الميتفورمين والميلوكسيكام والبيوغليتازون في تجربةسريرية 33. ومع ذلك ، على عكس HbA1c ، قد تعكس حالة نسبة السكر في الدم طفرات الجلوكوز على المدى القصير ، والتي من غير المرجح أن تؤثر سلبا على القيود الوظيفية ، مما يؤدي إلى درجات أعلى في استجاباتهم.
وجدت دراسة سابقة أيضا أن درجات مجال KOOS كانت مرتبطة سلبا بالتحكم في نسبة السكرفي الدم 7. وبالمثل ، يتنبأ HbA1c بشكل كبير بدرجات مجال الألم KOOS لدى الأفراد الذين يخضعون لعملية تقويم مفصل الركبة الكلية. ومع ذلك ، يجب أيضا مراعاة وجود ألم لا يطاق لدى أولئك الذين اختاروا استبدال الركبة بالكامل34،35. قد لا ترتبط مقاييس لقطة لنسبة الجلوكوز في الدم الشعرية بدرجات KOOS لأنها تعكس حالة نسبة السكر في الدم في وقت ما ولا تأخذ في الاعتبار التحكم في نسبة السكر في الدم على مدى فترة زمنية36. ومع ذلك ، فإن الارتباط بين ارتفاع السكر في الدم بمستوى التعليم والعرق وأمراض الكلى المزمنة ومؤشر كتلة الجسم يشير إلى أن اختبار الجلوكوز الشعري العشوائي يعكس التحكم في نسبة السكر في الدم ، حيث أن هذه عوامل خطر ثابتة لضعف التحكم في نسبة السكر في الدم. بالإضافة إلى ذلك ، فإن معرفة الإدارة الذاتية للركبة ونمط الحياة وتناول الطعام المتأثرة بالعرق قد تؤثر أيضا على ألم وأعراض KOA37،38،39. عادة ما يكون مرض الكلى المزمن لدى الأفراد المصابين بداء السكري مؤشرا على وجود أمراض الأوعية الدموية الدقيقة ، وهو أحد المضاعفات طويلة الأمد لضعف التحكم في نسبة السكر في الدم40،41. تؤدي زيادة مؤشر كتلة الجسم إلى زيادة الحمل الميكانيكي على مفصل الركبة بالإضافة إلى ارتباطه الراسخ بمقاومة الأنسولين ، وبالتالي ، له دور مهم في التحكم في نسبة السكر فيالدم 42. قد يكون التأثير المربك لمؤشر كتلة الجسم على العلاقة بين التحكم في نسبة السكر في الدم وشدة KOA الإشعاعية انعكاسا للعلاقة بين السمنة ومقاومة الأنسولين بالإضافة إلى الحمل الميكانيكي الناجم عن الوزن على مفصلالركبة 43. اقترحت دراسة سابقة أن العلاج بالأنسولين يؤدي إلى الحماية من تكوين العظم ، مما يشير إلى أن التحكم الأفضل في نسبة السكر في الدم قد يؤدي إلى تقليل التغيرات الهيكلية ل KOA44. بالنظر إلى علامات ELISA ، فإن التعديل غير الأنزيمي للكولاجين ، الذي يشكل AGE لا رجعة فيه ويعكس ارتفاع السكر في الدم التراكمي45. من المحتمل أن يفسر هذا العلاقة بين التحكم في نسبة السكر في الدم وليس حالة نسبة السكر في الدم في هذه الدراسة46. تم العثور أيضا على الارتباط المتناقص بعد تعديل مؤشر كتلة الجسم في دراسات أخرى47.
هناك بعض الخطوات الحاسمة الموضحة في البروتوكولات ، مثل تلك التي أثناء إدارة الاستبيان وشرح الخطوات. يجب أن يضع الباحثون في اعتبارهم الفهم لدى كبار السن المشاركين بسبب الانخفاض المحتمل في الوظيفة المعرفية. يجب أن تكون التعليمات المقدمة واضحة وبعبارات الشخص العادي لتجنب الالتباس. أثناء أخذ عينات الدم ، يجب إطلاع المشاركين على مخاطر حدوث مضاعفات والحصول على الموافقة قبل الإجراء لأنه غازي. بعد الطرد المركزي للدم ، يجب نقل عينات المصل إلى أنابيب متعددة للطرد المركزي الدقيق قبل التجميد لمنع تكرار عمليات التجميد والذوبان التي ستسبب تدهور البروتين وفقدان الإشارة في اختبار ELISA48. يختلف إجراء ELISA خطوة بخطوة باختلاف الشركات المصنعة ، فمن المهم قراءة الدليل جيدا وتحسين وقت الحضانة والتخفيف ودرجة الحرارة وفقا لعينة الدراسة48.
تشمل قيود هذه الدراسة وجود عوامل مربكة غير مقاسة ، مثل العادات الغذائية والاستعدادات الوراثية. علاوة على ذلك ، اقتصرت مجموعة العينات على منطقتي كوالالمبور وسيلانغور ، والتي قد لا تلتقط الاختلافات بين مجموعات سكانية مختلفة للنظر في تأثير نمط الحياة والوصول إلى الرعاية الصحية تجاه حالة نسبة السكر في الدم أو السيطرة. علاوة على ذلك ، فإن KOOS ، باعتباره استبيانا بأثر رجعي تم الإبلاغ عنه ذاتيا ، هو شخصي بطبيعته. يمكن أن تتضمن التقييمات المستقبلية لأعراض الركبة ووظائفها التقييم الميكانيكي الحيوي للتخفيف من التحيزات المحتملة. من أجل تفكير أفضل في الأداء البدني للمشاركين المصابين ب KOA المصابين بداء السكري ، يمكن الحصول على مقاييس متكررة في منهجية الدراسة المستقبلية. فيما يتعلق بالوسطاء الالتهابيين ، قامت هذه الدراسة بقياس خمسة مؤشرات حيوية فقط ، لكن التنميط الأكثر شمولا يمكن أن يرسم خريطة أفضل للآلية الأساسية. يمكن أن يكون حجم العينة الصغير أيضا أحد المخاوف. كان فقدان بيانات جلوكوز الدم الشعرية من إجمالي العينة بسبب نفاد شرائط الاختبار أثناء جمع البيانات في موقع المجتمع وإحجام المشارك عن حضور زيارة ثانية. من ناحية أخرى ، تم إجراء جمع الدم الوريدي لاختبار HbA1c خلال الزيارة الثانية للمستشفى في نفس الوقت الذي تم فيه تصوير الركبة بالأشعة السينية ، الأمر الذي تطلب التزاما إضافيا بالوقت من المشاركين. تم حساب حجم العينة بناء على 80٪ من القوة للحصول على نسبة الأرجحية (OR = 2.010 ، 95٪ CI 1.003 ، 4.026) ، والتي تم تحديدها من الأدبيات المنشورة وأسفرت عن حجم عينة تقديري قدره 7249. في هذه الدراسة ، قمنا بتجميع كل من سكر الدم الصائم وسكر الدم العشوائي في متغير واحد ، وهو CBG. ومع ذلك ، أشارت النتائج إلى انخفاض الحساسية ، حيث يمكن إخفاء ميزة القياس الفردي بواسطة شخص آخر. وبالتالي ، يفضل تحليل ارتباطات حالة نسبة السكر في الدم مع المعلمات عن طريق سكر الدم الصائم وسكر الدم العشوائي ، على التوالي. يجب أن تقيم الدراسات المستقبلية الآن اتجاهات نسبة السكر في الدم على المدى الطويل لتحديد تأثير فرط السكر في الدم المزمن على KOA.
يمكن تعديل البروتوكولات المتضمنة في هذه الدراسة للدراسة الطولية أو التجربة السريرية العشوائية لجمع البيانات باستخدام الاستبيانات والاختبارات الفيزيائية وقياسات مستوى السكر في الدم ومقايسة ELISA. يجب اختيار طرق تقييم نسبة السكر في الدم وأخذ عينات الدم الشعرية وجمع الدم الوريدي بناء على المعلمات التي تم فحصها وطبيعة الدراسة. مع داء السكري كعامل خطر لأمراض القلب والأوعية الدموية واعتلال الشبكية والاعتلال العصبي المحيطي وأمراض الكلى السكرية ، فإن طرق تقييم نسبة السكر في الدم ضرورية بلا شك لاعتمادها في منهجية البحث5،50. علاوة على ذلك ، مهدت التحسينات في إدارة مرض السكري وزيادة متوسط العمر المتوقع الطريق لمضاعفات مرض السكري الناشئة ، مثل السرطان وأمراض الكبد والإعاقة الوظيفيةوالمعرفية 51. هذه متوقعة في اتجاهات البحث المستقبلية.
Disclosures
ليس لدى جميع المؤلفين تضارب في المصالح للإعلان عنه.
Acknowledgements
تم تمويل هذه الدراسة من قبل برنامج منح البحوث الأساسية ، وزارة التعليم العالي ، ماليزيا ، رقم المنحة / الجائزة: FRGS / 1/2021 / SKK0 / UKM / 02/15.
Materials
| Name | Company | Catalog Number | Comments |
| Butterfly needle | BD Vacutainer | 367282 | |
| G*Power 3.1 | Heinrich-Heine-University | https://www.psychologie.hhu.de/arbeitsgruppen/allgemeine-psychologie-und-arbeitspsychologie/gpower | Heinrich-Heine-University, Düsseldorf |
| Glucometer and test strips | Contour plus | https://www.diabetes.ascensia.my/en/products/contour-plus/ | Basel, Switzerland |
| Human CRP(C-Reactive Protein) ELISA Kit | Elabscience | E-EL-H0043-96T | ELISA kit |
| Human IL-1β(Interleukin 1 Beta) ELISA Kit | Elabscience | E-EL-H0149-96T | ELISA kit |
| Human IL-4(Interleukin 4) ELISA Kit | Elabscience | E-EL-H0101-96T | ELISA kit |
| Human NF-κB-p105 subunit | Bioassay Technology Laboratory | E0003Hu | ELISA kit |
| Human NF-κBp105(Nuclear factor NF-kappa-B p105 subunit) | Elabscience | E-EL-H1386-96T | ELISA kit |
| Manual hand dynamometer | Jamar | 5030J1 | Warrenville, Illinois, USA |
| Portable Body Composition Analyzer | InBody ASIA | https://inbodyasia.com/products/inbody-270/ | Inbody 270, Cheonan, Chungcheongnam-do |
| Portable stadiometer | Seca | 213 1821 009 | SECA 213, Hamburg, Germany |
References
- Allen, K. D., Thoma, L. M., Golightly, Y. M. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 30 (2), 184-195 (2022).
- Mat, S., et al. Factors influencing quality of life among older persons living with osteoarthritis using 3 different definitions. Top Geriatr Rehabil. 38 (1), 26-34 (2022).
- Berenbaum, F. Diabetes-induced osteoarthritis: From a new paradigm to a new phenotype. Ann Rheum Dis. 70 (8), 1354 (2011).
- Institute for Public Health. . National health and morbidity survey (NHMS) 2023: Non-communicable diseases and healthcare demand - key findings. , (2024).
- Harding, J. L., Pavkov, M. E., Magliano, D. J., Shaw, J. E., Gregg, E. W. Global trends in diabetes complications: A review of current evidence. Diabetologia. 62 (1), 3-16 (2019).
- Eitner, A., Culvenor, A. G., Wirth, W., Schaible, H. -. G., Eckstein, F. Impact of diabetes mellitus on knee osteoarthritis pain and physical and mental status: Data from the osteoarthritis initiative. Arthritis Care Res (Hoboken). 73 (4), 540-548 (2021).
- Aykan, S. A., Kaymaz, S. The association between diabetes mellitus and functionality in knee osteoarthritis: A cross-sectional study. J Health Sci Med. 5 (4), 1114-1118 (2022).
- Alenazi, A. M., Alqahtani, B. A. Diabetes is associated with longitudinal declined physical performance measures in persons with or at risk of knee osteoarthritis: Data from the osteoarthritis initiative. Eur J Phys Rehabil Med. 60 (3), 496-504 (2024).
- Neumann, J., et al. Diabetics show accelerated progression of knee cartilage and meniscal lesions: Data from the osteoarthritis initiative. Skeletal Radiol. 48 (6), 919-930 (2019).
- Courties, A., Gualillo, O., Berenbaum, F., Sellam, J. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthritis Cartilage. 23 (11), 1955-1965 (2015).
- Wei, G., et al. Risk of metabolic abnormalities in osteoarthritis: A new perspective to understand its pathological mechanisms. Bone Res. 11 (1), 63 (2023).
- Sriwimol, W., Choosongsang, P., Choosongsang, P., Petkliang, W., Treerut, P. Associations between hba1c-derived estimated average glucose and fasting plasma glucose in patients with normal and abnormal hemoglobin patterns. Scand J Clin Lab Invest. 82 (3), 192-198 (2022).
- Papachristoforou, E., Lambadiari, V., Maratou, E., Makrilakis, K. Association of glycemic indices (hyperglycemia, glucose variability, and hypoglycemia) with oxidative stress and diabetic complications. J Diabetes Res. 2020 (1), 7489795 (2020).
- Matsushita, Y., et al. A comparison of the association of fasting plasma glucose and hba1c levels with diabetic retinopathy in japanese men. J Diabetes Res. 2020 (1), 3214676 (2020).
- Baig, M. A. Comparative evaluation of efficiency of hba1c, fasting & post prandial blood glucose levels, in the diagnosis of type-2 diabetes mellitus and its prognostic outcome. Int J Res Med Sci. 3 (11), 3245-3249 (2015).
- Altman, R., et al. Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthritis Rheum. 29 (8), 1039-1049 (1986).
- Kang, H. Sample size determination and power analysis using the G* power software. J Educ Eval Health Prof. 18, (2021).
- Roos, E. M., Lohmander, L. S. The knee injury and osteoarthritis outcome score (koos): From joint injury to osteoarthritis. Health Qual Life Outcomes. 1, 64 (2003).
- Ipaq Research Committee. . Guidelines for data processing and analysis of the international physical activity questionnaire (IPAQ)-short and long forms. , (2005).
- Perissinotto, E., Pisent, C., Sergi, G., Grigoletto, F., Enzi, G. Anthropometric measurements in the elderly: Age and gender differences. Br J Nutr. 87 (2), 177-186 (2002).
- Sun, Y. -. S., et al. Calf circumference as a novel tool for risk of disability of the elderly population. Sci Rep. 7 (1), 16359 (2017).
- Chen, L. -. K., et al. Asian working group for sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment. J Am Med Dir Assoc. 21 (3), 300-307 (2020).
- Samah, Z. A., et al. Discriminative and predictive ability of physical performance measures in identifying fall risk among older adults. Sains Malays. 47 (11), 2769-2776 (2018).
- Bohannon, R. W., Williams Andrews, A. Normal walking speed: A descriptive meta-analysis. Physiotherapy. 97 (3), 182-189 (2011).
- Kim, M., Won, C. W. Cut points of chair stand test for poor physical function and its association with adverse health outcomes in community-dwelling older adults: A cross-sectional and longitudinal study. J Am Med Dir Assoc. 23 (8), 1375-1382.e3 (2022).
- Parcell, A. C., Sawyer, R. D., Tricoli, V. A., Chinevere, T. D. Minimum rest period for strength recovery during a common isokinetic testing protocol. Med Sci Sports Exerc. 34 (6), (2002).
- Kohn, M. D., Sassoon, A. A., Fernando, N. D. Classifications in brief: Kellgren-lawrence classification of osteoarthritis. Clin Orthop Relat Res. 474 (8), 1886-1893 (2016).
- Gottschalk, P. G., Dunn, J. R. Measuring parallelism, linearity, and relative potency in bioassay and immunoassay data. J Biopharm Stat. 15 (3), 437-463 (2005).
- Das, S., Swain, M., Pradhan, R. Evaluating the relationship of fasting capillary and venous blood sugar level in self-glucose monitoring device, fasting plasma glucose level and glycosylated hemoglobin (HbA1c). Nurs Care Open Access J. 1 (2), 00011 (2016).
- Bao, Y., Zhu, D. Clinical application guidelines for blood glucose monitoring in china (2022 edition). Diabetes Metab Res Rev. 38 (8), e3581 (2022).
- Wu, C. -. N., Tien, K. -. J. The impact of antidiabetic agents on sarcopenia in type 2 diabetes: A literature review. J Diabetes Res. 2020 (1), 9368583 (2020).
- Kalaitzoglou, E., Fowlkes, J. L., Popescu, I., Thrailkill, K. M. Diabetes pharmacotherapy and effects on the musculoskeletal system. Diabetes Metab Res Rev. 35 (2), e3100 (2019).
- Mohammed, M. M., Al-Shamma, K. J., Jassim, N. A. Evaluation of the clinical use of metformin or pioglitazone in combination with meloxicam in patients with knee osteoarthritis; using knee injury and osteoarthritis outcome score. Iraqi J Pharm Sci. 23 (2), 13-23 (2014).
- Vervullens, S., et al. Preoperative glycaemic control, number of pain locations, structural knee damage, self-reported central sensitisation, satisfaction and personal control are predictive of 1-year postoperative pain, and change in pain from pre- to 1-year posttotal knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. , (2024).
- Eitner, A., et al. Pain sensation in human osteoarthritic knee joints is strongly enhanced by diabetes mellitus. Pain. 158 (9), 1743-1753 (2017).
- Li, H., George, D. M., Jaarsma, R. L., Mao, X. Metabolic syndrome and components exacerbate osteoarthritis symptoms of pain, depression and reduced knee function. Ann Transl Med. 4 (7), 133 (2016).
- Khachian, A., Seyedoshohadaei, M., Haghani, H., Amiri, F. Effect of self-management program on outcome of adult knee osteoarthritis. Int J Orthop Trauma Nurs. 39, 100797 (2020).
- Mat, S., et al. Ethnic differences in the prevalence, socioeconomic and health related risk factors of knee pain and osteoarthritis symptoms in older malaysians. PLoS One. 14 (11), e0225075 (2019).
- Cruz-Almeida, Y., et al. Racial and ethnic differences in older adults with knee osteoarthritis. Arthritis Rheumatol. 66 (7), 1800-1810 (2014).
- Kalantar-Zadeh, K., et al. Patient-centred approaches for the management of unpleasant symptoms in kidney disease. Nat Rev Nephrol. 18 (3), 185-198 (2022).
- Hsu, H. -. J., et al. Factors associated with chronic musculoskeletal pain in patients with chronic kidney disease. BMC Nephrol. 15 (1), 6 (2014).
- Larsen, P., Engberg, A. S., Motahar, I., Ostgaard, S. E., Elsoe, R. Obesity influences the knee injury and osteoarthritis outcome score. Joints. 7 (01), 008-012 (2019).
- Solanki, P., et al. Association between weight gain and knee osteoarthritis: A systematic review. Osteoarthritis Cartilage. 31 (3), 300-316 (2023).
- Al-Jarallah, K., Shehab, D., Abdella, N., Al Mohamedy, H., Abraham, M. Knee osteoarthritis in type 2 diabetes mellitus: Does insulin therapy retard osteophyte formation. Med Princ Pract. 25 (1), 12-17 (2016).
- Suzuki, A., Yabu, A., Nakamura, H. Advanced glycation end products in musculoskeletal system and disorders. Methods. 203, 179-186 (2022).
- Wang, M., Hng, T. M. Hba1c: More than just a number. Aust J Gen Pract. 50 (9), 628-632 (2021).
- Kalousova, M., Skrha, J., Zima, T. Advanced glycation end-products and advanced oxidation protein products in patients with diabetes mellitus. Physiol Res. 51 (6), 597-604 (2002).
- Shah, K., Maghsoudlou, P. Enzyme-linked immunosorbent assay (elisa): The basics. Br J Hosp Med. 77 (7), C98-C101 (2016).
- Nakanishi, S., et al. The impact of hand strength on hba1c, body mass index and body composition by group according to sedentary behaviour: Cross-sectional study in japanese patients with type 2 diabetes mellitus. Malays J Med Sci. 31 (3), 185-193 (2024).
- Joseph, J. J., et al. Comprehensive management of cardiovascular risk factors for adults with type 2 diabetes: A scientific statement from the american heart association. Circulation. 145 (9), e722-e759 (2022).
- Tomic, D., Shaw, J. E., Magliano, D. J. The burden and risks of emerging complications of diabetes mellitus. Nat Rev Endocrinol. 18 (9), 525-539 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved