Method Article
Tomografia Optoacústica Multiespectral para Imagem Funcional em Pesquisa Vascular
Neste Artigo
Resumo
O presente protocolo descreve a aquisição de imagens optoacústicas multiespectrais de vasculatura cutânea humana in vivo. Estes incluem a quantificação de hemoglobina e melanina, considerados cromóforos de interesse para análise funcional.
Resumo
O comprometimento microcirculatório tem sido reconhecido em vários processos de doença, subjacente a esse tema crescente dentro da pesquisa vascular. Nos últimos anos, o desenvolvimento de sistemas de imagem ao vivo estabeleceu o ritmo (analítico) na pesquisa básica e clínica, com o objetivo de criar novos instrumentos capazes de fornecer endpoints quantificáveis em tempo real com interesse clínico e aplicação. Espectroscopia de infravermelho próximo (NIRS), tomografia por emissão de pósitrons (PET), tomografia computadorizada (TC) e ressonância magnética (RM) estão disponíveis, entre outras técnicas, mas o custo, a resolução da imagem e o contraste reduzido são reconhecidos como desafios comuns. A tomografia optoacústica (OT) oferece uma nova perspectiva sobre a imagem funcional vascular, combinando capacidades de absorção óptica e resolução espacial de última geração (da resolução óptica microscópica à acústica milimétrica) com a profundidade do tecido. Neste estudo, testou-se a aplicabilidade da tomografia optoacústica multiespectral (ODM) para imagens funcionais. O sistema usa um oscilador óptico paramétrico ajustável (OPO) bombeado por um laser Nd: YAG, fornecendo pulsos de excitação detectados por uma sonda 3D em comprimentos de onda de 680 nm a 980 nm. As imagens obtidas do antebraço humano foram reconstruídas através de um algoritmo específico (fornecido dentro do software do fabricante) com base na resposta de cromóforos específicos. A Hemoglobina Oxigenada Máxima (HbOMáxima 2) e a Hemoglobina Desoxigenada (Hb Máxima), a Hemoglobina Total (HbT) e a Saturação Média de Oxigênio (mSO2) à densidade vascular (μVu), distâncias médias interunidades (ζAd) e volume sanguíneo capilar (mm3) podem ser medidas usando esse sistema. O potencial de aplicabilidade encontrado com este sistema de OT é relevante. Os desenvolvimentos contínuos de software certamente melhorarão a utilidade desse sistema de imagem.
Introdução
As doenças cardiovasculares são as principais causas recorrentes de morte em todo o mundo e representam um enorme fardo para qualquer sistema de saúde 1,2. A tecnologia tem sido um dos principais contribuintes para a expansão de nossa compreensão da fisiopatologia cardíaca e vascular fundamental, fornecendo ferramentas diagnósticas mais precisas e a possibilidade de detecção precoce de doenças e manejo mais eficaz. As técnicas de imagem oferecem a possibilidade de medir não apenas o desempenho cardíaco e dos vasos maiores, mas também, em uma escala muito menor, calcular a densidade capilar, a perfusão e o volume locais, a disfunção endotelial, entre outras características. Essas tecnologias ofereceram os primeiros insights quantitativos sobre biologia vascular com aplicação clínica direta. Alterações na densidade capilar, redução da perfusão local ou oclusão provavelmente correspondem a uma condição isquêmica, o que ajuda a explicar o crescente papel da imagem, tornando-se uma ferramenta indispensável na pesquisa e prática cardiovascular 3,4,5.
Nos últimos anos, a imagem funcional tem consistentemente definido o ritmo da inovação tecnológica, com espectroscopia de ultrassom (US) no infravermelho próximo (NIRS), tomografia por emissão de pósitrons (PET), tomografia computadorizada (TC) e ressonância magnética (MRI) como alguns exemplos bem conhecidos. No entanto, múltiplas preocupações limitam sua aplicação, desde o custo e a segurança do paciente (bem como o conforto) até o contraste e a resolução da imagem 6,7. A tomografia optoacústica (OT) emergiu recentemente como uma nova direção na pesquisa vascular de base óptica. Essa tecnologia, centrada na detecção de ondas ultrassônicas geradas pela expansão termoelástica do tecido impactado com pulsos de laser ultracurtos, é conhecida há algum tempo 6,8. Esta reação física de desenvolvimento de calor e expansão tecidual evoca um sinal acústico detectado por um transdutor de ultrassom. O uso de pulsos de luz do visível ao infravermelho próximo e a ausência de um sinal acústico de fundo beneficiam a profundidade de resolução. O contraste detectado resulta dos cromóforos mais importantes presentes (hemoglobina ou melanina). Em comparação com outras tecnologias, a OT tem as vantagens de (1) não necessitar de contraste (imagem sem rótulo), (2) melhor contraste e resolução com menos artefatos do que a ultrassonografia, e (3) menor preço, aquisição mais rápida e facilidade de operação 6,9,10,11.
A tomografia optoacústica multiespectral (MSOT) está entre as mais recentes gerações de instrumentos de TO. Construído com um oscilador óptico paramétrico ajustável (OPO) bombeado por um laser Nd:YAG que fornece pulsos de excitação, uma imagem 3D é adquirida por sinais resolvidos pelo tempo detectados a partir de pulsos de excitação ultrassônica de alta frequência em comprimentos de onda de 680 nm a 980 nm com uma taxa de repetição de até 50 Hz12. A plataforma de imagem optoacústica fornece a quantificação de diferentes cromóforos em profundidade (tão baixos quanto 15 mm). Variáveis como HbO2, Hb e melanina são facilmente acessíveis. Outras variáveis de interesse, como a Hemoglobina Oxigenada máxima (HbO Máxima2) e a Hemoglobina Desoxigenada (Hb Máxima), também estão disponíveis. Os algoritmos de reconstrução do software do fabricante permitem o cálculo de outras variáveis, como densidade vascular (μVu), distância média interunidades (ζAd) e volume capilar (mm3).
O presente estudo explora os aspectos operacionais essenciais deste novo sistema para entender melhor seus aspectos práticos e potenciais aplicações em pesquisas pré-clínicas cardiovasculares.
Protocolo
O protocolo experimental foi previamente aprovado pelo Comitê de Ética da Faculdade de Ciências da Saúde (CE) da Universidade. ECTS/P10.21). Os procedimentos respeitaram plenamente os princípios de boas práticas clínicas definidos para a pesquisa em humanos13. Uma amostra conveniente de seis participantes saudáveis de ambos os sexos (n = 3 por sexo) com idade média de 32,8 ± 11,9 anos foi escolhida da comunidade universitária. Os participantes selecionados deveriam ser normotensos, não fumantes e livres de qualquer medicação ou suplementação alimentar. A pressão arterial, a frequência cardíaca e o Índice de Massa Corporal também foram registrados. Todos os participantes foram previamente informados dos objetivos e duração do estudo e assinaram o termo de consentimento livre e esclarecido.
NOTA: Este estudo foi realizado utilizando o MSOTAcuity (ver Tabela de Materiais), doravante referenciado como a plataforma de imagem optoacústica.
1. Preparação para Aquisição
Observação : na descrição experimental a seguir, os comandos de tela estão no tipo Boldface.
- Carregando informações do assunto: Ligue o equipamento de imagem optoacústica. Enquanto o equipamento está aquecendo, introduza as informações do participante. A janela principal de boas-vindas do software é aberta para a visão geral do Scan. Introduza dados (incluindo nome, denominação do estudo, dados pessoais e quaisquer observações relevantes) depois de clicar em ID do paciente e conclua o aplicativo pressionando Selecionar.
- Seleção predefinida: Verifique se a mensagem Laser is Ready ( Laser is Ready ) aparece na tela do equipamento. Após o tempo de aquecimento, a barra de status do laser na tela do equipamento deve mudar de Laser Standby para Laser is Ready. Para este protocolo, a predefinição é projetada para cromóforos Hb, HbO2 e melanina. Depois de selecionar a predefinição correta, a potência do laser será testada.
- Neste ponto, certifique-se de que há uma mensagem na tela que lembre todos os participantes da sala para aplicar googles de segurança a laser. Pressione o pedal do interruptor de laser (alimentação) e aguarde a autoverificação da potência do laser. Após alguns segundos, uma janela aparece com o status atual do laser com um relatório de check-up. Solte esta janela pressionando o botão OK disponível.
NOTA: A plataforma de imagem optoacústica usa um laser Nd:YAG, considerado um laser de classe 4 particularmente perigoso para o olho humano. Assim, este laser deve ser manuseado com os devidos cuidados.
CUIDADO: Nenhuma aquisição deve ocorrer sem garantir que todos os procedimentos de segurança, incluindo a proteção ocular apropriada, estejam em vigor.
2. Posicionamento e Aquisição de Imagem
- Aclimatar o participante ao ambiente de laboratório (21 °C ± 1 °C; 40%-60% de umidade relativa), escolhendo uma posição confortável para minimizar movimentos desnecessários. Certifique-se de que a área a ser verificada esteja previamente limpa.
NOTA: Recomenda-se a recomendação do fabricante para limpar a área a ser fotografada com uma solução de etanol/água a 70%. Além disso, para melhor aquisição de imagem, sugere-se a remoção de pelos (quando aplicável). - Suporte da sonda e estabilização de imagem
- Aplique uma fina camada de gel de ultrassom no copo 3D. A estabilização de imagem requer a manutenção do copo 3D na posição de imagem desejada. Posicione e estabilize um braço travável para a área de interesse. O braço utilizado neste estudo foi projetado internamente e construído com componentes de perfil de alumínio (Figura 1).
- Depois de colocar o copo 3D na área de interesse, trave parcialmente a trava do braço estabilizador para aquisição de imagem.
NOTA: A qualidade e até mesmo a aplicação do gel de ultrassom é crítica; a presença de bolhas de ar pode comprometer a definição da imagem.
- Aquisição de imagens para condições dinâmicas, utilizando a manobra de Hiperemia Reativa Pós-Oclusiva (PORH), na aba do menu Exame .
- Adquira a varredura de controle de linha de base. Depois de encontrar um campo de visão para imagens, com o manguito de pressão arterial esvaziado no lugar, trave com segurança o braço de posicionamento do copo 3D.
- Aplique pressão mínima no local da imagem, pois pressões mais altas podem comprometer as leituras. Empurre a Hb, a HbO 2 e a melanina predefinidas padrão do fabricante, que medem simultaneamente os cromóforos para Hb, HbO2 e melanina.
CUIDADO: É obrigatório proteger os olhos com óculos de segurança adequados durante a operação.
NOTA: Os fototipos de pele IV a VI (pele escura) são propensos a erros de leitura, exigindo uma imagem de controle de linha de base para processamento adicional. O uso de óculos de segurança durante a aquisição da imagem (quando o laser está ativo) só permite que o olho humano reconheça as cores amarela e azul. As cores podem ser editadas durante o processamento da imagem. - Selecione a área anatômica para aquisição da imagem de linha de base. Para fins exploratórios, recomenda-se o antebraço ventral. Prossiga pressionando o pedal do pedal do pedal a laser.
NOTA: O botão de tela sensível ao toque rotulado Exibir (colorido de amarelo), que mostra a imagem ao vivo na tela quando pressionado. O status de estabilidade da imagem é mostrado como uma barra cinza no meio da tela sensível ao toque, indicando a estabilidade da sonda 3D.- Quando a estabilidade da imagem estiver maximizada, tire (ou capture) um instantâneo da área pressionando o botão Instantâneo na tela sensível ao toque. Cada varredura adquirirá de 10 a 12 quadros a uma profundidade acústica de 150 mm para cada comprimento de onda definido dentro da predefinição durante um tempo de aquisição de 2 s. Esta varredura de aquisição de linha de base incluirá um total de 30-36 quadros.
NOTA: 10 quadros para cada cromóforo detectado (Hb, HbO2 e melanina) são coletados com uma profundidade máxima de 15 mm. - Continue pressionando o pedal do pedal do pedal do pedal a laser para aquisição contínua de vídeo e preste atenção ao botão Exibir (colorido de amarelo) na tela sensível ao toque. A imagem estabilizada aparecerá. Pressione Gravar (cor azul) para iniciar a gravação de imagens ao vivo.
- Pare a gravação pressionando o botão Parar (cor preta). A plataforma de imagem optoacústica interromperá a gravação e renderizará automaticamente o vídeo para o modo de visualização.
- Quando a estabilidade da imagem estiver maximizada, tire (ou capture) um instantâneo da área pressionando o botão Instantâneo na tela sensível ao toque. Cada varredura adquirirá de 10 a 12 quadros a uma profundidade acústica de 150 mm para cada comprimento de onda definido dentro da predefinição durante um tempo de aquisição de 2 s. Esta varredura de aquisição de linha de base incluirá um total de 30-36 quadros.
- Medidas dinâmicas (ilustração PORH): Ajuste o manguito de pressão ao braço do paciente acima do cotovelo para ilustrar essa manobra. Inflar o manguito com pressão supra-sistólica (~200 mmHg) e proceder de acordo com os passos 2.3.1 a 2.3.3.1 para adquirir a vasculatura fotografada sob pressão.
- Para adquirir um vídeo para avaliar o impacto da liberação de pressão na vasculatura fotografada, abra a válvula de pressão enquanto adquire o vídeo como em 2.3.3.2. Como antes, acompanhe a imagem ao vivo na tela.
NOTA: Para executar esta manobra, a pressão supra-sistólica deve ser mantida por 1-5 min; é importante estar ciente de que essa pressão pode induzir diferentes graus de tolerância e desconforto no paciente. Este aspecto deve ser cuidadosamente gerenciado durante os experimentos.
3. Protocolo de análise de imagens
- Copie as digitalizações gravadas para uma pasta selecionada/dedicada para backup e análise adicional em uma estação de trabalho de computador separada usando o software analítico dedicado do fabricante. Cada varredura é armazenada por tempo de aquisição e ordenada pelo programa em uma pasta de estudo com um código em execução.
Observação : uma cópia de backup é altamente recomendada. Trabalhar diretamente com os dados brutos gravados é possível, mas fortemente desencorajado, pois qualquer falha potencial no disco rígido pode danificar os dados brutos. - Abra o programa de análise no computador da estação de trabalho. Escolha o menu do programa > Open Study para importar arquivos e acessar varreduras de backup. Abra o estudo e role até a parte inferior da pasta (com varreduras gravadas) para encontrar arquivos com um arquivo . Extensão NOD. Este é o único tipo de arquivo reconhecido pelo software para abrir um estudo.
NOTA:. Os arquivos NOD são nomeados automaticamente com um número de execução dado a cada estudo e não contêm informações do paciente no nome do arquivo. - Para reconstrução de imagem, abra o módulo de análise de imagem acessando o software Menu > Processamento avançado.
- Verifique se as guias do fluxo de trabalho do programa estão visíveis (coloridas de preto) na barra de menus superior (Figura 1 Suplementar): Menu; Visão geral da varredura; Reconstrução; Correção de Fluência; Desmistura Espectral; Visualização e Análise. Durante a análise, qualquer guia de fluxo de trabalho ativada é colorida de azul.
NOTA: Se o Processamento Antecipado não for aberto, o software mostrará apenas Visão Geral da Digitalização e Visualização e Análise.
- Verifique se as guias do fluxo de trabalho do programa estão visíveis (coloridas de preto) na barra de menus superior (Figura 1 Suplementar): Menu; Visão geral da varredura; Reconstrução; Correção de Fluência; Desmistura Espectral; Visualização e Análise. Durante a análise, qualquer guia de fluxo de trabalho ativada é colorida de azul.
- Reconstrua a imagem através da guia Reconstrução do software. Selecione as varreduras a serem reconstruídas no lado esquerdo do menu principal do programa. As varreduras carregadas aparecem no lado direito da tela. Deixe os seis comprimentos de onda de emissão optoacústica padrão (700, 730, 760, 800, 850 e 900 nm), pois eles incluem o sinal optoacústico máximo para HbO2 a 900 nm, para Hb a 760 nm e melanina a 700 nm.
- Execute a reconstrução da varredura usando o ícone no lado direito. Siga o fluxo de trabalho do programa selecionando a predefinição Digitalizar e o Campo de visão (resolução). As informações são apresentadas no canto superior esquerdo da tela principal. Ajuste a velocidade do som para ajustar o foco da varredura (Figura 2 Suplementar). O painel Reconstrução também mostra o número de quadros de cada varredura adquirida e permite a seleção das repetições a serem analisadas (se necessário).
NOTA: Cada varredura é carregada com uma velocidade padrão de som de -90, que deve ser ajustada pelo usuário. A velocidade do som também pode ser ajustada automaticamente com uma função de foco automático (AF).
- Execute a reconstrução da varredura usando o ícone no lado direito. Siga o fluxo de trabalho do programa selecionando a predefinição Digitalizar e o Campo de visão (resolução). As informações são apresentadas no canto superior esquerdo da tela principal. Ajuste a velocidade do som para ajustar o foco da varredura (Figura 2 Suplementar). O painel Reconstrução também mostra o número de quadros de cada varredura adquirida e permite a seleção das repetições a serem analisadas (se necessário).
- Pressione o botão Reconstruct Scans na parte superior da tela para avançar para a reconstrução da varredura. Um painel temporário aparecerá com a mensagem Processamento de Trabalho. Este painel também pode ser acessado a partir do Menu > Status de processamento. Após o término da reconstrução, a análise de pós-processamento da imagem deve avançar para a Correção de Fluência.
- Ativar a correção do Fluence de imagens reconstruídas no menu do painel. As imagens reconstruídas devem ser carregadas para correção da fluência. Eles aparecem com um sinalizador ao lado de cada número de varredura. Os arquivos carregados serão imediatamente exibidos no lado direito da tela como Reconstruções Selecionadas. Ative a Correção de fluência interagindo com o ícone no lado direito da tela (Figura 3 Suplementar). Empurre a( s) correção(ões) de salvamento de fluência para o progresso.
- Após salvar a correção de fluência, realize a desmistura espectral da predefinição adquirida (Hb, HbO2 e melanina). Selecione a guia Desmixagem espectral para abrir a lista de Reconstruções Selecionadas para desmixagem espectral. Uma lista com cada varredura do estudo selecionado será exibida com o histórico das etapas anteriores de processamento de imagem.
- Carregue os arquivos de correção de fluência salvos anteriormente. As varreduras carregadas serão exibidas imediatamente no lado direito da tela como Reconstruções Selecionadas (Figura 4 Suplementar). Ative a desmistura espectral pressionando o ícone no lado direito da tela.
- Observe os comprimentos de onda a serem não misturados. Todos os seis comprimentos de onda de emissão optoacústica (700, 730, 760, 800, 850 e 900 nm) levados para a etapa de reconstrução (etapa 3.4) são automaticamente escolhidos para desmixagem espectral. Edite os espectros desejados a serem processados (por exemplo, Espectros: Hb, HbO2 e melanina) usando o ícone XYZ , se necessário.
- Depois de confirmar os parâmetros ajustados, clique em Start Spectral Unmixing para que o desenrolar espectral progrida. Uma barra de menus de processamento é exibida, exibindo o progresso da operação.
NOTA: Vários ajustes de parâmetros são possíveis durante a desmistura espectral, e vários métodos de desmistura estão disponíveis. Neste protocolo, o método de Regressão Linear é usado como padrão para desmisturar Hb, HbO2 e melanina.
- Acesse a guia Visualização e Análise . Clique em uma varredura ativada para exibir todas as informações e comentários do assunto introduzidos na etapa 1.1 (Figura 5 Suplementar).
Observação : várias varreduras podem ser visualizadas em paralelo.- Pressione o botão + para criar uma análise de varredura múltipla. Nesta janela, introduza uma visualização de varredura múltipla e pressione o botão Salvar . Depois de salvar o nome da exibição, um novo painel é exibido, incluindo todas as varreduras do estudo que está sendo analisado.
- Selecione cada varredura desejada para Adicionar (cada) à Visualização de Análise salva. Adicione varreduras adicionais no ícone do canto superior esquerdo e elas serão exibidas automaticamente na Visualização de análise.
- Na visualização de análise, defina tabelas de pesquisa de cores adequadas para preparar a imagem para análise. Clique em Mais Opções de Controle de Imagem na barra de menus superior e ative o ícone Projeção de Intensidade Máxima. Atribua cores a camadas pressionando o ícone disponível no canto inferior direito da exibição da imagem, adjacente à exibição da imagem 2D+.
- Selecione Mais para editar as cores de todos os canais simultaneamente. Este menu mostra todos os cromóforos não misturados e permite a seleção de várias camadas para exibição.
Observação : mover o mouse sobre os ícones de software mostra seu nome em cinza conforme exibido no protocolo. - Ajuste a intensidade de cor de cada camada com as ferramentas disponíveis no canto inferior esquerdo da tela.
NOTA: O ajuste com interpolação mín/máximo para cada canal geralmente produz bons resultados.
4. Análise da Região de Interesse (ROI)
NOTA: A seleção de uma Região de Interesse (ROI) é obrigatória para a análise dos dados.
- Identifique o ROI a ser analisado. Envolva o ROI com as formas disponíveis (na barra de menus) na imagem XY enquanto rastreia o mesmo ROI dentro das visualizações ortogonais disponíveis nos eixos XZ e YZ (Figura 6 Suplementar).
NOTA: Uma forma de polígono foi usada para a análise atual do ROI.- Siga a forma de ROI nos eixos XZ e YZ restantes (exemplo na Figura 2) enquanto coloca várias camadas de polígonos com a função Add Interpolate e Remove sub-regions . Os dados podem ser plotados após a definição/seleção do ROI desejado.
- Pressione o ícone Importar região de interesse para quantificação e observe o componente multi espectros mostrado no lado direito da tela como um detalhe gráfico do ROI selecionado.
- Exporte os dados do ROI pressionando o ícone do Excel na parte inferior da exibição gráfica dos dados do ROI. Todo o pacote de dados de todas as regiões é exportado como um pacote para uma planilha para análise subsequente. A Figura 3 mostra os dados de um participante que se submeteu a um manguito de pressão inflado para 200 mmHg e a vasculatura foi analisada em comparação com o estado de repouso da vasculatura a 0 mmHg.
- Quantifique vários objetos de ROI simultaneamente seguindo as etapas 4.1-4.1.3.
- Exporte imagens do mesmo menu que os arquivos TIFF com todos os dados incorporados e o contorno de ROI interno (Figura 2).
Resultados
Os dados fornecidos pela imagem optoacústica podem ser analisados em imagens de exportação pós-processadas (Figura 2) e dados plotados (Figura 3). O objetivo aqui foi introduzir a operação da imagem funcional optoacústica e explorar sua aplicação em pesquisas vasculares mais comumente conhecidas. Para tanto, comparamos as imagens adquiridas durante o repouso e após uma oclusão de 200 mmHg de uma artéria principal fornecedora (Figura 2). Essas observações podem ser quantificadas após análise de ROI e exportação. No plano XY, observa-se o maior sinal de melanina em relação aos planos YZ e XZ, o que indica o limite da epiderme. A oclusão da artéria braquial (braço) provoca alguma estase nos vasos antes da colocação da sonda OT (antebraço ventral). Em consequência, detectamos um aumento nos sinais gerais mostrados como um aumento de azul (Hb) e vermelho (HbO2) nos eixos XY, YZ e XZ. A estase pode ser seguida no plano XY enquanto se mantém a pressão de 200 mmHg dentro do manguito. Os eixos YZ e XZ retratam aumento do volume sanguíneo devido à oclusão acima em comparação com as condições normais de perfusão (sem oclusão), destacadas pelas áreas mascaradas magenta.
A análise do ROI exportado da mesma área de microvasculatura quantifica os cromóforos HbO 2 (vermelho), Hb (azul) e HbT (rosa), mSO2 (vermelho profundo) e melanina (amarelo) a partir de imagens estabilizadas coletadas acima de 8,6 s. A liberação de pressão é imediatamente detectada; A Figura 3 mostra a evolução pós-oclusão da recuperação de Hb, HbO2 e HbT, enquanto a saída de dados optoacústicos segue as observações da Figura 1. O software calcula a saturação de oxigênio no sangue (mSO 2) e os valores de HbT a partir da adição dos sinais arbitrários de Hb e HbO2. A concentração de melanina permanece constante dentro da oclusão de 200 mmHg e no estado de repouso dentro do intervalo de tempo de aquisição da imagem.
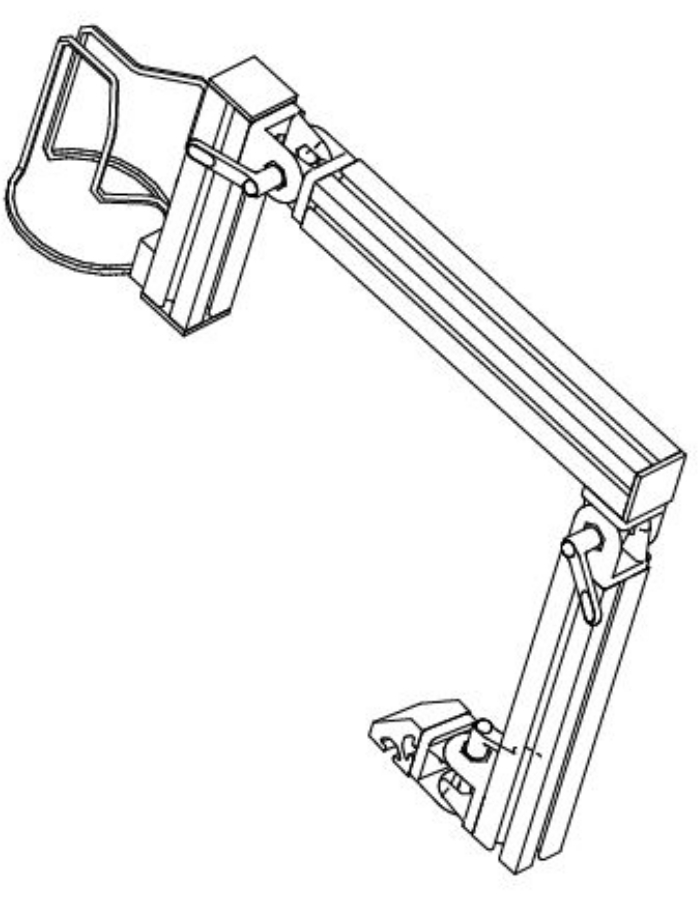
Figura 1: Diagrama esquemático representando o braço flexível projetado para manter a sonda de medição em contato estabilizado com a pele do participante. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens optoacústicas representativas destacando alterações da vasculatura em repouso ou sob pressão de 200 mmHg. A imagem mostrada inclui três cores, representando Hb (azul), HbO2 (vermelho) e melanina (amarelo), conforme descrito na análise da imagem na seção 4. Cada imagem optoacústica representa uma projeção de intensidade máxima de todos os planos associados a cada cromóforo digitalizado. (A) O plano XY da aquisição optoacústica. (B) A vista ortogonal YZ do mesmo local optoacústico fotografado. (C) A vista XZ da área digitalizada. As setas magenta apontam para as áreas com estase aumentada; a área mascarada magenta marca o aumento do volume de sangue preso no interior dos vasos devido à oclusão da artéria braquial em comparação com as condições normais de perfusão (sem oclusão). Por favor, clique aqui para ver uma versão maior desta figura.
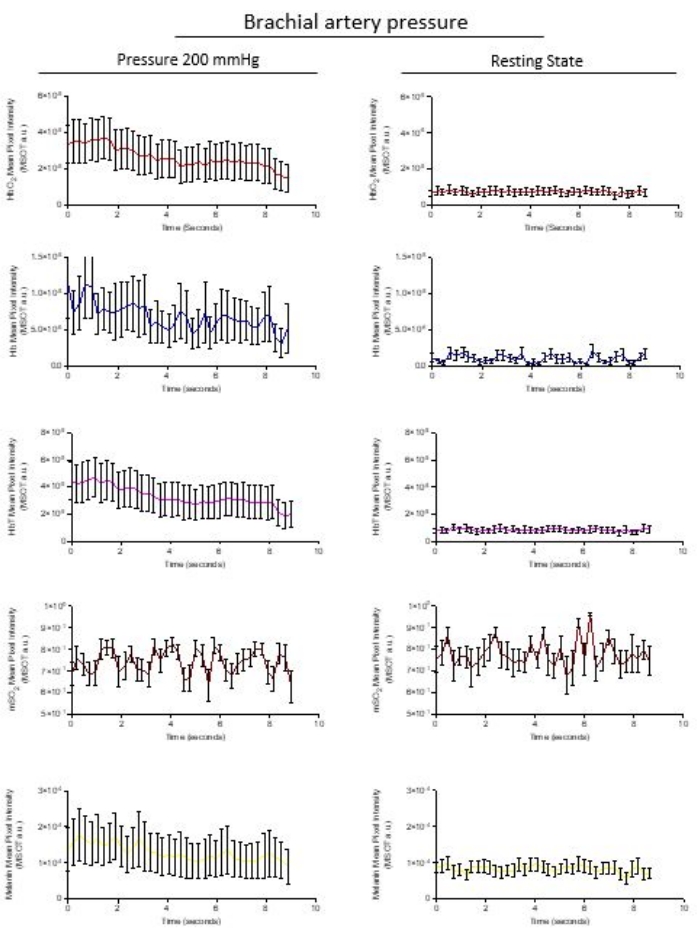
Figura 3: Exportação de dados representativos de um ROI quantificado. Os cromóforos naturais de HbO 2 (Vermelho), Hb (Azul) e HbT (Rosa), mSO2 (vermelho profundo) e melanina (amarelo) são representados a partir dos dados extraídos das imagens estabilizadas coletadas ao longo de 8,6 s. Os gráficos de Hb, HbO2 e HbT mostram uma inclinação de recuperação da oclusão para o estado de repouso não ocluído. A oxigenação sanguínea calculada mSO2 e a concentração de melanina permanecem constantes dentro da oclusão de 200 mmHg e no estado de repouso dentro do intervalo de tempo de aquisição da imagem. As imagens extraídas são pontos de dados representados como média ± sd de n = 10 imagens por quadro. Por favor, clique aqui para ver uma versão maior desta figura.
Figura 1 suplementar: Painel de visão geral da varredura e menu principal do software de análise. Pressionando o botão Menu (em preto), o menu principal exibirá opções para selecionar o estudo selecionado. Esta ação selecionará e carregará o arquivo ".nod" reconhecido pelo software. A visão geral da varredura (em azul) mostra todas as varreduras do estudo. Os detalhes (preto) aparecem à direita. Clique aqui para baixar este arquivo.
Figura 2 suplementar: Fluxo de trabalho de análise de reconstrução. Painel 1 - Selecione a digitalização a ser reconstruída e pressione a seta voltada para a direita no lado direito da tela (seta roxa) para avançar. Painel 2 - Observe a velocidade do som e ajuste o controle deslizante para o melhor foco (seta azul); a) foco ajustado exibido no lado direito da janela; b) selecionar repetições a serem analisadas (seta amarela); c) pressione o botão Reconstruct scans para prosseguir (seta verde). Clique aqui para baixar este arquivo.
Figura 3 suplementar: Fluxo de trabalho do painel de correção do Fluence. Painel 1 - Selecione varreduras a serem corrigidas e pressione a seta voltada para a direita no lado direito da tela. Painel 2 - pressione Salvar( es) Correção(ões) de Fluência para prosseguir (seta verde). Clique aqui para baixar este arquivo.
Figura 4 suplementar: Fluxo de trabalho do painel de desmistura de espectros. Painel 1 - Selecione varreduras para desmisturar e pressione a seta voltada para a direita (seta roxa). Painel 2 a) selecione a digitalização a ser desmixada (seta azul) e uma visualização da imagem ajustada será exibida no lado direito; b) Selecione as repetições a serem desmisturadas (seta amarela); c) pressione Start spectral unmixing para prosseguir (seta verde). Clique aqui para baixar este arquivo.
Figura 5 suplementar: Painel de visualização e seleção de cores cromóforas. Painel 1) Selecione digitalizações para exibir com um clique duplo (seta roxa); Painel 2) Imagem adquirida no eixo XY (quadrado azul), XZ (quadrado amarelo) e YZ (quadrado verde); 2a) Botão de análise de imagem mostrando os comprimentos de onda adquiridos; 2b) escolha Mais Opções de Controle de Imagem na barra de menu superior e ative o ícone de Projeção de Intensidade Máxima; selecione Mais para editar as cores dos canais. Clique aqui para baixar este arquivo.
Figura 6 Suplementar: Seleção da Região de Interesse (ROI). Selecione a ferramenta laço (seta amarela) e defina os limites do ROI dentro do eixo XY (seta magenta). É possível definir várias áreas de forma (polígono, retângulo, quadrado, círculo ou elipse). Siga o ROI nos eixos XZ e YZ e adicione sub-regiões (seta verde) à seleção inicial. Várias sub-regiões são exibidas (seta ciano). Para extrair dados do ROI selecionado, pressione o ícone Importar região de interesse para quantificação e prossiga. Clique aqui para baixar este arquivo.
Discussão
Este protocolo enfatiza as etapas de trabalho consideradas como requisitos práticos para operar este novo instrumento de imagem optoacústica, desde o posicionamento adequado (participante, sonda) necessário para a estabilização da sonda de copo 3D até a aquisição de imagens, seleção de ROI e reconstrução e análise de imagens.
A abordagem experimental proposta, utilizando aquisições "instantâneas" juntamente com imagens obtidas em condições dinâmicas, ilustra o interesse e a utilidade deste instrumento no acesso in vivo à fisiologia vascular humana. Como mostrado, a resolução da imagem acústica de 150 μm coletada em um volume de até 15 mm3 é inigualável por outras técnicas de tomografia.
Especial atenção é necessária em relação (i) à importância da estabilização da sonda para a aquisição de imagens; o uso de um suporte de sonda flexível e seguro melhora claramente a aquisição de imagens; (ii) a correta identificação das estruturas vasculares; referências ultrassonográficas como a melanina na transição epidérmico-dérmica podem ser utilizadas como marcador para identificar os vasos do plexo superior na pele; e (iii) a análise funcional da imagem realizada por meio do software de reconstrução do fabricante.
A análise avançada de dados de ROI e exportação de imagens requer uma compreensão mais profunda do software dedicado e dos algoritmos desenvolvidos. O instrumento de imagem optoacústica atual é capaz de reconstruir um volume 3D de 15 mm3 de tecido com uma resolução de 150 μm. Esta capacidade deve ser potencializada para quantificar melhor a(s) função(ões) microvascular(es) em profundidade. No entanto, a operação básica permite a observação direta de cromóforos de referência e a aquisição de múltiplas predefinições da mesma área, proporcionando digitalização rápida e gravações de vídeo ao vivo.
O potencial de aplicabilidade encontrado com o sistema de imagem optoacústica é relevante. Os desenvolvimentos contínuos de software certamente melhorarão a utilidade desse sistema de imagem.
Divulgações
Os autores não relatam conflitos de interesse.
Agradecimentos
Esta investigação é financiada pela ALIES e COFAC principais fornecedores da tecnologia em estudo, e pela Fundação para a Ciência e a Tecnologia (FCT) através da bolsa UIDB/04567/2020 ao CBIOS.
Materiais
| Name | Company | Catalog Number | Comments |
| Cuff | PIC | 107001 | |
| Drapes | Pajunk | 021151-1501 | |
| Ethanol 70% | Sigma Aldrich | EX0281 | |
| Gogless | Univet | 559G.00.00.201 | |
| Kimwipes | Amoos | 5601856202331.00 | |
| MSOT | iThera | MSOTAcuity | |
| Stabilizing arm | ITEM | Self designed and assemble | |
| Ultrasound gel | Parker Laboratories | 308 | |
| Waxing cream | Veet | kkdg08hagd |
Referências
- Iskander-Rizk, S., vander Steen, A. F. W., van Soest, G. Photoacoustic imaging for guidance of interventions in cardiovascular medicine. Physics in Medicine and Biology. 64 (16), (2019).
- Cakmak, H. A., Demir, M. MicroRNA and cardiovascular diseases. Balkan Medical Journal. 37 (2), 60-71 (2020).
- Li, Z., Gupte, A. A., Zhang, A., Hamilton, D. J. Pet imaging and its application in cardiovascular diseases. Methodist DeBakey Cardiovascular Journal. 13 (1), 29-33 (2017).
- Karlas, A., et al. Cardiovascular optoacoustics: From mice to men - A review. Photoacoustics. 14, 19-30 (2019).
- MacRitchie, N., Noonan, J., Guzik, T. J., Maffia, P. Molecular imaging of cardiovascular inflammation. British Journal of Pharmacology. 178 (21), 4216-4245 (2021).
- Granja, T., Andrade, S., Rodrigues, L. Optoaccoustic tomography - good news for microcirculatory research. Biomedical and Biopharmaceutical Research. 18 (2), 1-13 (2022).
- Tan, H., et al. Total-body PET/CT: Current applications and future perspectives. American Journal of Roentgenology. 215 (2), 325-337 (2020).
- Masthoff, M., et al. Multispectral optoacoustic tomography of systemic sclerosis. Journal of Biophotonics. 11 (11), 201800155 (2018).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15 (1), 011101 (2010).
- Wu, M., Awasthi, N., Rad, N. M., Pluim, J. P. W., Lopata, R. G. P. Advanced ultrasound and photoacoustic imaging in cardiology. Sensors (Basel). 21 (23), 7947 (2021).
- Yang, H., et al. Soft ultrasound priors in optoacoustic reconstruction: Improving clinical vascular imaging. Photoacoustics. 19, 100172 (2020).
- Dean-Ben, X. L., Gottschalk, S., Mc Larney, B., Shoham, S., Razansky, D. Advanced optoacoustic methods for multiscale imaging of in vivo dynamics. Chemical Society Reviews. 46 (8), 2158-2198 (2017).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 310 (20), 2191-2194 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados