Method Article
Tomographie optoacoustique multispectrale pour l’imagerie fonctionnelle en recherche vasculaire
Dans cet article
Résumé
Le présent protocole décrit l’acquisition d’images optoacoustiques multispectrales du système vasculaire cutané humain in vivo . Il s’agit notamment de la quantification de l’hémoglobine et de la mélanine, considérées comme des chromophores d’intérêt pour l’analyse fonctionnelle.
Résumé
L’insuffisance microcirculatoire a été reconnue dans divers processus pathologiques, sous-jacent à ce thème croissant dans la recherche vasculaire. Ces dernières années, le développement de systèmes d’imagerie en direct a donné le ton (analytique) à la recherche fondamentale et clinique, dans le but de créer de nouveaux instruments capables de fournir des critères d’évaluation quantifiables en temps réel présentant un intérêt et une application cliniques. La spectroscopie proche infrarouge (NIRS), la tomographie par émission de positrons (TEP), la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM) sont disponibles, entre autres techniques, mais le coût, la résolution d’image et le contraste réduit sont reconnus comme des défis courants. La tomographie optoacoustique (OT) offre une nouvelle perspective sur l’imagerie fonctionnelle vasculaire, combinant des capacités d’absorption optique et de résolution spatiale de pointe (de la résolution optique micrométrique à la résolution acoustique millimétrique) avec la profondeur des tissus. Dans cette étude, nous avons testé l’applicabilité de la tomographie optoacoustique multispectrale (MSOT) pour l’imagerie fonctionnelle. Le système utilise un oscillateur paramétrique optique accordable (OPO) pompé par un laser Nd: YAG, fournissant des impulsions d’excitation détectées par une sonde 3D à des longueurs d’onde de 680 nm à 980 nm. Les images obtenues à partir de l’avant-bras humain ont été reconstruites à l’aide d’un algorithme spécifique (fourni dans le logiciel du fabricant) basé sur la réponse de chromophores spécifiques. L’hémoglobine oxygénée maximale (Max HbO 2) et l’hémoglobine désoxygénée (Max Hb), l’hémoglobine totale (HbT) et la saturation moyenne en oxygène (mSO2) à la densité vasculaire (μVu), aux distances moyennes inter-unités (ζAd) et au volume sanguin capillaire (mm3) peuvent être mesurées à l’aide de ce système. Le potentiel d’applicabilité trouvé avec ce système OT est pertinent. Les développements logiciels en cours amélioreront sûrement l’utilité de ce système d’imagerie.
Introduction
Les maladies cardiovasculaires sont les principales causes récurrentes de décès dans le monde et représentent un fardeau énorme pour tout système de santé 1,2. La technologie a grandement contribué à l’élargissement de notre compréhension de la physiopathologie cardiaque et vasculaire fondamentale, en fournissant des outils de diagnostic plus précis et la possibilité d’une détection précoce de la maladie et d’une prise en charge plus efficace. Les techniques d’imagerie offrent la possibilité de mesurer non seulement la performance cardiaque et des principaux vaisseaux, mais aussi, à une échelle beaucoup plus petite, de calculer la densité capillaire, la perfusion et le volume locaux et le dysfonctionnement endothélial, entre autres caractéristiques. Ces technologies ont offert les premières perspectives quantitatives en biologie vasculaire avec une application clinique directe. Les changements dans la densité capillaire, la réduction de la perfusion locale ou l’occlusion correspondent probablement à une condition ischémique, ce qui contribue à expliquer le rôle croissant de l’imagerie, devenant un outil indispensable dans la recherche et la pratique cardiovasculaires 3,4,5.
Au cours des dernières années, l’imagerie fonctionnelle a constamment donné le ton en matière d’innovation technologique, avec l’échographie (US), la spectroscopie proche infrarouge (NIRS), la tomographie par émission de positrons (TEP), la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM) comme exemples bien connus. Cependant, de multiples préoccupations limitent leur application, du coût et de la sécurité des patients (ainsi que du confort) au contraste et à la résolutionde l’image 6,7. La tomographie optoacoustique (OT) a récemment émergé comme une nouvelle direction dans la recherche vasculaire optique. Cette technologie, centrée sur la détection des ondes ultrasonores générées par la dilatation thermoélastique du tissu impacté par des impulsions laser ultracourtes, est connue depuis quelques temps 6,8. Cette réaction physique de développement thermique et d’expansion tissulaire évoque un signal acoustique détecté par un transducteur à ultrasons. L’utilisation d’impulsions lumineuses du visible au proche infrarouge et l’absence d’un signal de fond acoustique améliorent la profondeur de résolution. Le contraste détecté résulte des chromophores les plus importants présents (hémoglobine ou mélanine). Par rapport à d’autres technologies, l’OT présente les avantages suivants : (1) ne nécessitant aucun contraste (imagerie sans étiquette), (2) un meilleur contraste et une meilleure résolution avec moins d’artefacts que l’échographie, et (3) un prix inférieur, une acquisition plus rapide et une facilité d’utilisation 6,9,10,11.
La tomographie optoacoustique multispectrale (MSOT) fait partie de la génération la plus récente d’instruments OT. Construite avec un oscillateur paramétrique optique accordable (OPO) pompé par un laser Nd:YAG fournissant des impulsions d’excitation, une image 3D est acquise par des signaux résolus dans le temps détectés à partir d’impulsions d’excitation ultrasonores à haute fréquence à des longueurs d’onde de 680 nm à 980 nm avec un taux de répétition allant jusqu’à 50 Hz12. La plateforme d’imagerie optoacoustique permet de quantifier différents chromophores en profondeur (jusqu’à 15 mm). Des variables telles que HbO2, Hb et mélanine sont facilement accessibles. D’autres variables d’intérêt, telles que l’hémoglobine oxygénée maximale (Max HbO2) et l’hémoglobine désoxygénée (Max Hb), sont également disponibles. Les algorithmes de reconstruction du logiciel du fabricant permettent de calculer d’autres variables telles que la densité vasculaire (μVu), la distance moyenne inter-unités (ζAd) et le volume capillaire (mm3).
La présente étude explore les aspects opérationnels essentiels de ce nouveau système afin de mieux comprendre ses aspects pratiques et ses applications potentielles dans la recherche préclinique cardiovasculaire.
Protocole
Le protocole expérimental a déjà été approuvé par le Comité d’éthique de la Faculté des sciences de la santé de l’Université (EC. ECTS/P10.21). Les procédures respectaient pleinement les principes de bonnes pratiques cliniques définis pour la recherche sur l’être humain13. Un échantillon pratique de six participants en santé des deux sexes (n = 3 par sexe) âgés en moyenne de 32,8 ± 11,9 ans a été choisi dans la communauté universitaire. Les participants sélectionnés devaient être normotendus, non-fumeurs et exempts de tout médicament ou complément alimentaire. La pression artérielle, la fréquence cardiaque et l’indice de masse corporelle ont également été enregistrés. Tous les participants ont été préalablement informés des objectifs et de la durée de l’étude et ont reçu un consentement écrit éclairé.
NOTE: Cette étude a été réalisée à l’aide de MSOTAcuity (voir Tableau des matériaux), ci-après dénommée plateforme d’imagerie optoacoustique.
1. Préparation à l’acquisition
Remarque : Dans la description expérimentale qui suit, les commandes d’écran sont en caractères gras.
- Chargement des informations sur le sujet : Allumez l’équipement d’imagerie optoacoustique. Pendant que l’équipement se réchauffe, présentez les informations aux participants. La fenêtre de bienvenue principale du logiciel s’ouvre sur la vue d’ensemble de l’analyse. Introduisez les données (y compris le nom, la dénomination de l’étude, les données personnelles et toute observation pertinente) après avoir cliqué sur ID du patient et terminez la demande en appuyant sur Sélectionner.
- Sélection prédéfinie : Assurez-vous que le message Laser is Ready (Le laser est prêt) apparaît sur l’écran de l’équipement. Après le temps de préchauffage, la barre d’état du laser sur l’écran de l’équipement doit passer de Laser Standby à Laser is Ready. Pour ce protocole, le préréglage est conçu pour les chromophores Hb, HbO2 et la mélanine. Après avoir sélectionné le bon préréglage, la puissance laser sera testée.
- À ce stade, assurez-vous qu’il y a un message à l’écran qui rappelle à chaque participant dans la salle d’appliquer des lunettes de sécurité laser. Appuyez sur la pédale de l’interrupteur laser (alimentation) et attendez l’auto-vérification de la puissance laser. Après quelques secondes, une fenêtre apparaît avec l’état actuel du laser avec un rapport de contrôle. Relâchez cette fenêtre en appuyant sur le bouton OK disponible.
REMARQUE: La plate-forme d’imagerie optoacoustique utilise un laser Nd: YAG, considéré comme un laser de classe 4 particulièrement dangereux pour l’œil humain. Ainsi, ce laser doit être manipulé avec des soins adéquats.
ATTENTION : Aucune acquisition ne devrait avoir lieu sans s’assurer que toutes les procédures de sécurité, y compris une protection oculaire appropriée, sont en place.
2. Positionnement et acquisition d’images
- Acclimater le participant à l’environnement de laboratoire (21 °C ± 1 °C; 40%-60% d’humidité relative), en choisissant une position confortable pour minimiser les mouvements inutiles. Assurez-vous que la zone à scanner est préalablement nettoyée.
REMARQUE: La recommandation du fabricant de nettoyer la zone à imager avec une solution éthanol/eau à 70% est recommandée. De plus, pour une meilleure acquisition d’image, l’épilation (le cas échéant) est suggérée. - Support de sonde et stabilisation d’image
- Appliquez une fine couche de gel à ultrasons sur la tasse 3D. La stabilisation d’image nécessite de maintenir la tasse 3D dans la position d’imagerie souhaitée. Positionnez et stabilisez un bras verrouillable pour la zone d’intérêt. Le bras utilisé dans cette étude a été conçu à l’interne et construit avec des composants de profilés en aluminium (figure 1).
- Après avoir placé la tasse 3D sur la zone d’intérêt, verrouillez partiellement le verrouillage du bras stabilisateur pour l’acquisition d’images.
REMARQUE: La qualité et l’application uniforme du gel à ultrasons sont critiques; La présence de bulles d’air peut compromettre la définition de l’image.
- Acquisition d’images pour des conditions dynamiques, à l’aide de la manœuvre d’hyperémie réactive post-occlusive (PORH), dans l’onglet de menu Examen .
- Acquérir l’analyse de contrôle de base. Après avoir trouvé un champ de vision pour l’imagerie, avec le brassard de pression artérielle dégonflé en place, verrouillez solidement le bras de positionnement de la tasse 3D.
- Appliquez une pression minimale sur le site d’imagerie, car des pressions plus élevées pourraient compromettre les lectures. Poussez le préréglage par défaut du fabricant Hb, HbO 2 et Melanin qui mesure simultanément les chromophores pour Hb, HbO2 et mélanine.
ATTENTION: Il est obligatoire de protéger les yeux avec des lunettes de sécurité appropriées pendant le fonctionnement.
REMARQUE: Les phototypes de peau IV à VI (peau foncée) sont sujets à une mauvaise lecture, nécessitant une image témoin de base pour un traitement ultérieur. L’utilisation de lunettes de sécurité lors de l’acquisition d’images (lorsque le laser est actif) permet uniquement à l’œil humain de reconnaître les couleurs jaunes et bleues. Les couleurs peuvent être modifiées pendant le traitement de l’image. - Sélectionnez la zone anatomique pour l’acquisition d’images de base. À des fins exploratoires, l’avant-bras ventral est recommandé. Continuez en appuyant sur la pédale de pédale laser.
REMARQUE: Le bouton de l’écran tactile intitulé Affichage (couleur jaune), qui affiche l’image en direct à l’écran lorsque vous appuyez dessus. L’état de stabilité de l’image est affiché sous la forme d’une barre grise au milieu de l’écran tactile, indiquant la stabilité de la sonde 3D.- Lorsque la stabilité de l’image est maximisée, prenez (ou capturez) un instantané de la zone en appuyant sur le bouton Snapshot de l’écran tactile. Chaque balayage acquerra 10 à 12 images à une profondeur acoustique de 150 mm pour chaque longueur d’onde définie dans le préréglage sur un temps d’acquisition de 2 s. Cette analyse d’acquisition de base comprendra un total de 30 à 36 images.
REMARQUE: 10 images pour chaque chromophore détecté (Hb, HbO2 et mélanine) sont collectées avec une profondeur maximale de 15 mm. - Continuez à appuyer sur la pédale de pédale laser pour une acquisition vidéo continue et faites attention au bouton Afficher (couleur jaune) sur l’écran tactile. L’image stabilisée apparaîtra. Appuyez sur Enregistrer (couleur bleue) pour commencer l’enregistrement de l’image en direct.
- Arrêtez l’enregistrement en appuyant sur le bouton Stop (de couleur noire). La plate-forme d’imagerie optoacoustique arrêtera l’enregistrement et rendra automatiquement la vidéo en mode de prévisualisation.
- Lorsque la stabilité de l’image est maximisée, prenez (ou capturez) un instantané de la zone en appuyant sur le bouton Snapshot de l’écran tactile. Chaque balayage acquerra 10 à 12 images à une profondeur acoustique de 150 mm pour chaque longueur d’onde définie dans le préréglage sur un temps d’acquisition de 2 s. Cette analyse d’acquisition de base comprendra un total de 30 à 36 images.
- Mesures dynamiques (illustration PORH) : Ajustez le brassard de pression au bras du patient au-dessus du coude pour illustrer cette manœuvre. Gonfler le brassard avec une pression supra systolique (~200 mmHg) et procéder selon les étapes 2.3.1 à 2.3.3.1 pour acquérir le système vasculaire imagé sous pression.
- Pour acquérir une vidéo afin d’évaluer l’impact de la libération de pression sur le système vasculaire imagé, ouvrez la soupape de pression tout en acquérant la vidéo comme en 2.3.3.2. Comme précédemment, suivez l’image en direct à l’écran.
NOTE: Pour exécuter cette manœuvre, la pression supra systolique doit être maintenue pendant 1-5 min; Il est important d’être conscient que cette pression peut induire différents degrés de tolérance et d’inconfort chez le patient. Cet aspect doit être soigneusement géré pendant les expériences.
3. Protocole d’analyse d’images
- Copiez les numérisations enregistrées dans un dossier sélectionné/dédié pour une sauvegarde et une analyse plus approfondie sur un poste de travail informatique distinct à l’aide du logiciel d’analyse dédié du fabricant. Chaque scan est stocké par temps d’acquisition et ordonné par le programme dans un dossier d’étude avec un code en cours d’exécution.
REMARQUE: Une copie de sauvegarde est fortement recommandée. Travailler directement avec les données brutes enregistrées est possible mais fortement déconseillé, car toute panne potentielle du disque dur pourrait endommager les données brutes. - Ouvrez le programme d’analyse sur le poste de travail. Choisissez le menu du programme > Ouvrir l’étude pour importer des fichiers et accéder aux analyses de sauvegarde. Ouvrez l’étude et faites défiler jusqu’au bas du dossier (avec les analyses enregistrées) pour rechercher les fichiers avec un fichier . Extension NOD. C’est le seul type de fichier reconnu par le logiciel pour ouvrir une étude.
NOTE:. Les fichiers NOD sont nommés automatiquement avec un numéro courant attribué à chaque étude et ne contiennent aucune information sur le patient dans le nom du fichier. - Pour la reconstruction d’image, ouvrez le module d’analyse d’image en accédant au logiciel Menu > Traitement avancé.
- Assurez-vous que les onglets du flux de travail du programme sont visibles (colorés en noir) dans la barre de menu supérieure (Figure supplémentaire 1) : Menu ; Vue d’ensemble de l’analyse; la reconstruction; correction de la fluence; Démixage spectral; Visualisation et analyse. Pendant l’analyse, tout onglet de workflow activé est coloré en bleu.
REMARQUE: Si le traitement avancé n’est pas ouvert, le logiciel affiche uniquement Vue d’ensemble de la numérisation et Visualisation et analyse.
- Assurez-vous que les onglets du flux de travail du programme sont visibles (colorés en noir) dans la barre de menu supérieure (Figure supplémentaire 1) : Menu ; Vue d’ensemble de l’analyse; la reconstruction; correction de la fluence; Démixage spectral; Visualisation et analyse. Pendant l’analyse, tout onglet de workflow activé est coloré en bleu.
- Reconstruisez l’image via l’onglet Reconstruction du logiciel. Sélectionnez les analyses à reconstruire dans la partie gauche du menu principal du programme. Les analyses chargées apparaissent sur le côté droit de l’écran. Laissez les six longueurs d’onde d’émission optoacoustique par défaut (700, 730, 760, 800, 850 et 900 nm), car elles incluent le signal optoacoustique maximal pour HbO2 à 900 nm, pour Hb à 760 nm et mélanine à 700 nm.
- Effectuez la reconstruction de numérisation à l’aide de l’icône sur le côté droit. Suivez le workflow du programme en sélectionnant le préréglage Scan et le champ de vision (résolution). L’information est présentée dans le coin supérieur gauche de l’écran principal. Ajustez la vitesse du son pour régler la mise au point du balayage (Figure supplémentaire 2). Le panneau Reconstruction affiche également le nombre d’images de chaque scan acquis et permet d’analyser la sélection des répétitions (si nécessaire).
REMARQUE: Chaque balayage est chargé avec une vitesse sonore par défaut de -90, qui doit être ajustée par l’utilisateur. La vitesse du son peut également être réglée automatiquement avec une fonction de mise au point automatique (AF).
- Effectuez la reconstruction de numérisation à l’aide de l’icône sur le côté droit. Suivez le workflow du programme en sélectionnant le préréglage Scan et le champ de vision (résolution). L’information est présentée dans le coin supérieur gauche de l’écran principal. Ajustez la vitesse du son pour régler la mise au point du balayage (Figure supplémentaire 2). Le panneau Reconstruction affiche également le nombre d’images de chaque scan acquis et permet d’analyser la sélection des répétitions (si nécessaire).
- Appuyez sur le bouton Reconstruire les analyses en haut de l’écran pour passer à la reconstruction de numérisation. Un tableau de bord temporaire apparaîtra avec le message Job Processing. Ce panneau est également accessible à partir du menu > État du traitement. Une fois la reconstruction terminée, l’analyse de post-traitement de l’image doit passer à la correction de fluence.
- Activez la correction de fluence des images reconstruites dans le menu du tableau de bord. Les images reconstruites doivent être chargées pour la correction de fluence. Ceux-ci apparaissent avec un drapeau à côté de chaque numéro de numérisation. Les fichiers chargés seront immédiatement affichés sur le côté droit de l’écran en tant que reconstructions sélectionnées. Activez la correction de fluence en interagissant avec l’icône située à droite de l’écran (Figure supplémentaire 3). Poussez la ou les corrections de fluence de sauvegarde pour progresser.
- Après avoir enregistré la correction de fluence, effectuez le démélange spectral du préréglage acquis (Hb, HbO2 et mélanine). Sélectionnez l’onglet Démixage spectral pour ouvrir la liste des reconstructions sélectionnées pour le démixage spectral. Une liste avec chaque scan de l’étude sélectionnée sera affichée avec l’historique des étapes de traitement d’image précédentes.
- Chargez les fichiers de correction de fluence précédemment enregistrés. Les numérisations chargées seront immédiatement affichées sur le côté droit de l’écran en tant que reconstructions sélectionnées (Figure supplémentaire 4). Activez le démixage spectral en appuyant sur l’icône sur le côté droit de l’écran.
- Observez que les longueurs d’onde ne sont pas mélangées. Les six longueurs d’onde d’émission optoacoustique (700, 730, 760, 800, 850 et 900 nm) prises dans l’étape de reconstruction (étape 3.4) sont automatiquement choisies pour le démixage spectral. Modifiez les spectres souhaités à traiter (par exemple, Spectres : Hb, HbO2 et mélanine) à l’aide de l’icône XYZ , si nécessaire.
- Après avoir confirmé les paramètres ajustés, cliquez sur Start Spectral Unmixing pour que le démixage spectral progresse. Une barre de menus de traitement s’affiche, affichant la progression de l’opération.
REMARQUE: Divers ajustements de paramètres sont possibles pendant le démixage spectral, et plusieurs méthodes de démélange sont disponibles. Dans ce protocole, la méthode de régression linéaire est utilisée comme norme pour démélanger Hb, HbO2 et mélanine.
- Accédez à l’onglet Visualisation et analyse . Cliquez sur une analyse activée pour afficher toutes les informations sur le sujet et les commentaires introduits à l’étape 1.1 (Figure supplémentaire 5).
REMARQUE: Plusieurs analyses peuvent être visualisées en parallèle.- Appuyez sur le bouton + pour créer une analyse à balayage multiple. Dans cette fenêtre, introduisez une vue à balayage multiple et appuyez sur le bouton Enregistrer . Après avoir enregistré le nom de la vue, un nouveau tableau de bord s’affiche, y compris tous les scans de l’étude analysée.
- Sélectionnez chaque analyse souhaitée à ajouter (chacune) à la vue d’analyse enregistrée. Ajoutez des analyses supplémentaires dans l’icône du coin supérieur gauche et elles s’afficheront automatiquement dans la vue Analyse.
- Dans la vue d’analyse, définissez des tables de choix de couleurs appropriées pour préparer l’image à l’analyse. Cliquez sur Plus d’options de contrôle d’image dans la barre de menus supérieure et activez l’icône Projection d’intensité maximale . Attribuez des couleurs aux calques en appuyant sur l’icône disponible dans le coin inférieur droit de l’affichage de l’image, à côté de l’affichage de l’image 2D+.
- Sélectionnez Plus pour modifier les couleurs de toutes les chaînes simultanément. Ce menu affiche tous les chromophores non mélangés et permet la sélection de plusieurs couches pour l’affichage.
REMARQUE: Déplacer la souris sur les icônes du logiciel affiche leur nom en gris comme affiché dans le protocole. - Ajustez l’intensité des couleurs de chaque calque avec les outils disponibles en bas à gauche de l’écran.
REMARQUE: Le réglage avec interpolation min/max pour chaque canal donne généralement de bons résultats.
4. Analyse de la région d’intérêt (ROI)
REMARQUE : La sélection d’une région d’intérêt (ROI) est obligatoire pour l’analyse des données.
- Identifiez le ROI à analyser. Entourez le retour sur investissement avec les formes disponibles (dans la barre de menus) dans l’image XY tout en traçant le même retour sur investissement dans les vues orthogonales disponibles dans les axes XZ et YZ (Figure supplémentaire 6).
REMARQUE : Une forme de polygone a été utilisée pour l’analyse du retour sur investissement actuel.- Suivez la forme ROI dans les axes XZ et YZ restants (exemple de la figure 2) tout en plaçant plusieurs couches de polygones avec la fonction Ajouter une interpolation et Supprimer des sous-régions . Les données peuvent être tracées après avoir défini/sélectionné le retour sur investissement souhaité.
- Appuyez sur l’icône Importer la région d’intérêt pour la quantification et observez la composante multispectrale affichée sur le côté droit de l’écran comme un détail graphique du retour sur investissement sélectionné.
- Exportez les données ROI en appuyant sur l’icône Excel en bas de la vue graphique des données ROI. L’ensemble du paquet de données de toutes les régions est exporté sous forme de paquet vers une feuille de calcul pour une analyse ultérieure. La figure 3 montre les données d’un participant qui s’est soumis à un brassard de pression gonflé à 200 mmHg et le système vasculaire a été analysé par rapport à l’état de repos vasculaire à 0 mmHg.
- Quantifier plusieurs objets ROI simultanément en suivant les étapes 4.1-4.1.3.
- Exportez des images à partir du même menu que les fichiers TIFF avec toutes les données intégrées et le contour du retour sur investissement intégré (Figure 2).
Résultats
Les données fournies par l’imagerie optoacoustique peuvent être analysées dans des images d’exportation post-traitées (Figure 2) et des données tracées (Figure 3). Le but ici était d’introduire le fonctionnement de l’imagerie fonctionnelle optoacoustique et d’explorer son application dans la recherche vasculaire plus communément connue. Pour cela, nous avons comparé les images acquises au repos et après une occlusion de 200 mmHg d’une artère d’alimentation majeure (Figure 2). Ces observations peuvent être quantifiées après analyse du retour sur investissement et exportation. Dans le plan XY, le signal de mélanine plus élevé par rapport aux plans YZ et XZ peut être observé, ce qui indique la limite de l’épiderme. L’occlusion de l’artère brachiale (bras) provoque une certaine stase dans les vaisseaux avant la mise en place de la sonde OT (avant-bras ventral). En conséquence, nous avons détecté une augmentation des signaux globaux montrés comme une augmentation du bleu (Hb) et du rouge (HbO2) aux axes XY, YZ et XZ. La stase peut être suivie dans le plan XY tout en maintenant la pression de 200 mmHg dans le brassard. Les axes YZ et XZ représentent une augmentation du volume sanguin due à l’occlusion ci-dessus par rapport aux conditions normales de perfusion (pas d’occlusion), mises en évidence par les zones masquées magenta.
L’analyse du retour sur investissement exporté de la même zone microvasculaire quantifie les chromophores HbO 2 (rouge), Hb (bleu) et HbT (rose), mSO2 (rouge foncé) et mélanine (jaune) à partir d’images stabilisées collectées sur 8,6 s. Le relâchement de pression est immédiatement détecté; La figure 3 montre l’évolution post-occlusion de la récupération de l’Hb, de l’HbO2 et de l’HbT, tandis que la sortie des données optoacoustiques suit les observations de la figure 1. Le logiciel calcule la saturation en oxygène du sang (mSO 2) et les valeurs d’HbT à partir de l’addition des signaux arbitraires Hb et HbO2. La concentration de mélanine reste constante dans l’occlusion de 200 mmHg et à l’état de repos dans l’intervalle de temps d’acquisition de l’image.
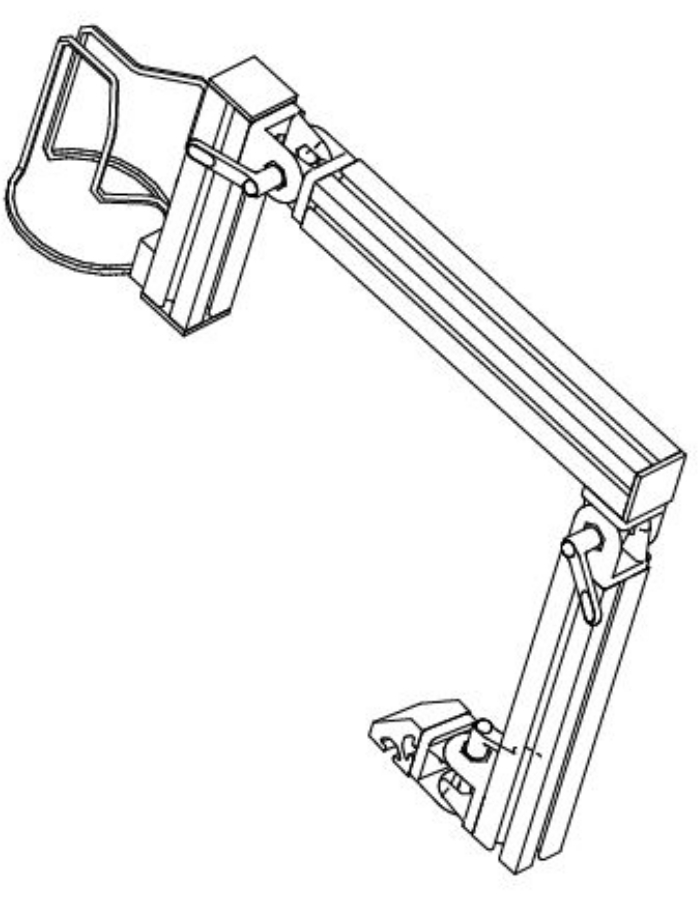
Figure 1 : Schéma représentant le bras flexible conçu pour maintenir la sonde de mesure en contact stabilisé avec la peau du participant. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images optoacoustiques représentatives mettant en évidence des modifications du système vasculaire au repos ou sous pression de 200 mmHg. L’image montrée comprend trois couleurs, représentant Hb (bleu), HbO2 (rouge) et mélanine (jaune), comme décrit dans l’analyse de l’image à la section 4. Chaque image optoacoustique représente une projection d’intensité maximale de tous les plans associés à chaque chromophore balayé. (A) Le plan XY de l’acquisition optoacoustique. (B) La vue orthogonale YZ du même site optoacoustique imagé. (C) La vue XZ de la zone numérisée. Les flèches magenta pointent vers les zones avec une stase accrue; La zone masquée magenta marque l’augmentation du volume de sang piégé à l’intérieur des vaisseaux en raison de l’occlusion de l’artère brachiale par rapport aux conditions normales de perfusion (pas d’occlusion). Veuillez cliquer ici pour voir une version agrandie de cette figure.
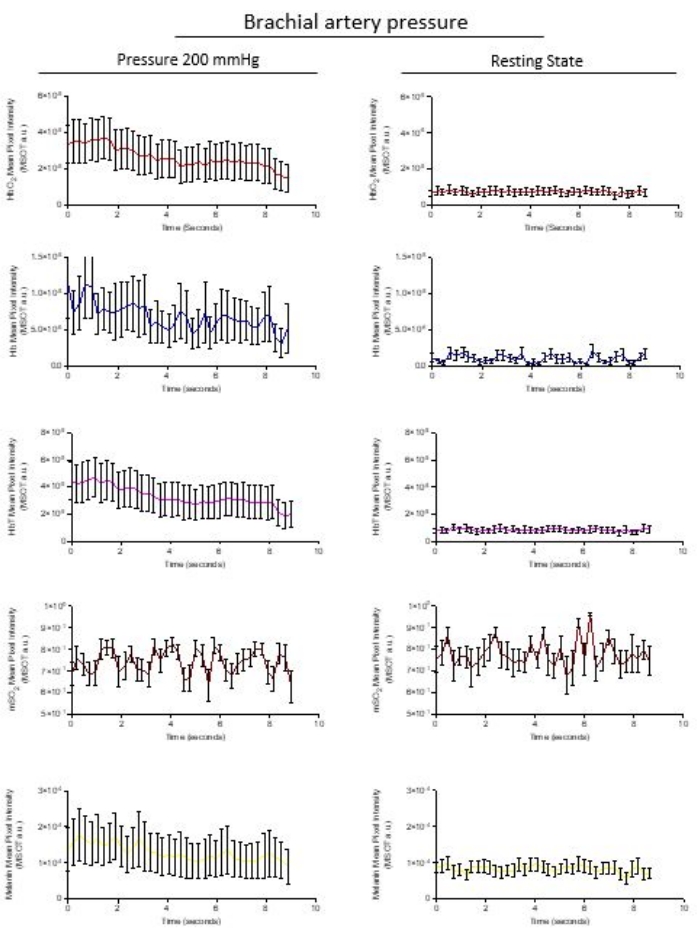
Figure 3 : Exportation de données représentatives d’un retour sur investissement quantifié. Les chromophores naturels de HbO 2 (rouge), Hb (bleu) et HbT (rose), mSO2 (rouge profond) et mélanine (jaune) sont représentés à partir des données extraites des images stabilisées recueillies sur 8,6 s. Les graphiques de Hb, HbO2 et HbT montrent une pente de récupération de l’occlusion vers l’état de repos non occlus. L’oxygénation sanguine calculée mSO2 et la concentration de mélanine restent constantes dans l’occlusion de 200 mmHg et à l’état de repos dans l’intervalle de temps d’acquisition de l’image. Les images extraites sont des points de données représentés par une moyenne ± sd de n = 10 images par image. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : panneau de présentation de la numérisation et menu principal du logiciel d’analyse. En appuyant sur le bouton Menu (en noir), le menu principal fera défiler les options pour sélectionner l’étude sélectionnée. Cette action sélectionnera et chargera le fichier « .nod » reconnu par le logiciel. L’aperçu de l’analyse (en bleu) montre toutes les analyses de l’étude . Les détails (noirs) apparaissent à droite. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Flux de travail d’analyse de reconstruction. Panneau 1 - Sélectionnez la numérisation à reconstruire et appuyez sur la flèche orientée vers la droite sur le côté droit de l’écran (flèche violette) pour avancer. Panel 2 - Observez la vitesse du son et réglez le curseur au mieux (flèche bleue); a) mise au point ajustée affichée dans la fenêtre de droite; b) sélectionner les répétitions à analyser (flèche jaune); c) appuyez sur le bouton Reconstruire les numérisations pour continuer (flèche verte). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Flux de travail du panneau de correction de fluence. Panel 1 - Sélectionnez les numérisations à corriger et appuyez sur la flèche orientée vers la droite sur le côté droit de l’écran. Panel 2 - appuyez sur Save Fluence Correction(s) pour continuer (flèche verte). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Flux de travail du panneau de démixage Spectra. Panel 1 - Sélectionnez les numérisations à démixer et appuyez sur la flèche orientée vers la droite (flèche violette). Panneau 2 a) sélectionnez la numérisation à démixer (flèche bleue) et un aperçu de l’image ajustée sera affiché dans la partie droite; b) Sélectionnez les répétitions à démélanger (flèche jaune); c) appuyez sur Start spectral unmixage pour continuer (flèche verte). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 5 : Panneau de visualisation et sélection des couleurs chromophores. Panneau 1) Sélectionnez les numérisations à afficher avec un double clic (flèche violette); Panneau 2) Image acquise dans l’axe XY (carré bleu), XZ (carré jaune) et YZ (carré vert); 2a) Bouton d’analyse d’image montrant les longueurs d’onde acquises; 2b) choisissez Plus d’options de contrôle d’image dans la barre de menu supérieure et activez l’icône Projection d’intensité maximale ; sélectionnez Plus pour modifier les couleurs des chaînes. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 6 : Sélection de la région d’intérêt (ROI). Sélectionnez l’outil lasso (flèche jaune) et définissez les limites du ROI dans l’axe XY (flèche magenta). Il est possible de définir différentes zones de forme (polygone, rectangle, carré, cercle ou elipse). Suivez le retour sur investissement des axes XZ et YZ et ajoutez des sous-régions (flèche verte) à la sélection initiale. Plusieurs sous-régions sont affichées (flèche cyan). Pour extraire les données du retour sur investissement sélectionné, appuyez sur l’icône Importer la région d’intérêt pour la quantification et continuer. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce protocole met l’accent sur les étapes de travail considérées comme des exigences pratiques pour faire fonctionner ce nouvel instrument d’imagerie optoacoustique, du positionnement adéquat (participant, sonde) nécessaire à la stabilisation de la sonde 3D à l’acquisition d’images, à la sélection du retour sur investissement, en passant par la reconstruction et l’analyse d’images.
L’approche expérimentale proposée, utilisant des acquisitions « instantanées » et des images obtenues dans des conditions dynamiques, illustre l’intérêt et l’utilité de cet instrument pour accéder à la physiologie vasculaire humaine in vivo . Comme illustré, la résolution d’image acoustique de 150 μm collectée dans un volume allant jusqu’à 15 mm3 est inégalée par d’autres techniques de tomographie.
Une attention particulière est nécessaire en ce qui concerne (i) l’importance de la stabilisation de la sonde pour l’acquisition d’images; l’utilisation d’un support de sonde flexible et sécurisé améliore nettement l’acquisition d’images; ii) l’identification correcte des structures vasculaires; des références échographiques telles que la mélanine dans la transition épidermo-dermique pourraient être utilisées comme marqueur pour identifier les vaisseaux du plexus supérieur dans la peau; et iii) l’analyse fonctionnelle de l’image effectuée à l’aide du logiciel de reconstruction du fabricant.
L’analyse avancée des données ROI et l’exportation d’images nécessitent une compréhension plus approfondie du logiciel dédié et des algorithmes développés. L’instrument d’imagerie optoacoustique actuel est capable de reconstruire un volume 3D de 15mm3 de tissu avec une résolution de 150 μm. Cette capacité devrait être potentialisée pour mieux quantifier en profondeur la ou les fonctions microvasculaires. Néanmoins, le fonctionnement de base permet l’observation directe des chromophores de référence et l’acquisition de plusieurs préréglages à partir de la même zone, fournissant un balayage rapide et des enregistrements vidéo en direct.
Le potentiel d’applicabilité trouvé avec le système d’imagerie optoacoustique est pertinent. Les développements logiciels en cours amélioreront sûrement l’utilité de ce système d’imagerie.
Déclarations de divulgation
Les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
Cette recherche est financée par ALIES et COFAC principaux fournisseurs de la technologie à l’étude, et par la Fundação para a Ciência e a Tecnologia (FCT) par le biais de la subvention UIDB/04567/2020 au CBIOS.
matériels
| Name | Company | Catalog Number | Comments |
| Cuff | PIC | 107001 | |
| Drapes | Pajunk | 021151-1501 | |
| Ethanol 70% | Sigma Aldrich | EX0281 | |
| Gogless | Univet | 559G.00.00.201 | |
| Kimwipes | Amoos | 5601856202331.00 | |
| MSOT | iThera | MSOTAcuity | |
| Stabilizing arm | ITEM | Self designed and assemble | |
| Ultrasound gel | Parker Laboratories | 308 | |
| Waxing cream | Veet | kkdg08hagd |
Références
- Iskander-Rizk, S., vander Steen, A. F. W., van Soest, G. Photoacoustic imaging for guidance of interventions in cardiovascular medicine. Physics in Medicine and Biology. 64 (16), (2019).
- Cakmak, H. A., Demir, M. MicroRNA and cardiovascular diseases. Balkan Medical Journal. 37 (2), 60-71 (2020).
- Li, Z., Gupte, A. A., Zhang, A., Hamilton, D. J. Pet imaging and its application in cardiovascular diseases. Methodist DeBakey Cardiovascular Journal. 13 (1), 29-33 (2017).
- Karlas, A., et al. Cardiovascular optoacoustics: From mice to men - A review. Photoacoustics. 14, 19-30 (2019).
- MacRitchie, N., Noonan, J., Guzik, T. J., Maffia, P. Molecular imaging of cardiovascular inflammation. British Journal of Pharmacology. 178 (21), 4216-4245 (2021).
- Granja, T., Andrade, S., Rodrigues, L. Optoaccoustic tomography - good news for microcirculatory research. Biomedical and Biopharmaceutical Research. 18 (2), 1-13 (2022).
- Tan, H., et al. Total-body PET/CT: Current applications and future perspectives. American Journal of Roentgenology. 215 (2), 325-337 (2020).
- Masthoff, M., et al. Multispectral optoacoustic tomography of systemic sclerosis. Journal of Biophotonics. 11 (11), 201800155 (2018).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15 (1), 011101 (2010).
- Wu, M., Awasthi, N., Rad, N. M., Pluim, J. P. W., Lopata, R. G. P. Advanced ultrasound and photoacoustic imaging in cardiology. Sensors (Basel). 21 (23), 7947 (2021).
- Yang, H., et al. Soft ultrasound priors in optoacoustic reconstruction: Improving clinical vascular imaging. Photoacoustics. 19, 100172 (2020).
- Dean-Ben, X. L., Gottschalk, S., Mc Larney, B., Shoham, S., Razansky, D. Advanced optoacoustic methods for multiscale imaging of in vivo dynamics. Chemical Society Reviews. 46 (8), 2158-2198 (2017).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 310 (20), 2191-2194 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon