Method Article
Tomografia optoacustica multispettrale per l'imaging funzionale nella ricerca vascolare
In questo articolo
Riepilogo
Il presente protocollo descrive l'acquisizione di immagini optoacustiche multispettrali di vascolarizzazione cutanea umana in vivo . Questi includono la quantificazione dell'emoglobina e della melanina, considerati cromofori di interesse per l'analisi funzionale.
Abstract
La compromissione del microcircolo è stata riconosciuta in vari processi patologici, alla base di questo tema crescente all'interno della ricerca vascolare. Negli ultimi anni, lo sviluppo di sistemi di live imaging ha impostato il ritmo (analitico) sia nella ricerca di base che clinica, con l'obiettivo di creare nuovi strumenti in grado di fornire endpoint quantificabili in tempo reale con interesse clinico e applicazione. La spettroscopia nel vicino infrarosso (NIRS), la tomografia ad emissione di positroni (PET), la tomografia computerizzata (CT) e la risonanza magnetica (MRI) sono disponibili, tra le altre tecniche, ma costo, risoluzione dell'immagine e contrasto ridotto sono riconosciuti come sfide comuni. La tomografia optoacustica (OT) offre una nuova prospettiva sull'imaging funzionale vascolare, combinando capacità di assorbimento ottico e risoluzione spaziale all'avanguardia (dalla risoluzione acustica micrometrica alla risoluzione acustica millimetrica) con la profondità del tessuto. In questo studio, abbiamo testato l'applicabilità della tomografia optoacustica multispettrale (MSOT) per l'imaging funzionale. Il sistema utilizza un oscillatore ottico parametrico sintonizzabile (OPO) pompato da un laser Nd: YAG, che fornisce impulsi di eccitazione rilevati da una sonda 3D a lunghezze d'onda da 680 nm a 980 nm. Le immagini ottenute dall'avambraccio umano sono state ricostruite attraverso uno specifico algoritmo (fornito all'interno del software del produttore) basato sulla risposta di specifici cromofori. L'emoglobina ossigenata massima (Max HbO 2) e l'emoglobina deossigenata (Max Hb), l'emoglobina totale (HbT) e la saturazione media di ossigeno (mSO2) alla densità vascolare (μVu), le distanze medie interunitarie (ζAd) e il volume ematico capillare (mm3) possono essere misurati utilizzando questo sistema. Il potenziale di applicabilità trovato con questo sistema OT è rilevante. Gli sviluppi software in corso miglioreranno sicuramente l'utilità di questo sistema di imaging.
Introduzione
Le malattie cardiovascolari sono le principali cause ricorrenti di morte in tutto il mondo e rappresentano un onere enorme per qualsiasi sistema sanitario 1,2. La tecnologia ha contribuito in modo determinante all'espansione della nostra comprensione della fisiopatologia cardiaca e vascolare fondamentale, fornendo strumenti diagnostici più precisi e la possibilità di una diagnosi precoce della malattia e di una gestione più efficace. Le tecniche di imaging offrono la possibilità di misurare non solo le prestazioni cardiache e dei vasi maggiori, ma anche, su scala molto più piccola, di calcolare la densità capillare, la perfusione locale e il volume e la disfunzione endoteliale, tra le altre caratteristiche. Queste tecnologie hanno offerto le prime intuizioni quantitative sulla biologia vascolare con applicazione clinica diretta. I cambiamenti nella densità capillare, la riduzione della perfusione locale o l'occlusione corrispondono probabilmente a una condizione ischemica, che aiuta a spiegare il ruolo crescente dell'imaging, diventando uno strumento indispensabile nella ricerca e nella pratica cardiovascolare 3,4,5.
Negli ultimi anni, l'imaging funzionale ha costantemente dettato il passo nell'innovazione tecnologica, con la spettroscopia a ultrasuoni (US) nel vicino infrarosso (NIRS), la tomografia ad emissione di positroni (PET), la tomografia computerizzata (CT) e la risonanza magnetica (MRI) come alcuni esempi ben noti. Tuttavia, molteplici preoccupazioni limitano la loro applicazione, dal costo e dalla sicurezza del paziente (nonché dal comfort) al contrasto dell'immagine e alla risoluzione 6,7. La tomografia optoacustica (OT) è recentemente emersa come una nuova direzione nella ricerca vascolare basata sull'ottica. Questa tecnologia, incentrata sulla rilevazione di onde ultrasoniche generate dall'espansione termoelastica del tessuto impattato con impulsi laser ultracorti, è nota da tempo 6,8. Questa reazione fisica di sviluppo del calore e di espansione tissutale evoca un segnale acustico rilevato da un trasduttore ad ultrasuoni. L'uso di impulsi di luce dal visibile al vicino infrarosso e l'assenza di un segnale acustico di fondo favoriscono la profondità di risoluzione. Il contrasto rilevato deriva dai cromofori più importanti presenti (emoglobina o melanina). Rispetto ad altre tecnologie, OT ha i vantaggi di (1) non aver bisogno di contrasto (imaging label-free), (2) contrasto e risoluzione migliori con meno artefatti rispetto all'ecografia e (3) prezzo inferiore e acquisizione più rapida e facilità d'uso 6,9,10,11.
La tomografia optoacustica multispettrale (MSOT) è tra gli strumenti OT di più recente generazione. Costruita con un oscillatore parametrico ottico sintonizzabile (OPO) pompato da un laser Nd: YAG che fornisce impulsi di eccitazione, un'immagine 3D viene acquisita da segnali risolti nel tempo rilevati da impulsi di eccitazione ultrasonica ad alta frequenza a lunghezze d'onda da 680 nm a 980 nm con una frequenza di ripetizione fino a 50 Hz12. La piattaforma di imaging optoacustico fornisce la quantificazione di diversi cromofori in profondità (fino a 15 mm). Variabili come HbO2, Hb e melanina sono facilmente accessibili. Sono disponibili anche altre variabili di interesse, come l'emoglobina ossigenata massimale (Max HbO2) e l'emoglobina deossigenata (Max Hb). Gli algoritmi di ricostruzione del software del produttore consentono il calcolo di altre variabili come la densità vascolare (μVu), la distanza media tra unità (ζAd) e il volume capillare (mm3).
Il presente studio esplora gli aspetti operativi essenziali di questo nuovo sistema per comprendere meglio i suoi aspetti pratici e le potenziali applicazioni nella ricerca preclinica cardiovascolare.
Protocollo
Il protocollo sperimentale è stato precedentemente approvato dal Comitato Etico della Scuola di Scienze della Salute dell'Università (EC. ECTS/P10.21). Procedure pienamente rispettate dei principi di buona pratica clinica definiti per la ricerca sull'uomo13. Un campione conveniente di sei partecipanti sani di entrambi i sessi (n = 3 per sesso) con un'età media di 32,8 ± 11,9 anni è stato scelto dalla comunità universitaria. I partecipanti selezionati dovevano essere normotensi, non fumatori e privi di qualsiasi farmaco o integrazione alimentare. Sono stati registrati anche la pressione sanguigna, la frequenza cardiaca e l'indice di massa corporea. Tutti i partecipanti sono stati precedentemente informati degli obiettivi e della durata dello studio e hanno fornito il consenso scritto informato.
NOTA: Questo studio è stato eseguito utilizzando MSOTAcuity (vedi Tabella dei materiali), d'ora in poi indicato come piattaforma di imaging optoacustico.
1. Preparazione per l'acquisizione
NOTA: nella descrizione sperimentale che segue, i comandi dello schermo sono in grassetto.
- Caricamento delle informazioni sul soggetto: accendere l'apparecchiatura di imaging optoacustico. Mentre l'attrezzatura si sta riscaldando, introdurre le informazioni sui partecipanti. La finestra di benvenuto principale del software si apre sulla panoramica della scansione. Introdurre i dati (inclusi nome, denominazione dello studio, dati personali e qualsiasi osservazione pertinente) dopo aver fatto clic su ID paziente e completare l'applicazione premendo Seleziona.
- Selezione preimpostata: assicurarsi che il messaggio Laser is Ready appaia sullo schermo dell'apparecchiatura. Dopo il tempo di riscaldamento, la barra di stato del laser sullo schermo dell'apparecchiatura deve cambiare da Laser Standby a Laser is Ready. Per questo protocollo, il preset è progettato per cromofori Hb, HbO2 e melanina. Dopo aver selezionato il preset corretto, verrà testata la potenza del laser.
- A questo punto, assicurati che ci sia un messaggio sullo schermo che ricordi a tutti i partecipanti nella stanza di applicare i google di sicurezza laser. Premere il pedale dell'interruttore laser (alimentazione) e attendere l'autocontrollo della potenza laser. Dopo alcuni secondi, viene visualizzata una finestra con lo stato laser corrente con un rapporto di controllo. Rilasciare questa finestra premendo il pulsante OK disponibile.
NOTA: La piattaforma di imaging optoacustico utilizza un laser Nd:YAG, considerato un laser di classe 4 particolarmente pericoloso per l'occhio umano. Pertanto, questo laser deve essere maneggiato con cura adeguata.
ATTENZIONE: Nessuna acquisizione dovrebbe avvenire senza garantire che tutte le procedure di sicurezza, compresa un'adeguata protezione degli occhi, siano in atto.
2. Posizionamento e acquisizione di immagini
- Acclimatare il partecipante all'ambiente di laboratorio (21 °C ± 1 °C; 40% -60% di umidità relativa), scegliendo una posizione comoda per ridurre al minimo i movimenti non necessari. Assicurarsi che l'area da scansionare sia stata precedentemente pulita.
NOTA: si raccomanda la raccomandazione del produttore di pulire l'area da visualizzare con una soluzione di etanolo / acqua al 70%. Inoltre, per una migliore acquisizione dell'immagine, si consiglia la rimozione dei peli (quando applicabile). - Portasonda e stabilizzazione dell'immagine
- Applicare un sottile strato di gel ad ultrasuoni sulla tazza 3D. La stabilizzazione dell'immagine richiede di tenere la tazza 3D nella posizione di imaging desiderata. Posizionare e stabilizzare un braccio bloccabile per l'area di interesse. Il braccio utilizzato in questo studio è stato progettato internamente e costruito con componenti profilati in alluminio (Figura 1).
- Dopo aver posizionato la tazza 3D sull'area di interesse, bloccare parzialmente il blocco del braccio stabilizzatore per l'acquisizione delle immagini.
NOTA: La qualità e l'applicazione uniforme del gel ad ultrasuoni è fondamentale; La presenza di bolle d'aria può compromettere la definizione dell'immagine.
- Acquisizione di immagini per condizioni dinamiche, utilizzando la manovra di iperemia reattiva post-occlusiva (PORH), nella scheda del menu Esame .
- Acquisire la scansione del controllo di base. Dopo aver trovato un campo visivo per l'imaging, con il bracciale della pressione sanguigna sgonfio in posizione, bloccare saldamente il braccio di posizionamento della tazza 3D.
- Applicare una pressione minima al sito di imaging, poiché pressioni più elevate potrebbero compromettere le letture. Spingere i predefiniti Hb, HbO 2 e Melanina preimpostati dal produttore che misurano simultaneamente i cromofori per Hb, HbO2 e melanina.
ATTENZIONE: È obbligatorio proteggere gli occhi con occhiali di sicurezza adeguati durante il funzionamento.
NOTA: i fototipi di pelle da IV a VI (pelle scura) sono soggetti a errori di lettura, richiedendo un'immagine di controllo di base per ulteriori elaborazioni. L'uso di occhiali di sicurezza durante l'acquisizione delle immagini (quando il laser è attivo) consente solo all'occhio umano di riconoscere i colori giallo e blu. I colori possono essere modificati durante l'elaborazione delle immagini. - Selezionare l'area anatomica per l'acquisizione dell'immagine di base. A scopo esplorativo, si raccomanda l'avambraccio ventrale. Procedere premendo il pedale dell'interruttore laser a pedale.
NOTA: il pulsante touch screen con l'etichetta Visualizza (di colore giallo), che mostra l'immagine live sullo schermo quando viene premuto. Lo stato di stabilità dell'immagine viene visualizzato come una barra grigia al centro del touch screen, che indica la stabilità della sonda 3D.- Quando la stabilità dell'immagine è massimizzata, scattare (o acquisire) un'istantanea dell'area premendo il pulsante Snapshot sul touchscreen. Ogni scansione acquisirà 10-12 fotogrammi ad una profondità acustica di 150 mm per ogni lunghezza d'onda definita all'interno del preset su un tempo di acquisizione di 2 s. Questa scansione di acquisizione di base includerà un totale di 30-36 fotogrammi.
NOTA: vengono raccolti 10 fotogrammi per ogni cromoforo rilevato (Hb, HbO2 e melanina) con una profondità massima di 15 mm. - Continuare a premere il pedale dell'interruttore laser per l'acquisizione video continua e prestare attenzione al pulsante Visualizza (di colore giallo) sul touch screen. Apparirà l'immagine stabilizzata. Premere Record (colorato in blu) per iniziare la registrazione delle immagini dal vivo.
- Interrompere la registrazione premendo il pulsante Stop (di colore nero). La piattaforma di imaging optoacustico interromperà la registrazione e renderà automaticamente il video in modalità anteprima.
- Quando la stabilità dell'immagine è massimizzata, scattare (o acquisire) un'istantanea dell'area premendo il pulsante Snapshot sul touchscreen. Ogni scansione acquisirà 10-12 fotogrammi ad una profondità acustica di 150 mm per ogni lunghezza d'onda definita all'interno del preset su un tempo di acquisizione di 2 s. Questa scansione di acquisizione di base includerà un totale di 30-36 fotogrammi.
- Misurazioni dinamiche (illustrazione PORH): regolare il bracciale di pressione sul braccio del paziente sopra il gomito per illustrare questa manovra. Gonfiare il bracciale con pressione sopra sistolica (~200 mmHg) e procedere secondo i passaggi da 2.3.1 a 2.3.3.1 per acquisire la vascolarizzazione ripresa sotto pressione.
- Per acquisire un video per valutare l'impatto del rilascio di pressione sulla vascolarizzazione ripresa, aprire la valvola di pressione mentre si acquisisce il video come in 2.3.3.2. Come prima, segui l'immagine live sullo schermo.
NOTA: Per eseguire questa manovra, la pressione sovra sistolica deve essere mantenuta per 1-5 minuti; È importante essere consapevoli che questa pressione potrebbe indurre diversi gradi di tolleranza e disagio nel paziente. Questo aspetto dovrebbe essere gestito con attenzione durante gli esperimenti.
3. Protocollo di analisi delle immagini
- Copiare le scansioni registrate in una cartella selezionata/dedicata per il backup e ulteriori analisi su una workstation separata utilizzando il software analitico dedicato del produttore. Ogni scansione viene memorizzata per tempo di acquisizione e ordinata dal programma in una cartella di studio con un codice in esecuzione.
NOTA: si consiglia vivamente di eseguire una copia di backup. Lavorare direttamente con i dati grezzi registrati è possibile ma fortemente scoraggiato, poiché qualsiasi potenziale crash del disco rigido potrebbe danneggiare i dati grezzi. - Aprire il programma di analisi sul computer workstation. Scegliere il menu del programma > Apri studio per importare i file e accedere alle scansioni di backup. Aprire lo studio e scorrere fino alla fine della cartella (con le scansioni registrate) per trovare i file con un file . NOD estensione. Questo è l'unico tipo di file riconosciuto dal software per aprire uno studio.
NOTA:. I file NOD sono denominati automaticamente con un numero di esecuzione assegnato a ciascun studio e non contengono informazioni sul paziente nel nome del file. - Per la ricostruzione delle immagini, aprire il modulo di analisi delle immagini accedendo al software Menu > elaborazione avanzata.
- Assicurarsi che le schede del flusso di lavoro del programma siano visibili (di colore nero) sulla barra dei menu superiore (Figura supplementare 1): Menu; Panoramica della scansione; Ricostruzione; Correzione della fluenza; Unmixing spettrale; Visualizzazione e analisi. Durante l'analisi, qualsiasi scheda del flusso di lavoro attivata viene colorata in blu.
NOTA: se l'elaborazione avanzata non è aperta, il software mostra solo Panoramica scansione e Visualizzazione e analisi.
- Assicurarsi che le schede del flusso di lavoro del programma siano visibili (di colore nero) sulla barra dei menu superiore (Figura supplementare 1): Menu; Panoramica della scansione; Ricostruzione; Correzione della fluenza; Unmixing spettrale; Visualizzazione e analisi. Durante l'analisi, qualsiasi scheda del flusso di lavoro attivata viene colorata in blu.
- Ricostruisci l'immagine tramite la scheda Ricostruzione del software. Selezionare le scansioni da ricostruire dal lato sinistro del menu principale del programma. Le scansioni caricate vengono visualizzate sul lato destro dello schermo. Lasciare le sei lunghezze d'onda di emissione optoacustica predefinite (700, 730, 760, 800, 850 e 900 nm), in quanto includono il segnale optoacustico massimo per HbO2 a 900 nm, per Hb a 760 nm e melanina a 700 nm.
- Eseguire la ricostruzione della scansione utilizzando l'icona sul lato destro. Seguire il flusso di lavoro del programma selezionando il predefinito di scansione e Campo visivo (risoluzione). Le informazioni sono presentate nell'angolo in alto a sinistra della schermata principale. Regolare la velocità del suono per regolare la messa a fuoco della scansione (Figura supplementare 2). Il pannello Ricostruzione mostra anche il numero di fotogrammi di ogni scansione acquisita e consente di analizzare (se necessario) la selezione delle ripetizioni.
NOTA: ogni scansione viene caricata con una velocità predefinita del suono di -90, che deve essere regolata dall'utente. La velocità del suono può anche essere regolata automaticamente con una funzione di messa a fuoco automatica (AF).
- Eseguire la ricostruzione della scansione utilizzando l'icona sul lato destro. Seguire il flusso di lavoro del programma selezionando il predefinito di scansione e Campo visivo (risoluzione). Le informazioni sono presentate nell'angolo in alto a sinistra della schermata principale. Regolare la velocità del suono per regolare la messa a fuoco della scansione (Figura supplementare 2). Il pannello Ricostruzione mostra anche il numero di fotogrammi di ogni scansione acquisita e consente di analizzare (se necessario) la selezione delle ripetizioni.
- Premere il pulsante Ricostruisci scansioni nella parte superiore dello schermo per passare alla ricostruzione delle scansioni. Verrà visualizzato un dashboard temporaneo con il messaggio Elaborazione processi. È possibile accedere a questo pannello anche dal menu > Stato elaborazione. Dopo aver terminato la ricostruzione, l'analisi di post-elaborazione dell'immagine deve passare alla correzione della fluenza.
- Attivare Fluence Correction delle immagini ricostruite nel menu del cruscotto. Le immagini ricostruite devono essere caricate per la correzione della fluenza. Questi vengono visualizzati con un flag accanto a ciascun numero di scansione. I file caricati verranno immediatamente visualizzati sul lato destro dello schermo come Ricostruzioni selezionate. Attivare Fluence Correction interagendo con l'icona sul lato destro dello schermo (Figura 3 supplementare). Premere Save Fluence Correction (s) per progredire.
- Dopo aver salvato la correzione della fluenza, eseguire la miscelazione spettrale del preset acquisito (Hb, HbO2 e melanina). Selezionate la scheda Rimescolamento spettrale per aprire l'elenco Ricostruzioni selezionate per la rimozione spettrale. Verrà visualizzato un elenco con ogni scansione dello studio selezionato con la cronologia delle precedenti fasi di elaborazione delle immagini.
- Caricare i file di correzione della fluenza salvati in precedenza. Le scansioni caricate verranno immediatamente visualizzate sul lato destro dello schermo come Ricostruzioni selezionate (Figura supplementare 4). Attiva la miscelazione spettrale premendo l'icona sul lato destro dello schermo.
- Osservare le lunghezze d'onda da non mescolare. Tutte e sei le lunghezze d'onda di emissione optoacustica (700, 730, 760, 800, 850 e 900 nm) prese nella fase di ricostruzione (fase 3.4) vengono scelte automaticamente per la dismiscelazione spettrale. Modificare gli spettri desiderati da elaborare (ad esempio, Spectra: Hb, HbO2 e melanina) utilizzando l'icona XYZ , se necessario.
- Dopo aver confermato i parametri regolati, fare clic su Avvia unmixing spettrale per far progredire l'unmixing spettrale . Viene visualizzata una barra dei menu di elaborazione che mostra lo stato di avanzamento dell'operazione.
NOTA: durante la dismiscelazione spettrale sono possibili varie regolazioni dei parametri e sono disponibili diversi metodi di smistamento. In questo protocollo, il metodo di regressione lineare viene utilizzato come standard per dismescolare Hb, HbO2 e melanina.
- Accedere alla scheda Visualizzazione e analisi . Fare clic su una scansione attivata per visualizzare tutte le informazioni sull'oggetto e i commenti introdotti nel passaggio 1.1 (Figura 5 supplementare).
NOTA: è possibile visualizzare più scansioni in parallelo.- Premere il pulsante + per creare un'analisi a scansione multipla. In questa finestra, introdurre una vista a scansione multipla e premere il pulsante Salva . Dopo aver salvato il nome della vista, viene visualizzata una nuova dashboard, che include tutte le scansioni dello studio analizzato.
- Selezionare ciascuna scansione desiderata da aggiungere (ciascuna) alla vista di analisi salvata. Aggiungi altre scansioni nell'icona nell'angolo in alto a sinistra e verranno visualizzate automaticamente nella vista Analisi.
- All'interno della vista di analisi, impostare le tabelle di ricerca dei colori appropriate per preparare l'immagine per l'analisi. Fai clic su Altre opzioni di controllo immagine nella barra dei menu in alto e attiva l'icona Proiezione massima intensità . Attribuire i colori ai livelli premendo l'icona disponibile nell'angolo inferiore destro della visualizzazione dell'immagine, accanto alla visualizzazione dell'immagine 2D+.
- Selezionare Altro per modificare i colori di tutti i canali contemporaneamente. Questo menu mostra tutti i cromofori non miscelati e consente la selezione di più livelli per la visualizzazione.
NOTA: spostando il mouse sulle icone del software viene visualizzato il loro nome in grigio come visualizzato nel protocollo. - Regola l'intensità del colore di ogni livello con gli strumenti disponibili nella parte inferiore sinistra dello schermo.
NOTA: la regolazione con interpolazione min/max per ciascun canale produce generalmente buoni risultati.
4. Analisi della regione di interesse (ROI)
NOTA: la selezione di una regione di interesse (ROI) è obbligatoria per l'analisi dei dati.
- Identificare il ROI da analizzare. Circondare il ROI con le forme disponibili (all'interno della barra dei menu) nell'immagine XY tracciando lo stesso ROI all'interno delle viste ortogonali disponibili negli assi XZ e YZ (Figura 6 supplementare).
NOTA: per l'analisi del ROI corrente è stata utilizzata una forma poligonale.- Seguite la forma ROI negli assi XZ e YZ rimanenti (esempio nella Figura 2) mentre posizionate più livelli poligonali con la funzione Aggiungi interpolazione e Rimuovi sottoregioni . I dati possono essere tracciati dopo aver definito/selezionato il ROI desiderato.
- Premere l'icona Importa regione di interesse per la quantificazione e osservare la componente multispettri mostrata sul lato destro dello schermo come dettaglio grafico del ROI selezionato.
- Esporta i dati ROI premendo l'icona Excel nella parte inferiore della visualizzazione grafica dei dati ROI. L'intero pacchetto di dati da tutte le regioni viene esportato come pacchetto in un foglio di calcolo per l'analisi successiva. La figura 3 mostra i dati di un partecipante che si è sottoposto a un bracciale a pressione gonfiato a 200 mmHg e la vascolarizzazione è stata analizzata rispetto allo stato di riposo della vascolarizzazione a 0 mmHg.
- Quantificare più oggetti ROI contemporaneamente seguendo i passaggi 4.1-4.1.3.
- Esportare le immagini dallo stesso menu dei file TIFF con tutti i dati incorporati e la struttura del ROI incorporata (Figura 2).
Risultati
I dati forniti dall'imaging optoacustico possono essere analizzati in immagini di esportazione post-elaborate (Figura 2) e dati tracciati (Figura 3). Lo scopo qui era quello di introdurre il funzionamento dell'imaging funzionale optoacustico e di esplorare la sua applicazione nella ricerca vascolare più comunemente conosciuta. Per questo, abbiamo confrontato le immagini acquisite durante il riposo e dopo un'occlusione di 200 mmHg di un'arteria principale di alimentazione (Figura 2). Queste osservazioni possono essere quantificate dopo l'analisi del ROI e l'esportazione. Nel piano XY, si può osservare il segnale più alto di melanina rispetto ai piani YZ e XZ, che indica il limite dell'epidermide. L'occlusione dell'arteria brachiale (braccio) provoca una certa stasi nei vasi prima del posizionamento della sonda OT (avambraccio ventrale). Di conseguenza, abbiamo rilevato un aumento dei segnali complessivi mostrati come un aumento di blu (Hb) e rosso (HbO2) sugli assi XY, YZ e XZ. La stasi potrebbe essere seguita nel piano XY mantenendo la pressione di 200 mmHg all'interno del bracciale. Gli assi YZ e XZ rappresentano un aumento del volume del sangue dovuto all'occlusione di cui sopra rispetto alle normali condizioni di perfusione (nessuna occlusione), evidenziate dalle aree mascherate magenta.
L'analisi del ROI esportato della stessa area microvascolare quantifica i cromofori HbO 2 (rosso), Hb (blu) e HbT (rosa), mSO2 (rosso intenso) e melanina (giallo) da immagini stabilizzate raccolte su 8,6 s. Il rilascio di pressione viene immediatamente rilevato; La Figura 3 mostra l'evoluzione post-occlusione del recupero di Hb, HbO2 e HbT, mentre l'output dei dati optoacustici segue le osservazioni in Figura 1. Il software calcola la saturazione di ossigeno nel sangue (mSO 2) e i valori di HbT dall'aggiunta dei segnali arbitrari di Hb e HbO2. La concentrazione di melanina rimane costante all'interno dell'occlusione di 200 mmHg e allo stato di riposo entro l'intervallo di tempo di acquisizione dell'immagine.
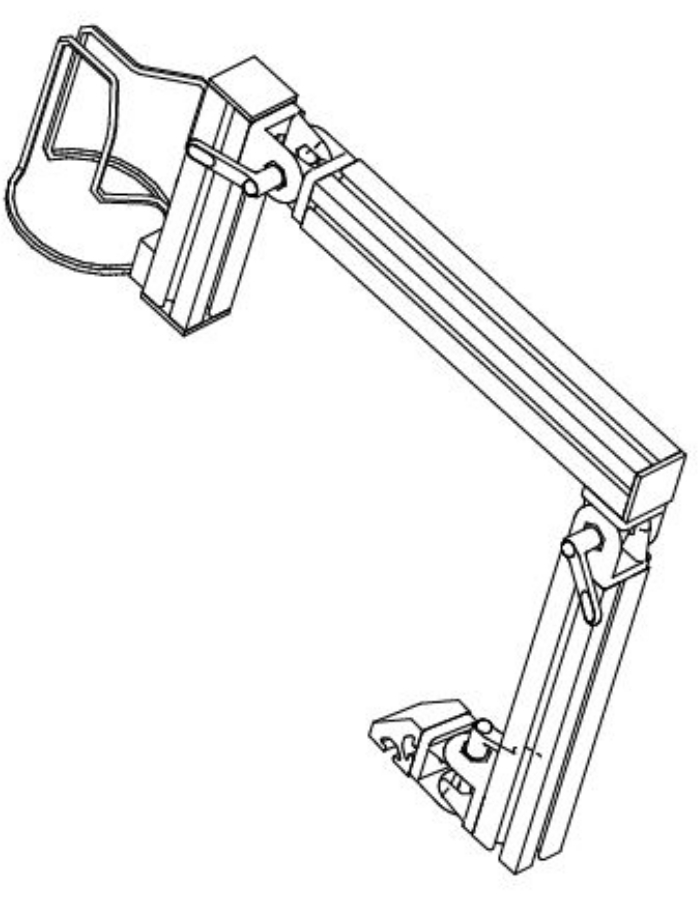
Figura 1: Diagramma schematico che rappresenta il braccio flessibile progettato per tenere la sonda di misura a contatto stabilizzato con la pelle del partecipante. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Immagini optoacustiche rappresentative che evidenziano i cambiamenti della vascolarizzazione a riposo o sotto pressione di 200 mmHg. L'immagine mostrata include tre colori, che rappresentano Hb (blu), HbO2 (rosso) e melanina (giallo), come descritto nell'analisi dell'immagine nella sezione 4. Ogni immagine optoacustica rappresenta una proiezione di massima intensità di tutti i piani associati a ciascun cromoforo scansionato. (A) Il piano XY dell'acquisizione optoacustica. (B) La vista ortogonale YZ dello stesso sito optoacustico ripreso. (C) La vista XZ dell'area scansionata. Le frecce magenta indicano le aree con maggiore stasi; L'area mascherata magenta segna l'aumento del volume di sangue intrappolato all'interno dei vasi a causa dell'occlusione dell'arteria brachiale rispetto alle normali condizioni di perfusione (nessuna occlusione). Fare clic qui per visualizzare una versione ingrandita di questa figura.
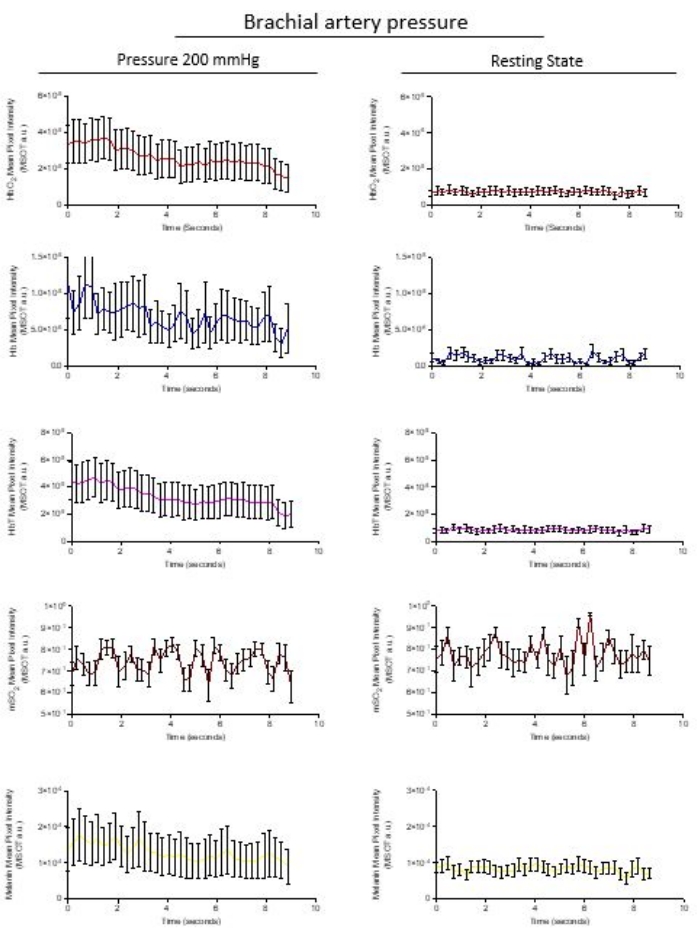
Figura 3: Esportazione rappresentativa dei dati di un ROI quantificato. I cromofori naturali di HbO 2 (rosso), Hb (blu) e HbT (rosa), mSO2 (rosso intenso) e melanina (giallo) sono rappresentati dai dati estratti dalle immagini stabilizzate raccolte su 8,6 s. I grafici di Hb, HbO2 e HbT mostrano una pendenza di recupero dall'occlusione verso lo stato di riposo non occluso. L'ossigenazione del sangue calcolata mSO2 e la concentrazione di melanina rimangono costanti entro l'occlusione di 200 mmHg e allo stato di riposo entro l'intervallo di tempo di acquisizione dell'immagine. Le immagini estratte sono punti dati rappresentati come media ± sd di n = 10 immagini per fotogramma. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Pannello di panoramica della scansione e menu principale del software di analisi. Premendo il pulsante Menu (in nero), il menu principale aprirà le opzioni per selezionare lo studio selezionato. Questa azione selezionerà e caricherà il file ".nod" riconosciuto dal software. La panoramica delle scansioni (in blu) mostra tutte le scansioni dello studio. I dettagli (neri) vengono visualizzati sulla destra. Clicca qui per scaricare questo file.
Figura supplementare 2: Flusso di lavoro dell'analisi della ricostruzione. Pannello 1 - Selezionare la scansione da ricostruire e premere la freccia rivolta a destra sul lato destro del display (freccia viola) per avanzare. Pannello 2 - Osservare la velocità del suono e regolare il cursore sulla messa a fuoco migliore (freccia blu); a) messa a fuoco regolata visualizzata nella finestra sul lato destro; b) selezionare le ripetizioni da analizzare (freccia gialla); c) premere il pulsante Ricostruisci scansioni per procedere (freccia verde). Clicca qui per scaricare questo file.
Figura supplementare 3: Flusso di lavoro del pannello di correzione della fluenza. Pannello 1 - Selezionare le scansioni da correggere e premere la freccia rivolta a destra sul lato destro dello schermo. Pannello 2 - premere Save Fluence Correction(s) per procedere (freccia verde). Clicca qui per scaricare questo file.
Figura supplementare 4: Flusso di lavoro del pannello di smistamento degli spettri. Pannello 1 - Selezionare le scansioni da sciogliere e premere la freccia rivolta a destra (freccia viola). Pannello 2 a) selezionare la scansione da scombinare (freccia blu) e verrà visualizzata un'anteprima dell'immagine regolata sul lato destro; b) Selezionare le ripetizioni da scombinare (freccia gialla); c) premere Start spectral unmixing per procedere (freccia verde). Clicca qui per scaricare questo file.
Figura supplementare 5: Pannello di visualizzazione e selezione dei colori cromofori. Pannello 1) Selezionare le scansioni da visualizzare con un doppio clic (freccia viola); Pannello 2) Immagine acquisita nell'asse XY (quadrato blu), XZ (quadrato giallo) e YZ (quadrato verde); 2a) Pulsante di analisi dell'immagine che mostra le lunghezze d'onda acquisite; 2b) scegliere Altre opzioni di controllo immagine nella barra dei menu in alto e attivare l'icona Proiezione massima intensità ; seleziona Altro per modificare i colori dei canali. Clicca qui per scaricare questo file.
Figura supplementare 6: Selezione della regione di interesse (ROI). Selezionate lo strumento lazo (freccia gialla) e definite i limiti del ROI all'interno dell'asse XY (freccia magenta). È possibile definire varie aree di forma (poligono, rettangolo, quadrato, cerchio o elise). Seguire il ROI negli assi XZ e YZ e aggiungere sottoregioni (freccia verde) alla selezione iniziale. Vengono visualizzate più sottoregioni (freccia ciano). Per estrarre i dati dal ROI selezionato, premere l'icona Importa regione di interesse per la quantificazione e procedere. Clicca qui per scaricare questo file.
Discussione
Questo protocollo enfatizza le fasi di lavoro considerate come requisiti pratici per il funzionamento di questo nuovo strumento di imaging optoacustico, dal posizionamento adeguato (partecipante, sonda) necessario per la stabilizzazione della sonda a tazza 3D all'acquisizione delle immagini, alla selezione del ROI e alla ricostruzione e analisi delle immagini.
L'approccio sperimentale proposto, utilizzando acquisizioni "istantanee" insieme a immagini ottenute in condizioni dinamiche, illustra l'interesse e l'utilità di questo strumento nell'accesso alla fisiologia vascolare umana in vivo . Come mostrato, la risoluzione dell'immagine acustica di 150 μm raccolta in un volume fino a 15 mm3 non ha eguali con altre tecniche di tomografia.
È necessaria particolare attenzione per quanto riguarda (i) l'importanza della stabilizzazione della sonda per l'acquisizione delle immagini; l'uso di un portasonda flessibile e sicuro migliora chiaramente l'acquisizione delle immagini; (ii) la corretta identificazione delle strutture vascolari; Riferimenti ecografici come la melanina nella transizione epidermico-dermica potrebbero essere usati come marcatore per identificare i vasi del plesso superiore nella pelle; e (iii) l'analisi funzionale dell'immagine eseguita attraverso il software di ricostruzione del produttore.
L'analisi avanzata dei dati ROI e dell'esportazione delle immagini richiede una comprensione più approfondita del software dedicato e degli algoritmi sviluppati. L'attuale strumento di imaging optoacustico è in grado di ricostruire un volume 3D di 15 mm3 di tessuto con una risoluzione di 150 μm. Questa capacità deve essere potenziata per quantificare meglio le funzioni microvascolari in profondità. Tuttavia, il funzionamento di base consente l'osservazione diretta dei cromofori di riferimento e l'acquisizione di più preset dalla stessa area, fornendo scansioni veloci e registrazioni video live.
Il potenziale di applicabilità riscontrato con il sistema di imaging optoacustico è rilevante. Gli sviluppi software in corso miglioreranno sicuramente l'utilità di questo sistema di imaging.
Divulgazioni
Gli autori non segnalano conflitti di interesse.
Riconoscimenti
Questa ricerca è finanziata da ALIES e COFAC principali fornitori della tecnologia in studio, e dalla Fundação para a Ciência e a Tecnologia (FCT) attraverso la sovvenzione UIDB/04567/2020 al CBIOS.
Materiali
| Name | Company | Catalog Number | Comments |
| Cuff | PIC | 107001 | |
| Drapes | Pajunk | 021151-1501 | |
| Ethanol 70% | Sigma Aldrich | EX0281 | |
| Gogless | Univet | 559G.00.00.201 | |
| Kimwipes | Amoos | 5601856202331.00 | |
| MSOT | iThera | MSOTAcuity | |
| Stabilizing arm | ITEM | Self designed and assemble | |
| Ultrasound gel | Parker Laboratories | 308 | |
| Waxing cream | Veet | kkdg08hagd |
Riferimenti
- Iskander-Rizk, S., vander Steen, A. F. W., van Soest, G. Photoacoustic imaging for guidance of interventions in cardiovascular medicine. Physics in Medicine and Biology. 64 (16), (2019).
- Cakmak, H. A., Demir, M. MicroRNA and cardiovascular diseases. Balkan Medical Journal. 37 (2), 60-71 (2020).
- Li, Z., Gupte, A. A., Zhang, A., Hamilton, D. J. Pet imaging and its application in cardiovascular diseases. Methodist DeBakey Cardiovascular Journal. 13 (1), 29-33 (2017).
- Karlas, A., et al. Cardiovascular optoacoustics: From mice to men - A review. Photoacoustics. 14, 19-30 (2019).
- MacRitchie, N., Noonan, J., Guzik, T. J., Maffia, P. Molecular imaging of cardiovascular inflammation. British Journal of Pharmacology. 178 (21), 4216-4245 (2021).
- Granja, T., Andrade, S., Rodrigues, L. Optoaccoustic tomography - good news for microcirculatory research. Biomedical and Biopharmaceutical Research. 18 (2), 1-13 (2022).
- Tan, H., et al. Total-body PET/CT: Current applications and future perspectives. American Journal of Roentgenology. 215 (2), 325-337 (2020).
- Masthoff, M., et al. Multispectral optoacoustic tomography of systemic sclerosis. Journal of Biophotonics. 11 (11), 201800155 (2018).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15 (1), 011101 (2010).
- Wu, M., Awasthi, N., Rad, N. M., Pluim, J. P. W., Lopata, R. G. P. Advanced ultrasound and photoacoustic imaging in cardiology. Sensors (Basel). 21 (23), 7947 (2021).
- Yang, H., et al. Soft ultrasound priors in optoacoustic reconstruction: Improving clinical vascular imaging. Photoacoustics. 19, 100172 (2020).
- Dean-Ben, X. L., Gottschalk, S., Mc Larney, B., Shoham, S., Razansky, D. Advanced optoacoustic methods for multiscale imaging of in vivo dynamics. Chemical Society Reviews. 46 (8), 2158-2198 (2017).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 310 (20), 2191-2194 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon