Method Article
Isolamento de microRNAs de Tick Ex Vivo Culturas de Glândulas Salivares e Vesículos Extracelulares
Neste Artigo
Resumo
O presente protocolo descreve o isolamento de microRNAs de glândulas salivares de carrapatos e vesículas extracelulares purificadas. Este é um procedimento universal que combina reagentes e suprimentos comumente usados. O método também permite o uso de um pequeno número de carrapatos, resultando em microRNAs de qualidade que podem ser facilmente sequenciadas.
Resumo
Carrapatos são ectoparasitas importantes que podem vetor múltiplos patógenos. As glândulas salivares dos carrapatos são essenciais para a alimentação, pois sua saliva contém muitos efeitos com propriedades farmacêuticas que podem diminuir as respostas imunológicas hospedeiras e melhorar a transmissão de patógenos. Um grupo desses efeitos são microRNAs (miRNAs). miRNAs são sequências curtas de não codificação que regulam a expressão genética do hospedeiro na interface tick-host e dentro dos órgãos do carrapato. Estes pequenos RNAs são transportados na saliva de carrapato através de vesículas extracelulares (EVs), que servem comunicação inter e intracelular. Vesículas contendo miRNAs foram identificadas na saliva de carrapatos. No entanto, pouco se sabe sobre os papéis e perfis dos miRNAs em vesículas salivares de carrapato e glândulas. Além disso, o estudo de vesículas e miRNAs na saliva de carrapato requer procedimentos tediosos para coletar saliva de carrapato. Este protocolo visa desenvolver e validar um método de isolação de miRNAs a partir de vesículas extracelulares purificadas produzidas por culturas de órgãos ex vivo . Os materiais e a metodologia necessários para extrair miRNAs de vesículas extracelulares e glândulas salivares de carrapato são descritos aqui.
Introdução
Carrapatos são ectoparasitas que vetores muitos patógenos para a vida selvagem, pecuária, humanos e seus animaisde estimação 1,2. A alimentação por carrapatos resulta em perda econômica significativa, causando danos à pele, reduzindo a produção de peso e leite devido à anemia grave, e a transmissão de patógenos potencialmente mortais causadores de doenças 1,3,4,5. As práticas atuais de controle para o manejo das populações de carrapatos estão focadas no uso de acaricídios. No entanto, o surgimento contínuo da resistência ao acaricídio em carrapatos que parasitam a pecuária 5,6, o aumento da incidência de picadas de carrapato7 e a transmissão de patógenos em áreas residenciais 8,9, levaram à necessidade de alternativas únicas de controle de carrapatos.
As glândulas salivares do carrapato são órgãos essenciais que garantem o sucesso biológico de um carrapato. São formadas por diferentes tipos de acinus (I, II, III e IV) com várias funções fisiológicas. As glândulas salivares são responsáveis pela osmoregulação, tanto fora quanto no hospedeiro, devolvendo o excesso de água e o conteúdo de ferro ao hospedeiro via salivação 2,10. Tipo I acini também estão envolvidos na captação de água da atmosfera pela secreção da saliva higroscópica10,11. Proteínas efeitos salivares, como cimento e cistatinas, são produzidas dentro de células secretary nos tipos II e III acini10,12. O acini tipo I não afeta a alimentação do carrapato, indicando que a ingestão de farinha de sangue não desencadeia alterações morfológicas e fisiológicas nestes acini tipo13,14. Por outro lado, acini tipo II e III são ativados durante a alimentação e apresentam muito pouca atividade pré-apego. Assim, a alimentação é necessária para desencadear o alargamento das células secretas dentro do acini tipo II e a produção de compostos bioativos. O acini tipo III é reduzido em tamanho durante a alimentação devido à secreção dentro dos grânulos secretos12.
As glândulas salivares também são o local da infecção por patógenos no carrapato e na rota de transmissão. Durante a alimentação, os carrapatos secretam vários compostos com efeitos farmacêuticos que são necessários para a conclusão bem sucedida da farinha de sangue 10,15,16. Esses compostos possuem propriedades anti-inflamatórias, imunossupressores e vasodilatações 10,15,17. Estudos recentes têm demonstrado que vesículas extracelulares (EVs) derivadas das glândulas salivares de carrapato abrigam vários desses compostos, induzindo efeitos anti-inflamatórios e imuno-modulatórios 18,19,20. "Vesículas extracelulares" é um termo de guarda-chuva usado para descrever vesículas classificadas como exosóis e microvesculas com base em seu tamanho e biogênese. No geral, os EVs são blebs lipídes com membranas bicamadas que são ~40 nm-1 μm no tamanho21; geralmente, exossomos são descritos como sendo de 40-150 nm de tamanho, enquanto microvesículos estão entre 150 nm-1 μm no tamanho 21,22,23. No entanto, o tamanho não é indicativo da via biogênese dos EVs22.
A biogênese dos exosóis começa com a invaginação sequencial da membrana plasmática. Essa invaginação leva à formação de corpos multivesiculares e, finalmente, resulta na deformação da membrana vesicular pela ação de complexos ESCRT ou sphingomyelinases (sMases)24,25. Os exossomos podem ser lisosomes dentro dos lisosóis para manter a homeostase celular ou sair via fusão vesicular à membrana plasmática para entregar constituintes celulares às células receptoras21,24. Por outro lado, os microvesículos são formados pela ação de flopasses e flipasses, alterando a conformação de lipídios na membrana plasmática26. Os EVs são essenciais para a comunicação célula-celular, servindo como um sistema de transporte para carga intracelular, como lipídios, proteínas, ácidos nucleicos e microRNAs (miRNAs)21,27,28. Uma vez transportadas, essas vesículas entregam sua carga para o citoplasma das células receptoras, gerando alterações fenotípicas na célula receptora22,29. Devido à importância das vesículas extracelulares na alimentação do carrapato e à manipulação das respostas imunes e cicatrizanteshospedeiras 18,20, a carga dentro de vesículas extracelulares apresenta potenciais alvos para o desenvolvimento de terapêutica anti-carrapato e um mecanismo único para interromper a alimentação de carrapatos. Isso inclui miRNAs dentro das glândulas salivares de carrapato e vesículas extracelulares derivadas da glândula salivar.
miRNAs são sequências curtas de não codificação, ~18-22 nucleotídeos (nt) de comprimento, que podem regular, degradar ou silenciar sequências mRNA30,31. Durante a transcrição, os pri-miRNAs são cortados por Dicer (RNA polymerase III) para formar uma estrutura distinta semelhante ao grampo de cabelo, tornando-se um pré-miRNA. O pré-miRNA é cortado mais uma vez por Drosha (RNA polymerase III) para formar um duplex miRNA maduro. A sequência madura torna-se integrada ao complexo de silenciamento induzido pelo RNA (RISC) complementar à sequência mRNA, causando repressão de tradução ou degradação de mRNA 28,30,32. Durante a alimentação hospedeira, miRNAs dentro da saliva de carrapato podem modular a expressão genética hospedeira para suprimir respostas imunes e melhorar a transmissão de patógenos 33,34,35,36,37. Embora existam estudos extensivos sobre EVs e miRNAs, seus papéis durante a alimentação na interface tick-host ainda são mal compreendidos. Otimizar protocolos que podem facilmente resultar no isolamento e purificação de miRNAs de alta qualidade é crucial para o avanço de nossos conhecimentos sobre esses tópicos.
Várias opções podem ser utilizadas para isolar EVs, como ultracentrifugação, precipitação exósmida, precipitação de polímeros, cromatografia imunoaffinity e técnicas de exclusão baseadas em tamanho38. No entanto, essas técnicas não podem distinguir entre exosósmos ou microvesculas. Assim, como mencionado anteriormente, o EV é usado como um termo guarda-chuva ao isolar EVs de diferentes amostras. As vesículas isoladas nos experimentos aqui descritos representam uma mistura de vesículas derivadas de diferentes vias de biogênese. A purificação de uma população específica de vesículas extracelulares pode ser alcançada por imunoprecipitação usando contas revestidas com anticorpos contra marcadores (ou seja, marcadores exosômicos, marcadores tumorais) exclusivos da população vesícula de interesse39,40. miRNAs também podem ser extraídos através de diferentes kits de isolamento disponíveis comercialmente 7,41,42.
O objetivo deste projeto foi desenvolver um protocolo que combina métodos comumente aplicados para isolar EVs e extrair miRNA de ambos os EVs e glândulas salivares fed-tick. Como a secreção de compostos bioativos é ativada pela alimentação12, os carrapatos devem ser autorizados a se alimentar para identificar miRNAs que podem ser importantes para manipular as respostas imunes do hospedeiro e curar feridas. O presente protocolo requer um pequeno número de carrapatos (20 carrapatos) para isolar EVs e seus respectivos miRNAs, em comparação com outros estudos descritos anteriormente que exigiram 2000 carrapatos43. Além disso, evita a contaminação de secreções salivares com pilocarpina44, o que poderia influenciar experimentos que estudam o efeito de EVs e seus miRNAs em células hospedeiras.
Protocolo
Todos os experimentos em animais foram realizados seguindo o protocolo de uso de animais (AUP#2020-0026) aprovado pelo comitê institucional de cuidados e uso de animais (AICUC) da Texas A&M University. As espécies de carrapatos, Ixodes scapularis e Rhipicephalus (Boophilus) microplus, e Coelhinhos Brancos Machos da Nova Zelândia, de 42 a 72 dias de idade, foram utilizadas para o presente estudo. I. scapularis foi recebido do Center for Disease Control (CDC) e da Oklahoma State University, certificado como livre de patógenos. R. microplus foi criado no Laboratório de Pesquisa de Carrapatos da Febre do Gado em Edinburg, Tx. Os coelhos foram obtidos a partir de fontes comerciais (ver Tabela de Materiais). Este protocolo pode isolar universalmente vesículas extracelulares e miRNAs de diferentes espécies de carrapatos, estágios de vida e tecidos.
1. Criação de I. scapularis femininos e preparação de cápsulas
- Prepare uma cápsula de espuma de acetato de etileno-vinil seguindo os procedimentos para coelhos que alimentam carrapatos duros45. Coloque uma cápsula em cada omoplata do coelho para um total de duas cápsulas por infestação.
NOTA: Brevemente, essas cápsulas consistem em dois quadrados de espuma de acetato de etileno-vinil com um espaço vazio interno. Um quadrado é colado na parte de trás do animal (neste caso, coelhos) com um adesivo de tecido (ver Tabela de Materiais). Malha fina é colada ao segundo quadrado para evitar a fuga de carrapatos. Os dois quadrados estão fechados usando fita adesiva autoadesiva. - Deixe as cápsulas fixar por 24 horas antes de aderir a cápsula nos coelhos. Armazene as cápsulas de espuma à temperatura ambiente.
NOTA: As cápsulas podem ser armazenadas indefinidamente à temperatura ambiente. - Adere à cápsula aos coelhos raspados à pele e deixe por 24 horas antes da infestação do carrapato.
2. Preparação de mídia sem vesículas
- Para preparar a mídia sem vesículas13, combine 0,5 mL de soro bovino fetal, 0,5 mL de caldo de fosfato de triptaose, 0,1 mL de concentrado lipoproteína-colesterol, 0,5 mL de 5% de bicarbonato de sódio (NaHCO3), 0,25 mL de 4-(2-hidroxitil)-1-piperazineethanesulfônico ácido (HEPES) e 8,125 mL de L15C300 médio (ver Tabela de Materiais). Ajuste o volume do meio conforme necessário. Coloque o meio em uma garrafa de centrífuga de policarbonato de 26,3 mL.
- Equilibre as garrafas por uma diferença de peso de 0,01 g máximo para garantir o bom funcionamento da ultracentrifuagem.
- Ultracentrizar o meio por 18 h a 100.000 x g a 4 °C. Remova o supernatante através de pipeta, garantindo cuidadosamente não perturbar nenhuma pelota formada.
- Transfira o supernatante para um novo tubo de centrífuga e ultracentrifuugar uma segunda vez por 18 h a 100.000 x g a 4 °C, com equilíbrio adequado.
- Isole o supernatante restante e passe por um filtro de seringa de 0,22 μm para remover contaminantes. Pipeta o supernatante em um tubo de centrífuga de 50 mL.
- Armazene o supernatante em um congelador de -20 °C até que seja necessário ou até 3 anos.
3. Infestação de coelhos
- Corte a parte superior de uma seringa de 10 mL e carregue fêmeas adultas I. scapularis usando um pincel padrão.
- Cubra a abertura da seringa usando gaze estéril (Figura 1).
- Coloque o coelho sobre uma mesa ou uma superfície de trabalho horizontalmente; enrole o coelho firmemente com uma toalha e cubra os dois olhos, deixando a cápsula preparada (passo 1.1) exposta para infestar o coelho com carrapatos.
- Abra a cápsula e insira carrapatos empurrando a alça da seringa. Deposite os carrapatos perto da pele do coelho. Feche rapidamente as cápsulas para evitar que os carrapatos escapem.
- De acordo com o projeto experimental, permita que os carrapatos femininos se alimentem pelo tempo que for necessário. Não permita que ixodes machos scapularis permaneçam na cápsula por mais de 24 horas para evitar a dessacação.
NOTA: O número de carrapatos a serem infestados nos animais fica a critério do investigador. Este protocolo utilizou ~100 carrapatos por infestação para explicar a mortalidade e material suficiente para réplicas. Os experimentos preliminares determinaram que pelo menos 20 carrapatos/réplicas eram necessários para obter material suficiente para sequenciar as miRNAs.
4. Remoção das fêmeas alimentadas
- Coloque os coelhos infestados abaixo de 2% de isoflurane em oxigênio usando um difusor de gás. Defina a taxa de oxigênio entre 700-1000 L/min.
NOTA: Outros anestésicos podem ser usados para evitar qualquer angústia ou dor. - Remova as fêmeas alimentadas segurando os carrapatos pelo seu capitulo, usando fórceps finos, o mais próximo possível da pele. Certifique-se de que as partes bucais sejam completamente removidas para evitar infecções bacterianas.
- Coloque os carrapatos em um tubo de centrífuga de 15 mL.
- Limpe o local da mordida com 70% de etanol e adicione uma pequena quantidade de antibiótico triplo (vale a ponta dos dedos, veja Tabela de Materiais) para evitar infecção no local da picada de carrapato.
- Leve os carrapatos ao laboratório para dissecções (etapa 5). Realizar essas dissecções dentro de 24-48 h de remoção dos carrapatos para evitar a degradação das glândulas salivares15,43.
5. Dissecção da glândula salivar e secreção de vesícula extracelular
- Adicione 500 μL de meio livre de vesícula (etapa 2) com 5 μL de penicilina de 100x, 5 μL de 100x de estreptomicina, 5 μL de 10 mg/mL de rifampicina e 5 μL de 100x de anfoterítmica para cada poço (ver Tabela de Materiais). Adicione 1x PBS com rifampicina a quaisquer poços que não contenham meio livre de vesícula para evitar o crescimento bacteriano.
- Coloque os carrapatos em um slide de vidro microscópico claro com fita adesiva de dois lados sob um microscópio dissecando. Para evitar a dessecação de órgãos, adicione 10 μL de 1x PBS a cada carrapato antes da dissecação.
- Usando tesouras de vannas de 4 mm (ver Tabela de Materiais), faça uma pequena incisão de ~1 mm na lateral de cada fêmea. Remova completamente o lado dorsal do carrapato (Figura 2) e remova ambas as glândulas salivares.
- Coloque 20-40 glândulas salivares de carrapato em 500 μL de meio livre de vesícula adicionado a um único poço em uma placa tratada com cultura de tecido de 24 poços (Figura 3).
- Incubar as amostras de glândula salivar a 32 °C por 24 h para permitir a secreção dos EVs.
6. Isolamento de vesículos extracelulares
- Após a incubação de 24 h, pipeta todo o meio contendo as glândulas salivares em um tubo de microcentrifuge de 1,5 mL.
- Centrifugar a amostra a 300 x g a 4 °C por 10 minutos para isolar as glândulas salivares. Duas fases serão separadas nesta etapa: (1) o supernatante contendo os EVs e (2) as glândulas salivares (pelota).
- Para continuar o isolamento dos EVs, pipeta o supernante em um novo tubo de microcentrifuge de 1,5 mL. Resuspenha a pelota contendo as glândulas salivares (passo 6.2) em 500 μL de RNAlater (ver Tabela de Materiais) e armazene a -80 °C até ser usada ou indefinidamente.
NOTA: Estas glândulas salivares serão usadas para o isolamento do miRNA na etapa 8. - Centrifugar o supernante a 2000 x g a 4 °C por 10 min para remover detritos celulares. Pipeta o supernatante em um novo tubo de microcentrifuge de 1,5 mL. Descarte a pelota.
- Centrifugar o supernante a 10.000 x g por 30 min a 4 °C para remover corpos apoptóticos e EVs maiores. Coloque a pelota e coloque o supernascido em um novo tubo de microcentrifuga de 1,5 mL.
- Conecte uma seringa de 10 mL a um filtro de seringa de nylon de 1 μm. Coloque a seringa e o filtro acima de um tubo ultracentrífuga (Figura 4A). Em seguida, adicione a amostra (Figura 4B) e encha a seringa com 10 mL de 1x PBS (Figura 4C) e equilibre o tubo em conformidade (Figura 4D).
- Coloque tubos em um rotor de 70Ti (ver Tabela de Materiais) e gire a 100.000 x g por 18 h a 4 °C.
- Após 18 h de ultracentrifugação, observe uma pelota na extremidade inferior do tubo (Figura 5). A pelota é a vesícula extracelular concentrada.
- Remova 90%-100% do supernatante sem reutilizar a pelota EV. Resuspend a pelota com 1x PBS. Se nem todos os supernasces pudessem ser removidos, use o restante do supernatante para resuspensar a pelota.
- Pipeta 500 μL da pelota EV/supernante em um filtro centrífugo de 300 K (ver Tabela de Materiais).
NOTA: Isso removerá quaisquer proteínas não associadas à vesícula, miRNAs e outras moléculas, enquanto as vesículas não passarão pelo filtro. - Centrifugar a 8.000 x g por 10 min a temperatura ambiente. Repita o passo 6.10 até que todas as pelotas EV/supernante tenham passado pelo filtro.
- Adicione 400 μL de PBS 1x esterilizado à coluna e misture bem via pipeta para remover EVs ligados à membrana. Coloque a amostra em um tubo sem DNase de 1,5 mL. As amostras podem ser armazenadas a -80 °C indefinidamente ou até serem utilizadas. Evite o degelo excessivo da amostra para evitar a degradação da amostra.
NOTA: Coloque tubos no gelo quando retirados da ultracentrifugação para evitar a degradação do EV. A amostra final será a pelota EV em 400 μL de 1x PBS. 25 μL desta amostra será utilizado para análise de rastreamento de nanopartículas (NTA, etapa 7) e 375 μL para isolamento de miRNA (etapa 8).
7. Análise de rastreamento de nanopartículas (NTA)
- Pegue 25 μL da amostra final (etapa 6.12) e adicione 375 μL de 1x PBS.
- Carregue a amostra diluída em uma seringa sem agulha de 1 mL e parafuso firmemente na lente óptica da NTA.
- Ajuste as configurações de acordo e capture vídeos com base nas preferências de configuração.
NOTA: No presente estudo, foram realizadas três leituras de 60 s cada. Toda leitura nta representa uma replicação técnica. Diferentes amostras da alimentação de carrapatos pelo mesmo período de tempo representam réplicas biológicas individuais. A câmera foi definida no nível 7 e o limiar de detecção foi definido no nível 5. - Estime os números finais do EV pela seguinte fórmula:
((concentração inicial de EVs (fator de diluição)) * (volume total deixado no tubo amostral)/1000) = EVs totais na amostra
NOTA: O volume deve ser dividido por 1000 porque a NTA lê as amostras como concentração/mL.
8. extração de miRNA de glândulas salivares e vesículas extracelulares
- Adicione 100 μL do reagente de lise (ver Tabela de Materiais) à amostra restante da etapa 6.12 e homogeneize com pilões esterilizados (Figura 6).
- Adicione os 600 μL restantes do reagente de lise e incubar por 5 min a temperatura ambiente.
- Adicione 140 μL de clorofórmio, agite vigorosamente por 15 s e incubar por 3 min a temperatura ambiente.
- Gire a 12.000 x g para 15 min a 4 °C.
- Pipeta a fase superior clara, evitando a interfase, em um novo tubo de 1,5 mL. Isso resultará em ~525 μL de volume amostral esperado. Em seguida, adicione um volume de 1:1 de 100% de etanol de grau molecular.
- Adicione 700 μL da amostra em uma coluna de rotação de isolamento de RNA (ver Tabela de Materiais).
- Gire a 8.000 x g para 30 s em temperatura ambiente, descarte o fluxo.
- Lave a amostra com 700 μL de tampão RTE (ver Tabela de Materiais), gire a 8.000 x g para 30 s, descarte o fluxo através.
- Lave a amostra com 500 μL de tampão RPE (ver Tabela de Materiais), gire a 8.000 x g para 30 s, descarte o fluxo através.
- Adicione 500 μL de 80% de etanol de grau molecular e gire a 8.000 x g por 2 min, descarte o fluxo.
- Gire a coluna na velocidade máxima por 5 minutos para secar a membrana. Descarte o tubo de coleta e coloque a coluna em um novo tubo de microfuça de 1,5 mL.
- Adicione 14 μL de água livre de RNase/DNase à membrana e incubar por 5 minutos à temperatura ambiente.
- Centrifugar a 21.000 x g por 1 min a temperatura ambiente.
- Adicione 1 μL de inibidor de RNase (ver Tabela de Materiais) aos miRNAs eluvar bem via pipeta.
NOTA: Antes da extração de miRNA das glândulas salivares, remova qualquer RNAlater adicionando 1 ml de PBS 1x (volume 1:1) e gire as glândulas salivares em velocidade máxima por 15 minutos a 4 °C. Isso precisa ser repetido três vezes ou até que as glândulas salivares tenham diminuído o suficiente para remover o supernatante. Neste ponto, a amostra representa uma mistura de pequenas RNAs de ~20-150 bp em tamanho (Figura Suplementar 1).
9. Medindo a concentração de miRNA
- Meça a concentração de RNA pequeno através de um kit de ensaio RNA disponível comercialmente41 (ver Tabela de Materiais).
- Em cada tubo, misture 199 μL de tampão de diluição (Componente A e B fornecidos no kit por amostra), 1 μL de corante fluorescente específico para a detecção de miRNAs (comprimento de onda de medição de 260 nm) (por amostra) e 2 μL de RNA pequeno (etapa 8) para cada amostra, de acordo com as instruções do fabricante.
- Antes de ler os tubos de amostra, leia o miRNA pré-diluído padrão 1 e o padrão 2 (fornecido no kit) para criar uma curva padrão antes da medição da amostra.
NOTA: As normas são utilizadas como ferramenta de comparação para determinar a concentração de miRNA medida nas amostras. - Coloque cada tubo padrão e amostra no fluorômetro dedicado (ver Tabela de Materiais) para medir a concentração como ng/μL.
10. Determinando a qualidade do miRNA
- Determine a qualidade do miRNA e de outros pequenos RNAs via eletroforese de gel usando um bioanalyzer46, seguindo as instruções do fabricante (ver Tabela de Materiais).
- Antes da leitura da amostra, normalize as amostras como a mesma concentração.
- Leia as amostras através de um pequeno chip RNA 41,46, seguindo as instruções do fabricante (ver Tabela de Materiais).
NOTA: Para determinar a qualidade do miRNA, as imagens semelhantes a gel (bandas) e eletroferogramas (picos) são indicadores da qualidade da amostra. Quanto mais escura a banda no gel, melhor é a qualidade miRNA. Quanto mais leve a banda (ou se não houver banda), menor será a qualidade ou prova a degradação amostral 46,47.
11. enriquecimento de microRNA
- Enriqueça o miRNA usando um pequeno kit de sequenciamento de RNA, seguindo as instruções do fabricante do pequeno kit de preparação de amostras de RNA (ver Tabela de Materiais).
- Ligate cada amostra com um adaptador adenylated de 3' e remova o adaptador em excesso através da limpeza de contas. Em seguida, adicione um adaptador de 5' e remova o adaptador em excesso por uma limpezade contas 48.
NOTA: Tanto os adaptadores quanto as contas para limpeza foram fornecidos no pequeno kit de sequenciamento de RNA da seção 11.1 (ver Tabela de Materiais). - Para sintetizar o primeiro fio, prepare uma mistura mestra das amostras ligadas com ambos os adaptadores, tampão RT e transcriptase reversa M-MuLV fornecida no kit (ver Tabela de Materiais). Em seguida, incubar a mistura por 30 min a 42 °C e 10 min a 90 °C. Acompanhamento com uma limpeza amostral conforme indicado nas instruções.
- Amplie a 1ª linha usando o primer rt forward e o primer universal reverso fornecido no kit (ver Tabela de Materiais) através de uma reação convencional de corrente de polimerase (PCR) por 2 min a 95 °C, depois para 12-25 ciclos para 20 s a 95 °C, 30 s a 60 °C e 15 s a 72 °C. Por fim, 2 min a 72 °C.
NOTA: Espera-se que o tamanho do produto PCR seja de ~150 bp (Figura 7). - Meça a qualidade do produto PCR através da estação de fita seguindo as instruções do fabricante (ver Tabela de Materiais).
- Sequencia as amostras usando um sistema de sequenciamento de próxima geração (75 ciclos), seguindo as instruções do fabricante (ver Tabela de Materiais).
NOTA: Para o enriquecimento do miRNA, a quantidade e a qualidade da amostra devem ser verificadas (etapas 9-10) antes da preparação da biblioteca.
12. Análise bioinformática
- Identifique os miRNAs conservados e exclusivos usando uma ferramenta de aplicação integrada para identificação de miRNA.
NOTA: No presente estudo, a identificação do miRNA foi realizada via miRDeep249,50. miRDeep2 é um catálogo online gratuito de todos os miRNAs conservados e novos encontrados em várias espécies 49,50 (ver Tabela de Materiais). - Alinhe as leituras ao genoma correspondente usando o mapeador integrado ao software.
- Insira os seguintes parâmetros no módulo mapeador.
- Corte as sequências do adaptador adicionadas da etapa 11.2 e remova sequências com menos de 18 nucleotídeos de comprimento. Remova as sequências de leitura redundantes.
- Converta os arquivos usando a análise para o parâmetro de formato FASTA, somente se o arquivo não estiver no formato FASTA49.
- Alinhe as sequências filtradas e aparadas ao genoma correspondente. Se não houver genoma para as espécies de interesse, alinhe-se com as espécies homologous mais próximas.
- Mostre os arquivos de saída como "reads.fa" e "reads_vs_genome.arf". O "read.fa" conterá apenas as leituras não redundantes, e o "reads_vs_genome.arf" incluirá as leituras mapeadas alinhadas ao genoma.
- Usando ambos os arquivos de saída da etapa 12.2, execute o perfil de expressão miRNA usando o quantificador integrado ao software.
- Baixe as sequências precursoras do miRNA de interesse e as sequências miRNA maduras do miRBase 51,52,53,54,55,56. Se não houver sequências precursoras ou maduras para as espécies de interesse, baixe o "hairpin.fa.gz" e "mature.fa.gz" que contêm todos os precursores e sequências maduras para todos os organismos disponíveis no miRBase.
- Descomprima os arquivos "hairpin.fa.gz" e "mature.fa.gz".
- Insira os arquivos "reads.fa" e "read_vs_genome.arf" da seção 12.3.4 e dos arquivos não compactados de 12.4.2.
- Leia os arquivos de saída como "nome de saída.csv", "nome de saída.html" e "nome de saída.pdf". O nome do arquivo de saída pode ser definido de acordo com o investigador.
NOTA: O arquivo "outputname.csv" conterá os perfis de expressão. Especificamente, o perfil de expressão terá o ID miRNA, a soma de leituras para todas as amostras mapeadas para o miRNA, o número de leituras mapeadas para um miRNA específico para cada amostra e o ID precursor correspondente às miRNAs maduras. O "nome de saída.html" da etapa 12.4.4 conterá os links para o Navegador de Genoma da Universidade de Santa Cruz (USCS), Centro Nacional de Informações de Biotecnologia (NCBI) e miRBase. O USCS e o NCBI conterão as sequências de consulta dos precursores atuais contra o banco de dados de nucleotídeos não redundantes, e o miRBase terá as informações do precursor atual do miRNA. O "nome de saída.pdf" terá a estrutura secundária RNA dos miRNAs que são expressas e o alinhamento da sequência precursora.
- Para identificar miRNAs únicos e conservados, use miRDeep2.
- Use os arquivos de saída da etapa 12.3.4 e da etapa 12.4.2 como os arquivos de entrada.
NOTA: Os arquivos de saída que são lidos como "outputname.html" conterão as previsões dos miRNAs únicos e conservados na amostra. - Use escores >1 para perfil de miRNA e escores >4 para análises experimentais adicionais, como a inibição do miRNA e a imitação de miRNAs endógenas 34,36,57.
- Selecione e identifique os miRNAs exclusivos da base mi Com base no seguinte: escore miRDeep2 (etapa 12,5,3), estimativa de probabilidade real (>90%), valor p de randfold significativo (<0,05)49,50,56.
NOTA: A análise bioinformática foi feita via miRDeep2 no Cyverse Discovery Environment58,59, uma plataforma online gratuita para análise de bioinformática. Os miRNAs conservados e únicos identificados através do miRDeep2 foram comparados com todas as espécies da miRbase. A identificação futura do miRDeep2 pode ser comparada com o genoma correspondente da espécie de interesse.
- Use os arquivos de saída da etapa 12.3.4 e da etapa 12.4.2 como os arquivos de entrada.
Resultados
O presente protocolo fornece uma metodologia detalhada para extrair miRNAs de glândulas salivares e EVs. De acordo com os resultados, este protocolo é eficaz para o isolamento do miRNA de adultos de duas espécies diferentes de carrapatos, I. scapularis e R. microplus, e pode potencialmente ser usado em outras espécies de carrapatos também. A concentração de EVs (partículas/mL) foi medida via NTA. Para R. microplus, cada fase de gênero e vida continha três réplicas biológicas medidas em três réplicas técnicas. As amostras foram separadas por gênero e fase de vida (Figura 8) para mostrar a variação dentro de cada amostra. Em seguida, as amostras foram combinadas para apresentar as diferenças de variação e estatística utilizando um ANOVA bidirecional e os múltiplos testes de comparação de Tukey20 (p-valor = < 0,05) (Figura 9). Cada amostra consistia de ~40 glândulas salivares dissecadas de 20 fêmeas, machos e ninfas. Após o isolamento e quantificação dos EVs, as amostras foram utilizadas para a pequena purificação do RNA.
A concentração do pequeno RNA dentro de cada amostra foi medida via Qubit (Tabela 1), e a qualidade foi medida através de um bioanalílise utilizando eletroforese de gel padrão46,47. As concentrações estão em nanogramas (Tabela 1) em um volume de 14 μL para ambas as espécies de carrapatos. O total médio de pequenas concentrações de RNA de órgãos I. scapularis variou de 45,92-6.356 ng. A concentração de RNA de vesículas de I. scapularis variou de 72,24-2.128 ng. Para R. microplus, a concentração do órgão variou de 259-2.142 ng, e as vesículas variaram de 59,22-1.848 ng. As amostras foram normalizadas para a mesma concentração, e sua qualidade foi então medida através de um bioanalítômetro (Figura 10). Uma escada de referência foi utilizada no gel como marcador para avaliação de qualidade. A integridade, intensidade e picos da banda foram representantes de degradação potencial ou concentração total em cada amostra. Bandas correspondentes a RNAs ribossômicas de 5 s e 5,8 s só estavam presentes nas amostras de órgãos da glândula salivar (Figura 10, faixas A-D) e ausentes na vesícula das amostras de glândula salivar (Figura 10, faixas E,F), demonstrando as diferenças nos pequenos perfis de RNA entre órgãos e vesículas extracelulares. A degradação da amostra foi inferida pela ausência de bandas no gel; isso significava que havia degradação amostral significativa. Recomenda-se que quaisquer amostras com degradação significativa sejam descartadas.
Para demonstrar a presença de amostras de miRNA dentro das preparações, pequenas bibliotecas de RNA cDNA foram preparadas a partir de amostras de RNA que foram armazenadas por 3-4 meses após o pequeno isolamento do RNA. Curiosamente, maior degradação amostral foi encontrada nessas amostras. As pistas A-D e G apresentaram sinais de degradação; pelo contrário, E, F e H-K apresentaram degradação mínima e concentração suficiente para a preparação da biblioteca do MIRNA cDNA (Figura Suplementar 1). Apenas uma amostra foi degradada quando as amostras foram usadas imediatamente após a purificação (Figura 10), sugerindo que as amostras de miRNA eram mais propensas à degradação uma vez que eram purificadas dos EVs. Assim, foram selecionadas as amostras E, F, H e I para análise de enriquecimento. Os asteriscos mostram os tamanhos da banda de ~150 bp, que eram os tamanhos esperados após a preparação da biblioteca cDNA (Figura 7). As faixas fracas inferiores indicam o primer dimer.
Durante o isolamento do EV, a velocidade e o tempo de centrifugação podem afetar a concentração final de EV. Ao encanar a pelota EV nas colunas de 300 k, como mencionado anteriormente na etapa 6.10, um baixo volume e velocidade são essenciais para evitar que os EVs passem pela membrana. Estudos anteriores mostraram que 700 μL a 12.000 x g por 20 min usando um concentrador centrífuga diferente foi suficiente para separar adequadamente os EVs das proteínas solúveis20; no entanto, baixas concentrações de EV foram exibidas na NTA usando um filtro diferente. Assim, otimizar os filtros e outros materiais disponíveis é essencial. Ao usar pela primeira vez as colunas de 300 mil, foram testados diferentes intervalos de velocidade para determinar qual deu a maior concentração de EV. O número de vesículas perdidas durante a centrifugação foi medido pela análise da NTA; concluiu-se que velocidades mais baixas resultaram em maior concentração de vesículas no fluxo (não mostrado). Concluiu-se que 500 μL a 6.000-8.000 x g foi satisfatório para isolar os EVs. Uma vez determinado isso, este protocolo foi usado para isolar vesículas de I. scapularis e R. microplus. A concentração das vesículas isoladas de cada espécie de carrapato foi medida via NTA (Figura 8). As concentrações de EV variaram entre 7,07 x 107 a 7,94 x 109 partículas/mL. A quantidade de EV correlaciona-se com as concentrações de miRNA, onde a maior quantidade de EV resultou em uma maior concentração de miRNA extraído.
Figura 1: 1 mL de seringas sem agulha carregadas com scapularis adultos fêmeas e cobertas com gaze esterilizada. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: O lado dorsal de uma fêmea engorgada foi removido com uma tesoura de vannas de 4 mm. A fêmea foi submersa em 1x PBS para evitar a dessacação de órgãos. As setas amarelas apontam para as glândulas salivares expostas. O valor foi levado em ampliação de 50x com uma lente objetiva de alta resolução. Clique aqui para ver uma versão maior desta figura.

Figura 3: Uma placa de cultura celular após uma incubação de 24 h a 32 °C. A primeira linha de poços contém a mídia sem vesículas e glândulas salivares dissecadas. O resto dos poços contêm 1x PBS com Rifampicina. Clique aqui para ver uma versão maior desta figura.

Figura 4: Um processo de preparação de amostras para um ciclo de ultracentrifuagem. (A) Uma seringa sem agulha de 10 mL coberta com um filtro de seringa de 1 μm. (B) O supernatante após três rodadas de centrifugação é espeto na seringa. (C) O resto da seringa é preenchida a 10 mL com PBS esterilizado de 1x. (D) A seringa está coberta, e o supernatante com 1x PBS é filtrado no tubo ultracentrífuga. Clique aqui para ver uma versão maior desta figura.
Figura 5: Após 18 h de ultracentrifugação, uma pelota de vesículas extracelulares se forma na parte inferior do tubo ultracentrífuga. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 6: Um pilão esterilizado é usado para homogeneizar órgãos da glândula salivar e as vesículas extracelulares. Por favor clique aqui para ver uma versão maior desta figura.
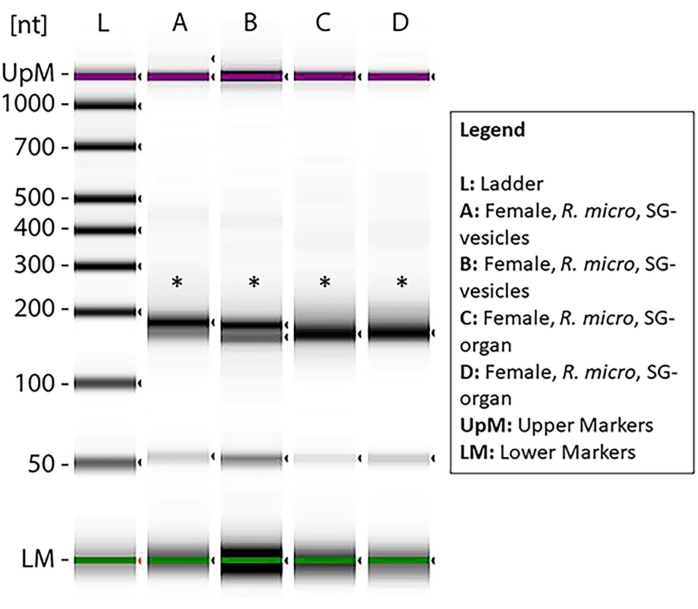
Figura 7: Uma eletroforese de gel medida através de estação de fita exibindo as bibliotecas pré-preparadas miRNA após uma análise de enriquecimento. As amostras de órgãos de glândula salivar R. microplus femininos e EVs foram baseadas em degradação mínima e concentração de miRNA suficiente para síntese da biblioteca cDNA. A escada (L) mostra os pontos de referência em nucleotídeos e nos marcadores superior e inferior. Os asteriscos indicam as faixas de tamanho do produto ~150 bp, que significam as pequenas bibliotecas RNA cDNA. As bandas inferiores mostram o primer dimer. Clique aqui para ver uma versão maior desta figura.
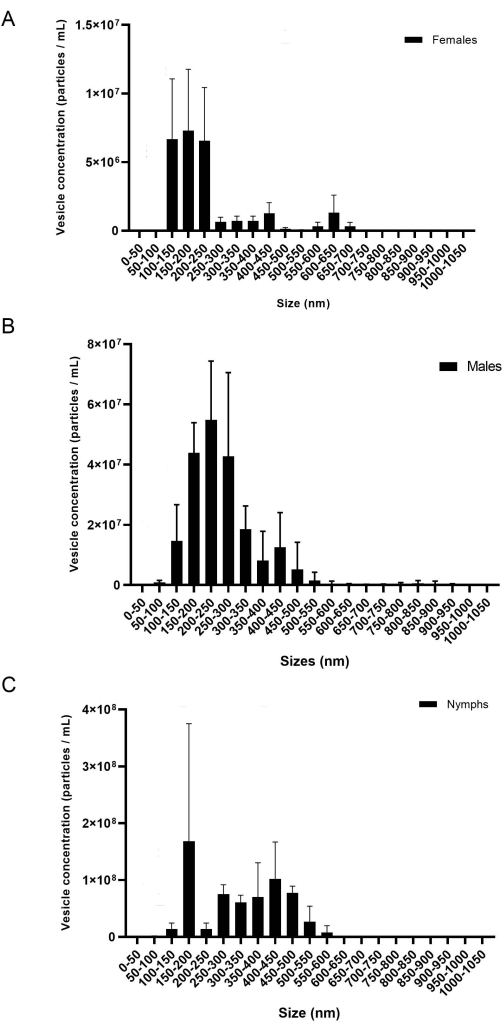
Figura 8: Figura representativa da variação entre as fêmeas de réplicas biológicas (A), (B) machos e (C) ninfas. O eixo x mostra o tamanho de EV (nm), e o eixo y mostra a concentração de EV (partículas/mL). Um teste de comparação bidirecional da ANOVA e da Tukey apresentou diferenças estatísticas (valor P = < 0,05). As barras de erro representam o erro padrão para explicar a variação. Cada amostra continha 20 carrapatos com três réplicas biológicas. As amostras foram registradas para 60 s, três vezes cada. A câmera foi definida no nível 7, e o limiar de detecção foi definido no nível 5. Clique aqui para ver uma versão maior desta figura.

Figura 9: Figura representativa da variação para todas as réplicas biológicas combinadas para ninfas (vermelhas), fêmeas (azuis) e machos (preto). O eixo x mostra o tamanho de EV (nm), e o eixo y exibe a concentração de EV (partículas/mL). Um teste de comparação bidirecional da ANOVA e da Tukey apresentou diferenças estatísticas (valor P = < 0,05). As barras de erro representam o erro padrão para explicar a variação. Cada amostra continha 20 carrapatos com três réplicas biológicas. Os asteriscos simbolizam uma diferença significativa de p < 0,05. Cada gravação foi feita por 60, três vezes cada. A câmera foi definida no nível 7, e o limiar de detecção foi definido no nível 5. Clique aqui para ver uma versão maior desta figura.
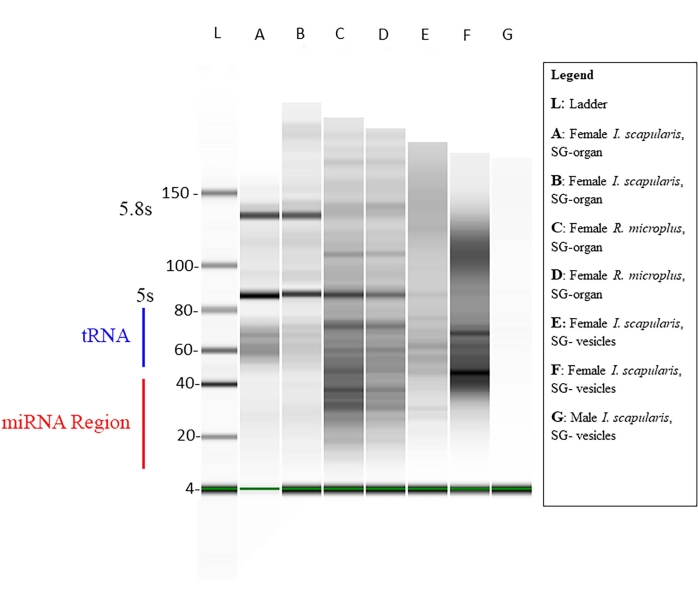
Figura 10: Um gel representativo através do bioanalílise. A eletroforese gel foi realizada utilizando uma escada base como referência. Uma sequência de miRNA madura é ~18-22 nt de comprimento, onde bandas fracas são mostradas na faixa de tamanho designada. Outros pequenos RNAs, como pequenas RNAs nucleares, RNAs de transfer-messenger e RNAs regulatórios, também estão presentes nas amostras. Os tamanhos dos pequenos RNAs variaram de ~20-150 nt. As amostras variam de espécies de carrapatos, tecidos e sexo. Para a faixa G, um exemplo de degradação amostral não mostra bandas. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Uma eletroforese de gel foi medida através do bioanalílise, exibindo a qualidade extraída dos miRNAs extraídos de órgãos e EVs da glândula salivar feminina R. microplus. A escada (L) mostra os tamanhos de referência em nucleotídeos, onde miRNAs maduras medem ~18-22 nt de comprimento. As pistas A-D e G mostram degradação, e as pistas E, F e H-K apresentam degradação mínima. Clique aqui para baixar este Arquivo.
| Espécie | Gênero | Órgão/Vesícula | Concentração de EV | concentração de miRNA (ng) |
| R. microplus | Fêmea | Órgão | N/A | 259 |
| R. microplus | Fêmea | Órgão | N/A | 2,142 |
| R. microplus | Fêmea | Vesícula | 1.64 E+08 | 59.22 |
| R. microplus | Fêmea | Vesícula | 1.64 E+09 | 1,848 |
| I. scapularis | Fêmea | Órgão | N/A | 45.92 |
| I. scapularis | Fêmea | Órgão | N/A | 6,356 |
| I. scapularis | Fêmea | Vesícula | 1.73E+08 | 65.66 |
| I. scapularis | Fêmea | Vesícula | 3.14 E+09 | 2,128 |
Tabela 1: Um exemplo das concentrações de miRNA tanto para glândulas salivares quanto para vesículas extracelulares. A coluna de concentrações de miRNA representa as concentrações mais baixas e mais altas para cada espécie de carrapato.
| microRNA | I. scapularis | I. ricinus | R. microplus | H. longicornis | Referências |
| miR-8 | Um | P | P | P | 33, 36, 37, 43 |
| miR-71 | P | P | P | Um | 33, 36, 37, 43 |
| miR-279 | P | Um | Um | P | 33, 36, 37, 43 |
| let-7 | Um | P | P | P | 33, 36, 37, 43 |
Tabela 2: Os miRNAs conservados em diferentes espécies de carrapatos. (P) indica que o miRNA foi comumente expresso, ou presente, e (A) significa que os miRNAs não foram comumente expressos ou detectados.
| Tipo de amostra | Número de pontuações >1* | Número de pontuações >4γ | Número de Conservados | Número de Romance |
| Macho | 17 | 0 | 48,885 | 23 |
| Fêmea | 25 | 0 | 48,885 | 21 |
| Ninfas | 38 | 0 | 48,885 | 38 |
Mesa 3. Os miRNAs conservados e únicos foram detectados nos EVs para fêmeas R. microplus , machos e ninfas. *pontuação miRNA usada para criação de perfil. γescore de miRNA usado para experimentos funcionais.
Tabela suplementar 1: Uma tabela que mostra os resultados de sequenciamento de última geraçãopara EVs masculinos R. microplus secretados de glândulas salivares. Clique aqui para baixar esta Tabela.
Tabela suplementar 2: Uma tabela mostrando os resultados de sequenciamento da próxima geraçãopara EVs femininos R. microplus secretados de glândulas salivares. Clique aqui para baixar esta Tabela.
Tabela suplementar 3: Uma tabela que mostra os resultados de sequenciamento de próxima geraçãopara EVs de ninfa R. microplus secretados de glândulas salivares. Clique aqui para baixar esta Tabela.
Discussão
O protocolo atual fornece uma metodologia detalhada para extrair miRNA de glândulas salivares e EVs. No entanto, há considerações importantes, todas detalhadas nas notas de cada seção deste protocolo. A cápsula e a rede de malha devem ser fixadas durante a alimentação do carrapato para evitar que os carrapatos escapem. A preparação e colocação da cápsula estão descritas em Koga et al.40. Várias réplicas das dissecções de carrapato precisam ser feitas se uma amostra inadequada for descartada. Além disso, vários desafios podem estar presentes ao utilizar técnicas de isolamento de EV a partir do tecido de carrapato 18,20,43. Por exemplo, os tecidos devem ser mantidos úmidos durante a dissecção para evitar a desiccação. Isso é feito adicionando PBS durante toda a dissecção. Tanto o PBS quanto os meios utilizados para a dissecção e cultura dos órgãos devem ser mantidos com antibióticos para evitar a contaminação bacteriana do microbioma do carrapato. Estes devem incluir antibióticos que visam bactérias Gram-negativas e Gram-positivas, pois ambas podem ser encontradas dentro dos tecidosde carrapato 60. Da mesma forma, deve-se tomar cuidado durante a dissecção para diminuir a contaminação com tecidos de outros órgãos. Assim, as dissecções precisam ser feitas lentamente, e à medida que o usuário ganha experiência, mais carrapatos podem ser dissecados. Por fim, como os EVs são secretados de todas as células, incluindo células infectadas por patógenos, os estudos de carrapato que conduzem o isolamento do EV precisam usar mídia e buffers livres de EV para evitar a contaminação entre EV25,61.
No entanto, este protocolo permite a redução do número de carrapatos necessários para produzir EVs salivares de carrapato. Protocolos anteriores exigiam a salivação de um número significativamente maior de carrapatos. Por exemplo, miRNAs secretadas dentro de EVs salivares em Haemaphysalis longicornis precisavam da salivação de 2.000 carrapatos adultos43. Isso pode ser extremamente caro para laboratórios sem capacidade de retrocessão. Da mesma forma, os tecidos maculatum Amblyomma utilizados para o isolamento EV foram parcialmente congelados antes do isolamento e tratados com 75 U/mL de colagenase tipo 3, o que poderia afetar a autenticidade da secreção EV19. Além disso, esses estudos exigiram 80-100 pares de glândulas salivares18.
Comparativamente, este protocolo pode ser aplicado a várias espécies de carrapatos, e requer um baixo número de carrapatos para isolar EVs e extrair miRNAs de qualidade conservada e novas (Tabela 2)33,36,37,43. As concentrações de miRNA variaram muito, mas foram suficientes para o sequenciamento de próxima geração (Tabela 3 e Tabelas Suplementares 1-3). Este protocolo pode ser ajustado para acomodar um tamanho amostral maior se forem necessárias concentrações de miRNA maiores. Além disso, os materiais utilizados neste protocolo são substituíveis dependendo da disponibilidade do material. No entanto, os volumes amostrais e a velocidade de centrifugação devem ser ajustados seguindo as instruções do fabricante para os kits e colunas utilizados.
Uma desvantagem deste método é que miRNAs e EVs podem facilmente se degradar ao longo das etapas de extração e isolamento. Portanto, o protocolo deve ser realizado de forma rápida e eficiente. Quando declarado, as amostras devem ser mantidas no gelo, e a extração de miRNA deve ser conduzida em um ambiente esterilizado. Além disso, um tratamento RNase pode ser feito nos EVs isolados para eliminar grandes RNAs ligados à membrana EV. Isso pode impedir que grandes RNAs contaminem a amostra durante as extrações de miRNA. Por fim, adicionar um inibidor rnAse à amostra de miRNA após o isolamento de EVs ou órgãos é uma medida preventiva importante para a degradação. Este protocolo pode ser alterado e aplicado paralelamente aos objetivos do experimento que está sendo conduzido.
Aplicações futuras para este protocolo podem incluir o estudo de interações patógenos-vetores para entender como os patógenos afetam o miRNA e outras cargas genômicas dentro de EVs salivares de carrapato. Da mesma forma, este protocolo pode definir proteínas específicas e processos celulares envolvidos na embalagem de miRNAs em EVs de carrapato, e o efeito específico que esses EVs e miRNAs têm na cicatrização de feridas e respostas imunes. Devido à crescente resistência do carrapato aos acaricídeos, há uma necessidade desesperada de métodos de controle únicos. Os EVs têm potencial para um método alternativo de controle em comparação com os acaricídeos. Os EVs podem ser usados como nano-transportadores em aplicações terapêuticas 18,23,61. Em humanos, os EVs que transportam miRNAs têm sido usados para suprimir o crescimento do tumor durante a imunoterapia contra o câncer62,63. Da mesma forma, em carrapatos, os EVs podem transportar miRNAs geneticamente modificadas que têm sido mostrados para afetar funções biológicas de carrapatos vitais e transmissão de patógenos 36,57,64. A orientação futura é usar este protocolo para determinar os perfis miRNA de múltiplas espécies de carrapatos para identificar miRNAs de interesse para estudos funcionais.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Agradecemos muito a ajuda do Laboratório de Carrapatos da Febre do Gado em Edinburg, Texas. Gostaríamos de agradecer a Michael Moses, Jason Tidwell, James Hellums, Cesario Agado e Homer Vasquez. Também gostaríamos de reconhecer a ajuda de Sarah Sharpton, Elizabeth Lohstroh, Amy Filip, Kelsey Johnson, Kelli Kochcan, Andrew Hillhouse, Charluz Arocho Rosario e Stephanie Guzman Valencia durante todo o projeto. Gostaríamos de agradecer ao Texas A&M Aggie Women in Entomology (AWE) Writing Group por sua ajuda e conselhos durante a escrita deste manuscrito. Os seguintes reagentes foram fornecidos pelos Centros de Controle e Prevenção de Doenças para distribuição pela BEI Resources, NIAID, NIH: Ixodes scapularis Adult (Live), NR-42510. Carrapatos femininos I. scapularis também foram recebidos do Tick Rearing Facility na Oklahoma State University. Este projeto foi financiado pela Texas A&M University T3: tríades para subvenção de transformação e o acordo de cooperação #58-3094-1-003 pelo USDA-ARS para a AOC.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | GenClone | 25-240 | |
| 1 µm nylon syringe filter | Tisch Scientific | 283129028 | |
| 1 inch black adhesive | Amazon | B00FQ937NM | Capsule |
| 10 mL needeless syringe | Exelint | 26265 | |
| 3' and 5' Adapters | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| 4 mm vannas scissors | Fine Science Tools | 15000-08 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid | Sigma-Aldrich | 1.1523 | |
| 70Ti rotor | Beckman Coulter | 337922 | |
| Amphotericin | Corning | 30-003-CF | |
| Beads | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Bioanalyzer | Agilent | G2939BA | |
| Bioanalyzer kit | Agilent | 5067-1513 | |
| Centrifuge 5425 | Eppendorf | ||
| Chloroform | Macron | UN1888 | |
| Cyverse Discovery Enviornment | https://cyverse.org/discovery-environment | ||
| Dissecting microscope | Nikon | SMZ745 | |
| Double-sideded carpet tape | amazon | 286373 | |
| Falcon Tubes, 50 mL | VWR | 21008-940 | |
| Fetal Bovine Serum | Gibco | FBS-02-0050 | |
| fine forceps | Excelta | 5-S-SE | |
| Foamies, 2 mm | Amazon | B004M5QGBQ | Capsule |
| Isoflurane | Phoenix Pharmaceuticals manfactured | 193.33165.3 | |
| Ixodes scaplaris | CDC, Oklahoma State University | ||
| L15C300 medium | In-lab | ||
| lipoprotein-cholesterol concentrate | MPI | 02191476-CF | |
| Microscope slide | VWR | 10118-596 | |
| miRDeep2 | https://github.com/rajewsky-lab/mirdeep2 | ||
| M-MuLV Reverse Transcriptase | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| molecular grade ethanol | Fischer Bioreagents | UN1170 | |
| multi-well 24 well tissue culture treated plate | Corning | 353047 | |
| Nanopaticle Tracking Analyzer machine | Malvern Panalytical | ||
| Nanosep with 300K Omega filter | Pall Corporation | OD3003C33 | |
| NEXTFLEX Small RNA-Seq Kit v3 | PerkinElmer | ||
| NextSeq 500/550 High Output Kit (75 cycles) | Illumina | 20024906 | |
| Optima XPN 90 Ultracentrifuge | Beckman Coulter | ||
| Penicillin | Thermofischer Scientific | ICN19453780 | |
| Pippettes | Ependorff | ||
| polycarbonate centrifuge bottle | Beckman Coulter | 355618 | |
| Qiagen miRNeasy kit | Qiagen | 217084 | |
| QIAzol lysis reagent | Qiagen | 79306 | |
| Qubit | Thermofisher | Q32880 | |
| Qubit kit | Thermofisher | Q10212 | |
| Rabbits | Charles River | ||
| Reverse Universal Primer | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Rhipicephalus microplus | Cattle Fever Tick Research Labratoty | ||
| Rifampicin | Fischer Bioreagents | 215544 | |
| RNAlater | Invitrogen | 833280 | |
| RNAse free tubes | VWR | 87003294 | |
| RNAse inhibitor | Thermo Fischer | 11111729 | |
| RNAse/DNAse free water | Qiagen | 217084 | |
| RNeasy Minelute spin column | Qiagen | 217084 | Qiagen miRNeasy kit |
| RPE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| RT Buffer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RT Forward Primer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RTE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| Sodium bicarbonate | Sigma-Aldrich | S6014-25G | |
| Sorvall ST16 | Thermo Fischer | 75004380 | |
| Sterilized Gauze sponges | Covidien | 2187 | |
| Sterilized PBS | Sigma | RNBK0694 | |
| streptomycin | thermofischer Scientific | 15240062 | |
| TapeStation | Aligent | G2991BA | |
| Tear Mender Instant Fabric and Leather Adhesive | Amazon | 7.42836E+11 | Capsule |
| Tissue Adhesive | 3M VetBond | ||
| Triple Antibiotics | dechra | 17033-122-75 | |
| Tryptose phosphate broth | BD | BD 260300 |
Referências
- Jongejan, F., Uilenberg, G. The global importance of ticks. Parasitology. 129, 3-14 (2004).
- Anderson, J. F., Magnarelli, L. A. Biology of ticks. Infectious Disease Clinics of North America. 22 (2), 195-215 (2008).
- de la Fuente, J. Controlling ticks and tick-borne diseases… looking forward. Ticks and Tick-Borne Diseases. 9 (5), 1354-1357 (2018).
- Nicholson, W. L., Sonenshine, D. E., Noden, B. H., Brown, R. N. Ticks (Ixodia). Medical and Veterinary Entomology. , 603-672 (2019).
- Guerrero, F. D., Lovis, L., Martins, J. R. Acaricide resistance mechanisms in Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitologia Veterinária. 21 (1), 1-6 (2012).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: the state of play. Veterinary Parasitology. 203 (1-2), 6-20 (2014).
- Redshaw, N., et al. A comparison of miRNA isolation and RT-qPCR technologies and their effects on quantification accuracy and repeatability. Biotechniques. 54 (3), 155-164 (2013).
- Estrada-Peña, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Experimental and Applied Acarology. 23 (9), 685-715 (1999).
- Eisen, R. J., Eisen, L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology. 34 (4), 295-309 (2018).
- Bowman, A. S., Sauer, J. R. Tick salivary glands: function, physiology and future. Parasitology. 129, 67 (2004).
- Kim, D., Maldonado-Ruiz, P., Zurek, L., Park, Y. Water absorption through salivary gland type I acini in the blacklegged tick, Ixodes scapularis. PeerJ. 5, 3984 (2017).
- Nunes, P. H., Bechara, G. H., Camargo-Mathias, M. I. Morphological changes in the salivary glands of Amblyomma cajennense females (Acari: Ixodidae) in different feeding stages on rabbits at first infestation. Experimental and Applied Acarology. 45 (3), 199-209 (2008).
- Bishop, R., et al. A cement protein of the tick Rhipicephalusappendiculatus, located in the secretory e cell granules of the type III salivary gland acini, induces strong antibody responses in cattle. International Journal for Parasitology. 32 (7), 833-842 (2002).
- Yamaji, K., et al. A salivary cystatin, HlSC-1, from the ixodid tick Haemaphysalis longicornis play roles in the blood-feeding processes. Parasitology Research. 106 (1), 61-68 (2009).
- Simo, L., Kazimirova, M., Richardson, J., Bonnet, S. I. The essential role of tick salivary glands and saliva in tick feeding and pathogen transmission. Frontiers in Cellular and Infection Microbiology. 7, 281 (2017).
- Perner, J., Kropáčková, S., Kopáček, P., Ribeiro, J. M. C. Sialome diversity of ticks revealed by RNAseq of single tick salivary glands. PLoS Neglected Tropical Diseases. 12 (4), 0006410 (2018).
- Madden, R. D., Sauer, J. R., Dillwith, J. W. A proteomics approach to characterizing tick salivary secretions. Experimental and Applied Acarology. 32 (1), 131-141 (2004).
- Zhou, W., et al. Discovery of exosomes from tick saliva and salivary glands reveals therapeutic roles for CXCL12 and IL-8 in wound healing at the tick-human skin interface. Frontiers in Cell and Developmental Biology. 8, 554 (2020).
- Zhou, W., et al. Exosomes serve as novel modes of tick-borne flavivirus transmission from arthropod to human cells and facilitates dissemination of viral RNA and proteins to the vertebrate neuronal cells. PLoS Pathogens. 14 (1), 1006764 (2018).
- Chávez, A. S. O., et al. Tick extracellular vesicles enable arthropod feeding and promote distinct outcomes of bacterial infection. Nature Communications. 12 (1), 1-17 (2021).
- Pegtel, D. M., Gould, S. J. Exosomes. Annual Review of Biochemistry. 88, 487-514 (2019).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Théry, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nature Cell Biology. 21 (1), 9-17 (2019).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. A. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213 (2018).
- Gioseffi, A., Edelmann, M. J., Kima, P. E. Intravacuolar pathogens hijack host extracellular vesicle biogenesis to secrete virulence factors. Frontiers in Immunology. 12, 662944 (2021).
- Chávez, A. S. O., O'Neal, A. J., Santambrogio, L., Kotsyfakis, M., Pedra, J. H. F. Message in a vesicle-trans-kingdom intercommunication at the vector-host interface. Journal of Cell Science. 132 (6), 224212 (2019).
- Janas, T., Janas, M. M., Sapoń, K., Janas, T. Mechanisms of RNA loading into exosomes. FEBS Letters. 589 (13), 1391-1398 (2015).
- Lu, T. X., Rothenberg, M. E. MicroRNA. Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- Pegtel, D. M., et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences. 107 (14), 6328-6333 (2010).
- Bartel, D. P. MicroRNAs: target recognition and regulatory functions. Cell. 136 (2), 215-233 (2009).
- Ambros, V. MicroRNAs and developmental timing. Current Opinion in Genetics and Development. 21 (4), 511-517 (2011).
- Bushati, N., Cohen, S. M. microRNA functions. Annual Review of Cell and Developmental Biology. 23, 175-205 (2007).
- Hackenberg, M., Langenberger, D., Schwarz, A., Erhart, J., Kotsyfakis, M. In silico target network analysis of de novo-discovered, tick saliva-specific microRNAs reveals important combinatorial effects in their interference with vertebrate host physiology. RNA. 23 (8), 1259-1269 (2017).
- Luo, J., et al. MicroRNA-1 promotes the development of and prolongs engorgement time in Hyalomma anatolicum anatolicum (Acari: Ixodidae) ticks. Biorxiv. , (2020).
- Zhou, J., Zhou, Y., Cao, J., Zhang, H., Yu, Y. Distinctive microRNA profiles in the salivary glands of Haemaphysalis longicornis related to tick blood-feeding. Experimental and Applied Acarology. 59 (3), 339-349 (2013).
- Hermance, M. E., Widen, S. G., Wood, T. G., Thangamani, S. Ixodes scapularis salivary gland microRNAs are differentially expressed during Powassan virus transmission. Scientific Reports. 9 (1), 1-17 (2019).
- Barrero, R. A., et al. Evolutionary conserved microRNAs are ubiquitously expressed compared to tick-specific miRNAs in the cattle tick Rhipicephalus (Boophilus) microplus. BMC Genomics. 12 (1), 1-17 (2011).
- Colombo, M., et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. Journal of Cell Science. 126 (24), 5553-5565 (2013).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. . Proteomic Profiling. , 179-209 (2015).
- Koga, K., et al. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Research. 25, 3703-3707 (2005).
- Wright, K., de Silva, K., Purdie, A. C., Plain, K. M. Comparison of methods for miRNA isolation and quantification from ovine plasma. Scientific Reports. 10 (1), 1-11 (2020).
- Mráz, M., Malinova, K., Mayer, J., Pospisilova, S. MicroRNA isolation and stability in stored RNA samples. Biochemical and Biophysical Research Communications. 390 (1), 1-4 (2009).
- Nawaz, M., et al. miRNA profile of extracellular vesicles isolated from saliva of Haemaphysalis longicornis tick. Acta Tropica. 212, 105718 (2020).
- Ribeiro, J. M. C., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva. Medical and Veterinary Entomology. 18 (1), 20-24 (2004).
- Almazán, C., et al. A versatile model of hard tick infestation on laboratory rabbits. Journal of Visualized Experiments. (140), e57994 (2018).
- Masotti, A., Preckel, T. Analysis of small RNAs with the Agilent 2100 Bioanalyzer. Nature Methods. 3 (8), 658 (2006).
- Benesova, S., Kubista, M., Valihrach, L. Small RNA-sequencing: approaches and considerations for miRNA analysis. Diagnostics. 11 (6), 964 (2021).
- Mackowiak, S. D. Identification of novel and known miRNAs in deep-sequencing data with miRDeep2. Current Protocols in Bioinformatics. 36 (1), 12 (2011).
- Friedländer, M. R., Mackowiak, S. D., Li, N., Chen, W., Rajewsky, N. miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades. Nucleic Acids Research. 40 (1), 37-52 (2012).
- Griffiths-Jones, S. The microRNA registry. Nucleic Acids Research. 32, 109-111 (2004).
- Griffiths-Jones, S., Grocock, R. J., Van Dongen, S., Bateman, A., Enright, A. J. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research. 34, 140-144 (2006).
- Griffiths-Jones, S., Saini, H. K., Van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucleic Acids Research. 36, 154-158 (2007).
- Kozomara, A., Birgaoanu, M., Griffiths-Jones, S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 47, 155-162 (2019).
- Kozomara, A., Griffiths-Jones, S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Research. 39, 152-157 (2011).
- Kozomara, A., Griffiths-Jones, S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Research. 42, 68-73 (2014).
- Wu, F., et al. MicroRNA let-7 regulates the expression of ecdysteroid receptor (ECR) in Hyalomma asiaticum (Acari: Ixodidae) ticks. Parasites and Vectors. 12 (1), 1-13 (2019).
- Goff, S. A., et al. The iPlant collaborative: cyberinfrastructure for plant biology. Frontiers in Plant Science. 2, 34 (2011).
- Merchant, N., et al. The iPlant collaborative: cyberinfrastructure for enabling data to discovery for the life sciences. PLoS Biology. 14 (1), 1002342 (2016).
- Kumar, D., et al. An exploratory study on the microbiome of northern and southern populations of Ixodes scapularis ticks predicts changes and unique bacterial interactions. Pathogens. 11 (2), 130 (2022).
- Zhang, Y., et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. International Journal of Nanomedicine. 15, 6917 (2020).
- Di Leva, G., Croce, C. M. miRNA profiling of cancer. Current Opinion in Genetics and Development. 23 (1), 3-11 (2013).
- Ganju, A., et al. miRNA nanotherapeutics for cancer. Drug Discovery Today. 22 (2), 424-432 (2017).
- Luo, J., et al. MicroRNA-1 Expression and Function in Hyalomma Anatolicum anatolicum (Acari: Ixodidae) Ticks. Frontiers in Physiology. 12, 596289 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados