Method Article
בידוד של מיקרו-רנ"א מתרביות בלוטת הרוק של Tick Ex Vivo ושלפוחיות חוץ-תאיות
In This Article
Summary
הפרוטוקול הנוכחי מתאר את הבידוד של מיקרו-רנ"א מבלוטות הרוק של קרציות ושלפוחיות חוץ-תאיות מטוהרות. זהו הליך אוניברסלי המשלב ריאגנטים ואספקה נפוצים. השיטה גם מאפשרת שימוש במספר קטן של קרציות, וכתוצאה מכך מיקרו-רנ"א איכותיים שניתן לרצף בקלות.
Abstract
קרציות הן ectoparasitesites חשוב שיכולים וקטור פתוגנים מרובים. בלוטות הרוק של הקרציות חיוניות להאכלה מכיוון שהרוק שלהן מכיל אפקטים רבים בעלי תכונות פרמצבטיות שיכולות להפחית את התגובה החיסונית של המארח ולהגביר את העברת הפתוגנים. קבוצה אחת של משפיעים כאלה הם מיקרו-רנ"א (miRNAs). miRNAs הם רצפים קצרים שאינם מקודדים המווסתים את ביטוי הגנים המארחים בממשק הקרצייה-מארח ובתוך איברי הקרצייה. רנ"א קטנים אלה מועברים ברוק הקרציות באמצעות שלפוחיות חוץ-תאיות (EVs), המשרתות תקשורת בין-תאית ותוך-תאית. שלפוחיות המכילות miRNA זוהו ברוק של קרציות. עם זאת, מעט ידוע על התפקידים והפרופילים של miRNAs בשלפוחיות ובלוטות רוק קרציות. יתר על כן, המחקר של שלפוחיות ו miRNAs ברוק קרציות דורש הליכים מייגעים כדי לאסוף רוק קרציות. פרוטוקול זה נועד לפתח ולאמת שיטה לבידוד miRNAs מבועיות חוץ-תאיות מטוהרות המיוצרות על ידי תרביות איברים ex vivo . החומרים והמתודולוגיה הדרושים לחילוץ miRNA מבועיות חוץ-תאיות ומבלוטות רוק קרציות מתוארים כאן.
Introduction
קרציות הן ectoparasitesites אשר וקטור פתוגנים רבים לחיות בר, בעלי חיים, בני אדם, וחיות המחמד שלהם 1,2. האכלת קרציות גורמת לאובדן כלכלי משמעותי על ידי גרימת נזק להסתרה, הפחתת המשקל וייצור החלב עקב אנמיה קשה, והעברת פתוגנים שעלולים לגרום למחלות קטלניות 1,3,4,5. נוהלי הבקרה הנוכחיים לניהול אוכלוסיות קרציות מתמקדים בשימוש בקוטלי אקריות. אף על פי כן, הופעתה המתמשכת של עמידות בפני קוטלים בקרציות הטפילות בעלי חיים 5,6, השכיחות המוגברת של עקיצות קרציות7 והעברת פתוגנים באזורי מגורים 8,9, הובילו לצורך בחלופות ייחודיות לבקרת קרציות.
בלוטות הרוק של הקרצייה הן איברים חיוניים המבטיחים את הצלחתה הביולוגית של הקרצייה. הם נוצרים על ידי סוגים שונים של צינוס (I, II, III ו- IV) עם פונקציות פיזיולוגיות שונות. בלוטות הרוק אחראיות לאוסמורגולציה, הן מחוץ לפונדקאי והן על הפונדקאי, על ידי החזרת עודף מים ותכולת ברזל לפונדקאי באמצעות ריר 2,10. אצ'יני מסוג I מעורבים גם בקליטת מים מהאטמוספרה על ידי הפרשת הרוק ההיגרוסקופי10,11. חלבונים משפיעי רוק, כגון מלט וציסטאטינים, מיוצרים בתוך תאים מפרישים בסוג II ו-IIIacini 10,12. אצ'יני מסוג I אינו משפיע על האכלת קרציות, מה שמצביע על כך שצריכת קמח הדם אינה מעוררת שינויים מורפולוגיים ופיזיולוגיים באצ'יני מסוג13,14 אלה. מצד שני, אצ'יני מסוג II ו- III מופעלים במהלך ההאכלה ומציגים מעט מאוד פעילות לפני ההתקשרות. לפיכך, האכלה נחוצה כדי להפעיל את הגדלת התאים המפרישים בתוך סוג II acini ואת הייצור של תרכובות ביואקטיביות. אצ'יני מסוג III מצטמצמים בגודלם במהלך ההאכלה עקב הפרשה בתוך גרגירי הפרשה12.
בלוטות הרוק הן גם האתר של זיהום פתוגן בקרצייה ובנתיב ההעברה. במהלך ההאכלה, הקרציות מפרישות מספר תרכובות עם השפעות תרופתיות הדרושות לסיום מוצלח של קמח הדם 10,15,16. לתרכובות אלה יש תכונות אנטי דלקתיות, מדכאות חיסון ואסודילטוריות 10,15,17. מחקרים אחרונים הראו כי שלפוחיות חוץ-תאיות (EVs) המופקות מבלוטות הרוק של הקרציות מכילות כמה מהתרכובות הללו, מה שגורם להשפעות אנטי-דלקתיות ואימונו-אפנון 18,19,20. "שלפוחיות חוץ-תאיות" הוא מונח-על המשמש לתיאור בועיות המסווגות כאקסוזומים ומיקרו-ווסיקלים בהתבסס על גודלן ועל פי הביוגנזה שלהן. בסך הכל, כלי רכב חשמליים הם גושים שומניים עם ממברנות דו-שכבתיות שגודלן כ-40 ננומטר-1 מיקרומטר בגודל21; באופן כללי, אקסוזומים מתוארים כגודלם 40-150 ננומטר, בעוד שגודלם בין 150 ננומטר ל-1 מיקרומטר הוא 21,22,23. עם זאת, הגודל אינו מעיד על מסלול הביוגנזה של כלי הרכב החשמליים22.
הביוגנזה של האקסוזומים מתחילה באינווגינציה רציפה של קרום הפלזמה. אינווגינציה זו מובילה להיווצרותם של גופים רב-ווסקולריים ולבסוף גורמת לעיוות של קרום השלפוחית על ידי פעולה של קומפלקסים ESCRT או sphingomyelinases (sMases)24,25. ניתן לשכב את האקסוזומים בתוך הליזוזומים כדי לשמור על הומאוסטזיס תאי או לצאת באמצעות היתוך שלפוחיתי לקרום הפלזמה כדי להעביר מרכיבים תאיים לתאים המקבלים21,24. מצד שני, microvesicles נוצרים על ידי פעולה של flopasses ו flipasses, שינוי הקונפורמציה של שומנים בקרום פלזמה26. כלי רכב חשמליים חיוניים לתקשורת בין תאים, ומשמשים כמערכת הובלה למטענים תוך-תאיים, כגון שומנים, חלבונים, חומצות גרעין ומיקרו-רנ"א (miRNA)21,27,28. לאחר ההובלה, בועיות אלה מעבירות את המטען שלהן לתוך הציטופלסמה של התאים המקבלים, ויוצרות שינויים פנוטיפיים בתא המקבל22,29. בשל החשיבות של שלפוחיות חוץ-תאיות בהאכלת קרציות ומניפולציה של תגובות ריפוי חיסון ופצעים של המארח18,20, המטען בתוך שלפוחיות חוץ-תאיות מציג מטרות פוטנציאליות לפיתוח טיפולים נגד קרציות ומנגנון ייחודי לשיבוש האכלת הקרציות. זה כולל miRNAs בתוך בלוטות הרוק של קרציות ושלפוחיות חוץ-תאיות שמקורן בבלוטת הרוק.
miRNAs הם רצפים קצרים שאינם מקודדים, באורך של כ-18-22 נוקלאוטידים (nt), שיכולים לווסת, להשפיל או להשתיק רצפי mRNA לאחר שעתוק30,31. במהלך שעתוק, ה-pri-miRNAs נבקעים על ידי Dicer (RNA פולימראז III) ויוצרים מבנה ייחודי דמוי סיכת שיער, והופכים ל-pre-miRNA. הקדם-miRNA נחתך שוב על ידי Drosha (RNA פולימראז III) כדי ליצור דופלקס miRNA בוגר. הרצף הבוגר משתלב בקומפלקס ההשתקה המושרה על ידי RNA (RISC) המשלים את רצף ה-mRNA, וגורם להדחקת תרגום או לפירוק mRNA 28,30,32. במהלך האכלת הפונדקאי, miRNAs בתוך רוק הקרציות יכולים לווסת את ביטוי הגנים המארחים כדי לדכא תגובות חיסוניות ולהגביר את העברת הפתוגנים ל-33,34,35,36,37. למרות שקיימים מחקרים מקיפים על כלי רכב חשמליים ו-miRNA, תפקידם במהלך ההזנה בממשק הטיק-מארח עדיין לא מובן היטב. אופטימיזציה של פרוטוקולים שיכולים בקלות לגרום לבידוד וטיהור של miRNA באיכות גבוהה היא חיונית לקידום הידע שלנו בנושאים אלה.
ניתן להשתמש באפשרויות רבות כדי לבודד כלי רכב חשמליים, כגון אולטרה-צנטריפוגציה, משקעים אקסוזומים, משקעים פולימריים, כרומטוגרפיה של אימונו-אפיניטי וטכניקות הרחקה מבוססות גודל38. עם זאת, טכניקות אלה אינן יכולות להבחין בין אקסוזומים או מיקרו-וסיקלים. לפיכך, כאמור, EV משמש כמונח מטריה בעת בידוד כלי רכב חשמליים מדגימות שונות. הבועיות שבודדו בניסויים המתוארים כאן מייצגות תערובת של שלפוחיות שמקורן במסלולי ביוגנזה שונים. טיהור נוסף של אוכלוסייה מסוימת של בועיות חוץ-תאיות יכול להיות מושג על ידי מיצוי חיסוני באמצעות חרוזים המצופים בנוגדנים נגד סמנים (כלומר, סמנים אקסוזומליים, סמני גידול) הייחודיים לאוכלוסיית השלפוחית המעניינת39,40. ניתן גם לחלץ miRNAs באמצעות ערכות בידוד שונות הזמינות מסחרית 7,41,42.
מטרת הפרויקט הייתה לפתח פרוטוקול המשלב שיטות נפוצות לבידוד כלי רכב חשמליים ולמיצוי miRNA הן מרכבים חשמליים והן מבלוטות רוק מוזנות. מאחר שהפרשת תרכובות ביו-אקטיביות מופעלת על-ידי האכלהשל 12, יש לאפשר לקרציות להזין כדי לזהות miRNAs שעשויים להיות חשובים למניפולציה של תגובות חיסוניות ופצעים של פונדקאי. הפרוטוקול הנוכחי דורש מספר קטן של קרציות (20 קרציות) כדי לבודד כלי רכב חשמליים ואת ה-miRNA שלהם בהתאמה, בהשוואה למחקרים אחרים שתוארו קודם לכן שדרשו 2000 קרציות43. יתר על כן, הוא מונע זיהום של הפרשות רוק עם pilocarpine44, אשר יכול להשפיע על ניסויים החוקרים את ההשפעה של כלי רכב חשמליים ואת miRNAs שלהם על תאים מארחים.
Protocol
כל הניסויים בבעלי חיים בוצעו בעקבות פרוטוקול שימוש בבעלי חיים (AUP#2020-0026) שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (AICUC) באוניברסיטת טקסס A&M. מיני הקרציות, Ixodes scapularis ו-Rhipicephalus (Boophilus) microplus, וארנבים לבנים זכרים מניו זילנד, בני 42-72 ימים, שימשו למחקר הנוכחי. I. scapularis התקבל מהמרכז לבקרת מחלות (CDC) ומאוניברסיטת אוקלהומה סטייט, מאושרת כנטולת פתוגנים. R. microplus גודל במעבדה לחקר קרציות קדחת הבקר באדינבורו, טקסס. הארנבים התקבלו ממקורות מסחריים (ראו טבלת חומרים). פרוטוקול זה יכול לבודד באופן אוניברסלי שלפוחיות חוץ-תאיות ו-miRNAs ממיני קרציות, שלבי חיים ורקמות שונים.
1. גידול נקבה I. scapularis והכנת כמוסה
- הכינו כמוסת קצף אתילן-ויניל אצטט בעקבות ההליכים לארנבים קשים המזינים קרציות45. מניחים קפסולה אחת על כל להב כתף של הארנב בסך הכל שתי כמוסות לכל התפשטות.
הערה: בקצרה, כמוסות אלה מורכבות משני ריבועים של קצף אתילן-ויניל אצטט עם חלל ריק פנימי. ריבוע אחד מודבק לחלק האחורי של החיה (במקרה זה, ארנבים) עם דבק רקמה (ראו טבלת חומרים). רשת עדינה מודבקת לריבוע השני כדי למנוע בריחה של קרציות. שני הריבועים סגורים באמצעות סרט הדבקה עצמי. - אפשרו לכמוסות להתייצב למשך 24 שעות לפני הדבקת הקפסולה על הארנבים. אחסנו את קפסולות הקצף בטמפרטורת החדר.
הערה: ניתן לאחסן את הקפסולות ללא הגבלת זמן בטמפרטורת החדר. - הדביקו את הקפסולה לארנבים מגולחים עד עור והשאירו למשך 24 שעות לפני התפשטות הקרציות.
2. הכנת מדיה ללא שלפוחית
- כדי להכין מדיה ללא שלפוחית13, שלבו 0.5 מ"ל של סרום בקר עוברי, 0.5 מ"ל של ציר פוספט טריפטוז, 0.1 מ"ל של 10% תרכיז ליפופרוטאין-כולסטרול, 0.5 מ"ל של 5% נתרן ביקרבונט (NaHCO3), 0.25 מ"ל של 4-(2-הידרוקסיאתיל)-1-פיפרזין אתאנסולפוניק (HEPES), ו-8.125 מ"ל של מדיום L15C300 (ראו טבלת חומרים). התאם את עוצמת הקול של המדיום לפי הצורך. ממקמים את המדיום בבקבוק צנטריפוגת פוליקרבונט 26.3 מ"ל.
- מאזנים את הבקבוקים בהפרש משקל של 0.01 גרם לכל היותר כדי להבטיח את תפקודו התקין של האולטרה-סנטריפוג'.
- Ultracentrifuge את המדיום במשך 18 שעות ב 100,000 x g ב 4 °C (64 °F). מוציאים את ה-supernatant באמצעות פיפטה, תוך הקפדה על כך שלא תפריע לכל כדור שנוצר.
- העבר את הסופרנטנט לצינור צנטריפוגה חדש ואולטרה-צנטריפוג' בפעם השנייה למשך 18 שעות ב-100,000 x גרם ב-4 מעלות צלזיוס, עם איזון מתאים.
- מבודדים את חומר העל הנותר ועוברים דרך מסנן מזרקים של 0.22 מיקרומטר כדי להסיר מזהמים. פיפטה את הסופרנטנט לתוך צינור צנטריפוגה 50 מ"ל.
- אחסנו את חומר העל במקפיא של -20 מעלות צלזיוס עד הצורך או עד 3 שנים.
3. התפשטות ארנב
- חותכים את החלק העליון ממזרק 10 מ"ל ומעמיסים נקבות בוגרות I. scapularis באמצעות מכחול סטנדרטי.
- מכסים את פתח המזרק באמצעות גזה סטרילית (איור 1).
- הניחו את הארנב על משטח שולחן או משטח עבודה אופקית; לעטוף את הארנב בחוזקה במגבת ולכסות את שתי העיניים, ולהשאיר את הקפסולה המוכנה (שלב 1.1) חשופה לשורץ את הארנב בקרציות.
- פתחו את הקפסולה והכניסו קרציות על ידי לחיצה על ידית המזרק. להפקיד את הקרציות קרוב לעור הארנב. סגרו במהירות את הכמוסות כדי למנוע מהקרציות לברוח.
- על פי התכנון הניסיוני, אפשרו לנקבות הקרציות להאכיל כל עוד יש צורך בכך. אין לאפשר לזכר Ixodes scapularis להישאר בקפסולה במשך יותר מ -24 שעות כדי למנוע ייבוש.
הערה: מספר הקרציות שיש לחדור לבעלי החיים נתון לשיקול דעתו של החוקר. פרוטוקול זה השתמש בכ-100 קרציות לכל התפשטות כדי להסביר תמותה ומספיק חומר לשכפולים. הניסויים הראשוניים קבעו כי יש צורך בלפחות 20 קרציות/שכפולים כדי להשיג מספיק חומר לריצוף ה-miRNA.
4. הסרת הנקבות הניזונות
- מניחים את הארנבים שורצי התת-קרקעיים מתחת ל-2% איזופלורן בחמצן באמצעות מפזר גזים. הגדר את קצב החמצן בין 700-1000 ליטר לדקה.
הערה: ניתן להשתמש בחומרי הרדמה אחרים כדי למנוע כל מצוקה או כאב. - הסר את הנקבות המוזנות על ידי אחיזת הקרציות על ידי הקפיטולום שלהן, באמצעות מלקחיים עדינים, קרוב ככל האפשר לעור. ודא כי חלקי הפה מוסרים לחלוטין כדי למנוע זיהום חיידקי.
- מקם את הקרציות בצינור צנטריפוגה של 15 מ"ל.
- נקו את אתר הנשיכה עם 70% אתנול והוסיפו כמות קטנה של אנטיביוטיקה משולשת (שווה קצות האצבעות, ראו טבלת חומרים) כדי למנוע זיהום באתר עקיצת הקרציות.
- נשאו את הקרציות למעבדה לצורך ניתוחים (שלב 5). בצע ניתוחים אלה תוך 24-48 שעות של הסרת הקרציות כדי למנוע השפלה של בלוטות הרוק15,43.
5. כריתת בלוטת הרוק והפרשת שלפוחית חוץ-תאית
- הוסף 500 μL של מדיום ללא שלפוחית (שלב 2) עם 5 μL של 100x פניצילין, 5 μL של 100x סטרפטומיצין, 5 μL של 10 מ"ג / מ"ל של ריפאמפיצין, ו 5 μL של 100x amphotericin לכל באר (ראה טבלת חומרים). הוסיפו 1x PBS עם ריפאמפיצין לבארות שאינן מכילות מדיום נטול שלפוחית כדי למנוע צמיחת חיידקים.
- הניחו את הקרציות על מגלשת זכוכית מיקרוסקופית שקופה עם סרט שטיח דו-צדדי תחת מיקרוסקופ מנתח. כדי למנוע ייבוש איברים, יש להוסיף 10 μL של 1x PBS לכל תקתוק לפני הנתיחה.
- באמצעות מספריים 4 מ"מ vannas (ראה טבלת חומרים), לעשות חתך קטן של ~ 1 מ"מ בצד של כל נקבה. הסר לחלוטין את הצד הגבי של הקרצייה (איור 2) והסר את שתי בלוטות הרוק.
- שים 20-40 בלוטות רוק קרציות ב-500 מיקרול' של מדיום נטול שלפוחית שנוסף לבאר אחת בצלחת שטופלה בתרבית רקמה של 24 באר (איור 3).
- דגירה של דגימות בלוטת הרוק בטמפרטורה של 32 מעלות צלזיוס למשך 24 שעות כדי לאפשר את הפרשת כלי הרכב החשמליים.
6. בידוד של שלפוחיות חוץ-תאיות
- לאחר דגירה של 24 שעות, פיפטה את כל המדיום המכיל את בלוטות הרוק לצינור מיקרוצנטריפוגה של 1.5 מ"ל.
- צנטריפוגה הדגימה ב 300 x g ב 4 ° C במשך 10 דקות כדי לבודד את בלוטות הרוק. שני שלבים יופרדו בשלב זה: (1) הסופרנטנט המכיל את כלי הרכב החשמליים ו-(2) בלוטות הרוק (גלולה).
- כדי להמשיך את הבידוד של כלי הרכב החשמליים, פיפט את הסופרנטנט לתוך צינור מיקרו-צנטריפוגה חדש של 1.5 מ"ל. יש להחיות את הכדור המכיל את בלוטות הרוק (שלב 6.2) ב-500 μL של RNAlater (ראו טבלת חומרים) ולאחסן בטמפרטורה של -80 מעלות צלזיוס עד לשימוש או ללא הגבלת זמן.
הערה: בלוטות הרוק הללו ישמשו לבידוד miRNA בשלב 8. - צנטריפוגה את supernatant ב 2000 x g ב 4 ° C במשך 10 דקות כדי להסיר פסולת סלולרית. פיפט את הסופרנטנט לתוך צינור מיקרו-צנטריפוגה חדש של 1.5 מ"ל. השליכו את הכדור.
- צנטריפוגה של הסופרנטנט ב-10,000 x g למשך 30 דקות ב-4 מעלות צלזיוס כדי להסיר גופים אפופטוטיים ורכבים חשמליים גדולים יותר. זורקים את הכדור, ומכניסים את הסופרנטנט לתוך צינור מיקרו-סנטריפוג חדש של 1.5 מ"ל.
- חברו מזרק 10 מ"ל למסנן מזרק ניילון של 1 מיקרומטר. מניחים את המזרק ומסננים מעל צינור אולטרה-צנטריפוג' (איור 4A). לאחר מכן הוסיפו את הדגימה (איור 4B) ומלאו את המזרק ב-10 מ"ל של 1x PBS (איור 4C), ומאזנו את הצינור בהתאם (איור 4D).
- מניחים צינורות ברוטור 70Ti (ראו טבלת חומרים) ומסובבים ב-100,000 x גרם במשך 18 שעות בטמפרטורה של 4 מעלות צלזיוס.
- לאחר 18 שעות של אולטרה-צנטריפוגציה, שימו לב לכדור בקצה התחתון של הצינור (איור 5). הכדור הוא הבועיות החוץ-תאיות המרוכזות.
- הסר 90%-100% מהסופרנטנט מבלי לעשות שימוש חוזר בכדור EV. החייאת הכדור עם 1x PBS. אם לא ניתן היה להסיר את כל הסופרנאטנט, השתמש בסופרנאטנט הנותר כדי להחיות את הכדור.
- Pipette 500 μL של גלולת EV/סופרנטנט לתוך מסנן צנטריפוגלי של 300 K (ראו טבלת חומרים).
הערה: פעולה זו תסיר חלבונים שאינם קשורים לשלפוחית, miRNA ומולקולות אחרות, בעוד שהבועיות לא יעברו דרך המסנן. - צנטריפוגה ב 8,000 x g במשך 10 דקות בטמפרטורת הסביבה. חזור על שלב 6.10 עד שכל כדורי EV / supernatant יעברו דרך המסנן.
- הוסיפו 400 μL של PBS 1x מעוקר לטור וערבבו היטב באמצעות פיפטה כדי להסיר כלי רכב חשמליים המחוברים לממברנה. שים את הדגימה לתוך צינור 1.5 מ"ל DNase-/ RNase ללא DNase. ניתן לאחסן את הדגימות בטמפרטורה של -80 מעלות צלזיוס ללא הגבלת זמן או עד לשימוש. הימנעו מהפשרה מוגזמת של דגימות כדי למנוע השפלה של הדגימה.
הערה: הניחו צינורות על קרח כאשר מוציאים אותם מתוך ultracentrifuge כדי למנוע פגיעה ב-EV. המדגם הסופי יהיה גלולת EV ב-400 μL של 1x PBS. 25 μL של דגימה זו ישמשו לניתוח מעקב אחר ננו-חלקיקים (NTA, שלב 7), ו-375 μL לבידוד miRNA (שלב 8).
7. ניתוח מעקב אחר ננו-חלקיקים (NTA)
- קח 25 μL של הדגימה הסופית (שלב 6.12) והוסף 375 μL של 1x PBS.
- טען את הדגימה המדוללת למזרק ללא מחט 1 מ"ל והברג בחוזקה את העדשה האופטית של ה- NTA.
- התאם את ההגדרות בהתאם וצלם סרטונים על סמך הגדרת העדפות.
הערה: במחקר הנוכחי נלקחו שלוש קריאות של 60 שניות כל אחת. כל קריאת נת"ע מייצגת שכפול טכני. דגימות שונות מהזנת קרציות לאותו משך זמן מייצגות שכפולים ביולוגיים בודדים. המצלמה הוגדרה ברמה 7 וסף הזיהוי נקבע ברמה 5. - הערך את מספרי EV הסופיים לפי הנוסחה הבאה:
((תחילת ריכוז כלי רכב חשמליים (גורם דילול)) * (הנפח הכולל שנותר בצינור הדגימה)/1000) = סך כל כלי הרכב החשמליים במדגם
הערה: יש לחלק את הנפח ב-1000 מכיוון שהנת"ע קוראת את הדגימות כריכוז/מ"ל.
8. מיצוי miRNA מבלוטות רוק ובועיות חוץ-תאיות
- הוסיפו 100 μL של מגיב הליזיס (ראו טבלת חומרים) לדגימה הנותרת משלב 6.12 והומוגניזציה עם מזיקים מעוקרים (איור 6).
- הוסף את 600 μL הנותרים של מגיב lysis ודגירה במשך 5 דקות בטמפרטורת החדר.
- מוסיפים 140 μL של כלורופורם, מנערים במרץ במשך 15 שניות, ודגירה במשך 3 דקות בטמפרטורת החדר.
- סובב ב 12,000 x g במשך 15 דקות ב 4 ° C.
- פיפטה את הפאזה העליונה השקופה, תוך הימנעות מאינטרפאזה, לתוך צינור חדש של 1.5 מ"ל. התוצאה תהיה ~ 525 μL של נפח הדגימה הצפוי. לאחר מכן, הוסף נפח של 1:1 של אתנול בדרגה מולקולרית של 100%.
- הוסף 700 μL של הדגימה לעמודת ספין בידוד RNA (ראה טבלת חומרים).
- סובבו ברזולוציה של 8,000 x גרם במשך 30 שניות בטמפרטורת הסביבה, השליכו את הזרימה החוצה.
- שטפו את הדגימה עם 700 μL של מאגר RTE (ראו טבלת חומרים), סובבו ב-8,000 x גרם במשך 30 שניות, השליכו את הזרימה החוצה.
- שטפו את הדגימה עם 500 μL של מאגר RPE (ראו טבלת חומרים), סובבו ברזולוציה של 8,000 x גרם במשך 30 שניות, השליכו את הזרימה החוצה.
- הוסיפו 500 μL של אתנול בדרגה מולקולרית של 80% וסובבו ב-8,000 x גרם למשך 2 דקות, השליכו את הזרימה החוצה.
- סובב את העמוד במהירות המרבית למשך 5 דקות כדי לייבש את הממברנה. השליכו את שפופרת האיסוף והניחו את העמודה על צינור מיקרו-פוג' חדש בגודל 1.5 מ"ל.
- הוסיפו 14 μL של מים נטולי RNase/DNase לממברנה ודגרו במשך 5 דקות בטמפרטורת החדר.
- צנטריפוגה בגודל 21,000 x g למשך דקה אחת בטמפרטורת החדר.
- הוסיפו 1 μL של מעכב RNase (ראו טבלת חומרים) ל-miRNAs המבוקרים וערבבו היטב באמצעות פיפטה.
הערה: לפני מיצוי miRNA מבלוטות הרוק, הסר כל RNAlater על ידי הוספת 1 מ"ל של 1x PBS (נפח 1:1) וסובב את בלוטות הרוק במהירות המרבית למשך 15 דקות ב 4 °C (4 °C). זה צריך לחזור על עצמו שלוש פעמים או עד בלוטות הרוק שככו מספיק כדי להסיר את supernatant. בשלב זה, המדגם מייצג תערובת של רנ"א קטנים בגודל של כ-20-150 bp (איור משלים 1).
9. מדידת ריכוז miRNA
- מדוד את הריכוז של RNA קטן באמצעות ערכת בדיקת RNA41 הזמינה מסחרית (ראה טבלת חומרים).
- בכל צינור, מערבבים 199 μL של מאגר דילול (רכיב A ו-B המסופק בערכה לכל דגימה), 1 μL של צבע פלואורסצנטי ספציפי לזיהוי miRNA (אורך גל מדידה 260 ננומטר) (לכל דגימה), ו-2 μL של RNA קטן (שלב 8) עבור כל דגימה, על פי הוראות היצרן.
- לפני קריאת צינורות הדגימה, קרא את תקן miRNA מדולל מראש 1 ותקן 2 (המסופק בערכה) כדי ליצור עקומה סטנדרטית לפני מדידת הדגימה.
הערה: התקנים משמשים ככלי השוואה לקביעת ריכוז ה-miRNA הנמדד בדגימות. - מקם כל צינור תקן וצינור דגימה בפלואורומטר הייעודי (ראה טבלת חומרים) כדי למדוד את הריכוז כ- ng/μL.
10. קביעת איכות ה-miRNA
- קבעו את האיכות של miRNA ו-RNA קטנים אחרים באמצעות אלקטרופורזה של ג'ל באמצעות ביואנליזר46, בהתאם להוראות היצרן (ראו טבלת חומרים).
- לפני קריאת הדגימה, נרמלו את הדגימות כך שיהיו באותו ריכוז.
- קרא את הדגימות דרך שבב RNA קטן41,46, בהתאם להוראות היצרן (ראה טבלת חומרים).
הערה: כדי לקבוע את איכות ה-miRNA, התמונות דמויות הג'ל (רצועות) והאלקטרופרוגרמות (פסגות) הן אינדיקטורים לאיכות הדגימה. ככל שהפס בג'ל כהה יותר, כך איכות ה-miRNA טובה יותר. ככל שהפס קל יותר (או אם אין פס), כך איכותו ירודה יותר או מוכיחה ירידה בדגימה46,47.
11. העשרת מיקרו-רנ"א
- העשר את ה-miRNA באמצעות ערכת ריצוף RNA קטנה, בהתאם להוראות היצרן של ערכת הכנת דגימות ה-RNA הקטנה (ראו טבלת חומרים).
- שחרר כל דגימה עם מתאם אדנילציה בגודל 3 אינץ' והסר את המתאם העודף באמצעות ניקוי חרוזים. לאחר מכן, הוסף מתאם בגודל 5 אינץ' והסר את המתאם העודף על ידי ניקויחרוזים 48.
הערה: גם המתאמים וגם החרוזים לניקוי סופקו בערכת ריצוף ה-RNA הקטנה מסעיף 11.1 (ראו טבלת חומרים). - כדי לסנתז את הגדיל הראשון, הכינו תערובת ראשית של הדגימות הקשורות לשני המתאמים, מאגר RT ותעתיק הפוך M-MuLV המסופק בערכה (ראו טבלת חומרים). לאחר מכן, דגירה של התערובת למשך 30 דקות ב-42 מעלות צלזיוס ו-10 דקות ב-90 מעלות צלזיוס. מעקב עם ניקוי לדוגמה כמפורט בהוראות.
- הגבר את הגדיל הראשון באמצעות פריימר קדמי RT ופריימר אוניברסלי הפוך המסופק בערכה (ראה טבלת חומרים) באמצעות תגובת שרשרת פולימראז קונבנציונלית (PCR) למשך 2 דקות ב-95 מעלות צלזיוס, ולאחר מכן עבור 12-25 מחזורים במשך 20 שניות ב-95 מעלות צלזיוס, 30 שניות ב-60 מעלות צלזיוס ו-15 שניות ב-72 מעלות צלזיוס. לבסוף, 2 דקות ב 72 °C (72 °F).
הערה: גודל מוצר ה-PCR צפוי להיות כ-150 bp (איור 7). - מדוד את איכות מוצר ה-PCR באמצעות תחנת קלטת בהתאם להוראות היצרן (ראה טבלת חומרים).
- תרצף את הדגימות באמצעות מערכת ריצוף מהדור הבא (75 מחזורים), בהתאם להוראות היצרן (ראה טבלת חומרים).
הערה: לצורך העשרת miRNA, יש לבדוק את כמות ואיכות הדגימה (שלבים 9-10) לפני הכנת הספרייה.
12. אנליזה ביואינפורמטית
- זהה את ה-miRNA המשומרים והייחודיים באמצעות כלי יישום משולב לזיהוי miRNA.
הערה: במחקר הנוכחי, זיהוי miRNA בוצע באמצעות miRDeep249,50. miRDeep2 הוא קטלוג מקוון חינמי של כל ה-miRNAs המשומרים והחדשניים שזוהו ונמצאו במינים שונים49,50 (ראו טבלת חומרים). - יישר את הקריאות לגנום המתאים באמצעות הממפה המשולב בתוכנה.
- הזן את הפרמטרים הבאים למודול המפה.
- חתוך את רצפי המתאמים שנוספו משלב 11.2 והסר רצפים באורך של פחות מ-18 נוקלאוטידים. הסר את רצפי הקריאה המיותרים.
- המרת הקבצים באמצעות הניתוח לפרמטר תבנית FASTA, רק אם הקובץ אינו בתבנית FASTA49.
- יישרו את הרצפים המסוננים והחתוכים לגנום המתאים. אם אין גנום למינים המעניינים, התיישרו עם המינים ההומולוגיים הקרובים ביותר.
- הצג את קבצי הפלט כ- "reads.fa" ו- "reads_vs_genome.arf". ה-"read.fa" יכיל רק את הקריאות הלא-מיותרות, וה-"reads_vs_genome.arf" יכלול את הקריאות הממופות המיושרות לגנום.
- באמצעות שני קבצי הפלט משלב 12.2, בצע את פרופיל ביטוי miRNA באמצעות הקוונטיפייר המשולב עם התוכנה.
- הורד את המינים של רצפי מבשרי miRNA מעניינים ואת רצפי miRNA הבוגרים מ- miRBase 51,52,53,54,55,56. אם אין רצפים מקדימים או בוגרים עבור המינים המעניינים, הורד את "סיכת השיער.fa.gz" ואת "mature.fa.gz" המכילים את כל המבשרים והרצפים הבוגרים עבור כל האורגניזמים הזמינים ב- miRBase.
- בטל את הדחיסה של הקבצים "סיכת שיער.gz" ו-"mature.fa.gz".
- הזן את הקבצים "reads.fa" ו- "read_vs_genome.arf" מסעיף 12.3.4 ואת הקבצים הלא דחוסים מ- 12.4.2.
- קרא את קבצי הפלט כ-"outputname.csv","outputname.html", ו-"outputname.pdf". ניתן להגדיר את שם קובץ הפלט על פי החוקר.
הערה: הקובץ "שם פלט.csv" יכיל את פרופילי הביטויים. באופן ספציפי, פרופיל הביטוי יכלול את מזהה ה-miRNA, את סכום הקריאות עבור כל הדגימות הממופות ל-miRNA, את מספר הקריאות הממופות ל-miRNA ספציפי עבור כל דגימה, ואת המזהה המקדים המתאים ל-miRNA הבוגר. "שם הפלט.html" משלב 12.4.4 יכיל את הקישורים לדפדפן הגנום של אוניברסיטת סנטה קרוז (USCS), המרכז הלאומי למידע ביוטכנולוגי (NCBI) ו- miRBase. ה- USCS וה- NCBI יכילו את רצפי השאילתות של המבשרים הנוכחיים כנגד מסד הנתונים הלא יתיר של הנוקלאוטידים, ול- miRBase יהיה את המידע של מבשר ה- miRNA הנוכחי. "שם הפלט.pdf" יהיה בעל המבנה המשני של ה-RNA של ה-miRNA המבוטאים ויישור הרצף המבשר.
- כדי לזהות miRNA ייחודיים ושמורים, השתמש ב- miRDeep2.
- השתמש בקבצי הפלט משלב 12.3.4 ומשלב 12.4.2 כקבצי הקלט.
הערה: קבצי הפלט הנקראים "שם פלט.html" יכילו את התחזיות של ה- miRNA הייחודיים והשמורים במדגם. - השתמש בציונים >1 ליצירת פרופיל miRNA ובציונים >4 לניתוח ניסיוני נוסף, כגון עיכוב miRNA וחיקוי miRNA אנדוגני 34,36,57.
- בחר וזהה את ה- miRNA הייחודיים מבסיס miR בהתבסס על הדברים הבאים: ציון miRDeep2 (שלב 12.5.3), הערכה של הסתברות אמיתית (>90%), ערך p ראנדפול משמעותי (<0.05)49,50,56.
הערה: ניתוח הביואינפורמטיקה נעשה באמצעות miRDeep2 בסביבת הגילוי של Cyverse58,59, פלטפורמה מקוונת חינמית לניתוח ביואינפורמטיקה. ה-miRNAs המשומרים והייחודיים שזוהו באמצעות miRDeep2 הושוו כנגד כל המינים מבסיס ה-miRbase. ניתן להשוות זיהוי miRDeep2 עתידי מול הגנום המקביל של המינים המעניינים.
- השתמש בקבצי הפלט משלב 12.3.4 ומשלב 12.4.2 כקבצי הקלט.
תוצאות
הפרוטוקול הנוכחי מספק מתודולוגיה מפורטת לחילוץ miRNA מבלוטות רוק ומרכבים חשמליים. על פי התוצאות, פרוטוקול זה יעיל לבידוד של miRNA מבוגרים של שני מיני קרציות שונים, I. scapularis ו - R. microplus, וניתן להשתמש בו גם במינים אחרים של קרציות. ריכוז כלי הרכב החשמליים (חלקיקים/מ"ל) נמדד באמצעות נת"ע. עבור R. microplus, כל שלב מגדר וחיים הכיל שלושה שכפולים ביולוגיים שנמדדו בשלושה שכפולים טכניים. הדגימות הופרדו לפי מין ושלב חיים (איור 8) כדי להראות את השונות בתוך כל דגימה. לאחר מכן, הדגימות שולבו כדי להציג את השונות וההבדלים הסטטיסטיים באמצעות ANOVA דו-כיווני ומבחני ההשוואה המרובים של Tukey20 (p-value = < 0.05) (איור 9). כל דגימה כללה כ-40 בלוטות רוק שנותחו מ-20 נקבות, זכרים ונימפות. לאחר הבידוד והכימות של כלי הרכב החשמליים, הדגימות שימשו לטיהור RNA קטן.
ריכוז הרנ"א הקטן בתוך כל דגימה נמדד באמצעות קיוביט (טבלה 1), והאיכות נמדדה באמצעות ביואנליזר באמצעות אלקטרופורזה סטנדרטית של ג'ל46,47. הריכוזים הם בננוגרמות (טבלה 1) בנפח של 14 מיקרול'ל עבור שני מיני הקרציות. הסך הממוצע של ריכוזי RNA קטנים מאיברי I. scapularis נע בין 45.92-6,356 ננוגרם. ריכוז הרנ"א של שלפוחיות I. scapularis נע בין 72.24-2,128 ננוגרם. עבור R. microplus, ריכוז האיברים נע בין 259-2,142 ננוגרם, והבועיות נעו בין 59.22-1,848 ננוגרם. הדגימות נורמלו לאותו ריכוז, ואיכותן נמדדה לאחר מכן באמצעות ביואנליזר (איור 10). סולם ייחוס שימש בג'ל כסמן להערכת איכות. שלמות הלהקה, עוצמתה ושיאים היו נציגים של השפלה פוטנציאלית או ריכוז מוחלט בכל דגימה. רצועות המתאימות ל-5 s ו-5.8 s RNA ריבוזומלי היו קיימות רק בדגימות איברי בלוטת הרוק (איור 10, נתיבים A-D) ונעדרו בשלפוחית מדגימות בלוטות הרוק (איור 10, נתיבים E,F), מה שמדגים את ההבדלים בפרופילי RNA קטנים בין איברים לשלפוחיות חוץ-תאיות. השפלת הדגימה הוסקה על ידי היעדר רצועות בג'ל; זה סימן כי הייתה ירידה משמעותית במדגם. מומלץ להשליך את כל הדגימות שיש להן השפלה משמעותית.
כדי להדגים את נוכחותן של דגימות miRNA בתוך ההכנות, הוכנו ספריות RNA cDNA קטנות מדגימות RNA שאוחסנו במשך 3-4 חודשים לאחר בידוד RNA קטן. באופן מוזר, ירידה גבוהה יותר בדגימות אלה נמצאה ירידה בדגימות אלה. הנתיבים א'-ד' ו-ז' הראו סימני השפלה; להיפך, E, F ו-H-K הראו השפלה מינימלית וריכוז מספיק להכנת ספריית miRNA cDNA (איור משלים 1). רק דגימה אחת הושפלה כאשר נעשה שימוש בדגימות מיד לאחר הטיהור (איור 10), מה שמרמז על כך שדגימות miRNA היו מועדות יותר להתפרקות ברגע שהן טוהרו מרכבים חשמליים. לפיכך, דגימות E, F, H ואני נבחרנו לניתוח העשרה. הכוכביות מראות את גדלי הרצועה של כ-150 bp, שהיו הגדלים הצפויים לאחר הכנת ספריית cDNA (איור 7). הפסים הקלושים התחתונים מציינים את דימר הפריימר.
במהלך בידוד EV, מהירות הצנטריפוגה והזמן יכולים להשפיע על ריכוז EV הסופי. כאשר מכניסים את כדור ה-EV לעמודות של 300 k, כפי שהוזכר קודם לכן בשלב 6.10, נפח נמוך ומהירות הם חיוניים כדי למנוע מרכבים חשמליים לעבור דרך הממברנה. מחקרים קודמים הראו כי 700 μL ב-12,000 x g במשך 20 דקות באמצעות רכז צנטריפוגלי אחר הספיקו כדי להפריד כראוי בין כלי רכב חשמליים לחלבונים המסיסים20; עם זאת, ריכוזי EV נמוכים הוצגו ב-NTA באמצעות מסנן אחר. לכן, אופטימיזציה של המסננים וחומרים זמינים אחרים היא חיונית. כאשר השתמשו לראשונה בעמודות של 300 k, נבדקו מרווחי מהירות שונים כדי לקבוע אילו מהם נתנו את ריכוז ה-EV הגבוה ביותר. מספר הבועיות שאבדו במהלך הצנטריפוגה נמדד על ידי ניתוח NTA; הוסק כי מהירויות נמוכות יותר גרמו לריכוז שלפוחית גבוה יותר בזרימה-דרך (לא מוצג). נקבע כי 500 μL ב 6,000-8,000 x g היה משביע רצון כדי לבודד את כלי הרכב החשמליים. לאחר שנקבע זאת, פרוטוקול זה שימש לבידוד שלפוחיות מ- I. scapularis ו - R. microplus. ריכוז הבועיות שבודדו מכל מין קרציות נמדד באמצעות NTA (איור 8). ריכוזי ה-EV נעו בין 7.07 x 107 ל-7.94 x 109 חלקיקים/מ"ל. כמות ה-EV נמצאה בקורלציה עם ריכוזי ה-miRNA, כאשר הכמות הגדולה יותר של EV הביאה לריכוז גבוה יותר של miRNA שחולץ.
איור 1: מזרקים ללא מחט 1 מ"ל עמוסים בנקבה בוגרת I. scapularis ומכוסים בגאזה מעוקרת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הצד הגבי של נקבה לכודה הוסר באמצעות מספריים 4 מ"מ של ואנה. הנקבה הייתה שקועה ב-1x PBS כדי למנוע ייבוש איברים. החצים הצהובים מצביעים על בלוטות הרוק החשופות. הנתון צולם בהגדלה של פי 50 עם עדשה אובייקטיבית ברזולוציה גבוהה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: צלחת תרבית תאים לאחר דגירה של 24 שעות בטמפרטורה של 32 מעלות צלזיוס. שורת הבארות הראשונה מכילה את המדיה נטולת השלפוחית ואת בלוטות הרוק המנותקות. שאר הבארות מכילות 1x PBS עם ריפאמפיצין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: תהליך הכנה לדוגמה למחזור אולטרה-מרכזי. (A) מזרק ללא מחט 10 מ"ל עם מסנן מזרק של 1 מיקרומטר. (B) הסופרנאטנט לאחר שלושה סיבובים של צנטריפוגה נזרק לתוך המזרק. (C) שאר המזרק מלא עד 10 מ"ל עם 1x PBS מעוקר. (D) המזרק מכוסה, והסופרנטנט עם 1x PBS מסונן לתוך צינור האולטרה-צנטריפוגה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור 5: לאחר 18 שעות של אולטרה-צנטריפוגציה, נוצרת גלולה של שלפוחיות חוץ-תאיות בתחתית שפופרת האולטרה-צנטריפוגה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: מזיק מעוקר משמש להומוגניזציה של איברי בלוטת הרוק ושל הבועיות החוץ-תאיות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.
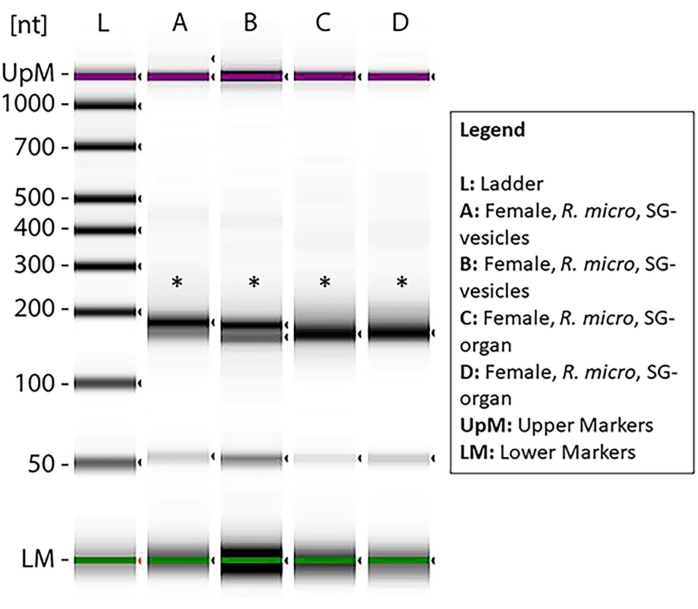
איור 7: אלקטרופורזה של ג'ל שנמדדה באמצעות תחנת קלטת המציגה את הספריות המוכנות של miRNA לאחר ניתוח העשרה. הדגימות מנקבות R. microplus איברי בלוטת הרוק ורכבים חשמליים התבססו על השפלה מינימלית וריכוז miRNA מספיק לסינתזה של ספריית cDNA. הסולם (L) מציג את נקודות הייחוס בנוקלאוטידים ואת הסמנים העליונים והתחתונים. הכוכביות מציינות את הפסים של מוצר הגודל ~ 150 bp, המסמלים את ספריות ה- RNA cDNA הקטנות. הפסים התחתונים מראים דימר פריימר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
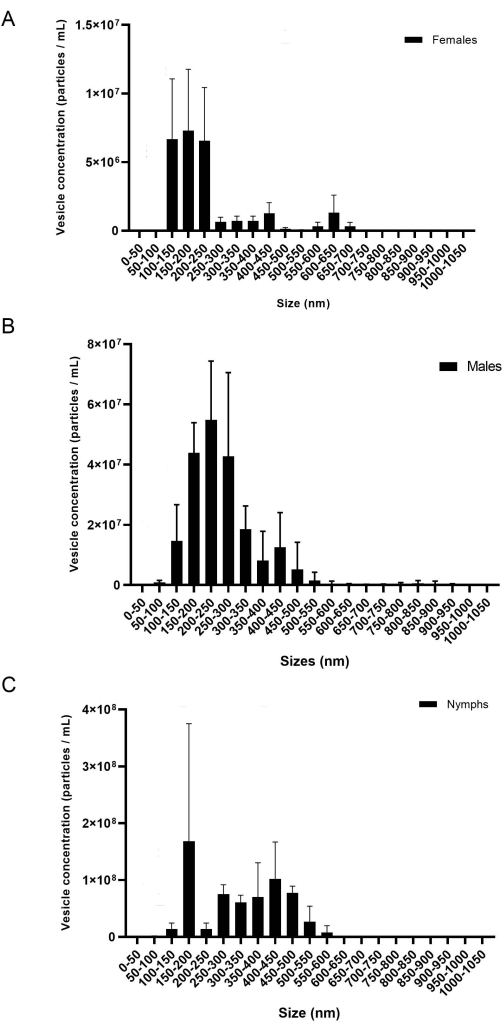
איור 8: דמות מייצגת של השונות בין השכפול הביולוגי (A) נקבות, (B) זכרים ו-(C) נימפות. ציר ה-x מציג את גודל ה-EV (nm), וציר ה-y מציג את ריכוז ה-EV (חלקיקים/מ"ל). מבחן השוואה דו-כיווני של ANOVA ו-Tukey הציג הבדלים סטטיסטיים (P-value = < 0.05). פסי השגיאה מייצגים את שגיאת התקן כדי לקחת בחשבון את השונות. כל דגימה הכילה 20 קרציות עם שלושה שכפולים ביולוגיים. הדגימות תועדו במשך 60 שניות, שלוש פעמים כל אחת. המצלמה הוגדרה ברמה 7, וסף הזיהוי נקבע ברמה 5. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 9: דמות מייצגת של הווריאציה עבור כל השכפולים הביולוגיים המשולבים עבור נימפות (אדומות), נקבות (כחולות) וזכרים (שחורים). ציר ה-x מציג את גודל ה-EV (nm), וציר ה-y מציג את ריכוז ה-EV (חלקיקים/מ"ל). מבחן השוואה דו-כיווני של ANOVA ו-Tukey הציג הבדלים סטטיסטיים (P-value = < 0.05). פסי השגיאה מייצגים את שגיאת התקן כדי לקחת בחשבון את השונות. כל דגימה הכילה 20 קרציות עם שלושה שכפולים ביולוגיים. הכוכביות מסמלות הבדל משמעותי של p < 0.05. כל הקלטה נעשתה במשך 60 שניות, שלוש פעמים כל אחת. המצלמה הוגדרה ברמה 7, וסף הזיהוי נקבע ברמה 5. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
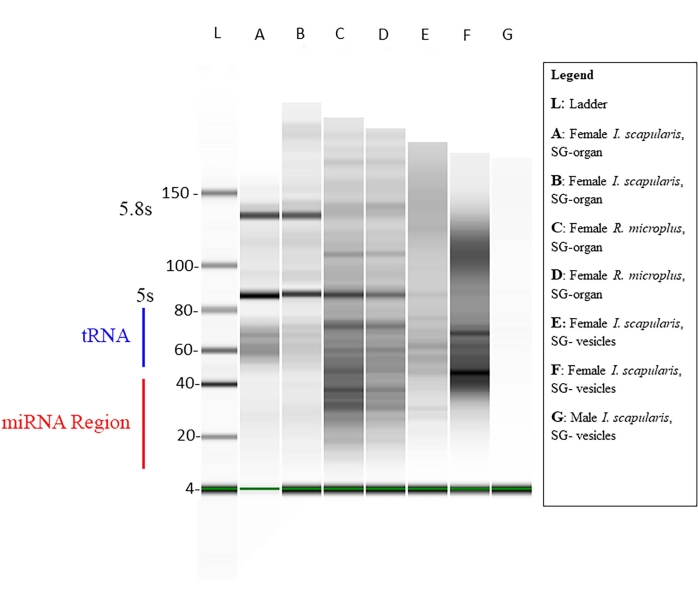
איור 10: ג'ל מייצג דרך הביואנלייזר. האלקטרופורזה של הג'ל בוצעה באמצעות סולם בסיס כהפניה. רצף miRNA בוגר הוא באורך של כ-18-22 nt, כאשר פסים קלושים מוצגים בטווח הגודל המיועד. רנ"א קטנים אחרים, כגון רנ"א גרעיניים קטנים, רנ"א שליח העברה ורנ"א רגולטוריים, נמצאים גם הם בדגימות. הגדלים של הרנ"א הקטנים נעו בין 20-150 nt. הדגימות משתנות ממיני קרציות, רקמות ומין. עבור נתיב G, דוגמה של השפלה לדוגמה לא מראה להקות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור משלים 1: אלקטרופורזה של ג'ל נמדדה באמצעות הביואנליזר, והציגה את האיכות של ה-miRNAs המופקים מאיברי בלוטת הרוק הנשית R. microplus ומרכבים חשמליים. הסולם (L) מציג את גדלי הייחוס בנוקלאוטידים, כאשר miRNAs בוגרים מודדים כ-18-22 nt אורך. הנתיבים A-D ו-G מראים ירידה, והנתיבים E, F ו-H-K מראים ירידה מינימלית. אנא לחץ כאן כדי להוריד קובץ זה.
| מינים | מין | עוגב/ שלפוחית | ריכוז EV | ריכוז miRNA (ng) |
| R. מיקרופלוס | נקבה | איבר | N/A | 259 |
| R. מיקרופלוס | נקבה | איבר | N/A | 2,142 |
| R. מיקרופלוס | נקבה | שלפוחית | 1.64 E+08 | 59.22 |
| R. מיקרופלוס | נקבה | שלפוחית | 1.64 E+09 | 1,848 |
| I. scapularis | נקבה | איבר | N/A | 45.92 |
| I. scapularis | נקבה | איבר | N/A | 6,356 |
| I. scapularis | נקבה | שלפוחית | 1.73E+08 | 65.66 |
| I. scapularis | נקבה | שלפוחית | 3.14 E+09 | 2,128 |
טבלה 1: דוגמה לריכוזי ה-miRNA הן עבור בלוטות הרוק והן עבור שלפוחיות חוץ-תאיות. עמודת ריכוזי ה-miRNA מייצגת את הריכוזים הנמוכים ביותר עד הגבוהים ביותר עבור כל מין קרציות.
| מיקרו-רנ"א | I. scapularis | I. ricinus | R. מיקרופלוס | H. longicornis | הפניות |
| miR-8 | A | P | P | P | 33, 36, 37, 43 |
| miR-71 | P | P | P | A | 33, 36, 37, 43 |
| miR-279 | P | A | A | P | 33, 36, 37, 43 |
| let-7 | A | P | P | P | 33, 36, 37, 43 |
טבלה 2: ה-miRNAs המשומרים במינים שונים של קרציות. (P) מציין שה-miRNA היו מבוטא בדרך כלל, או נוכח, ו-(A) מסמן שה-miRNA לא הובעו או זוהו בדרך כלל.
| סוג לדוגמה | מספר הציונים >1* | מספר הציונים >4γ | מספר נשמרים | מספר הרומן |
| זכר | 17 | 0 | 48,885 | 23 |
| נקבה | 25 | 0 | 48,885 | 21 |
| נימפות | 38 | 0 | 48,885 | 38 |
טבלה 3. ה-miRNAs המשומרים והייחודיים זוהו ברכבים החשמליים עבור נקבות R. microplus , זכרים ונימפות. *ציון miRNA המשמש ליצירת פרופילים. γציון miRNA המשמש לניסויים פונקציונליים.
טבלה משלימה 1: טבלה המציגה את תוצאות הריצוף של הדור הבאעבור זכרי R. microplus רכבים חשמליים המופרשים מבלוטות הרוק. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 2: טבלה המציגה את תוצאות הריצוף של הדור הבאעבור כלי רכב חשמליים נקבות R. microplus המופרשות מבלוטות הרוק. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 3: טבלה המציגה את תוצאות הריצוף של הדור הבא עבור כלי רכב חשמליים של נימפות R. microplus המופרשים מבלוטות הרוק. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
הפרוטוקול הנוכחי מספק מתודולוגיה מפורטת לחילוץ miRNA מבלוטות הרוק ומרכבים חשמליים. עם זאת, ישנם שיקולים חשובים, שכולם מפורטים בהערות עבור כל סעיף בפרוטוקול זה. יש לאבטח את הקפסולה ואת רשת הרשת במהלך האכלת הקרציות כדי למנוע מהקרציות לברוח. ההכנה והמיקום של הקפסולה מתוארים ב- Koga et al.40. מספר שכפולים של ניתוחי הקרציות צריכים להיעשות אם מדגם לא מתאים מושלך. בנוסף, ניתן להציב מספר אתגרים בעת שימוש בטכניקות בידוד EV מרקמת קרציות 18,20,43. לדוגמה, יש לשמור על רקמות לחות במהלך הנתיחה כדי למנוע ייבוש. זה נעשה על ידי הוספת PBS לאורך כל הנתיחה. הן את ה- PBS והן את המדיה המשמשת לניתוח ולתרבית של האיברים יש לשמור על אנטיביוטיקה כדי למנוע זיהום חיידקי מהמיקרוביום של הקרציות. אלה צריכים לכלול אנטיביוטיקה המכוונת לחיידקים גראם שליליים וגראם חיוביים, שכן ניתן למצוא את שניהם בתוך רקמות הקרציות60. כמו כן, יש לנקוט בזהירות במהלך הנתיחה כדי להפחית את הזיהום עם רקמות מאיברים אחרים. לכן, ניתוחים צריכים להיעשות לאט, וככל שהמשתמש צובר ניסיון, ניתן לנתח יותר קרציות. לבסוף, מכיוון שרכבים חשמליים מופרשים מכל התאים, כולל תאים נגועים בפתוגנים, מחקרי קרציות המבצעים בידוד EV צריכים להשתמש במדיה נטולת EV ובמאגרים כדי למנוע זיהום חוצה EV25,61.
עם זאת, פרוטוקול זה מאפשר הפחתה של מספר הקרציות הדרושות לייצור כלי רכב חשמליים מרוק קרציות. פרוטוקולים קודמים דרשו ריור של מספר גדול משמעותית של קרציות. לדוגמה, miRNA שהופרשו בתוך כלי רכב חשמליים ברוק ב-Haemaphysalis longicornis נזקקו לרוק של 2,000 קרציות בוגרות43. זה יכול להיות יקר מאוד עבור מעבדות חסרות את היכולת לקרציות אחוריות. באופן דומה, רקמות Amblyomma maculatum המשמשות לבידוד EV הוקפאו חלקית לפני הבידוד וטופלו ב-75 U/mL של קולגן מסוג 3, מה שעלול להשפיע על האותנטיות של הפרשת EV19. יתר על כן, מחקרים אלה דרשו 80-100 זוגות של בלוטות רוק18.
באופן יחסי, פרוטוקול זה יכול להיות מיושם על מיני קרציות מרובים, ודורש מספר נמוך של קרציות כדי לבודד כלי רכב חשמליים ולהפיק איכות שמורה וחדשנית miRNAs (טבלה 2)33,36,37,43. ריכוזי ה-miRNA השתנו מאוד אך הספיקו לריצוף הדור הבא (טבלה 3 וטבלאות משלימות 1-3). ניתן להתאים פרוטוקול זה כך שיתאים לגודל מדגם גדול יותר אם יש צורך בריכוזי miRNA גדולים יותר. כמו כן, חומרים המשמשים בפרוטוקול זה ניתנים להחלפה בהתאם לזמינות החומר. עם זאת, יש להתאים את נפחי הדגימה ואת מהירות הצנטריפוגה בהתאם להוראות היצרן לערכות ולעמודות שבהן נעשה שימוש.
החיסרון של שיטה זו הוא כי miRNAs ורכבים חשמליים יכולים בקלות להתדרדר לאורך שלבי החילוץ והבידוד. לכן, יש לבצע את הפרוטוקול במהירות וביעילות. כאשר נאמר, הדגימות חייבות להישמר על קרח, ואת מיצוי miRNA חייב להתבצע בסביבה מעוקרת. בנוסף, ניתן לבצע טיפול RNase ברכבים החשמליים המבודדים כדי לחסל רנ"א גדולים המחוברים לממברנת EV. זה יכול למנוע מ-RNA גדול לזהם את הדגימה במהלך מיצויי miRNA. לבסוף, הוספת מעכב RNAse לדגימת ה-miRNA לאחר בידוד מרכבים חשמליים או מאיברים היא אמצעי מניעה חשוב לפירוק. ניתן לשנות וליישם פרוטוקול זה במקביל למטרות הניסוי הנערך.
יישומים עתידיים לפרוטוקול זה עשויים לכלול מחקר של אינטראקציות בין פתוגנים לווקטורים כדי להבין כיצד פתוגנים משפיעים על ה-miRNA ועל מטענים גנומיים אחרים בתוך כלי רכב חשמליים בעלי רוק קרציות. באופן דומה, פרוטוקול זה יכול להגדיר חלבונים ותהליכים תאיים ספציפיים המעורבים באריזת miRNAs לרכבים חשמליים של קרציות, ואת ההשפעה הספציפית שיש לרכבים חשמליים ול-miRNA אלה על ריפוי פצעים ותגובות חיסוניות. בשל ההתנגדות הגוברת לקרציות לקוטלי אקריות, יש צורך נואש בשיטות בקרה ייחודיות. לרכבים חשמליים יש פוטנציאל לשיטת בקרה חלופית בהשוואה לקוטלי חשמל. כלי רכב חשמליים יכולים לשמש כננו-טרנספורטרים ביישומים טיפוליים 18,23,61. בבני אדם, כלי רכב חשמליים המובילים miRNAs שימשו לדיכוי צמיחת הגידול במהלך אימונותרפיה של סרטן62,63. באופן דומה, בקרציות, כלי רכב חשמליים יכולים לשאת miRNAs מהונדסים גנטית שהוכחו כמשפיעים על תפקודים ביולוגיים חיוניים של קרציות והעברת פתוגנים 36,57,64. הכיוון העתידי הוא להשתמש בפרוטוקול זה כדי לקבוע את פרופילי ה-miRNA של מיני קרציות מרובים כדי לזהות miRNA בעלי עניין למחקרים פונקציונליים.
Disclosures
המחברים מצהירים על היעדר ניגוד עניינים.
Acknowledgements
אנו מעריכים מאוד את הסיוע ממעבדת קרציות קדחת הבקר באדינבורו, טקסס. ברצוננו להודות למייקל מוזס, ג'ייסון טידוול, ג'יימס הלומס, סזאריו אגאדו והומר ואסקז. ברצוננו גם להודות על עזרתן של שרה שרפטון, אליזבת לוהסטרו, איימי פיליפ, קלסי ג'ונסון, קלי קוצ'קאן, אנדרו הילאוס, צ'רלוז ארוצ'ו רוסאריו וסטפני גוזמן ולנסיה לאורך כל הפרויקט. ברצוננו להודות לקבוצת הכתיבה של טקסס A&M Aggie Women in Entomology (AWE) על עזרתן ועצותיהן במהלך כתיבת כתב יד זה. הריאגנטים הבאים סופקו על ידי המרכזים לבקרת מחלות ומניעתן להפצה על ידי משאבי BEI, NIAID, NIH: Ixodes scapularis Adult (חי), NR-42510. נקבות קרציות I. scapularis התקבלו גם הן ממתקן גידול הקרציות באוניברסיטת אוקלהומה סטייט. פרויקט זה מומן על ידי אוניברסיטת טקסס A&M T3: שלישיות למענק טרנספורמציה והסכם שיתוף הפעולה #58-3094-1-003 על ידי USDA-ARS ל- AOC.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | GenClone | 25-240 | |
| 1 µm nylon syringe filter | Tisch Scientific | 283129028 | |
| 1 inch black adhesive | Amazon | B00FQ937NM | Capsule |
| 10 mL needeless syringe | Exelint | 26265 | |
| 3' and 5' Adapters | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| 4 mm vannas scissors | Fine Science Tools | 15000-08 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid | Sigma-Aldrich | 1.1523 | |
| 70Ti rotor | Beckman Coulter | 337922 | |
| Amphotericin | Corning | 30-003-CF | |
| Beads | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Bioanalyzer | Agilent | G2939BA | |
| Bioanalyzer kit | Agilent | 5067-1513 | |
| Centrifuge 5425 | Eppendorf | ||
| Chloroform | Macron | UN1888 | |
| Cyverse Discovery Enviornment | https://cyverse.org/discovery-environment | ||
| Dissecting microscope | Nikon | SMZ745 | |
| Double-sideded carpet tape | amazon | 286373 | |
| Falcon Tubes, 50 mL | VWR | 21008-940 | |
| Fetal Bovine Serum | Gibco | FBS-02-0050 | |
| fine forceps | Excelta | 5-S-SE | |
| Foamies, 2 mm | Amazon | B004M5QGBQ | Capsule |
| Isoflurane | Phoenix Pharmaceuticals manfactured | 193.33165.3 | |
| Ixodes scaplaris | CDC, Oklahoma State University | ||
| L15C300 medium | In-lab | ||
| lipoprotein-cholesterol concentrate | MPI | 02191476-CF | |
| Microscope slide | VWR | 10118-596 | |
| miRDeep2 | https://github.com/rajewsky-lab/mirdeep2 | ||
| M-MuLV Reverse Transcriptase | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| molecular grade ethanol | Fischer Bioreagents | UN1170 | |
| multi-well 24 well tissue culture treated plate | Corning | 353047 | |
| Nanopaticle Tracking Analyzer machine | Malvern Panalytical | ||
| Nanosep with 300K Omega filter | Pall Corporation | OD3003C33 | |
| NEXTFLEX Small RNA-Seq Kit v3 | PerkinElmer | ||
| NextSeq 500/550 High Output Kit (75 cycles) | Illumina | 20024906 | |
| Optima XPN 90 Ultracentrifuge | Beckman Coulter | ||
| Penicillin | Thermofischer Scientific | ICN19453780 | |
| Pippettes | Ependorff | ||
| polycarbonate centrifuge bottle | Beckman Coulter | 355618 | |
| Qiagen miRNeasy kit | Qiagen | 217084 | |
| QIAzol lysis reagent | Qiagen | 79306 | |
| Qubit | Thermofisher | Q32880 | |
| Qubit kit | Thermofisher | Q10212 | |
| Rabbits | Charles River | ||
| Reverse Universal Primer | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Rhipicephalus microplus | Cattle Fever Tick Research Labratoty | ||
| Rifampicin | Fischer Bioreagents | 215544 | |
| RNAlater | Invitrogen | 833280 | |
| RNAse free tubes | VWR | 87003294 | |
| RNAse inhibitor | Thermo Fischer | 11111729 | |
| RNAse/DNAse free water | Qiagen | 217084 | |
| RNeasy Minelute spin column | Qiagen | 217084 | Qiagen miRNeasy kit |
| RPE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| RT Buffer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RT Forward Primer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RTE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| Sodium bicarbonate | Sigma-Aldrich | S6014-25G | |
| Sorvall ST16 | Thermo Fischer | 75004380 | |
| Sterilized Gauze sponges | Covidien | 2187 | |
| Sterilized PBS | Sigma | RNBK0694 | |
| streptomycin | thermofischer Scientific | 15240062 | |
| TapeStation | Aligent | G2991BA | |
| Tear Mender Instant Fabric and Leather Adhesive | Amazon | 7.42836E+11 | Capsule |
| Tissue Adhesive | 3M VetBond | ||
| Triple Antibiotics | dechra | 17033-122-75 | |
| Tryptose phosphate broth | BD | BD 260300 |
References
- Jongejan, F., Uilenberg, G. The global importance of ticks. Parasitology. 129, 3-14 (2004).
- Anderson, J. F., Magnarelli, L. A. Biology of ticks. Infectious Disease Clinics of North America. 22 (2), 195-215 (2008).
- de la Fuente, J. Controlling ticks and tick-borne diseases… looking forward. Ticks and Tick-Borne Diseases. 9 (5), 1354-1357 (2018).
- Nicholson, W. L., Sonenshine, D. E., Noden, B. H., Brown, R. N. Ticks (Ixodia). Medical and Veterinary Entomology. , 603-672 (2019).
- Guerrero, F. D., Lovis, L., Martins, J. R. Acaricide resistance mechanisms in Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitologia Veterinária. 21 (1), 1-6 (2012).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: the state of play. Veterinary Parasitology. 203 (1-2), 6-20 (2014).
- Redshaw, N., et al. A comparison of miRNA isolation and RT-qPCR technologies and their effects on quantification accuracy and repeatability. Biotechniques. 54 (3), 155-164 (2013).
- Estrada-Peña, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Experimental and Applied Acarology. 23 (9), 685-715 (1999).
- Eisen, R. J., Eisen, L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology. 34 (4), 295-309 (2018).
- Bowman, A. S., Sauer, J. R. Tick salivary glands: function, physiology and future. Parasitology. 129, 67 (2004).
- Kim, D., Maldonado-Ruiz, P., Zurek, L., Park, Y. Water absorption through salivary gland type I acini in the blacklegged tick, Ixodes scapularis. PeerJ. 5, 3984 (2017).
- Nunes, P. H., Bechara, G. H., Camargo-Mathias, M. I. Morphological changes in the salivary glands of Amblyomma cajennense females (Acari: Ixodidae) in different feeding stages on rabbits at first infestation. Experimental and Applied Acarology. 45 (3), 199-209 (2008).
- Bishop, R., et al. A cement protein of the tick Rhipicephalusappendiculatus, located in the secretory e cell granules of the type III salivary gland acini, induces strong antibody responses in cattle. International Journal for Parasitology. 32 (7), 833-842 (2002).
- Yamaji, K., et al. A salivary cystatin, HlSC-1, from the ixodid tick Haemaphysalis longicornis play roles in the blood-feeding processes. Parasitology Research. 106 (1), 61-68 (2009).
- Simo, L., Kazimirova, M., Richardson, J., Bonnet, S. I. The essential role of tick salivary glands and saliva in tick feeding and pathogen transmission. Frontiers in Cellular and Infection Microbiology. 7, 281 (2017).
- Perner, J., Kropáčková, S., Kopáček, P., Ribeiro, J. M. C. Sialome diversity of ticks revealed by RNAseq of single tick salivary glands. PLoS Neglected Tropical Diseases. 12 (4), 0006410 (2018).
- Madden, R. D., Sauer, J. R., Dillwith, J. W. A proteomics approach to characterizing tick salivary secretions. Experimental and Applied Acarology. 32 (1), 131-141 (2004).
- Zhou, W., et al. Discovery of exosomes from tick saliva and salivary glands reveals therapeutic roles for CXCL12 and IL-8 in wound healing at the tick-human skin interface. Frontiers in Cell and Developmental Biology. 8, 554 (2020).
- Zhou, W., et al. Exosomes serve as novel modes of tick-borne flavivirus transmission from arthropod to human cells and facilitates dissemination of viral RNA and proteins to the vertebrate neuronal cells. PLoS Pathogens. 14 (1), 1006764 (2018).
- Chávez, A. S. O., et al. Tick extracellular vesicles enable arthropod feeding and promote distinct outcomes of bacterial infection. Nature Communications. 12 (1), 1-17 (2021).
- Pegtel, D. M., Gould, S. J. Exosomes. Annual Review of Biochemistry. 88, 487-514 (2019).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Théry, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nature Cell Biology. 21 (1), 9-17 (2019).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. A. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213 (2018).
- Gioseffi, A., Edelmann, M. J., Kima, P. E. Intravacuolar pathogens hijack host extracellular vesicle biogenesis to secrete virulence factors. Frontiers in Immunology. 12, 662944 (2021).
- Chávez, A. S. O., O'Neal, A. J., Santambrogio, L., Kotsyfakis, M., Pedra, J. H. F. Message in a vesicle-trans-kingdom intercommunication at the vector-host interface. Journal of Cell Science. 132 (6), 224212 (2019).
- Janas, T., Janas, M. M., Sapoń, K., Janas, T. Mechanisms of RNA loading into exosomes. FEBS Letters. 589 (13), 1391-1398 (2015).
- Lu, T. X., Rothenberg, M. E. MicroRNA. Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- Pegtel, D. M., et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences. 107 (14), 6328-6333 (2010).
- Bartel, D. P. MicroRNAs: target recognition and regulatory functions. Cell. 136 (2), 215-233 (2009).
- Ambros, V. MicroRNAs and developmental timing. Current Opinion in Genetics and Development. 21 (4), 511-517 (2011).
- Bushati, N., Cohen, S. M. microRNA functions. Annual Review of Cell and Developmental Biology. 23, 175-205 (2007).
- Hackenberg, M., Langenberger, D., Schwarz, A., Erhart, J., Kotsyfakis, M. In silico target network analysis of de novo-discovered, tick saliva-specific microRNAs reveals important combinatorial effects in their interference with vertebrate host physiology. RNA. 23 (8), 1259-1269 (2017).
- Luo, J., et al. MicroRNA-1 promotes the development of and prolongs engorgement time in Hyalomma anatolicum anatolicum (Acari: Ixodidae) ticks. Biorxiv. , (2020).
- Zhou, J., Zhou, Y., Cao, J., Zhang, H., Yu, Y. Distinctive microRNA profiles in the salivary glands of Haemaphysalis longicornis related to tick blood-feeding. Experimental and Applied Acarology. 59 (3), 339-349 (2013).
- Hermance, M. E., Widen, S. G., Wood, T. G., Thangamani, S. Ixodes scapularis salivary gland microRNAs are differentially expressed during Powassan virus transmission. Scientific Reports. 9 (1), 1-17 (2019).
- Barrero, R. A., et al. Evolutionary conserved microRNAs are ubiquitously expressed compared to tick-specific miRNAs in the cattle tick Rhipicephalus (Boophilus) microplus. BMC Genomics. 12 (1), 1-17 (2011).
- Colombo, M., et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. Journal of Cell Science. 126 (24), 5553-5565 (2013).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. . Proteomic Profiling. , 179-209 (2015).
- Koga, K., et al. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Research. 25, 3703-3707 (2005).
- Wright, K., de Silva, K., Purdie, A. C., Plain, K. M. Comparison of methods for miRNA isolation and quantification from ovine plasma. Scientific Reports. 10 (1), 1-11 (2020).
- Mráz, M., Malinova, K., Mayer, J., Pospisilova, S. MicroRNA isolation and stability in stored RNA samples. Biochemical and Biophysical Research Communications. 390 (1), 1-4 (2009).
- Nawaz, M., et al. miRNA profile of extracellular vesicles isolated from saliva of Haemaphysalis longicornis tick. Acta Tropica. 212, 105718 (2020).
- Ribeiro, J. M. C., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva. Medical and Veterinary Entomology. 18 (1), 20-24 (2004).
- Almazán, C., et al. A versatile model of hard tick infestation on laboratory rabbits. Journal of Visualized Experiments. (140), e57994 (2018).
- Masotti, A., Preckel, T. Analysis of small RNAs with the Agilent 2100 Bioanalyzer. Nature Methods. 3 (8), 658 (2006).
- Benesova, S., Kubista, M., Valihrach, L. Small RNA-sequencing: approaches and considerations for miRNA analysis. Diagnostics. 11 (6), 964 (2021).
- Mackowiak, S. D. Identification of novel and known miRNAs in deep-sequencing data with miRDeep2. Current Protocols in Bioinformatics. 36 (1), 12 (2011).
- Friedländer, M. R., Mackowiak, S. D., Li, N., Chen, W., Rajewsky, N. miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades. Nucleic Acids Research. 40 (1), 37-52 (2012).
- Griffiths-Jones, S. The microRNA registry. Nucleic Acids Research. 32, 109-111 (2004).
- Griffiths-Jones, S., Grocock, R. J., Van Dongen, S., Bateman, A., Enright, A. J. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research. 34, 140-144 (2006).
- Griffiths-Jones, S., Saini, H. K., Van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucleic Acids Research. 36, 154-158 (2007).
- Kozomara, A., Birgaoanu, M., Griffiths-Jones, S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 47, 155-162 (2019).
- Kozomara, A., Griffiths-Jones, S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Research. 39, 152-157 (2011).
- Kozomara, A., Griffiths-Jones, S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Research. 42, 68-73 (2014).
- Wu, F., et al. MicroRNA let-7 regulates the expression of ecdysteroid receptor (ECR) in Hyalomma asiaticum (Acari: Ixodidae) ticks. Parasites and Vectors. 12 (1), 1-13 (2019).
- Goff, S. A., et al. The iPlant collaborative: cyberinfrastructure for plant biology. Frontiers in Plant Science. 2, 34 (2011).
- Merchant, N., et al. The iPlant collaborative: cyberinfrastructure for enabling data to discovery for the life sciences. PLoS Biology. 14 (1), 1002342 (2016).
- Kumar, D., et al. An exploratory study on the microbiome of northern and southern populations of Ixodes scapularis ticks predicts changes and unique bacterial interactions. Pathogens. 11 (2), 130 (2022).
- Zhang, Y., et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. International Journal of Nanomedicine. 15, 6917 (2020).
- Di Leva, G., Croce, C. M. miRNA profiling of cancer. Current Opinion in Genetics and Development. 23 (1), 3-11 (2013).
- Ganju, A., et al. miRNA nanotherapeutics for cancer. Drug Discovery Today. 22 (2), 424-432 (2017).
- Luo, J., et al. MicroRNA-1 Expression and Function in Hyalomma Anatolicum anatolicum (Acari: Ixodidae) Ticks. Frontiers in Physiology. 12, 596289 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved