Method Article
Isolement de microARN à partir de cultures de glandes salivaires ex vivo et de vésicules extracellulaires
Dans cet article
Résumé
Le présent protocole décrit l’isolement des microARN des glandes salivaires des tiques et des vésicules extracellulaires purifiées. Il s’agit d’une procédure universelle qui combine des réactifs et des fournitures couramment utilisés. La méthode permet également l’utilisation d’un petit nombre de tiques, ce qui donne des microARN de qualité qui peuvent être facilement séquencés.
Résumé
Les tiques sont des ectoparasites importants qui peuvent vecteurs de multiples agents pathogènes. Les glandes salivaires des tiques sont essentielles à l’alimentation car leur salive contient de nombreux effecteurs aux propriétés pharmaceutiques qui peuvent diminuer les réponses immunitaires de l’hôte et améliorer la transmission des agents pathogènes. Un groupe de ces effecteurs sont les microARN (miARN). Les miARN sont de courtes séquences non codantes qui régulent l’expression des gènes hôtes à l’interface tique-hôte et dans les organes de la tique. Ces petits ARN sont transportés dans la salive des tiques via des vésicules extracellulaires (VE), qui servent à la communication intercellulaire et intracellulaire. Des vésicules contenant des miARN ont été identifiées dans la salive des tiques. Cependant, on sait peu de choses sur les rôles et les profils des miARN dans les vésicules et les glandes salivaires des tiques. De plus, l’étude des vésicules et des miARN dans la salive des tiques nécessite des procédures fastidieuses pour recueillir la salive des tiques. Ce protocole vise à développer et valider une méthode d’isolement des miARN à partir de vésicules extracellulaires purifiées produites par des cultures d’organes ex vivo . Les matériaux et la méthodologie nécessaires pour extraire les miARN des vésicules extracellulaires et des glandes salivaires des tiques sont décrits ici.
Introduction
Les tiques sont des ectoparasites qui transmettent de nombreux agents pathogènes à la faune, au bétail, aux humains et à leurs animaux de compagnie 1,2. L’alimentation des tiques entraîne des pertes économiques importantes en causant des dommages à la peau, en réduisant le poids et la production de lait en raison d’une anémie sévère et de la transmission d’agents pathogènes potentiellement mortels 1,3,4,5. Les pratiques de contrôle actuelles pour la gestion des populations de tiques sont axées sur l’utilisation d’acaricides. Néanmoins, l’émergence continue de la résistance aux acaricides chez les tiques parasitant le bétail 5,6, l’incidence accrue des piqûres de tiques7 et la transmission d’agents pathogènes dans les zones résidentielles 8,9 ont conduit à un besoin de solutions de rechange uniques pour la lutte contre les tiques.
Les glandes salivaires des tiques sont des organes essentiels qui assurent le succès biologique d’une tique. Ils sont formés par différents types d’acinus (I, II, III et IV) avec diverses fonctions physiologiques. Les glandes salivaires sont responsables de l’osmorégulation, à la fois hors et sur l’hôte, en renvoyant l’excès d’eau et la teneur en fer à l’hôte via la salivation 2,10. Les acini de type I sont également impliqués dans l’absorption de l’eau de l’atmosphère par la sécrétion de salive hygroscopique10,11. Les protéines effectrices salivaires, telles que le ciment et les cystatines, sont produites dans les cellules sécrétoires des acini10,12 de type II et III. Les acini de type I n’affectent pas l’alimentation des tiques, ce qui indique que l’apport en farine de sang ne déclenche pas de changements morphologiques et physiologiques dans ces acini de type13,14. D’autre part, les Acini de type II et III sont activés pendant l’alimentation et présentent très peu d’activité avant l’attachement. Ainsi, l’alimentation est nécessaire pour déclencher l’élargissement des cellules sécrétoires au sein des acini de type II et la production de composés bioactifs. Les acini de type III sont réduits en taille pendant l’alimentation en raison de la sécrétion dans les granules sécrétoires12.
Les glandes salivaires sont également le site de l’infection pathogène dans la tique et la voie de transmission. Pendant l’alimentation, les tiques sécrètent plusieurs composés ayant des effets pharmaceutiques qui sont nécessaires pour réussir la farine de sang 10,15,16. Ces composés ont des propriétés anti-inflammatoires, immunosuppressives et vasodilatatrices 10,15,17. Des études récentes ont montré que les vésicules extracellulaires (VE) dérivées des glandes salivaires des tiques hébergent plusieurs de ces composés, induisant des effets anti-inflammatoires et immunomodulateurs 18,19,20. « Vésicules extracellulaires » est un terme générique utilisé pour décrire les vésicules classées comme exosomes et microvésicules en fonction de leur taille et de leur biogenèse. Dans l’ensemble, les VE sont des blebs lipidiques avec des membranes bicouches d’environ 40 nm-1 μm de taille21; en général, les exosomes sont décrits comme ayant une taille de 40 à 150 nm, tandis que les microvésicules mesurent entre 150 nm et 1 μm etune taille de 21,22,23. Cependant, la taille n’est pas indicative de la voie de biogenèse22 des VE.
La biogenèse des exosomes commence par l’invagination séquentielle de la membrane plasmique. Cette invagination conduit à la formation de corps multivésiculaires et aboutit finalement à la déformation de la membrane vésiculeuse par l’action de complexes ESCRT ou de sphingomyélinases (sMases)24,25. Les exosomes peuvent soit être lysés dans les lysosomes pour maintenir l’homéostasie cellulaire, soit sortir par fusion vésiculeuse vers la membrane plasmique pour délivrer des constituants cellulaires aux cellules réceptrices21,24. D’autre part, les microvésicules sont formées par l’action des flopasses et des tongasses, modifiant la conformation des lipides dans la membraneplasmique 26. Les VE sont essentiels pour la communication de cellule à cellule, servant de système de transport pour les cargaisons intracellulaires, telles que les lipides, les protéines, les acides nucléiques et les microARN (miARN)21,27,28. Une fois transportées, ces vésicules délivrent leur cargaison dans le cytoplasme des cellules réceptrices, générant des changements phénotypiques dans la cellule réceptrice22,29. En raison de l’importance des vésicules extracellulaires dans l’alimentation des tiques et de la manipulation des réponses immunitaires et de cicatrisation des plaiesde l’hôte 18,20, la cargaison dans les vésicules extracellulaires présente des cibles potentielles pour le développement de thérapies anti-tiques et un mécanisme unique pour perturber l’alimentation des tiques. Cela inclut les miARN dans les glandes salivaires des tiques et les vésicules extracellulaires dérivées des glandes salivaires.
Les miARN sont de courtes séquences non codantes, d’une longueur d’environ 18 à 22 nucléotides (nt), qui peuvent réguler, dégrader ou faire taire les séquences d’ARNm30,31 par post-transcription. Au cours de la transcription, les pri-miARN sont clivés par Dicer (ARN polymérase III) pour former une structure distinctive en forme d’épingle à cheveux, devenant un pré-miARN. Le pré-miARN est coupé une fois de plus par Drosha (ARN polymérase III) pour former un duplex miARN mature. La séquence mature s’intègre dans le complexe de silençage induit par l’ARN (RISC) complémentaire à la séquence d’ARNm, provoquant une répression de la traduction ou une dégradation de l’ARNm 28,30,32. Pendant l’alimentation de l’hôte, les miARN dans la salive de la tique peuvent moduler l’expression des gènes de l’hôte pour supprimer les réponses immunitaires et améliorer la transmission des agents pathogènes 33,34,35,36,37. Bien qu’il existe des études approfondies sur les ve et les miARN, leurs rôles lors de l’alimentation à l’interface tique-hôte sont encore mal compris. L’optimisation des protocoles qui peuvent facilement entraîner l’isolement et la purification de miARN de haute qualité est cruciale pour faire progresser nos connaissances sur ces sujets.
Plusieurs options peuvent être utilisées pour isoler les VE, telles que l’ultracentrifugation, la précipitation des exosomes, la précipitation des polymères, la chromatographie par immunoaffinité et les techniques d’exclusion basées sur la taille38. Cependant, ces techniques ne peuvent pas faire la distinction entre les exosomes ou les microvésicules. Ainsi, comme mentionné précédemment, EV est utilisé comme un terme générique lors de l’isolation des véhicules électriques de différents échantillons. Les vésicules isolées dans les expériences décrites ici représentent un mélange de vésicules dérivées de différentes voies de biogenèse. Une purification plus poussée d’une population spécifique de vésicules extracellulaires peut être obtenue par immunoprécipitation à l’aide de perles recouvertes d’anticorps contre les marqueurs (c.-à-d. marqueurs exosomaux, marqueurs tumoraux) uniques à la population de vésicules d’intérêt39,40. Les miARN peuvent également être extraits via différents kits d’isolement disponibles dans le commerce 7,41,42.
L’objectif de ce projet était de développer un protocole qui combine des méthodes couramment appliquées pour isoler les VE et extraire les miARN des VE et des glandes salivaires nourries. Étant donné que la sécrétion de composés bioactifs est activée en nourrissant12 personnes, les tiques devraient être autorisées à se nourrir pour identifier les miARN qui peuvent être importants pour manipuler les réponses immunitaires et de cicatrisation des plaies de l’hôte. Le protocole actuel exige un petit nombre de tiques (20 tiques) pour isoler les VE et leurs miARN respectifs, par rapport à d’autres études décrites précédemment qui nécessitaient 2000 tiques43. En outre, il évite la contamination des sécrétions salivaires par la pilocarpine44, ce qui pourrait influencer les expériences étudiant l’effet des VE et de leurs miARN sur les cellules hôtes.
Protocole
Toutes les expériences sur les animaux ont été effectuées conformément au protocole d’utilisation des animaux (AUP # 2020-0026) approuvé par le comité institutionnel de soins et d’utilisation des animaux (AICUC) de la Texas A & M University. Les espèces de tiques, Ixodes scapularis et Rhipicephalus (Boophilus) microplus, et les lapins blancs mâles de Nouvelle-Zélande, âgés de 42 à 72 jours, ont été utilisés pour la présente étude. I. scapularis a été reçu du Center for Disease Control (CDC) et de l’Oklahoma State University, certifié comme exempt d’agents pathogènes. R. microplus a été élevé au Cattle Fever Tick Research Laboratory à Edinburg, Tx. Les lapins ont été obtenus de sources commerciales (voir tableau des matériaux). Ce protocole peut isoler universellement les vésicules extracellulaires et les miARN de différentes espèces de tiques, stades de vie et tissus.
1. Élevage de la femelle I. scapularis et préparation des capsules
- Préparez une capsule de mousse d’éthylène-acétate de vinyle en suivant les procédures pour les lapins nourris aux tiques dures45. Placez une capsule sur chaque omoplate du lapin pour un total de deux capsules par infestation.
REMARQUE: Brièvement, ces capsules se composent de deux carrés de mousse d’éthylène-acétate de vinyle avec un espace vide intérieur. Un carré est collé à l’arrière de l’animal (dans ce cas, des lapins) avec un adhésif tissulaire (voir Tableau des matériaux). Une maille fine est collée au deuxième carré pour éviter l’échappement des tiques. Les deux carrés sont fermés à l’aide de ruban adhésif autocollant. - Laisser reposer les capsules pendant 24 h avant d’adhérer à la capsule sur les lapins. Conservez les capsules de mousse à température ambiante.
REMARQUE: Les capsules peuvent être conservées indéfiniment à température ambiante. - Collez la capsule aux lapins rasés et laissez-les reposer pendant 24 heures avant l’infestation par les tiques.
2. Préparation de milieux sans vésicules
- Pour préparer un milieu sans vésicules13, combiner 0,5 mL de sérum fœtal bovin, 0,5 mL de bouillon de phosphate de tryptose, 0,1 mL de concentré de lipoprotéines-cholestérol à 10 %, 0,5 mL de bicarbonate de sodium à 5 % (NaHCO3), 0,25 mL d’acide 4-(2-hydroxyéthyl)-1-pipérazineéthanesulfonique (HEPES) et 8,125 mL de milieu L15C300 (voir tableau des matériaux). Réglez le volume du support au besoin. Placer le milieu dans une bouteille de centrifugeuse en polycarbonate de 26,3 mL.
- Équilibrez les bouteilles par une différence de poids de 0,01 g maximum pour assurer le bon fonctionnement de l’ultracentrifugeuse.
- Ultracentrifuge le milieu pendant 18 h à 100 000 x g à 4 °C. Retirez le surnageant à l’aide d’une pipette, en veillant soigneusement à ne pas déranger les granulés formés.
- Transférer le surnageant dans un nouveau tube centrifuge et ultracentrifugeuse une deuxième fois pendant 18 h à 100 000 x g à 4 °C, avec un bon équilibre.
- Isolez le surnageant restant et passez à travers un filtre à seringue de 0,22 μm pour éliminer les contaminants. Pipeter le surnageant dans un tube de centrifugeuse de 50 mL.
- Conservez le surnageant dans un congélateur à -20 °C jusqu’à ce que nécessaire ou jusqu’à 3 ans.
3. Infestation de lapins
- Coupez le dessus d’une seringue de 10 mL et chargez les femelles adultes I. scapularis à l’aide d’un pinceau standard.
- Couvrir l’ouverture de la seringue à l’aide de gaze stérile (Figure 1).
- Placer le lapin sur une table ou une surface de travail horizontalement; enveloppez le lapin hermétiquement avec une serviette et couvrez les deux yeux, en laissant la capsule préparée (étape 1.1) exposée à infester le lapin avec des tiques.
- Ouvrez la capsule et insérez des tiques en poussant la poignée de la seringue. Déposez les tiques près de la peau du lapin. Fermez rapidement les capsules pour empêcher les tiques de s’échapper.
- Selon la conception expérimentale, permettre aux tiques femelles de se nourrir aussi longtemps que nécessaire. Ne laissez pas Ixodes scapularis mâle rester dans la capsule pendant plus de 24 heures pour éviter la dessiccation.
REMARQUE : Le nombre de tiques à infester chez les animaux est à la discrétion de l’enquêteur. Ce protocole utilisait environ 100 tiques par infestation pour tenir compte de la mortalité et suffisamment de matériel pour les répliques. Les expériences préliminaires ont déterminé qu’au moins 20 tiques / répliques étaient nécessaires pour obtenir suffisamment de matériel pour le séquençage des miARN.
4. Retrait des femelles nourries
- Placez les lapins infestés sous 2% d’isoflurane dans l’oxygène à l’aide d’un diffuseur de gaz. Réglez le débit d’oxygène entre 700-1000 L / min.
REMARQUE: D’autres anesthésiques peuvent être utilisés pour éviter toute détresse ou douleur. - Retirez les femelles nourries en saisissant les tiques par leur capitule, à l’aide de pinces fines, aussi près que possible de la peau. Assurez-vous que les pièces buccales sont complètement enlevées pour éviter une infection bactérienne.
- Placez les tiques dans un tube de centrifugeuse de 15 mL.
- Nettoyez le site de la morsure avec de l’éthanol à 70% et ajoutez une petite quantité d’antibiotique triple (valeur du bout des doigts, voir tableau des matériaux) pour prévenir l’infection au site de la piqûre de tique.
- Portez les tiques au laboratoire pour les dissections (étape 5). Effectuer ces dissections dans les 24-48 h suivant l’élimination des tiques pour éviter la dégradation des glandes salivaires15,43.
5. Dissection des glandes salivaires et sécrétion de vésicules extracellulaires
- Ajouter 500 μL de milieu sans vésicules (étape 2) avec 5 μL de 100x pénicilline, 5 μL de 100x streptomycine, 5 μL de 10 mg/mL de rifampicine et 5 μL de 100x amphotéricine à chaque puits (voir tableau des matériaux). Ajouter 1x PBS avec de la rifampicine à tous les puits qui ne contiennent pas de milieu sans vésicules pour empêcher la croissance bactérienne.
- Placez les tiques sur une lame de verre microscopique transparente avec du ruban adhésif double face sous un microscope à dissection. Pour éviter la dessiccation des organes, ajoutez 10 μL de 1x PBS à chaque tique avant la dissection.
- À l’aide de ciseaux vannas de 4 mm (voir Tableau des matériaux), faites une petite incision d’environ 1 mm sur le côté de chaque femelle. Retirez complètement la face dorsale de la tique (Figure 2) et retirez les deux glandes salivaires.
- Placer 20 à 40 glandes salivaires de tiques dans 500 μL de milieu sans vésicule ajouté à un seul puits dans une plaque de 24 puits traitée par culture tissulaire (figure 3).
- Incuber les échantillons de glandes salivaires à 32 °C pendant 24 h pour permettre la sécrétion des VE.
6. Isolement des vésicules extracellulaires
- Après 24 h d’incubation, pipeter tout le milieu contenant les glandes salivaires dans un tube de microcentrifugation de 1,5 mL.
- Centrifuger l’échantillon à 300 x g à 4 °C pendant 10 min pour isoler les glandes salivaires. Deux phases seront séparées dans cette étape : (1) le surnageant contenant les VE et (2) les glandes salivaires (pastille).
- Pour poursuivre l’isolement des véhicules électriques, pipettez le surnageant dans un nouveau tube de microcentrifugation de 1,5 mL. Remettre en suspension la pastille contenant les glandes salivaires (étape 6.2) dans 500 μL d’ARNi (voir tableau des matériaux) et conserver à -80 °C jusqu’à ce qu’elle soit utilisée ou indéfiniment.
REMARQUE: Ces glandes salivaires seront utilisées pour l’isolement des miARN à l’étape 8. - Centrifuger le surnageant à 2000 x g à 4 °C pendant 10 min pour éliminer les débris cellulaires. Pipeter le surnageant dans un nouveau tube de microcentrifugation de 1,5 mL. Jetez la pastille.
- Centrifuger le surnageant à 10 000 x g pendant 30 min à 4 °C pour éliminer les corps apoptotiques et les véhicules électriques plus gros. Mélanger la pastille et pipeter le surnageant dans un nouveau tube de microcentrifugeuse de 1,5 mL.
- Fixez une seringue de 10 mL à un filtre à seringue en nylon de 1 μm. Placez la seringue et le filtre au-dessus d’un tube ultracentrifuge (Figure 4A). Ajoutez ensuite l’échantillon (Figure 4B) et remplissez la seringue avec 10 mL de 1x PBS (Figure 4C), puis équilibrez le tube en conséquence (Figure 4D).
- Placer les tubes dans un rotor 70Ti (voir tableau des matériaux) et tourner à 100 000 x g pendant 18 h à 4 °C.
- Après 18 h d’ultracentrifugation, observez une pastille à l’extrémité inférieure du tube (Figure 5). La pastille est la vésicule extracellulaire concentrée.
- Retirez 90% à 100% du surnageant sans remettre la pastille EV en suspension. Remettez en suspension la pastille avec 1x PBS. Si tout le surnageant n’a pas pu être retiré, utilisez le surnageant restant pour remettre en suspension la pastille.
- Pipette 500 μL de la pastille EV/surnageant dans un filtre centrifuge de 300 K (voir Tableau des matériaux).
REMARQUE: Cela éliminera toutes les protéines non associées aux vésicules, les miARN et autres molécules, tandis que les vésicules ne passeront pas à travers le filtre. - Centrifuger à 8 000 x g pendant 10 min à température ambiante. Répétez l’étape 6.10 jusqu’à ce que toutes les pastilles/surnageants EV aient traversé le filtre.
- Ajouter 400 μL de PBS stérilisé 1x à la colonne et bien mélanger à l’aide d’une pipette pour éliminer les véhicules électriques fixés à la membrane. Mettez l’échantillon dans un tube de 1,5 mL sans DNase/RNase. Les échantillons peuvent être conservés à -80 °C indéfiniment ou jusqu’à ce qu’ils soient utilisés. Évitez la décongélation excessive des échantillons pour éviter la dégradation des échantillons.
REMARQUE: Placez les tubes sur la glace lorsqu’ils sont sortis de l’ultracentrifugeuse pour éviter la dégradation des véhicules électriques. L’échantillon final sera la pastille EV dans 400 μL de 1x PBS. 25 μL de cet échantillon seront utilisés pour l’analyse de suivi des nanoparticules (NTA, étape 7) et 375 μL pour l’isolement des miARN (étape 8).
7. Analyse de suivi des nanoparticules (NTA)
- Prélever 25 μL de l’échantillon final (étape 6.12) et ajouter 375 μL de 1x PBS.
- Chargez l’échantillon dilué dans une seringue sans aiguille de 1 mL et vissez hermétiquement sur la lentille optique du NTA.
- Ajustez les paramètres en conséquence et capturez des vidéos en fonction des préférences de réglage.
NOTE: Dans la présente étude, trois lectures de 60 s chacune ont été prises. Chaque lecture NTA représente une réplique technique. Différents échantillons provenant de l’alimentation des tiques pendant la même durée représentent des répliques biologiques individuelles. La caméra a été réglée au niveau 7 et le seuil de détection au niveau 5. - Estimez le nombre final de VE selon la formule suivante :
((concentration des VE de départ (facteur de dilution)) * (volume total restant dans le tube d’échantillonnage)/1000) = VE totaux dans l’échantillon
REMARQUE: Le volume doit être divisé par 1000 car le NTA lit les échantillons en concentration / mL.
8. Extraction du miARN des glandes salivaires et des vésicules extracellulaires
- Ajouter 100 μL du réactif de lyse (voir tableau des matériaux) à l’échantillon restant de l’étape 6.12 et homogénéiser avec des pilons stérilisés (figure 6).
- Ajouter les 600 μL restants du réactif de lyse et incuber pendant 5 min à température ambiante.
- Ajouter 140 μL de chloroforme, agiter vigoureusement pendant 15 s et incuber pendant 3 min à température ambiante.
- Tourner à 12 000 x g pendant 15 min à 4 °C.
- Pipeter la phase supérieure transparente, en évitant l’interphase, dans un nouveau tube de 1,5 mL. Il en résultera environ 525 μL de volume d’échantillon attendu. Ensuite, ajoutez un volume 1: 1 d’éthanol de qualité moléculaire à 100%.
- Ajouter 700 μL de l’échantillon dans une colonne de spin d’isolement de l’ARN (voir tableau des matériaux).
- Essorer à 8 000 x g pendant 30 s à température ambiante, jeter l’écoulement.
- Laver l’échantillon avec 700 μL de tampon RTE (voir tableau des matériaux), tourner à 8 000 x g pendant 30 s, jeter l’écoulement.
- Laver l’échantillon avec 500 μL de tampon RPE (voir tableau des matériaux), tourner à 8 000 x g pendant 30 s, jeter l’écoulement.
- Ajouter 500 μL d’éthanol de qualité moléculaire à 80 % et tourner à 8 000 x g pendant 2 min, éliminer le débit.
- Faites tourner la colonne à la vitesse maximale pendant 5 min pour sécher la membrane. Jetez le tube de collecte et placez la colonne sur un nouveau tube microfuge de 1,5 mL.
- Ajouter 14 μL d’eau sans RNase/DNase à la membrane et incuber pendant 5 min à température ambiante.
- Centrifuger à 21 000 x g pendant 1 min à température ambiante.
- Ajouter 1 μL d’inhibiteur de la RNase (voir tableau des matériaux) aux miARN élués et bien mélanger à l’aide d’une pipette.
REMARQUE: Avant l’extraction du miARN des glandes salivaires, retirez tout RNAlater en ajoutant 1 ml de PBS 1x (volume 1: 1) et faites tourner les glandes salivaires à la vitesse maximale pendant 15 min à 4 ° C. Cela doit être répété trois fois ou jusqu’à ce que les glandes salivaires se soient suffisamment calmées pour éliminer le surnageant. À ce stade, l’échantillon représente un mélange de petits ARN d’une taille d’environ 20 à 150 pb (figure supplémentaire 1).
9. Mesure de la concentration de miARN
- Mesurer la concentration de petit ARN à l’aide d’un kit d’analyse d’ARN41 disponible dans le commerce (voir tableau des matériaux).
- Dans chaque tube, mélanger 199 μL de tampon de dilution (composants A et B fournis dans le kit par échantillon), 1 μL de colorant fluorescent spécifique à la détection des miARN (longueur d’onde de mesure 260 nm) (par échantillon), et 2 μL de petit ARN (étape 8) pour chaque échantillon, selon les instructions du fabricant.
- Avant de lire les tubes d’échantillonnage, lisez les normes 1 et 2 de miARN pré-diluées (fournies dans le kit) pour créer une courbe standard avant la mesure de l’échantillon.
REMARQUE : Les étalons sont utilisés comme outil de comparaison pour déterminer la concentration mesurée de miARN dans les échantillons. - Placez chaque étalon et tube d’échantillonnage dans le fluoromètre dédié (voir tableau des matériaux) pour mesurer la concentration en ng/μL.
10. Détermination de la qualité du miARN
- Déterminer la qualité des miARN et d’autres petits ARN par électrophorèse sur gel à l’aide d’un bioanalyseur46, en suivant les instructions du fabricant (voir tableau des matériaux).
- Avant la lecture de l’échantillon, normalisez les échantillons pour qu’ils aient la même concentration.
- Lisez les échantillons à l’aide d’une petite puce à ARN 41,46, en suivant les instructions du fabricant (voir tableau des matériaux).
REMARQUE: Pour déterminer la qualité du miARN, les images de type gel (bandes) et les électrophérogrammes (pics) sont des indicateurs de la qualité de l’échantillon. Plus la bande dans le gel est foncée, meilleure est la qualité du miARN. Plus la bande est légère (ou si aucune bande n’est présente), plus la qualité ou la dégradation de l’échantillon est faible46,47.
11. enrichissement des microARN
- Enrichir le miARN à l’aide d’un petit kit de séquençage d’ARN, en suivant les instructions du fabricant du kit de préparation d’échantillons de petit ARN (voir tableau des matériaux).
- Ligaturez chaque échantillon avec un adaptateur adénylé de 3' et retirez l’adaptateur excédentaire via le nettoyage des billes. Ensuite, ajoutez un adaptateur 5' et retirez l’adaptateur excédentaire par un nettoyage deperle 48.
REMARQUE: Les adaptateurs et les billes pour le nettoyage ont été fournis dans le kit de séquençage de l’ARN de petite taille de la section 11.1 (voir la table des matériaux). - Pour synthétiser le premier brin, préparez un mélange maître des échantillons ligaturés avec les deux adaptateurs, le tampon RT et la transcriptase inverse M-MuLV fournis dans le kit (voir Tableau des matériaux). Ensuite, incuber le mélange pendant 30 min à 42 °C et 10 min à 90 °C. Faites un suivi avec un nettoyage d’échantillon comme indiqué dans les instructions.
- Amplifier le 1er brin à l’aide de l’apprêt AVANT RT et de l’apprêt universel inverse fournis dans le kit (voir Tableau des matériaux) via une réaction en chaîne par polymérase conventionnelle (PCR) pendant 2 min à 95 °C, puis pendant 12 à 25 cycles pendant 20 s à 95 °C, 30 s à 60 °C et 15 s à 72 °C. Enfin, 2 min à 72 °C.
REMARQUE : La taille du produit PCR devrait être d’environ 150 pb (Figure 7). - Mesurez la qualité du produit PCR via une station de bande en suivant les instructions du fabricant (voir tableau des matériaux).
- Séquencer les échantillons à l’aide d’un système de séquençage de nouvelle génération (75 cycles), en suivant les instructions du fabricant (voir la table des matériaux).
REMARQUE: Pour l’enrichissement en miARN, la quantité et la qualité de l’échantillon doivent être vérifiées (étapes 9 à 10) avant la préparation de la bibliothèque.
12. Analyse bioinformatique
- Identifiez les miARN conservés et uniques à l’aide d’un outil d’application intégré pour l’identification des miARN.
REMARQUE: Dans la présente étude, l’identification des miARN a été effectuée via miRDeep249,50. miRDeep2 est un catalogue en ligne gratuit de tous les miARN conservés et nouveaux identifiés trouvés dans diverses espèces49,50 (voir tableau des matériaux). - Alignez les lectures sur le génome correspondant à l’aide du mappeur intégré au logiciel.
- Entrez les paramètres suivants dans le module mappeur.
- Coupez les séquences d’adaptateur ajoutées à partir de l’étape 11.2 et supprimez les séquences de moins de 18 nucléotides de long. Supprimez les séquences de lecture redondantes.
- Convertissez les fichiers à l’aide du paramètre de format PARSe en FASTA, uniquement si le fichier n’est pas au format FASTA49.
- Alignez les séquences filtrées et découpées sur le génome correspondant. S’il n’y a pas de génome pour l’espèce d’intérêt, alignez-vous sur l’espèce homologue la plus proche.
- Affichez les fichiers de sortie comme « reads.fa » et « reads_vs_genome.arf ». Le « read.fa » ne contiendra que les lectures non redondantes, et le « reads_vs_genome.arf » inclura les lectures mappées alignées sur le génome.
- À l’aide des deux fichiers de sortie de l’étape 12.2, effectuez le profilage d’expression miRNA à l’aide du quantificateur intégré au logiciel.
- Téléchargez les séquences précurseurs de miARN d’intérêt et les séquences de miARN matures à partir de miRBase 51,52,53,54,55,56. S’il n’y a pas de précurseur ou de séquences matures pour les espèces d’intérêt, téléchargez les « hairpin.fa.gz » et « mature.fa.gz » qui contiennent tous les précurseurs et séquences matures pour tous les organismes disponibles sur miRBase.
- Décompressez les fichiers « hairpin.fa.gz » et « mature.fa.gz ».
- Entrez les fichiers « reads.fa » et « read_vs_genome.arf » de la section 12.3.4 et les fichiers non compressés de la section 12.4.2.
- Lisez les fichiers de sortie comme « outputname.csv »,"outputname.html », et « outputname.pdf ». Le nom du fichier de sortie peut être défini en fonction de l’enquêteur.
Remarque : Le fichier « outputname.csv » contiendra les profils d’expression. Plus précisément, le profil d’expression aura l’ID de miARN, la somme des lectures pour tous les échantillons mappés au miARN, le nombre de lectures mappées à un miARN spécifique pour chaque échantillon et l’ID de précurseur correspondant aux miARN matures. Le « outputname.html » de l’étape 12.4.4 contiendra les liens vers le navigateur de génome de l’Université de Santa Cruz (USCS), le National Center for Biotechnology Information (NCBI) et miRBase. L’USCS et le NCBI contiendront les séquences de requête des précurseurs actuels par rapport à la base de données de nucléotides non redondants, et miRBase aura les informations du précurseur actuel des miARN. Le « outputname.pdf » aura la structure secondaire de l’ARN des miARN qui sont exprimés et l’alignement de la séquence précurseur.
- Pour identifier les miARN uniques et conservés, utilisez miRDeep2.
- Utilisez les fichiers de sortie des étapes 12.3.4 et 12.4.2 comme fichiers d’entrée.
REMARQUE : Les fichiers de sortie qui se lisent comme « outputname .html » contiendront les prédictions des miARN uniques et conservés dans l’échantillon. - Utilisez les scores >1 pour le profilage des miARN et les scores >4 pour une analyse expérimentale plus approfondie, comme l’inhibition des miARN et l’imitation des miARN endogènes 34,36,57.
- Sélectionnez et identifiez les miARN uniques à partir de la miRbase en fonction des éléments suivants : score miRDeep2 (étape 12.5.3), estimation de la probabilité réelle (>90 %), valeur p significative du randfold (<0,05)49,50,56.
REMARQUE: L’analyse bioinformatique a été effectuée via miRDeep2 dans Cyverse Discovery Environment58,59, une plate-forme en ligne gratuite pour l’analyse bioinformatique. Les miARN conservés et uniques identifiés par miRDeep2 ont été comparés à toutes les espèces de la miRbase. L’identification future de miRDeep2 peut être comparée au génome correspondant de l’espèce d’intérêt.
- Utilisez les fichiers de sortie des étapes 12.3.4 et 12.4.2 comme fichiers d’entrée.
Résultats
Le présent protocole fournit une méthodologie détaillée pour extraire les miARN des glandes salivaires et des VE. Selon les résultats, ce protocole est efficace pour isoler les miARN des adultes de deux espèces de tiques différentes, I. scapularis et R. microplus, et peut également être utilisé chez d’autres espèces de tiques. La concentration des VE (particules/mL) a été mesurée par NTA. Pour R. microplus, chaque sexe et chaque étape de la vie contenaient trois répliques biologiques mesurées en trois répliques techniques. Les échantillons ont été séparés par sexe et par stade de vie (figure 8) pour montrer la variation au sein de chaque échantillon. Ensuite, les échantillons ont été combinés pour afficher la variation et les différences statistiques à l’aide d’une ANOVA bidirectionnelle et des tests de comparaison multiples de Tukey20 (valeur de p = < 0,05) (figure 9). Chaque échantillon se composait d’environ 40 glandes salivaires disséquées de 20 femelles, mâles et nymphes. Après l’isolement et la quantification des VE, les échantillons ont été utilisés pour la purification de petits ARN.
La concentration du petit ARN dans chaque échantillon a été mesurée via Qubit (tableau 1), et la qualité a été mesurée via un bioanalyseur en utilisant l’électrophorèse sur gel standard46,47. Les concentrations sont exprimées en nanogrammes (tableau 1) dans un volume de 14 μL pour les deux espèces de tiques. Le total moyen de petites concentrations d’ARN provenant des organes d’I. scapularis variait de 45,92 à 6 356 ng. La concentration d’ARN des vésicules d’I. scapularis variait de 72,24 à 2 128 ng. Pour R. microplus, la concentration dans les organes variait de 259 à 2 142 ng et les vésicules de 59,22 à 1 848 ng. Les échantillons ont été normalisés à la même concentration, et leur qualité a ensuite été mesurée à l’aide d’un bioanalyseur (figure 10). Une échelle de référence a été utilisée dans le gel comme marqueur pour l’évaluation de la qualité. L’intégrité, l’intensité et les pics de la bande étaient représentatifs de la dégradation potentielle ou de la concentration totale dans chaque échantillon. Des bandes correspondant à des ARN ribosomiques de 5 s et 5,8 s n’étaient présentes que dans les échantillons d’organes des glandes salivaires (Figure 10, voies A-D) et absentes dans la vésicule des échantillons de glandes salivaires (Figure 10, voies E,F), démontrant les différences dans les profils de petits ARN entre les organes et les vésicules extracellulaires. La dégradation de l’échantillon a été déduite par l’absence de bandes dans le gel; cela signifiait qu’il y avait une dégradation importante de l’échantillon. Il est recommandé de jeter tous les échantillons présentant une dégradation importante.
Pour démontrer la présence d’échantillons de miARN dans les préparations, de petites bibliothèques d’ADNc d’ARN ont été préparées à partir d’échantillons d’ARN qui ont été stockés pendant 3 à 4 mois après l’isolement de petits ARN. Curieusement, une dégradation plus élevée de l’échantillon a été trouvée dans ces échantillons. Les voies A-D et G montraient des signes de dégradation; au contraire, E, F et H-K ont montré une dégradation minimale et une concentration suffisante pour la préparation de la bibliothèque d’ADNc de miARN (figure supplémentaire 1). Un seul échantillon a été dégradé lorsque les échantillons ont été utilisés immédiatement après la purification (figure 10), ce qui suggère que les échantillons de miARN étaient plus sujets à la dégradation une fois qu’ils ont été purifiés des VE. Ainsi, les échantillons E, F, H et I ont été sélectionnés pour l’analyse d’enrichissement. Les astérisques indiquent les tailles de bande d’environ 150 pb, qui étaient les tailles attendues après la préparation de la bibliothèque d’ADNc (Figure 7). Les bandes faibles inférieures indiquent le dimère d’amorce.
Pendant l’isolement du VE, la vitesse et le temps de centrifugation peuvent affecter la concentration finale du VE. Lors du pipetage de la pastille EV dans les colonnes de 300 k, comme mentionné précédemment à l’étape 6.10, un faible volume et une faible vitesse sont essentiels pour empêcher les véhicules électriques de traverser la membrane. Des études antérieures ont montré que 700 μL à 12 000 x g pendant 20 min en utilisant un concentrateur centrifuge différent était suffisant pour séparer correctement les VE des protéines solubles20; cependant, de faibles concentrations de VE ont été affichées dans la NTA à l’aide d’un filtre différent. Ainsi, l’optimisation des filtres et autres matériaux disponibles est essentielle. Lors de la première utilisation des colonnes de 300 k, différents intervalles de vitesse ont été testés pour déterminer lequel donnait la concentration de VE la plus élevée. Le nombre de vésicules perdues pendant la centrifugation a été mesuré par analyse NTA; il a été conclu que des vitesses plus faibles entraînaient une concentration plus élevée des vésicules dans l’écoulement (non montré). Il a été conclu que 500 μL à 6 000-8 000 x g étaient satisfaisants pour isoler les VE. Une fois cela déterminé, ce protocole a été utilisé pour isoler les vésicules d’I. scapularis et de R. microplus. La concentration des vésicules isolées de chaque espèce de tique a été mesurée par NTA (Figure 8). Les concentrations de VE variaient entre 7,07 x 107 et 7,94 x 109 particules/mL. La quantité de VE était corrélée avec les concentrations de miARN, où la plus grande quantité de VE entraînait une concentration plus élevée de miARN extrait.
Figure 1: Seringues sans aiguille de 1 mL chargées d’I. scapularis adulte femelle et recouvertes de gaze stérilisée. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 2 : La face dorsale d’une femelle engorgée a été enlevée avec des ciseaux vannas de 4 mm. La femelle a été immergée dans 1x PBS pour empêcher la dessiccation des organes. Les flèches jaunes pointent vers les glandes salivaires exposées. La figure a été prise à un grossissement de 50x avec un objectif haute résolution. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Plaque de culture cellulaire après une incubation de 24 h à 32 °C. La première rangée de puits contient le milieu sans vésicules et les glandes salivaires disséquées. Le reste des puits contient 1x PBS avec rifampicine. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Procédé de préparation d’échantillons pour un cycle d’ultracentrifugation. (A) Une seringue sans aiguille de 10 mL surmontée d’un filtre à seringue de 1 μm. (B) Le surnageant après trois cycles de centrifugation est pipeté dans la seringue. (C) Le reste de la seringue est rempli à 10 mL avec 1x PBS stérilisé. (D) La seringue est recouverte et le surnageant avec 1x PBS est filtré dans le tube ultracentrifuge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 5: Après 18 h d’ultracentrifugation, une pastille de vésicules extracellulaires se forme au fond du tube ultracentrifugeux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6: Un pilon stérilisé est utilisé pour homogénéiser les organes des glandes salivaires et les vésicules extracellulaires. Veuillez cliquer ici pour voir une version plus grande de cette figure.
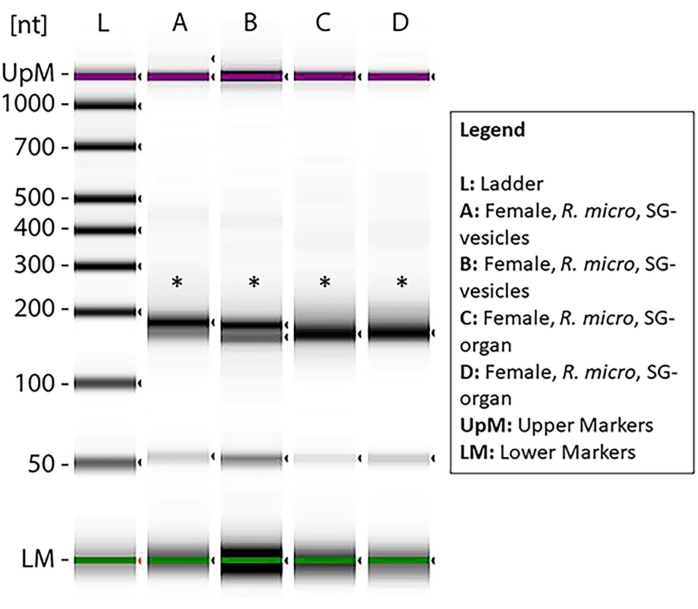
Figure 7 : Électrophorèse sur gel mesurée via une station de bande affichant les bibliothèques préparées de miARN après une analyse d’enrichissement. Les échantillons prélevés sur les organes des glandes salivaires R. microplus femelles et les VE étaient basés sur une dégradation minimale et une concentration suffisante de miARN pour la synthèse de la bibliothèque d’ADNc. L’échelle (L) montre les points de référence en nucléotides et les marqueurs supérieurs et inférieurs. Les astérisques indiquent les bandes de taille du produit ~150 bp, ce qui signifie les petites bibliothèques d’ADNc à ARN. Les bandes inférieures montrent le dimère d’apprêt. Veuillez cliquer ici pour voir une version agrandie de cette figure.
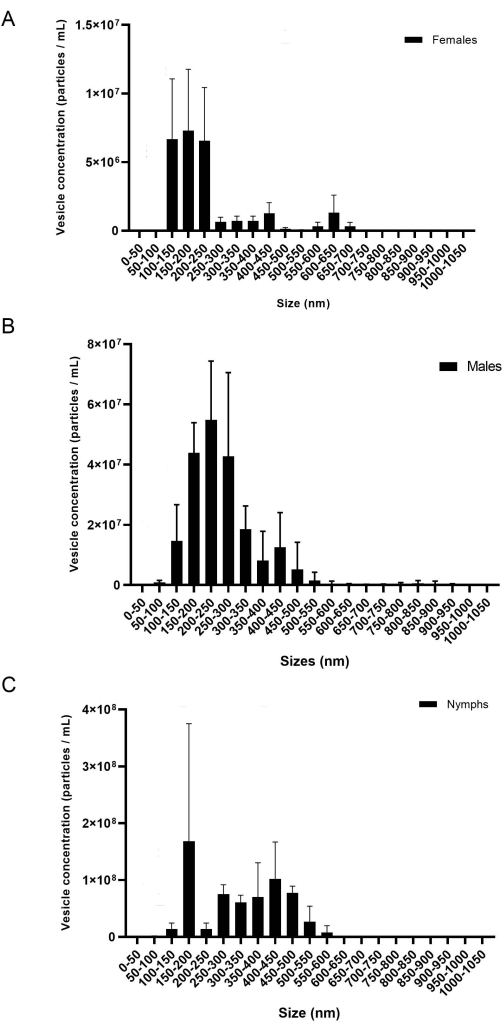
Figure 8 : Figure représentative de la variation entre les répliques biologiques (A) femelles, (B) mâles et (C) nymphes. L’axe des x indique la taille de l’EV (nm) et l’axe des y indique la concentration de VE (particules/mL). Un test de comparaison bidirectionnel ANOVA et Tukey a montré des différences statistiques (valeur P = < 0,05). Les barres d’erreur représentent l’erreur-type pour tenir compte de la variation. Chaque échantillon contenait 20 tiques avec trois répliques biologiques. Les échantillons ont été enregistrés pendant 60 s, trois fois chacun. La caméra a été réglée au niveau 7 et le seuil de détection au niveau 5. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9 : Figure représentative de la variation pour tous les réplicats biologiques combinés pour les nymphes (rouge), les femelles (bleu) et les mâles (noir). L’axe des x indique la taille de l’EV (nm) et l’axe des y affiche la concentration de VE (particules/mL). Un test de comparaison bidirectionnel ANOVA et Tukey a montré des différences statistiques (valeur P = < 0,05). Les barres d’erreur représentent l’erreur-type pour tenir compte de la variation. Chaque échantillon contenait 20 tiques avec trois répliques biologiques. Les astérisques symbolisent une différence significative de p < 0,05. Chaque enregistrement a été fait pendant 60 s, trois fois chacun. La caméra a été réglée au niveau 7 et le seuil de détection au niveau 5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
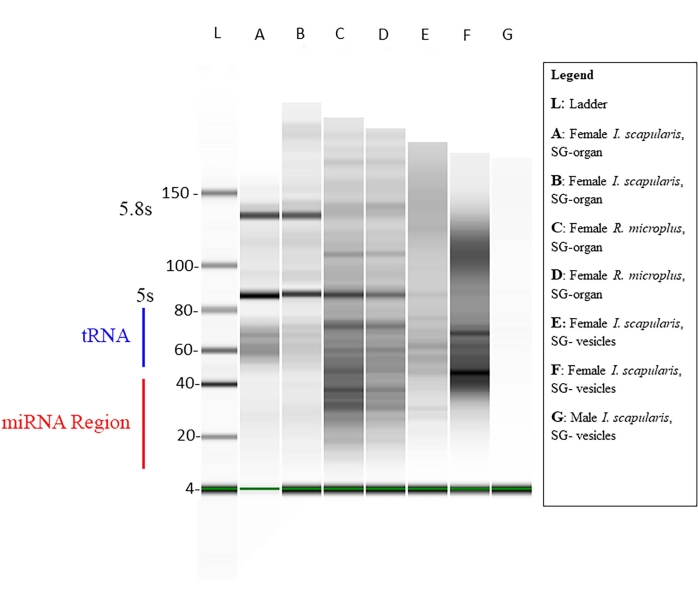
Figure 10 : Un gel représentatif via le bioanalyseur. L’électrophorèse sur gel a été réalisée à l’aide d’une échelle de base comme référence. Une séquence de miARN mature est d’environ 18-22 nt de long, où de faibles bandes sont montrées dans la plage de taille désignée. D’autres petits ARN, tels que les petits ARN nucléaires, les ARN messagers de transfert et les ARN régulateurs, sont également présents dans les échantillons. La taille des petits ARN variait de ~20-150 nt. Les échantillons varient selon les espèces de tiques, les tissus et le sexe. Pour la voie G, un exemple de dégradation de l’échantillon ne montre aucune bande. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Une électrophorèse sur gel a été mesurée à l’aide du bioanalyseur, montrant la qualité des miARN extraits des organes des glandes salivaires femelles R. microplus et des VE. L’échelle (L) montre les tailles de référence en nucléotides, où les miARN matures mesurent environ 18-22 nt de longueur. Les voies A-D et G montrent une dégradation, et les voies E, F et H-K montrent une dégradation minimale. Veuillez cliquer ici pour télécharger ce fichier.
| Espèce | Genre | Organe / Vésicule | Concentration de VE | concentration de miARN (ng) |
| R. microplus | Femelle | Organe | N/a | 259 |
| R. microplus | Femelle | Organe | N/a | 2,142 |
| R. microplus | Femelle | Vésicule | 1,64 E+08 | 59.22 |
| R. microplus | Femelle | Vésicule | 1,64 E+09 | 1,848 |
| I. scapularis | Femelle | Organe | N/a | 45.92 |
| I. scapularis | Femelle | Organe | N/a | 6,356 |
| I. scapularis | Femelle | Vésicule | 1,73E+08 | 65.66 |
| I. scapularis | Femelle | Vésicule | 3.14 E+09 | 2,128 |
Tableau 1 : Un exemple des concentrations de miARN pour les glandes salivaires et les vésicules extracellulaires. La colonne des concentrations de miARN représente les concentrations les plus faibles à les plus élevées pour chaque espèce de tique.
| microARN | I. scapularis | I. ricinus | R. microplus | H. longicornis | Références |
| miR-8 | Un | P | P | P | 33, 36, 37, 43 |
| miR-71 | P | P | P | Un | 33, 36, 37, 43 |
| miR-279 | P | Un | Un | P | 33, 36, 37, 43 |
| let-7 | Un | P | P | P | 33, 36, 37, 43 |
Tableau 2 : Les miARN conservés chez différentes espèces de tiques. (P) indique que les miARN ont été couramment exprimés ou présents, et (A) signifie que les miARN n’ont pas été couramment exprimés ou détectés.
| Type d’échantillon | Nombre de scores >1* | Nombre de scores >4γ | Nombre de conserves | Nombre de romans |
| Mâle | 17 | 0 | 48,885 | 23 |
| Femelle | 25 | 0 | 48,885 | 21 |
| Nymphes | 38 | 0 | 48,885 | 38 |
Tableau 3. Les miARN conservés et uniques ont été détectés dans les VE pour les femelles, les mâles et les nymphes de R. microplus. *score miRNA utilisé pour le profilage. γscore miARN utilisé pour les expériences fonctionnelles.
Tableau supplémentaire 1 : Tableau montrant les résultats du séquençage de nouvelle générationpour les VE mâles R. microplus sécrétés par les glandes salivaires. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 2 : Tableau montrant les résultats du séquençage de nouvelle générationpour les VE femelles R. microplus sécrétés par les glandes salivaires. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 3 : Tableau montrant les résultats du séquençage de nouvelle générationpour les VE nymphes R. microplus sécrétés par les glandes salivaires. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le protocole actuel fournit une méthodologie détaillée pour extraire les miARN des glandes salivaires et des VE. Cependant, il y a des considérations importantes, qui sont toutes détaillées dans les notes pour chaque section de ce protocole. La capsule et le filet en maille doivent être fixés pendant l’alimentation des tiques pour empêcher les tiques de s’échapper. La préparation et la mise en place de la capsule sont décrites dans Koga et al.40. Plusieurs répétitions des dissections de tiques doivent être effectuées si un échantillon inapproprié est jeté. En outre, plusieurs défis peuvent être présents lors de l’utilisation de techniques d’isolement EV à partir de tissu de tique 18,20,43. Par exemple, les tissus doivent être maintenus humides pendant la dissection pour éviter la dessiccation. Cela se fait en ajoutant PBS tout au long de la dissection. Le PBS et les milieux utilisés pour la dissection et la culture des organes doivent être maintenus avec des antibiotiques pour éviter la contamination bactérienne du microbiome des tiques. Ceux-ci devraient inclure des antibiotiques qui ciblent les bactéries Gram négatif et Gram positif, car les deux peuvent être trouvés dans les tissus à tiques60. De même, des précautions doivent être prises pendant la dissection pour diminuer la contamination par les tissus d’autres organes. Ainsi, les dissections doivent être effectuées lentement et, à mesure que l’utilisateur gagne en expérience, davantage de tiques peuvent être disséquées. Enfin, étant donné que les VE sont sécrétés par toutes les cellules, y compris les cellules infectées par des agents pathogènes, les études sur les tiques menant l’isolement des VE doivent utiliser des milieux et des tampons sans VE pour éviter la contamination croisée des VE25,61.
Néanmoins, ce protocole permet de réduire le nombre de tiques nécessaires à la production de veaux salivaires pour les tiques. Les protocoles précédents nécessitaient la salivation d’un nombre significativement plus important de tiques. Par exemple, les miARN sécrétés dans les VE salivaires chez Haemaphysalis longicornis nécessitaient la salivation de 2 000 tiques adultes43. Cela peut être extrêmement coûteux pour les laboratoires qui n’ont pas la capacité d’élever des tiques. De même, les tissus d’Amblyomma maculatum utilisés pour l’isolement ev ont été partiellement congelés avant l’isolement et traités avec 75 U/mL de collagénase de type 3, ce qui pourrait affecter l’authenticité de la sécrétionEV 19. De plus, ces études ont nécessité 80 à 100 paires de glandes salivaires18.
Comparativement, ce protocole peut être appliqué à plusieurs espèces de tiques et exige un faible nombre de tiques pour isoler les VE et extraire des miARN conservés et nouveaux (tableau 2)33,36,37,43. Les concentrations de miARN variaient considérablement, mais elles étaient suffisantes pour le séquençage de prochaine génération (tableau 3 et tableaux supplémentaires 1 à 3). Ce protocole peut être ajusté pour s’adapter à un échantillon de plus grande taille si des concentrations plus élevées de miARN sont nécessaires. En outre, les matériaux utilisés dans ce protocole sont substituables en fonction de la disponibilité des matériaux. Toutefois, les volumes d’échantillons et la vitesse de centrifugation doivent être ajustés en suivant les instructions du fabricant pour les kits et les colonnes utilisés.
Un inconvénient de cette méthode est que les miARN et les VE peuvent facilement se dégrader tout au long des étapes d’extraction et d’isolement. Par conséquent, le protocole doit être accompli rapidement et efficacement. Lorsqu’ils sont indiqués, les échantillons doivent être conservés sur de la glace et l’extraction du miARN doit être effectuée dans un environnement stérilisé. De plus, un traitement à la RNase peut être effectué sur les VE isolés pour éliminer les gros ARN attachés à la membrane EV. Cela peut empêcher les gros ARN de contaminer l’échantillon lors des extractions de miARN. Enfin, l’ajout d’un inhibiteur de l’ARNi à l’échantillon de miARN après isolement des VE ou des organes est une mesure préventive importante pour la dégradation. Ce protocole peut être modifié et appliqué parallèlement aux objectifs de l’expérience en cours.
Les applications futures de ce protocole pourraient inclure l’étude des interactions pathogènes-vecteurs pour comprendre comment les agents pathogènes affectent le miARN et d’autres cargaisons génomiques dans les VE salivaires des tiques. De même, ce protocole peut définir des protéines et des processus cellulaires spécifiques impliqués dans l’emballage des miARN dans les VE des tiques, et l’effet spécifique de ces VE et miARN sur la cicatrisation des plaies et les réponses immunitaires. En raison de la résistance croissante des tiques aux acaricides, il existe un besoin désespéré de méthodes de contrôle uniques. Les véhicules électriques ont le potentiel d’une méthode de contrôle alternative par rapport aux acaricides. Les véhicules électriques peuvent être utilisés comme nanotransporteurs dans des applications thérapeutiques 18,23,61. Chez l’homme, les VE transportant des miARN ont été utilisés pour supprimer la croissance tumorale pendant l’immunothérapie du cancer62,63. De même, chez les tiques, les VE peuvent être porteurs de miARN génétiquement modifiés dont il a été démontré qu’ils affectent les fonctions biologiques vitales des tiques et la transmission d’agents pathogènes 36,57,64. L’orientation future est d’utiliser ce protocole pour déterminer les profils de miARN de plusieurs espèces de tiques afin d’identifier les miARN d’intérêt pour les études fonctionnelles.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous sommes très reconnaissants de l’aide du Cattle Fever Tick Laboratory à Edinburg, au Texas. Nous tenons à remercier Michael Moses, Jason Tidwell, James Hellums, Cesario Agado et Homer Vasquez. Nous tenons également à remercier Sarah Sharpton, Elizabeth Lohstroh, Amy Filip, Kelsey Johnson, Kelli Kochcan, Andrew Hillhouse, Charluz Arocho Rosario et Stephanie Guzman Valencia tout au long du projet. Nous tenons à remercier le Texas A&M Aggie Women in Entomology (AWE) Writing Group pour son aide et ses conseils lors de la rédaction de ce manuscrit. Les réactifs suivants ont été fournis par les Centers for Disease Control and Prevention pour distribution par BEI Resources, NIAID, NIH: Ixodes scapularis Adult (Live), NR-42510. Des tiques femelles I. scapularis ont également été reçues du Tick Rearing Facility de l’Oklahoma State University. Ce projet a été financé par texas a &M University T3: triades pour la subvention de transformation et l’accord de coopération n ° 58-3094-1-003 par l’USDA-ARS à AOC.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | GenClone | 25-240 | |
| 1 µm nylon syringe filter | Tisch Scientific | 283129028 | |
| 1 inch black adhesive | Amazon | B00FQ937NM | Capsule |
| 10 mL needeless syringe | Exelint | 26265 | |
| 3' and 5' Adapters | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| 4 mm vannas scissors | Fine Science Tools | 15000-08 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid | Sigma-Aldrich | 1.1523 | |
| 70Ti rotor | Beckman Coulter | 337922 | |
| Amphotericin | Corning | 30-003-CF | |
| Beads | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Bioanalyzer | Agilent | G2939BA | |
| Bioanalyzer kit | Agilent | 5067-1513 | |
| Centrifuge 5425 | Eppendorf | ||
| Chloroform | Macron | UN1888 | |
| Cyverse Discovery Enviornment | https://cyverse.org/discovery-environment | ||
| Dissecting microscope | Nikon | SMZ745 | |
| Double-sideded carpet tape | amazon | 286373 | |
| Falcon Tubes, 50 mL | VWR | 21008-940 | |
| Fetal Bovine Serum | Gibco | FBS-02-0050 | |
| fine forceps | Excelta | 5-S-SE | |
| Foamies, 2 mm | Amazon | B004M5QGBQ | Capsule |
| Isoflurane | Phoenix Pharmaceuticals manfactured | 193.33165.3 | |
| Ixodes scaplaris | CDC, Oklahoma State University | ||
| L15C300 medium | In-lab | ||
| lipoprotein-cholesterol concentrate | MPI | 02191476-CF | |
| Microscope slide | VWR | 10118-596 | |
| miRDeep2 | https://github.com/rajewsky-lab/mirdeep2 | ||
| M-MuLV Reverse Transcriptase | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| molecular grade ethanol | Fischer Bioreagents | UN1170 | |
| multi-well 24 well tissue culture treated plate | Corning | 353047 | |
| Nanopaticle Tracking Analyzer machine | Malvern Panalytical | ||
| Nanosep with 300K Omega filter | Pall Corporation | OD3003C33 | |
| NEXTFLEX Small RNA-Seq Kit v3 | PerkinElmer | ||
| NextSeq 500/550 High Output Kit (75 cycles) | Illumina | 20024906 | |
| Optima XPN 90 Ultracentrifuge | Beckman Coulter | ||
| Penicillin | Thermofischer Scientific | ICN19453780 | |
| Pippettes | Ependorff | ||
| polycarbonate centrifuge bottle | Beckman Coulter | 355618 | |
| Qiagen miRNeasy kit | Qiagen | 217084 | |
| QIAzol lysis reagent | Qiagen | 79306 | |
| Qubit | Thermofisher | Q32880 | |
| Qubit kit | Thermofisher | Q10212 | |
| Rabbits | Charles River | ||
| Reverse Universal Primer | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Rhipicephalus microplus | Cattle Fever Tick Research Labratoty | ||
| Rifampicin | Fischer Bioreagents | 215544 | |
| RNAlater | Invitrogen | 833280 | |
| RNAse free tubes | VWR | 87003294 | |
| RNAse inhibitor | Thermo Fischer | 11111729 | |
| RNAse/DNAse free water | Qiagen | 217084 | |
| RNeasy Minelute spin column | Qiagen | 217084 | Qiagen miRNeasy kit |
| RPE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| RT Buffer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RT Forward Primer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RTE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| Sodium bicarbonate | Sigma-Aldrich | S6014-25G | |
| Sorvall ST16 | Thermo Fischer | 75004380 | |
| Sterilized Gauze sponges | Covidien | 2187 | |
| Sterilized PBS | Sigma | RNBK0694 | |
| streptomycin | thermofischer Scientific | 15240062 | |
| TapeStation | Aligent | G2991BA | |
| Tear Mender Instant Fabric and Leather Adhesive | Amazon | 7.42836E+11 | Capsule |
| Tissue Adhesive | 3M VetBond | ||
| Triple Antibiotics | dechra | 17033-122-75 | |
| Tryptose phosphate broth | BD | BD 260300 |
Références
- Jongejan, F., Uilenberg, G. The global importance of ticks. Parasitology. 129, 3-14 (2004).
- Anderson, J. F., Magnarelli, L. A. Biology of ticks. Infectious Disease Clinics of North America. 22 (2), 195-215 (2008).
- de la Fuente, J. Controlling ticks and tick-borne diseases… looking forward. Ticks and Tick-Borne Diseases. 9 (5), 1354-1357 (2018).
- Nicholson, W. L., Sonenshine, D. E., Noden, B. H., Brown, R. N. Ticks (Ixodia). Medical and Veterinary Entomology. , 603-672 (2019).
- Guerrero, F. D., Lovis, L., Martins, J. R. Acaricide resistance mechanisms in Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitologia Veterinária. 21 (1), 1-6 (2012).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: the state of play. Veterinary Parasitology. 203 (1-2), 6-20 (2014).
- Redshaw, N., et al. A comparison of miRNA isolation and RT-qPCR technologies and their effects on quantification accuracy and repeatability. Biotechniques. 54 (3), 155-164 (2013).
- Estrada-Peña, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Experimental and Applied Acarology. 23 (9), 685-715 (1999).
- Eisen, R. J., Eisen, L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology. 34 (4), 295-309 (2018).
- Bowman, A. S., Sauer, J. R. Tick salivary glands: function, physiology and future. Parasitology. 129, 67 (2004).
- Kim, D., Maldonado-Ruiz, P., Zurek, L., Park, Y. Water absorption through salivary gland type I acini in the blacklegged tick, Ixodes scapularis. PeerJ. 5, 3984 (2017).
- Nunes, P. H., Bechara, G. H., Camargo-Mathias, M. I. Morphological changes in the salivary glands of Amblyomma cajennense females (Acari: Ixodidae) in different feeding stages on rabbits at first infestation. Experimental and Applied Acarology. 45 (3), 199-209 (2008).
- Bishop, R., et al. A cement protein of the tick Rhipicephalusappendiculatus, located in the secretory e cell granules of the type III salivary gland acini, induces strong antibody responses in cattle. International Journal for Parasitology. 32 (7), 833-842 (2002).
- Yamaji, K., et al. A salivary cystatin, HlSC-1, from the ixodid tick Haemaphysalis longicornis play roles in the blood-feeding processes. Parasitology Research. 106 (1), 61-68 (2009).
- Simo, L., Kazimirova, M., Richardson, J., Bonnet, S. I. The essential role of tick salivary glands and saliva in tick feeding and pathogen transmission. Frontiers in Cellular and Infection Microbiology. 7, 281 (2017).
- Perner, J., Kropáčková, S., Kopáček, P., Ribeiro, J. M. C. Sialome diversity of ticks revealed by RNAseq of single tick salivary glands. PLoS Neglected Tropical Diseases. 12 (4), 0006410 (2018).
- Madden, R. D., Sauer, J. R., Dillwith, J. W. A proteomics approach to characterizing tick salivary secretions. Experimental and Applied Acarology. 32 (1), 131-141 (2004).
- Zhou, W., et al. Discovery of exosomes from tick saliva and salivary glands reveals therapeutic roles for CXCL12 and IL-8 in wound healing at the tick-human skin interface. Frontiers in Cell and Developmental Biology. 8, 554 (2020).
- Zhou, W., et al. Exosomes serve as novel modes of tick-borne flavivirus transmission from arthropod to human cells and facilitates dissemination of viral RNA and proteins to the vertebrate neuronal cells. PLoS Pathogens. 14 (1), 1006764 (2018).
- Chávez, A. S. O., et al. Tick extracellular vesicles enable arthropod feeding and promote distinct outcomes of bacterial infection. Nature Communications. 12 (1), 1-17 (2021).
- Pegtel, D. M., Gould, S. J. Exosomes. Annual Review of Biochemistry. 88, 487-514 (2019).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Théry, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nature Cell Biology. 21 (1), 9-17 (2019).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. A. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213 (2018).
- Gioseffi, A., Edelmann, M. J., Kima, P. E. Intravacuolar pathogens hijack host extracellular vesicle biogenesis to secrete virulence factors. Frontiers in Immunology. 12, 662944 (2021).
- Chávez, A. S. O., O'Neal, A. J., Santambrogio, L., Kotsyfakis, M., Pedra, J. H. F. Message in a vesicle-trans-kingdom intercommunication at the vector-host interface. Journal of Cell Science. 132 (6), 224212 (2019).
- Janas, T., Janas, M. M., Sapoń, K., Janas, T. Mechanisms of RNA loading into exosomes. FEBS Letters. 589 (13), 1391-1398 (2015).
- Lu, T. X., Rothenberg, M. E. MicroRNA. Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- Pegtel, D. M., et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences. 107 (14), 6328-6333 (2010).
- Bartel, D. P. MicroRNAs: target recognition and regulatory functions. Cell. 136 (2), 215-233 (2009).
- Ambros, V. MicroRNAs and developmental timing. Current Opinion in Genetics and Development. 21 (4), 511-517 (2011).
- Bushati, N., Cohen, S. M. microRNA functions. Annual Review of Cell and Developmental Biology. 23, 175-205 (2007).
- Hackenberg, M., Langenberger, D., Schwarz, A., Erhart, J., Kotsyfakis, M. In silico target network analysis of de novo-discovered, tick saliva-specific microRNAs reveals important combinatorial effects in their interference with vertebrate host physiology. RNA. 23 (8), 1259-1269 (2017).
- Luo, J., et al. MicroRNA-1 promotes the development of and prolongs engorgement time in Hyalomma anatolicum anatolicum (Acari: Ixodidae) ticks. Biorxiv. , (2020).
- Zhou, J., Zhou, Y., Cao, J., Zhang, H., Yu, Y. Distinctive microRNA profiles in the salivary glands of Haemaphysalis longicornis related to tick blood-feeding. Experimental and Applied Acarology. 59 (3), 339-349 (2013).
- Hermance, M. E., Widen, S. G., Wood, T. G., Thangamani, S. Ixodes scapularis salivary gland microRNAs are differentially expressed during Powassan virus transmission. Scientific Reports. 9 (1), 1-17 (2019).
- Barrero, R. A., et al. Evolutionary conserved microRNAs are ubiquitously expressed compared to tick-specific miRNAs in the cattle tick Rhipicephalus (Boophilus) microplus. BMC Genomics. 12 (1), 1-17 (2011).
- Colombo, M., et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. Journal of Cell Science. 126 (24), 5553-5565 (2013).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. . Proteomic Profiling. , 179-209 (2015).
- Koga, K., et al. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Research. 25, 3703-3707 (2005).
- Wright, K., de Silva, K., Purdie, A. C., Plain, K. M. Comparison of methods for miRNA isolation and quantification from ovine plasma. Scientific Reports. 10 (1), 1-11 (2020).
- Mráz, M., Malinova, K., Mayer, J., Pospisilova, S. MicroRNA isolation and stability in stored RNA samples. Biochemical and Biophysical Research Communications. 390 (1), 1-4 (2009).
- Nawaz, M., et al. miRNA profile of extracellular vesicles isolated from saliva of Haemaphysalis longicornis tick. Acta Tropica. 212, 105718 (2020).
- Ribeiro, J. M. C., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva. Medical and Veterinary Entomology. 18 (1), 20-24 (2004).
- Almazán, C., et al. A versatile model of hard tick infestation on laboratory rabbits. Journal of Visualized Experiments. (140), e57994 (2018).
- Masotti, A., Preckel, T. Analysis of small RNAs with the Agilent 2100 Bioanalyzer. Nature Methods. 3 (8), 658 (2006).
- Benesova, S., Kubista, M., Valihrach, L. Small RNA-sequencing: approaches and considerations for miRNA analysis. Diagnostics. 11 (6), 964 (2021).
- Mackowiak, S. D. Identification of novel and known miRNAs in deep-sequencing data with miRDeep2. Current Protocols in Bioinformatics. 36 (1), 12 (2011).
- Friedländer, M. R., Mackowiak, S. D., Li, N., Chen, W., Rajewsky, N. miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades. Nucleic Acids Research. 40 (1), 37-52 (2012).
- Griffiths-Jones, S. The microRNA registry. Nucleic Acids Research. 32, 109-111 (2004).
- Griffiths-Jones, S., Grocock, R. J., Van Dongen, S., Bateman, A., Enright, A. J. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research. 34, 140-144 (2006).
- Griffiths-Jones, S., Saini, H. K., Van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucleic Acids Research. 36, 154-158 (2007).
- Kozomara, A., Birgaoanu, M., Griffiths-Jones, S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 47, 155-162 (2019).
- Kozomara, A., Griffiths-Jones, S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Research. 39, 152-157 (2011).
- Kozomara, A., Griffiths-Jones, S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Research. 42, 68-73 (2014).
- Wu, F., et al. MicroRNA let-7 regulates the expression of ecdysteroid receptor (ECR) in Hyalomma asiaticum (Acari: Ixodidae) ticks. Parasites and Vectors. 12 (1), 1-13 (2019).
- Goff, S. A., et al. The iPlant collaborative: cyberinfrastructure for plant biology. Frontiers in Plant Science. 2, 34 (2011).
- Merchant, N., et al. The iPlant collaborative: cyberinfrastructure for enabling data to discovery for the life sciences. PLoS Biology. 14 (1), 1002342 (2016).
- Kumar, D., et al. An exploratory study on the microbiome of northern and southern populations of Ixodes scapularis ticks predicts changes and unique bacterial interactions. Pathogens. 11 (2), 130 (2022).
- Zhang, Y., et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. International Journal of Nanomedicine. 15, 6917 (2020).
- Di Leva, G., Croce, C. M. miRNA profiling of cancer. Current Opinion in Genetics and Development. 23 (1), 3-11 (2013).
- Ganju, A., et al. miRNA nanotherapeutics for cancer. Drug Discovery Today. 22 (2), 424-432 (2017).
- Luo, J., et al. MicroRNA-1 Expression and Function in Hyalomma Anatolicum anatolicum (Acari: Ixodidae) Ticks. Frontiers in Physiology. 12, 596289 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon