Method Article
Isolierung von microRNAs aus Zecken-Ex-vivo-Speicheldrüsenkulturen und extrazellulären Vesikeln
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Isolierung von microRNAs aus Zeckenspeicheldrüsen und gereinigten extrazellulären Vesikeln. Dies ist ein universelles Verfahren, das häufig verwendete Reagenzien und Verbrauchsmaterialien kombiniert. Die Methode ermöglicht auch die Verwendung einer kleinen Anzahl von Zecken, was zu hochwertigen microRNAs führt, die leicht sequenziert werden können.
Zusammenfassung
Zecken sind wichtige Ektoparasiten, die mehrere Krankheitserreger übertragen können. Die Speicheldrüsen von Zecken sind für die Fütterung unerlässlich, da ihr Speichel viele Effektoren mit pharmazeutischen Eigenschaften enthält, die die Immunantwort des Wirts verringern und die Übertragung von Krankheitserregern verbessern können. Eine Gruppe solcher Effektoren sind microRNAs (miRNAs). miRNAs sind kurze nicht-kodierende Sequenzen, die die Expression von Wirtsgenen an der Zecken-Wirt-Grenzfläche und in den Organen der Zecke regulieren. Diese kleinen RNAs werden im Zeckenspeichel über extrazelluläre Vesikel (EVs) transportiert, die der inter- und intrazellulären Kommunikation dienen. Vesikel, die miRNAs enthalten, wurden im Speichel von Zecken identifiziert. Über die Rollen und Profile der miRNAs in Zeckenspeichelbläschen und -drüsen ist jedoch wenig bekannt. Darüber hinaus erfordert die Untersuchung von Vesikeln und miRNAs im Zeckenspeichel langwierige Verfahren, um Zeckenspeichel zu sammeln. Dieses Protokoll zielt darauf ab, eine Methode zur Isolierung von miRNAs aus gereinigten extrazellulären Vesikeln zu entwickeln und zu validieren, die von Ex-vivo-Organkulturen produziert werden. Die Materialien und die Methodik, die benötigt werden, um miRNAs aus extrazellulären Vesikeln und Zeckenspeicheldrüsen zu extrahieren, werden hierin beschrieben.
Einleitung
Zecken sind Ektoparasiten, die viele Krankheitserreger auf Wildtiere, Nutztiere, Menschen und ihre Haustiere übertragen 1,2. Die Fütterung von Zecken führt zu erheblichen wirtschaftlichen Verlusten, indem sie die Haut schädigt, das Gewicht und die Milchproduktion aufgrund schwerer Anämie reduziert und potenziell tödliche krankheitserregende Krankheitserregerüberträgt 1,3,4,5. Die derzeitigen Kontrollpraktiken für das Management von Zeckenpopulationen konzentrieren sich auf den Einsatz von Akariziden. Dennoch haben das kontinuierliche Auftreten von Akarizidresistenzen bei Zecken, die Nutztiereparasitieren 5,6, die erhöhte Inzidenz von Zeckenstichen7 und die Übertragung von Krankheitserregern in Wohngebieten 8,9 zu einem Bedarf an einzigartigen Zeckenbekämpfungsalternativen geführt.
Die Zeckenspeicheldrüsen sind essentielle Organe, die den biologischen Erfolg einer Zecke sicherstellen. Sie werden von verschiedenen Acinus-Typen (I, II, III und IV) mit verschiedenen physiologischen Funktionen gebildet. Die Speicheldrüsen sind für die Osmoregulation, sowohl außerhalb als auch auf dem Wirt, verantwortlich, indem sie dem Wirt über Speichelfluss Wasserüberschuss und Eisengehalt zurückgeben 2,10. Typ-I-Acini sind auch an der Aufnahme von Wasser aus der Atmosphäre durch die Sekretion von hygroskopischem Speichelbeteiligt 10,11. Speicheleffektorproteine wie Zement und Cystatine werden in sekretorischen Zellen in Typ-II- und III-Acini10,12 produziert. Typ-I-Acini haben keinen Einfluss auf die Zeckenfütterung, was darauf hindeutet, dass die Blutmahlzeitenaufnahme keine morphologischen und physiologischen Veränderungen bei diesen Acini Typ13,14 auslöst. Auf der anderen Seite werden Acini Typ II und III während der Fütterung aktiviert und zeigen sehr wenig Aktivität vor der Befestigung. Daher ist die Fütterung notwendig, um die Vergrößerung der sekretorischen Zellen innerhalb von Typ-II-Acini und die Produktion bioaktiver Verbindungen auszulösen. Typ-III-Acini werden während der Fütterung aufgrund der Sekretion im sekretorischen Granulat12 verkleinert.
Die Speicheldrüsen sind auch der Ort der Erregerinfektion in der Zecke und im Übertragungsweg. Während der Fütterung sezernieren Zecken mehrere Verbindungen mit pharmazeutischer Wirkung, die für einen erfolgreichen Abschluss der Blutmahlzeitbenötigt werden 10,15,16. Diese Verbindungen haben entzündungshemmende, immunsuppressive und vasodilatatorische Eigenschaften10,15,17. Neuere Studien haben gezeigt, dass extrazelluläre Vesikel (EVs), die aus Zeckenspeicheldrüsen gewonnen werden, mehrere dieser Verbindungen beherbergen und entzündungshemmende und immunmodulatorische Wirkungen induzieren18,19,20. "Extrazelluläre Vesikel" ist ein Überbegriff, der verwendet wird, um Vesikel zu beschreiben, die aufgrund ihrer Größe und Biogenese als Exosomen und Mikrovesikel klassifiziert werden. Insgesamt sind EVs Lipidblebs mit zweischichtigen Membranen, die ~ 40 nm-1 μm in Größe21 sind; Im Allgemeinen werden Exosomen als 40-150 nm groß beschrieben, während Mikrovesikel zwischen 150 nm-1 μm in der Größe21,22,23 liegen. Die Größe ist jedoch kein Hinweis auf den Biogeneseweg der EVs22.
Die Biogenese von Exosomen beginnt mit der sequentiellen Invagination der Plasmamembran. Diese Invagination führt zur Bildung von multivesikulären Körpern und führt schließlich zur Verformung der vesikulären Membran durch die Wirkung von ESCRT-Komplexen oder Sphingomyelinasen (sMases)24,25. Die Exosomen können entweder innerhalb der Lysosomen lysiert werden, um die zelluläre Homöostase aufrechtzuerhalten, oder durch vesikuläre Fusion in die Plasmamembran austreten, um zelluläre Bestandteile an die Empfängerzellen zu liefern21,24. Auf der anderen Seite werden Mikrovesikel durch die Wirkung von Flopassen und Flipassen gebildet, wodurch die Konformation von Lipiden in der Plasmamembran26 verändert wird. EVs sind essentiell für die Zell-zu-Zell-Kommunikation und dienen als Transportsystem für intrazelluläre Fracht wie Lipide, Proteine, Nukleinsäuren und microRNAs (miRNAs)21,27,28. Nach dem Transport geben diese Vesikel ihre Fracht in das Zytoplasma der Empfängerzellen ab und erzeugen phänotypische Veränderungen in der aufnehmenden Zelle22,29. Aufgrund der Bedeutung extrazellulärer Vesikel bei der Zeckenfütterung und der Manipulation der Immun- und Wundheilungsreaktionen des Wirts18,20 bietet die Ladung in extrazellulären Vesikeln potenzielle Ziele für die Entwicklung von Anti-Zecken-Therapeutika und einen einzigartigen Mechanismus zur Störung der Zeckenfütterung. Dazu gehören miRNAs in Zeckenspeicheldrüsen und aus Speicheldrüsen gewonnene extrazelluläre Vesikel.
miRNAs sind kurze, nicht-kodierende Sequenzen, ~ 18-22 Nukleotid (nt) lang, die mRNA-Sequenzen30,31 posttranskriptionell regulieren, abbauen oder zum Schweigen bringen können. Während der Transkription werden die pri-miRNAs von Dicer (RNA-Polymerase III) gespalten, um eine unverwechselbare Haarnadel-ähnliche Struktur zu bilden, die zu einer Pre-miRNA wird. Die Pre-miRNA wird erneut durch Drosha (RNA-Polymerase III) geschnitten, um einen reifen miRNA-Duplex zu bilden. Die ausgereifte Sequenz wird komplementär zur mRNA-Sequenz in den RNA-induzierten Silencing-Komplex (RISC) integriert, was zu einer Translationsrepression oder einem mRNA-Abbauführt 28,30,32. Während der Wirtsfütterung können miRNAs im Zeckenspeichel die Expression des Wirtsgens modulieren, um Immunantworten zu unterdrücken und die Erregerübertragungzu verbessern 33,34,35,36,37. Obwohl umfangreiche Studien zu EVs und miRNAs existieren, sind ihre Rollen während der Fütterung an der Zecken-Wirt-Schnittstelle noch wenig verstanden. Die Optimierung von Protokollen, die leicht zur Isolierung und Aufreinigung hochwertiger miRNAs führen können, ist entscheidend für die Weiterentwicklung unseres Wissens zu diesen Themen.
Zur Isolierung von Elektrofahrzeugen können mehrere Optionen verwendet werden, z. B. Ultrazentrifugation, Exosomenfällung, Polymerausfällung, Immunaffinitätschromatographie und größenbasierte Ausschlusstechniken38. Diese Techniken können jedoch nicht zwischen Exosomen oder Mikrovesikeln unterscheiden. Wie bereits erwähnt, wird EV als Oberbegriff verwendet, wenn Elektrofahrzeuge von verschiedenen Proben isoliert werden. Die in den hierin beschriebenen Experimenten isolierten Vesikel stellen eine Mischung von Vesikeln dar, die aus verschiedenen Biogenesewegen stammen. Eine weitere Aufreinigung einer spezifischen Population extrazellulärer Vesikel kann durch Immunpräzipitation unter Verwendung von Kügelchen erreicht werden, die mit Antikörpern gegen Marker (d.h. exosomale Marker, Tumormarker) beschichtet sind, die für die für die interessierende Vesikelpopulationeinzigartig sind 39,40. miRNAs können auch über verschiedene kommerziell erhältliche Isolationskits 7,41,42 extrahiert werden.
Ziel dieses Projekts war es, ein Protokoll zu entwickeln, das häufig angewandte Methoden zur Isolierung von EVs und zur Extraktion von miRNA sowohl aus EVs als auch aus Speicheldrüsen kombiniert. Da die Sekretion bioaktiver Verbindungen durch Fütterungvon 12 aktiviert wird, sollten Zecken gefüttert werden dürfen, um miRNAs zu identifizieren, die für die Manipulation der Immun- und Wundheilungsreaktionen des Wirts wichtig sein können. Das vorliegende Protokoll erfordert eine kleine Anzahl von Zecken (20 Zecken), um EVs und ihre jeweiligen miRNAs zu isolieren, verglichen mit anderen zuvor beschriebenen Studien, die 2000 Zecken43 erforderten. Darüber hinaus vermeidet es die Kontamination von Speichelsekreten mit Pilocarpin44, was Experimente beeinflussen könnte, die die Wirkung von EVs und ihren miRNAs auf Wirtszellen untersuchen.
Protokoll
Alle Tierversuche wurden nach dem Tiernutzungsprotokoll (AUP # 2020-0026) durchgeführt, das vom Institutional Animal Care and Use Committee (AICUC) der Texas A & M University genehmigt wurde. Die Zeckenarten, Ixodes scapularis und Rhipicephalus (Boophilus) microplus, sowie neuseeländische männliche weiße Kaninchen, 42-72 Tage alt, wurden für die vorliegende Studie verwendet. I. scapularis wurde vom Center for Disease Control (CDC) und der Oklahoma State University als pathogenfrei zertifiziert. R. microplus wurde im Cattle Fever Tick Research Laboratory in Edinburg, Texas, aufgezogen. Die Kaninchen wurden aus kommerziellen Quellen gewonnen (siehe Materialtabelle). Dieses Protokoll kann extrazelluläre Vesikel und miRNAs universell aus verschiedenen Zeckenarten, Lebensstadien und Geweben isolieren.
1. Aufzucht von Weibchen I. scapularis und Kapselvorbereitung
- Bereiten Sie eine Ethylen-Vinylacetat-Schaumkapsel nach den Verfahren für harte Zecken vor, die Kaninchenfüttern 45. Legen Sie eine Kapsel auf jedes Schulterblatt des Kaninchens für insgesamt zwei Kapseln pro Befall.
HINWEIS: Kurz gesagt, diese Kapseln bestehen aus zwei Quadraten aus Ethylen-Vinylacetat-Schaum mit einem leeren Innenraum. Ein Quadrat wird mit einem Gewebekleber auf den Rücken des Tieres (in diesem Fall Kaninchen) geklebt (siehe Materialtabelle). Feines Netz wird auf das zweite Quadrat geklebt, um das Entweichen von Zecken zu vermeiden. Die beiden Quadrate werden mit selbstklebendem Hakenband verschlossen. - Lassen Sie die Kapseln 24 h einwirken, bevor Sie die Kapsel auf die Kaninchen kleben. Lagern Sie die Schaumstoffkapseln bei Raumtemperatur.
HINWEIS: Die Kapseln können unbegrenzt bei Raumtemperatur gelagert werden. - Kleben Sie die Kapsel an rasierte Kaninchen und lassen Sie sie 24 Stunden vor Zeckenbefall stehen.
2. Aufbereitung von vesikelfreien Medien
- Zur Herstellung von vesikelfreien Medien13 kombinieren Sie 0,5 ml fetales Rinderserum, 0,5 ml Tryptosephosphatbrühe, 0,1 ml 10% Lipoprotein-Cholesterin-Konzentrat, 0,5 ml 5% Natriumbicarbonat (NaHCO 3), 0,25 ml 4-(2-hydroxyethyl)-1-piperazinethansulfonsäure (HEPES) und 8,125 ml L15C300-Medium (siehe Materialtabelle). Stellen Sie die Lautstärke des Mediums nach Bedarf ein. Geben Sie das Medium in eine 26,3 ml Polycarbonat-Zentrifugenflasche.
- Balancieren Sie die Flaschen durch einen Gewichtsunterschied von maximal 0,01 g, um das ordnungsgemäße Funktionieren der Ultrazentrifuge zu gewährleisten.
- Ultrazentrifugieren Sie das Medium für 18 h bei 100.000 x g bei 4 °C. Entfernen Sie den Überstand über die Pipette und achten Sie darauf, dass keine Pelletbildung gestört wird.
- Überfüllen Sie den Überstand auf ein neues Zentrifugenröhrchen und Ultrazentrifuge ein zweites Mal für 18 h bei 100.000 x g bei 4 °C, bei richtiger Balance.
- Isolieren Sie den verbleibenden Überstand und passieren Sie einen 0,22 μm Spritzenfilter, um Verunreinigungen zu entfernen. Pipette den Überstand in ein 50 ml Zentrifugenröhrchen.
- Lagern Sie den Überstand in einem -20 °C Gefrierschrank, bis er benötigt wird, oder bis zu 3 Jahre.
3. Kaninchenbefall
- Schneiden Sie die Oberseite einer 10-ml-Spritze ab und laden Sie erwachsene I. scapularis-Weibchen mit einem Standardpinsel.
- Decken Sie die Spritzenöffnung mit steriler Gaze ab (Abbildung 1).
- Stellen Sie das Kaninchen horizontal auf eine Tischplatte oder eine Arbeitsfläche; Wickeln Sie das Kaninchen fest mit einem Handtuch ein und bedecken Sie beide Augen, wobei die vorbereitete Kapsel (Schritt 1.1) ausgesetzt ist, um das Kaninchen mit Zecken zu befallen.
- Öffnen Sie die Kapsel und setzen Sie Zecken ein, indem Sie den Spritzengriff drücken. Deponieren Sie die Zecken in der Nähe der Kaninchenhaut. Schließen Sie die Kapseln schnell, um zu verhindern, dass die Zecken entweichen.
- Lassen Sie die weiblichen Zecken gemäß dem experimentellen Design so lange wie nötig fressen. Lassen Sie männliche Ixodes scapularis nicht länger als 24 h in der Kapsel verbleiben, um eine Austrocknung zu vermeiden.
HINWEIS: Die Anzahl der Zecken, die in die Tiere eingeschleust werden sollen, liegt im Ermessen des Prüfers. Dieses Protokoll verwendete ~ 100 Zecken pro Befall, um die Mortalität zu erklären, und genug Material für Replikationen. Die vorläufigen Experimente ergaben, dass mindestens 20 Zecken/Replikat benötigt wurden, um genügend Material für die Sequenzierung der miRNAs zu erhalten.
4. Entfernung der gefütterten Weibchen
- Legen Sie die befallenen Kaninchen mit einem Gasdiffusor unter 2% Isofluran in Sauerstoff. Stellen Sie die Sauerstoffrate zwischen 700-1000 L / min ein.
HINWEIS: Andere Anästhetika können verwendet werden, um Stress oder Schmerzen zu vermeiden. - Entfernen Sie die gefütterten Weibchen, indem Sie die Zecken an ihrem Kapitulum mit feiner Pinzette so nah wie möglich an der Haut festhalten. Stellen Sie sicher, dass die Mundwerkzeuge vollständig entfernt werden, um eine bakterielle Infektion zu vermeiden.
- Legen Sie die Zecken in ein 15 ml Zentrifugenröhrchen.
- Reinigen Sie die Bissstelle mit 70% Ethanol und fügen Sie eine kleine Menge dreifaches Antibiotikum hinzu (Fingerspitzenwert, siehe Materialtabelle), um eine Infektion an der Zeckenstichstelle zu verhindern.
- Tragen Sie die Zecken zur Dissektion ins Labor (Schritt 5). Führen Sie diese Dissektionen innerhalb von 24-48 Stunden nach dem Entfernen der Zecken durch, um eine Verschlechterung der Speicheldrüsenzu vermeiden 15,43.
5. Speicheldrüsendissektion und extrazelluläre Vesikelsekretion
- Geben Sie 500 μL vesikelfreies Medium (Schritt 2) mit 5 μL 100x Penicillin, 5 μL 100x Streptomycin, 5 μL 10 mg/ml Rifampicin und 5 μL 100x Amphotericin zu jeder Vertiefung (siehe Materialtabelle). Fügen Sie 1x PBS mit Rifampicin zu allen Vertiefungen hinzu, die kein vesikelfreies Medium enthalten, um das Bakterienwachstum zu verhindern.
- Legen Sie die Zecken auf einen durchsichtigen mikroskopisch kleinen Glasobjektträger mit doppelseitigem Teppichband unter einem Seziermikroskop. Um eine Organaustrocknung zu verhindern, fügen Sie jeder Zecke vor der Dissektion 10 μL 1x PBS hinzu.
- Machen Sie mit einer 4-mm-Vannas-Schere (siehe Materialtabelle) einen kleinen Schnitt von ~ 1 mm an der Seite jedes Weibchens. Entfernen Sie die dorsale Seite der Zecke vollständig (Abbildung 2) und entfernen Sie beide Speicheldrüsen.
- Geben Sie 20-40 Zeckenspeicheldrüsen in 500 μL vesikelfreies Medium, das zu einer einzigen Vertiefung in einer 24-Well-Gewebekultur-behandelten Platte hinzugefügt wird (Abbildung 3).
- Inkubieren Sie die Speicheldrüsenproben bei 32 °C für 24 h, um die Sekretion der EVs zu ermöglichen.
6. Isolierung extrazellulärer Vesikel
- Nach 24 Stunden Inkubation pipettieren Sie das gesamte Medium, das die Speicheldrüsen enthält, in ein 1,5 ml Mikrozentrifugenröhrchen.
- Zentrifugieren Sie die Probe bei 300 x g bei 4 °C für 10 Minuten, um die Speicheldrüsen zu isolieren. In diesem Schritt werden zwei Phasen getrennt: (1) der Überstand, der die EVs enthält, und (2) die Speicheldrüsen (Pellet).
- Um die Isolierung der Elektrofahrzeuge fortzusetzen, pipettieren Sie den Überstand in ein neues 1,5-ml-Mikrozentrifugenröhrchen. Das Pellet, das die Speicheldrüsen enthält (Schritt 6.2), wird in 500 μL RNAlater (siehe Materialtabelle) resuspendiert und bei -80 °C gelagert, bis es verwendet oder auf unbestimmte Zeit verwendet wird.
HINWEIS: Diese Speicheldrüsen werden in Schritt 8 zur miRNA-Isolierung verwendet. - Zentrifugieren Sie den Überstand bei 2000 x g bei 4 °C für 10 Minuten, um Zelltrümmer zu entfernen. Pipette den Überstand in ein neues 1,5 ml Mikrozentrifugenröhrchen. Entsorgen Sie das Pellet.
- Zentrifugieren Sie den Überstand bei 10.000 x g für 30 min bei 4 °C, um apoptotische Körper und größere Elektrofahrzeuge zu entfernen. Werfen Sie das Pellet und pipettieren Sie den Überstand in ein neues 1,5-ml-Mikrozentrifugenröhrchen.
- Befestigen Sie eine 10-ml-Spritze an einem 1-μm-Nylon-Spritzenfilter. Setzen Sie die Spritze und den Filter über ein Ultrazentrifugenröhrchen (Abbildung 4A). Fügen Sie dann die Probe hinzu (Abbildung 4B), füllen Sie die Spritze mit 10 ml 1x PBS (Abbildung 4C) und balancieren Sie das Röhrchen entsprechend aus (Abbildung 4D).
- Legen Sie die Rohre in einen 70Ti-Rotor (siehe Materialtabelle) und drehen Sie sie bei 100.000 x g für 18 h bei 4 ° C.
- Nach 18 h Ultrazentrifugation ist ein Pellet am unteren Ende des Röhrchens zu beobachten (Abbildung 5). Das Pellet sind die konzentrierten extrazellulären Vesikel.
- Entfernen Sie 90% -100% des Überstands, ohne das EV-Pellet wieder zu suspendieren. Suspendiert das Pellet mit 1x PBS. Wenn nicht der gesamte Überstand entfernt werden konnte, verwenden Sie den verbleibenden Überstand, um das Pellet wieder zu suspendieren.
- Pipette 500 μL des EV-Pellets/Überstands in einen 300 K Zentrifugalfilter (siehe Materialtabelle).
HINWEIS: Dadurch werden alle nicht vesikelassoziierten Proteine, miRNAs und andere Moleküle entfernt, während die Vesikel den Filter nicht passieren. - Zentrifuge bei 8.000 x g für 10 min bei Umgebungstemperatur. Wiederholen Sie Schritt 6.10, bis alle EV-Pellets/Überstände den Filter passiert haben.
- Geben Sie 400 μL sterilisiertes 1x PBS in die Säule und mischen Sie gründlich über die Pipette, um die an der Membran befestigten Elektrofahrzeuge zu entfernen. Geben Sie die Probe in ein 1,5 ml DNase-/RNase-freies Röhrchen. Die Proben können unbegrenzt oder bis zur Verwendung bei -80 °C gelagert werden. Vermeiden Sie übermäßiges Auftauen der Proben, um eine Verschlechterung der Probe zu verhindern.
HINWEIS: Legen Sie Röhrchen auf Eis, wenn sie aus der Ultrazentrifuge genommen werden, um eine Verschlechterung des EV zu verhindern. Die endgültige Probe wird das EV-Pellet in 400 μL von 1x PBS sein. 25 μL dieser Probe werden für die Nanopartikel-Tracking-Analyse (NTA, Schritt 7) und 375 μL für die miRNA-Isolierung (Schritt 8) verwendet.
7. Nanopartikel-Tracking-Analyse (NTA)
- Von der endgültigen Probe (Schritt 6.12) sind 25 μl entnommen und 375 μL 1x PBS zugegeben.
- Laden Sie die verdünnte Probe in eine 1 ml nadellose Spritze und schrauben Sie sie fest auf die optische Linse des NTA.
- Passen Sie die Einstellungen entsprechend an und nehmen Sie Videos basierend auf den Einstellungseinstellungen auf.
ANMERKUNG: In der vorliegenden Studie wurden drei Lesungen von jeweils 60 s genommen. Jeder NTA-Messwert stellt eine technische Replik dar. Verschiedene Proben aus der Zeckenfütterung für die gleiche Zeitspanne stellen einzelne biologische Replikate dar. Die Kamera wurde auf Stufe 7 eingestellt und die Erkennungsschwelle wurde auf Stufe 5 eingestellt. - Schätzen Sie die endgültigen EV-Zahlen nach der folgenden Formel:
((Anfangs-EVs-Konzentration (Verdünnungsfaktor)) * (Gesamtvolumen im Probenröhrchen)/1000) = Gesamt-EVs in der Probe
HINWEIS: Das Volumen muss durch 1000 geteilt werden, da die NTA die Proben als Konzentration/ml liest.
8. miRNA-Extraktion aus Speicheldrüsen und extrazellulären Vesikeln
- 100 μL des Lysereagenzes (siehe Materialtabelle) in die verbleibende Probe aus Schritt 6.12 geben und mit sterilisierten Stößeln homogenisieren (Abbildung 6).
- Die restlichen 600 μL des Lysereagenzes zugeben und 5 min bei Raumtemperatur inkubieren.
- 140 μL Chloroform hinzufügen, 15 s kräftig schütteln und 3 min bei Raumtemperatur inkubieren.
- Drehen Sie mit 12.000 x g für 15 min bei 4 °C.
- Pippen Sie die klare obere Phase unter Vermeidung der Interphase in ein neues 1,5-ml-Rohr. Dies führt zu ~ 525 μL erwartetem Probenvolumen. Als nächstes fügen Sie ein 1: 1-Volumen von 100% Ethanol in molekularer Qualität hinzu.
- 700 μL der Probe in eine RNA-Isolationsspinsäule geben (siehe Materialtabelle).
- Drehen Sie bei 8.000 x g für 30 s bei Umgebungstemperatur, entsorgen Sie den Durchfluss.
- Waschen Sie die Probe mit 700 μL RTE-Puffer (siehe Materialtabelle), drehen Sie bei 8.000 x g für 30 s, entsorgen Sie den Durchfluss.
- Waschen Sie die Probe mit 500 μL RPE-Puffer (siehe Materialtabelle), drehen Sie bei 8.000 x g für 30 s, entsorgen Sie den Durchfluss.
- Fügen Sie 500 μL 80% Ethanol in molekularer Qualität hinzu und drehen Sie ihn bei 8.000 x g für 2 min, verwerfen Sie den Durchfluss.
- Drehen Sie die Säule mit der maximalen Geschwindigkeit für 5 Minuten, um die Membran zu trocknen. Entsorgen Sie das Auffangrohr und setzen Sie die Säule auf ein neues 1,5-ml-Mikrofugenröhrchen.
- 14 μL RNase-/DNase-freies Wasser in die Membran geben und 5 min bei Raumtemperatur inkubieren.
- Zentrifuge bei 21.000 x g für 1 min bei Raumtemperatur.
- Fügen Sie 1 μL RNase-Inhibitor (siehe Materialtabelle) zu den eluierten miRNAs hinzu und mischen Sie gut über die Pipette.
HINWEIS: Entfernen Sie vor der miRNA-Extraktion aus den Speicheldrüsen alle RNAlater, indem Sie 1 ml 1x PBS (1:1 Volumen) hinzufügen und die Speicheldrüsen mit maximaler Geschwindigkeit für 15 Minuten bei 4 ° C nach unten drehen. Dies muss dreimal wiederholt werden oder bis die Speicheldrüsen genug abgeklungen sind, um den Überstand zu entfernen. Zu diesem Zeitpunkt stellt die Probe eine Mischung aus kleinen RNAs von ~ 20-150 bp Größe dar (Ergänzende Abbildung 1).
9. Messung der miRNA-Konzentration
- Messen Sie die Konzentration kleiner RNA mit einem kommerziell erhältlichen RNA-Assay-Kit41 (siehe Materialtabelle).
- Mischen Sie in jedem Röhrchen 199 μL Verdünnungspuffer (Komponente A und B im Kit pro Probe), 1 μL Fluoreszenzfarbstoff speziell für den Nachweis von miRNAs (Messwellenlänge 260 nm) (pro Probe) und 2 μL kleine RNA (Schritt 8) für jede Probe, gemäß den Anweisungen des Herstellers.
- Lesen Sie vor dem Lesen der Probenröhrchen vorverdünnte miRNA Standard 1 und Standard 2 (im Kit enthalten), um vor der Probenmessung eine Standardkurve zu erstellen.
HINWEIS: Die Standards werden als Vergleichsinstrument verwendet, um die gemessene miRNA-Konzentration in den Proben zu bestimmen. - Legen Sie jeden Standard und jedes Probenröhrchen in das spezielle Fluorometer (siehe Materialtabelle), um die Konzentration als ng/μL zu messen.
10. Bestimmung der miRNA-Qualität
- Bestimmen Sie die Qualität von miRNA und anderen kleinen RNAs mittels Gelelektrophorese mit einem Bioanalyzer46 gemäß den Anweisungen des Herstellers (siehe Materialtabelle).
- Normalisieren Sie die Proben vor dem Ablesen der Proben auf die gleiche Konzentration.
- Lesen Sie die Proben durch einen kleinen RNA-Chip41,46 gemäß den Anweisungen des Herstellers (siehe Materialtabelle).
HINWEIS: Zur Bestimmung der miRNA-Qualität sind die gelartigen Bilder (Banden) und Elektropherogramme (Peaks) Indikatoren für die Probenqualität. Je dunkler das Band im Gel, desto besser ist die miRNA-Qualität. Je heller das Band (oder wenn kein Band vorhanden ist), desto schlechter ist die Qualität oder der Nachweis des Probenabbaus46,47.
11. microRNA-Anreicherung
- Bereichern Sie die miRNA mit einem kleinen RNA-Sequenzierungskit gemäß den Anweisungen des Herstellers des kleinen RNA-Probenvorbereitungskits (siehe Materialtabelle).
- Ligaten Sie jede Probe mit einem 3' adenylierten Adapter und entfernen Sie den überschüssigen Adapter durch Perlenreinigung. Fügen Sie als Nächstes einen 5-Zoll-Adapter hinzu und entfernen Sie den überschüssigen Adapter durch eine Perlenbereinigung48.
HINWEIS: Sowohl Adapter als auch Perlen für die Reinigung wurden im kleinen RNA-Sequenzierungskit aus Abschnitt 11.1 bereitgestellt (siehe Materialtabelle). - Um den ersten Strang zu synthetisieren, bereiten Sie eine Mastermischung der Proben vor, die mit beiden Adaptern, RT-Puffer und M-MuLV-Reverse-Transkriptase, die im Kit enthalten sind (siehe Materialtabelle), ligiert sind. Als nächstes inkubieren Sie die Mischung für 30 min bei 42 °C und 10 min bei 90 °C. Follow-up mit einer Beispielbereinigung, wie in den Anweisungen angegeben.
- Verstärken Sie den 1. Strang mit dem RT-Vorwärtsprimer und dem umgekehrten Universalprimer, die im Kit enthalten sind (siehe Materialtabelle), über eine konventionelle Polymerase-Kettenreaktion (PCR) für 2 min bei 95 °C, dann für 12-25 Zyklen für 20 s bei 95 °C, 30 s bei 60 °C und 15 s bei 72 °C. Zum Schluss 2 min bei 72 °C.
HINWEIS: Die PCR-Produktgröße wird voraussichtlich ~ 150 bp betragen (Abbildung 7). - Messen Sie die Qualität des PCR-Produkts über eine Bandstation gemäß den Anweisungen des Herstellers (siehe Materialtabelle).
- Sequenzieren Sie die Proben mit einem Sequenzierungssystem der nächsten Generation (75 Zyklen) gemäß den Anweisungen des Herstellers (siehe Materialtabelle).
HINWEIS: Für die miRNA-Anreicherung müssen Probenmenge und -qualität vor der Bibliotheksvorbereitung überprüft werden (Schritte 9-10).
12. Bioinformatische Analyse
- Identifizieren Sie die konservierten und eindeutigen miRNAs mit einem integrierten Anwendungstool zur miRNA-Identifikation.
HINWEIS: In der vorliegenden Studie wurde die miRNA-Identifizierung über miRDeep2 49,50 durchgeführt. miRDeep2 ist ein kostenloser Online-Katalog aller identifizierten konservierten und neuartigen miRNAs, die in verschiedenen Spezies49,50 gefunden wurden (siehe Tabelle der Materialien). - Richten Sie die Lesevorgänge mit dem in die Software integrierten Mapper an das entsprechende Genom aus.
- Geben Sie die folgenden Parameter in das Mapper-Modul ein.
- Kürzen Sie die aus Schritt 11.2 hinzugefügten Adaptersequenzen und entfernen Sie Sequenzen, die weniger als 18 Nukleotide lang sind. Entfernen Sie die redundanten Lesesequenzen.
- Konvertieren Sie die Dateien mit dem Parameter Parse in das FASTA-Format, nur wenn die Datei nicht im FASTA-Format49 vorliegt.
- Richten Sie die gefilterten und getrimmten Sequenzen auf das entsprechende Genom aus. Wenn es kein Genom für die interessierenden Arten gibt, richten Sie sich an der nächstgelegenen homologen Art aus.
- Zeigen Sie die Ausgabedateien als "reads.fa" und "reads_vs_genome.arf" an. "read.fa" enthält nur die nicht redundanten Lesevorgänge, und die "reads_vs_genome.arf" enthält die zugeordneten Lesevorgänge, die auf das Genom ausgerichtet sind.
- Verwenden Sie beide Ausgabedateien aus Schritt 12.2 und führen Sie die miRNA-Expressionsprofilerstellung mit dem in die Software integrierten Quantifikator durch.
- Laden Sie die interessierenden miRNA-Vorläufersequenzen und die reifen miRNA-Sequenzen von miRBase 51,52,53,54,55,56 herunter. Wenn es keine Vorläufer- oder reifen Sequenzen für die interessierenden Arten gibt, laden Sie die "hairpin.fa.gz" und "mature.fa.gz" herunter, die alle Vorläufer und reifen Sequenzen für alle auf miRBase verfügbaren Organismen enthalten.
- Entpacken Sie die Dateien "hairpin.fa.gz" und "mature.fa.gz".
- Geben Sie die Dateien "reads.fa" und "read_vs_genome.arf" aus Abschnitt 12.3.4 und die unkomprimierten Dateien aus 12.4.2 ein.
- Lesen Sie die Ausgabedateien als "outputname.csv", "outputname.html" und "outputname.pdf". Der Name der Ausgabedatei kann je nach Prüfer festgelegt werden.
Hinweis: Die Datei "outputname.csv" enthält die Ausdrucksprofile. Insbesondere enthält das Expressionsprofil die miRNA-ID, die Summe der Lesevorgänge für alle Proben, die der miRNA zugeordnet sind, die Anzahl der Lesevorgänge, die einer bestimmten miRNA für jede Probe zugeordnet sind, und die Vorläufer-ID, die den reifen miRNAs entspricht. Der "outputname.html" aus Schritt 12.4.4 enthält die Links zum Genome Browser (USCS) der University of Santa Cruz, zum National Center for Biotechnology Information (NCBI) und zur miRBase. Das USCS und NCBI enthalten die Abfragesequenzen der aktuellen Vorläufer gegen die nicht-redundante Nukleotiddatenbank, und miRBase wird die Informationen des aktuellen miRNA-Vorläufers enthalten. Der "outputname.pdf" hat die RNA-Sekundärstruktur der exprimierten miRNAs und die Ausrichtung der Vorläufersequenz.
- Um eindeutige und konservierte miRNAs zu identifizieren, verwenden Sie miRDeep2.
- Verwenden Sie die Ausgabedateien aus Schritt 12.3.4 und Schritt 12.4.2 als Eingabedateien.
HINWEIS: Die Ausgabedateien, die als "outputname.html" gelesen werden, enthalten die Vorhersagen der einzigartigen und konservierten miRNAs in der Probe. - Verwenden Sie Scores >1 für die miRNA-Profilerstellung und Scores >4 für weitere experimentelle Analysen, wie z.B. miRNA-Hemmung und Nachahmung endogener miRNAs34,36,57.
- Wählen und identifizieren Sie die eindeutigen miRNAs aus der miRbase basierend auf Folgendem: miRDeep2-Score (Schritt 12.5.3), Schätzung der wahren Wahrscheinlichkeit (>90%), signifikanter Randfold-p-Wert (<0.05)49,50,56.
HINWEIS: Die Bioinformatik-Analyse wurde über miRDeep2 in Cyverse Discovery Environment58,59, einer kostenlosen Online-Plattform für Bioinformatik-Analysen, durchgeführt. Die konservierten und einzigartigen miRNAs, die durch miRDeep2 identifiziert wurden, wurden mit allen Spezies aus der miRbase verglichen. Die zukünftige miRDeep2-Identifizierung kann mit dem entsprechenden Genom der interessierenden Spezies verglichen werden.
- Verwenden Sie die Ausgabedateien aus Schritt 12.3.4 und Schritt 12.4.2 als Eingabedateien.
Ergebnisse
Das vorliegende Protokoll bietet eine detaillierte Methodik zur Extraktion von miRNAs aus Speicheldrüsen und EVs. Den Ergebnissen zufolge ist dieses Protokoll für die Isolierung von miRNA aus Erwachsenen zweier verschiedener Zeckenarten, I. scapularis und R. microplus, wirksam und kann möglicherweise auch bei anderen Zeckenarten verwendet werden. Die EV-Konzentration (Partikel/ml) wurde mittels NTA gemessen. Für R. microplus enthielt jedes Geschlecht und jede Lebensphase drei biologische Replikate, die in drei technischen Replikaten gemessen wurden. Die Proben wurden nach Geschlecht und Lebensphase getrennt (Abbildung 8), um die Variation innerhalb jeder Stichprobe zu zeigen. Als nächstes wurden die Stichproben kombiniert, um die Variation und die statistischen Unterschiede unter Verwendung einer bidirektionalen ANOVA und Tukeys mehrfachen Vergleichstests20 (p-Wert = < 0,05) anzuzeigen (Abbildung 9). Jede Probe bestand aus ~ 40 Speicheldrüsen, die aus 20 Weibchen, Männchen und Nymphen seziert wurden. Nach der Isolierung und Quantifizierung der EVs wurden die Proben für die kleine RNA-Aufreinigung verwendet.
Die Konzentration der kleinen RNA in jeder Probe wurde mit Qubit gemessen (Tabelle 1), und die Qualität wurde mit einem Bioanalysator unter Verwendung der Standard-Gelelektrophorese46,47 gemessen. Die Konzentrationen sind in Nanogramm (Tabelle 1) in einem Volumen von 14 μL für beide Zeckenarten. Die durchschnittliche Summe der kleinen RNA-Konzentrationen aus I. scapularis-Organen reichte von 45,92-6.356 ng. Die RNA-Konzentration von I. scapularis vesikles lag zwischen 72,24 und 2.128 ng. Für R. microplus lag die Organkonzentration zwischen 259 und 2.142 ng und die Vesikel zwischen 59,22 und 1.848 ng. Die Proben wurden auf die gleiche Konzentration normalisiert und ihre Qualität wurde dann mit einem Bioanalysator gemessen (Abbildung 10). Eine Referenzleiter wurde im Gel als Marker für die Qualitätsbewertung verwendet. Die Bandintegrität, -intensität und -peaks waren repräsentativ für den potenziellen Abbau oder die Gesamtkonzentration in jeder Probe. Banden, die 5 s und 5,8 s ribosomalen RNAs entsprachen, waren nur in den Speicheldrüsenorganproben vorhanden (Abbildung 10, Lanes A-D) und fehlten im Vesikel von den Speicheldrüsenproben (Abbildung 10, Lanes E,F), was die Unterschiede in kleinen RNA-Profilen zwischen Organen und extrazellulären Vesikeln zeigt. Der Probenabbau wurde durch das Fehlen von Banden im Gel abgeleitet; Dies bedeutete, dass es zu einer signifikanten Verschlechterung der Stichproben kam. Es wird empfohlen, alle Proben mit signifikantem Abbau zu verwerfen.
Um das Vorhandensein von miRNA-Proben in den Präparaten nachzuweisen, wurden kleine RNA-cDNA-Bibliotheken aus RNA-Proben hergestellt, die nach der Isolation kleiner RNA 3-4 Monate gelagert wurden. Seltsamerweise wurde bei diesen Proben ein höherer Probenabbau festgestellt. Die Bahnen A-D und G zeigten Anzeichen von Degradation; Im Gegenteil, E, F und H-K zeigten einen minimalen Abbau und eine ausreichende Konzentration für die Vorbereitung der miRNA-cDNA-Bibliothek (Ergänzende Abbildung 1). Nur eine Probe wurde abgebaut, wenn die Proben unmittelbar nach der Reinigung verwendet wurden (Abbildung 10), was darauf hindeutet, dass miRNA-Proben anfälliger für den Abbau waren, sobald sie von EVs gereinigt wurden. Daher wurden die Proben E, F, H und I für die Anreicherungsanalyse ausgewählt. Die Sternchen zeigen die Bandgrößen von ~150 bp, die die erwarteten Größen nach der Vorbereitung der cDNA-Bibliothek waren (Abbildung 7). Die unteren schwachen Bänder zeigen das Primer-Dimer an.
Während der EV-Isolierung können die Zentrifugationsgeschwindigkeit und -zeit die endgültige EV-Konzentration beeinflussen. Beim Pipettieren des EV-Pellets in die 300-k-Säulen, wie bereits in Schritt 6.10 erwähnt, sind ein geringes Volumen und eine geringe Geschwindigkeit unerlässlich, um zu verhindern, dass EVs die Membran passieren. Frühere Studien zeigten, dass 700 μL bei 12.000 x g für 20 min mit einem anderen Zentrifugalkonzentrator ausreichten, um EVs ordnungsgemäß von den löslichen Proteinen zu trennen20; Niedrige EV-Konzentrationen wurden jedoch im NTA mit einem anderen Filter angezeigt. Daher ist die Optimierung der Filter und anderer verfügbarer Materialien unerlässlich. Bei der ersten Verwendung der 300-k-Säulen wurden verschiedene Geschwindigkeitsintervalle getestet, um festzustellen, welche die höchste EV-Konzentration ergaben. Die Anzahl der Vesikel, die während der Zentrifugation verloren gehen, wurde durch NTA-Analyse gemessen; Es wurde der Schluss gezogen, dass niedrigere Geschwindigkeiten zu einer höheren Vesikelkonzentration im Durchfluss führten (nicht gezeigt). Es wurde der Schluss gezogen, dass 500 μL bei 6.000-8.000 x g für die Isolierung der Elektrofahrzeuge zufriedenstellend waren. Sobald dies bestimmt war, wurde dieses Protokoll verwendet, um Vesikel von I. scapularis und R. microplus zu isolieren. Die Konzentration der aus jeder Zeckenart isolierten Vesikel wurde mittels NTA gemessen (Abbildung 8). Die EV-Konzentrationen variierten zwischen 7,07 x 10 7 und7,94 x 109 Partikeln /ml. Die EV-Menge korrelierte mit den miRNA-Konzentrationen, wobei die größere Menge an EV zu einer höheren Konzentration der extrahierten miRNA führte.
Abbildung 1: 1 ml nadellose Spritzen, die mit weiblicher erwachsener I. scapularis beladen und mit sterilisierter Gaze bedeckt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Die Rückenseite eines verstopften Weibchens wurde mit einer 4-mm-Vannas-Schere entfernt. Das Weibchen wurde in 1x PBS getaucht, um eine Organaustrocknung zu verhindern. Die gelben Pfeile zeigen auf die freiliegenden Speicheldrüsen. Die Figur wurde bei 50-facher Vergrößerung mit einem hochauflösenden Objektiv aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Eine Zellkulturplatte nach einer 24 h Inkubation bei 32 °C. Die erste Reihe von Vertiefungen enthält die vesikelfreien Medien und die sezierten Speicheldrüsen. Der Rest der Brunnen enthält 1x PBS mit Rifampicin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Ein Probenvorbereitungsprozess für einen Ultrazentrifugenzyklus. (A) Eine nadellose 10-ml-Spritze, die mit einem 1-μm-Spritzenfilter versehen ist. (B) Der Überstand wird nach drei Runden der Zentrifugation in die Spritze pipettiert. (C) Der Rest der Spritze ist auf 10 ml mit 1x sterilisiertem PBS gefüllt. (D) Die Spritze wird abgedeckt und der Überstand mit 1x PBS wird in das Ultrazentrifugenröhrchen gefiltert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 5: Nach 18 h Ultrazentrifugation bildet sich am Boden des Ultrazentrifugenröhrchens ein Pellet extrazellulärer Vesikel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Ein sterilisierter Stößel wird verwendet, um Speicheldrüsenorgane und die extrazellulären Vesikel zu homogenisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
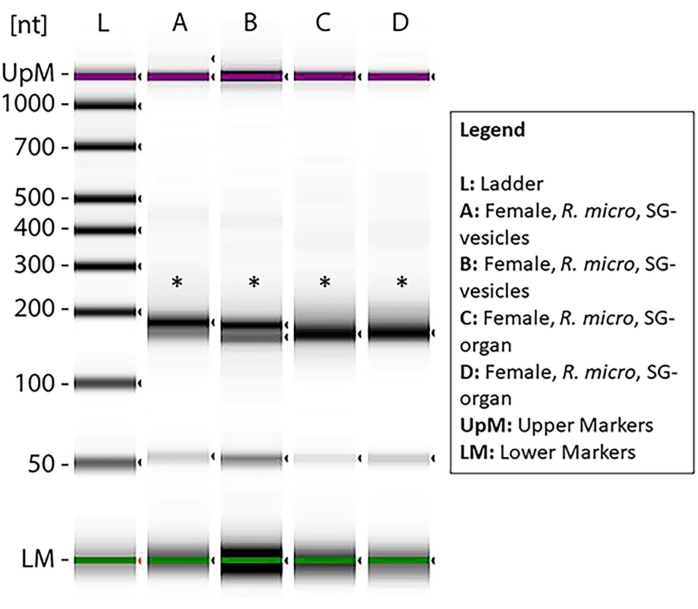
Abbildung 7: Eine über eine Bandstation gemessene Gelelektrophorese, die nach einer Anreicherungsanalyse die miRNA-präparierten Bibliotheken anzeigt. Die Proben von weiblichen R. microplus Speicheldrüsenorganen und EVs basierten auf minimalem Abbau und ausreichender miRNA-Konzentration für die cDNA-Bibliothekssynthese. Die Leiter (L) zeigt die Referenzpunkte in Nukleotiden und die oberen und unteren Markierungen. Die Sternchen zeigen die Banden des Größenprodukts ~ 150 bp an, die die kleinen RNA-cDNA-Bibliotheken bezeichnen. Die unteren Bänder zeigen Primer-Dimer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
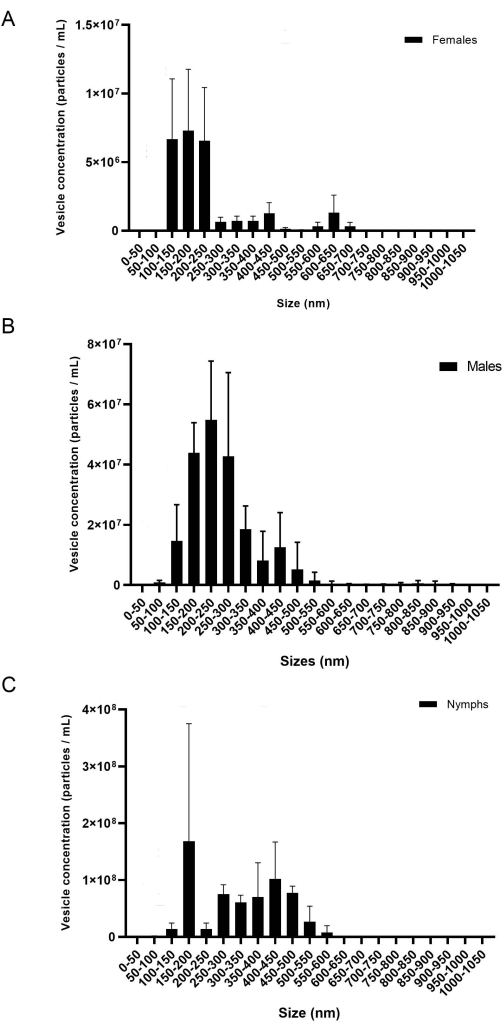
Abbildung 8: Eine repräsentative Zahl der Variation zwischen den biologischen Replikaten (A) Weibchen, (B) Männchen und (C) Nymphen. Die x-Achse zeigt die EV-Größe (nm) und die y-Achse die EV-Konzentration (Partikel/ml). Ein Zwei-Wege-ANOVA und der Vergleichstest von Tukey zeigten statistische Unterschiede (P-Wert = < 0,05). Die Fehlerindikatoren stellen den Standardfehler dar, um Variationen zu berücksichtigen. Jede Probe enthielt 20 Zecken mit drei biologischen Replikaten. Die Proben wurden für 60 s, jeweils dreimal, aufgezeichnet. Die Kamera wurde auf Stufe 7 und die Erkennungsschwelle auf Stufe 5 eingestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 9: Eine repräsentative Zahl der Variation für alle kombinierten biologischen Replikate für Nymphen (rot), Weibchen (blau) und Männchen (schwarz). Die x-Achse zeigt die EV-Größe (nm) und die y-Achse die EV-Konzentration (Partikel/ml) an. Ein Zwei-Wege-ANOVA und der Vergleichstest von Tukey zeigten statistische Unterschiede (P-Wert = < 0,05). Die Fehlerindikatoren stellen den Standardfehler dar, um Variationen zu berücksichtigen. Jede Probe enthielt 20 Zecken mit drei biologischen Replikaten. Die Sternchen symbolisieren eine signifikante Differenz von p < 0,05. Jede Aufnahme wurde für 60 s gemacht, jeweils dreimal. Die Kamera wurde auf Stufe 7 und die Erkennungsschwelle auf Stufe 5 eingestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
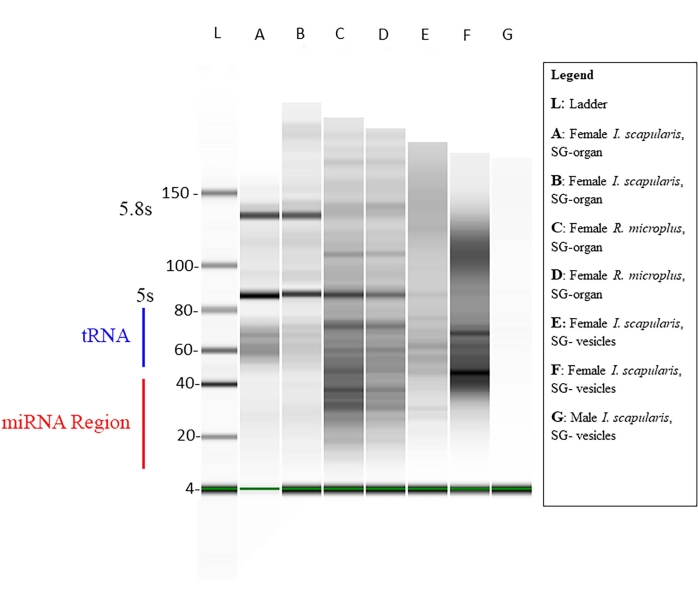
Abbildung 10: Ein repräsentatives Gel über den Bioanalysator. Die Gelelektrophorese wurde unter Verwendung einer Basisleiter als Referenz durchgeführt. Eine reife miRNA-Sequenz ist ~18-22 nt lang, wobei schwache Bänder im angegebenen Größenbereich angezeigt werden. Andere kleine RNAs, wie kleine nukleäre RNAs, Transfer-Messenger-RNAs und regulatorische RNAs, sind ebenfalls in den Proben vorhanden. Die Größen der kleinen RNAs reichten von ~ 20-150 nt. Die Proben variieren je nach Zeckenart, Gewebe und Geschlecht. Für Bahn G zeigt ein Beispiel für die Probendegradation keine Bänder. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Eine Gelelektrophorese wurde über den Bioanalysator gemessen, die die Qualität der extrahierten miRNAs aus R. microplus weiblichen Speicheldrüsenorganen und EVs anzeigte. Die Leiter (L) zeigt die Referenzgrößen in Nukleotiden, wobei reife miRNAs ~ 18-22 nt in der Länge messen. Die Bahnen A-D und G zeigen eine Verschlechterung und die Bahnen E, F und H-K zeigen eine minimale Verschlechterung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
| Spezies | Geschlecht | Organ/ Vesikel | EV-Konzentration | miRNA-Konzentration (ng) |
| R. microplus | Weiblich | Orgel | N/A | 259 |
| R. microplus | Weiblich | Orgel | N/A | 2,142 |
| R. microplus | Weiblich | Bläschen | 1,64 E+08 | 59.22 |
| R. microplus | Weiblich | Bläschen | 1,64 E+09 | 1,848 |
| I. scapularis | Weiblich | Orgel | N/A | 45.92 |
| I. scapularis | Weiblich | Orgel | N/A | 6,356 |
| I. scapularis | Weiblich | Bläschen | 1,73E+08 | 65.66 |
| I. scapularis | Weiblich | Bläschen | 3,14 E+09 | 2,128 |
Tabelle 1: Ein Beispiel für die miRNA-Konzentrationen sowohl für Speicheldrüsen als auch für extrazelluläre Vesikel. Die Spalte der miRNA-Konzentrationen stellt die niedrigsten bis höchsten Konzentrationen für jede Zeckenart dar.
| microRNA | I. scapularis | I. ricinus | R. microplus | H. longicornis | Referenzen |
| miR-8 | Ein | P | P | P | 33, 36, 37, 43 |
| miR-71 | P | P | P | Ein | 33, 36, 37, 43 |
| miR-279 | P | Ein | Ein | P | 33, 36, 37, 43 |
| let-7 | Ein | P | P | P | 33, 36, 37, 43 |
Tabelle 2: Die konservierten miRNAs in verschiedenen Zeckenarten. (P) zeigt an, dass die miRNA häufig exprimiert oder vorhanden war, und (A) bedeutet, dass die miRNAs nicht allgemein exprimiert oder nachgewiesen wurden.
| Beispieltyp | Anzahl der Punktzahlen >1* | Anzahl der Ergebnisse >4γ | Anzahl der konservierten | Anzahl der Romane |
| Männlich | 17 | 0 | 48,885 | 23 |
| Weiblich | 25 | 0 | 48,885 | 21 |
| Nymphen | 38 | 0 | 48,885 | 38 |
Tabelle 3. Die konservierten und einzigartigen miRNAs wurden in den EVs für R. microplus Weibchen, Männchen und Nymphen nachgewiesen. *miRNA-Score, der für die Profilerstellung verwendet wird. γmiRNA-Score, der für funktionelle Experimente verwendet wird.
Ergänzende Tabelle 1: Eine Tabelle, die die Ergebnisse der Next-Generation-Sequenzierungfür R. microplus männliche EVs zeigt, die aus Speicheldrüsen ausgeschieden werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 2: Eine Tabelle, die die Sequenzierungsergebnisse der nächsten Generationfür weibliche Elektrofahrzeuge von R. microplus zeigt , die aus Speicheldrüsen ausgeschieden werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 3: Eine Tabelle, die die Sequenzierungsergebnisse der nächsten Generationfür R. microplus-Nymphen-EVs zeigt , die aus Speicheldrüsen ausgeschieden werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das aktuelle Protokoll bietet eine detaillierte Methodik zur Extraktion von miRNA aus Speicheldrüsen und EVs. Es gibt jedoch wichtige Überlegungen, die alle in den Anmerkungen zu jedem Abschnitt dieses Protokolls ausführlich beschrieben werden. Die Kapsel und das Netz müssen während der Zeckenfütterung gesichert werden, um zu verhindern, dass Zecken entweichen. Die Kapselvorbereitung und -platzierung sind in Koga et al.40 beschrieben. Mehrere Wiederholungen der Zeckendissektionen müssen durchgeführt werden, wenn eine ungeeignete Probe verworfen wird. Darüber hinaus können bei der Verwendung von EV-Isolationstechniken aus Zeckengewebe 18,20,43 mehrere Herausforderungen auftreten. Zum Beispiel sollten Gewebe während der Dissektion feucht gehalten werden, um Austrocknung zu vermeiden. Dies geschieht durch Hinzufügen von PBS während der gesamten Dissektion. Sowohl das PBS als auch die Medien, die für die Dissektion und Kultur der Organe verwendet werden, sollten mit Antibiotika aufrechterhalten werden, um eine bakterielle Kontamination durch das Zeckenmikrobiom zu vermeiden. Dazu sollten Antibiotika gehören, die auf gramnegative und grampositive Bakterien abzielen, da beide in Zeckengewebengefunden werden können 60. Ebenso muss bei der Dissektion darauf geachtet werden, dass die Kontamination mit Geweben aus anderen Organen verringert wird. Daher müssen Dissektionen langsam durchgeführt werden, und wenn der Benutzer Erfahrung gewinnt, können mehr Zecken seziert werden. Da EVs aus allen Zellen ausgeschieden werden, einschließlich pathogen-infizierter Zellen, müssen Zeckenstudien, die eine EV-Isolierung durchführen, EV-freie Medien und Puffer verwenden, um eine Cross-EV-Kontamination zu vermeiden25,61.
Nichtsdestotrotz ermöglicht dieses Protokoll die Reduzierung der Anzahl der Zecken, die benötigt werden, um Zeckenspeichel-EVs zu produzieren. Frühere Protokolle erforderten den Speichelfluss einer deutlich größeren Anzahl von Zecken. Zum Beispiel benötigten miRNAs, die in Speichel-EVs in Haemaphysalis longicornis sezerniert wurden, den Speichelfluss von 2.000 erwachsenen Zecken43. Dies kann für Labore, die nicht in der Lage sind, Zecken zu zücken, extrem teuer sein. In ähnlicher Weise wurden Amblyomma maculatum-Gewebe , die für die EV-Isolierung verwendet wurden, vor der Isolierung teilweise eingefroren und mit 75 U / ml Kollagenase Typ 3 behandelt, was die Authentizität der EV-Sekretionbeeinflussen könnte 19. Darüber hinaus erforderten diese Studien 80-100 Paare von Speicheldrüsen18.
Im Vergleich dazu kann dieses Protokoll auf mehrere Zeckenarten angewendet werden und erfordert eine geringe Anzahl von Zecken, um EVs zu isolieren und qualitätskonservierte und neuartige miRNAs zu extrahieren (Tabelle 2) 33,36,37,43. Die miRNA-Konzentrationen variierten stark, reichten aber für die Next-Generation-Sequenzierung aus (Tabelle 3 und ergänzende Tabellen 1-3). Dieses Protokoll kann angepasst werden, um eine größere Stichprobengröße aufzunehmen, wenn größere miRNA-Konzentrationen benötigt werden. Außerdem sind die in diesem Protokoll verwendeten Materialien je nach Materialverfügbarkeit substituierbar. Die Probenvolumina und die Zentrifugationsgeschwindigkeit müssen jedoch gemäß den Anweisungen des Herstellers für die verwendeten Kits und Säulen angepasst werden.
Ein Nachteil dieser Methode ist, dass miRNAs und EVs während der Extraktions- und Isolationsschritte leicht abgebaut werden können. Daher muss das Protokoll schnell und effizient durchgeführt werden. Wenn angegeben, müssen die Proben auf Eis gehalten werden, und die miRNA-Extraktion muss in einer sterilisierten Umgebung durchgeführt werden. Zusätzlich kann eine RNase-Behandlung an den isolierten EVs durchgeführt werden, um große RNAs zu eliminieren, die an die EV-Membran gebunden sind. Dies kann verhindern, dass große RNAs die Probe während der miRNA-Extraktionen kontaminieren. Schließlich ist die Zugabe eines RNAse-Inhibitors zur miRNA-Probe nach der Isolierung von EVs oder Organen eine wichtige vorbeugende Maßnahme für den Abbau. Dieses Protokoll kann geändert und parallel zu den Zielen des Experiments angewendet werden.
Zukünftige Anwendungen für dieses Protokoll könnten die Untersuchung von Erreger-Vektor-Interaktionen umfassen, um zu verstehen, wie Krankheitserreger die miRNA und andere genomische Fracht in Zeckenspeichel-EVs beeinflussen. Ebenso kann dieses Protokoll spezifische Proteine und zelluläre Prozesse definieren, die an der Verpackung von miRNAs in Zecken-EVs beteiligt sind, und die spezifische Wirkung, die diese EVs und miRNAs auf die Wundheilung und Immunantwort haben. Aufgrund der zunehmenden Zeckenresistenz gegen Akarizide besteht ein dringender Bedarf an einzigartigen Bekämpfungsmethoden. Elektrofahrzeuge haben das Potenzial für eine alternative Kontrollmethode im Vergleich zu Akariziden. Elektrofahrzeuge können als Nanotransporter in therapeutischen Anwendungeneingesetzt werden 18,23,61. Beim Menschen wurden EVs, die miRNAs transportieren, verwendet, um das Tumorwachstum während der Krebsimmuntherapiezu unterdrücken 62,63. In ähnlicher Weise können EVs in Zecken genetisch veränderte miRNAs tragen, von denen gezeigt wurde, dass sie lebenswichtige biologische Funktionen der Zecken und die Übertragung von Krankheitserregern beeinflussen 36,57,64. Die zukünftige Richtung besteht darin, dieses Protokoll zu verwenden, um die miRNA-Profile mehrerer Zeckenarten zu bestimmen, um miRNAs zu identifizieren, die für funktionelle Studien von Interesse sind.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Wir sind sehr dankbar für die Unterstützung durch das Cattle Fever Tick Laboratory in Edinburg, Texas. Wir danken Michael Moses, Jason Tidwell, James Hellums, Cesario Agado und Homer Vasquez. Wir möchten auch die Unterstützung von Sarah Sharpton, Elizabeth Lohstroh, Amy Filip, Kelsey Johnson, Kelli Kochcan, Andrew Hillhouse, Charluz Arocho Rosario und Stephanie Guzman Valencia während des gesamten Projekts danken. Wir möchten der Texas A&M Aggie Women in Entomology (AWE) Writing Group für ihre Hilfe und ihren Rat während des Schreibens dieses Manuskripts danken. Die folgenden Reagenzien wurden von den Centers for Disease Control and Prevention zur Verteilung durch BEI Resources, NIAID, NIH, zur Verfügung gestellt: Ixodes scapularis Adult (Live), NR-42510. Weibliche I. scapularis-Zecken wurden auch von der Tick Rearing Facility an der Oklahoma State University erhalten. Dieses Projekt wurde von der Texas A&M University T3: triads for transformation grant und der Kooperationsvereinbarung #58-3094-1-003 des USDA-ARS an AOC finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | GenClone | 25-240 | |
| 1 µm nylon syringe filter | Tisch Scientific | 283129028 | |
| 1 inch black adhesive | Amazon | B00FQ937NM | Capsule |
| 10 mL needeless syringe | Exelint | 26265 | |
| 3' and 5' Adapters | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| 4 mm vannas scissors | Fine Science Tools | 15000-08 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid | Sigma-Aldrich | 1.1523 | |
| 70Ti rotor | Beckman Coulter | 337922 | |
| Amphotericin | Corning | 30-003-CF | |
| Beads | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Bioanalyzer | Agilent | G2939BA | |
| Bioanalyzer kit | Agilent | 5067-1513 | |
| Centrifuge 5425 | Eppendorf | ||
| Chloroform | Macron | UN1888 | |
| Cyverse Discovery Enviornment | https://cyverse.org/discovery-environment | ||
| Dissecting microscope | Nikon | SMZ745 | |
| Double-sideded carpet tape | amazon | 286373 | |
| Falcon Tubes, 50 mL | VWR | 21008-940 | |
| Fetal Bovine Serum | Gibco | FBS-02-0050 | |
| fine forceps | Excelta | 5-S-SE | |
| Foamies, 2 mm | Amazon | B004M5QGBQ | Capsule |
| Isoflurane | Phoenix Pharmaceuticals manfactured | 193.33165.3 | |
| Ixodes scaplaris | CDC, Oklahoma State University | ||
| L15C300 medium | In-lab | ||
| lipoprotein-cholesterol concentrate | MPI | 02191476-CF | |
| Microscope slide | VWR | 10118-596 | |
| miRDeep2 | https://github.com/rajewsky-lab/mirdeep2 | ||
| M-MuLV Reverse Transcriptase | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| molecular grade ethanol | Fischer Bioreagents | UN1170 | |
| multi-well 24 well tissue culture treated plate | Corning | 353047 | |
| Nanopaticle Tracking Analyzer machine | Malvern Panalytical | ||
| Nanosep with 300K Omega filter | Pall Corporation | OD3003C33 | |
| NEXTFLEX Small RNA-Seq Kit v3 | PerkinElmer | ||
| NextSeq 500/550 High Output Kit (75 cycles) | Illumina | 20024906 | |
| Optima XPN 90 Ultracentrifuge | Beckman Coulter | ||
| Penicillin | Thermofischer Scientific | ICN19453780 | |
| Pippettes | Ependorff | ||
| polycarbonate centrifuge bottle | Beckman Coulter | 355618 | |
| Qiagen miRNeasy kit | Qiagen | 217084 | |
| QIAzol lysis reagent | Qiagen | 79306 | |
| Qubit | Thermofisher | Q32880 | |
| Qubit kit | Thermofisher | Q10212 | |
| Rabbits | Charles River | ||
| Reverse Universal Primer | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Rhipicephalus microplus | Cattle Fever Tick Research Labratoty | ||
| Rifampicin | Fischer Bioreagents | 215544 | |
| RNAlater | Invitrogen | 833280 | |
| RNAse free tubes | VWR | 87003294 | |
| RNAse inhibitor | Thermo Fischer | 11111729 | |
| RNAse/DNAse free water | Qiagen | 217084 | |
| RNeasy Minelute spin column | Qiagen | 217084 | Qiagen miRNeasy kit |
| RPE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| RT Buffer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RT Forward Primer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RTE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| Sodium bicarbonate | Sigma-Aldrich | S6014-25G | |
| Sorvall ST16 | Thermo Fischer | 75004380 | |
| Sterilized Gauze sponges | Covidien | 2187 | |
| Sterilized PBS | Sigma | RNBK0694 | |
| streptomycin | thermofischer Scientific | 15240062 | |
| TapeStation | Aligent | G2991BA | |
| Tear Mender Instant Fabric and Leather Adhesive | Amazon | 7.42836E+11 | Capsule |
| Tissue Adhesive | 3M VetBond | ||
| Triple Antibiotics | dechra | 17033-122-75 | |
| Tryptose phosphate broth | BD | BD 260300 |
Referenzen
- Jongejan, F., Uilenberg, G. The global importance of ticks. Parasitology. 129, 3-14 (2004).
- Anderson, J. F., Magnarelli, L. A. Biology of ticks. Infectious Disease Clinics of North America. 22 (2), 195-215 (2008).
- de la Fuente, J. Controlling ticks and tick-borne diseases… looking forward. Ticks and Tick-Borne Diseases. 9 (5), 1354-1357 (2018).
- Nicholson, W. L., Sonenshine, D. E., Noden, B. H., Brown, R. N. Ticks (Ixodia). Medical and Veterinary Entomology. , 603-672 (2019).
- Guerrero, F. D., Lovis, L., Martins, J. R. Acaricide resistance mechanisms in Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitologia Veterinária. 21 (1), 1-6 (2012).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: the state of play. Veterinary Parasitology. 203 (1-2), 6-20 (2014).
- Redshaw, N., et al. A comparison of miRNA isolation and RT-qPCR technologies and their effects on quantification accuracy and repeatability. Biotechniques. 54 (3), 155-164 (2013).
- Estrada-Peña, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Experimental and Applied Acarology. 23 (9), 685-715 (1999).
- Eisen, R. J., Eisen, L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology. 34 (4), 295-309 (2018).
- Bowman, A. S., Sauer, J. R. Tick salivary glands: function, physiology and future. Parasitology. 129, 67 (2004).
- Kim, D., Maldonado-Ruiz, P., Zurek, L., Park, Y. Water absorption through salivary gland type I acini in the blacklegged tick, Ixodes scapularis. PeerJ. 5, 3984 (2017).
- Nunes, P. H., Bechara, G. H., Camargo-Mathias, M. I. Morphological changes in the salivary glands of Amblyomma cajennense females (Acari: Ixodidae) in different feeding stages on rabbits at first infestation. Experimental and Applied Acarology. 45 (3), 199-209 (2008).
- Bishop, R., et al. A cement protein of the tick Rhipicephalusappendiculatus, located in the secretory e cell granules of the type III salivary gland acini, induces strong antibody responses in cattle. International Journal for Parasitology. 32 (7), 833-842 (2002).
- Yamaji, K., et al. A salivary cystatin, HlSC-1, from the ixodid tick Haemaphysalis longicornis play roles in the blood-feeding processes. Parasitology Research. 106 (1), 61-68 (2009).
- Simo, L., Kazimirova, M., Richardson, J., Bonnet, S. I. The essential role of tick salivary glands and saliva in tick feeding and pathogen transmission. Frontiers in Cellular and Infection Microbiology. 7, 281 (2017).
- Perner, J., Kropáčková, S., Kopáček, P., Ribeiro, J. M. C. Sialome diversity of ticks revealed by RNAseq of single tick salivary glands. PLoS Neglected Tropical Diseases. 12 (4), 0006410 (2018).
- Madden, R. D., Sauer, J. R., Dillwith, J. W. A proteomics approach to characterizing tick salivary secretions. Experimental and Applied Acarology. 32 (1), 131-141 (2004).
- Zhou, W., et al. Discovery of exosomes from tick saliva and salivary glands reveals therapeutic roles for CXCL12 and IL-8 in wound healing at the tick-human skin interface. Frontiers in Cell and Developmental Biology. 8, 554 (2020).
- Zhou, W., et al. Exosomes serve as novel modes of tick-borne flavivirus transmission from arthropod to human cells and facilitates dissemination of viral RNA and proteins to the vertebrate neuronal cells. PLoS Pathogens. 14 (1), 1006764 (2018).
- Chávez, A. S. O., et al. Tick extracellular vesicles enable arthropod feeding and promote distinct outcomes of bacterial infection. Nature Communications. 12 (1), 1-17 (2021).
- Pegtel, D. M., Gould, S. J. Exosomes. Annual Review of Biochemistry. 88, 487-514 (2019).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Théry, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nature Cell Biology. 21 (1), 9-17 (2019).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. A. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213 (2018).
- Gioseffi, A., Edelmann, M. J., Kima, P. E. Intravacuolar pathogens hijack host extracellular vesicle biogenesis to secrete virulence factors. Frontiers in Immunology. 12, 662944 (2021).
- Chávez, A. S. O., O'Neal, A. J., Santambrogio, L., Kotsyfakis, M., Pedra, J. H. F. Message in a vesicle-trans-kingdom intercommunication at the vector-host interface. Journal of Cell Science. 132 (6), 224212 (2019).
- Janas, T., Janas, M. M., Sapoń, K., Janas, T. Mechanisms of RNA loading into exosomes. FEBS Letters. 589 (13), 1391-1398 (2015).
- Lu, T. X., Rothenberg, M. E. MicroRNA. Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- Pegtel, D. M., et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences. 107 (14), 6328-6333 (2010).
- Bartel, D. P. MicroRNAs: target recognition and regulatory functions. Cell. 136 (2), 215-233 (2009).
- Ambros, V. MicroRNAs and developmental timing. Current Opinion in Genetics and Development. 21 (4), 511-517 (2011).
- Bushati, N., Cohen, S. M. microRNA functions. Annual Review of Cell and Developmental Biology. 23, 175-205 (2007).
- Hackenberg, M., Langenberger, D., Schwarz, A., Erhart, J., Kotsyfakis, M. In silico target network analysis of de novo-discovered, tick saliva-specific microRNAs reveals important combinatorial effects in their interference with vertebrate host physiology. RNA. 23 (8), 1259-1269 (2017).
- Luo, J., et al. MicroRNA-1 promotes the development of and prolongs engorgement time in Hyalomma anatolicum anatolicum (Acari: Ixodidae) ticks. Biorxiv. , (2020).
- Zhou, J., Zhou, Y., Cao, J., Zhang, H., Yu, Y. Distinctive microRNA profiles in the salivary glands of Haemaphysalis longicornis related to tick blood-feeding. Experimental and Applied Acarology. 59 (3), 339-349 (2013).
- Hermance, M. E., Widen, S. G., Wood, T. G., Thangamani, S. Ixodes scapularis salivary gland microRNAs are differentially expressed during Powassan virus transmission. Scientific Reports. 9 (1), 1-17 (2019).
- Barrero, R. A., et al. Evolutionary conserved microRNAs are ubiquitously expressed compared to tick-specific miRNAs in the cattle tick Rhipicephalus (Boophilus) microplus. BMC Genomics. 12 (1), 1-17 (2011).
- Colombo, M., et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. Journal of Cell Science. 126 (24), 5553-5565 (2013).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. . Proteomic Profiling. , 179-209 (2015).
- Koga, K., et al. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Research. 25, 3703-3707 (2005).
- Wright, K., de Silva, K., Purdie, A. C., Plain, K. M. Comparison of methods for miRNA isolation and quantification from ovine plasma. Scientific Reports. 10 (1), 1-11 (2020).
- Mráz, M., Malinova, K., Mayer, J., Pospisilova, S. MicroRNA isolation and stability in stored RNA samples. Biochemical and Biophysical Research Communications. 390 (1), 1-4 (2009).
- Nawaz, M., et al. miRNA profile of extracellular vesicles isolated from saliva of Haemaphysalis longicornis tick. Acta Tropica. 212, 105718 (2020).
- Ribeiro, J. M. C., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva. Medical and Veterinary Entomology. 18 (1), 20-24 (2004).
- Almazán, C., et al. A versatile model of hard tick infestation on laboratory rabbits. Journal of Visualized Experiments. (140), e57994 (2018).
- Masotti, A., Preckel, T. Analysis of small RNAs with the Agilent 2100 Bioanalyzer. Nature Methods. 3 (8), 658 (2006).
- Benesova, S., Kubista, M., Valihrach, L. Small RNA-sequencing: approaches and considerations for miRNA analysis. Diagnostics. 11 (6), 964 (2021).
- Mackowiak, S. D. Identification of novel and known miRNAs in deep-sequencing data with miRDeep2. Current Protocols in Bioinformatics. 36 (1), 12 (2011).
- Friedländer, M. R., Mackowiak, S. D., Li, N., Chen, W., Rajewsky, N. miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades. Nucleic Acids Research. 40 (1), 37-52 (2012).
- Griffiths-Jones, S. The microRNA registry. Nucleic Acids Research. 32, 109-111 (2004).
- Griffiths-Jones, S., Grocock, R. J., Van Dongen, S., Bateman, A., Enright, A. J. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research. 34, 140-144 (2006).
- Griffiths-Jones, S., Saini, H. K., Van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucleic Acids Research. 36, 154-158 (2007).
- Kozomara, A., Birgaoanu, M., Griffiths-Jones, S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 47, 155-162 (2019).
- Kozomara, A., Griffiths-Jones, S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Research. 39, 152-157 (2011).
- Kozomara, A., Griffiths-Jones, S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Research. 42, 68-73 (2014).
- Wu, F., et al. MicroRNA let-7 regulates the expression of ecdysteroid receptor (ECR) in Hyalomma asiaticum (Acari: Ixodidae) ticks. Parasites and Vectors. 12 (1), 1-13 (2019).
- Goff, S. A., et al. The iPlant collaborative: cyberinfrastructure for plant biology. Frontiers in Plant Science. 2, 34 (2011).
- Merchant, N., et al. The iPlant collaborative: cyberinfrastructure for enabling data to discovery for the life sciences. PLoS Biology. 14 (1), 1002342 (2016).
- Kumar, D., et al. An exploratory study on the microbiome of northern and southern populations of Ixodes scapularis ticks predicts changes and unique bacterial interactions. Pathogens. 11 (2), 130 (2022).
- Zhang, Y., et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. International Journal of Nanomedicine. 15, 6917 (2020).
- Di Leva, G., Croce, C. M. miRNA profiling of cancer. Current Opinion in Genetics and Development. 23 (1), 3-11 (2013).
- Ganju, A., et al. miRNA nanotherapeutics for cancer. Drug Discovery Today. 22 (2), 424-432 (2017).
- Luo, J., et al. MicroRNA-1 Expression and Function in Hyalomma Anatolicum anatolicum (Acari: Ixodidae) Ticks. Frontiers in Physiology. 12, 596289 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten