Method Article
عزل الحمض النووي الريبي الميكروي عن ثقافات الغدد اللعابية خارج الجسم الحي والحويصلات خارج الخلية
In This Article
Summary
يصف هذا البروتوكول عزل الحمض النووي الريبي الميكروي عن الغدد اللعابية القراد والحويصلات خارج الخلية المنقاة. هذا إجراء عالمي يجمع بين الكواشف واللوازم شائعة الاستخدام. تسمح هذه الطريقة أيضا باستخدام عدد صغير من القراد ، مما يؤدي إلى microRNAs عالية الجودة التي يمكن تسلسلها بسهولة.
Abstract
القراد هي طفيليات خارجية مهمة يمكنها نقل مسببات الأمراض المتعددة. الغدد اللعابية للقراد ضرورية للتغذية لأن لعابها يحتوي على العديد من المؤثرات ذات الخصائص الصيدلانية التي يمكن أن تقلل من الاستجابات المناعية للمضيف وتعزز انتقال مسببات الأمراض. مجموعة واحدة من هذه المؤثرات هي microRNAs (miRNAs). miRNAs هي تسلسلات قصيرة غير مشفرة تنظم التعبير الجيني المضيف في واجهة القراد والمضيف وداخل أعضاء القراد. يتم نقل هذه الحمض النووي الريبي الصغير في لعاب القراد عبر الحويصلات خارج الخلية (EVs) ، والتي تخدم الاتصالات بين الخلايا وداخلها. تم تحديد الحويصلات التي تحتوي على miRNAs في لعاب القراد. ومع ذلك ، لا يعرف سوى القليل عن أدوار وملامح miRNAs في الحويصلات والغدد اللعابية القراد. علاوة على ذلك ، تتطلب دراسة الحويصلات و miRNAs في لعاب القراد إجراءات شاقة لجمع لعاب القراد. يهدف هذا البروتوكول إلى تطوير والتحقق من صحة طريقة لعزل miRNAs من الحويصلات خارج الخلية النقية التي تنتجها مزارع الأعضاء خارج الجسم الحي . يتم وصف المواد والمنهجية اللازمة لاستخراج miRNAs من الحويصلات خارج الخلية والغدد اللعابية القراد هنا.
Introduction
القراد هي طفيليات خارجية تنقل العديد من مسببات الأمراض إلى الحياة البرية والماشية والبشر وحيواناتهم الأليفة 1,2. تؤدي تغذية القراد إلى خسارة اقتصادية كبيرة من خلال التسبب في تلف الاختباء ، وتقليل الوزن وإنتاج الحليب بسبب فقر الدم الشديد ، وانتقال مسببات الأمراض التي يحتمل أن تكون قاتلة مسببة للأمراض1،3،4،5. وتركز ممارسات المكافحة الحالية لإدارة مجموعات القراد على استخدام مبيدات القراد. ومع ذلك، فإن الظهور المستمر لمقاومة مبيدات الآفات في القراد المتطفل على الماشية5,6، وزيادة حدوث لدغات القراد7، وانتقال مسببات الأمراض داخل المناطق السكنية 8,9، أدت إلى الحاجة إلى بدائل فريدة لمكافحة القراد.
الغدد اللعابية القراد هي أعضاء أساسية تضمن النجاح البيولوجي للقراد. يتم تشكيلها من قبل أنواع مختلفة من الأسينوس (الأول والثاني والثالث والرابع) مع وظائف فسيولوجية مختلفة. الغدد اللعابية هي المسؤولة عن التنظيم الأسموزي ، سواء خارج أو على المضيف ، عن طريق إعادة فائض الماء ومحتوى الحديد إلى المضيف عن طريق إفراز اللعاب 2,10. وتشارك أيضا من النوع الأول من الأسيني في امتصاص الماء من الغلاف الجوي عن طريق إفراز اللعاب استرطابي10,11. يتم إنتاج البروتينات المستجيبة للعاب ، مثل الأسمنت والسيستاتين ، داخل الخلايا الإفرازية في النوع الثاني والثالث من الأسيني10,12. لا يؤثر النوع الأول من الأسيني على تغذية القراد ، مما يشير إلى أن تناول دقيق الدم لا يؤدي إلى تغيرات مورفولوجية وفسيولوجية في هذا النوع من الأسيني13,14. من ناحية أخرى ، يتم تنشيط Acini من النوع الثاني والثالث أثناء التغذية ويقدم القليل جدا من النشاط قبل التعلق. وبالتالي ، فإن التغذية ضرورية لتحفيز تضخم الخلايا الإفرازية داخل النوع الثاني من الأسيني وإنتاج المركبات النشطة بيولوجيا. يتم تقليل حجم الأسيني من النوع الثالث أثناء التغذية بسبب الإفراز داخل الحبيبات الإفرازية12.
الغدد اللعابية هي أيضا موقع العدوى المسببة للأمراض في القراد وطريق الانتقال. أثناء التغذية ، تفرز القراد العديد من المركبات ذات التأثيرات الصيدلانية اللازمة لإكمال دقيق الدمبنجاح 10،15،16. هذه المركبات لها خصائص مضادة للالتهابات ومثبطة للمناعة وموسعة للأوعيةالدموية 10،15،17. وقد أظهرت الدراسات الحديثة أن الحويصلات خارج الخلية (EVs) المشتقة من الغدد اللعابية القراد تؤوي العديد من هذه المركبات ، مما يؤدي إلى تأثيرات مضادة للالتهابات ومناعية18،19،20. "الحويصلات خارج الخلية" هو مصطلح شامل يستخدم لوصف الحويصلات المصنفة على أنها إكسوسومات وحويصلات دقيقة بناء على حجمها ونشأتها الحيوية. بشكل عام ، EVs هي بقع دهنية ذات أغشية ثنائية الطبقة تبلغ ~ 40 نانومتر - 1 ميكرومتر في الحجم21 ؛ بشكل عام ، توصف الإكسوسومات بأنها بحجم 40-150 نانومتر ، في حين أن الحويصلات الدقيقة تتراوح بين 150 نانومتر - 1 ميكرومتر في الحجم21،22،23. ومع ذلك ، فإن الحجم لا يدل على مسار التكوين الحيوي للمركبات الكهربائية22.
يبدأ التكوين الحيوي للإكسوسومات بالغزو المتسلسل لغشاء البلازما. يؤدي هذا الغزو إلى تكوين أجسام متعددة الحويصلات ويؤدي في النهاية إلى تشوه الغشاء الحويصلي بفعل مجمعات ESCRT أو sphingomyelinases (sMases)24,25. يمكن إما تحليل الإكسوسومات داخل الليزوسومات للحفاظ على التوازن الخلوي أو الخروج عن طريق الاندماج الحويصلي إلى غشاء البلازما لتوصيل المكونات الخلوية إلى الخلايا المتلقية21,24. من ناحية أخرى ، تتشكل الحويصلات الدقيقة من خلال عمل flopass و flipassess ، مما يغير تشكيل الدهون في غشاء البلازما26. المركبات الكهربائية ضرورية للاتصال من خلية إلى خلية ، وتعمل كنظام نقل للبضائع داخل الخلايا ، مثل الدهون والبروتينات والأحماض النووية والحمض النووي الريبي الميكروي (miRNAs) 21،27،28. بمجرد نقلها ، تقوم هذه الحويصلات بتوصيل حمولتها إلى سيتوبلازم الخلايا المتلقية ، مما يولد تغيرات في النمط الظاهري في الخلية المستقبلة22,29. نظرا لأهمية الحويصلات خارج الخلية في تغذية القراد والتلاعب باستجابات المناعة المضيف والتئام الجروح18,20 ، فإن الشحنة داخل الحويصلات خارج الخلية تمثل أهدافا محتملة لتطوير علاجات مضادة للقراد وآلية فريدة لتعطيل تغذية القراد. وهذا يشمل miRNAs داخل الغدد اللعابية القراد والحويصلات خارج الخلية المشتقة من الغدة اللعابية.
miRNAs هي تسلسلات قصيرة غير مشفرة ، ~ 18-22 نيوكليوتيد (nt) في الطول ، والتي يمكن أن تنظم بعد النسخ أو تحلل أو تسكت تسلسلات mRNA30,31. أثناء النسخ ، يتم شق pri-miRNAs بواسطة Dicer (RNA polymerase III) لتشكيل بنية مميزة تشبه دبوس الشعر ، لتصبح ما قبل miRNA. يتم قطع الحمض النووي الريبوزي المرسال المسبق مرة أخرى بواسطة دروشا (RNA polymerase III) لتشكيل دوبلكس miRNA ناضج. يصبح التسلسل الناضج مدمجا في مجمع إسكات الحمض النووي الريبي الناجم عن الحمض النووي الريبي الريبي (RISC) المكمل لتسلسل الحمض النووي الريبوزي المرسال ، مما يتسبب في قمع الترجمة أو تدهور الحمض النووي الريبي المرسال28،30،32. أثناء تغذية المضيف ، يمكن ل miRNAs داخل لعاب القراد تعديل التعبير الجيني للمضيف لقمع الاستجابات المناعية وتعزيز انتقال مسببات الأمراض33،34،35،36،37. على الرغم من وجود دراسات مكثفة حول المركبات الكهربائية والحمض النووي الريبوزي المرسال ، إلا أن أدوارها أثناء التغذية في واجهة مضيف القراد لا تزال غير مفهومة بشكل جيد. يعد تحسين البروتوكولات التي يمكن أن تؤدي بسهولة إلى عزل وتنقية الحمض النووي الريبوزي المرسال عالي الجودة أمرا بالغ الأهمية لتعزيز معرفتنا حول هذه المواضيع.
يمكن استخدام خيارات متعددة لعزل المركبات الكهربائية ، مثل الطرد المركزي الفائق ، وهطول الأمطار الخارجية ، وهطول الأمطار البوليمر ، وكروماتوغرافيا التقارب المناعي ، وتقنيات الاستبعاد القائمة على الحجم38. ومع ذلك ، لا يمكن لهذه التقنيات التمييز بين الإكسوسومات أو الحويصلات الدقيقة. وبالتالي ، كما ذكرنا سابقا ، يتم استخدام EV كمصطلح شامل عند عزل EVs من عينات مختلفة. تمثل الحويصلات المعزولة في التجارب الموصوفة هنا خليطا من الحويصلات المشتقة من مسارات التخلق الحيوي المختلفة. يمكن تحقيق مزيد من التنقية لمجموعة محددة من الحويصلات خارج الخلية عن طريق الترسيب المناعي باستخدام الخرز المطلي بالأجسام المضادة ضد العلامات (أي العلامات الخارجية ، علامات الورم) الفريدة من نوعها لمجموعة الحويصلات ذات الأهمية39,40. يمكن أيضا استخراج miRNAs عبر مجموعات عزل مختلفة متاحة تجاريا 7,41,42.
كان الهدف من هذا المشروع هو تطوير بروتوكول يجمع بين الطرق المطبقة بشكل شائع لعزل المركبات الكهربائية واستخراج miRNA من كل من EVs والغدد اللعابية المغذية. نظرا لأن إفراز المركبات النشطة بيولوجيا يتم تنشيطه عن طريق تغذية12 ، يجب السماح للقراد بالتغذية لتحديد miRNAs التي قد تكون مهمة للتلاعب باستجابات المناعة والتئام الجروح للمضيف. يتطلب البروتوكول الحالي عددا صغيرا من القراد (20 علامة) لعزل المركبات الكهربائية والحمض النووي الريبوزي المرسال الخاص بها ، مقارنة بالدراسات الأخرى الموصوفة سابقا التي تطلبت 2000 علامة43. علاوة على ذلك ، فإنه يتجنب تلوث إفرازات اللعاب بالبيلوكاربين44 ، مما قد يؤثر على التجارب التي تدرس تأثير EVs و miRNAs على الخلايا المضيفة.
Protocol
تم إجراء جميع التجارب على الحيوانات وفقا لبروتوكول استخدام الحيوانات (AUP # 2020-0026) المعتمد من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها (AICUC) في جامعة تكساس إيه آند إم. تم استخدام أنواع القراد ، Ixodes scapularis و Rhipicephalus (Boophilus) microplus ، والأرانب البيضاء الذكور النيوزيلندية ، 42-72 يوما من العمر ، لهذه الدراسة. تم استلام I. scapularis من مركز السيطرة على الأمراض (CDC) وجامعة ولاية أوكلاهوما ، معتمدا على أنه خال من مسببات الأمراض. تم تربية R. microplus في مختبر أبحاث القراد حمى الماشية في إدينبورغ ، تكساس. تم الحصول على الأرانب من مصادر تجارية (انظر جدول المواد). يمكن لهذا البروتوكول أن يعزل عالميا الحويصلات خارج الخلية والحمض النووي الريبوزي المرسال من أنواع القراد المختلفة ومراحل الحياة والأنسجة.
1. تربية الإناث I. الكتف وإعداد كبسولة
- تحضير كبسولة رغوة خلات الإيثيلين والفينيل باتباع إجراءات الأرانب الصلبة التي تتغذى على القراد45. ضع كبسولة واحدة على كل شفرة كتف للأرنب لما مجموعه كبسولتان لكل إصابة.
ملاحظة: باختصار ، تتكون هذه الكبسولات من مربعين من رغوة خلات الإيثيلين والفينيل مع مساحة فارغة داخلية. يتم لصق مربع واحد على الجزء الخلفي من الحيوان (في هذه الحالة ، الأرانب) مع لاصق الأنسجة (انظر جدول المواد). يتم لصق شبكة دقيقة على المربع الثاني لتجنب هروب القراد. يتم إغلاق المربعين باستخدام شريط خطاف ذاتي اللصق. - اسمح للكبسولات بضبط 24 ساعة قبل لصق الكبسولة على الأرانب. تخزين كبسولات الرغوة في درجة حرارة الغرفة.
ملاحظة: يمكن تخزين الكبسولات إلى أجل غير مسمى في درجة حرارة الغرفة. - التمسك الكبسولة إلى الأرانب حلق إلى الجلد وترك لمدة 24 ساعة قبل الإصابة القراد.
2. إعداد وسائط خالية من الحويصلات
- لإعداد وسائط خالية من الحويصلة 13 ، اجمع بين 0.5 مل من مصل البقر الجنيني ، و 0.5 مل من مرق فوسفات التربتوز ، و 0.1 مل من تركيز البروتين الدهني والكوليسترول بنسبة 10٪ ، و 0.5 مل من بيكربونات الصوديوم بنسبة 5٪ (NaHCO3) ، و 0.25 مل من 4-(2-hydroxyethyl) -1-piperazineethanesulfonic acid (HEPES) ، و8.125 مل من L15C300 المتوسطة (انظر جدول المواد). اضبط مستوى صوت الوسط حسب الحاجة. ضع الوسط في زجاجة طرد مركزي من البولي كربونات سعة 26.3 مل.
- قم بموازنة الزجاجات بفارق وزن قدره 0.01 جم كحد أقصى لضمان الأداء السليم لجهاز الطرد المركزي الفائق.
- جهاز الطرد المركزي الفائق الوسط لمدة 18 ساعة عند 100000 × g عند 4 درجات مئوية. قم بإزالة السوبرناتانت عن طريق الماصة ، مع التأكد بعناية من عدم إزعاج أي حبيبات متشكلة.
- انقل المادة الفائقة إلى أنبوب طرد مركزي جديد وأجهزة طرد مركزي فائقة للمرة الثانية لمدة 18 ساعة عند 100000 × جم عند 4 درجات مئوية ، مع توازن مناسب.
- اعزل المادة الفائقة المتبقية ومرر عبر مرشح حقنة 0.22 ميكرومتر لإزالة الملوثات. ماصة السوبرناتانت في أنبوب طرد مركزي 50 مل.
- قم بتخزين المادة الفائقة في ثلاجة -20 درجة مئوية حتى الحاجة إليها أو حتى 3 سنوات.
3. إصابة الأرانب
- قطع الجزء العلوي من حقنة 10 مل وتحميل الإناث الكبار I. scapularis باستخدام فرشاة الطلاء القياسية.
- قم بتغطية فتحة المحقنة باستخدام شاش معقم (الشكل 1).
- ضع الأرنب على سطح طاولة أو سطح عمل أفقيا ؛ لف الأرنب بإحكام بمنشفة وقم بتغطية كلتا العينين ، تاركا الكبسولة المحضرة (الخطوة 1.1) معرضة لإصابة الأرنب بالقراد.
- افتح الكبسولة وأدخل القراد عن طريق دفع مقبض المحقنة. إيداع القراد بالقرب من جلد الأرنب. أغلق الكبسولات بسرعة لمنع القراد من الهروب.
- وفقا للتصميم التجريبي ، اسمح للقراد الإناث بالتغذية طالما دعت الحاجة. لا تسمح للذكور Ixodes scapularis بالبقاء في الكبسولة لأكثر من 24 ساعة لتجنب الجفاف.
ملاحظة: عدد القراد الذي سيتم ضربه في الحيوانات هو حسب تقدير المحقق. استخدم هذا البروتوكول ~ 100 قراد لكل إصابة لحساب الوفيات والمواد الكافية للنسخ المتماثلة. وحددت التجارب الأولية أن هناك حاجة إلى ما لا يقل عن 20 علامة / تكرار للحصول على ما يكفي من المواد لتسلسل الحمض النووي الريبوزي المرسال.
4. إزالة الإناث تغذية
- ضع الأرانب الموبوءة تحت 2٪ من الأيزوفلوران في الأكسجين باستخدام ناشر الغاز. اضبط معدل الأكسجين بين 700-1000 لتر / دقيقة.
ملاحظة: يمكن استخدام مواد تخدير أخرى لتجنب أي ضائقة أو ألم. - قم بإزالة الإناث التي يتم تغذيتها عن طريق الإمساك بالقراد بواسطة استسلامها ، باستخدام ملقط ناعم ، أقرب ما يمكن إلى الجلد. تأكد من إزالة أجزاء الفم بالكامل لتجنب العدوى البكتيرية.
- ضع القراد في أنبوب طرد مركزي 15 مل.
- نظف موقع العضة بنسبة 70٪ من الإيثانول وأضف كمية صغيرة من المضادات الحيوية الثلاثية (قيمة أطراف الأصابع ، انظر جدول المواد) لمنع العدوى في موقع لدغة القراد.
- احمل القراد إلى المختبر للتشريح (الخطوة 5). قم بإجراء هذه التشريحات في غضون 24-48 ساعة من إزالة القراد لتجنب تدهور الغدد اللعابية15,43.
5. تشريح الغدة اللعابية وإفراز الحويصلة خارج الخلية
- أضف 500 ميكرولتر من الوسط الخالي من الحويصلة (الخطوة 2) مع 5 ميكرولتر من البنسلين 100x ، و 5 ميكرولتر من الستربتومايسين 100x ، و 5 ميكرولتر من 10 ملغ / مل من ريفامبيسين ، و 5 ميكرولتر من 100x amphotericin إلى كل بئر (انظر جدول المواد). أضف 1x PBS مع ريفامبيسين إلى أي آبار لا تحتوي على وسط خال من الحويصلات لمنع نمو البكتيريا.
- ضع القراد على شريحة زجاجية مجهرية واضحة مع شريط سجاد على الوجهين تحت مجهر تشريح. لمنع جفاف الأعضاء ، أضف 10 ميكرولتر من 1x PBS إلى كل علامة قبل التشريح.
- باستخدام مقص فانياس 4 مم (انظر جدول المواد) ، قم بعمل شق صغير يبلغ ~ 1 مم على جانب كل أنثى. إزالة الجانب الظهري من القراد تماما (الشكل 2) وإزالة كل من الغدد اللعابية.
- ضع 20-40 غدة لعابية من القراد في 500 ميكرولتر من الوسط الخالي من الحويصلات المضاف إلى بئر واحد في صفيحة معالجة بزراعة الأنسجة من 24 بئرا (الشكل 3).
- احتضان عينات الغدة اللعابية عند 32 درجة مئوية لمدة 24 ساعة للسماح بإفراز المركبات الكهربائية.
6. عزل الحويصلات خارج الخلية
- بعد 24 ساعة من الحضانة ، قم بماصة جميع الوسائط التي تحتوي على الغدد اللعابية في أنبوب طرد مركزي دقيق 1.5 مل.
- الطرد المركزي للعينة عند 300 × g عند 4 درجات مئوية لمدة 10 دقائق لعزل الغدد اللعابية. سيتم فصل مرحلتين في هذه الخطوة: (1) supernatant التي تحتوي على EVs و (2) الغدد اللعابية (الكريات).
- لمواصلة عزل المركبات الكهربائية ، قم بماصة السوبر نات في أنبوب طرد مركزي دقيق جديد سعة 1.5 مل. أعد تعليق الكريات التي تحتوي على الغدد اللعابية (الخطوة 6.2) في 500 ميكرولتر من الحمض النووي الريبي لاحقا (انظر جدول المواد) وتخزينها عند -80 درجة مئوية حتى استخدامها أو إلى أجل غير مسمى.
ملاحظة: سيتم استخدام هذه الغدد اللعابية لعزل الحمض النووي الريبوزي المرسال في الخطوة 8. - جهاز الطرد المركزي الفائق عند 2000 × g عند 4 درجات مئوية لمدة 10 دقائق لإزالة الحطام الخلوي. ماصة السوبرناتانت في أنبوب جديد 1.5 مل microcentrigege. تخلص من الكرية.
- قم بطرد مركزي لجهاز الطرد المركزي عند 10000 × g لمدة 30 دقيقة عند 4 درجات مئوية لإزالة الأجسام الماصة والمركبات الكهربائية الأكبر. رمي الكريات ، وماصة supernatant في أنبوب جديد 1.5 مل microcentrifuge.
- قم بتوصيل حقنة سعة 10 مل بفلتر حقنة نايلون سعة 1 ميكرومتر. ضع المحقنة والفلتر فوق أنبوب الطرد المركزي الفائق (الشكل 4A). ثم أضف العينة (الشكل 4B) واملأ المحقنة ب 10 مل من 1x PBS (الشكل 4C) ، وقم بموازنة الأنبوب وفقا لذلك (الشكل 4D).
- ضع الأنابيب في دوار 70Ti (انظر جدول المواد) وقم بالدوران عند 100000 × g لمدة 18 ساعة عند 4 درجات مئوية.
- بعد 18 ساعة من الطرد المركزي الفائق ، لاحظ حبيبة في الطرف السفلي من الأنبوب (الشكل 5). الكريات هي الحويصلات المركزة خارج الخلية.
- قم بإزالة 90٪ -100٪ من supernatant دون تعليق بيليه EV. أعد تعليق الكريات باستخدام 1x PBS. إذا لم يكن من الممكن إزالة جميع المواد الخارقة ، فاستخدم السوبرناتانت المتبقي لإعادة تعليق الكريات.
- ماصة 500 ميكرولتر من بيليه EV / supernatant في مرشح طرد مركزي 300 K (انظر جدول المواد).
ملاحظة: سيؤدي ذلك إلى إزالة أي بروتينات غير مرتبطة بالحويصلات و miRNAs وجزيئات أخرى ، في حين أن الحويصلات لن تمر عبر الفلتر. - جهاز طرد مركزي عند 8000 × g لمدة 10 دقائق في درجة الحرارة المحيطة. كرر الخطوة 6.10 حتى تمر جميع كريات EV / supernatant عبر الفلتر.
- أضف 400 ميكرولتر من 1x PBS المعقم إلى العمود واخلطه جيدا عبر ماصة لإزالة المركبات الكهربائية المتصلة بالغشاء. ضع العينة في أنبوب خال من الحمض النووي / RNase سعة 1.5 مل. يمكن تخزين العينات عند -80 درجة مئوية إلى أجل غير مسمى أو حتى استخدامها. تجنب ذوبان العينات المفرط لمنع تدهور العينة.
ملاحظة: ضع الأنابيب على الجليد عند إخراجها من جهاز الطرد المركزي الفائق لمنع تدهور المركبات الكهربائية. ستكون العينة النهائية هي بيليه EV في 400 ميكرولتر من 1x PBS. سيتم استخدام 25 ميكرولتر من هذه العينة لتحليل تتبع الجسيمات النانوية (NTA ، الخطوة 7) ، و 375 ميكرولتر لعزل miRNA (الخطوة 8).
7. تحليل تتبع الجسيمات النانوية (NTA)
- خذ 25 ميكرولتر من العينة النهائية (الخطوة 6.12) وأضف 375 ميكرولتر من 1x PBS.
- قم بتحميل العينة المخففة في حقنة بدون إبرة سعة 1 مل وقم بتثبيتها بإحكام على العدسة البصرية ل NTA.
- اضبط الإعدادات وفقا لذلك والتقط مقاطع الفيديو بناء على تفضيلات الإعداد.
ملاحظة: في هذه الدراسة ، تم أخذ ثلاث قراءات من 60 ثانية لكل منها. تمثل كل قراءة NTA نسخة طبق الأصل من الناحية الفنية. تمثل العينات المختلفة من تغذية القراد لنفس المدة الزمنية تكرارات بيولوجية فردية. تم تعيين الكاميرا في المستوى 7 وتم تعيين عتبة الكشف على المستوى 5. - قم بتقدير الأرقام EV النهائية بالصيغة التالية:
((بدء تركيز المركبات الكهربائية (عامل التخفيف)) * (إجمالي الحجم المتبقي في أنبوب العينة)/1000) = إجمالي المركبات الكهربائية في العينة
ملاحظة: يجب قسمة وحدة التخزين على 1000 لأن NTA يقرأ العينات كتركيز/مل.
8. استخراج الحمض النووي الريبوزي المرسال من الغدد اللعابية والحويصلات خارج الخلية
- أضف 100 ميكرولتر من كاشف التحلل (انظر جدول المواد) إلى العينة المتبقية من الخطوة 6.12 وتجانس مع المدقات المعقمة (الشكل 6).
- أضف 600 ميكرولتر المتبقية من كاشف التحلل واحتضنها لمدة 5 دقائق في درجة حرارة الغرفة.
- أضف 140 ميكرولتر من الكلوروفورم ، ورجه بقوة لمدة 15 ثانية ، واحتضنه لمدة 3 دقائق في درجة حرارة الغرفة.
- تدور عند 12000 × جم لمدة 15 دقيقة عند 4 درجات مئوية.
- ماصة المرحلة العليا الواضحة ، وتجنب الطور البيني ، في أنبوب جديد 1.5 مل. سيؤدي ذلك إلى ~ 525 ميكرولتر من حجم العينة المتوقع. بعد ذلك ، أضف حجما 1: 1 من الإيثانول الجزيئي بنسبة 100٪.
- أضف 700 ميكرولتر من العينة إلى عمود دوران عزل الحمض النووي الريبي (انظر جدول المواد).
- تدور بسرعة 8000 × جم لمدة 30 ثانية في درجة الحرارة المحيطة، وتتخلص من التدفق من خلالها.
- اغسل العينة ب 700 ميكرولتر من المخزن المؤقت RTE (انظر جدول المواد) ، وقم بالدوران عند 8000 × g لمدة 30 ثانية ، وتخلص من التدفق من خلال.
- اغسل العينة باستخدام 500 ميكرولتر من المخزن المؤقت RPE (انظر جدول المواد) ، وقم بالدوران عند 8000 × g لمدة 30 ثانية ، وتخلص من التدفق من خلال.
- أضف 500 ميكرولتر من الإيثانول الجزيئي بنسبة 80٪ وقم بالدوران عند 8000 × g لمدة 2 دقيقة ، وتخلص من التدفق من خلال.
- قم بتدوير العمود بأقصى سرعة لمدة 5 دقائق لتجفيف الغشاء. تخلص من أنبوب التجميع وضع العمود على أنبوب microfuge جديد سعة 1.5 مل.
- أضف 14 ميكرولتر من الماء الخالي من RNase-/DNase إلى الغشاء واحتضنه لمدة 5 دقائق في درجة حرارة الغرفة.
- جهاز طرد مركزي عند 21000 × g لمدة 1 دقيقة في درجة حرارة الغرفة.
- أضف 1 ميكرولتر من مثبطات RNase (انظر جدول المواد) إلى miRNAs المنفرة واخلطها جيدا عبر الماصة.
ملاحظة: قبل استخراج الحمض النووي الريبوزي المرسال من الغدد اللعابية، قم بإزالة أي حمض نووي ريبي لاحق عن طريق إضافة 1 مل من 1x PBS (حجم 1:1) وقم بتدوير الغدد اللعابية بسرعة قصوى لمدة 15 دقيقة عند 4 درجات مئوية. يجب تكرار ذلك ثلاث مرات أو حتى تهدأ الغدد اللعابية بما يكفي لإزالة السوبرناتانت. عند هذه النقطة، تمثل العينة مزيجا من الحمض النووي الريبي الصغير الذي يبلغ حجمه ~ 20-150 نقطة أساس (الشكل التكميلي 1).
9. قياس تركيز الحمض النووي الريبوزي المرسال
- قياس تركيز الحمض النووي الريبي الصغير عبر مجموعة فحص الحمض النووي الريبي المتاحة تجاريا41 (انظر جدول المواد).
- في كل أنبوب، امزج 199 ميكرولتر من المخزن المؤقت للتخفيف (المكون A و B المقدمان في المجموعة لكل عينة)، و 1 ميكرولتر من صبغة الفلورسنت الخاصة بالكشف عن الحمض النووي الريبوزي المرسال (قياس الطول الموجي 260 نانومتر) (لكل عينة)، و 2 ميكرولتر من الحمض النووي الريبي الصغير (الخطوة 8) لكل عينة، وفقا لتعليمات الشركة المصنعة.
- قبل قراءة أنابيب العينة، اقرأ معيار miRNA المخفف مسبقا 1 والمعيار 2 (المتوفر في المجموعة) لإنشاء منحنى قياسي قبل قياس العينة.
ملاحظة: تستخدم المعايير كأداة مقارنة لتحديد تركيز الحمض النووي الريبوزي المرسال المقاس في العينات. - ضع كل أنبوب قياسي وعينة في مقياس الفلورومتر المخصص (انظر جدول المواد) لقياس التركيز على أنه ng/μL.
10. تحديد جودة الحمض النووي الريبوزي المرسال
- حدد جودة الحمض النووي الريبوزي المرسال وغيره من الحمض النووي الريبي الصغير عن طريق الرحلان الكهربائي الهلامي باستخدام محلل حيوي46 ، باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- قبل قراءة العينة، قم بتطبيع العينات لتكون بنفس التركيز.
- اقرأ العينات من خلال شريحة RNA صغيرة41,46 ، باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
ملاحظة: لتحديد جودة miRNA، فإن الصور الشبيهة بالهلام (النطاقات) والكهروفيروجرام (القمم) هي مؤشرات على جودة العينة. كلما كانت الفرقة في الجل أغمق ، كانت جودة miRNA أفضل. كلما كان النطاق أخف وزنا (أو في حالة عدم وجود نطاق) ، كلما كانت الجودة أقل أو أثبت تدهور العينة46,47.
11. إثراء الحمض النووي الريبي الميكروي
- قم بإثراء الحمض النووي الريبي المرسال باستخدام مجموعة تسلسل صغيرة للحمض النووي الريبي، باتباع تعليمات الشركة المصنعة لمجموعة إعداد عينات الحمض النووي الريبي الصغيرة (انظر جدول المواد).
- قم بربط كل عينة بمحول أدينيلي 3 أقدام وقم بإزالة المحول الزائد عن طريق تنظيف الخرزة. بعد ذلك ، أضف محول 5 أقدام وقم بإزالة المحول الزائد عن طريق تنظيف الخرزة48.
ملاحظة: تم توفير كل من المحولات والخرز للتنظيف في مجموعة تسلسل الحمض النووي الريبي الصغيرة من القسم 11.1 (انظر جدول المواد). - لتوليف الخيط الأول، قم بإعداد مزيج رئيسي من العينات المربوطة بكل من المحولات، والمخزن المؤقت RT، والنسخ العكسي M-MuLV المتوفر في المجموعة (انظر جدول المواد). بعد ذلك ، احتضن المزيج لمدة 30 دقيقة عند 42 درجة مئوية و 10 دقائق عند 90 درجة مئوية. المتابعة مع تنظيف عينة كما هو مذكور في التعليمات.
- قم بتضخيم الشريط الأول باستخدام التمهيدي الأمامي RT والتمهيدي العالمي العكسي المقدم في المجموعة (انظر جدول المواد) عبر تفاعل البوليميراز المتسلسل التقليدي (PCR) لمدة دقيقتين عند 95 درجة مئوية ، ثم لمدة 12-25 دورة لمدة 20 ثانية عند 95 درجة مئوية ، و 30 ثانية عند 60 درجة مئوية ، و 15 ثانية عند 72 درجة مئوية. وأخيرا، 2 دقيقة عند 72 درجة مئوية.
ملاحظة: من المتوقع أن يكون حجم منتج PCR ~ 150 نقطة أساس (الشكل 7). - قم بقياس جودة منتج PCR عبر محطة الشريط باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- تسلسل العينات باستخدام نظام تسلسل من الجيل التالي (75 دورة)، باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
ملاحظة: لتخصيب miRNA، يجب التحقق من كمية العينة وجودتها (الخطوات من 9 إلى 10) قبل إعداد المكتبة.
12. تحليل المعلوماتية الحيوية
- تحديد الحمض النووي الريبوزي المرسال المحفوظ والفريد من نوعه باستخدام أداة تطبيق متكاملة لتحديد الحمض النووي الريبوزي المرسال.
ملاحظة: في هذه الدراسة ، تم إجراء تحديد miRNA عبر miRDeep249,50. miRDeep2 هو كتالوج مجاني على الإنترنت لجميع miRNAs المحفوظة والجديدة المحددة الموجودة في أنواع مختلفة49,50 (انظر جدول المواد). - قم بمحاذاة القراءات مع الجينوم المقابل باستخدام مخطط الخرائط المدمج مع البرنامج.
- أدخل المعلمات التالية في وحدة تخطيط الخرائط.
- قم بقص تسلسلات المحول المضافة من الخطوة 11.2 وقم بإزالة التسلسلات التي يقل طولها عن 18 نيوكليوتيدات. إزالة تسلسلات القراءة الزائدة.
- تحويل الملفات باستخدام التحليل إلى معلمة تنسيق FASTA ، فقط إذا لم يكن الملف بتنسيق FASTA49.
- قم بمحاذاة التسلسلات المصفاة والمشذبة مع الجينوم المقابل. إذا لم يكن هناك جينوم للأنواع ذات الأهمية ، فقم بالمحاذاة مع أقرب الأنواع المتماثلة.
- إظهار ملفات الإخراج ك "reads.fa" و "reads_vs_genome.arf". سيحتوي "read.fa" فقط على القراءات غير الزائدة عن الحاجة ، وسيتضمن "reads_vs_genome.arf" القراءات المعينة المحاذية للجينوم.
- باستخدام كل من ملفات الإخراج من الخطوة 12.2 ، قم بإجراء تنميط تعبير miRNA باستخدام المقياس الكمي المدمج مع البرنامج.
- قم بتنزيل الأنواع ذات الأهمية من تسلسلات سلائف miRNA وتسلسلات miRNA الناضجة من miRBase 51,52,53,54,55,56. إذا لم تكن هناك سلائف أو تسلسلات ناضجة للأنواع ذات الأهمية ، فقم بتنزيل "hairpin.fa.gz" و "mature.fa.gz" اللذين يحتويان على جميع السلائف والتسلسلات الناضجة لجميع الكائنات الحية المتاحة على miRBase.
- قم بإلغاء ضغط ملفات "hairpin.fa.gz" و "mature.fa.gz".
- أدخل ملفات "reads.fa" و "read_vs_genome.arf" من القسم 12.3.4 والملفات غير المضغوطة من 12.4.2.
- اقرأ ملفات الإخراج ك "outputname.csv" و "outputname.html" و "outputname.pdf". يمكن تعيين اسم ملف الإخراج وفقا للمحقق.
ملاحظة: سيحتوي الملف "outputname.csv" على ملفات تعريف التعبير. وعلى وجه التحديد، سيكون لملف تعريف التعبير معرف miRNA، ومجموع القراءات لجميع العينات التي تم تعيينها إلى miRNA، وعدد القراءات التي تم تعيينها إلى miRNA محدد لكل عينة، ومعرف السلائف المقابل ل miRNAs الناضجة. سيحتوي "اسم الإخراج.html" من الخطوة 12.4.4 على روابط إلى متصفح الجينوم بجامعة سانتا كروز (USCS) والمركز الوطني لمعلومات التكنولوجيا الحيوية (NCBI) و miRBase. وسيحتوي كل من USCS وNCBI على تسلسلات الاستعلام الخاصة بالسلائف الحالية مقابل قاعدة بيانات النوكليوتيدات غير الزائدة عن الحاجة، وسيحتوي miRBase على معلومات عن سلائف miRNA الحالية. سيكون ل "اسم الإخراج.pdf" البنية الثانوية للحمض النووي الريبي للحمض النووي الريبي المعبر عنه ومحاذاة تسلسل السلائف.
- لتحديد الحمض النووي الريبوزي المرسال الفريد والمحفوظ، استخدم miRDeep2.
- استخدم ملفات الإخراج من الخطوة 12.3.4 والخطوة 12.4.2 كملفات إدخال.
ملاحظة: ستحتوي ملفات الإخراج التي تقرأ على أنها "اسم الإخراج.html" على تنبؤات الحمض النووي الريبي المرسال الفريد والمحفوظ في العينة. - استخدم الدرجات >1 لتنميط الحمض النووي الريبوزي المرسال والدرجات >4 لمزيد من التحليل التجريبي، مثل تثبيط الحمض النووي الريبوزي المرسال ومحاكاة الحمض النووي الريبوزي المرسال الداخلي34,36,57.
- حدد وحدد miRNAs الفريدة من miRbase بناء على ما يلي: درجة miRDeep2 (الخطوة 12.5.3) ، وتقدير الاحتمال الحقيقي (>90٪) ، وقيمة p-value p-value كبيرة للراندfold (<0.05) 49,50,56.
ملاحظة: تم إجراء تحليل المعلوماتية الحيوية عبر miRDeep2 في Cyverse Discovery Environment58,59 ، وهي منصة مجانية عبر الإنترنت لتحليل المعلوماتية الحيوية. تمت مقارنة miRNAs المحفوظة والفريدة التي تم تحديدها من خلال miRDeep2 مع جميع الأنواع من miRbase. يمكن مقارنة تحديد miRDeep2 المستقبلي بالجينوم المقابل للأنواع ذات الاهتمام.
- استخدم ملفات الإخراج من الخطوة 12.3.4 والخطوة 12.4.2 كملفات إدخال.
النتائج
يوفر هذا البروتوكول منهجية مفصلة لاستخراج miRNAs من الغدد اللعابية والمركبات الكهربائية. وفقا للنتائج ، فإن هذا البروتوكول فعال لعزل miRNA عن البالغين من نوعين مختلفين من القراد ، I. scapularis و R. microplus ، ويمكن استخدامه في أنواع القراد الأخرى أيضا. تم قياس تركيز المركبات الكهربائية (الجسيمات / مل) عبر NTA. بالنسبة ل R. microplus ، تحتوي كل مرحلة من مراحل الجنس والحياة على ثلاثة تكرارات بيولوجية تقاس في ثلاث نسخ متماثلة تقنية. تم فصل العينات حسب الجنس ومرحلة الحياة (الشكل 8) لإظهار التباين داخل كل عينة. بعد ذلك ، تم دمج العينات لعرض التباين والاختلافات الإحصائية باستخدام اختبارات المقارنة المتعددة ANOVA ثنائية الاتجاه و Tukey20 (قيمة p = < 0.05) (الشكل 9). تألفت كل عينة من ~ 40 غدة لعابية تم تشريحها من 20 أنثى وذكرا وحورية. بعد عزل المركبات الكهربائية وقياسها كميا، استخدمت العينات لتنقية الحمض النووي الريبي الصغيرة.
تم قياس تركيز الحمض النووي الريبي الصغير داخل كل عينة عبر Qubit (الجدول 1) ، وتم قياس الجودة عبر محلل حيوي باستخدام الرحلان الكهربائي الهلامي القياسي46,47. التركيزات بالنانوغرام (الجدول 1) في حجم 14 ميكرولتر لكل من أنواع القراد. تراوح متوسط إجمالي تركيزات الحمض النووي الريبي الصغيرة من أعضاء I. scapularis بين 45.92-6,356 ng. تراوح تركيز الحمض النووي الريبي لحويصلات I. scapularis من 72.24-2,128 ng. بالنسبة ل R. microplus ، تراوح تركيز العضو من 259-2,142 نانوغرام ، وتراوحت الحويصلات من 59.22-1,848 نانوغرام. تم تطبيع العينات بنفس التركيز ، ثم تم قياس جودتها عبر محلل حيوي (الشكل 10). تم استخدام سلم مرجعي في الجل كعلامة لتقييم الجودة. كانت سلامة النطاق وكثافته وذروته ممثلين للتدهور المحتمل أو التركيز الكلي في كل عينة. كانت النطاقات المقابلة ل 5 s و 5.8 s rbosomal RNAs موجودة فقط في عينات أعضاء الغدة اللعابية (الشكل 10 ، الممرات A-D) وغائبة في الحويصلة من عينات الغدة اللعابية (الشكل 10 ، الممرات E ، F) ، مما يدل على الاختلافات في ملامح الحمض النووي الريبي الصغيرة بين الأعضاء والحويصلات خارج الخلية. تم الاستدلال على تدهور العينة من خلال عدم وجود نطاقات في الجل. وهذا يدل على أن هناك تدهورا كبيرا في العينات. يوصى بالتخلص من أي عينات بها تدهور كبير.
لإثبات وجود عينات miRNA داخل المستحضرات ، تم إعداد مكتبات صغيرة من الحمض النووي الريبي cDNA من عينات الحمض النووي الريبي التي تم تخزينها لمدة 3-4 أشهر بعد عزل الحمض النووي الريبي الصغير. ومن الغريب أنه تم العثور على تدهور أعلى للعينات في هذه العينات. وأظهر الحارتان A-D و G علامات التدهور. على العكس من ذلك ، أظهرت E و F و H-K الحد الأدنى من التدهور والتركيز الكافي لإعداد مكتبة miRNA cDNA (الشكل التكميلي 1). وتدهورت عينة واحدة فقط عندما استخدمت العينات مباشرة بعد التنقية (الشكل 10)، مما يشير إلى أن عينات الحمض النووي الريبوزي المرسال كانت أكثر عرضة للتحلل بمجرد تنقيتها من المركبات الكهربائية. وهكذا ، تم اختيار العينات E و F و H و I لتحليل التخصيب. تظهر العلامات النجمية أحجام النطاق ~ 150 نقطة أساس ، والتي كانت الأحجام المتوقعة بعد إعداد مكتبة cDNA (الشكل 7). تشير الأشرطة الخافتة السفلية إلى التمهيدي الدامر.
أثناء عزل EV ، يمكن أن تؤثر سرعة الطرد المركزي والوقت على تركيز EV النهائي. عند سحب حبيبات EV في أعمدة 300 k ، كما ذكرنا سابقا في الخطوة 6.10 ، يعد الحجم المنخفض والسرعة ضروريين لمنع المركبات الكهربائية من المرور عبر الغشاء. أظهرت الدراسات السابقة أن 700 ميكرولتر عند 12000 × g لمدة 20 دقيقة باستخدام مكثف طرد مركزي مختلف كان كافيا لفصل EVs بشكل صحيح عن البروتينات القابلة للذوبان20 ؛ ومع ذلك ، تم عرض تركيزات EV منخفضة في NTA باستخدام مرشح مختلف. وبالتالي ، فإن تحسين المرشحات والمواد الأخرى المتاحة أمر ضروري. عند استخدام أعمدة 300 k لأول مرة ، تم اختبار فترات سرعة مختلفة لتحديد أيهما أعطى أعلى تركيز EV. تم قياس عدد الحويصلات المفقودة أثناء الطرد المركزي بواسطة تحليل NTA. وخلص إلى أن السرعات المنخفضة أدت إلى ارتفاع تركيز الحويصلة في التدفق (غير معروض). وخلص إلى أن 500 ميكرولتر عند 6000-8000 × غرام كانت مرضية لعزل المركبات الكهربائية. بمجرد تحديد ذلك ، تم استخدام هذا البروتوكول لعزل الحويصلات عن I. scapularis و R. microplus. تم قياس تركيز الحويصلات المعزولة من كل نوع من أنواع القراد عن طريق NTA (الشكل 8). وتراوحت تركيزات المركبات الكهربائية بين 7.07 × 10 7 إلى7.94 × 109 جسيمات/مل. ارتبطت كمية EV بتركيزات miRNA ، حيث أدت الكمية الأكبر من EV إلى تركيز أعلى من miRNA المستخرج.
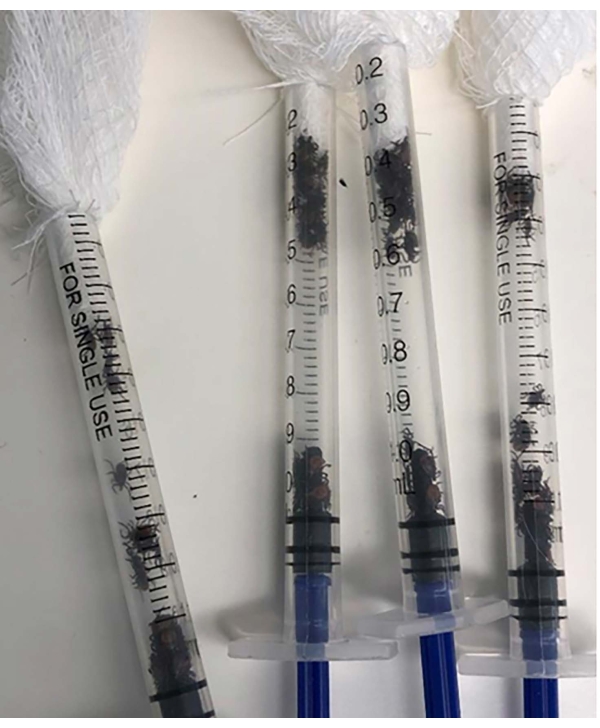
الشكل 1: 1 مل من المحاقن الخالية من الإبر المحملة بالإناث البالغات I. scapularis ومغطاة بشاش معقم.

الشكل 2: تمت إزالة الجانب الظهري لأنثى محتقنة بمقص فانياس 4 ملم. كانت الأنثى مغمورة في 1x PBS لمنع جفاف الأعضاء. تشير الأسهم الصفراء إلى الغدد اللعابية المكشوفة. تم التقاط الرقم عند تكبير 50x باستخدام عدسة موضوعية عالية الدقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صفيحة زراعة الخلايا بعد حضانة لمدة 24 ساعة عند 32 درجة مئوية. يحتوي الصف الأول من الآبار على وسائط خالية من الحويصلات وغدد لعابية مشوهة. بقية الآبار تحتوي على 1x PBS مع ريفامبيسين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: عملية تحضير عينة لدورة أجهزة الطرد المركزي الفائقة. (أ) حقنة بدون إبرة سعة 10 مل مغطاة بفلتر حقنة 1 ميكرومتر. (ب) يتم ماصة المادة الفائقة بعد ثلاث جولات من الطرد المركزي في المحقنة. (ج) يتم ملء بقية المحقنة إلى 10 مل مع 1x PBS معقمة. (د) يتم تغطية المحقنة ، ويتم ترشيح supernatant مع 1x PBS في أنبوب جهاز الطرد المركزي الفائق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
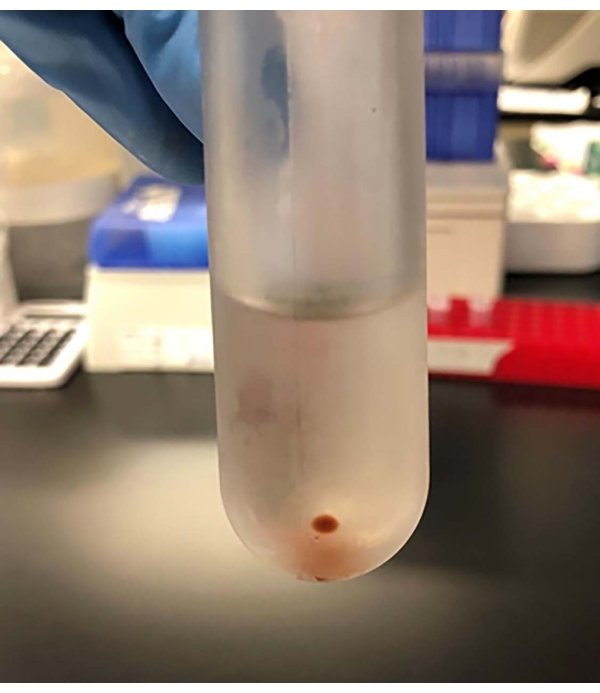
الشكل 5: بعد 18 ساعة من الطرد المركزي الفائق ، تتشكل حبيبة من الحويصلات خارج الخلية في الجزء السفلي من أنبوب الطرد المركزي الفائق.

الشكل 6: يتم استخدام مدقة معقمة لتجانس أعضاء الغدة اللعابية والحويصلات خارج الخلية.
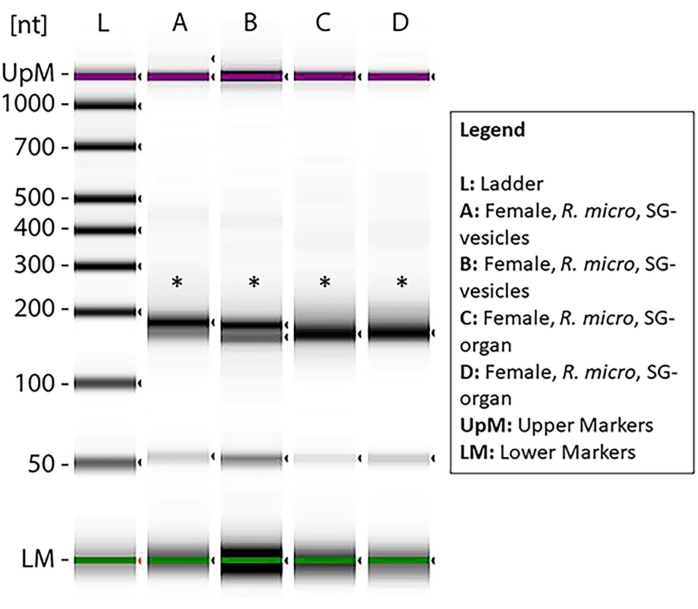
الشكل 7: الرحلان الكهربائي الهلامي الذي تم قياسه عبر محطة شريط تعرض المكتبات المجهزة بالحمض النووي الريبوزي المرسال (miRNA) بعد تحليل التخصيب. استندت العينات المأخوذة من أعضاء الغدة اللعابية R. microplus الأنثوية والمركبات الكهربائية إلى الحد الأدنى من التدهور وتركيز miRNA الكافي لتخليق مكتبة cDNA. يوضح السلم (L) النقاط المرجعية في النيوكليوتيدات والعلامات العلوية والسفلية. تشير العلامات النجمية إلى نطاقات حجم المنتج ~ 150 نقطة أساس ، مما يدل على مكتبات الحمض النووي الريبي الصغيرة cDNA. تظهر الأشرطة السفلية التمهيدي dimer. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
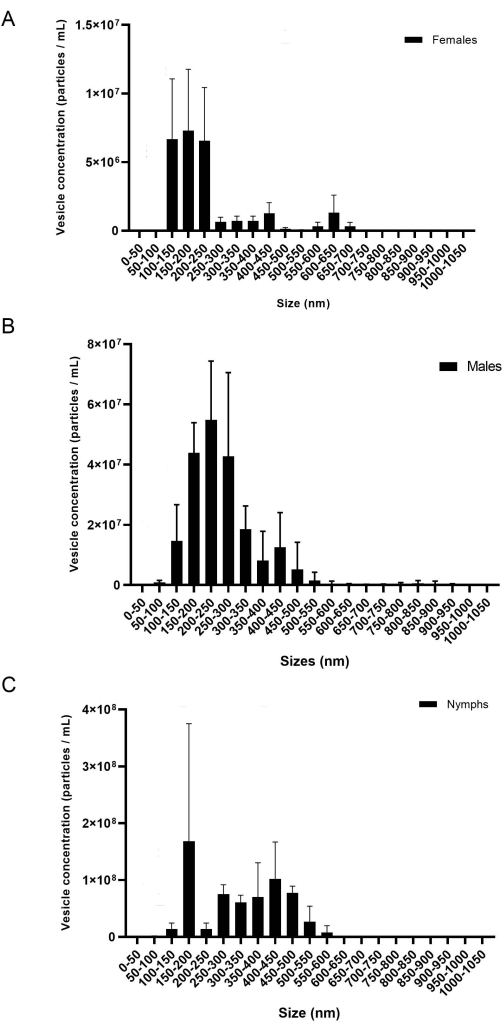
الشكل 8: صورة تمثيلية للتباين بين التكرارات البيولوجية (أ) الإناث، (ب) الذكور، و (ج) الحوريات. يظهر المحور x حجم EV (نانومتر) ، ويظهر المحور y تركيز EV (الجسيمات / مل). أظهر اختبار المقارنة ثنائي الاتجاه ANOVA و Tukey اختلافات إحصائية (قيمة P = < 0.05). تمثل أشرطة الخطأ الخطأ القياسي لحساب الاختلاف. احتوت كل عينة على 20 علامة مع ثلاثة نسخ بيولوجية. تم تسجيل العينات لمدة 60 ثانية ، ثلاث مرات لكل منها. تم تعيين الكاميرا على المستوى 7 ، وتم تعيين عتبة الكشف على المستوى 5. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: رقم تمثيلي للتباين لجميع النسخ المتماثلة البيولوجية المدمجة للحوريات (الحمراء) والإناث (الزرقاء) والذكور (السوداء). يظهر المحور x حجم EV (nm) ، ويعرض المحور y تركيز EV (الجسيمات / mL). أظهر اختبار المقارنة ثنائي الاتجاه ANOVA و Tukey اختلافات إحصائية (قيمة P = < 0.05). تمثل أشرطة الخطأ الخطأ القياسي لحساب الاختلاف. احتوت كل عينة على 20 علامة مع ثلاثة نسخ بيولوجية. ترمز العلامات النجمية إلى اختلاف كبير قدره p < 0.05. تم إجراء كل تسجيل لمدة 60 ثانية ، ثلاث مرات لكل منهما. تم تعيين الكاميرا على المستوى 7 ، وتم تعيين عتبة الكشف على المستوى 5. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
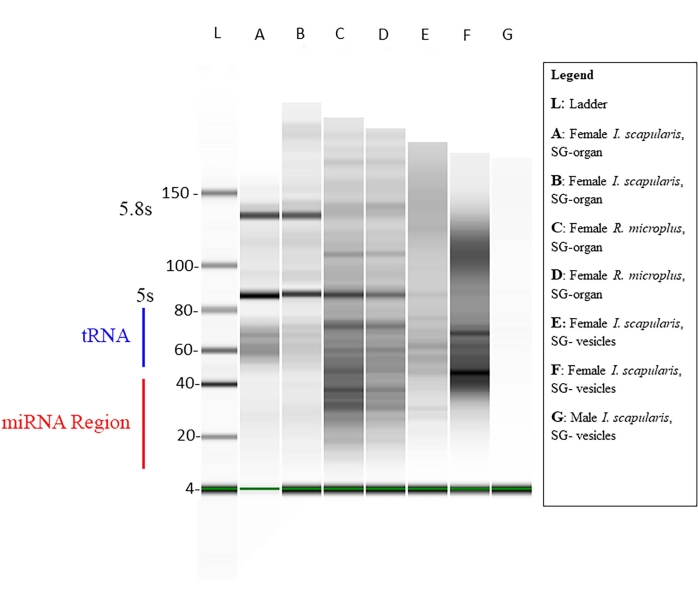
الشكل 10: هلام تمثيلي عبر المحلل الحيوي. تم إجراء الرحلان الكهربائي الهلامي باستخدام سلم أساسي كمرجع. يبلغ طول تسلسل miRNA الناضج ~ 18-22 nt ، حيث تظهر نطاقات باهتة في نطاق الحجم المحدد. كما توجد في العينات الحمض النووي الريبي الصغير الآخر ، مثل الحمض النووي الريبي النووي الصغير ، والحمض النووي الريبي المرسال الناقل ، والحمض النووي الريبي التنظيمي. تراوحت أحجام الحمض النووي الريبي الصغير من ~ 20-150 nt. تختلف العينات من أنواع القراد والأنسجة والجنس. بالنسبة للحارة G، لا يظهر مثال على تدهور العينة أي نطاقات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: تم قياس الرحلان الكهربائي الهلامي عبر المحلل الحيوي ، مع عرض جودة الحمض النووي الريبوزي المرسال المستخرج من أعضاء الغدة اللعابية الأنثوية R. microplus و EVs. يوضح السلم (L) الأحجام المرجعية في النيوكليوتيدات ، حيث يبلغ طول miRNAs الناضجة ~ 18-22 نانومتر. تظهر الممرات A-D و G تدهورا ، وتظهر الممرات E و F و H-K الحد الأدنى من التدهور. يرجى النقر هنا لتنزيل هذا الملف.
| جنس | جنس | الجهاز / الحويصلة | تركيز EV | تركيز الحمض النووي الريبوزي المرسال (نانوغرام) |
| ر. ميكروبلس | أنثى | أرغن | غير متوفر | 259 |
| ر. ميكروبلس | أنثى | أرغن | غير متوفر | 2,142 |
| ر. ميكروبلس | أنثى | الحويصله | 1.64 هاء+08 | 59.22 |
| ر. ميكروبلس | أنثى | الحويصله | 1.64 هاء+09 | 1,848 |
| I. الكتف | أنثى | أرغن | غير متوفر | 45.92 |
| I. الكتف | أنثى | أرغن | غير متوفر | 6,356 |
| I. الكتف | أنثى | الحويصله | 1.73E+08 | 65.66 |
| I. الكتف | أنثى | الحويصله | 3.14 هاء+09 | 2,128 |
الجدول 1: مثال على تركيزات الحمض النووي الريبوزي المرسال لكل من الغدد اللعابية والحويصلات خارج الخلية. يمثل عمود تركيزات miRNA أدنى إلى أعلى تركيزات لكل نوع من أنواع القراد.
| الحمض النووي الريبي الميكروي | I. الكتف | إ. ريسينوس | ر. ميكروبلس | ه. لونجيكورنيس | مراجع |
| مير-8 | A | P | P | P | 33, 36, 37, 43 |
| مير-71 | P | P | P | A | 33, 36, 37, 43 |
| مير-279 | P | A | A | P | 33, 36, 37, 43 |
| دعونا -7 | A | P | P | P | 33, 36, 37, 43 |
الجدول 2: الحمض النووي الريبوزي المرسال المحفوظ في أنواع القراد المختلفة. (P) يشير إلى أن الحمض النووي الريبوزي المرسال كان شائعا أو موجودا ، و (أ) يشير إلى أن الحمض النووي الريبوزي المرسال لم يتم التعبير عنه أو اكتشافه بشكل شائع.
| نوع العينة | عدد الدرجات >1* | عدد الدرجات >4γ | عدد المحفوظة | عدد الروايات |
| ذكر | 17 | 0 | 48,885 | 23 |
| أنثى | 25 | 0 | 48,885 | 21 |
| الحوريات | 38 | 0 | 48,885 | 38 |
الجدول 3. تم الكشف عن miRNAs المحفوظة والفريدة من نوعها في EVs للإناث R. microplus والذكور والحوريات. * درجة miRNA المستخدمة في التنميط. γدرجة miRNA المستخدمة في التجارب الوظيفية.
الجدول التكميلي 1: جدول يوضح نتائج تسلسل الجيل التالي للذكور R. microplus EVs المفرزة من الغدد اللعابية. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول التكميلي 2: جدول يوضح نتائج تسلسل الجيل التالي للمركبات الكهربائية الأنثوية R. microplus التي تفرز من الغدد اللعابية. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول التكميلي 3: جدول يوضح نتائج تسلسل الجيل التاليللمركبات الكهربائية R. microplus nymph التي تفرز من الغدد اللعابية. يرجى النقر هنا لتنزيل هذا الجدول.
Discussion
يوفر البروتوكول الحالي منهجية مفصلة لاستخراج miRNA من الغدد اللعابية والمركبات الكهربائية. ومع ذلك، هناك اعتبارات هامة، وكلها مفصلة في الملاحظات الخاصة بكل قسم من أقسام هذا البروتوكول. يجب تأمين الكبسولة والمعاوضة الشبكية أثناء تغذية القراد لمنع القراد من الهروب. يتم وصف إعداد الكبسولة ووضعها في Koga et al.40. يجب إجراء العديد من النسخ المتماثلة لتشريح القراد إذا تم التخلص من عينة غير مناسبة. بالإضافة إلى ذلك ، يمكن أن تكون هناك العديد من التحديات عند استخدام تقنيات عزل EV من أنسجة القراد18،20،43. على سبيل المثال ، يجب أن تبقى الأنسجة رطبة أثناء التشريح لتجنب الجفاف. يتم ذلك عن طريق إضافة PBS طوال التشريح. يجب الحفاظ على كل من PBS والوسائط المستخدمة لتشريح وزراعة الأعضاء بالمضادات الحيوية لتجنب التلوث البكتيري من ميكروبيوم القراد. يجب أن تشمل هذه المضادات الحيوية التي تستهدف البكتيريا سالبة الجرام وإيجابية الجرام حيث يمكن العثور على كليهما داخل أنسجة القراد60. وبالمثل ، يجب توخي الحذر أثناء التشريح لتقليل التلوث بالأنسجة من الأعضاء الأخرى. وبالتالي ، يجب إجراء التشريح ببطء ، ومع اكتساب المستخدم للخبرة ، يمكن تشريح المزيد من القراد. أخيرا ، نظرا لأن المركبات الكهربائية تفرز من جميع الخلايا ، بما في ذلك الخلايا المصابة بمسببات الأمراض ، فإن دراسات القراد التي تجري عزل EV تحتاج إلى استخدام وسائط ومخازن مؤقتة خالية من EV لتجنب التلوث عبر EV 25,61.
ومع ذلك ، يسمح هذا البروتوكول بتقليل عدد القراد اللازم لإنتاج EVs اللعابية للقراد. كانت البروتوكولات السابقة تتطلب إفراز لعاب عدد أكبر بكثير من القراد. على سبيل المثال ، احتاجت miRNAs التي تفرز داخل EVs اللعابية في Haemaphysalis longicornis إلى إفراز لعاب 2000 قراد بالغ43. يمكن أن يكون هذا مكلفا للغاية بالنسبة للمختبرات التي تفتقر إلى القدرة على وضع القراد الخلفي. وبالمثل ، تم تجميد أنسجة Amblyomma maculatum المستخدمة في عزل EV جزئيا قبل العزل ومعالجتها ب 75 U / mL من الكولاجيناز من النوع 3 ، مما قد يؤثر على صحة إفراز EV19. علاوة على ذلك ، تطلبت هذه الدراسات 80-100 زوج من الغدد اللعابية18.
وبالمقارنة، يمكن تطبيق هذا البروتوكول على أنواع متعددة من القراد، ويتطلب عددا منخفضا من القراد لعزل المركبات الكهربائية واستخراج الحمض النووي الريبوزي المرسال المحفوظ والجديد عالي الجودة (الجدول 2)33،36،37،43. وتفاوتت تركيزات الحمض النووي الريبوزي المرسال تفاوتا كبيرا ولكنها كانت كافية لتسلسل الجيل التالي (الجدول 3 والجداول التكميلية 1-3). يمكن تعديل هذا البروتوكول لاستيعاب حجم عينة أكبر إذا كانت هناك حاجة إلى تركيزات أكبر من الحمض النووي الريبوزي المرسال. أيضا ، المواد المستخدمة في هذا البروتوكول قابلة للاستبدال اعتمادا على توافر المواد. ومع ذلك ، يجب ضبط أحجام العينات وسرعة الطرد المركزي باتباع تعليمات الشركة المصنعة للمجموعات والأعمدة المستخدمة.
أحد عيوب هذه الطريقة هو أن miRNAs و EVs يمكن أن تتحلل بسهولة طوال خطوات الاستخراج والعزل. لذلك ، يجب إنجاز البروتوكول بسرعة وكفاءة. عند ذكرها ، يجب الاحتفاظ بالعينات على الجليد ، ويجب إجراء استخراج miRNA في بيئة معقمة. بالإضافة إلى ذلك ، يمكن إجراء علاج RNase على المركبات الكهربائية المعزولة للقضاء على الحمض النووي الريبي الكبير المرتبط بغشاء EV. هذا يمكن أن يمنع الحمض النووي الريبي الكبير من تلويث العينة أثناء استخراج الحمض النووي الريبوزي المرسال. وأخيرا، فإن إضافة مثبط الحمض النووي الريبي إلى عينة الحمض النووي الريبوزي المرسال بعد عزله عن المركبات الكهربائية أو الأعضاء هو إجراء وقائي مهم للتدهور. يمكن تغيير هذا البروتوكول وتطبيقه بالتوازي مع أهداف التجربة التي يتم إجراؤها.
قد تشمل التطبيقات المستقبلية لهذا البروتوكول دراسة التفاعلات بين مسببات الأمراض والنواقل لفهم كيفية تأثير مسببات الأمراض على الحمض النووي الريبوزي المرسال (miRNA) وغيرها من الشحنات الجينومية داخل المركبات الكهربائية اللعابية للقراد. وبالمثل ، يمكن لهذا البروتوكول تحديد بروتينات محددة وعمليات خلوية تشارك في تغليف miRNAs في EVs القراد ، والتأثير المحدد لهذه EVs و miRNAs على التئام الجروح والاستجابات المناعية. بسبب زيادة مقاومة القراد للمبيدات الحشرية ، هناك حاجة ماسة لطرق تحكم فريدة من نوعها. المركبات الكهربائية لديها القدرة على طريقة تحكم بديلة مقارنة بالمبيدات الحشرية. يمكن استخدام المركبات الكهربائية كناقلات نانوية في التطبيقات العلاجية18،23،61. في البشر ، تم استخدام EVs التي تنقل miRNAs لقمع نمو الورم أثناء العلاج المناعي للسرطان62,63. وبالمثل ، في القراد ، يمكن أن تحمل EVs miRNAs المعدلة وراثيا التي ثبت أنها تؤثر على الوظائف البيولوجية الحيوية للقراد وانتقال مسببات الأمراض 36,57,64. الاتجاه المستقبلي هو استخدام هذا البروتوكول لتحديد ملامح miRNA لأنواع القراد المتعددة لتحديد miRNAs ذات الأهمية للدراسات الوظيفية.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نحن ممتنون للغاية للمساعدة المقدمة من مختبر قراد حمى الماشية في إدينبورغ ، تكساس. نود أن نشكر مايكل موسى وجيسون تيدويل وجيمس هيلومز وسيزاريو أغادو وهوميروس فاسكيز. نود أيضا أن نعرب عن تقديرنا للمساعدة التي قدمتها سارة شاربتون وإليزابيث لوهستروه وإيمي فيليب وكيلسي جونسون وكيلي كوشكان وأندرو هيلهاوس وشارلوز أروتشو روزاريو وستيفاني غوزمان فالنسيا طوال المشروع. نود أن نشكر مجموعة تكساس إيه آند إم آجي للنساء في علم الحشرات (AWE) على مساعدتهم ونصائحهم أثناء كتابة هذه المخطوطة. تم توفير الكواشف التالية من قبل مراكز السيطرة على الأمراض والوقاية منها لتوزيعها من قبل BEI Resources و NIAID و NIH: Ixodes scapularis Adult (Live) ، NR-42510. كما تم استلام القراد الكتف I . الإناث من مرفق تربية القراد في جامعة ولاية أوكلاهوما. تم تمويل هذا المشروع من قبل جامعة تكساس إيه آند إم T3: ثالوث لمنحة التحول والاتفاقية التعاونية #58-3094-1-003 من قبل وزارة الزراعة الأمريكية-ARS إلى AOC.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | GenClone | 25-240 | |
| 1 µm nylon syringe filter | Tisch Scientific | 283129028 | |
| 1 inch black adhesive | Amazon | B00FQ937NM | Capsule |
| 10 mL needeless syringe | Exelint | 26265 | |
| 3' and 5' Adapters | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| 4 mm vannas scissors | Fine Science Tools | 15000-08 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid | Sigma-Aldrich | 1.1523 | |
| 70Ti rotor | Beckman Coulter | 337922 | |
| Amphotericin | Corning | 30-003-CF | |
| Beads | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Bioanalyzer | Agilent | G2939BA | |
| Bioanalyzer kit | Agilent | 5067-1513 | |
| Centrifuge 5425 | Eppendorf | ||
| Chloroform | Macron | UN1888 | |
| Cyverse Discovery Enviornment | https://cyverse.org/discovery-environment | ||
| Dissecting microscope | Nikon | SMZ745 | |
| Double-sideded carpet tape | amazon | 286373 | |
| Falcon Tubes, 50 mL | VWR | 21008-940 | |
| Fetal Bovine Serum | Gibco | FBS-02-0050 | |
| fine forceps | Excelta | 5-S-SE | |
| Foamies, 2 mm | Amazon | B004M5QGBQ | Capsule |
| Isoflurane | Phoenix Pharmaceuticals manfactured | 193.33165.3 | |
| Ixodes scaplaris | CDC, Oklahoma State University | ||
| L15C300 medium | In-lab | ||
| lipoprotein-cholesterol concentrate | MPI | 02191476-CF | |
| Microscope slide | VWR | 10118-596 | |
| miRDeep2 | https://github.com/rajewsky-lab/mirdeep2 | ||
| M-MuLV Reverse Transcriptase | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| molecular grade ethanol | Fischer Bioreagents | UN1170 | |
| multi-well 24 well tissue culture treated plate | Corning | 353047 | |
| Nanopaticle Tracking Analyzer machine | Malvern Panalytical | ||
| Nanosep with 300K Omega filter | Pall Corporation | OD3003C33 | |
| NEXTFLEX Small RNA-Seq Kit v3 | PerkinElmer | ||
| NextSeq 500/550 High Output Kit (75 cycles) | Illumina | 20024906 | |
| Optima XPN 90 Ultracentrifuge | Beckman Coulter | ||
| Penicillin | Thermofischer Scientific | ICN19453780 | |
| Pippettes | Ependorff | ||
| polycarbonate centrifuge bottle | Beckman Coulter | 355618 | |
| Qiagen miRNeasy kit | Qiagen | 217084 | |
| QIAzol lysis reagent | Qiagen | 79306 | |
| Qubit | Thermofisher | Q32880 | |
| Qubit kit | Thermofisher | Q10212 | |
| Rabbits | Charles River | ||
| Reverse Universal Primer | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Rhipicephalus microplus | Cattle Fever Tick Research Labratoty | ||
| Rifampicin | Fischer Bioreagents | 215544 | |
| RNAlater | Invitrogen | 833280 | |
| RNAse free tubes | VWR | 87003294 | |
| RNAse inhibitor | Thermo Fischer | 11111729 | |
| RNAse/DNAse free water | Qiagen | 217084 | |
| RNeasy Minelute spin column | Qiagen | 217084 | Qiagen miRNeasy kit |
| RPE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| RT Buffer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RT Forward Primer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RTE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| Sodium bicarbonate | Sigma-Aldrich | S6014-25G | |
| Sorvall ST16 | Thermo Fischer | 75004380 | |
| Sterilized Gauze sponges | Covidien | 2187 | |
| Sterilized PBS | Sigma | RNBK0694 | |
| streptomycin | thermofischer Scientific | 15240062 | |
| TapeStation | Aligent | G2991BA | |
| Tear Mender Instant Fabric and Leather Adhesive | Amazon | 7.42836E+11 | Capsule |
| Tissue Adhesive | 3M VetBond | ||
| Triple Antibiotics | dechra | 17033-122-75 | |
| Tryptose phosphate broth | BD | BD 260300 |
References
- Jongejan, F., Uilenberg, G. The global importance of ticks. Parasitology. 129, 3-14 (2004).
- Anderson, J. F., Magnarelli, L. A. Biology of ticks. Infectious Disease Clinics of North America. 22 (2), 195-215 (2008).
- de la Fuente, J. Controlling ticks and tick-borne diseases… looking forward. Ticks and Tick-Borne Diseases. 9 (5), 1354-1357 (2018).
- Nicholson, W. L., Sonenshine, D. E., Noden, B. H., Brown, R. N. Ticks (Ixodia). Medical and Veterinary Entomology. , 603-672 (2019).
- Guerrero, F. D., Lovis, L., Martins, J. R. Acaricide resistance mechanisms in Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitologia Veterinária. 21 (1), 1-6 (2012).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: the state of play. Veterinary Parasitology. 203 (1-2), 6-20 (2014).
- Redshaw, N., et al. A comparison of miRNA isolation and RT-qPCR technologies and their effects on quantification accuracy and repeatability. Biotechniques. 54 (3), 155-164 (2013).
- Estrada-Peña, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Experimental and Applied Acarology. 23 (9), 685-715 (1999).
- Eisen, R. J., Eisen, L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology. 34 (4), 295-309 (2018).
- Bowman, A. S., Sauer, J. R. Tick salivary glands: function, physiology and future. Parasitology. 129, 67 (2004).
- Kim, D., Maldonado-Ruiz, P., Zurek, L., Park, Y. Water absorption through salivary gland type I acini in the blacklegged tick, Ixodes scapularis. PeerJ. 5, 3984 (2017).
- Nunes, P. H., Bechara, G. H., Camargo-Mathias, M. I. Morphological changes in the salivary glands of Amblyomma cajennense females (Acari: Ixodidae) in different feeding stages on rabbits at first infestation. Experimental and Applied Acarology. 45 (3), 199-209 (2008).
- Bishop, R., et al. A cement protein of the tick Rhipicephalusappendiculatus, located in the secretory e cell granules of the type III salivary gland acini, induces strong antibody responses in cattle. International Journal for Parasitology. 32 (7), 833-842 (2002).
- Yamaji, K., et al. A salivary cystatin, HlSC-1, from the ixodid tick Haemaphysalis longicornis play roles in the blood-feeding processes. Parasitology Research. 106 (1), 61-68 (2009).
- Simo, L., Kazimirova, M., Richardson, J., Bonnet, S. I. The essential role of tick salivary glands and saliva in tick feeding and pathogen transmission. Frontiers in Cellular and Infection Microbiology. 7, 281 (2017).
- Perner, J., Kropáčková, S., Kopáček, P., Ribeiro, J. M. C. Sialome diversity of ticks revealed by RNAseq of single tick salivary glands. PLoS Neglected Tropical Diseases. 12 (4), 0006410 (2018).
- Madden, R. D., Sauer, J. R., Dillwith, J. W. A proteomics approach to characterizing tick salivary secretions. Experimental and Applied Acarology. 32 (1), 131-141 (2004).
- Zhou, W., et al. Discovery of exosomes from tick saliva and salivary glands reveals therapeutic roles for CXCL12 and IL-8 in wound healing at the tick-human skin interface. Frontiers in Cell and Developmental Biology. 8, 554 (2020).
- Zhou, W., et al. Exosomes serve as novel modes of tick-borne flavivirus transmission from arthropod to human cells and facilitates dissemination of viral RNA and proteins to the vertebrate neuronal cells. PLoS Pathogens. 14 (1), 1006764 (2018).
- Chávez, A. S. O., et al. Tick extracellular vesicles enable arthropod feeding and promote distinct outcomes of bacterial infection. Nature Communications. 12 (1), 1-17 (2021).
- Pegtel, D. M., Gould, S. J. Exosomes. Annual Review of Biochemistry. 88, 487-514 (2019).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Théry, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nature Cell Biology. 21 (1), 9-17 (2019).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. A. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213 (2018).
- Gioseffi, A., Edelmann, M. J., Kima, P. E. Intravacuolar pathogens hijack host extracellular vesicle biogenesis to secrete virulence factors. Frontiers in Immunology. 12, 662944 (2021).
- Chávez, A. S. O., O'Neal, A. J., Santambrogio, L., Kotsyfakis, M., Pedra, J. H. F. Message in a vesicle-trans-kingdom intercommunication at the vector-host interface. Journal of Cell Science. 132 (6), 224212 (2019).
- Janas, T., Janas, M. M., Sapoń, K., Janas, T. Mechanisms of RNA loading into exosomes. FEBS Letters. 589 (13), 1391-1398 (2015).
- Lu, T. X., Rothenberg, M. E. MicroRNA. Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- Pegtel, D. M., et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences. 107 (14), 6328-6333 (2010).
- Bartel, D. P. MicroRNAs: target recognition and regulatory functions. Cell. 136 (2), 215-233 (2009).
- Ambros, V. MicroRNAs and developmental timing. Current Opinion in Genetics and Development. 21 (4), 511-517 (2011).
- Bushati, N., Cohen, S. M. microRNA functions. Annual Review of Cell and Developmental Biology. 23, 175-205 (2007).
- Hackenberg, M., Langenberger, D., Schwarz, A., Erhart, J., Kotsyfakis, M. In silico target network analysis of de novo-discovered, tick saliva-specific microRNAs reveals important combinatorial effects in their interference with vertebrate host physiology. RNA. 23 (8), 1259-1269 (2017).
- Luo, J., et al. MicroRNA-1 promotes the development of and prolongs engorgement time in Hyalomma anatolicum anatolicum (Acari: Ixodidae) ticks. Biorxiv. , (2020).
- Zhou, J., Zhou, Y., Cao, J., Zhang, H., Yu, Y. Distinctive microRNA profiles in the salivary glands of Haemaphysalis longicornis related to tick blood-feeding. Experimental and Applied Acarology. 59 (3), 339-349 (2013).
- Hermance, M. E., Widen, S. G., Wood, T. G., Thangamani, S. Ixodes scapularis salivary gland microRNAs are differentially expressed during Powassan virus transmission. Scientific Reports. 9 (1), 1-17 (2019).
- Barrero, R. A., et al. Evolutionary conserved microRNAs are ubiquitously expressed compared to tick-specific miRNAs in the cattle tick Rhipicephalus (Boophilus) microplus. BMC Genomics. 12 (1), 1-17 (2011).
- Colombo, M., et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. Journal of Cell Science. 126 (24), 5553-5565 (2013).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. . Proteomic Profiling. , 179-209 (2015).
- Koga, K., et al. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Research. 25, 3703-3707 (2005).
- Wright, K., de Silva, K., Purdie, A. C., Plain, K. M. Comparison of methods for miRNA isolation and quantification from ovine plasma. Scientific Reports. 10 (1), 1-11 (2020).
- Mráz, M., Malinova, K., Mayer, J., Pospisilova, S. MicroRNA isolation and stability in stored RNA samples. Biochemical and Biophysical Research Communications. 390 (1), 1-4 (2009).
- Nawaz, M., et al. miRNA profile of extracellular vesicles isolated from saliva of Haemaphysalis longicornis tick. Acta Tropica. 212, 105718 (2020).
- Ribeiro, J. M. C., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva. Medical and Veterinary Entomology. 18 (1), 20-24 (2004).
- Almazán, C., et al. A versatile model of hard tick infestation on laboratory rabbits. Journal of Visualized Experiments. (140), e57994 (2018).
- Masotti, A., Preckel, T. Analysis of small RNAs with the Agilent 2100 Bioanalyzer. Nature Methods. 3 (8), 658 (2006).
- Benesova, S., Kubista, M., Valihrach, L. Small RNA-sequencing: approaches and considerations for miRNA analysis. Diagnostics. 11 (6), 964 (2021).
- Mackowiak, S. D. Identification of novel and known miRNAs in deep-sequencing data with miRDeep2. Current Protocols in Bioinformatics. 36 (1), 12 (2011).
- Friedländer, M. R., Mackowiak, S. D., Li, N., Chen, W., Rajewsky, N. miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades. Nucleic Acids Research. 40 (1), 37-52 (2012).
- Griffiths-Jones, S. The microRNA registry. Nucleic Acids Research. 32, 109-111 (2004).
- Griffiths-Jones, S., Grocock, R. J., Van Dongen, S., Bateman, A., Enright, A. J. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research. 34, 140-144 (2006).
- Griffiths-Jones, S., Saini, H. K., Van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucleic Acids Research. 36, 154-158 (2007).
- Kozomara, A., Birgaoanu, M., Griffiths-Jones, S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 47, 155-162 (2019).
- Kozomara, A., Griffiths-Jones, S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Research. 39, 152-157 (2011).
- Kozomara, A., Griffiths-Jones, S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Research. 42, 68-73 (2014).
- Wu, F., et al. MicroRNA let-7 regulates the expression of ecdysteroid receptor (ECR) in Hyalomma asiaticum (Acari: Ixodidae) ticks. Parasites and Vectors. 12 (1), 1-13 (2019).
- Goff, S. A., et al. The iPlant collaborative: cyberinfrastructure for plant biology. Frontiers in Plant Science. 2, 34 (2011).
- Merchant, N., et al. The iPlant collaborative: cyberinfrastructure for enabling data to discovery for the life sciences. PLoS Biology. 14 (1), 1002342 (2016).
- Kumar, D., et al. An exploratory study on the microbiome of northern and southern populations of Ixodes scapularis ticks predicts changes and unique bacterial interactions. Pathogens. 11 (2), 130 (2022).
- Zhang, Y., et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. International Journal of Nanomedicine. 15, 6917 (2020).
- Di Leva, G., Croce, C. M. miRNA profiling of cancer. Current Opinion in Genetics and Development. 23 (1), 3-11 (2013).
- Ganju, A., et al. miRNA nanotherapeutics for cancer. Drug Discovery Today. 22 (2), 424-432 (2017).
- Luo, J., et al. MicroRNA-1 Expression and Function in Hyalomma Anatolicum anatolicum (Acari: Ixodidae) Ticks. Frontiers in Physiology. 12, 596289 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved