Method Article
Aislamiento de microARN de cultivos de garrapatas ex vivo de glándulas salivales y vesículas extracelulares
En este artículo
Resumen
El presente protocolo describe el aislamiento de microARN de las glándulas salivales de las garrapatas y las vesículas extracelulares purificadas. Este es un procedimiento universal que combina reactivos y suministros de uso común. El método también permite el uso de un pequeño número de garrapatas, lo que resulta en microARN de calidad que se pueden secuenciar fácilmente.
Resumen
Las garrapatas son ectoparásitos importantes que pueden vectorizar múltiples patógenos. Las glándulas salivales de las garrapatas son esenciales para la alimentación, ya que su saliva contiene muchos efectores con propiedades farmacéuticas que pueden disminuir las respuestas inmunes del huésped y mejorar la transmisión de patógenos. Un grupo de tales efectores son los microARN (miARN). Los miRNAs son secuencias cortas no codificantes que regulan la expresión génica del huésped en la interfaz garrapata-huésped y dentro de los órganos de la garrapata. Estos pequeños ARN se transportan en la saliva de la garrapata a través de vesículas extracelulares (EV), que sirven para la comunicación inter e intracelular. Se han identificado vesículas que contienen miRNAs en la saliva de las garrapatas. Sin embargo, se sabe poco sobre los roles y perfiles de los miRNAs en las vesículas y glándulas salivales de las garrapatas. Además, el estudio de vesículas y miRNAs en la saliva de garrapatas requiere procedimientos tediosos para recolectar saliva de garrapatas. Este protocolo tiene como objetivo desarrollar y validar un método para aislar miRNAs de vesículas extracelulares purificadas producidas por cultivos de órganos ex vivo . Los materiales y la metodología necesarios para extraer miRNAs de vesículas extracelulares y glándulas salivales de garrapatas se describen aquí.
Introducción
Las garrapatas son ectoparásitos que vectorizan muchos patógenos a la vida silvestre, el ganado, los humanos y sus mascotas 1,2. La alimentación con garrapatas resulta en una pérdida económica significativa al causar daños en la piel, reducir el peso y la producción de leche debido a la anemia severa y la transmisión de patógenos potencialmente mortales que causan enfermedades 1,3,4,5. Las prácticas de control actuales para el manejo de las poblaciones de garrapatas se centran en el uso de acaricidas. Sin embargo, la continua aparición de resistencia a los acaricidas en garrapatas que parasitan el ganado 5,6, el aumento de la incidencia de picaduras de garrapatas7 y la transmisión de patógenos dentro de las zonas residenciales 8,9, han llevado a la necesidad de alternativas únicas de control de garrapatas.
Las glándulas salivales de la garrapata son órganos esenciales que aseguran el éxito biológico de una garrapata. Están formados por diferentes tipos de acinos (I, II, III y IV) con diversas funciones fisiológicas. Las glándulas salivales son responsables de la osmorregulación, tanto fuera como sobre el huésped, al devolver el exceso de agua y el contenido de hierro al huésped a través de la salivación 2,10. Los acinos de tipo I también están involucrados en la absorción de agua de la atmósfera por la secreción de saliva higroscópica10,11. Las proteínas efectoras salivales, como el cemento y las cistatinas, se producen dentro de las células secretoras en los acini10,12 de tipo II y III. Los acinos tipo I no afectan la alimentación con garrapatas, lo que indica que la ingesta de harina de sangre no desencadena cambios morfológicos y fisiológicos en estos acinos tipo13,14. Por otro lado, los Acini tipo II y III se activan durante la alimentación y presentan muy poca actividad pre-fijación. Por lo tanto, la alimentación es necesaria para desencadenar el agrandamiento de las células secretoras dentro de los acinos tipo II y la producción de compuestos bioactivos. Los acinos tipo III se reducen de tamaño durante la alimentación debido a la secreción dentro de los gránulos secretores12.
Las glándulas salivales también son el sitio de infección por patógenos en la garrapata y la ruta de transmisión. Durante la alimentación, las garrapatas secretan varios compuestos con efectos farmacéuticos que son necesarios para completar con éxito la harina de sangre 10,15,16. Estos compuestos tienen propiedades antiinflamatorias, inmunosupresoras y vasodilatadoras 10,15,17. Estudios recientes han demostrado que las vesículas extracelulares (EV) derivadas de las glándulas salivales de las garrapatas albergan varios de estos compuestos, induciendo efectos antiinflamatorios e inmunomoduladores 18,19,20. "Vesículas extracelulares" es un término general utilizado para describir vesículas clasificadas como exosomas y microvesículas en función de su tamaño y biogénesis. En general, los EV son ampollas lipídicas con membranas bicapa que son ~ 40 nm-1 μm de tamaño21; en general, los exosomas se describen como de 40-150 nm de tamaño, mientras que las microvesículas tienen entre 150 nm-1 μm de tamaño 21,22,23. Sin embargo, el tamaño no es indicativo de la vía de biogénesis de los EV22.
La biogénesis de los exosomas comienza con la invaginación secuencial de la membrana plasmática. Esta invaginación conduce a la formación de cuerpos multivesiculares y finalmente da lugar a la deformación de la membrana vesicular por la acción de complejos ESCRT o esfingomielinasas (sMasas)24,25. Los exosomas pueden lisarse dentro de los lisosomas para mantener la homeostasis celular o salir a través de la fusión vesicular a la membrana plasmática para entregar constituyentes celulares a las células receptoras21,24. Por otro lado, las microvesículas se forman por la acción de flopasses y flipasses, cambiando la conformación de lípidos en la membrana plasmática26. Los EV son esenciales para la comunicación de célula a célula, ya que sirven como un sistema de transporte para la carga intracelular, como lípidos, proteínas, ácidos nucleicos y microARN (miARN)21,27,28. Una vez transportadas, estas vesículas entregan su carga en el citoplasma de las células receptoras, generando cambios fenotípicos en la célula receptora22,29. Debido a la importancia de las vesículas extracelulares en la alimentación de garrapatas y la manipulación de las respuestas inmunes y de curación de heridas del huésped18,20, la carga dentro de las vesículas extracelulares presenta objetivos potenciales para el desarrollo de terapias antihorques y un mecanismo único para interrumpir la alimentación de garrapatas. Esto incluye miRNAs dentro de las glándulas salivales de garrapatas y vesículas extracelulares derivadas de glándulas salivales.
Los miRNAs son secuencias cortas no codificantes, de ~18-22 nucleótidos (nt) de longitud, que pueden regular, degradar o silenciar secuencias de ARNm post-transcripcionales30,31. Durante la transcripción, los pri-miRNAs son escindidos por Dicer (ARN polimerasa III) para formar una estructura distintiva similar a una horquilla, convirtiéndose en un pre-miRNA. El pre-miRNA es cortado una vez más por Drosha (ARN polimerasa III) para formar un dúplex de miRNA maduro. La secuencia madura se integra en el complejo silenciador inducido por ARN (RISC) complementario a la secuencia de ARNm, causando represión de la traducción o degradación del ARNm 28,30,32. Durante la alimentación del huésped, los miRNAs dentro de la saliva de la garrapata pueden modular la expresión génica del huésped para suprimir las respuestas inmunes y mejorar la transmisión de patógenos 33,34,35,36,37. Aunque existen estudios extensos sobre vehículos eléctricos y miRNAs, sus funciones durante la alimentación en la interfaz garrapata-huésped aún no se conocen bien. Optimizar los protocolos que pueden resultar fácilmente en el aislamiento y la purificación de miRNAs de alta calidad es crucial para avanzar en nuestro conocimiento sobre estos temas.
Se pueden utilizar múltiples opciones para aislar los EV, como la ultracentrifugación, la precipitación de exosomas, la precipitación de polímeros, la cromatografía de inmunoafinidad y las técnicas de exclusión basadas en el tamaño38. Sin embargo, estas técnicas no pueden distinguir entre exosomas o microvesículas. Por lo tanto, como se mencionó anteriormente, EV se utiliza como un término general al aislar EV de diferentes muestras. Las vesículas aisladas en los experimentos descritos aquí representan una mezcla de vesículas derivadas de diferentes vías de biogénesis. La purificación adicional de una población específica de vesículas extracelulares se puede lograr mediante inmunoprecipitación utilizando perlas recubiertas con anticuerpos contra marcadores (es decir, marcadores exosomales, marcadores tumorales) únicos para la población de vesículas de interés39,40. Los miRNAs también se pueden extraer a través de diferentes kits de aislamiento disponibles comercialmente 7,41,42.
El objetivo de este proyecto fue desarrollar un protocolo que combine métodos comúnmente aplicados para aislar los EV y extraer miRNA tanto de los EV como de las glándulas salivales de las garrapatas alimentadas. Debido a que la secreción de compuestos bioactivos se activa al alimentara 12, se debe permitir que las garrapatas se alimenten para identificar miRNAs que pueden ser importantes para manipular las respuestas inmunes y de curación de heridas del huésped. El presente protocolo requiere un pequeño número de garrapatas (20 garrapatas) para aislar los EV y sus respectivos miRNAs, en comparación con otros estudios descritos anteriormente que requirieron 2000 garrapatas43. Además, evita la contaminación de las secreciones salivales con pilocarpina44, lo que podría influir en los experimentos que estudian el efecto de los EV y sus miRNAs en las células huésped.
Protocolo
Todos los experimentos con animales se realizaron siguiendo el protocolo de uso de animales (AUP # 2020-0026) aprobado por el comité institucional de cuidado y uso de animales (AICUC) de la Universidad de Texas A & M. Las especies de garrapatas, Ixodes scapularis y Rhipicephalus (Boophilus) microplus, y los conejos blancos machos de Nueva Zelanda, de 42 a 72 días de edad, se utilizaron para el presente estudio. I. scapularis fue recibido del Centro para el Control de Enfermedades (CDC) y la Universidad Estatal de Oklahoma, certificado como libre de patógenos. R. microplus fue criado en el Laboratorio de Investigación de Garrapatas de la Fiebre del Ganado en Edinburg, Tx. Los conejos se obtuvieron de fuentes comerciales (ver Tabla de Materiales). Este protocolo puede aislar universalmente vesículas extracelulares y miRNAs de diferentes especies de garrapatas, etapas de vida y tejidos.
1. Cría de hembras de I. scapularis y preparación de cápsulas
- Prepare una cápsula de espuma de acetato de etileno-vinilo siguiendo los procedimientos para conejos duros que alimentan garrapatas45. Coloque una cápsula en cada omóplato del conejo para un total de dos cápsulas por infestación.
NOTA: Brevemente, estas cápsulas consisten en dos cuadrados de espuma de etileno-acetato de vinilo con un espacio vacío interior. Un cuadrado está pegado a la parte posterior del animal (en este caso, conejos) con un adhesivo de tejido (ver Tabla de Materiales). La malla fina se pega al segundo cuadrado para evitar el escape de garrapatas. Los dos cuadrados se cierran con cinta de gancho autoadhesiva. - Deje que las cápsulas se fijen durante 24 horas antes de adherir la cápsula en los conejos. Guarde las cápsulas de espuma a temperatura ambiente.
NOTA: Las cápsulas se pueden almacenar indefinidamente a temperatura ambiente. - Adhiera la cápsula a los conejos afeitados hasta la piel y déjela durante 24 horas antes de la infestación por garrapatas.
2. Preparación de medios libres de vesículas
- Para preparar medios libres de vesículas13, combine 0,5 ml de suero fetal bovino, 0,5 ml de caldo de fosfato de triptosa, 0,1 ml de concentrado de lipoproteína-colesterol al 10%, 0,5 ml de bicarbonato de sodio al 5 % (NaHCO3), 0,25 ml de ácido 4-(2-hidroxietil)-1-piperazinatenosulfónico (HEPES) y 8,125 ml de medio L15C300 (ver Tabla de materiales). Ajuste el volumen del medio según sea necesario. Coloque el medio en una botella centrífuga de policarbonato de 26,3 ml.
- Equilibrar las botellas por una diferencia de peso de 0,01 g como máximo para garantizar el correcto funcionamiento de la ultracentrífuga.
- Ultracentrífuga el medio durante 18 h a 100.000 x g a 4 °C. Retire el sobrenadante a través de una pipeta, asegurándose cuidadosamente de no molestar a ningún gránulo formado.
- Transfiera el sobrenadante a un nuevo tubo de centrífuga y ultracentrífuga por segunda vez durante 18 h a 100.000 x g a 4 °C, con el equilibrio adecuado.
- Aísle el sobrenadante restante y pase a través de un filtro de jeringa de 0,22 μm para eliminar los contaminantes. Pipetear el sobrenadante en un tubo centrífugo de 50 ml.
- Guarde el sobrenadante en un congelador de -20 °C hasta que sea necesario o hasta 3 años.
3. Infestación de conejos
- Cortar la parte superior de una jeringa de 10 ml y cargar hembras adultas de I. scapularis usando un pincel estándar.
- Cubra la abertura de la jeringa con una gasa estéril (Figura 1).
- Coloque el conejo en una mesa o una superficie de trabajo horizontalmente; envuelva al conejo firmemente con una toalla y cubra ambos ojos, dejando la cápsula preparada (paso 1.1) expuesta para infestar al conejo con garrapatas.
- Abra la cápsula e inserte las garrapatas empujando el mango de la jeringa. Deposite las garrapatas cerca de la piel del conejo. Cierre rápidamente las cápsulas para evitar que las garrapatas se escapen.
- De acuerdo con el diseño experimental, permita que las garrapatas hembra se alimenten durante el tiempo que sea necesario. No permita que los Machos Ixodes scapularis permanezcan en la cápsula durante más de 24 h para evitar la desecación.
NOTA: El número de garrapatas que se infestarán en los animales queda a discreción del investigador. Este protocolo utilizó ~ 100 garrapatas por infestación para tener en cuenta la mortalidad y suficiente material para las réplicas. Los experimentos preliminares determinaron que se necesitaban al menos 20 garrapatas / réplica para obtener suficiente material para secuenciar los miRNAs.
4. Eliminación de las hembras alimentadas
- Coloque los conejos infestados por debajo del 2% de isoflurano en oxígeno utilizando un difusor de gas. Ajuste la tasa de oxígeno entre 700-1000 L/min.
NOTA: Se pueden usar otros anestésicos para evitar cualquier angustia o dolor. - Retire las hembras alimentadas agarrando las garrapatas por su capitulo, usando fórceps finos, lo más cerca posible de la piel. Asegúrese de que las piezas bucales se retiren por completo para evitar infecciones bacterianas.
- Coloque las garrapatas en un tubo centrífugo de 15 ml.
- Limpie el sitio de la picadura con etanol al 70% y agregue una pequeña cantidad de antibiótico triple (valor de la punta de los dedos, consulte la Tabla de materiales) para prevenir la infección en el sitio de la picadura de la garrapata.
- Lleve las garrapatas al laboratorio para las disecciones (paso 5). Realizar estas disecciones dentro de las 24-48 h de la eliminación de las garrapatas para evitar la degradación de las glándulas salivales15,43.
5. Disección de glándulas salivales y secreción de vesículas extracelulares
- Añadir 500 μL de medio libre de vesículas (paso 2) con 5 μL de 100x penicilina, 5 μL de 100x estreptomicina, 5 μL de 10 mg/ml de rifampicina y 5 μL de 100x anfotericina a cada pocillo (ver Tabla de Materiales). Agregue 1x PBS con rifampicina a cualquier pocillo que no contenga medio libre de vesículas para prevenir el crecimiento bacteriano.
- Coloque las garrapatas en un portaobjetos de vidrio microscópico transparente con cinta de alfombra de doble cara bajo un microscopio de disección. Para prevenir la desecación de órganos, agregue 10 μL de 1x PBS a cada garrapata antes de la disección.
- Usando tijeras vannas de 4 mm (ver Tabla de Materiales), haga una pequeña incisión de ~ 1 mm en el costado de cada hembra. Retire completamente el lado dorsal de la garrapata (Figura 2) y elimine ambas glándulas salivales.
- Coloque 20-40 glándulas salivales de garrapatas en 500 μL de medio libre de vesículas agregado a un solo pozo en una placa tratada con cultivo de tejido de 24 pocillos (Figura 3).
- Incubar las muestras de glándulas salivales a 32 °C durante 24 h para permitir la secreción de los EV.
6. Aislamiento de vesículas extracelulares
- Después de 24 h de incubación, pipetee todo el medio que contiene las glándulas salivales en un tubo de microcentrífuga de 1,5 ml.
- Centrifugar la muestra a 300 x g a 4 °C durante 10 min para aislar las glándulas salivales. En este paso se separarán dos fases: (1) el sobrenadante que contiene los EV y (2) las glándulas salivales (pellet).
- Para continuar con el aislamiento de los vehículos eléctricos, pipetee el sobrenadante en un nuevo tubo de microcentrífuga de 1,5 ml. Resuspender el pellet que contiene las glándulas salivales (paso 6.2) en 500 μL de RNAlater (ver Tabla de Materiales) y almacenar a -80 °C hasta su uso o indefinidamente.
NOTA: Estas glándulas salivales se utilizarán para el aislamiento de miRNA en el paso 8. - Centrifugar el sobrenadante a 2000 x g a 4 °C durante 10 min para eliminar los desechos celulares. Pipetear el sobrenadante en un nuevo tubo de microcentrífuga de 1,5 ml. Deseche el pellet.
- Centrifugar el sobrenadante a 10.000 x g durante 30 min a 4 °C para eliminar cuerpos apoptóticos y EV más grandes. Mezcle el pellet y pipetee el sobrenadante en un nuevo tubo de microcentrífuga de 1,5 ml.
- Conecte una jeringa de 10 ml a un filtro de jeringa de nylon de 1 μm. Coloque la jeringa y el filtro sobre un tubo de ultracentrífuga (Figura 4A). Luego agregue la muestra (Figura 4B) y llene la jeringa con 10 ml de 1x PBS (Figura 4C), y equilibre el tubo en consecuencia (Figura 4D).
- Coloque los tubos en un rotor 70Ti (consulte la Tabla de materiales) y gire a 100.000 x g durante 18 h a 4 °C.
- Después de 18 h de ultracentrifugación, observe un pellet en el extremo inferior del tubo (Figura 5). El pellet son las vesículas extracelulares concentradas.
- Retire el 90%-100% del sobrenadante sin resuspender el pellet EV. Resuspend el pellet con 1x PBS. Si no se pudo quitar todo el sobrenadante, use el sobrenadante restante para volver a suspender el pellet.
- Pipetear 500 μL del pellet/sobrenadante EV en un filtro centrífugo de 300 K (ver Tabla de Materiales).
NOTA: Esto eliminará cualquier proteína no asociada a vesículas, miRNAs y otras moléculas, mientras que las vesículas no pasarán a través del filtro. - Centrifugadora a 8.000 x g durante 10 min a temperatura ambiente. Repita el paso 6.10 hasta que todos los gránulos/sobrenadante EV hayan pasado a través del filtro.
- Agregue 400 μL de PBS esterilizado 1x a la columna y mezcle bien a través de pipeta para eliminar los EV unidos a la membrana. Coloque la muestra en un tubo libre de DNasa/RNasa de 1,5 ml. Las muestras se pueden almacenar a -80 °C indefinidamente o hasta que se utilicen. Evite la descongelación excesiva de la muestra para evitar la degradación de la muestra.
NOTA: Coloque los tubos en el hielo cuando se saque de la ultracentrífuga para evitar la degradación de ev. La muestra final será el pellet EV en 400 μL de 1x PBS. 25 μL de esta muestra se utilizarán para el análisis de seguimiento de nanopartículas (NTA, paso 7), y 375 μL para el aislamiento de miARN (paso 8).
7. Análisis de seguimiento de nanopartículas (NTA)
- Tome 25 μL de la muestra final (paso 6.12) y agregue 375 μL de 1x PBS.
- Cargue la muestra diluida en una jeringa sin aguja de 1 ml y atornille firmemente a la lente óptica del NTA.
- Ajuste la configuración en consecuencia y capture videos según las preferencias de configuración.
NOTA: En el presente estudio se tomaron tres lecturas de 60 s cada una. Cada lectura de NTA representa una réplica técnica. Diferentes muestras de alimentación de garrapatas durante el mismo período de tiempo representan réplicas biológicas individuales. La cámara se estableció en el nivel 7 y el umbral de detección se estableció en el nivel 5. - Calcule los números finales de EV mediante la siguiente fórmula:
((concentración inicial de EV (factor de dilución)) * (volumen total dejado en el tubo de muestra)/1000) = EV totales en la muestra
NOTA: El volumen debe dividirse por 1000 porque el NTA lee las muestras como concentración/ml.
8. extracción de miRNA de glándulas salivales y vesículas extracelulares
- Añadir 100 μL del reactivo de lisis (ver Tabla de Materiales) a la muestra restante del paso 6.12 y homogeneizar con morteros esterilizados (Figura 6).
- Añadir los 600 μL restantes del reactivo de lisis e incubar durante 5 min a temperatura ambiente.
- Agregue 140 μL de cloroformo, agite vigorosamente durante 15 s e incube durante 3 min a temperatura ambiente.
- Girar a 12.000 x g durante 15 min a 4 °C.
- Pipetear la fase superior transparente, evitando la interfase, en un nuevo tubo de 1,5 ml. Esto resultará en ~ 525 μL del volumen de muestra esperado. A continuación, agregue un volumen 1: 1 de etanol de grado molecular 100%.
- Añadir 700 μL de la muestra en una columna de espín de aislamiento de ARN (ver Tabla de Materiales).
- Girar a 8.000 x g durante 30 s a temperatura ambiente, desechar el flujo a través.
- Lavar la muestra con 700 μL de tampón RTE (ver Tabla de Materiales), centrifugar a 8.000 x g durante 30 s, desechar el flujo a través.
- Lavar la muestra con 500 μL de tampón RPE (ver Tabla de Materiales), centrifugar a 8.000 x g durante 30 s, desechar el flujo a través.
- Agregue 500 μL de etanol de grado molecular al 80% y espín a 8,000 x g durante 2 min, descarte el flujo a través.
- Gire la columna a la velocidad máxima durante 5 minutos para secar la membrana. Deseche el tubo de recolección y coloque la columna sobre un nuevo tubo de microfuge de 1,5 ml.
- Añadir 14 μL de agua libre de RNasa/DNasa a la membrana e incubar durante 5 min a temperatura ambiente.
- Centrifugadora a 21.000 x g durante 1 min a temperatura ambiente.
- Añadir 1 μL de inhibidor de la RNasa (ver Tabla de Materiales) a los miRNAs eluidos y mezclar bien a través de pipeta.
NOTA: Antes de la extracción de miRNA de las glándulas salivales, retire cualquier RNAlater agregando 1 ml de 1x PBS (volumen 1: 1) y gire hacia abajo las glándulas salivales a la velocidad máxima durante 15 min a 4 ° C. Esto debe repetirse tres veces o hasta que las glándulas salivales hayan disminuido lo suficiente como para eliminar el sobrenadante. En este punto, la muestra representa una mezcla de ARN pequeños de ~ 20-150 pb de tamaño (Figura suplementaria 1).
9. Medición de la concentración de miRNA
- Mida la concentración de ARN pequeño a través de un kit de ensayo de ARN disponible comercialmente41 (consulte la Tabla de materiales).
- En cada tubo, mezcle 199 μL de tampón de dilución (Componente A y B proporcionados en el kit por muestra), 1 μL de colorante fluorescente específico para la detección de miRNAs (longitud de onda de medición 260 nm) (por muestra) y 2 μL de ARN pequeño (paso 8) para cada muestra, de acuerdo con las instrucciones del fabricante.
- Antes de leer los tubos de muestra, lea el estándar 1 y el estándar 2 de miRNA premluidos (proporcionados en el kit) para crear una curva estándar antes de la medición de la muestra.
NOTA: Los estándares se utilizan como una herramienta de comparación para determinar la concentración de miRNA medida en las muestras. - Coloque cada tubo estándar y de muestra en el fluorómetro dedicado (consulte la Tabla de materiales) para medir la concentración como ng/μL.
10. Determinación de la calidad del miRNA
- Determinar la calidad de miRNA y otros ARN pequeños mediante electroforesis en gel utilizando un bioanalizador46, siguiendo las instrucciones del fabricante (ver Tabla de Materiales).
- Antes de la lectura de la muestra, normalice las muestras para que tengan la misma concentración.
- Lea las muestras a través de un pequeño chip de ARN41,46, siguiendo las instrucciones del fabricante (ver Tabla de Materiales).
NOTA: Para determinar la calidad del miRNA, las imágenes en forma de gel (bandas) y los electroferogramas (picos) son indicadores de la calidad de la muestra. Cuanto más oscura sea la banda en el gel, mejor será la calidad de miRNA. Cuanto más ligera es la banda (o si no hay banda presente), peor es la calidad o prueba la degradación de la muestra46,47.
11. enriquecimiento de microARN
- Enriquezca el miRNA utilizando un pequeño kit de secuenciación de ARN, siguiendo las instrucciones del fabricante del kit de preparación de muestras de ARN pequeño (consulte la Tabla de materiales).
- Ligar cada muestra con un adaptador adenilado de 3'y retirar el exceso de adaptador mediante la limpieza de perlas. A continuación, agregue un adaptador de 5 'y retire el exceso de adaptador mediante una limpieza decuentas 48.
NOTA: Tanto los adaptadores como las perlas para la limpieza se proporcionaron en el pequeño kit de secuenciación de ARN de la sección 11.1 (ver Tabla de materiales). - Para sintetizar la primera hebra, prepare una mezcla maestra de las muestras ligadas con ambos adaptadores, búfer RT y transcriptasa inversa M-MuLV proporcionada en el kit (consulte la Tabla de materiales). A continuación, incubar la mezcla durante 30 min a 42 °C y 10 min a 90 °C. Seguimiento con una limpieza de muestra como se indica en las instrucciones.
- Amplifique la primera hebra utilizando la imprimación rt directa y la imprimación universal inversa proporcionada en el kit (consulte la Tabla de materiales) a través de una reacción en cadena de la polimerasa (PCR) convencional durante 2 minutos a 95 ° C, luego durante 12-25 ciclos durante 20 s a 95 ° C, 30 s a 60 ° C y 15 s a 72 ° C. Por último, 2 min a 72 °C.
NOTA: Se espera que el tamaño del producto de PCR sea de ~ 150 pb (Figura 7). - Mida la calidad del producto de PCR a través de una estación de cinta siguiendo las instrucciones del fabricante (consulte la Tabla de materiales).
- Secuenciar las muestras utilizando un sistema de secuenciación de última generación (75 ciclos), siguiendo las instrucciones del fabricante (ver Tabla de Materiales).
NOTA: Para el enriquecimiento de miRNA, se debe verificar la cantidad y calidad de la muestra (pasos 9-10) antes de la preparación de la biblioteca.
12. Análisis bioinformático
- Identifique los miRNAs conservados y únicos utilizando una herramienta de aplicación integrada para la identificación de miRNA.
NOTA: En el presente estudio, la identificación de miRNA se realizó a través de miRDeep249,50. miRDeep2 es un catálogo en línea gratuito de todos los miRNAs conservados y novedosos identificados que se encuentran en varias especies49,50 (ver Tabla de Materiales). - Alinee las lecturas con el genoma correspondiente utilizando el mapeador integrado con el software.
- Introduzca los siguientes parámetros en el módulo mapeador.
- Recorte las secuencias del adaptador agregadas a partir del paso 11.2 y elimine las secuencias de menos de 18 nucleótidos de longitud. Elimine las secuencias de lectura redundantes.
- Convierta los archivos utilizando el parámetro de análisis a formato FASTA, solo si el archivo no está en formato FASTA49.
- Alinee las secuencias filtradas y recortadas con el genoma correspondiente. Si no hay genoma para la especie de interés, alinearse con la especie homóloga más cercana.
- Muestre los archivos de salida como "reads.fa" y "reads_vs_genome.arf". El "read.fa" contendrá solo las lecturas no redundantes, y el "reads_vs_genome.arf" incluirá las lecturas mapeadas alineadas con el genoma.
- Utilizando ambos archivos de salida del paso 12.2, realice el perfil de expresión miRNA utilizando el cuantificador integrado con el software.
- Descargue las especies de interés de las secuencias precursoras de miRNA y las secuencias de miRNA maduras de miRBase 51,52,53,54,55,56. Si no hay secuencias precursoras o maduras para la especie de interés, descargue "hairpin.fa.gz" y "mature.fa.gz" que contienen todos los precursores y secuencias maduras para todos los organismos disponibles en miRBase.
- Descomprima los archivos "hairpin.fa.gz" y "mature.fa.gz".
- Introduzca los archivos "reads.fa" y "read_vs_genome.arf" de la sección 12.3.4 y los archivos sin comprimir de la sección 12.4.2.
- Lea los archivos de salida como "outputname.csv","outputname.html" y "outputname.pdf". El nombre del archivo de salida se puede establecer de acuerdo con el investigador.
Nota : el archivo "outputname.csv" contendrá los perfiles de expresión. Específicamente, el perfil de expresión tendrá el ID de miRNA, la suma de lecturas para todas las muestras asignadas al miRNA, el número de lecturas asignadas a un miRNA específico para cada muestra y el ID del precursor correspondiente a los miRNAs maduros. El "outputname.html" del paso 12.4.4 contendrá los enlaces al Navegador del Genoma de la Universidad de Santa Cruz (USCS), el Centro Nacional de Información Biotecnológica (NCBI) y miRBase. El USCS y el NCBI contendrán las secuencias de consulta de los precursores actuales contra la base de datos de nucleótidos no redundantes, y miRBase tendrá la información del precursor actual de miRNA. El "outputname.pdf" tendrá la estructura secundaria de ARN de los miRNAs que se expresan y la alineación de la secuencia precursora.
- Para identificar miRNAs únicos y conservados, use miRDeep2.
- Utilice los archivos de salida de los pasos 12.3.4 y 12.4.2 como archivos de entrada.
NOTA: Los archivos de salida que se leen como "outputname.html" contendrán las predicciones de los miRNAs únicos y conservados en el ejemplo. - Utilice puntuaciones >1 para el perfil de miRNA y puntuaciones >4 para análisis experimentales adicionales, como la inhibición de miRNA y la imitación de miRNAs endógenos 34,36,57.
- Seleccione e identifique los miRNAs únicos de la miRbase en función de lo siguiente: puntuación miRDeep2 (paso 12.5.3), estimación de probabilidad verdadera (>90%), valor p de randfold significativo (<0.05)49,50,56.
NOTA: El análisis bioinformático se realizó a través de miRDeep2 en Cyverse Discovery Environment58,59, una plataforma en línea gratuita para el análisis bioinformático. Los miRNAs conservados y únicos identificados a través de miRDeep2 se compararon con todas las especies de la miRbase. La futura identificación de miRDeep2 se puede comparar con el genoma correspondiente de la especie de interés.
- Utilice los archivos de salida de los pasos 12.3.4 y 12.4.2 como archivos de entrada.
Resultados
El presente protocolo proporciona una metodología detallada para extraer miRNAs de glándulas salivales y EV. Según los resultados, este protocolo es efectivo para el aislamiento de miRNA de adultos de dos especies diferentes de garrapatas, I. scapularis y R. microplus, y también se puede usar potencialmente en otras especies de garrapatas. La concentración de EV (partículas/ml) se midió a través de NTA. Para R. microplus, cada género y etapa de la vida contenía tres réplicas biológicas medidas en tres réplicas técnicas. Las muestras fueron separadas por género y etapa de vida (Figura 8) para mostrar la variación dentro de cada muestra. A continuación, las muestras se combinaron para mostrar la variación y las diferencias estadísticas utilizando un ANOVA bidireccional y las pruebas de comparación múltiple de Tukey20 (p-valor = < 0,05) (Figura 9). Cada muestra consistió en ~ 40 glándulas salivales diseccionadas de 20 hembras, machos y ninfas. Después del aislamiento y la cuantificación de los EV, las muestras se utilizaron para la purificación de ARN pequeño.
La concentración del ARN pequeño dentro de cada muestra se midió a través de Qubit (Tabla 1), y la calidad se midió a través de un bioanalizador utilizando electroforesis de gel estándar46,47. Las concentraciones son en nanogramos (Tabla 1) en un volumen de 14 μL para ambas especies de garrapatas. El total promedio de pequeñas concentraciones de ARN de los órganos de I. scapularis varió de 45,92 a 6.356 ng. La concentración de ARN de las vesículas de I. scapularis varió de 72,24 a 2.128 ng. Para R. microplus, la concentración de órganos varió de 259-2.142 ng, y las vesículas variaron de 59,22-1.848 ng. Las muestras se normalizaron a la misma concentración, y su calidad se midió a través de un bioanalizador (Figura 10). Se utilizó una escalera de referencia en el gel como marcador para la evaluación de la calidad. La integridad de la banda, la intensidad y los picos fueron representativos de la degradación potencial o la concentración total en cada muestra. Las bandas correspondientes a ARN ribosómicos de 5 s y 5,8 s solo estaban presentes en las muestras de órganos de las glándulas salivales (Figura 10, carriles A-D) y ausentes en la vesícula de las muestras de glándulas salivales (Figura 10, carriles E, F), lo que demuestra las diferencias en los pequeños perfiles de ARN entre órganos y vesículas extracelulares. La degradación de la muestra se dedujo por la ausencia de bandas en el gel; esto significó que hubo una degradación significativa de la muestra. Se recomienda descartar cualquier muestra que tenga una degradación significativa.
Para demostrar la presencia de muestras de miRNA dentro de las preparaciones, se prepararon pequeñas bibliotecas de ARN CDNA a partir de muestras de ARN que se han almacenado durante 3-4 meses después de un pequeño aislamiento de ARN. Curiosamente, se encontró una mayor degradación de la muestra en estas muestras. Los carriles A-D y G mostraron signos de degradación; por el contrario, E, F y H-K mostraron una degradación mínima y una concentración suficiente para la preparación de la biblioteca de aDNc de miRNA (Figura suplementaria 1). Solo una muestra se degradó cuando las muestras se utilizaron inmediatamente después de la purificación (Figura 10), lo que sugiere que las muestras de miRNA eran más propensas a la degradación una vez que se purificaban de los EV. Por lo tanto, las muestras E, F, H e I fueron seleccionadas para el análisis de enriquecimiento. Los asteriscos muestran los tamaños de banda de ~ 150 pb, que eran los tamaños esperados después de la preparación de la biblioteca de ADNc (Figura 7). Las bandas débiles inferiores indican el dímero de imprimación.
Durante el aislamiento del EV, la velocidad y el tiempo de centrifugación pueden afectar la concentración final del EV. Al pipetear el pellet EV en las columnas de 300 k, como se mencionó anteriormente en el paso 6.10, un bajo volumen y velocidad son esenciales para evitar que los EV pasen a través de la membrana. Estudios previos mostraron que 700 μL a 12.000 x g durante 20 min utilizando un concentrador centrífugo diferente era suficiente para separar adecuadamente los EV de las proteínas solubles20; sin embargo, las bajas concentraciones de EV se mostraron en el NTA utilizando un filtro diferente. Por lo tanto, la optimización de los filtros y otros materiales disponibles es esencial. Cuando se utilizaron por primera vez las columnas de 300 k, se probaron diferentes intervalos de velocidad para determinar cuál daba la mayor concentración de EV. El número de vesículas que se perdieron durante la centrifugación se midió mediante análisis NTA; se concluyó que las velocidades más bajas resultaron en una mayor concentración de vesículas en el flujo (no se muestra). Se concluyó que 500 μL a 6.000-8.000 x g era satisfactorio para aislar los EV. Una vez determinado esto, se utilizó este protocolo para aislar vesículas de I. scapularis y R. microplus. La concentración de las vesículas aisladas de cada especie de garrapata se midió a través de NTA (Figura 8). Las concentraciones de EV variaron entre 7,07 x 107 a 7,94 x 109 partículas/ml. La cantidad de EV se correlacionó con las concentraciones de miRNA, donde la mayor cantidad de EV resultó en una mayor concentración de miRNA extraído.
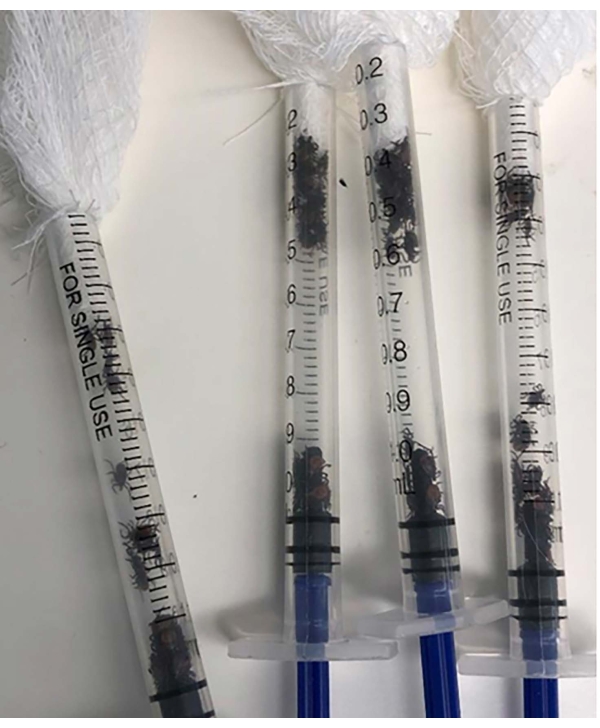
Figura 1: Jeringas sin aguja de 1 ml cargadas con I. scapularis adulto hembra y cubiertas con gasa esterilizada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Se extrajo el lado dorsal de una hembra hinchada con tijeras vannas de 4 mm. La hembra fue sumergida en 1x PBS para evitar la desecación de órganos. Las flechas amarillas apuntan a las glándulas salivales expuestas. La figura fue tomada a un aumento de 50x con una lente de objetivo de alta resolución. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Una placa de cultivo celular después de una incubación de 24 h a 32 °C. La primera fila de pocillos contiene los medios libres de vesículas y las glándulas salivales disecadas. El resto de los pocillos contienen 1x PBS con rifampicina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Un proceso de preparación de muestras para un ciclo de ultracentrífuga. (A) Una jeringa sin aguja de 10 ml rematada con un filtro de jeringa de 1 μm. (B) El sobrenadante después de tres rondas de centrifugación se canaliza en la jeringa. (C) El resto de la jeringa se llena a 10 ml con 1x PBS esterilizado. (D) La jeringa está cubierta y el sobrenadante con 1x PBS se filtra en el tubo de la ultracentrífuga. Haga clic aquí para ver una versión más grande de esta figura.
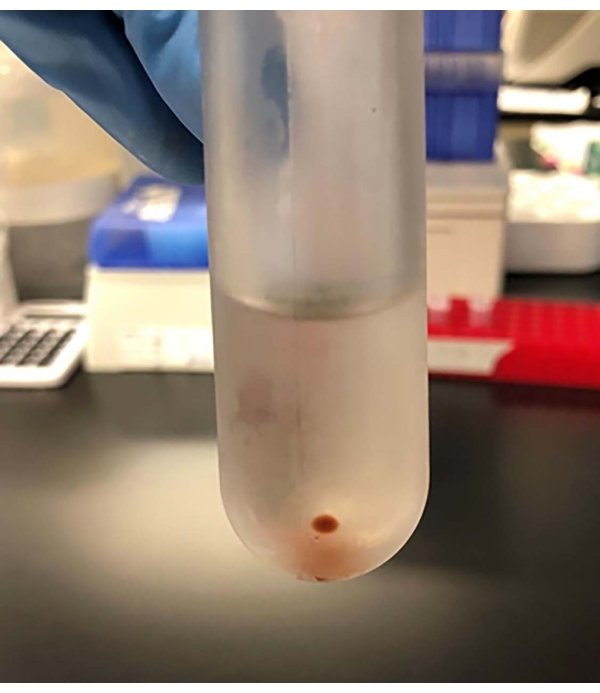
Figura 5: Después de 18 h de ultracentrifugación, se forma una bolita de vesículas extracelulares en la parte inferior del tubo de la ultracentrífuga. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Se utiliza un mortero esterilizado para homogeneizar los órganos de las glándulas salivales y las vesículas extracelulares. Haga clic aquí para ver una versión más grande de esta figura.
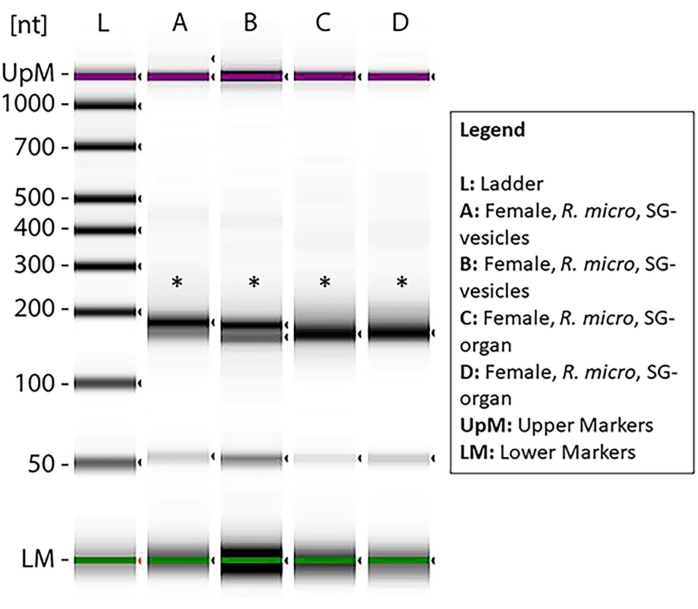
Figura 7: Electroforesis en gel medida a través de una estación de cinta que muestra las bibliotecas preparadas con miRNA después de un análisis de enriquecimiento. Las muestras de órganos femeninos de las glándulas salivales R . microplus y EV se basaron en una degradación mínima y una concentración suficiente de miRNA para la síntesis de la biblioteca de ADNc. La escalera (L) muestra los puntos de referencia en nucleótidos y los marcadores superior e inferior. Los asteriscos indican las bandas de tamaño producto ~ 150 pb, que significan las pequeñas bibliotecas de ARN cDNA. Las bandas inferiores muestran el dímero de imprimación. Haga clic aquí para ver una versión más grande de esta figura.
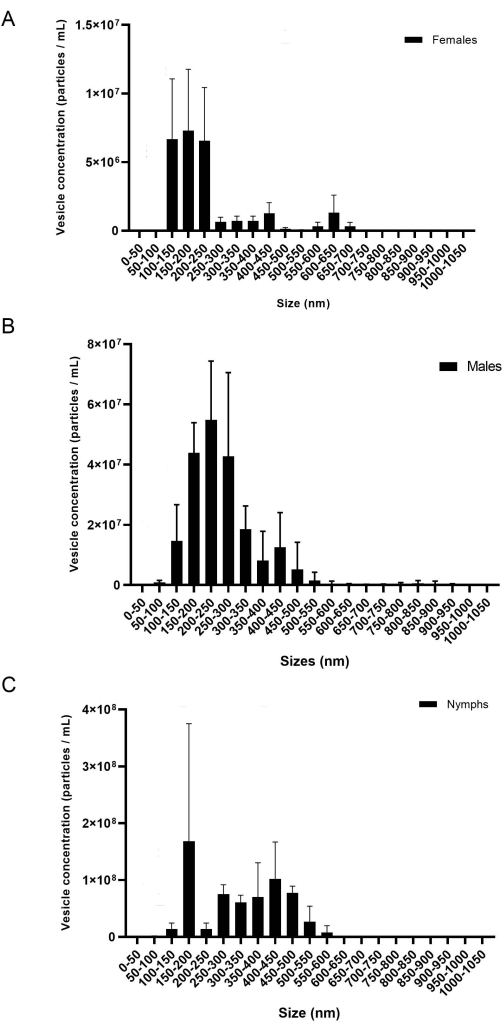
Figura 8: Una figura representativa de la variación entre las réplicas biológicas (A) hembras, (B) machos y (C) ninfas. El eje x muestra el tamaño EV (nm), y el eje y muestra la concentración EV (partículas/mL). Un ANOVA bidireccional y la prueba de comparación de Tukey mostraron diferencias estadísticas (valor P = < 0,05). Las barras de error representan el error estándar para tener en cuenta la variación. Cada muestra contenía 20 garrapatas con tres réplicas biológicas. Las muestras se registraron durante 60 s, tres veces cada una. La cámara se estableció en el nivel 7 y el umbral de detección se estableció en el nivel 5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Una cifra representativa de la variación para todas las réplicas biológicas combinadas para ninfas (rojo), hembras (azul) y machos (negro). El eje x muestra el tamaño ev (nm) y el eje y muestra la concentración EV (partículas/ml). Un ANOVA bidireccional y la prueba de comparación de Tukey mostraron diferencias estadísticas (valor P = < 0,05). Las barras de error representan el error estándar para tener en cuenta la variación. Cada muestra contenía 20 garrapatas con tres réplicas biológicas. Los asteriscos simbolizan una diferencia significativa de p < 0,05. Cada grabación se realizó durante 60 s, tres veces cada una. La cámara se estableció en el nivel 7 y el umbral de detección se estableció en el nivel 5. Haga clic aquí para ver una versión más grande de esta figura.
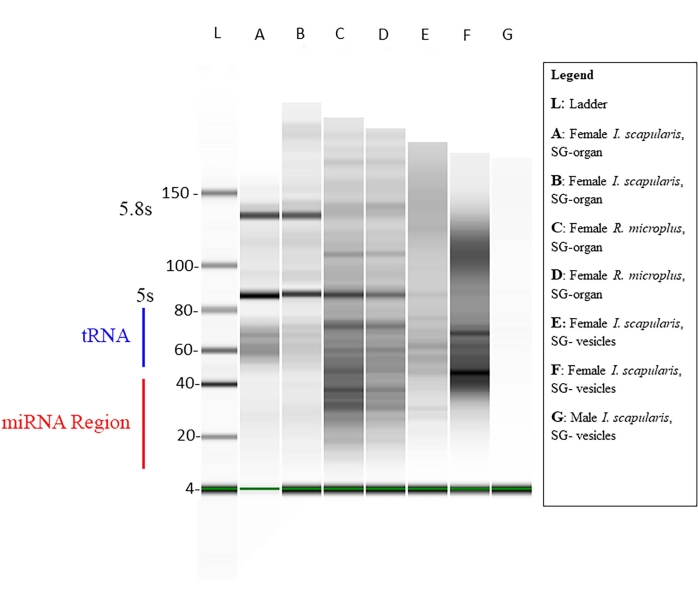
Figura 10: Un gel representativo a través del bioanalizador. La electroforesis en gel se realizó utilizando una escalera base como referencia. Una secuencia de miARN maduro es de ~18-22 nt de largo, donde se muestran bandas débiles en el rango de tamaño designado. Otros ARN pequeños, como los ARN nucleares pequeños, los ARN mensajeros de transferencia y los ARN reguladores, también están presentes en las muestras. Los tamaños de los ARN pequeños oscilaron entre ~ 20-150 nt. Las muestras varían de especies de garrapatas, tejidos y género. Para el carril G, un ejemplo de degradación de la muestra no muestra bandas. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Se midió una electroforesis en gel a través del bioanalizador, mostrando la calidad de los miRNAs extraídos de los órganos de las glándulas salivales femeninas y EV de R. microplus. La escalera (L) muestra los tamaños de referencia en nucleótidos, donde los miRNAs maduros miden ~18-22 nt de longitud. Los carriles A-D y G muestran degradación, y los carriles E, F y H-K muestran una degradación mínima. Haga clic aquí para descargar este archivo.
| Especie | Género | Órgano/ Vesícula | Concentración ev | concentración de miRNA (ng) |
| R. microplus | Hembra | Órgano | N/A | 259 |
| R. microplus | Hembra | Órgano | N/A | 2,142 |
| R. microplus | Hembra | Vesícula | 1,64 E+08 | 59.22 |
| R. microplus | Hembra | Vesícula | 1,64 E+09 | 1,848 |
| I. escápularis | Hembra | Órgano | N/A | 45.92 |
| I. escápularis | Hembra | Órgano | N/A | 6,356 |
| I. escápularis | Hembra | Vesícula | 1.73E+08 | 65.66 |
| I. escápularis | Hembra | Vesícula | 3.14 E+09 | 2,128 |
Tabla 1: Un ejemplo de las concentraciones de miRNA tanto para las glándulas salivales como para las vesículas extracelulares. La columna de concentraciones de miRNA representa las concentraciones más bajas a más altas para cada especie de garrapata.
| microARN | I. escápularis | I. ricinus | R. microplus | H. longicornis | Referencias |
| miR-8 | Un | P | P | P | 33, 36, 37, 43 |
| miR-71 | P | P | P | Un | 33, 36, 37, 43 |
| miR-279 | P | Un | Un | P | 33, 36, 37, 43 |
| let-7 | Un | P | P | P | 33, 36, 37, 43 |
Tabla 2: Los miRNAs conservados en diferentes especies de garrapatas. (P) indica que los miRNA se expresaron o presentaron comúnmente, y (A) significa que los miRNAs no se expresaron o detectaron comúnmente.
| Tipo de muestra | Número de puntuaciones >1* | Número de puntuaciones >4γ | Número de conservados | Número de novelas |
| Masculino | 17 | 0 | 48,885 | 23 |
| Hembra | 25 | 0 | 48,885 | 21 |
| Ninfas | 38 | 0 | 48,885 | 38 |
Tabla 3. Los miRNAs conservados y únicos se detectaron en los EV para hembras, machos y ninfas de R. microplus. *puntuación miRNA utilizada para la elaboración de perfiles. γpuntuación de miRNA utilizada para experimentos funcionales.
Tabla suplementaria 1: Una tabla que muestra los resultados de secuenciación de próxima generaciónpara los EV masculinos R. microplus secretados por las glándulas salivales. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 2: Una tabla que muestra los resultados de secuenciación de próxima generación para los EV femeninos R. microplus secretados de las glándulas salivales. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 3: Una tabla que muestra los resultados de secuenciación de próxima generaciónpara los EV de ninfa R. microplus secretados por las glándulas salivales. Haga clic aquí para descargar esta tabla.
Discusión
El protocolo actual proporciona una metodología detallada para extraer miRNA de las glándulas salivales y los EV. Sin embargo, hay consideraciones importantes, todas las cuales se detallan en las notas para cada sección de este protocolo. La cápsula y la malla deben asegurarse durante la alimentación con garrapatas para evitar que las garrapatas se escapen. La preparación y colocación de la cápsula se describen en Koga et al.40. Se deben realizar varias réplicas de las disecciones de garrapatas si se descarta una muestra inadecuada. Además, varios desafíos pueden estar presentes cuando se utilizan técnicas de aislamiento EV de tejido degarrapatas 18,20,43. Por ejemplo, los tejidos deben mantenerse húmedos durante la disección para evitar la desecación. Esto se hace agregando PBS a lo largo de la disección. Tanto el PBS como los medios utilizados para la disección y el cultivo de los órganos deben mantenerse con antibióticos para evitar la contaminación bacteriana del microbioma de garrapatas. Estos deben incluir antibióticos que se dirijan a las bacterias Gram-negativas y Gram-positivas, ya que ambos se pueden encontrar dentro de los tejidos de garrapatas60. Del mismo modo, se debe tener cuidado durante la disección para disminuir la contaminación con tejidos de otros órganos. Por lo tanto, las disecciones deben hacerse lentamente, y a medida que el usuario gana experiencia, se pueden diseccionar más garrapatas. Por último, debido a que los EV se secretan de todas las células, incluidas las células infectadas por patógenos, los estudios de garrapatas que realizan el aislamiento de EV deben usar medios y tampones libres de EV para evitar la contaminación entre EV25,61.
Sin embargo, este protocolo permite la reducción del número de garrapatas que se necesitan para producir evs salivales de garrapatas. Los protocolos anteriores requerían la salivación de un número significativamente mayor de garrapatas. Por ejemplo, los miRNAs secretados dentro de los EV salivales en Haemaphysalis longicornis necesitaron la salivación de 2.000 garrapatas adultas43. Esto puede ser extremadamente costoso para los laboratorios que carecen de la capacidad de hacer garrapatas. Del mismo modo, los tejidos de Amblyomma maculatum utilizados para el aislamiento de EV se congelaron parcialmente antes del aislamiento y se trataron con 75 U/mL de colagenasa tipo 3, lo que podría afectar la autenticidad de la secreción de EV19. Además, estos estudios requirieron 80-100 pares de glándulas salivales18.
Comparativamente, este protocolo se puede aplicar a múltiples especies de garrapatas, y requiere un bajo número de garrapatas para aislar los EV y extraer miRNAs de calidad conservada y novedosa (Tabla 2)33,36,37,43. Las concentraciones de miRNA variaron mucho, pero fueron suficientes para la secuenciación de próxima generación (Tabla 3 y Tablas suplementarias 1-3). Este protocolo se puede ajustar para acomodar un tamaño de muestra más grande si se necesitan concentraciones más grandes de miRNA. Además, los materiales utilizados en este protocolo son sustituibles dependiendo de la disponibilidad de material. No obstante, los volúmenes de muestra y la velocidad de centrifugación deberán ajustarse siguiendo las instrucciones del fabricante para los kits y columnas utilizados.
Una desventaja de este método es que los miRNAs y EVs pueden degradarse fácilmente a lo largo de los pasos de extracción y aislamiento. Por lo tanto, el protocolo debe cumplirse de manera rápida y eficiente. Cuando se indique, las muestras deben mantenerse en hielo y la extracción de miRNA debe realizarse en un ambiente esterilizado. Además, se puede realizar un tratamiento con RNasa en los EV aislados para eliminar los ARN grandes unidos a la membrana EV. Esto puede evitar que los ARN grandes contaminen la muestra durante las extracciones de miRNA. Por último, agregar un inhibidor de la ARN A la muestra de MIRNA después del aislamiento de EV u órganos es una medida preventiva importante para la degradación. Este protocolo puede ser alterado y aplicado en paralelo a los objetivos del experimento que se está llevando a cabo.
Las aplicaciones futuras de este protocolo pueden incluir el estudio de las interacciones patógeno-vector para comprender cómo los patógenos afectan el miRNA y otra carga genómica dentro de los EV salivales de garrapatas. Del mismo modo, este protocolo puede definir proteínas específicas y procesos celulares involucrados en el empaquetamiento de miRNAs en EVs de garrapatas, y el efecto específico que estos EVs y miRNAs tienen sobre la cicatrización de heridas y las respuestas inmunes. Debido a la creciente resistencia de las garrapatas a los acaricidas, existe una necesidad desesperada de métodos de control únicos. Los EV tienen el potencial de un método de control alternativo en comparación con los acaricidas. Los EV se pueden utilizar como nanotransportadores en aplicaciones terapéuticas 18,23,61. En humanos, los EV que transportan miRNAs se han utilizado para suprimir el crecimiento tumoral durante la inmunoterapia contra el cáncer62,63. Del mismo modo, en las garrapatas, los EV pueden transportar miRNAs genéticamente modificados que se ha demostrado que afectan las funciones biológicas vitales de las garrapatas y la transmisión de patógenos 36,57,64. La dirección futura es utilizar este protocolo para determinar los perfiles de miRNA de múltiples especies de garrapatas para identificar miRNAs de interés para estudios funcionales.
Divulgaciones
Los autores declaran no tener conflicto de intereses.
Agradecimientos
Estamos muy agradecidos por la asistencia del Laboratorio de Garrapatas de la Fiebre del Ganado en Edinburg, Texas. Nos gustaría agradecer a Michael Moses, Jason Tidwell, James Hellums, Cesario Agado y Homer Vasquez. También nos gustaría agradecer la asistencia de Sarah Sharpton, Elizabeth Lohstroh, Amy Filip, Kelsey Johnson, Kelli Kochcan, Andrew Hillhouse, Charluz Arocho Rosario y Stephanie Guzmán Valencia durante todo el proyecto. Nos gustaría agradecer al Grupo de Escritura de Mujeres en Entomología (AWE) de Texas A&M Aggie por su ayuda y consejos durante la redacción de este manuscrito. Los siguientes reactivos fueron proporcionados por los Centros para el Control y la Prevención de Enfermedades para su distribución por BEI Resources, NIAID, NIH: Ixodes scapularis Adult (Live), NR-42510. Las garrapatas hembra de I. scapularis también se recibieron de la Instalación de Cría de Garrapatas en la Universidad Estatal de Oklahoma. Este proyecto fue financiado por Texas A&M University T3: triads for transformation grant y el acuerdo de cooperación #58-3094-1-003 por el USDA-ARS a AOC.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | GenClone | 25-240 | |
| 1 µm nylon syringe filter | Tisch Scientific | 283129028 | |
| 1 inch black adhesive | Amazon | B00FQ937NM | Capsule |
| 10 mL needeless syringe | Exelint | 26265 | |
| 3' and 5' Adapters | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| 4 mm vannas scissors | Fine Science Tools | 15000-08 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid | Sigma-Aldrich | 1.1523 | |
| 70Ti rotor | Beckman Coulter | 337922 | |
| Amphotericin | Corning | 30-003-CF | |
| Beads | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Bioanalyzer | Agilent | G2939BA | |
| Bioanalyzer kit | Agilent | 5067-1513 | |
| Centrifuge 5425 | Eppendorf | ||
| Chloroform | Macron | UN1888 | |
| Cyverse Discovery Enviornment | https://cyverse.org/discovery-environment | ||
| Dissecting microscope | Nikon | SMZ745 | |
| Double-sideded carpet tape | amazon | 286373 | |
| Falcon Tubes, 50 mL | VWR | 21008-940 | |
| Fetal Bovine Serum | Gibco | FBS-02-0050 | |
| fine forceps | Excelta | 5-S-SE | |
| Foamies, 2 mm | Amazon | B004M5QGBQ | Capsule |
| Isoflurane | Phoenix Pharmaceuticals manfactured | 193.33165.3 | |
| Ixodes scaplaris | CDC, Oklahoma State University | ||
| L15C300 medium | In-lab | ||
| lipoprotein-cholesterol concentrate | MPI | 02191476-CF | |
| Microscope slide | VWR | 10118-596 | |
| miRDeep2 | https://github.com/rajewsky-lab/mirdeep2 | ||
| M-MuLV Reverse Transcriptase | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| molecular grade ethanol | Fischer Bioreagents | UN1170 | |
| multi-well 24 well tissue culture treated plate | Corning | 353047 | |
| Nanopaticle Tracking Analyzer machine | Malvern Panalytical | ||
| Nanosep with 300K Omega filter | Pall Corporation | OD3003C33 | |
| NEXTFLEX Small RNA-Seq Kit v3 | PerkinElmer | ||
| NextSeq 500/550 High Output Kit (75 cycles) | Illumina | 20024906 | |
| Optima XPN 90 Ultracentrifuge | Beckman Coulter | ||
| Penicillin | Thermofischer Scientific | ICN19453780 | |
| Pippettes | Ependorff | ||
| polycarbonate centrifuge bottle | Beckman Coulter | 355618 | |
| Qiagen miRNeasy kit | Qiagen | 217084 | |
| QIAzol lysis reagent | Qiagen | 79306 | |
| Qubit | Thermofisher | Q32880 | |
| Qubit kit | Thermofisher | Q10212 | |
| Rabbits | Charles River | ||
| Reverse Universal Primer | Illumina | 20024906 | NEXTFLEX Small RNA-Seq Kit |
| Rhipicephalus microplus | Cattle Fever Tick Research Labratoty | ||
| Rifampicin | Fischer Bioreagents | 215544 | |
| RNAlater | Invitrogen | 833280 | |
| RNAse free tubes | VWR | 87003294 | |
| RNAse inhibitor | Thermo Fischer | 11111729 | |
| RNAse/DNAse free water | Qiagen | 217084 | |
| RNeasy Minelute spin column | Qiagen | 217084 | Qiagen miRNeasy kit |
| RPE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| RT Buffer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RT Forward Primer | Illumina | 20024906 | NEXTFLEX Small RNA-seq kit |
| RTE Buffer | Qiagen | 217084 | Qiagen miRNeasy kit |
| Sodium bicarbonate | Sigma-Aldrich | S6014-25G | |
| Sorvall ST16 | Thermo Fischer | 75004380 | |
| Sterilized Gauze sponges | Covidien | 2187 | |
| Sterilized PBS | Sigma | RNBK0694 | |
| streptomycin | thermofischer Scientific | 15240062 | |
| TapeStation | Aligent | G2991BA | |
| Tear Mender Instant Fabric and Leather Adhesive | Amazon | 7.42836E+11 | Capsule |
| Tissue Adhesive | 3M VetBond | ||
| Triple Antibiotics | dechra | 17033-122-75 | |
| Tryptose phosphate broth | BD | BD 260300 |
Referencias
- Jongejan, F., Uilenberg, G. The global importance of ticks. Parasitology. 129, 3-14 (2004).
- Anderson, J. F., Magnarelli, L. A. Biology of ticks. Infectious Disease Clinics of North America. 22 (2), 195-215 (2008).
- de la Fuente, J. Controlling ticks and tick-borne diseases… looking forward. Ticks and Tick-Borne Diseases. 9 (5), 1354-1357 (2018).
- Nicholson, W. L., Sonenshine, D. E., Noden, B. H., Brown, R. N. Ticks (Ixodia). Medical and Veterinary Entomology. , 603-672 (2019).
- Guerrero, F. D., Lovis, L., Martins, J. R. Acaricide resistance mechanisms in Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitologia Veterinária. 21 (1), 1-6 (2012).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: the state of play. Veterinary Parasitology. 203 (1-2), 6-20 (2014).
- Redshaw, N., et al. A comparison of miRNA isolation and RT-qPCR technologies and their effects on quantification accuracy and repeatability. Biotechniques. 54 (3), 155-164 (2013).
- Estrada-Peña, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Experimental and Applied Acarology. 23 (9), 685-715 (1999).
- Eisen, R. J., Eisen, L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology. 34 (4), 295-309 (2018).
- Bowman, A. S., Sauer, J. R. Tick salivary glands: function, physiology and future. Parasitology. 129, 67 (2004).
- Kim, D., Maldonado-Ruiz, P., Zurek, L., Park, Y. Water absorption through salivary gland type I acini in the blacklegged tick, Ixodes scapularis. PeerJ. 5, 3984 (2017).
- Nunes, P. H., Bechara, G. H., Camargo-Mathias, M. I. Morphological changes in the salivary glands of Amblyomma cajennense females (Acari: Ixodidae) in different feeding stages on rabbits at first infestation. Experimental and Applied Acarology. 45 (3), 199-209 (2008).
- Bishop, R., et al. A cement protein of the tick Rhipicephalusappendiculatus, located in the secretory e cell granules of the type III salivary gland acini, induces strong antibody responses in cattle. International Journal for Parasitology. 32 (7), 833-842 (2002).
- Yamaji, K., et al. A salivary cystatin, HlSC-1, from the ixodid tick Haemaphysalis longicornis play roles in the blood-feeding processes. Parasitology Research. 106 (1), 61-68 (2009).
- Simo, L., Kazimirova, M., Richardson, J., Bonnet, S. I. The essential role of tick salivary glands and saliva in tick feeding and pathogen transmission. Frontiers in Cellular and Infection Microbiology. 7, 281 (2017).
- Perner, J., Kropáčková, S., Kopáček, P., Ribeiro, J. M. C. Sialome diversity of ticks revealed by RNAseq of single tick salivary glands. PLoS Neglected Tropical Diseases. 12 (4), 0006410 (2018).
- Madden, R. D., Sauer, J. R., Dillwith, J. W. A proteomics approach to characterizing tick salivary secretions. Experimental and Applied Acarology. 32 (1), 131-141 (2004).
- Zhou, W., et al. Discovery of exosomes from tick saliva and salivary glands reveals therapeutic roles for CXCL12 and IL-8 in wound healing at the tick-human skin interface. Frontiers in Cell and Developmental Biology. 8, 554 (2020).
- Zhou, W., et al. Exosomes serve as novel modes of tick-borne flavivirus transmission from arthropod to human cells and facilitates dissemination of viral RNA and proteins to the vertebrate neuronal cells. PLoS Pathogens. 14 (1), 1006764 (2018).
- Chávez, A. S. O., et al. Tick extracellular vesicles enable arthropod feeding and promote distinct outcomes of bacterial infection. Nature Communications. 12 (1), 1-17 (2021).
- Pegtel, D. M., Gould, S. J. Exosomes. Annual Review of Biochemistry. 88, 487-514 (2019).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Théry, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nature Cell Biology. 21 (1), 9-17 (2019).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. A. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213 (2018).
- Gioseffi, A., Edelmann, M. J., Kima, P. E. Intravacuolar pathogens hijack host extracellular vesicle biogenesis to secrete virulence factors. Frontiers in Immunology. 12, 662944 (2021).
- Chávez, A. S. O., O'Neal, A. J., Santambrogio, L., Kotsyfakis, M., Pedra, J. H. F. Message in a vesicle-trans-kingdom intercommunication at the vector-host interface. Journal of Cell Science. 132 (6), 224212 (2019).
- Janas, T., Janas, M. M., Sapoń, K., Janas, T. Mechanisms of RNA loading into exosomes. FEBS Letters. 589 (13), 1391-1398 (2015).
- Lu, T. X., Rothenberg, M. E. MicroRNA. Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- Pegtel, D. M., et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences. 107 (14), 6328-6333 (2010).
- Bartel, D. P. MicroRNAs: target recognition and regulatory functions. Cell. 136 (2), 215-233 (2009).
- Ambros, V. MicroRNAs and developmental timing. Current Opinion in Genetics and Development. 21 (4), 511-517 (2011).
- Bushati, N., Cohen, S. M. microRNA functions. Annual Review of Cell and Developmental Biology. 23, 175-205 (2007).
- Hackenberg, M., Langenberger, D., Schwarz, A., Erhart, J., Kotsyfakis, M. In silico target network analysis of de novo-discovered, tick saliva-specific microRNAs reveals important combinatorial effects in their interference with vertebrate host physiology. RNA. 23 (8), 1259-1269 (2017).
- Luo, J., et al. MicroRNA-1 promotes the development of and prolongs engorgement time in Hyalomma anatolicum anatolicum (Acari: Ixodidae) ticks. Biorxiv. , (2020).
- Zhou, J., Zhou, Y., Cao, J., Zhang, H., Yu, Y. Distinctive microRNA profiles in the salivary glands of Haemaphysalis longicornis related to tick blood-feeding. Experimental and Applied Acarology. 59 (3), 339-349 (2013).
- Hermance, M. E., Widen, S. G., Wood, T. G., Thangamani, S. Ixodes scapularis salivary gland microRNAs are differentially expressed during Powassan virus transmission. Scientific Reports. 9 (1), 1-17 (2019).
- Barrero, R. A., et al. Evolutionary conserved microRNAs are ubiquitously expressed compared to tick-specific miRNAs in the cattle tick Rhipicephalus (Boophilus) microplus. BMC Genomics. 12 (1), 1-17 (2011).
- Colombo, M., et al. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. Journal of Cell Science. 126 (24), 5553-5565 (2013).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. . Proteomic Profiling. , 179-209 (2015).
- Koga, K., et al. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Research. 25, 3703-3707 (2005).
- Wright, K., de Silva, K., Purdie, A. C., Plain, K. M. Comparison of methods for miRNA isolation and quantification from ovine plasma. Scientific Reports. 10 (1), 1-11 (2020).
- Mráz, M., Malinova, K., Mayer, J., Pospisilova, S. MicroRNA isolation and stability in stored RNA samples. Biochemical and Biophysical Research Communications. 390 (1), 1-4 (2009).
- Nawaz, M., et al. miRNA profile of extracellular vesicles isolated from saliva of Haemaphysalis longicornis tick. Acta Tropica. 212, 105718 (2020).
- Ribeiro, J. M. C., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva. Medical and Veterinary Entomology. 18 (1), 20-24 (2004).
- Almazán, C., et al. A versatile model of hard tick infestation on laboratory rabbits. Journal of Visualized Experiments. (140), e57994 (2018).
- Masotti, A., Preckel, T. Analysis of small RNAs with the Agilent 2100 Bioanalyzer. Nature Methods. 3 (8), 658 (2006).
- Benesova, S., Kubista, M., Valihrach, L. Small RNA-sequencing: approaches and considerations for miRNA analysis. Diagnostics. 11 (6), 964 (2021).
- Mackowiak, S. D. Identification of novel and known miRNAs in deep-sequencing data with miRDeep2. Current Protocols in Bioinformatics. 36 (1), 12 (2011).
- Friedländer, M. R., Mackowiak, S. D., Li, N., Chen, W., Rajewsky, N. miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades. Nucleic Acids Research. 40 (1), 37-52 (2012).
- Griffiths-Jones, S. The microRNA registry. Nucleic Acids Research. 32, 109-111 (2004).
- Griffiths-Jones, S., Grocock, R. J., Van Dongen, S., Bateman, A., Enright, A. J. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Research. 34, 140-144 (2006).
- Griffiths-Jones, S., Saini, H. K., Van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucleic Acids Research. 36, 154-158 (2007).
- Kozomara, A., Birgaoanu, M., Griffiths-Jones, S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 47, 155-162 (2019).
- Kozomara, A., Griffiths-Jones, S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Research. 39, 152-157 (2011).
- Kozomara, A., Griffiths-Jones, S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Research. 42, 68-73 (2014).
- Wu, F., et al. MicroRNA let-7 regulates the expression of ecdysteroid receptor (ECR) in Hyalomma asiaticum (Acari: Ixodidae) ticks. Parasites and Vectors. 12 (1), 1-13 (2019).
- Goff, S. A., et al. The iPlant collaborative: cyberinfrastructure for plant biology. Frontiers in Plant Science. 2, 34 (2011).
- Merchant, N., et al. The iPlant collaborative: cyberinfrastructure for enabling data to discovery for the life sciences. PLoS Biology. 14 (1), 1002342 (2016).
- Kumar, D., et al. An exploratory study on the microbiome of northern and southern populations of Ixodes scapularis ticks predicts changes and unique bacterial interactions. Pathogens. 11 (2), 130 (2022).
- Zhang, Y., et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. International Journal of Nanomedicine. 15, 6917 (2020).
- Di Leva, G., Croce, C. M. miRNA profiling of cancer. Current Opinion in Genetics and Development. 23 (1), 3-11 (2013).
- Ganju, A., et al. miRNA nanotherapeutics for cancer. Drug Discovery Today. 22 (2), 424-432 (2017).
- Luo, J., et al. MicroRNA-1 Expression and Function in Hyalomma Anatolicum anatolicum (Acari: Ixodidae) Ticks. Frontiers in Physiology. 12, 596289 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados