Method Article
In vitro Ensaio Tridimensional de Angiogênese Utilizando Células-Tronco Embrionárias de Camundongos para Modelagem de Doenças Vasculares e Testes de Fármacos
Neste Artigo
Resumo
Este ensaio utiliza células-tronco embrionárias de camundongos diferenciadas em corpos embrionários cultivadas em gel de colágeno 3D para analisar os processos biológicos que controlam a angiogênese brotada in vitro. A técnica pode ser aplicada para testar drogas, modelar doenças e estudar genes específicos no contexto de deleções embrionariamente letais.
Resumo
Avanços recentes em células-tronco pluripotentes induzidas (iPSC) e tecnologias de edição de genes permitem o desenvolvimento de novos modelos de doenças baseadas em células humanas para programas de descoberta de drogas fenotípicas (PDD). Embora esses novos dispositivos pudessem prever a segurança e a eficácia de drogas experimentais em humanos com mais precisão, seu desenvolvimento para a clínica ainda depende fortemente de dados de mamíferos, notadamente o uso de modelos de doenças em camundongos. Em paralelo aos modelos de doenças organoides ou organ-on-chip humanas, o desenvolvimento de modelos relevantes em camundongos in vitro é, portanto, uma necessidade não atendida para avaliar comparações diretas de eficácia e segurança de medicamentos entre espécies e condições in vivo e in vitro. Neste artigo, descreve-se um ensaio de brotamento vascular que utiliza células-tronco embrionárias de camundongos diferenciadas em corpos embrionários (EBs). EBs vascularizadas cultivadas em gel de colágeno 3D desenvolvem novos vasos sanguíneos que se expandem, um processo chamado angiogênese brotamento. Esse modelo recapitula as principais características da angiogênese germinada in vivo-formação de vasos sanguíneos a partir de uma rede vascular pré-existente, incluindo seleção de células da ponta endotelial, migração e proliferação de células endoteliais, orientação celular, formação de tubos e recrutamento de células murais. É passível de triagem para drogas e genes moduladores da angiogênese e apresenta semelhanças com ensaios vasculares tridimensionais (3D) recentemente descritos baseados em tecnologias humanas de iPSC.
Introdução
Nas últimas três décadas, a descoberta de fármacos baseada em alvos (TDD) tem sido amplamente empregada na descoberta de fármacos pela indústria farmacêutica. A TDD incorpora um alvo molecular definido que desempenha um papel importante em uma doença e depende do desenvolvimento de sistemas de cultura celular relativamente simples e leituras para triagem de drogas1. A maioria dos modelos típicos de doenças usados em programas de TDD incluem métodos tradicionais de cultura de células, como células cancerosas ou linhagens celulares imortalizadas cultivadas em ambientes artificiais e substratos não fisiológicos. Embora muitos desses modelos tenham fornecido ferramentas viáveis para identificar candidatos a fármacos bem-sucedidos, o uso de tais sistemas pode ser questionável devido à sua baixa relevância para a doença2.
Para a maioria das doenças, os mecanismos subjacentes são realmente complexos e vários tipos celulares, vias de sinalização independentes e múltiplos conjuntos de genes são frequentemente encontrados para contribuir para um fenótipo específico da doença. Isso também é verdade para doenças hereditárias em que a causa primária é uma mutação em um único gene. Com o recente advento de tecnologias de células-tronco pluripotentes induzidas por humanos (iPSC) e ferramentas de edição gênica, agora é possível gerar organoides 3D e modelos de doenças organ-on-chip que poderiam recapitular melhor a complexidade humana in vivo 3,4. O desenvolvimento de tais tecnologias está associado ao ressurgimento do interesse em programas de descoberta de drogas fenotípicas (TID)1. O TID pode ser comparado ao rastreamento empírico, pois não depende do conhecimento da identidade de um alvo específico da droga ou de uma hipótese sobre seu papel na doença. A abordagem TID é hoje cada vez mais reconhecida por contribuir fortemente para a descoberta de drogas de primeira classe5. Como o desenvolvimento de tecnologias de organoides humanos e organ-on-chip ainda está engatinhando, espera-se que os modelos iPSC (complementados com ferramentas inovadoras de imagem e aprendizado de máquina6,7) forneçam, em um futuro próximo, vários novos modelos complexos de doenças baseadas em células para triagem de drogas e programas associados de TID para superar a baixa produtividade da abordagem TDD8, 9º.
Embora os modelos organoides humanos e organ-on-chip possam fornecer informações importantes sobre a complexidade da doença e para a identificação de novos medicamentos, trazer medicamentos para a nova prática clínica também depende fortemente de dados de modelos animais para avaliar sua eficácia e segurança. Entre eles, camundongos geneticamente modificados são certamente os modelos de mamíferos preferidos. Eles têm muitas vantagens, pois têm um tempo de geração relativamente curto para os mamíferos, têm muitos fenótipos semelhantes às doenças humanas e podem ser facilmente manipulados geneticamente. São, portanto, extensivamente utilizados em programas de descoberta de fármacos10. No entanto, fazer a ponte entre camundongos e humanos continua sendo um desafio importante11. O desenvolvimento de modelos in vitro de camundongos equivalentes a modelos organoides e organ-on-chip humanos poderia, pelo menos parcialmente, preencher essa lacuna, pois permitirá comparações diretas de eficácia e segurança de medicamentos entre dados in vivo de camundongos e in vitro em humanos.
Aqui, um ensaio de brotamento vascular em corpos embrionários (EBs) de camundongos é descrito. Os vasos sanguíneos são compostos por células endoteliais (revestimento interno das paredes dos vasos), células murais (células musculares lisas vasculares e pericitos)12. Esse protocolo baseia-se na diferenciação de células-tronco embrionárias de camundongos (mESCs) em EBs vascularizadas utilizando gotículas pendentes que recapitulam a diferenciação de células endoteliais e murais de novo 13,14. CTEs de camundongos podem ser facilmente estabelecidas em cultura a partir de blastocistos isolados do dia 3,5 de camundongos com diferentes origens genéticas15. Também oferecem possibilidades de análise clonal, rastreamento de linhagens e podem ser facilmente manipulados geneticamente para gerar modelos de doenças13,16.
Como os vasos sanguíneos nutrem todos os órgãos, não é surpreendente que muitas doenças, se não todas, estejam associadas a alterações na microvasculatura. Em condições patológicas, as células endoteliais podem adotar um estado ativado ou podem se tornar disfuncionais, resultando em morte celular mural ou migração para longe dos vasos sanguíneos. Estes podem resultar em angiogênese excessiva ou em rarefação de vasos, podem induzir fluxo sanguíneo anormal e barreira vascular defeituosa levando ao extravasamento de células imunes e inflamação12,17,18,19. A pesquisa para o desenvolvimento de fármacos moduladores dos vasos sanguíneos é, portanto, alta, e múltiplos atores e conceitos moleculares já foram identificados para o direcionamento terapêutico. Nesse contexto, o protocolo descrito é particularmente adequado para a construção de modelos de doenças e para testes de drogas, pois recapitula as principais características da angiogênese em brotamento in vivo, incluindo seleção de células da ponta e do pedúnculo endotelial, migração e proliferação de células endoteliais, orientação de células endoteliais, formação de tubos e recrutamento de células murais. Também apresenta semelhanças com ensaios vasculares 3D recentemente descritos, baseados em tecnologias humanas iPSC20.
Protocolo
1. Preparação de mídia e cultura de mESC
- Preparar meio condicionado +/- (CM+/-) usando o suplemento 1x Glasgow MEM (G-MEM BHK-21) com 10% (vol/vol) de Soro Fetal Bovino (FBS) inativado pelo calor, 0,05 mM β-mercaptoetanol, 1x aminoácidos não essenciais (NEAA 1x), 2 mM L-glutamina e 1 mM de piruvato de sódio.
- Preparar meio condicionado +/+ (CM+/+) utilizando o suplemento meio CM+/- com Fator Inibidor de Leucemia (LIF) (1.500 U/mL) e β-mercaptoetanol 0,1 mM.
- Preparar meio condicionado +/+ na presença de dois inibidores (CM+/+ 2i) utilizando o suplemento meio CM+/+ com 1 μM PD0325901 e 3 μM CHIR99021.
- Preparar solução de gelatina a 0,1% misturando 25 mL de solução de gelatina a 2% pré-aquecida em 500 mL de solução salina tamponada com fosfato sem cálcio e magnésio (DPBS).
- Preparar 10x tampão de fosfato de tripsina versene (TVP 10x) misturando tripsina (2,5%) com TVP 1x (9,5% 10x DPBS, 1 mM EDTA, 0,01% soro de frango, 0,01% tripsina (2,5%) em H2O) (proporção 1:10, vol/vol).
NOTA: Filtrar todas as soluções através de um filtro de poros de 0,22 μm. Conservar o meio de cultura a -20 °C a longo prazo e manter outros reagentes a 4 °C até 3 semanas (ver Tabela de Materiais). - Revestir duas placas de cultura celular de 12 poços com solução de gelatina a 0,1% (500 μL por poço) e incubá-las por 30 min em estufa CO 2 (37 °C, 5% CO2, atmosfera úmida).
- Lave as placas revestidas com gelatina com PBS e adicione 500 μL de meio CM+/-.
- Descongelar dois frascos para injetáveis de 1 x 106 fibroblastos embrionários de camundongos (MEFs) irradiados criopreservados a 37 °C e transferir a suspensão celular para um tubo cônico com 5 mL de meio CM+/-.
- Centrifugar as células a 200 x g durante 5 min à temperatura ambiente (TR). Aspirar o meio e ressuspender suavemente o pellet de células em 12 mL de meio CM+/- na concentração de 1,67 x 10,5 células por mL.
- Semear 500 μL de MEF em uma placa de cultura celular de 12 poços (2,4 x 105 células por cm 2) e incubar a placa durante a noite (o/n) em uma incubadora de CO2.
- Descongelar um frasco para injetáveis de mESCs criopreservados (1 x 106) em meio CM+/+ 2i.
- Semeando a suspensão de mESC em uma placa de 12 poços pré-lavada com MEFs em 1 mL de meio CM+/+ 2i e transferindo a placa para uma incubadora de CO2 . Atualize o meio diariamente.
- Com 70% de confluência, lavar as colônias mESC com DPBS. Adicionar 150 μL de tampão TVP 10x quente e incubar em RT por 30 s para iniciar a dissociação enzimática.
- Remover cuidadosamente o tampão TVP, ressuspender as células em 1 mL de meio CM+/+ 2i e dissociar as colônias em células únicas por pipetagem suave.
- Passar as células transferindo-as para uma nova placa de cultura celular de 12 poços com MEFs (proporção de divisão: 1:3-1:5). Misture suavemente para distribuir as células e incube em uma incubadora de CO2 .
- Atualizar o meio de cultura (2-3 mL) e observar diariamente o crescimento/morfologia celular. Repita a passagem em série com 70% de confluência a cada 2 dias. Mude para o meio CM+/+ por duas passagens antes de iniciar a diferenciação celular.
2. Formação de EB em gota suspensa
- Preparar o meio de diferenciação do mesoderma fresco suplementando o meio CM+/- com Fator de Crescimento de Fibroblastos (bFGF) básico (50 ng·mL-1) e com Proteína Morfogenética Óssea 4 (BMP-4) (5 ng·mL-1) e mantê-lo a 4 °C até o uso.
- Cobrir um poço da placa de cultura celular de 6 poços com 500 μL de solução de gelatina a 0,1% e colocá-lo em uma incubadora de CO2 por 30 min.
- Lave as placas revestidas com gelatina com PBS e adicione 500 μL de meio CM+/-.
- Para obter uma população pura de mESCs, tripsinize a placa de cultura celular com tampão TVP 10x por 30 s em RT, ressuspenda as células em meio de diferenciação de mesoderma de 1 mL e, em seguida, transfira-as para a placa de 6 poços revestida com gelatina por 30 min, permitindo que as MEFs se fixem enquanto as mESCs permanecem em suspensão.
- Coletar a suspensão celular em um tubo cônico de 50 mL e contar as células usando um hemocitômetro de Neubauer e corante azul de Trypan para uma exclusão de células vivas/mortas.
- Centrifugar as células a 200 x g por 5 min na RT. Retirar o sobrenadante e ressuspender o pellet celular em meio de diferenciação mesodérmica para atingir 4,55 x 104 células por mL.
- Encha o fundo de placas de poliestireno de fixação baixa de 94 mm com 15 mL de água estéril.
NOTA: Quatro pratos contendo gotas pendentes (1,6 x 105 células em 3,52 mL de meio) serão necessários para testar uma condição específica usando o ensaio de angiogênese de brotação 3D. - Transfira a suspensão celular para um reservatório plástico estéril e carregue quatro posições de uma pipeta multicanal com 22 μL de suspensão celular por canal (1 x 103 células por gota de 22 μL).
- Levante e inverta a tampa da placa de 94 mm e coloque-a na superfície limpa do gabinete de fluxo com o lado interno voltado para cima.
- Depositar 40 gotas da suspensão celular na superfície interna de cada tampa. Inverta cuidadosamente a tampa sem perturbação e coloque-a de volta no prato, de modo que as gotas fiquem viradas para a água.
- Incube os pratos em uma incubadora de CO2 . Considere isso como dia de diferenciação 0. Manter as placas por 4 dias para formar EBs.
3. Ensaio de competição para a posição da célula de ponta
- Cultura: uma linhagem mESC fluorescente e outra não fluorescente, conforme descrito anteriormente13. Como exemplo, são usados mESCs 7ACS/EYFP rotulados em amarelo e mESCs R1.
- Prepare EBs em mosaico misturando quantidades iguais das duas linhas mESC (proporção 1:1) e incube as placas suspensas em uma incubadora de CO 2, conforme descrito na etapa2 .
4. Cultura de EBs flutuantes para diferenciação vascular
- Antes de coletar EBs das gotas pendentes, prepare o seguinte.
- Preparar solução de ágar a 5% em H2O e esterilizá-la em autoclave (20 min a 120 °C).
- Use a solução quente de ágar a 5% para preparar o meio G-MEM BHK-21 contendo ágar a 1% e despeje rapidamente 3 mL em uma das placas de poliestireno de 60 mm. Deixe o ágar solidificar por 1 h no RT. Guarde os pratos a 4 °C até usar.
- Preparar meio de diferenciação vascular fresco 2x suplementando o meio CM+/- com bFGF (100 ng·mL-1) e VEGF-A (50 ng·mL-1). Conservar o meio a 4 °C até à utilização.
- Coletar as gotas pendentes em um tubo cônico de 15 mL usando uma pipeta P1000 e remover o sobrenadante após alguns minutos de sedimentação com EB.
- Ressuspender as EBs em 3 mL de meio de diferenciação vascular 2x, transferir a suspensão da EB para uma mão revestida em ágar, distribuir as EBs homogeneamente para evitar agregação.
- Incubar as placas em estufa CO 2 e refrescar o meio a cada2 dias até o dia 9 usando 1x meio de diferenciação vascular na presença de bFGF (50 ng·mL-1) e VEGF-A (25 ng·mL-1).
- Alternativamente, adicione o Fator de Crescimento Derivado de Plaquetas-BB (PDGF-BB) (10 ng·mL-1 no dia 4 e 5 ng·mL-1 no dia 6 e no dia 8) ao meio de diferenciação vascular para promover a diferenciação das células murais.
5. Análise por citometria de fluxo
- Coletar os EBs de 9 dias em um tubo cônico de 15 mL usando uma pipeta P1000 e lavá-los uma vez com PBS quente.
- Adicionar 1mL de meio G-MEM BHK-21 contendo 0,2 mg·mL-1 de colagenase A e incubar as células em incubadora de CO2 por 5 min.
- Dissociar os EBs pipetando suavemente para cima e para baixo com uma pipeta P1000.
- Interromper a atividade da colagenase adicionando 1 mL de meio G-MEM BHK-21 frio com 10% de FBS.
- Centrifugar as células a 200 x g por 5 min no TR.
- Ressuspender as células em 500 μL de PBS com SFB a 2%.
- Conte as células usando um hemocitômetro de Neubauer.
- Ressuspender 400.000 células em 100 μL de PBS com 2% de FBS por condição de coloração.
- Incubar as células durante 45 minutos a 4 °C com os seguintes anticorpos: APC conjugado de rato anti-rato PECAM-1 (clone MEC13.3) e FITC conjugado de rato anti-rato CD45 (clone 30-F11) ou anticorpos de controlo isotípico.
- Lavar as células duas vezes com 1 mL de PBS contendo FBS a 2%.
- Ressuspender as células para atingir uma concentração final de 5 x 106 células por mL.
- Filtre as células usando um tubo de ensaio de poliestireno de fundo redondo, com uma tampa de encaixe do filtro de células.
- Analisar 20.000 eventos PECAM-1 (+) por citometria de fluxo.
6.3D ensaio de angiogênese por brotamento e coloração por imunofluorescência
- No dia 9, preparar um meio de brotação adicionando 10% FBS (vol/vol), bFGF (50 ng·mL-1), VEGF-A (25 ng·mL-1), eritropoetina humana recombinante (hEPO) (20 ng·mL-1), interleucina-6 humana (IL-6) (10 ng·mL-1), β-mercaptoetanol 0,05 mM, NEAA (1x), L-glutamina (1x), piruvato de sódio (1x), colágeno de cauda de rato tipo I (1,25 mg·mL-1), e NaOH (3,1 mM) para GMEM em meio BHK-1.
- Para evitar a gelificação do colágeno, mantenha o meio de brotação no gelo até o uso.
- Para avaliar o efeito de moléculas pró/antiangiogênicas, adicione o fármaco ou veículo selecionado ao meio de brotação na concentração selecionada.
- Coletar EBs de 9 dias de uma placa de ágar de 60 mm em um tubo cônico de 15 mL (equivalente a uma condição) e remover o sobrenadante após alguns minutos de sedimentação.
- Cobrir o fundo de uma placa de cultura de 35 mm com 1 mL do meio de brotação e incubar a 37 °C por 5 min para induzir a gelificação.
- Ressuspender as EBs em 2 mL de meio de brotação a frio.
- Transfira a suspensão para a placa de cultura de 35 mm revestida com a primeira camada de meio de brotação.
- Distribua os EBs por toda a placa e certifique-se de que eles estejam a uma distância igual um do outro. Incubar o prato em uma incubadora de CO2 . A primeira formação de brotos acontece dentro de 24-48 h.
- No 12º dia, o gel de colágeno contendo EBs é cuidadosamente transferido para uma lâmina de vidro (75 x 26 mm) usando uma espátula.
- Retire o excesso de líquido usando uma pipeta (P1000) e desidrate o gel colocando uma folha de gaze de linho de nylon e cartões de filtro absorvente (gel blotting paper) sobre o gel. Aplique pressão colocando um peso (250 g) por 2 min. Retire cuidadosamente os papéis de nylon/filtro e deixe as lâminas secarem ao ar por 30 min no RT.
- Lave as lâminas três vezes com PBS por 5 min no RT.
- Fixar os EB utilizando solução de zinco (ver Tabela de Materiais) o/n a 4 °C. Alternativamente, fixar os EBs fluorescentes em mosaico com Paraformaldeído (PFA) (4%) o/n a 4 °C no escuro.
- Remova o fixador. Lave as lâminas cinco vezes com PBS por 5 min no RT.
- Permeabilizar os EBs em PBS contendo Triton-X100 a 0,1% por 15 min no TR.
- Remova a solução de permeabilização. Lave as lâminas cinco vezes com PBS por 5 min.
- Incubar os EBs no tampão de bloqueio (PBS com 2% de Albumina de Soro Bovino, BSA) por 1 h no TR.
- Para corar os brotos endoteliais, use um anticorpo primário anti-PECAM-1 de rato (diluição de 1:100) no tampão de bloqueio o/n a 4 °C.
- Lave as lâminas cinco vezes com PBS por 5 min.
- Incubar as lâminas com o anticorpo secundário Alexa 555 anti-rato de cabra em tampão de bloqueio (diluição de 1:250) e, quando necessário, com o anticorpo anti-α-SMA conjugado com FITC em tampão de bloqueio (diluição de 1:250) para corar as células murais por 2 h no RT no escuro.
- Lave as lâminas três vezes com PBS por 5 min e uma vez com H20 antes de montá-las.
7. Imagem confocal, morfométrica e análise quantitativa de brotos endoteliais de EB
- Adquirir imagens de alta resolução das EBs imunomarcadas por fusão no plano focal (z-stacking) usando um microscópio confocal. Use a objetiva de ampliação de 10x para criar imagens de EBs inteiras.
- Analisar as imagens adquiridas no ImageJ para avaliar a morfologia e quantificar as características dos brotos endoteliais positivos para PECAM-1 de acordo com métodos de quantificação estabelecidos13,14,21.
- Calcular o número médio de brotos endoteliais por EBs contando manualmente o número total de brotos por EBs individuais.
- Meça os comprimentos individuais dos brotos usando a ferramenta de desenho ImageJ. Definir a base do broto endotelial a partir da área central da EB e traçar manualmente uma linha até o final da ponta do broto.
- Calcule o número médio de células da ponta por broto contando manualmente o número de células da ponta por broto individual e, em seguida, calcule a média por EB.
- Calcule a orientação dos filópodes determinando manualmente o eixo do broto pai e meça o ângulo agudo entre eles usando a ferramenta de ângulo do software ImageJ. Calcule o número de brotos com orientação >50° e divida pelo número total de brotos do EB de interesse.
OBS: Os ângulos sempre variaram de 0° a 90°.
- Adquirir imagens de alta resolução das EBs imunomarcadas usando um microscópio confocal. Use a objetiva de aumento de 40x para obter imagens de alta resolução de brotos endoteliais únicos.
- Quantifique a cobertura vascular de brotos CE positivos para PECAM-1 circundados por MCs positivos para α-SMA usando o software ImageJ.
- Divida as imagens mescladas em canais vermelhos e verdes separados.
- Converta as imagens em sua forma binária.
- Medir a área celular total do broto ocupada separadamente por células positivas para PECAM-1 (células endoteliais marcadas em vermelho) e por células positivas para α-SMA (células murais marcadas em verde).
- Gere a imagem mesclada usando a função de calculadora de imagem e o operador AND. Meça a área celular total da imagem. Para calcular a cobertura, divida a área da imagem colocalizada pela área da imagem binária PECAM-1.
- Para analisar a competição celular pela posição das células da ponta/pedúnculo endotelial de brotos desenvolvidos por EBs em mosaico, pontuar manualmente o número de células da ponta e marcar sua origem genotípica com base no sinal de fluorescência. Calcular os valores médios por EB.
Resultados
A visão geral do protocolo do ensaio de brotamento de vasos sanguíneos é mostrada na Figura 1. EBs de nove dias de idade derivadas de três linhagens independentes de 129/Ola mESC (Z/Red, R1 e E14) foram enzimaticamente dissociadas em células únicas usando colagenase A. As células foram coradas para PECAM-1 e analisadas por classificação celular ativada por fluorescência (FACS) conforme descrito. Todas as linhagens celulares exibiram diferenciação endotelial robusta, e não foram observadas diferenças na sua capacidade de diferenciação em células endoteliais. Todas as linhagens celulares produziram cerca de 10,5% ± 1,3% de células endoteliais (Figura 2A). Os níveis relativos de expressão de marcadores celulares PAN-endoteliais nas populações celulares PECAM-1 (+) também foram quantificados. Os níveis de expressão de RNAm de todos os marcadores analisados (Flk1, Flt1, Flt4, Eng, Tie2 e Cdh5) foram comparáveis entre as linhagens celulares e os experimentos, confirmando a robustez do protocolo de diferenciação (Figura 2B). As populações celulares PECAM-1 (+) expressaram apenas níveis muito baixos de RNAm de marcadores arteriais (Notch1 e Efnb2) ou venosos (Couptf2 e Ephb4), suportando o estado relativamente imaturo das células endoteliais geradas pelo protocolo (Figura 2C).
Demonstrou-se, então, a capacidade do modelo de EB vascular brotante em rastrear drogas moduladoras da angiogênese (Figura 3). DC101 e DAPT (N-[N-(3,5-difluorofenacetil)-Lalanil]-S-fenilglicina t-butiléster) foram testados. Esses compostos são amplamente utilizados em camundongos para, respectivamente, bloquear a angiogênese, inibindo a atividade do VEGFR2 ou para promover a diferenciação das células da ponta endotelial e a formação de um plexo vascular denso visando a sinalização Notch (Figura 3A). As vias de sinalização VEGF e Notch são reguladores-chave da angiogênese brotante in vivo. Avaliaram-se os efeitos de várias concentrações de DC101 e DAPT em EBs plaqueadas com colágeno I. Altas doses de DC101 variando de 6-30 mg· L-1 inibiu tanto o número quanto o comprimento dos brotos do vaso, enquanto o DAPT teve efeitos opostos na dose de 1 μmol· L-1 (Figura 3B-C). Imagens de alta magnificação dos brotos do vaso corados para PECAM-1 de EBs cultivados na presença de DAPT também são fornecidas (Figura 3D). DAPT mesmo em doses baixas variando de 0,5-1 μmol· L-1 aumentou fortemente o número de células da ponta endotelial com brotos de vasos com fenótipo de orientação incorreta (Figura 3D-F). Altas doses de DAPT também levaram à coalescência dos vasos e à formação de grandes e planas áreas de células endoteliais sem organização (Figura 3A). Os resultados confirmaram a capacidade do modelo de testar drogas que promovem ou inibem a angiogênese.
Para confirmar que esse modelo é adequado para mimetizar doenças vasculares, as imagens confocais de EBs derivadas de Acvrl1+/- mESCs são fornecidas. O gene Acvrl1 codifica para ALK1 (Activin Receptor-like Kinase 1), um receptor especificamente expresso em células endoteliais que, se mutado, é responsável pelo desenvolvimento de uma doença vascular rara com angiodisplasia denominada Telangiectasia Hemorrágica Hereditária (THH). Uma imagem de alta magnificação dos brotos endoteliais Acvrl1+/- revelou que eles tinham mais células da ponta endotelial e mais ramos por broto que estavam em ângulos aleatórios em relação aos vasos de origem. Estes confirmaram in vitro um fenótipo de desorientação, como observado em camundongos THH (Figura 4).
Ao formar EBs quiméricas que contêm mESC fluorescentemente marcadas e mESC diferenciadas de um genótipo particular, um protocolo alternativo para estudar o processo de seleção da ponta endotelial é incluído (Figura 5A-C). Uma imagem confocal de brotos de vasos marcados com PECAM-1 identificou a origem genotípica das principais células da ponta endotelial (Figura 5B). Misturas de uma linha mESC de YFP (proteína fluorescente amarela) do tipo selvagem na proporção de 1:1 com uma linha selvagem mESC não marcada levaram consistentemente à contribuição igual de cada população para as principais células da ponta endotelial (Figura 5C).
Este protocolo também é adequado para quantificar a cobertura celular mural do brotamento do vaso. As EBs submetidas à angiogênese foram fixadas e coradas para PECAM-1 (células endoteliais, vermelhas) e para α-Actina de Músculo Liso (α-SMA) (células murais, verde) (Figura 5D). Uma imagem de grande aumento revelou como um brotamento de vaso individual estava circundado por células murais (Figura 5E, esquerda). A transformação binária foi realizada após a separação dos canais de cores (Figura F-G) para quantificar a proporção de PECAM-1 (+) recoberto por células murais de α-SMA (+) utilizando o software ImageJ (Figura 5H).

Figura 1: Linha do tempo dos procedimentos do protocolo. Clique aqui para ver uma versão maior desta figura.
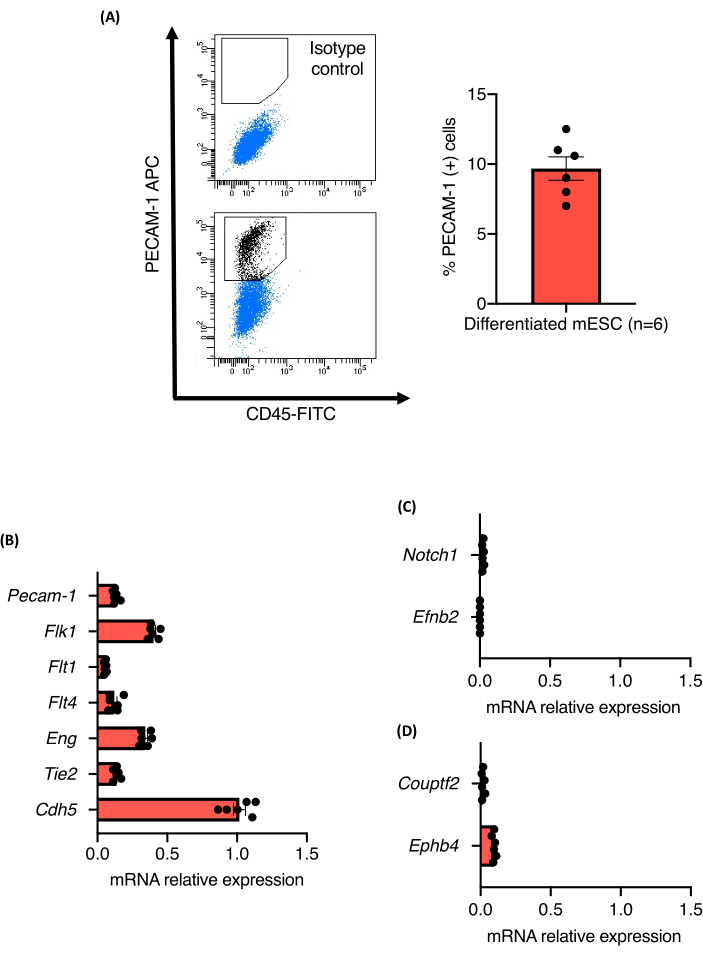
Figura 2: Caracterização das CE derivadas da diferenciação vascular da mESC dentro das EBs. (A) Análise por citometria de fluxo da expressão de CD31 de EBs com 9 dias de idade e quantificação da porcentagem de células Pecam-1 (+). (B-D) níveis de expressão de mRNA de Pecam-1, Flk1, Flt1, Flt4, Eng, Tie2, Cdh5, Notch1, EfnB2, Couptf2 e EphB4 em células endoteliais selecionadas de EBs de 9 dias de idade. As barras de erro representam a média ± o erro padrão da média (EPM). Clique aqui para ver uma versão maior desta figura.
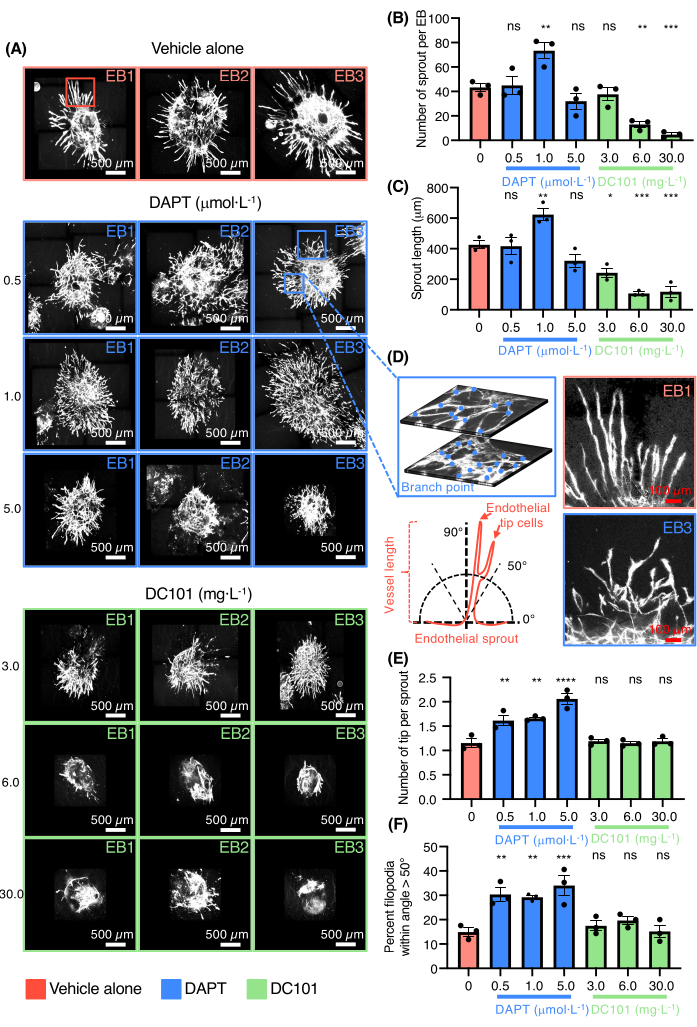
Figura 3: Ensaio de angiogênese com brotamento 3D para teste de drogas. (A) Imagens confocais de três EBs representativas coradas por Pecam-1 (células endoteliais brancas) tratadas apenas com veículo, DAPT (0,5 μmol· L-1, 1,0 μmol· L-1, 5,0 μmol· L-1) ou DC101 (3 mg· L-1, 6 mg· L-1, 30 mg· L-1). (B) Quantificação do número de brotos por EB. (C) Quantificação do comprimento do broto. (D) No painel superior esquerdo, alta magnificação do broto endotelial mostrando a complexidade da rede e o ponto de ramificação contando com duas camadas diferentes do mesmo BE, no painel inferior esquerdo uma ilustração esquemática representando o método de medida da orientação do broto endotelial. No painel superior direito, alta magnificação dos brotos endoteliais do veículo isoladamente e no painel inferior direito, alta magnificação dos brotos endoteliais do DAPT (0,5 μmol· L-1). (E) Quantificação do número de células da ponta por broto. (F) Quantificação da porcentagem de filópodes dentro do ângulo >50°. Todas as barras representam a média ± EPM e os valores de p do teste ANOVA unidirecional não pareado. ns = não significante, *p < 0,05, **p < 0,01, ***p < 0,001 e ****p < 0,0001. Clique aqui para ver uma versão maior desta figura.

Figura 4: Brotamento de vasos defeituosos nas EBs de Telangiectasias Hemorrágicas Hereditárias. No painel superior, imagens confocais de EBs representativas de 12 dias de idade dos genótipos Acvrl1+/+ e Acvrl1+/- corados para Pecam-1 (células endoteliais brancas). No painel inferior, alta ampliação dos brotos endoteliais Acvrl1+/- (caixa branca do painel superior) mostrando numerosas células da ponta (setas vermelhas), pontos de ramo endotelial (pontos azuis) e fenótipo de desorientação brotada (setas verdes). Clique aqui para ver uma versão maior desta figura.

Figura 5: Estudo da posição da célula da ponta/pedúnculo e maturação do vaso utilizando o ensaio de brotamento 3D. (A) Imagem confocal de uma EB quimérica representativa de 12 dias de idade feita de linhagem celular selvagem R1 misturada 1:1 com linhagem celular selvagem 7ACS/EYFP corada para Pecam-1 (células endoteliais vermelhas). As setas vermelhas indicam as células da ponta da linha celular R1 e as setas verdes indicam as células da ponta da linha celular 7ACS/EYFP. (B) Alta magnificação de um broto endotelial mostrando a distribuição da célula endotelial R1 e 7ACS/EYFP ao longo do broto. (C) Quantificação das células da ponta de genotipagem relativa de EBs selvagens representativas. (D) Imagem confocal de EB representativa de 12 dias de idade corada por Pecam-1 (células endoteliais vermelhas) e α-SMA (células verdes murais). (E) Aumento alto de um broto endotelial (caixa pontilhada retangular branca de D) mostrando interação célula mural/endotelial. (F-G) Imagens do broto endotelial colorido e suas imagens binárias transformadas associadas. (H) Imagem binária de coloração co-localizada de Pecam-1 e α-SMA. Proporção de brotos de células endoteliais recobertos por células murais. Todas as barras representam ± MEV média. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um ensaio vascular de brotamento baseado em EB 3D imparcial, robusto e reprodutível, passível de triagem para drogas e genes moduladores da angiogênese. Este método oferece vantagens sobre muitos ensaios bidimensionais (2D) amplamente utilizados usando culturas de células endoteliais, como as células endoteliais da veia umbilical humana (HUVECs) para monitorar a migração (ensaio de scratch lateral ou o ensaio da câmara de Boyden)22,23 ou proliferação (contagem do número de células, detecção de síntese de DNA, detecção de marcadores de proliferação ou ensaios metabólicos)24 na medida em que permite de forma única o estudo da diferenciação de células endoteliais e murais e sua organização em uma rede vascular mimetizando etapas-chave da angiogênese brotante. Essas etapas incluem a seleção das células da ponta endotelial, a proliferação das células do pedúnculo, a orientação espacial e a migração do brotamento do vaso e o recrutamento de células murais para o vaso sanguíneonascente25. Ele também oferece vantagens para muitos modelos de angiogênese 3D. O grânulo de fibrina 26,27 ou o ensaio com gel de colágeno28,29,30 mimetizando a tubulogênese comumente utilizam HUVECs ou Endothelial Colony Forming Cells derived Endothelial Cells (ECFC-EC) por apresentarem alta taxa proliferativa, mas não serem adequados para células endoteliais primárias de camundongos que são de difícil manutenção em cultura. O explante ex vivo de retina31 ou o ensaio de micro-órgãos vascularizado32 podem recapitular bem todas as etapas de formação de vasos sanguíneos, mas possuem procedimentos experimentais complexos e não são adequados para triagem genética ou de drogas de alto rendimento. Isso também é verdadeiro para o ensaio ex vivo do anel aórtico33,34 e para muitos ensaios in vivo, como tumores implantados em camundongos ou estudos de perda de função em camundongos, que muitas vezes apresentam alto custo e dificuldades na obtenção de grande quantidade dedados35. Este protocolo também complementa bem ensaios similares de angiogênese in vitro usando iPSCs humanas, permitindo comparações entre dados de camundongos e humanos. Embora seja importante notar que as células endoteliais humanas derivadas da iPSC apresentam menor capacidade de brotar do que as células de camundongo36,37.
O método aqui desenvolvido também apresenta algumas limitações. Ele não pode avaliar os efeitos do fluxo de fluido sobre a maturação dos vasos sanguíneos, a permeabilidade dos vasos e não produz vasos sanguíneos nascentes em um ambiente tecidual específico em comparação com dispositivos microfabricados recentes que estão em desenvolvimento. De fato, tecnologias organ-on-chip que combinam microfluídica com engenharia tecidual podem fornecer às células endoteliais cultivadas um microambiente semelhante ao in vivo38,39. Os sistemas microfluídicos contêm a composição correta da matriz extracelular e são projetados para produzir sinais mecânicos, como tensão de cisalhamento. Alguns são projetados para incorporar células murais e outras células de suporte de um determinado tecido ou podem gerar gradientes químicos. Eles contêm redes de canais preenchidos por fluidos em escala de mícrons que são semelhantes em tamanho e estrutura aos capilares sanguíneos. As tecnologias organ-on-chip também permitem a quantificação de funções vasculares específicas, incluindo a permeabilidade e a resistência elétrica transendotelial. Embora as tecnologias organ-on-chip sejam promissoras, elas estão muito além da experiência em pesquisa da maioria dos laboratórios de biologia, ainda precisam de padronização adequada e exigem técnicas de fabricação especializadas. A comercialização da fabricação da tecnologia organ-on-chip está apenas começando, e esses sistemas são considerados proibitivos de custo e tempo para as empresas farmacêuticas atualmente40,41.
Existem várias etapas críticas que devem ser levadas em conta. Use células de alta qualidade que expressem de forma robusta marcadores bem aceitos (Nanog, Oct4, Sox2 e SSEA-1) do estado pluripotente. É essencial monitorar cuidadosamente seu crescimento, a forma das células mES e o tamanho e a morfologia das colônias mES. Como a estabilidade cariotípica é estocástica em células cultivadas, reavaliá-la após extensa passagem é essencial. Recomenda-se usar produtos já testados para cultura de mESC e testar alimentadores de MEF, soro fetal de bezerro e todos os compostos químicos por várias passagens para detectar se as mESCs mantêm suas propriedades celulares ou se diferenciam ou adquirem um fenótipo epiblástico. O meio deve ser atualizado diariamente e as colônias mESC não devem ser permitidas para se tornarem muito grandes e densas. Finalmente, as mESCs precisam ser cultivadas pelo menos por duas passagens sem 2i antes da diferenciação para garantir o melhor rendimento das células endoteliais.
A diferenciação endotelial inclui duas etapas importantes: a formação das EBs pelo método da gota suspensa e sua cultura em condições de flutuação na presença de meio de diferenciação vascular13,14. O movimento das placas de gota suspensas deve ser minimizado para alcançar uma agregação celular uniforme. O número de mESCs usadas para formar um agregado, na maioria dos casos, varia entre 800-1.000 células, mas pode precisar ser otimizado se as mESCs tiverem um fundo genético diferente de 129/ola para garantir uma diferenciação ideal em EBs vascularizadas. Quando cultivados em condições flutuantes, os EBs precisam ser cuidadosamente distribuídos e evitar movimentos que favoreçam a aglomeração do EB.
As EBs são finalmente cultivadas em gel de colágeno I para formar brotos de vasos. O meio angiogênico deve ser preparado na hora e, uma vez misturado ao colágeno, deve ser mantido no gelo para evitar gelificação espontânea. No caso de testes de drogas, os medicamentos são adicionados na mistura fria na concentração certa durante esta etapa. Ajustar o pH com NaOH antes de ressuspender os EBs é crucial, caso contrário, a acidez do colágeno causará toxicidade celular. Finalmente, os EBs devem ser distribuídos a uma distância equidistante uns dos outros para garantir resultados reprodutíveis.
Em conclusão, este método introduz um ensaio de brotamento vascular 3D baseado em mESC que tem a robustez e escalabilidade necessárias para ser usado para o rastreamento genético, como recentemente descrito por Elling U. et al. que gerou um grande haplobanco de mutantes hemi/homozigotos mESC16 e para o programa de descoberta fenotípica de drogas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por subsídios da Nederlandse organisatie voor gezondheidsonderzoek en zorginnovatie (ZonMW 446002501), Health Holland (LSHM19057-H040), Leading Fellows Programme Marie Skłodowska-Curie COFUND, e pela Association Maladie de Rendu-Osler (AMRO).
Materiais
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Milipore, Merck | 805740 | Biohazard: adequate safety instructions should be taken when handling |
| Agar Noble | Difco, BD Pharmigen | 214220 | |
| Alexa Fluo 555 goat anti rat IgG | Life technologies | A21434 | |
| APC conjugated rat anti-mouse PECAM-1 antibody (clone MEC13.3) | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control (Clone R35-95) | BD Biosciences | 553932 | |
| Axiovert 25 inverted phase contrast tissue culture microscope | ZEISS | ||
| Basic Fibroblast Growth Factor-2 (bFGF) | Peprotech | 450-33 | |
| Benchtop Centrifuge, Allegra X-15R | Beckman Coulter | 392932 | |
| Biosafety cabinet BioVanguard (Green Line) | Telstar | 133H401001 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| Cell counting chamber, Buerker, 0.100mm | Marienfeld | 640211 | |
| Cell culture dishes 60 x 15mm | Corning | 353802 | |
| Cell culture dishes, 35 x 10 mm | Corning | 353801 | |
| Cell culture plates 12-well | Corning | 3512 | |
| CFX96 Touch Real-Time PCR Detection System | Biorad | 1855196 | |
| Chicken serum | Sigma-Aldrich | C5405 | |
| CHIR-99021 (CT99021) HCl | Selleckchem | S2924 | |
| Collagen I, High Concentration, Rat Tail, 100mg | Corning | 354249 | |
| Collagenase A | Roche | 10103586001 | |
| Confocal Laser Scanning Microscope, TCS SP5 | Leica | ||
| Cover glasses, 24 × 50 mm | Vwr | 631-0146 | |
| DAPT γ?secretase inhibitor | Sigma Aldrich | D5942 | |
| DC101 anti mouse VEGFR-2 Clone | BioXcell | BP0060 | |
| DC101 isotype rat IgG1 | BioXcell | BP0290 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2438-5X | Biohazard: adequate safety instructions should be taken when handling |
| DPBS (10x), no calcium, no magnesium | Gibco, Thermofisher scientific | 14200067 | |
| EDTA 40 mM | Gibco, Thermofisher scientific | 15575-038 | |
| Embryonic stem-cell Fetal Bovine Serum | Gibco, Thermofisher scientific | 16141-079 | Should be lot-tested for maximum ES cell viability and growth. Heat inactivate at 60°C and store at −20 °C for up to 1 year |
| Eppendorf Microcentrifuge 5415R | Eppendorf AG | Z605212 | |
| Erythropoietin, human (hEPO), 250 U (2.5 µg) (1 mL) | Roche | 11120166001 | |
| ESGRO Recombinant Mouse LIF Protein (10? units 1 mL) | Milipore, Merck | ESG1107 | |
| Falcon tubes 15 mL | Greiner Bio-One | 188271 | |
| Falcon tubes 50 mL | Greiner Bio-0ne | 227270 | |
| Filter tip ,clear ,sterile F.Gilson, P-200 | Greiner Bio-One | 739288 | |
| Filter tip ,clear ,sterile F.Gilson, P10 | Greiner Bio-One | 771288 | |
| Filter tip ,clear ,sterile F.Gilson, P1000 | Greiner Bio-One | 740288 | |
| FITC conjugated anti-α Smooth Muscle Actin (SMA) (clone 1A4) | Sigma Aldrich | F3777 | |
| FITC conjugated rat anti-mouse CD45 (clone 30-F11) | Biolegend | 103107 | |
| FITC Rat IgG2b, κ Isotype Ctrl Antibody (clone RTK4530) | Biolegend | 400605 | |
| Fluorscent mounting media | DAKO | S3023 | |
| Gascompress | Cutisoft | 45846 | |
| Gauze Cutisoft 10 x 10 cm | Bsn Medical | 45844_00 | |
| Gel blotting paper, Grade GB003 | Whatman | WHA10547922 | |
| Gelatin solution, type B | Sigma-Aldrich | G1393-100 ml | |
| Glasgow's MEM (GMEM) | Gibco, Thermofisher scientific | 21710082 | |
| IHC Zinc Fixative | BD Pharmigen | 550523 | |
| IncuSafe CO2 Incubator | PHCBi | MCO-170AICUV-PE | |
| Interleukin-6, human (hIL-6) | Roche | 11138600001 | |
| L-Glutamine 200 mM | Gibco, Thermofisher scientific | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco, Thermofisher scientific | 11140035 | |
| Microscope slide box | Kartell Labware | 278 | |
| Microscope slide, Starfrost | Knittel glass | VS113711FKB.0 | |
| Mm_Cdh5_1_SG QuantiTect Primer Assay | Qiagen | QT00110467 | |
| Mm_Eng_1_SG QuantiTect Primer Assay | Qiagen | QT00148981 | |
| Mm_Epha4_1_SG QuantiTect Primer Assay | Qiagen | QT00093576 | |
| Mm_Ephb2_1_SG QuantiTect Primer Assay | Qiagen | QT00154014 | |
| Mm_Flt1_1_SG QuantiTect Primer Assay | Qiagen | QT00096292 | |
| Mm_Flt4_1_SG QuantiTect Primer Assay | Qiagen | QT00099064 | |
| Mm_Gapdh_3_SG QuantiTect Primer Assay | Qiagen | QT01658692 | |
| Mm_Kdr_1_SG QuantiTect Primer Assay | Qiagen | QT00097020 | |
| Mm_Notch1_1_SG QuantiTect Primer | Qiagen | QT00156982 | |
| Mm_Nr2f2_1_SG QuantiTect Primer Assay | Qiagen | QT00153104 | |
| Mm_Pecam1_1_SG QuantiTect Primer | Qiagen | QT01052044 | |
| Mm_Tek_1_SG QuantiTect Primer Assay | Qiagen | QT00114576 | |
| Mouse (ICR) Inactivated Embryonic Fibroblasts (2 M) | Gibco, Thermofisher scientific | A24903 | Store vials in liquid nitrogen (195.79 °C) indefinitely |
| Mouse embryonic stem cell line 7AC5/EYFP (ATCC SCRC-1033) | ATCC | SCRC-1033 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Hadjantonakis, A. K., et al. Mechanisms of Development. 76 (1–2), 79–90 (1998)]. |
| Mouse embryonic stem cell lines Acvrl1 +/- and Acvrl1 +/+ | Generated at Leiden University Medical Centre [Thalgott, J.H. et al. Circulation. 138 (23), 2698–2712 (2018)]. | ||
| Mouse embryonic stem cells line E14 | Provided by M Letarte laboratory and generated according to Cho, S. K., et al. Blood. 98 (13), 3635–3642 (2001). | ||
| Mouse embryonic stem cells line R1 (ATCC SCRC-1011) | ATCC | SCRC-1011 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Nagy, A., et al. Procedings of the National Academy of Sciences of the United States of America. 90 (18), 8424–8428 (1993)]. |
| Mouse embryonic stem cells line Z/Red (strain 129/Ola) | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada [Vintersten, K., et al. Genesis. 40 (4), 241–246 (2004)]. | ||
| NanoDrop 1000 UV/VIS Spectrophotometer | Thermo Fischer Scientific | ND-1000 | |
| PD0325901 | Selleckchem | S1036 | |
| PDGF-BB, Recombinant Human | Peprotech | 100-14B | |
| Pecam-1 antibody, Rat Anti-Mouse | BD Biosciences | 550274 | |
| Penicillin-streptomycin (10,000 U/mL) | Gibco, Thermofisher scientific | 15140122 | |
| Petri dish, PS, 94/16 mm, standard ,with vents, sterile | Greiner Bio-One | 633181 | |
| Pipetboy acu 2 | Integra-Biosciences | 155 019 | |
| Pipetman G Multichannel P8 x 200G | Gilson | F144072 | |
| Pipetman G Starter Kit, 4 Pipette Kit, P2G, P20G, P200G, P1000G | Gilson | F167360 | |
| Recombinant Human BMP-4 Protein | R&D Systems | 314-BP | |
| RNeasy Plus mini Kit | QIAGEN | 74134 | |
| Serological pipettes, 10 mL | Greiner Bio-One | 607 180 | |
| Serological pipettes, 25 mL | Greiner Bio-One | 760 180 | |
| Serological pipettes, 5 mL | Greiner Bio-One | 606 180 | |
| Sodium hydroxide (NaOH) | Merck | 106498 | |
| Sodium pyruvate 100 mM | Gibco, Thermofisher scientific | 11360039 | |
| Test tubes 5ml round-bottom with cell-strainer cap | Corning | 352235 | |
| Thermal cycler, T100 | Biorad | 1861096 | |
| Triton X-100 (BioXtra) | Sigma Aldrich | T9284 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher scientific | 15250061 | |
| Trypsin (2.5%) | Gibco, Thermofisher scientific | 15090046 | |
| Vacuum Filter/Storage Bottle System, 500 mL | Corning | 430758 | |
| VEGFA165 , recombinant murine | Peprotech | 450-32 | |
| Water, Sterile | Fresenius-Kabi | B230531 | |
| Waterbath, Lab-Line Digital | Thermo Fischer Scientific | 18052A |
Referências
- Moffat, J. G., Vincent, F., Lee, J. A., Eder, J., Prunotto, M. Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nature Reviews Drug Discovery. 16 (8), 531-543 (2017).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews. Drug Discovery. 15 (11), 751-769 (2016).
- Low, L. A., Mummery, C., Berridge, B. R., Austin, C. P., Tagle, D. A. Organs-on-chips: into the next decade. Nature Reviews. Drug Discovery. , (2020).
- Ma, C., Peng, Y., Li, H., Chen, W. Organ-on-a-Chip: A new paradigm for drug development. Trends in Pharmacological Sciences. 42 (2), 119-133 (2021).
- Swinney, D. C., Anthony, J. How were new medicines discovered. Nature Reviews Drug Discovery. 10 (7), 507-519 (2011).
- Hussain, S., et al. High-content image generation for drug discovery using generative adversarial networks. Neural Networks: The Official Journal of the INternational Neural Network Society. 132, 353-363 (2020).
- Scheeder, C., Heigwer, F., Boutros, M. Machine learning and image-based profiling in drug discovery. Current Opinion in Systems Biology. 10, 43-52 (2018).
- Wagner, B. K., Schreiber, S. L. The power of sophisticated phenotypic screening and modern mechanism-of-action methods. Cell Chemical Biology. 23 (1), 3-9 (2016).
- Scannell, J. W., Bosley, J. When quality beats quantity: Decision theory, drug discovery, and the reproducibility crisis. PLoS One. 11 (2), 0147215 (2016).
- Webster, J. D., Santagostino, S. F., Foreman, O. Applications and considerations for the use of genetically engineered mouse models in drug development. Cell and Tissue Research. 380 (2), 325-340 (2020).
- Howland, D. S., Munoz-Sanjuan, I. Mind the gap: models in multiple species needed for therapeutic development in Huntington's disease. Movement Disorders: Official Journal of the Movement Disorder Scoiety. 29 (11), 1397-1403 (2014).
- Galaris, G., Thalgott, J. H., Lebrin, F. P. G. Pericytes in hereditary hemorrhagic telangiectasia. Advances in Experimental Medicine and Biology. 1147, 215-246 (2019).
- Thalgott, J. H., et al. Decreased expression of vascular endothelial growth factor receptor 1 contributes to the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Circulation. 138 (23), 2698-2712 (2018).
- Lebrin, F., et al. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia. Nature Medicine. 16 (4), 420-428 (2010).
- Czechanski, A., et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nature Protocols. 9 (3), 559-574 (2014).
- Elling, U., et al. A reversible haploid mouse embryonic stem cell biobank resource for functional genomics. Nature. 550 (7674), 114-118 (2017).
- Cheng, J., et al. Targeting pericytes for therapeutic approaches to neurological disorders. Acta Neuropathologica. 136 (4), 507-523 (2018).
- Chade, A. R. Small vessels, big role: Renal microcirculation and progression of renal injury. Hypertension. 69 (4), 551-563 (2017).
- Jourde-Chiche, N., et al. Endothelium structure and function in kidney health and disease. Nature Reviews. Nephrology. 15 (2), 87-108 (2019).
- van Duinen, V., et al. Standardized and scalable assay to study perfused 3D angiogenic sprouting of iPSC-derived endothelial cells in vitro. Journal of Visualized Experiment: JoVE. (153), e59678 (2019).
- Chappell, J. C., Taylor, S. M., Ferrara, N., Bautch, V. L. Local guidance of emerging vessel sprouts requires soluble Flt-1. Developmental Cell. 17 (3), 377-386 (2009).
- Sato, Y., Rifkin, D. B. Inhibition of endothelial cell movement by pericytes and smooth muscle cells: activation of a latent transforming growth factor-beta 1-like molecule by plasmin during co-culture. Journal of Cell Biology. 109 (1), 309-315 (1989).
- Tchaikovski, V., Olieslagers, S., Bohmer, F. D., Waltenberger, J. Diabetes mellitus activates signal transduction pathways resulting in vascular endothelial growth factor resistance of human monocytes. Circulation. 120 (2), 150-159 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. International Journal of Experimental Pathology. 90 (3), 195-221 (2009).
- Herbert, S. P., Stainier, D. Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis. Nature Reviews Molecular Cell Biology. 12 (9), 551-564 (2011).
- Nakatsu, M. N., Hughes, C. C. An optimized three-dimensional in vitro model for the analysis of angiogenesis. Methods in Enzymology. 443, 65-82 (2008).
- Nakatsu, M. N., Davis, J., Hughes, C. C. Optimized fibrin gel bead assay for the study of angiogenesis. Journal of Visualized Experiments: JoVE. (186), (2007).
- Gau, D., et al. Pharmacological intervention of MKL/SRF signaling by CCG-1423 impedes endothelial cell migration and angiogenesis. Angiogenesis. 20 (4), 663-672 (2017).
- Torres-Estay, V., et al. Androgens modulate male-derived endothelial cell homeostasis using androgen receptor-dependent and receptor-independent mechanisms. Angiogenesis. 20 (1), 25-38 (2017).
- Merjaneh, M., et al. Pro-angiogenic capacities of microvesicles produced by skin wound myofibroblasts. Angiogenesis. 20 (3), 385-398 (2017).
- Rezzola, S., et al. In vitro and ex vivo retina angiogenesis assays. Angiogenesis. 17 (3), 429-442 (2014).
- Wang, X., Phan, D. T. T., George, S. C., Hughes, C. C. W., Lee, A. P. 3D Anastomosed microvascular network model with living capillary networks and endothelial cell-lined microfluidic channels. Methods in Molecular Biology. 1612, 325-344 (2017).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Laboratory Investigation; A Journal of Technical Methods and Pathology. 63 (1), 115-122 (1990).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. Journal of Cellular and Molecular Medicine. 13 (10), 4113-4136 (2009).
- Nowak-Sliwinska, P., et al. Consensus guidelines for the use and interpretation of angiogenesis assays. Angiogenesis. 21 (3), 425 (2018).
- Belair, D. G., Schwartz, M. P., Knudsen, T., Murphy, W. L. Human iPSC-derived endothelial cell sprouting assay in synthetic hydrogel arrays. Acta Biomaterialia. 39, 12-24 (2016).
- Bezenah, J. R., Kong, Y. P., Putnam, A. J. Evaluating the potential of endothelial cells derived from human induced pluripotent stem cells to form microvascular networks in 3D cultures. Scientific Reports. 8 (1), 2671 (2018).
- Henderson, A. R., Choi, H., Lee, E. Blood and lymphatic vasculatures on-chip platforms and their applications for organ-specific in vitro modeling. Micromachines (Basel). 11 (2), 147 (2020).
- Lin, D. S. Y., Guo, F., Zhang, B. Modeling organ-specific vasculature with organ-on-a-chip devices. Nanotechnology. 30 (2), 024002 (2019).
- Pollet, A., den Toonder, J. M. J. Recapitulating the vasculature using organ-on-chip technology. Bioengineering. 7 (1), 17 (2020).
- Cochrane, A., et al. Advanced in vitro models of vascular biology: Human induced pluripotent stem cells and organ-on-chip technology. Advanced Drug Delivery Reviews. 140, 68-77 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados