Method Article
במבחנה בדיקת הנבטה תלת מימדית של אנגיוגנזה באמצעות תאי גזע עובריים של עכבר לצורך מידול מחלות כלי דם ובדיקות סמים
In This Article
Summary
בדיקה זו משתמשת בתאי גזע עובריים של עכברים המתמיינים לגופי עובר בתרבית בג'ל קולגן תלת-ממדי כדי לנתח את התהליכים הביולוגיים השולטים באנגיוגנזה נובטת במבחנה. הטכניקה יכולה להיות מיושמת לבדיקת תרופות, מידול מחלות, ולחקר גנים ספציפיים בהקשר של מחיקות קטלניות עוברית.
Abstract
ההתקדמות האחרונה בתאי גזע פלוריפוטנטיים מושרים (iPSC) ובטכנולוגיות עריכת גנים מאפשרת פיתוח מודלים חדשניים של מחלות מבוססות תאים אנושיים עבור תוכניות גילוי תרופות פנוטיפיות (PDD). למרות שמכשירים חדשניים אלה יכולים לחזות את הבטיחות והיעילות של תרופות ניסיוניות בבני אדם בצורה מדויקת יותר, הפיתוח שלהם למרפאה עדיין מסתמך במידה רבה על נתוני יונקים, בעיקר השימוש במודלים של מחלות עכברים. במקביל למודלים אנושיים של אורגנואידים או מחלות איבר על שבב, פיתוח מודלים רלוונטיים של עכברי מבחנה הוא לפיכך צורך בלתי מסופק להערכת יעילות תרופות ישירות והשוואות בטיחות בין מינים ובתנאי in vivo ו - in vitro . כאן מתוארת בדיקת הנבטת כלי דם המשתמשת בתאי גזע עובריים של עכברים המתמיינים לגוף עוברי (EBs). EBs וסקולריים בתרבית על ג'ל קולגן תלת-ממדי מפתחים כלי דם חדשים שמתרחבים, תהליך שנקרא אנגיוגנזה נובטת. מודל זה משחזר תכונות עיקריות של אנגיוגנזה הנבטת in vivo - היווצרות כלי דם מרשת כלי דם קיימת - כולל בחירת תאי קצה אנדותל, נדידה ושגשוג תאי אנדותל, הנחיית תאים, היווצרות צינור וגיוס תאי קיר. הוא מקובל לבדיקות סקר לתרופות וגנים המווסתים אנגיוגנזה ומראה קווי דמיון עם בדיקות כלי דם תלת מימדיות (3D) שתוארו לאחרונה המבוססות על טכנולוגיות iPSC אנושיות.
Introduction
בשלושת העשורים האחרונים, גילוי תרופות מבוססות מטרה (TDD) נעשה שימוש נרחב בגילוי תרופות על ידי תעשיית התרופות. TDD משלב מטרה מולקולרית מוגדרת הממלאת תפקיד חשוב במחלה ומסתמך על פיתוח מערכות תרבית תאים פשוטות יחסית וקריאות לבדיקת תרופות1. רוב מודלי המחלה האופייניים המשמשים בתוכניות TDD כוללים שיטות מסורתיות של תרביות תאים כגון תאים סרטניים או קווי תאים אימורטליים הגדלים בסביבות מלאכותיות ומצעים לא פיזיולוגיים. למרות שרבים מהמודלים הללו סיפקו כלים מעשיים לזיהוי מועמדים מוצלחים לתרופות, השימוש במערכות כאלה יכול להיות מוטל בספק בשל הרלוונטיות הנמוכה שלהןלמחלה 2.
עבור רוב המחלות, המנגנונים הבסיסיים הם אכן מורכבים וסוגי תאים שונים, מסלולי איתות עצמאיים וקבוצות מרובות של גנים נמצאים לעתים קרובות כתורמים לפנוטיפ מחלה ספציפי. זה נכון גם לגבי מחלות תורשתיות שבהן הגורם העיקרי הוא מוטציה בגן אחד. עם הופעתן לאחרונה של טכנולוגיות תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSC) וכלי עריכת גנים, כעת ניתן ליצור אורגנואידים תלת-ממדיים ומודלים של מחלות איברים-על-שבב שיכולים לשחזר טוב יותר את המורכבות האנושית in vivo 3,4. הפיתוח של טכנולוגיות כאלה קשור להתעוררות מחודשת בעניין בתוכניות גילוי תרופות פנוטיפיות (PDD)1. ניתן להשוות PDD לבדיקות אמפיריות, מכיוון שהן אינן מסתמכות על ידע על זהותו של יעד תרופה ספציפי או על השערה לגבי תפקידה במחלה. גישת PDD מוכרת כיום יותר ויותר כתורמת רבות לגילוי תרופות ראשונות מסוגן5. מכיוון שהפיתוח של טכנולוגיות אורגנואידים ואיברים-על-שבב אנושיים עדיין בחיתוליו, צפוי כי מודלים iPSC (בשילוב עם כלי הדמיה ולמידת מכונהחדשניים 6,7) יספקו, בעתיד הקרוב, מספר מודלים חדשניים חדשניים מבוססי תאים מורכבים לבדיקת תרופות ותוכניות PDD נלוות כדי להתגבר על הפרודוקטיביות הירודה של גישת TDD8, 9.
בעוד שמודלים אנושיים של אורגנואידים ואיברים-על-שבב יכולים לספק תובנות חשובות על מורכבות המחלה ועל זיהוי תרופות חדשות, הכנסת תרופות לפרקטיקה קלינית חדשה מסתמכת במידה רבה גם על נתונים ממודלים של בעלי חיים כדי להעריך את יעילותן ובטיחותן. ביניהם, עכברים מהונדסים גנטית הם ללא ספק המודלים המועדפים ביותר על יונקים. יש להם יתרונות רבים מכיוון שיש להם זמן דור קצר יחסית ליונקים, יש להם פנוטיפים דומים רבים למחלות אנושיות, וניתן לבצע בהם מניפולציות גנטיות בקלות. לכן הם נמצאים בשימוש נרחב בתוכניות גילוי סמים10. עם זאת, גישור על הפער בין עכברים לבני אדם נותר אתגר חשוב11. הפיתוח של מודלים של עכברי מבחנה המקבילים למודלים של אורגנואידים אנושיים ואיבר על שבב יכול למלא את הפער הזה לפחות חלקית, שכן הוא יאפשר השוואות ישירות של יעילות ובטיחות של תרופות בין עכבר in vivo לבין נתונים אנושיים במבחנה.
כאן מתוארת בדיקת הנבטת כלי דם בגופי עובר עכבר (EBs). כלי הדם מורכבים מתאי אנדותל (רירית פנימית של דפנות כלי הדם), תאי קיר (תאי שריר חלק של כלי דם ופריציטים)12. פרוטוקול זה מבוסס על התמיינות של תאי גזע עובריים של עכברים (mESCs) לתאי EB וסקולריים באמצעות טיפות תלויות המשחזרות התמיינות תאי אנדותל ותאי קיר13,14. ניתן לקבוע בקלות תאי גזע עובריים בעכבר בתרבית מבלסטוציסטים של עכבר מיום 3.5 מבודדים בעלי רקע גנטי שונה15. הם גם מספקים אפשרויות לניתוח שבטים, מעקב אחר שושלת, וניתן בקלות לבצע בהם מניפולציה גנטית כדי ליצור מודלים של מחלות13,16.
מכיוון שכלי הדם מזינים את כל האיברים, אין זה מפתיע שמחלות רבות, אם לא כולן, קשורות לשינויים בכלי הדם. בתנאים פתולוגיים, תאי אנדותל יכולים לאמץ מצב פעיל או יכולים להפוך לבלתי מתפקדים וכתוצאה מכך מוות של תאי קיר או נדידה הרחק מכלי הדם. אלה יכולים לגרום לאנגיוגנזה מוגזמת או לרפרקציה של כלי דם, יכולים לגרום לזרימת דם לא תקינה ומחסום כלי דם פגום המוביל לאקסטרווציה של תאי מערכת החיסון, ודלקת12,17,18,19. המחקר לפיתוח תרופות המווסתות את כלי הדם הוא אפוא גבוה, וכבר זוהו שחקנים ומושגים מולקולריים רבים למיקוד טיפולי. בהקשר זה, הפרוטוקול המתואר מתאים במיוחד לבניית מודלים של מחלות ולבדיקות תרופתיות, שכן הוא משחזר מאפיינים מרכזיים של אנגיוגנזה של הנבטת in vivo, כולל בחירת תאי קצה אנדותל וגבעול, נדידה ושגשוג של תאי אנדותל, הנחיית תאי אנדותל, היווצרות צינוריות וגיוס תאי קיר. הוא גם מראה קווי דמיון עם בדיקות כלי דם תלת-ממדיות שתוארו לאחרונה המבוססות על טכנולוגיות iPSC אנושיות20.
Protocol
1. הכנת מדיה ותרבות של mESC
- הכינו מדיום מותנה +/- (CM+/-) באמצעות התוסף 1x Glasgow MEM (G-MEM BHK-21) בינוני עם 10% (vol/vol) סרום בקר עוברי (FBS) מומת חום, 0.05 mM β-מרקפטואתנול, 1x חומצות אמינו לא חיוניות (NEAA 1x), 2 mM L-גלוטמין, 1 mM נתרן פירובט.
- הכינו מדיום מותנה +/+ (CM+/+) באמצעות התוסף CM+/- בינוני עם גורם מעכב לוקמיה (LIF) (1,500 U/mL) ו-0.1 mM β-מרקפטואתנול.
- הכינו מדיום מותנה +/+ בנוכחות שני מעכבים (CM+/+ 2i) באמצעות התוסף CM+/+ medium עם 1 μM PD0325901 ו-3 μM CHIR99021.
- הכינו תמיסת ג'לטין 0.1% על ידי ערבוב 25 מ"ל של תמיסת ג'לטין 2% שחוממה מראש ב-500 מ"ל של מלח חוצץ פוספט ללא סידן ומגנזיום (DPBS).
- הכינו חיץ 10x טריפסין וורנה פוספט (TVP 10x) על ידי ערבוב טריפסין (2.5%) עם TVP 1x (9.5% 10x DPBS, 1 mM EDTA, 0.01% סרום עוף, 0.01% טריפסין (2.5%) ב-H2O) (יחס 1:10, vol/vol).
הערה: סנן את כל התמיסות דרך מסנן נקבוביות בגודל 0.22 מיקרומטר. אחסנו את מדיום התרבית בטמפרטורה של -20°C לטווח ארוך ושמרו ריאגנטים אחרים בטמפרטורה של 4°C למשך עד 3 שבועות (ראו טבלת חומרים). - מצפים שתי צלחות תרבית תאים בנות 12 בארות בתמיסת ג'לטין 0.1% (500 מיקרוליטר לבאר) ודגרים עליהן במשך 30 דקות באינקובטור CO 2 (37°C, 5% CO2, אטמוספירה לחה).
- שטפו את הצלחות מצופות הג'לטין עם PBS והוסיפו 500 μL של CM+/- בינוני.
- הפשירו שני בקבוקונים של 1 x 106 פיברובלסטים עובריים של עכברים מוקרנים בהקפאה (MEFs) בטמפרטורה של 37°C והעבירו את תרחיף התא לצינור חרוטי עם 5 מ"ל של CM+/- בינוני.
- צנטריפוגה את התאים ב 200 x גרם במשך 5 דקות בטמפרטורת החדר (RT). שאפו את המדיום והשעו בעדינות את גלולת התא ב 12 מ"ל של CM+/- בינוני בריכוז של 1.67 x 105 תאים למ"ל.
- זרעו 500 μL של תרחיף MEF בצלחת תרבית תאים של 12 בארות (2.4 x 10,5 תאים לסמ"ר, 2) ודגרו על הצלחת למשך הלילה (o/n) באינקובטור CO2.
- הפשירו בקבוקון אחד של mESCs שמורים בהקפאה (1 x 10,6) בתווך CM+/+ 2i.
- זרעו את מתלה mESC על צלחת שטופה מראש של 12 בארות עם MEFs ב-1 מ"ל של CM+/+ 2i בינוני והעבירו את הצלחת לאינקובטור CO2 . רענן את המדיום מדי יום.
- במפגש של 70%, שטפו את מושבות mESC עם DPBS. הוסף 150 μL של חיץ TVP חם 10x ודגור ב- RT במשך 30 שניות כדי להתחיל דיסוציאציה אנזימטית.
- בזהירות להסיר את מאגר TVP, להשעות מחדש את התאים ב 1 מ"ל של CM+/+ 2i בינוני לנתק את המושבות לתאים בודדים על ידי pipetting עדין.
- עברו את התאים על ידי העברתם לצלחת תרבית תאים חדשה בת 12 בארות עם MEFs (יחס פיצול: 1:3-1:5). מערבבים בעדינות לפיזור התאים ודגורים באינקובטורCO2 .
- רעננו את מדיום התרבית (2-3 מ"ל) והתבוננו בגדילת התא / מורפולוגיה מדי יום. חזור על ההעברה הטורית במפגש של 70% כל יומיים. עבור לתווך CM+/+ עבור שני מעברים לפני תחילת התמיינות תאים.
2. היווצרות EB בטיפה תלויה
- הכינו מדיום התמיינות מזודרם טרי על ידי השלמת המדיום CM+/- עם גורם גדילה פיברובלסט בסיסי (bFGF) (50 ננוגרם·מ"ל-1) ועם חלבון מורפוגנטי עצם 4 (BMP-4) (5 ננוגרם·מ"ל-1) ושמרו אותו בטמפרטורה של 4°C עד לשימוש.
- מצפים באר אחת של צלחת תרבית התא 6 בארות עם 500 μL של 0.1% תמיסת ג'לטין ומניחים אותו באינקובטור CO2 למשך 30 דקות.
- שטפו את הצלחות מצופות הג'לטין עם PBS והוסיפו 500 μL של CM+/- בינוני.
- כדי להשיג אוכלוסייה טהורה של תאי גזע עובריים עובריים, טריפסין את צלחת תרבית התאים עם חיץ TVP 10x למשך 30 שניות ב-RT, השהה מחדש את התאים בתווך התמיינות מזודרם של 1 מ"ל ולאחר מכן העבר אותם לצלחת 6-באר מצופה ג'לטין למשך 30 דקות ומאפשר ל-MEFs להתחבר בזמן שה-mESCs נשארים בהשעיה.
- אספו את תרחיף התא בצינור חרוטי של 50 מ"ל וספרו את התאים באמצעות המוציטומטר נויבאואר וצבע כחול טריפאן להרחקת תאים חיים/מתים.
- צנטריפוגה את התאים ב 200 x גרם במשך 5 דקות ב RT. הסר את supernatant ו resuspend את גלולת התא בתווך התמיינות mesoderm כדי להגיע 4.55 x 104 תאים לכל מ"ל.
- ממלאים את החלק התחתון של צלחות פוליסטירן בעלות חיבור נמוך בקוטר 94 מ"מ ב-15 מ"ל מים סטריליים.
הערה: ארבע צלחות המכילות טיפות תלויות (1.6 x 105 תאים ב 3.52 מ"ל של מדיום) יידרשו לבדיקת מצב מסוים אחד באמצעות בדיקת אנגיוגנזה מונבטת תלת מימדית. - מעבירים את תרחיף התא למאגר פלסטיק סטרילי ומעמיסים ארבע עמדות של פיפטה רב ערוצית עם 22 מיקרוליטר של תרחיף תאים לערוץ (1 x 103 תאים לכל טיפה של 22 מיקרוליטר).
- הרימו והפכו את מכסה התבנית בקוטר 94 מ"מ והניחו אותה על משטח נקי של ארון הזרימה כשהצד הפנימי פונה כלפי מעלה.
- הפקידו 40 טיפות של תרחיף התא על המשטח הפנימי של כל מכסה. הפכו בזהירות את המכסה ללא הפרעה והחזירו אותו לצלחת, כך שהטיפות פונות למים.
- דוגרים על הכלים בחממת CO2 . ראו בכך יום בידול 0. שמרו על הצלחות במשך 4 ימים ליצירת EBs.
3. מבחן תחרות על מיקום תא החוד
- תרבית קו mESC פלואורסצנטי אחד וקו mESC אחד שאינו פלואורסצנטי כפי שתואר קודם לכן13. לדוגמה, נעשה שימוש ב-mESCs מסוג 7ACS/EYFP המסומנים בצהוב וב-R1 mESCs.
- הכינו EBs פסיפס על ידי ערבוב כמויות שוות של שני קווי mESC (יחס 1:1) ודגרו על צלחות הטיפה התלויות באינקובטור CO 2 כמתואר בשלב2 .
4. תרבית EBs צפה להתמיינות כלי דם
- לפני איסוף EBs מן טיפות תלוי, להכין את הדברים הבאים.
- הכינו תמיסת אגר 5% ב- H2O ועיקרו אותה על ידי אוטוקלאבינג (20 דקות ב 120 מעלות צלזיוס).
- השתמש בתמיסת אגר 5% חמה להכנת מדיום G-MEM BHK-21 המכיל 1% אגר ומזגו במהירות 3 מ"ל באחת ממנות הפוליסטירן 60 מ"מ. תנו לאגר להתמצק במשך שעה ב-RT. אחסנו את הכלים ב-4°C עד לשימוש.
- הכינו מדיום התמיינות כלי דם טרי פי 2 על ידי השלמת המדיום CM+/- עם bFGF (100 ng·mL-1) ו-VEGF-A (50 ng·mL-1). יש לאחסן את המדיום בטמפרטורה של 4°C עד לשימוש.
- אספו את הטיפות התלויות בצינור חרוטי בנפח 15 מ"ל באמצעות פיפטה P1000 והוציאו את הסופרנאטנט לאחר מספר דקות של שקיעת EB.
- השהה מחדש את ה- EBs ב- 3 מ"ל של מדיום התמיינות כלי דם 2x, העבר את מתלה ה- EB ליד אחת מצופה אגר ופזר את ה- EBs בצורה הומוגנית כדי למנוע צבירה.
- לדגור על הכלים באינקובטור CO2 ולרענן את המדיום כל יומיים עד יום 9 באמצעות מדיום התמיינות כלי דם 1x בנוכחות bFGF (50 ng·mL-1) ו- VEGF-A (25 ng·mL-1).
- לחלופין, הוסף גורם גדילה נגזר טסיות-BB (PDGF-BB) (10 ng·mL-1 ביום 4 ו 5 ng·mL-1 ביום 6 ויום 8) למדיום התמיינות כלי הדם כדי לקדם התמיינות תאי קיר.
5. ניתוח ציטומטריה של זרימה
- אספו את ה-EBs בני 9 הימים בצינור חרוטי של 15 מ"ל באמצעות פיפטה P1000 ושטפו אותם פעם אחת עם PBS חם.
- הוסף 1mL של G-MEM BHK-21 בינוני המכיל 0.2 מ"ג·mL-1 של collagenase A ודגור את התאים באינקובטור CO2 במשך 5 דקות.
- נתק את ה-EBs על-ידי פיפטה עדינה למעלה ולמטה עם פיפטה P1000.
- עצור את פעילות collagenase על ידי הוספת 1 מ"ל של G-MEM BHK-21 קר בינוני עם 10% FBS.
- צנטריפוגה את התאים ב 200 x גרם במשך 5 דקות ב RT.
- להשעות מחדש את התאים ב 500 μL של PBS עם 2% FBS.
- ספרו את התאים באמצעות המוציטומטר נויבאואר.
- השהה מחדש 400,000 תאים ב-100 מיקרוליטר PBS עם 2% FBS לכל מצב צביעה.
- יש לדגור על התאים במשך 45 דקות בטמפרטורה של 4°C עם הנוגדנים הבאים: נוגדן PECAM-1 מצומד לחולדה מצומדת APC (שיבוט MEC13.3) ונוגדנים מצומדים לחולדה מצומדת נגד עכבר CD45 (שיבוט 30-F11) או נוגדנים לבקרת איזוטיפ.
- לשטוף את התאים פעמיים עם 1 מ"ל של PBS המכיל 2% FBS.
- להשעות מחדש את התאים כדי להגיע לריכוז סופי של 5 x 106 תאים לכל מ"ל.
- סנן את התאים באמצעות מבחנה עגולה מפוליסטירן תחתון, עם מכסה הצמדה של מסננת תאים.
- נתח 20,000 אירועי PECAM-1 (+) לפי ציטומטריית זרימה.
6.3D בדיקת אנגיוגנזה מונבטת וצביעה אימונופלואורסצנטית
- ביום 9, הכינו מצע הנבטה על ידי הוספת 10% FBS (vol/vol), bFGF (50 ng·mL-1), VEGF-A (25 ng·mL-1), אריתרופויאטין רקומביננטי אנושי (hEPO) (20 ng·mL-1), אינטרלוקין-6 אנושי (IL-6) (10 ng·mL-1), 0.05 mM β-מרקפטואתנול, NEAA (1x), L-גלוטמין (1x), נתרן פירובט (1x), קולגן זנב חולדה סוג I (1.25 מ"ג·מ"ל-1), ו-NaOH (3.1 מילימול) עד GMEM BHK-1 בינוני.
- כדי למנוע ג'לציה של קולגן, יש לשמור על מצע ההנבטה על קרח עד לשימוש.
- כדי להעריך את ההשפעה של מולקולות פרו/אנטי-אנגיוגניות, הוסף את התרופה או הרכב שנבחרו למדיום ההנבטה בריכוז שנבחר.
- אספו EBs בני 9 ימים מצלחת אגר אחת בקוטר 60 מ"מ בצינור חרוטי של 15 מ"ל (שווה ערך למצב אחד) והוציאו את הסופרנאטנט לאחר מספר דקות של שיקוע.
- מכסים את תחתית צלחת התרבית בקוטר 35 מ"מ ב-1 מ"ל של מדיום ההנבטה ודגרים בטמפרטורה של 37°C למשך 5 דקות להשראת ג'לציה.
- השהה מחדש את ה- EBs ב- 2 מ"ל של מדיום הנבטה קר.
- מעבירים את התרחיף לצלחת תרבית בקוטר 35 מ"מ המצופה בשכבה הראשונה של מצע הנבטה.
- פזרו את ה-EBs על כל הצלחת וודאו שהם נמצאים במרחק שווה זה מזה. דוגרים על המנה באינקובטור CO2 . היווצרות הנבטים הראשונה מתרחשת תוך 24-48 שעות.
- ביום ה-12, ג'ל הקולגן המכיל EBs מועבר בזהירות למגלשת זכוכית (75X26 מ"מ) באמצעות מרית.
- מוציאים את עודפי הנוזלים בעזרת פיפטה (P1000) ומייבשים את הג'ל על ידי הנחת יריעת גזה של פשתן ניילון וכרטיסי סינון סופגים (נייר ניקוי ג'ל) על גבי הג'ל. הפעל לחץ על ידי הנחת משקל (250 גרם) למשך 2 דקות. הסר בזהירות את ניירות הניילון/פילטר ואפשר לשקופיות להתייבש באוויר למשך 30 דקות ב-RT.
- שטפו את המגלשות שלוש פעמים עם PBS במשך 5 דקות ב- RT.
- תקן את EBs באמצעות תמיסת אבץ (ראה טבלת חומרים) o/n ב 4 ° C. לחלופין, תקן את EBs פלואורסצנטי פסיפס עם Paraformaldehyde (PFA) (4%) o/n ב 4 ° C בחושך.
- הסר את הקיבוע. שטפו את המגלשות חמש פעמים עם PBS במשך 5 דקות ב- RT.
- חדרו את ה-EBs ב-PBS המכילים 0.1% Triton-X100 למשך 15 דקות ב-RT.
- הסר את פתרון החדירה. שטפו את המגלשות חמש פעמים עם PBS במשך 5 דקות.
- דגרו על EBs במאגר החוסם (PBS עם אלבומין 2% בסרום בקר, BSA) למשך שעה אחת ב-RT.
- כדי להכתים את נבטי האנדותל, השתמש בנוגדן ראשוני נגד עכבר נגד עכבר מסוג PECAM-1 (דילול של 1:100) בחסימת חיץ O/n בטמפרטורה של 4°C.
- שטפו את המגלשות חמש פעמים עם PBS במשך 5 דקות.
- לדגור על המגלשות עם נוגדן משני נגד חולדות עז Alexa 555 בחיץ חוסם (דילול 1:250) ובמידת הצורך, עם נוגדן אנטי-α-SMA מצומד FITC בחיץ חוסם (דילול 1:250) כדי להכתים תאי קיר למשך שעתיים ב- RT בחושך.
- שטפו את המגלשות שלוש פעמים עם PBS במשך 5 דקות ופעם אחת עם H20 לפני הרכבתן.
7. הדמיה קונפוקלית, ניתוח מורפומטרי וכמותי של נבטי אנדותל EB
- קבל תמונות ברזולוציה גבוהה של EBs immunostained על ידי מיזוג מישור מוקד (z-stacking) באמצעות מיקרוסקופ קונפוקלי. השתמש במטרה הגדלה של 10x כדי לצלם EBs שלמים.
- נתח את התמונות שנרכשו באמצעות ImageJ כדי להעריך את המורפולוגיה ולכמת את המאפיינים של נבטי אנדותל חיוביים PECAM-1 על פי שיטות כימות מבוססות13,14,21.
- חשב את המספר הממוצע של נבטי אנדותל לכל EBs על ידי ספירה ידנית של מספר הנבטים הכולל לכל EBs בודדים.
- מדדו את אורכי הנבטים הבודדים בעזרת כלי הציור ImageJ. הגדר את הבסיס של נבט האנדותל החל מאזור הליבה EB וצייר קו באופן ידני עד לקצה קצה הנבט.
- חשב את המספר הממוצע של תאי קצה לכל נבט על-ידי ספירה ידנית של מספר תאי החוד לכל נבט בודד ולאחר מכן חשב את הממוצע לכל EB.
- חשב את כיוון הפילופודיה על ידי קביעה ידנית של ציר נבט האב ומדידת הזווית החריפה ביניהם באמצעות כלי הזווית של תוכנת ImageJ. חישוב מספר הנבטים עם כיוון >50° ולחלק אותו במספר הכולל של נבטים של EB של עניין.
הערה: הזוויות נעו תמיד בין 0° ל- 90°.
- קבל תמונות ברזולוציה גבוהה של EBs immunostained באמצעות מיקרוסקופ קונפוקלי. השתמש במטרה להגדלה של 40x כדי לממש תמונות ברזולוציה גבוהה של נבטי אנדותל יחידים.
- כמת את כיסוי כלי השיט של נבטי EC חיוביים PECAM-1 המוקפים ב- MCs חיוביים α-SMA באמצעות תוכנת ImageJ.
- פצלו את התמונות הממוזגות לערוצים נפרדים של אדום וירוק.
- המר את התמונות לצורתן הבינארית.
- מדדו את השטח התאי הכולל של הנבט שנכבש בנפרד על ידי PECAM-1 (תאי אנדותל המסומנים באדום) ועל ידי תאים חיוביים α-SMA (תאי קיר המסומנים בירוק).
- צור את התמונה הממוזגת באמצעות פונקציית מחשבון התמונות והאופרטור AND. מדדו את השטח הסלולרי הכולל של התמונה. כדי לחשב את הכיסוי, חלק את שטח התמונה המשותפת באזור התמונה הבינארית PECAM-1.
- כדי לנתח את התחרות התאית על מיקום תאי קצה אנדותל/גבעול של נבטים שפותחו על ידי פסיפס EBs, דרג ידנית את מספר תאי החוד וסמן את מקורם הגנוטיפי בהתבסס על האות הפלואורסצנטי. חשב את הערכים הממוצעים לכל EB.
תוצאות
סקירת הפרוטוקול של בדיקת הנבטת כלי הדם מוצגת באיור 1. EBs בני תשעה ימים שנגזרו משלושה קווי mESC עצמאיים של 129/Ola (Z/Red, R1 ו-E14) נותקו אנזימטית לתאים בודדים באמצעות collagenase A. התאים הוכתמו עבור PECAM-1 ונותחו על ידי מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) כמתואר. כל קווי התאים הציגו התמיינות אנדותל חזקה, ולא נצפו הבדלים ביכולתם להתמיין לתאי אנדותל. כל קווי התאים ייצרו כ-10.5% ±-1.3% מתאי האנדותל (איור 2A). רמות הביטוי היחסיות של סמני תאים PAN-אנדוטליים באוכלוסיית תאי PECAM-1 (+) כומתו גם הן. רמות ביטוי ה-mRNA של כל הסמנים שנותחו (Flk1, Flt1, Flt4, Eng, Tie2 ו-Cdh5) היו דומות בין קווי התאים לבין הניסויים, מה שאישר את החוסן של פרוטוקול ההתמיינות (איור 2B). אוכלוסיות תאי PECAM-1 (+) ביטאו רק רמות mRNA נמוכות מאוד של סמנים עורקיים (Notch1 ו-Efnb2) או ורידיים (Couptf2 ו-Ephb4) התומכים במצב הלא בשל יחסית של תאי האנדותל שנוצרו על-ידי הפרוטוקול (איור 2C).
לאחר מכן הודגמה היכולת של מודל EB להנבט כלי דם לסנן תרופות המווסתות אנגיוגנזה (איור 3). DC101 ו-DAPT (N-[N-(3,5-difluorophenacetyl)-Lalanyl]-S-phenylglycine t-butylester) נבדקו. תרכובות אלה נמצאות בשימוש נרחב בעכברים כדי לחסום אנגיוגנזה בהתאמה על-ידי עיכוב פעילות VEGFR2 או כדי לקדם התמיינות תאי קצה אנדותל והיווצרות מקלעת כלי דם צפופה על-ידי התמקדות באיתות Notch (איור 3A). גם מסלולי איתות VEGF וגם Notch הם רגולטורים מרכזיים של אנגיוגנזה נובטת in vivo. נבדקו ההשפעות של ריכוזים שונים של DC101 ו-DAPT ב-EBs המצופים בקולגן. מינונים גבוהים של DC101 הנעים בין 6-30 מ"ג· L-1 עיכב הן את מספר נבטי כלי הדם והן את אורכם, בעוד של-DAPT היו השפעות הפוכות במינון של 1 μmol· L-1 (איור 3B-C). תמונות בהגדלה גבוהה של נבטי כלי הדם המוכתמות עבור PECAM-1 של EBs שגודלו בתרבית בנוכחות DAPT מסופקות גם כן (איור 3D). DAPT גם במינונים נמוכים הנעים בין 0.5-1 μmol· L-1 הגדיל מאוד את מספר תאי קצה האנדותל עם נבטי כלי דם שהיו להם פנוטיפ של הטעיה (איור 3D-F). מינון גבוה של DAPT הוביל גם להתלכדות כלי דם ולהיווצרות אזורי תאי אנדותל גדולים ושטוחים ללא ארגון (איור 3A). התוצאות אישרו את יכולתו של המודל לבדוק תרופות המקדמות או מעכבות אנגיוגנזה.
כדי לאשר שמודל זה מתאים לחיקוי מחלות כלי דם, מסופקות התמונות הקונפוקליות של EBs הנגזרים מ- Acvrl1+/- mESCs. גן Acvrl1 מקודד ל-ALK1 (Activin Receptor-like Kinase 1), קולטן המתבטא באופן ספציפי בתאי אנדותל, שאם עובר מוטציה הוא אחראי להתפתחות מחלה וסקולרית נדירה עם אנגיודיספלסיה בשם Hereditary Hemorrhagic Telangiectasia (HHT). תמונת הגדלה גבוהה של נבטי האנדותל Acvrl1+/- גילתה שהיו להם יותר תאי קצה אנדותל ויותר ענפים לכל נבט שהיו בזוויות אקראיות ביחס לכלי הדם ההורים. אלה אישרו במבחנה פנוטיפ של הטעיה כפי שנצפה בעכברי HHT (איור 4).
על-ידי יצירת EBs כימריים המכילים mESC מובחן עם תווית פלואורסצנטית ו-mESC של גנוטיפ מסוים, נכלל פרוטוקול חלופי לחקר תהליך בחירת קצה האנדותל (איור 5A-C). תמונה קונפוקלית של נבטי כלי דם מסומנים ב-PECAM-1 זיהתה את המקור הגנוטיפי של תאי קצה האנדותל המובילים (איור 5B). תערובות של קו mESC מסוג YFP (חלבון פלואורסצנטי צהוב) ביחס של 1:1 עם קו mESC פראי אחד ללא תווית הובילו באופן עקבי לתרומה שווה של כל אוכלוסייה לתאי קצה האנדותל המובילים (איור 5C).
פרוטוקול זה מתאים גם לכימות כיסוי תאי הקיר של נבט כלי הדם. EBs שעוברים אנגיוגנזה תוקנו ונצבעו עבור PECAM-1 (תאי אנדותל, אדום) ועבור α-Smooth Muscle Actin (α-SMA) (תאי קיר, ירוק) (איור 5D). תמונת הגדלה גבוהה חשפה כיצד נבט כלי בודד אחד מוקף בתאי ציור קיר (איור 5E, משמאל). טרנספורמציה בינארית בוצעה לאחר הפרדת ערוצי צבע (איור F-G) כדי לכמת את היחס בין כלי PECAM-1 (+) המכוסה על-ידי תאי ציור קיר α-SMA (+) באמצעות תוכנת ImageJ (איור 5H).

איור 1: ציר הזמן של הליכי הפרוטוקול. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
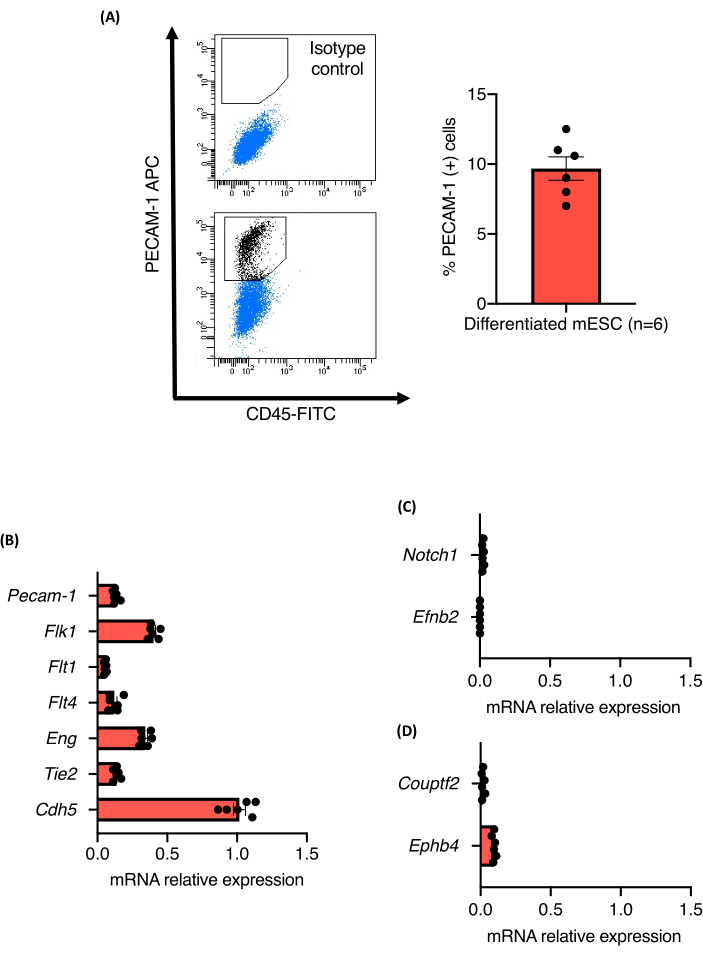
איור 2: אפיון ECs הנגזרים מהתמיינות כלי דם mESC בתוך EBs. (A) ניתוח ציטומטרי זרימה של ביטוי CD31 מ- EBs בני 9 ימים וכימות אחוז תאי Pecam-1 (+). (B-D) רמות ביטוי mRNA של Pecam-1, Flk1, Flt1, Flt4, Eng, Tie2, Cdh5, Notch1, EfnB2, Couptf2 ו- EphB4 בתאי אנדותל ממוינים מ- EBs בני 9 ימים. קווי שגיאה מייצגים את הממוצע ± שגיאת התקן של הממוצע (SEM). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
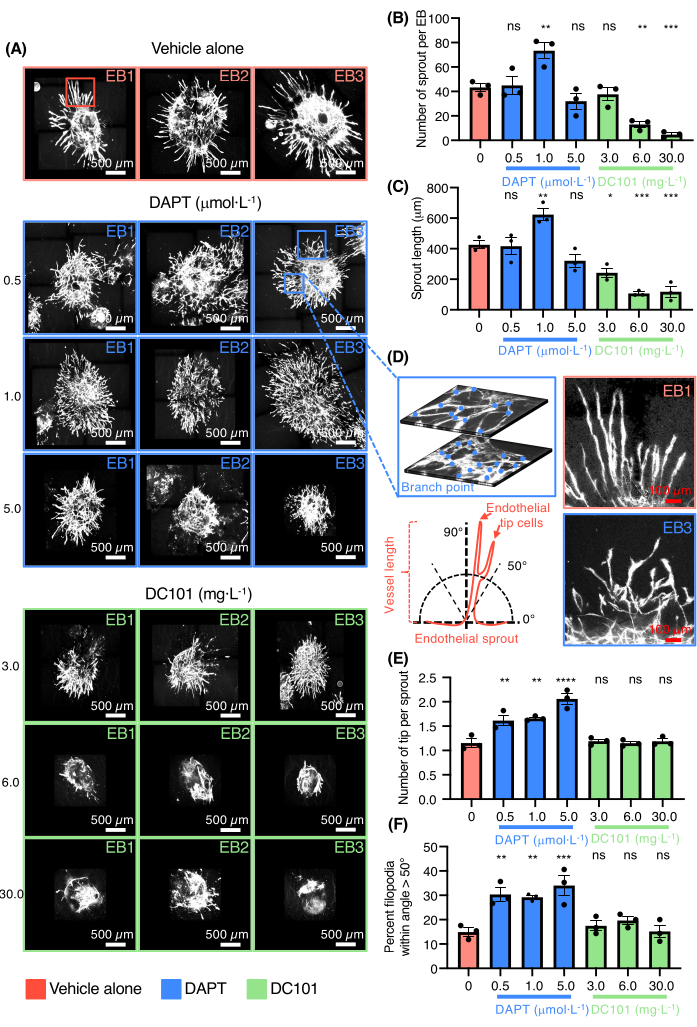
איור 3: בדיקת אנגיוגנזה מונבטת תלת-ממדית לבדיקת תרופות. (A) תמונות קונפוקליות של שלושה EBs מייצגים מוכתמים עבור Pecam-1 (תאי אנדותל לבנים) שטופלו ברכב בלבד, DAPT (0.5 μmol· L-1, 1.0 μmol· L-1, 5.0 μmol· L-1) או DC101 (3 מ"ג· L-1, 6 מ"ג· L-1, 30 מ"ג· L-1). (B) כימות מספר הנבטים לכל EB. (ג) כימות אורך הנבט. (D) בלוח השמאלי העליון, הגדלה גבוהה של נבט אנדותל המראה את סיבוכיות הרשת ואת נקודת ההסתעפות הנספרת על שתי שכבות שונות מאותו EB, בלוח השמאלי התחתון איור סכמטי המייצג את שיטת המדידה של כיוון נבטי אנדותל. בפאנל הימני העליון, הגדלה גבוהה של נבטי אנדותל מהרכב בלבד ובפאנל הימני התחתון, הגדלה גבוהה של נבטי אנדותל מ-DAPT (0.5 μmol· L-1) תנאי. (E) כימות מספר תאי החוד לכל נבט. (F) כימות אחוז פילופודיה בזווית >50°. כל העמודות מייצגות ערכי SEM ו-p ממוצעים ± מבדיקת ANOVA חד-כיוונית לא מזווגת. ns = לא משמעותי, *p < 0.05, **p < 0.01, ***p < 0.001 ו- ****p < 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: כלי דם פגומים שנובטים ב- Hereditary Hemorrhagic Telangiectasia EBs. בלוח העליון, תמונות קונפוקליות של EBs מייצגים בני 12 יום מ- Acvrl1+/+ ו- Acvrl1+/- גנוטיפים מוכתמים עבור Pecam-1 (תאי אנדותל לבנים). בלוח התחתון, הגדלה גבוהה של נבטי אנדותל Acvrl1+/- (קופסה לבנה מהפאנל העליון) המציגה תאי קצה רבים (חיצים אדומים), נקודות הסתעפות אנדותל (נקודות כחולות) ופנוטיפ הנבטה מטעה (חיצים ירוקים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: חקר מיקום תא קצה / גבעול והבשלת כלי דם באמצעות בדיקת הנבטה תלת-ממדית. (A) תמונה קונפוקלית של EB כימרי מייצג בן 12 יום העשוי מקו תאים מסוג בר R1 מעורבב ביחס 1:1 עם קו תאים פראי מסוג 7ACS/EYFP המוכתם עבור Pecam-1 (אדום, תאי אנדותל). חצים אדומים מציינים תאי קצה מקו תא R1 וחצים ירוקים מציינים תאי קצה מקו תא 7ACS/EYFP. (B) הגדלה גבוהה של נבט אנדותל המראה את הפיזור של תאי אנדותל R1 ו-7ACS/EYFP לאורך הנבט. (C) כימות של תאי קצה הגנוטיפ היחסיים מתאי EB מייצגים מסוג בר. (D) תמונה קונפוקלית של EB מייצג בן 12 יום מוכתמת עבור Pecam-1 (אדום, תאי אנדותל) ו- α-SMA (ירוק, תאי קיר). (E) הגדלה גבוהה של נבט אנדותל (תיבה לבנה מלבנית מנוקדת מ-D) המראה אינטראקציה בין ציור קיר לתאי אנדותל. (פ-ג) תמונות של נבטי האנדותל הצבעוניים והתמונות הבינאריות הקשורות אליהם. (H) תמונה בינארית של צביעת Pecam-1 ו-α-SMA שעברו לוקליזציה. יחס נבטי תאי אנדותל המכוסים בתאי קיר. כל העמודות מייצגות ממוצע ± SEM. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר בדיקת הנבטת כלי דם תלת-ממדית תלת-ממדית מבוססת EB בלתי משוחדת, חזקה וניתנת לשחזור, הניתנת לבדיקה לאיתור תרופות וגנים המווסתים אנגיוגנזה. שיטה זו מציעה יתרונות על פני בדיקות דו-ממדיות (דו-ממדיות) רבות הנמצאות בשימוש נרחב באמצעות תרביות תאי אנדותל כגון תאי אנדותל של וריד הטבור האנושי (HUVECs) כדי לעקוב אחר הגירה (בדיקת שריטה צידית או בדיקת תא בוידן)22,23 או התפשטות (ספירת מספר תאים, זיהוי סינתזת DNA, זיהוי סמני התפשטות או בדיקות מטבוליות)24 בכך שהוא מאפשר באופן ייחודי לחקור הן את התמיינות תאי האנדותל והן את ארגונם לרשת כלי דם המחקה שלבים מרכזיים של אנגיוגנזה מונבטת. שלבים אלה כוללים את בחירת תאי קצה האנדותל, התפשטות תאי הגבעול, התמצאות מרחבית ונדידה של נבט כלי הדם, וגיוס תאי קיר לכלי הדם המתהווה25. הוא מציע גם יתרונות למודלים רבים של אנגיוגנזה תלת ממדית. חרוז פיברין26,27 או בדיקת ג'ל קולגן28,29,30 המחקים את הטובולוגנזה משתמשים בדרך כלל בתאי אנדותל (ECFC-EC) של HUVECs או תאים יוצרי מושבת אנדותל הנגזרים מתאי אנדותל (ECFC-EC) מכיוון שיש להם קצב התרבות גבוה אך אינם מתאימים לתאי אנדותל ראשוניים של עכבר שקשה לשמור עליהם בתרבית. explant רשתית ex vivo explant 31 או בדיקת מיקרו-איברים וסקולרית32 יכולים לשחזר היטב את כל שלבי היווצרות כלי הדם, אך יש להם הליכים ניסיוניים מורכבים ואינם מתאימים לתרופות בתפוקה גבוהה או לסינון גנטי. זה נכון גם עבור בדיקת טבעת אבי העורקים ex vivo 33,34 ועבור בדיקות in vivo רבות כגון גידול שהושתל בעכברים או מחקרי אובדן תפקוד בעכברים שלעתים קרובות יש להם עלות גבוהה וקשיים בהשגת כמות גדולה של נתונים 35. פרוטוקול זה גם משלים יפה מבחני אנגיוגנזה חוץ גופית דומים באמצעות iPSCs אנושיים המאפשרים השוואה בין נתונים עכבריים ואנושיים. למרות שחשוב לציין כי תאי אנדותל אנושיים שמקורם ב- iPSC מראים פחות יכולת לנבוט מאשר תאי עכבר36,37.
לשיטה שפותחה כאן יש גם כמה מגבלות. הוא אינו יכול להעריך את ההשפעות של זרימת נוזלים על הבשלת כלי דם, חדירות כלי דם ואינו מייצר כלי דם מתהווה בסביבת רקמה ספציפית בהשוואה למכשירים מיקרו-מפוברקים עדכניים הנמצאים בפיתוח. ואכן, טכנולוגיות איבר על שבב המשלבות מיקרופלואידיקה עם הנדסת רקמות יכולות לספק לתאי אנדותל בתרבית מיקרו-סביבה דומה לזו in vivo38,39. מערכות מיקרופלואידיות מכילות את הרכב המטריצות החוץ תאיות הנכון ומתוכננות לייצר אותות מכניים כגון לחץ גזירה. חלקם מתוכננים לשלב תאי קיר ותאים תומכים אחרים של רקמה נתונה או יכולים ליצור שיפועים כימיים. הם מכילים רשתות של תעלות מלאות נוזל בקנה מידה מיקרוני הדומות בגודל ובמבנה לנימי הדם. טכנולוגיות איבר על שבב מאפשרות גם לכמת תפקודי כלי דם ספציפיים, כולל החדירות וההתנגדות החשמלית הטרנס-אנדותלית. למרות שטכנולוגיות איבר על שבב מציעות הבטחה, הן הרבה מעבר למומחיות המחקר של רוב מעבדות הביולוגיה, עדיין זקוקות לסטנדרטיזציה נאותה, ודורשות טכניקות ייצור מיוחדות. מסחור הייצור של טכנולוגיית איבר על שבב רק מתחיל, ומערכות אלה נחשבות לבלתי אפשריות מבחינת עלות וזמן עבור חברות התרופות כיום40,41.
ישנם מספר צעדים קריטיים שיש לקחת בחשבון. השתמש בתאים באיכות גבוהה המבטאים בצורה חזקה סמנים מקובלים היטב (Nanog, Oct4, Sox2 ו- SSEA-1) של המצב הפלוריפוטנטי. חיוני לעקוב בקפידה אחר צמיחתם, צורת תאי mES והגודל והמורפולוגיה של מושבות mES. מכיוון שהיציבות הקריוטיפית היא סטוכסטית בתאים בתרבית, הערכה מחדש שלה לאחר מעבר נרחב היא חיונית. מומלץ להשתמש במוצרים שכבר נבדקו עבור תרבית mESC ולבדוק מזיני MEF, סרום עגל עוברי וכל התרכובות הכימיות עבור מספר מעברים כדי לזהות אם mESCs שומרים על התכונות התאיות שלהם או אם הם ממיינים או רוכשים פנוטיפ אפיבלסטי. יש לרענן את המדיום מדי יום ואין לאפשר למושבות mESC להיות גדולות וצפופות מדי. לבסוף, mESCs צריכים להיות בתרבית לפחות עבור שני מעברים ללא 2i לפני התמיינות כדי להבטיח את התפוקה הטובה ביותר של תאי אנדותל.
התמיינות האנדותל כוללת שני שלבים חשובים: היווצרות EBs בשיטת הטיפה התלויה ותרבית שלהם בתנאי ציפה בנוכחות מדיום התמיינות כלי דם13,14. יש למזער את תנועת צלחות הטיפה התלויות כדי להשיג צבירת תאים אחידה. מספר mESCs המשמשים ליצירת צבר ברוב המקרים, נע בין 800-1,000 תאים, אך ייתכן שיהיה צורך למטב אותו אם mESCs יש רקע גנטי שונה מאשר 129/ola כדי להבטיח התמיינות אופטימלית לתוך EBs כלי דם. כאשר מגדלים אותם בתרבית בתנאים צפים, יש לפזר אותם בזהירות ולהימנע מתנועה המעדיפה התגבשות EB.
EBs הם סוף סוף תרבית קולגן I ג'ל כדי ליצור נבטי כלי. מדיום אנגיוגני צריך להיות מוכן טרי ולאחר ערבוב עם קולגן אני חייב להישמר על קרח כדי למנוע ג'לציה ספונטנית. במקרה של בדיקת סמים, תרופות מתווספות בתערובת קרה בריכוז הנכון במהלך שלב זה. התאמת ה- pH עם NaOH לפני השעיה מחדש של EBs היא חיונית, אחרת חומציות קולגן תגרום לרעילות תאים. לבסוף, EBs צריכים להיות מפוזרים במרחק שווה אחד מהשני כדי להבטיח תוצאות לשחזור.
לסיכום, שיטה זו מציגה בדיקת הנבטת כלי דם תלת ממדית המבוססת על mESC שיש לה את החוסן והמדרגיות הנדרשים לשימוש בבדיקות גנטיות כפי שתואר לאחרונה על ידי Elling U. et al. זה יצר haplobank גדול של mESC16 מוטנטי hemi/homozygous ועבור תוכנית גילוי תרופות פנוטיפיות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מארגון Nederlandse organisatie voor gezondheidsonderzoek en zorginnovatie (ZonMW 446002501), Health Holland (LSHM19057-H040), תוכנית עמיתים מובילה מארי סקלודובסקה-קירי COFUND, ועל ידי האגודה Maladie de Rendu-Osler (AMRO).
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Milipore, Merck | 805740 | Biohazard: adequate safety instructions should be taken when handling |
| Agar Noble | Difco, BD Pharmigen | 214220 | |
| Alexa Fluo 555 goat anti rat IgG | Life technologies | A21434 | |
| APC conjugated rat anti-mouse PECAM-1 antibody (clone MEC13.3) | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control (Clone R35-95) | BD Biosciences | 553932 | |
| Axiovert 25 inverted phase contrast tissue culture microscope | ZEISS | ||
| Basic Fibroblast Growth Factor-2 (bFGF) | Peprotech | 450-33 | |
| Benchtop Centrifuge, Allegra X-15R | Beckman Coulter | 392932 | |
| Biosafety cabinet BioVanguard (Green Line) | Telstar | 133H401001 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| Cell counting chamber, Buerker, 0.100mm | Marienfeld | 640211 | |
| Cell culture dishes 60 x 15mm | Corning | 353802 | |
| Cell culture dishes, 35 x 10 mm | Corning | 353801 | |
| Cell culture plates 12-well | Corning | 3512 | |
| CFX96 Touch Real-Time PCR Detection System | Biorad | 1855196 | |
| Chicken serum | Sigma-Aldrich | C5405 | |
| CHIR-99021 (CT99021) HCl | Selleckchem | S2924 | |
| Collagen I, High Concentration, Rat Tail, 100mg | Corning | 354249 | |
| Collagenase A | Roche | 10103586001 | |
| Confocal Laser Scanning Microscope, TCS SP5 | Leica | ||
| Cover glasses, 24 × 50 mm | Vwr | 631-0146 | |
| DAPT γ?secretase inhibitor | Sigma Aldrich | D5942 | |
| DC101 anti mouse VEGFR-2 Clone | BioXcell | BP0060 | |
| DC101 isotype rat IgG1 | BioXcell | BP0290 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2438-5X | Biohazard: adequate safety instructions should be taken when handling |
| DPBS (10x), no calcium, no magnesium | Gibco, Thermofisher scientific | 14200067 | |
| EDTA 40 mM | Gibco, Thermofisher scientific | 15575-038 | |
| Embryonic stem-cell Fetal Bovine Serum | Gibco, Thermofisher scientific | 16141-079 | Should be lot-tested for maximum ES cell viability and growth. Heat inactivate at 60°C and store at −20 °C for up to 1 year |
| Eppendorf Microcentrifuge 5415R | Eppendorf AG | Z605212 | |
| Erythropoietin, human (hEPO), 250 U (2.5 µg) (1 mL) | Roche | 11120166001 | |
| ESGRO Recombinant Mouse LIF Protein (10? units 1 mL) | Milipore, Merck | ESG1107 | |
| Falcon tubes 15 mL | Greiner Bio-One | 188271 | |
| Falcon tubes 50 mL | Greiner Bio-0ne | 227270 | |
| Filter tip ,clear ,sterile F.Gilson, P-200 | Greiner Bio-One | 739288 | |
| Filter tip ,clear ,sterile F.Gilson, P10 | Greiner Bio-One | 771288 | |
| Filter tip ,clear ,sterile F.Gilson, P1000 | Greiner Bio-One | 740288 | |
| FITC conjugated anti-α Smooth Muscle Actin (SMA) (clone 1A4) | Sigma Aldrich | F3777 | |
| FITC conjugated rat anti-mouse CD45 (clone 30-F11) | Biolegend | 103107 | |
| FITC Rat IgG2b, κ Isotype Ctrl Antibody (clone RTK4530) | Biolegend | 400605 | |
| Fluorscent mounting media | DAKO | S3023 | |
| Gascompress | Cutisoft | 45846 | |
| Gauze Cutisoft 10 x 10 cm | Bsn Medical | 45844_00 | |
| Gel blotting paper, Grade GB003 | Whatman | WHA10547922 | |
| Gelatin solution, type B | Sigma-Aldrich | G1393-100 ml | |
| Glasgow's MEM (GMEM) | Gibco, Thermofisher scientific | 21710082 | |
| IHC Zinc Fixative | BD Pharmigen | 550523 | |
| IncuSafe CO2 Incubator | PHCBi | MCO-170AICUV-PE | |
| Interleukin-6, human (hIL-6) | Roche | 11138600001 | |
| L-Glutamine 200 mM | Gibco, Thermofisher scientific | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco, Thermofisher scientific | 11140035 | |
| Microscope slide box | Kartell Labware | 278 | |
| Microscope slide, Starfrost | Knittel glass | VS113711FKB.0 | |
| Mm_Cdh5_1_SG QuantiTect Primer Assay | Qiagen | QT00110467 | |
| Mm_Eng_1_SG QuantiTect Primer Assay | Qiagen | QT00148981 | |
| Mm_Epha4_1_SG QuantiTect Primer Assay | Qiagen | QT00093576 | |
| Mm_Ephb2_1_SG QuantiTect Primer Assay | Qiagen | QT00154014 | |
| Mm_Flt1_1_SG QuantiTect Primer Assay | Qiagen | QT00096292 | |
| Mm_Flt4_1_SG QuantiTect Primer Assay | Qiagen | QT00099064 | |
| Mm_Gapdh_3_SG QuantiTect Primer Assay | Qiagen | QT01658692 | |
| Mm_Kdr_1_SG QuantiTect Primer Assay | Qiagen | QT00097020 | |
| Mm_Notch1_1_SG QuantiTect Primer | Qiagen | QT00156982 | |
| Mm_Nr2f2_1_SG QuantiTect Primer Assay | Qiagen | QT00153104 | |
| Mm_Pecam1_1_SG QuantiTect Primer | Qiagen | QT01052044 | |
| Mm_Tek_1_SG QuantiTect Primer Assay | Qiagen | QT00114576 | |
| Mouse (ICR) Inactivated Embryonic Fibroblasts (2 M) | Gibco, Thermofisher scientific | A24903 | Store vials in liquid nitrogen (195.79 °C) indefinitely |
| Mouse embryonic stem cell line 7AC5/EYFP (ATCC SCRC-1033) | ATCC | SCRC-1033 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Hadjantonakis, A. K., et al. Mechanisms of Development. 76 (1–2), 79–90 (1998)]. |
| Mouse embryonic stem cell lines Acvrl1 +/- and Acvrl1 +/+ | Generated at Leiden University Medical Centre [Thalgott, J.H. et al. Circulation. 138 (23), 2698–2712 (2018)]. | ||
| Mouse embryonic stem cells line E14 | Provided by M Letarte laboratory and generated according to Cho, S. K., et al. Blood. 98 (13), 3635–3642 (2001). | ||
| Mouse embryonic stem cells line R1 (ATCC SCRC-1011) | ATCC | SCRC-1011 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Nagy, A., et al. Procedings of the National Academy of Sciences of the United States of America. 90 (18), 8424–8428 (1993)]. |
| Mouse embryonic stem cells line Z/Red (strain 129/Ola) | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada [Vintersten, K., et al. Genesis. 40 (4), 241–246 (2004)]. | ||
| NanoDrop 1000 UV/VIS Spectrophotometer | Thermo Fischer Scientific | ND-1000 | |
| PD0325901 | Selleckchem | S1036 | |
| PDGF-BB, Recombinant Human | Peprotech | 100-14B | |
| Pecam-1 antibody, Rat Anti-Mouse | BD Biosciences | 550274 | |
| Penicillin-streptomycin (10,000 U/mL) | Gibco, Thermofisher scientific | 15140122 | |
| Petri dish, PS, 94/16 mm, standard ,with vents, sterile | Greiner Bio-One | 633181 | |
| Pipetboy acu 2 | Integra-Biosciences | 155 019 | |
| Pipetman G Multichannel P8 x 200G | Gilson | F144072 | |
| Pipetman G Starter Kit, 4 Pipette Kit, P2G, P20G, P200G, P1000G | Gilson | F167360 | |
| Recombinant Human BMP-4 Protein | R&D Systems | 314-BP | |
| RNeasy Plus mini Kit | QIAGEN | 74134 | |
| Serological pipettes, 10 mL | Greiner Bio-One | 607 180 | |
| Serological pipettes, 25 mL | Greiner Bio-One | 760 180 | |
| Serological pipettes, 5 mL | Greiner Bio-One | 606 180 | |
| Sodium hydroxide (NaOH) | Merck | 106498 | |
| Sodium pyruvate 100 mM | Gibco, Thermofisher scientific | 11360039 | |
| Test tubes 5ml round-bottom with cell-strainer cap | Corning | 352235 | |
| Thermal cycler, T100 | Biorad | 1861096 | |
| Triton X-100 (BioXtra) | Sigma Aldrich | T9284 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher scientific | 15250061 | |
| Trypsin (2.5%) | Gibco, Thermofisher scientific | 15090046 | |
| Vacuum Filter/Storage Bottle System, 500 mL | Corning | 430758 | |
| VEGFA165 , recombinant murine | Peprotech | 450-32 | |
| Water, Sterile | Fresenius-Kabi | B230531 | |
| Waterbath, Lab-Line Digital | Thermo Fischer Scientific | 18052A |
References
- Moffat, J. G., Vincent, F., Lee, J. A., Eder, J., Prunotto, M. Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nature Reviews Drug Discovery. 16 (8), 531-543 (2017).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews. Drug Discovery. 15 (11), 751-769 (2016).
- Low, L. A., Mummery, C., Berridge, B. R., Austin, C. P., Tagle, D. A. Organs-on-chips: into the next decade. Nature Reviews. Drug Discovery. , (2020).
- Ma, C., Peng, Y., Li, H., Chen, W. Organ-on-a-Chip: A new paradigm for drug development. Trends in Pharmacological Sciences. 42 (2), 119-133 (2021).
- Swinney, D. C., Anthony, J. How were new medicines discovered. Nature Reviews Drug Discovery. 10 (7), 507-519 (2011).
- Hussain, S., et al. High-content image generation for drug discovery using generative adversarial networks. Neural Networks: The Official Journal of the INternational Neural Network Society. 132, 353-363 (2020).
- Scheeder, C., Heigwer, F., Boutros, M. Machine learning and image-based profiling in drug discovery. Current Opinion in Systems Biology. 10, 43-52 (2018).
- Wagner, B. K., Schreiber, S. L. The power of sophisticated phenotypic screening and modern mechanism-of-action methods. Cell Chemical Biology. 23 (1), 3-9 (2016).
- Scannell, J. W., Bosley, J. When quality beats quantity: Decision theory, drug discovery, and the reproducibility crisis. PLoS One. 11 (2), 0147215 (2016).
- Webster, J. D., Santagostino, S. F., Foreman, O. Applications and considerations for the use of genetically engineered mouse models in drug development. Cell and Tissue Research. 380 (2), 325-340 (2020).
- Howland, D. S., Munoz-Sanjuan, I. Mind the gap: models in multiple species needed for therapeutic development in Huntington's disease. Movement Disorders: Official Journal of the Movement Disorder Scoiety. 29 (11), 1397-1403 (2014).
- Galaris, G., Thalgott, J. H., Lebrin, F. P. G. Pericytes in hereditary hemorrhagic telangiectasia. Advances in Experimental Medicine and Biology. 1147, 215-246 (2019).
- Thalgott, J. H., et al. Decreased expression of vascular endothelial growth factor receptor 1 contributes to the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Circulation. 138 (23), 2698-2712 (2018).
- Lebrin, F., et al. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia. Nature Medicine. 16 (4), 420-428 (2010).
- Czechanski, A., et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nature Protocols. 9 (3), 559-574 (2014).
- Elling, U., et al. A reversible haploid mouse embryonic stem cell biobank resource for functional genomics. Nature. 550 (7674), 114-118 (2017).
- Cheng, J., et al. Targeting pericytes for therapeutic approaches to neurological disorders. Acta Neuropathologica. 136 (4), 507-523 (2018).
- Chade, A. R. Small vessels, big role: Renal microcirculation and progression of renal injury. Hypertension. 69 (4), 551-563 (2017).
- Jourde-Chiche, N., et al. Endothelium structure and function in kidney health and disease. Nature Reviews. Nephrology. 15 (2), 87-108 (2019).
- van Duinen, V., et al. Standardized and scalable assay to study perfused 3D angiogenic sprouting of iPSC-derived endothelial cells in vitro. Journal of Visualized Experiment: JoVE. (153), e59678 (2019).
- Chappell, J. C., Taylor, S. M., Ferrara, N., Bautch, V. L. Local guidance of emerging vessel sprouts requires soluble Flt-1. Developmental Cell. 17 (3), 377-386 (2009).
- Sato, Y., Rifkin, D. B. Inhibition of endothelial cell movement by pericytes and smooth muscle cells: activation of a latent transforming growth factor-beta 1-like molecule by plasmin during co-culture. Journal of Cell Biology. 109 (1), 309-315 (1989).
- Tchaikovski, V., Olieslagers, S., Bohmer, F. D., Waltenberger, J. Diabetes mellitus activates signal transduction pathways resulting in vascular endothelial growth factor resistance of human monocytes. Circulation. 120 (2), 150-159 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. International Journal of Experimental Pathology. 90 (3), 195-221 (2009).
- Herbert, S. P., Stainier, D. Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis. Nature Reviews Molecular Cell Biology. 12 (9), 551-564 (2011).
- Nakatsu, M. N., Hughes, C. C. An optimized three-dimensional in vitro model for the analysis of angiogenesis. Methods in Enzymology. 443, 65-82 (2008).
- Nakatsu, M. N., Davis, J., Hughes, C. C. Optimized fibrin gel bead assay for the study of angiogenesis. Journal of Visualized Experiments: JoVE. (186), (2007).
- Gau, D., et al. Pharmacological intervention of MKL/SRF signaling by CCG-1423 impedes endothelial cell migration and angiogenesis. Angiogenesis. 20 (4), 663-672 (2017).
- Torres-Estay, V., et al. Androgens modulate male-derived endothelial cell homeostasis using androgen receptor-dependent and receptor-independent mechanisms. Angiogenesis. 20 (1), 25-38 (2017).
- Merjaneh, M., et al. Pro-angiogenic capacities of microvesicles produced by skin wound myofibroblasts. Angiogenesis. 20 (3), 385-398 (2017).
- Rezzola, S., et al. In vitro and ex vivo retina angiogenesis assays. Angiogenesis. 17 (3), 429-442 (2014).
- Wang, X., Phan, D. T. T., George, S. C., Hughes, C. C. W., Lee, A. P. 3D Anastomosed microvascular network model with living capillary networks and endothelial cell-lined microfluidic channels. Methods in Molecular Biology. 1612, 325-344 (2017).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Laboratory Investigation; A Journal of Technical Methods and Pathology. 63 (1), 115-122 (1990).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. Journal of Cellular and Molecular Medicine. 13 (10), 4113-4136 (2009).
- Nowak-Sliwinska, P., et al. Consensus guidelines for the use and interpretation of angiogenesis assays. Angiogenesis. 21 (3), 425 (2018).
- Belair, D. G., Schwartz, M. P., Knudsen, T., Murphy, W. L. Human iPSC-derived endothelial cell sprouting assay in synthetic hydrogel arrays. Acta Biomaterialia. 39, 12-24 (2016).
- Bezenah, J. R., Kong, Y. P., Putnam, A. J. Evaluating the potential of endothelial cells derived from human induced pluripotent stem cells to form microvascular networks in 3D cultures. Scientific Reports. 8 (1), 2671 (2018).
- Henderson, A. R., Choi, H., Lee, E. Blood and lymphatic vasculatures on-chip platforms and their applications for organ-specific in vitro modeling. Micromachines (Basel). 11 (2), 147 (2020).
- Lin, D. S. Y., Guo, F., Zhang, B. Modeling organ-specific vasculature with organ-on-a-chip devices. Nanotechnology. 30 (2), 024002 (2019).
- Pollet, A., den Toonder, J. M. J. Recapitulating the vasculature using organ-on-chip technology. Bioengineering. 7 (1), 17 (2020).
- Cochrane, A., et al. Advanced in vitro models of vascular biology: Human induced pluripotent stem cells and organ-on-chip technology. Advanced Drug Delivery Reviews. 140, 68-77 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved