Method Article
في المختبر مقايسة تنبت ثلاثية الأبعاد لتكوين الأوعية الدموية باستخدام الخلايا الجذعية الجنينية للفأر لنمذجة أمراض الأوعية الدموية واختبار الأدوية
In This Article
Summary
يستخدم هذا الفحص الخلايا الجذعية الجنينية للفأر المتمايزة إلى أجسام جنينية مستزرعة في هلام الكولاجين 3D لتحليل العمليات البيولوجية التي تتحكم في تكوين الأوعية الدموية في المختبر. يمكن تطبيق هذه التقنية لاختبار الأدوية ، ونمذجة الأمراض ، ودراسة جينات معينة في سياق عمليات الحذف القاتلة من الناحية الجنينية.
Abstract
تمكن التطورات الحديثة في الخلايا الجذعية المستحثة متعددة القدرات (iPSC) وتقنيات تحرير الجينات من تطوير نماذج جديدة للأمراض القائمة على الخلايا البشرية لبرامج اكتشاف الأدوية المظهرية (PDD). على الرغم من أن هذه الأجهزة الجديدة يمكن أن تتنبأ بسلامة وفعالية الأدوية التجريبية في البشر بشكل أكثر دقة ، إلا أن تطويرها إلى العيادة لا يزال يعتمد بشدة على بيانات الثدييات ، ولا سيما استخدام نماذج أمراض الفئران. بالتوازي مع نماذج الأمراض العضوية البشرية أو الأعضاء على الرقاقة ، فإن تطوير نماذج الفئران ذات الصلة في المختبر هو بالتالي حاجة غير ملباة لتقييم فعالية الدواء المباشر ومقارنات السلامة بين الأنواع وفي الجسم الحي وفي الظروف المختبرية . هنا ، يتم وصف مقايسة تنبت الأوعية الدموية التي تستخدم الخلايا الجذعية الجنينية للفأر المتمايزة إلى أجسام جنينية (EBs). EBs الوعائية المزروعة على هلام الكولاجين 3D تطوير الأوعية الدموية الجديدة التي تتوسع ، وهي عملية تسمى تنبت تولد الأوعية. يلخص هذا النموذج السمات الرئيسية لتكوين الأوعية الدموية في الجسم الحي - تكوين الأوعية الدموية من شبكة الأوعية الدموية الموجودة مسبقا - بما في ذلك اختيار خلايا الطرف البطاني ، وهجرة الخلايا البطانية وتكاثرها ، وتوجيه الخلايا ، وتكوين الأنبوب ، وتجنيد الخلايا الجدارية. إنه قابل لفحص الأدوية والجينات التي تعدل تكوين الأوعية ويظهر أوجه التشابه مع فحوصات الأوعية الدموية ثلاثية الأبعاد (3D) الموصوفة مؤخرا بناء على تقنيات iPSC البشرية.
Introduction
في العقود الثلاثة الماضية ، تم استخدام اكتشاف الأدوية القائم على الهدف (TDD) على نطاق واسع في اكتشاف الأدوية من قبل صناعة الأدوية. يتضمن TDD هدفا جزيئيا محددا يلعب دورا مهما في المرض ويعتمد على تطوير أنظمة زراعة الخلايا البسيطة نسبيا والقراءات لفحص الأدوية1. تتضمن معظم نماذج الأمراض النموذجية المستخدمة في برامج TDD طرق زراعة الخلايا التقليدية مثل الخلايا السرطانية أو خطوط الخلايا الخالدة المزروعة داخل بيئات اصطناعية وركائز غير فسيولوجية. وعلى الرغم من أن العديد من هذه النماذج قد وفر أدوات ناجعة لتحديد الأدوية المرشحة الناجحة، فإن استخدام مثل هذه النظم يمكن أن يكون موضع شك بسبب ضعف أهميتها المرضية2.
بالنسبة لمعظم الأمراض ، تكون الآليات الأساسية معقدة بالفعل وغالبا ما توجد أنواع مختلفة من الخلايا ومسارات إشارات مستقلة ومجموعات متعددة من الجينات تساهم في النمط الظاهري لمرض معين. وينطبق هذا أيضا على الأمراض الوراثية حيث يكون السبب الرئيسي هو طفرة في جين واحد. مع ظهور تقنيات الخلايا الجذعية متعددة القدرات (iPSC) التي يسببها الإنسان وأدوات تحرير الجينات مؤخرا ، أصبح من الممكن الآن إنشاء عضويات ثلاثية الأبعاد ونماذج مرض عضو على رقاقة يمكن أن تلخص بشكل أفضل التعقيد البشري في الجسم الحي 3,4. يرتبط تطوير مثل هذه التقنيات بعودة الاهتمام ببرامج اكتشاف الأدوية ذات النمط الظاهري(PDD) 1. يمكن مقارنة PDD بالفحص التجريبي ، لأنها لا تعتمد على معرفة هوية هدف دواء معين أو فرضية حول دوره في المرض. ومن المسلم به الآن بشكل متزايد أن نهج PDD يساهم بقوة في اكتشاف الأدوية الأولى في فئتها5. نظرا لأن تطوير التقنيات العضوية البشرية والأعضاء على الرقاقة لا يزال في مهده ، فمن المتوقع أن توفر نماذج iPSC (المكملة بأدوات التصوير والتعلم الآليالمبتكرة 6,7) ، في المستقبل القريب ، نماذج جديدة متعددة للأمراض المعقدة القائمة على الخلايا لفحص الأدوية وبرامج PDD المرتبطة للتغلب على الإنتاجية الضعيفة لنهج TDD 8 ، 9.
في حين أن النماذج العضوية البشرية والأعضاء على الرقاقة يمكن أن توفر رؤى مهمة حول تعقيد المرض وتحديد الأدوية الجديدة ، فإن إدخال الأدوية في الممارسة السريرية الجديدة يعتمد أيضا بشدة على البيانات من النماذج الحيوانية لتقييم فعاليتها وسلامتها. من بينها ، الفئران المعدلة وراثيا هي بالتأكيد نماذج الثدييات الأكثر تفضيلا. لديهم العديد من المزايا لأن لديهم وقت جيل قصير نسبيا للثدييات ، ولديهم العديد من الأنماط الظاهرية المماثلة للأمراض البشرية ، ويمكن التلاعب بها وراثيا بسهولة. لذلك يتم استخدامها على نطاق واسع في برامج اكتشاف الأدوية10. ومع ذلك ، لا يزال سد الفجوة بين الفئران والبشر يمثل تحديا مهما11. إن تطوير نماذج الفئران في المختبر المكافئة للنماذج العضوية البشرية والأعضاء على الرقاقة يمكن أن يملأ هذه الفجوة جزئيا على الأقل لأنه سيسمح بإجراء مقارنات مباشرة بين فعالية الأدوية وسلامتها بين البيانات البشرية في الجسم الحي والبيانات البشرية في المختبر.
هنا ، يتم وصف مقايسة تنبت الأوعية الدموية في الأجسام الجنينية للفأر (EBs). تتكون الأوعية الدموية من الخلايا البطانية (البطانة الداخلية لجدران الأوعية) ، والخلايا الجدارية (خلايا العضلات الملساء الوعائية والخلايا المحيطة)12. يعتمد هذا البروتوكول على تمايز الخلايا الجذعية الجنينية للفأر (mESCs) إلى EBs الوعائية باستخدام قطرات معلقة تلخص تمايز الخلايا البطانية الجديدة وتمايز الخلايا الجدارية13,14. يمكن إنشاء ESCs الفئران بسهولة في الثقافة من اليوم المعزول 3.5 الكيسات الأريمية للفأر ذات الخلفيات الجينيةالمختلفة 15. كما أنها توفر إمكانيات للتحليل النسيلي ، وتتبع النسب ، ويمكن التلاعب بها وراثيا بسهولة لإنشاء نماذج المرض13,16.
نظرا لأن الأوعية الدموية تغذي جميع الأعضاء ، فليس من المستغرب أن ترتبط العديد من الأمراض إن لم يكن كلها بالتغيرات في الأوعية الدموية الدقيقة. في الحالات المرضية ، يمكن أن تتبنى الخلايا البطانية حالة نشطة أو يمكن أن تصبح مختلة وظيفيا مما يؤدي إلى موت الخلايا الجدارية أو الهجرة بعيدا عن الأوعية الدموية. يمكن أن يؤدي ذلك إلى تكوين الأوعية الدموية المفرط أو في خلخل الأوعية الدموية ، ويمكن أن يؤدي إلى تدفق دم غير طبيعي وحاجز الأوعية الدموية المعيب مما يؤدي إلى تسرب الخلايا المناعية ، والتهاب12،17،18،19. وبالتالي ، فإن الأبحاث الخاصة بتطوير الأدوية التي تعدل الأوعية الدموية عالية ، وقد تم بالفعل تحديد العديد من اللاعبين والمفاهيم الجزيئية للاستهداف العلاجي. في هذا السياق ، فإن البروتوكول الموصوف مناسب بشكل خاص لبناء نماذج الأمراض واختبار الأدوية لأنه يلخص السمات الرئيسية لتكوين الأوعية الدموية في الجسم الحي ، بما في ذلك اختيار الطرف البطاني وخلايا الساق ، وهجرة الخلايا البطانية وانتشارها ، وتوجيه الخلايا البطانية ، وتشكيل الأنبوب ، وتجنيد الخلايا الجدارية. كما يظهر أوجه التشابه مع فحوصات الأوعية الدموية 3D الموصوفة مؤخرا بناء على تقنيات iPSC البشرية20.
Protocol
1. الإعداد الإعلامي وثقافة mESC
- تحضير وسط مكيف +/- (CM +/-) باستخدام الملحق 1x Glasgow MEM (G-MEM BHK-21) متوسط مع 10٪ (حجم / حجم) مصل جنيني بقري معطل بالحرارة (FBS) ، 0.05 مللي متر β-ميركابتوإيثانول ، 1x أحماض أمينية غير أساسية (NEAA 1x) ، 2 mM L-glutamine ، و 1 mM بيروفات الصوديوم.
- تحضير وسط مكيف +/+ (CM +/+) باستخدام المكمل CM +/- وسط مع عامل تثبيط سرطان الدم (LIF) (1500 وحدة / مل) و 0.1 مللي مول β-ميركابتوإيثانول.
- تحضير وسط مكيف +/+ في وجود مثبطين (CM +/+ 2i) باستخدام الملحق CM +/+ المتوسطة مع 1 ميكرومتر PD0325901 و 3 ميكرومتر CHIR99021.
- تحضير محلول الجيلاتين 0.1٪ عن طريق خلط 25 مل من محلول الجيلاتين المسخن مسبقا 2٪ في 500 مل من محلول ملحي مخزن بالفوسفات بدون الكالسيوم والمغنيسيوم (DPBS).
- تحضير 10x التربسين فيرسين فوسفات (TVP 10x) العازلة عن طريق خلط التربسين (2.5٪) مع TVP 1x (9.5٪ 10x DPBS ، 1 mM EDTA ، 0.01٪ مصل دجاج ، 0.01٪ تربسين (2.5٪) في H2O) (نسبة 1:10 ، حجم / حجم).
ملاحظة: قم بتصفية جميع المحاليل من خلال مرشح المسام 0.22 ميكرومتر. قم بتخزين وسط الاستزراع عند -20 درجة مئوية على المدى الطويل واحتفظ بالكواشف الأخرى عند 4 درجات مئوية لمدة تصل إلى 3 أسابيع (انظر جدول المواد). - قم بتغطية صفيحتين من 12 بئرا بمحلول جيلاتين 0.1٪ (500 ميكرولتر لكل بئر) واحتضانهما لمدة 30 دقيقة في حاضنة CO 2 (37 درجة مئوية ، 5٪ CO2 ، جو رطب).
- اغسل الألواح المطلية بالجيلاتين باستخدام PBS وأضف 500 ميكرولتر من CM +/- متوسط.
- قم بإذابة قارورة من 1 × 106 من الخلايا الليفية الجنينية للفأر المشع المحفوظة بالتبريد (MEFs) عند 37 درجة مئوية وانقل تعليق الخلية إلى أنبوب مخروطي مع 5 مل من CM +/- وسط.
- أجهزة الطرد المركزي الخلايا عند 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة (RT). نضح الوسط وأعد تعليق حبيبات الخلية برفق في 12 مل من CM +/- وسط بتركيز 1.67 × 105 خلايا لكل مل.
- بذر 500 ميكرولتر من تعليق MEF في صفيحة استزراع خلية ذات 12 بئرا (2.4 × 105 خلايا لكل سم 2) واحتضان اللوحة طوال الليل (o / n) في حاضنة CO2.
- قم بإذابة قارورة واحدة من mESCs المحفوظة بالتبريد (1 × 106) في وسط CM +/+ 2i.
- قم بزرع معلق mESC على صفيحة بئر 12 مغسولة مسبقا مع MEFs في 1 مل من وسط CM +/+ 2i وانقل اللوحة إلى حاضنة CO2 . قم بتحديث الوسيط يوميا.
- عند التقاء 70٪ ، اغسل مستعمرات mESC باستخدام DPBS. أضف 150 ميكرولتر من المخزن المؤقت الدافئ 10x TVP واحتضانه في RT لمدة 30 ثانية لبدء التفكك الأنزيمي.
- قم بإزالة المخزن المؤقت TVP بعناية ، وأعد تعليق الخلايا في 1 مل من وسط CM +/+ 2i وافصل المستعمرات إلى خلايا مفردة عن طريق السحب اللطيف.
- قم بتمرير الخلايا عن طريق نقلها إلى لوحة زراعة خلايا جديدة ذات 12 بئرا مع MEFs (نسبة التقسيم: 1: 3-1: 5). تخلط بلطف لتوزيع الخلايا واحتضانها في حاضنة CO2 .
- قم بتحديث وسط الاستزراع (2-3 مل) ولاحظ نمو / مورفولوجيا الخلية يوميا. كرر التمرير التسلسلي عند التقاء 70٪ كل 2 أيام. قم بالتبديل إلى وسيط CM +/+ لمقطعين قبل بدء تمايز الخلايا.
2. تشكيل EB في قطرة معلقة
- تحضير وسط تمايز الأديم المتوسط الطازج عن طريق استكمال وسط CM +/- بعامل نمو الخلايا الليفية الأساسي (bFGF) (50 نانوغرام · مل -1) ومع البروتين المورفولوجي للعظام 4 (BMP-4) (5 نانوغرام · مل -1) والاحتفاظ به عند 4 درجات مئوية حتى الاستخدام.
- قم بتغطية بئر واحد من صفيحة زراعة الخلايا المكونة من 6 آبار ب 500 ميكرولتر من محلول الجيلاتين 0.1٪ وضعه في حاضنة CO2 لمدة 30 دقيقة.
- اغسل الألواح المطلية بالجيلاتين باستخدام PBS وأضف 500 ميكرولتر من CM +/- متوسط.
- للحصول على مجموعة نقية من mESCs ، قم بتثريبسين صفيحة زراعة الخلايا باستخدام مخزن مؤقت 10x TVP لمدة 30 ثانية في RT ، وأعد تعليق الخلايا في وسط تمايز الأديم المتوسط سعة 1 مل ثم انقلها إلى لوحة 6 آبار مغلفة بالجيلاتين لمدة 30 دقيقة مما يسمح ل MEFs بالالتصاق بينما تظل mESCs في حالة تعليق.
- اجمع معلق الخلية في أنبوب مخروطي سعة 50 مل وعد الخلايا باستخدام مقياس الدم Neubauer وصبغة Trypan الزرقاء لاستبعاد الخلايا الحية / الميتة.
- أجهزة الطرد المركزي الخلايا في 200 × غرام لمدة 5 دقائق في RT. إزالة المادة الطافية وإعادة تعليق بيليه الخلية في وسط تمايز الأديم المتوسط للوصول إلى 4.55 × 104 خلايا لكل مل.
- املأ قاع أطباق البوليسترين منخفضة المرفق 94 مم ب 15 مل من الماء المعقم.
ملاحظة: ستكون هناك حاجة إلى أربعة أطباق تحتوي على قطرات معلقة (1.6 × 105 خلايا في 3.52 مل من الوسط) لاختبار حالة معينة باستخدام مقايسة تولد الأوعية الدموية ثلاثية الأبعاد. - انقل تعليق الخلية إلى خزان بلاستيكي معقم وقم بتحميل أربعة مواضع من ماصة متعددة القنوات مع 22 ميكرولتر من تعليق الخلية لكل قناة (1 × 103 خلايا لكل قطرة 22 ميكرولتر).
- ارفع واقلب غطاء الطبق مقاس 94 مم وضعه على السطح النظيف لخزانة التدفق بحيث يكون الجانب الداخلي متجها لأعلى.
- إيداع 40 قطرات من تعليق الخلية على السطح الداخلي لكل غطاء. اقلب الغطاء بعناية دون إزعاج وضعه مرة أخرى على الطبق ، بحيث تواجه القطرات الماء.
- احتضان الأطباق في حاضنة CO2 . اعتبر هذا يوم التمايز 0. الحفاظ على لوحات لمدة 4 أيام لتشكيل EBs.
3. مقايسة المنافسة لموضع خلية الطرف
- استزراع خط واحد من الفلورسنت وخط واحد غير فلوري mESC كما هو موضح سابقا13. على سبيل المثال ، يتم استخدام 7ACS / EYFP mESCs المسمى باللون الأصفر و R1 mESCs.
- قم بإعداد EBs الفسيفسائية عن طريق خلط كميات متساوية من خطي mESC (نسبة 1: 1) واحتضان أطباق القطرة المعلقة في حاضنة CO 2 كما هو موضح في الخطوة2 .
4. ثقافة EBs العائمة لتمايز الأوعية الدموية
- قبل جمع EBs من القطرات المعلقة ، قم بإعداد ما يلي.
- تحضير محلول أجار 5٪ في H2O وتعقيمه عن طريق التعقيم (20 دقيقة عند 120 درجة مئوية).
- استخدم محلول أجار 5٪ الدافئ لتحضير وسط G-MEM BHK-21 الذي يحتوي على 1٪ أجار وصب 3 مل بسرعة في أحد أطباق البوليسترين 60 مم. اترك الآجار يتجمد لمدة 1 ساعة في RT. قم بتخزين الأطباق على حرارة 4 درجات مئوية حتى الاستخدام.
- قم بإعداد وسط تمايز وعائي جديد 2x عن طريق استكمال CM +/- الوسط مع bFGF (100 نانوغرام · مل -1) و VEGF-A (50 نانوغرام · مل -1). يخزن الوسط على حرارة 4 درجات مئوية حتى الاستخدام.
- اجمع القطرات المعلقة في أنبوب مخروطي سعة 15 مل باستخدام ماصة P1000 وقم بإزالة المادة الطافية بعد بضع دقائق من ترسيب EB.
- أعد تعليق EBs في 3 مل من وسط تمايز الأوعية الدموية 2x ، وانقل تعليق EB إلى طبق واحد مطلي بالآجار ووزع EBs بشكل متجانس لتجنب التجميع.
- احتضان الأطباق في حاضنة CO2 وتحديث الوسط كل يومين حتى اليوم 9 باستخدام وسط تمايز الأوعية الدموية 1x في وجود bFGF (50 ng · mL-1) و VEGF-A (25 ng · mL-1).
- بدلا من ذلك ، أضف عامل النمو المشتق من الصفائح الدموية- BB (PDGF-BB) (10 نانوغرام · مل -1 في اليوم 4 و 5 نانوغرام · مل -1 في اليوم 6 واليوم 8) إلى وسط تمايز الأوعية الدموية لتعزيز تمايز الخلايا الجدارية.
5. تحليل التدفق الخلوي
- اجمع EBs البالغة من العمر 9 أيام في أنبوب مخروطي سعة 15 مل باستخدام ماصة P1000 واغسلها مرة واحدة باستخدام برنامج تلفزيوني دافئ.
- أضف 1 مل من وسط G-MEM BHK-21 الذي يحتوي على 0.2 مجم · مل -1 من كولاجيناز أ واحتضان الخلايا في حاضنة CO2 لمدة 5 دقائق.
- افصل EBs عن طريق السحب برفق لأعلى ولأسفل باستخدام ماصة P1000.
- أوقف نشاط الكولاجين بإضافة 1 مل من وسط G-MEM BHK-21 البارد مع 10٪ FBS.
- أجهزة الطرد المركزي الخلايا في 200 × غرام لمدة 5 دقائق في RT.
- أعد تعليق الخلايا في 500 ميكرولتر من PBS مع 2٪ FBS.
- عد الخلايا باستخدام مقياس الدم Neubauer.
- أعد تعليق 400000 خلية في 100 ميكرولتر من PBS مع 2٪ FBS لكل حالة تلطيخ.
- احتضان الخلايا لمدة 45 دقيقة عند 4 درجات مئوية بالأجسام المضادة التالية: APC الأجسام المضادة للفأر المترافق PECAM-1 (استنساخ MEC13.3) والفئران المترافقة FITC المضادة للفأر CD45 (استنساخ 30-F11) أو الأجسام المضادة للتحكم في النمط المتماثل.
- اغسل الخلايا مرتين باستخدام 1 مل من برنامج تلفزيوني يحتوي على 2٪ FBS.
- أعد تعليق الخلايا للوصول إلى تركيز نهائي قدره 5 × 106 خلايا لكل مل.
- قم بتصفية الخلايا باستخدام أنبوب اختبار البوليسترين المستدير القاع ، مع غطاء مفاجئ لمصفاة الخلية.
- تحليل 20000 حدث PECAM-1 (+) عن طريق قياس التدفق الخلوي.
6.3D تنبت مقايسة تكوين الأوعية وتلطيخ المناعي
- في اليوم 9 ، قم بإعداد وسط تنبت بإضافة 10٪ FBS (حجم / حجم) ، bFGF (50 نانوغرام · مل -1) ، VEGF-A (25 نانوغرام · مل -1) ، الإريثروبويتين البشري المؤتلف (hEPO) (20 نانوغرام · مل -1) ، إنترلوكين -6 (IL-6) (10 نانوغرام · مل -1) ، 0.05 مللي مول β-ميركابتوإيثانول ، NEAA (1x) ، L- الجلوتامين (1x) ، بيروفات الصوديوم (1x) ، النوع الأول من الكولاجين ذيل الفئران (1.25 ملغ · مل -1) ، وهيدروكسيد الصوديوم (3.1 مللي مول) إلى وسط GMEM BHK-1.
- لتجنب هلام الكولاجين ، حافظ على وسط النبتة على الثلج حتى الاستخدام.
- لتقييم تأثير الجزيئات المؤيدة / المضادة لتولد الأوعية ، أضف الدواء أو السيارة المختارة إلى وسط التنبت عند التركيز المحدد.
- اجمع EBs البالغة من العمر 9 أيام من طبق أجار واحد 60 مم في أنبوب مخروطي سعة 15 مل (أي ما يعادل حالة واحدة) وقم بإزالة المادة الطافية بعد بضع دقائق من الترسيب.
- يغطى قاع طبق استزراع 35 مم ب 1 مل من الوسط المنبت ويحتضنه على حرارة 37 درجة مئوية لمدة 5 دقائق للحث على الهلام.
- أعد تعليق EBs في 2 مل من وسط النبتة البارد.
- انقل التعليق إلى طبق الاستزراع 35 مم المطلي بالطبقة الأولى من وسط التنبت.
- قم بتوزيع EBs في جميع أنحاء اللوحة وتأكد من أنها على مسافة متساوية من بعضها البعض. احتضان الطبق في حاضنة CO2 . يحدث تكوين البرعم الأول في غضون 24-48 ساعة.
- في اليوم 12 ، يتم نقل هلام الكولاجين الذي يحتوي على EBs بعناية إلى شريحة زجاجية (75 × 26 مم) باستخدام ملعقة.
- قم بإزالة السائل الزائد باستخدام ماصة (P1000) وقم بتجفيف الجل عن طريق وضع ورقة شاش من الكتان النايلون وبطاقات الترشيح الماصة (ورق نشاف الجل) فوق الجل. الضغط عن طريق وضع وزن (250 جم) لمدة 2 دقيقة. قم بإزالة أوراق النايلون / الترشيح بعناية واترك الشرائح تجف في الهواء لمدة 30 دقيقة في RT.
- اغسل الشرائح ثلاث مرات باستخدام PBS لمدة 5 دقائق في RT.
- إصلاح EBs باستخدام محلول الزنك (انظر جدول المواد) o / n عند 4 درجات مئوية. بدلا من ذلك ، قم بتثبيت EBs الفلورية الفسيفسائية مع بارافورمالدهيد (PFA) (4٪) o / n عند 4 درجات مئوية في الظلام.
- إزالة المثبت. اغسل الشرائح خمس مرات باستخدام برنامج تلفزيوني لمدة 5 دقائق في RT.
- نفاذية EBs في PBS التي تحتوي على 0.1٪ Triton-X100 لمدة 15 دقيقة في RT.
- قم بإزالة محلول النفاذية. اغسل الشرائح خمس مرات باستخدام برنامج تلفزيوني لمدة 5 دقائق.
- احتضان EBs في المخزن المؤقت للحظر (PBS مع 2٪ ألبومين مصل البقر ، BSA) لمدة 1 ساعة في RT.
- لتلطيخ براعم البطانية ، استخدم الجسم المضاد الأولي المضاد للفأر المضاد ل PECAM-1 (تخفيف 1: 100) في منع المخزن المؤقت o / n عند 4 درجات مئوية.
- اغسل الشرائح خمس مرات باستخدام برنامج تلفزيوني لمدة 5 دقائق.
- احتضن الشرائح بالجسم المضاد الثانوي المضاد للفئران Alexa 555 في مانع المخزن المؤقت (تخفيف 1: 250) وعند الحاجة ، مع الجسم المضاد المترافق FITC المضاد ل α-SMA في منع المخزن المؤقت (1: 250 تخفيف) لتلطيخ الخلايا الجدارية لمدة 2 ساعة في RT في الظلام.
- اغسل الشرائح ثلاث مرات باستخدام PBS لمدة 5 دقائق ومرة واحدة باستخدام H20 قبل تركيبها.
7. التصوير البؤري والتحليل المورفومتري والكمي لبراعم البطانة EB
- الحصول على صور عالية الدقة ل EBs المناعية عن طريق دمج المستوى البؤري (z-stacking) باستخدام مجهر متحد البؤر. استخدم هدف التكبير 10x لتصوير EBs كاملة.
- قم بتحليل الصور التي تم الحصول عليها باستخدام ImageJ لتقييم التشكل وتحديد خصائص براعم البطانة الإيجابية PECAM-1 وفقا لطرق القياس الكمي المعمول بها13،14،21.
- احسب متوسط عدد البراعم البطانية لكل EBs عن طريق حساب إجمالي عدد البراعم يدويا لكل EBs فردية.
- قم بقياس أطوال البراعم الفردية باستخدام أداة الرسم ImageJ. حدد قاعدة البرعم البطاني بدءا من منطقة EB الأساسية وارسم خطا يدويا حتى ينتهي طرف البرعم.
- احسب متوسط عدد خلايا الطرف لكل برعم عن طريق حساب عدد خلايا الطرف يدويا لكل برعم فردي ثم احسب المتوسط لكل EB.
- احسب اتجاه الفيلوبوديا عن طريق تحديد محور البرعم الأصلي يدويا وقياس الزاوية الحادة بينهما باستخدام أداة زاوية برنامج ImageJ. احسب عدد البراعم ذات الاتجاه >50 درجة وقسمها على إجمالي عدد براعم EB ذات الاهتمام.
ملاحظة: تراوحت الزوايا دائما من 0 درجة إلى 90 درجة.
- الحصول على صور عالية الدقة من EBs المناعية باستخدام المجهر متحد البؤر. استخدم هدف التكبير 40x لتحقيق صور عالية الدقة للبراعم البطانية المفردة.
- حدد تغطية الوعاء لبراعم EC الإيجابية PECAM-1 المحاطة ب MCs إيجابية α-SMA باستخدام برنامج ImageJ.
- قم بتقسيم الصور المدمجة إلى قنوات حمراء وخضراء منفصلة.
- تحويل الصور إلى شكلها الثنائي.
- قم بقياس المساحة الخلوية الكلية للبراعم التي تشغلها بشكل منفصل PECAM-1 (الخلايا البطانية الموسومة باللون الأحمر) والخلايا الإيجابية α-SMA (الخلايا الجدارية المسماة باللون الأخضر).
- قم بإنشاء الصورة المدمجة باستخدام وظيفة حاسبة الصورة وعامل التشغيل AND. قم بقياس المساحة الخلوية الكلية للصورة. لحساب التغطية ، قسم مساحة الصورة المترجمة على مساحة الصورة الثنائية PECAM-1.
- لتحليل منافسة الخلايا على موضع خلية الطرف / الساق البطانية للبراعم التي طورتها الفسيفساء EBs ، قم بتسجيل عدد خلايا الطرف يدويا وتحديد أصلها الجيني بناء على إشارة التألق. احسب القيم المتوسطة لكل EB.
النتائج
يظهر الشكل 1 نظرة عامة على البروتوكول لفحص تنبت الأوعية الدموية. تم فصل EBs البالغة من العمر تسعة أيام المشتقة من ثلاثة خطوط 129 / Ola mESC مستقلة (Z / Red و R1 و E14) إنزيميا إلى خلايا مفردة باستخدام كولاجيناز A. تم تلطيخ الخلايا من أجل PECAM-1 وتحليلها بواسطة فرز الخلايا المنشط بالفلورة (FACS) كما هو موضح. أظهرت جميع خطوط الخلايا تمايز بطاني قوي ، ولم يلاحظ أي اختلافات في قدرتها على التمايز إلى خلايا بطانية. أنتجت جميع خطوط الخلايا حوالي 10.5٪ ± 1.3٪ من الخلايا البطانية (الشكل 2 أ). كما تم تحديد مستويات التعبير النسبية لعلامات الخلايا PAN-endotelial في مجموعات خلايا PECAM-1 (+). كانت مستويات تعبير mRNA لجميع العلامات التي تم تحليلها (Flk1 و Flt1 و Flt4 و Eng و Tie2 و Cdh5) قابلة للمقارنة بين خطوط الخلايا والتجارب ، مما يؤكد متانة بروتوكول التمايز (الشكل 2B). أعربت مجموعات خلايا PECAM-1 (+) فقط عن مستويات منخفضة جدا من mRNA من العلامات الشريانية (Notch1 و Efnb2) أو الوريدية (Couptf2 و Ephb4) التي تدعم الحالة غير الناضجة نسبيا للخلايا البطانية التي تم إنشاؤها بواسطة البروتوكول (الشكل 2C).
ثم تم إثبات قدرة نموذج EB الذي ينبت الأوعية الدموية على فحص الأدوية التي تعدل تكوين الأوعية (الشكل 3). تم اختبار DC101 و DAPT (N- [N- (3،5-ثنائي فلورو فيناسيتيل) -Lalanyl] -S-phenylglycine t-butylester). تستخدم هذه المركبات على نطاق واسع في الفئران لمنع تكوين الأوعية الدموية على التوالي عن طريق تثبيط نشاط VEGFR2 أو لتعزيز تمايز خلايا الطرف البطاني وتشكيل ضفيرة وعائية كثيفة عن طريق استهداف إشارات الشق (الشكل 3 أ). تعد كل من مسارات إشارات VEGF و Notch من المنظمين الرئيسيين لتنبت الأوعية الدموية في الجسم الحي. تم تقييم تأثيرات التركيزات المختلفة من DC101 و DAPT في EBs المطلية بالكولاجين I. جرعات عالية من DC101 تتراوح بين 6-30 ملغ · يثبط L-1 كلا من عدد وطول براعم الوعاء بينما كان ل DAPT تأثيرات معاكسة بجرعة 1 ميكرومول · L-1 (الشكل 3B-C). كما يتم توفير صور عالية التكبير لبراعم الأوعية الملطخة ل PECAM-1 من EBs المستزرعة في وجود DAPT (الشكل 3D). DAPT حتى عند الجرعات المنخفضة التي تتراوح من 0.5-1 ميكرومول · زاد L-1 بقوة من عدد خلايا الطرف البطاني مع براعم الأوعية التي لها نمط ظاهري مضلل (الشكل 3D-F). أدت الجرعة العالية من DAPT أيضا إلى اندماج الأوعية وتشكيل مناطق خلايا بطانية كبيرة ومسطحة دون تنظيم (الشكل 3 أ). أكدت النتائج قدرة النموذج على اختبار الأدوية التي إما تعزز أو تمنع تكوين الأوعية.
للتأكد من أن هذا النموذج مناسب لمحاكاة أمراض الأوعية الدموية ، يتم توفير الصور متحدة البؤر ل EBs المشتقة من Acvrl1 +/- mESCs. يشفر جين Acvrl1 ل ALK1 (كيناز 1 الشبيه بمستقبلات Activin) ، وهو مستقبل يتم التعبير عنه على وجه التحديد في الخلايا البطانية التي إذا تحورت تكون مسؤولة عن تطور مرض نادر في الأوعية الدموية مع خلل التنسج الوعائي يسمى توسع الشعيرات النزفي الوراثي (HHT). كشفت صورة عالية التكبير للبراعم البطانية Acvrl1 +/- أن لديهم المزيد من خلايا الطرف البطاني والمزيد من الفروع لكل برعم كانت بزوايا عشوائية بالنسبة للأوعية الأم. أكدت هذه في المختبر النمط الظاهري المضلل كما لوحظ في الفئران HHT (الشكل 4).
من خلال تكوين EBs الخيمرية التي تحتوي على علامات mESC متمايزة و mESC لنمط وراثي معين ، يتم تضمين بروتوكول بديل لدراسة عملية اختيار الطرف البطاني (الشكل 5A-C). حددت صورة متحدة البؤر لبراعم الأوعية الموسومة PECAM-1 الأصل الجيني لخلايا الطرف البطاني الرائدة (الشكل 5B). أدت مخاليط خط mESC من النوع البري YFP (البروتين الفلوري الأصفر) بنسبة 1: 1 مع خط واحد من النوع البري mESC غير المسمى باستمرار إلى المساهمة المتساوية لكل مجموعة في خلايا الطرف البطاني الرائدة (الشكل 5C).
هذا البروتوكول مناسب أيضا لتحديد تغطية الخلايا الجدارية لتنبت الوعاء. تم تثبيت EBs التي تخضع لتكوين الأوعية الدموية وتلطيخها ل PECAM-1 (الخلايا البطانية ، الحمراء) وأكتين العضلات الملساء α (α-SMA) (الخلايا الجدارية ، الخضراء) (الشكل 5D). كشفت صورة عالية التكبير كيف كان تنبت وعاء واحد محاطا بخلايا جدارية (الشكل 5E ، على اليسار). تم إجراء التحويل الثنائي بعد فصل قناة اللون (الشكل F-G) لتحديد نسبة وعاء PECAM-1 (+) المغطى بالخلايا الجدارية α-SMA (+) باستخدام برنامج ImageJ (الشكل 5H).

الشكل 1: الجدول الزمني لإجراءات البروتوكول. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
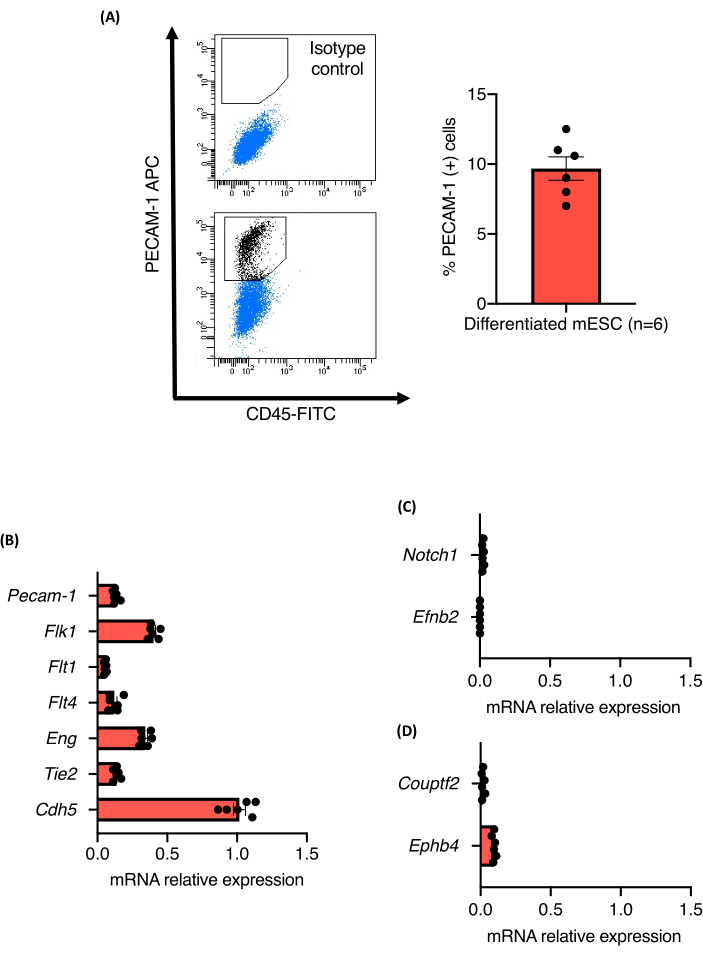
الشكل 2: توصيف ECs المشتقة من تمايز الأوعية الدموية mESC داخل EBs. (أ) تحليل التدفق الخلوي لتعبير CD31 من EBs البالغة من العمر 9 أيام والقياس الكمي للنسبة المئوية لخلايا Pecam-1 (+). (B-D) مستويات تعبير mRNA من Pecam-1 و Flk1 و Flt1 و Flt4 و Eng و Tie2 و Cdh5 و Notch1 و EfnB2 و Couptf2 و EphB4 في الخلايا البطانية المصنفة من EBs البالغة من العمر 9 أيام. تمثل أشرطة الخطأ متوسط الخطأ القياسي ± للمتوسط (SEM). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
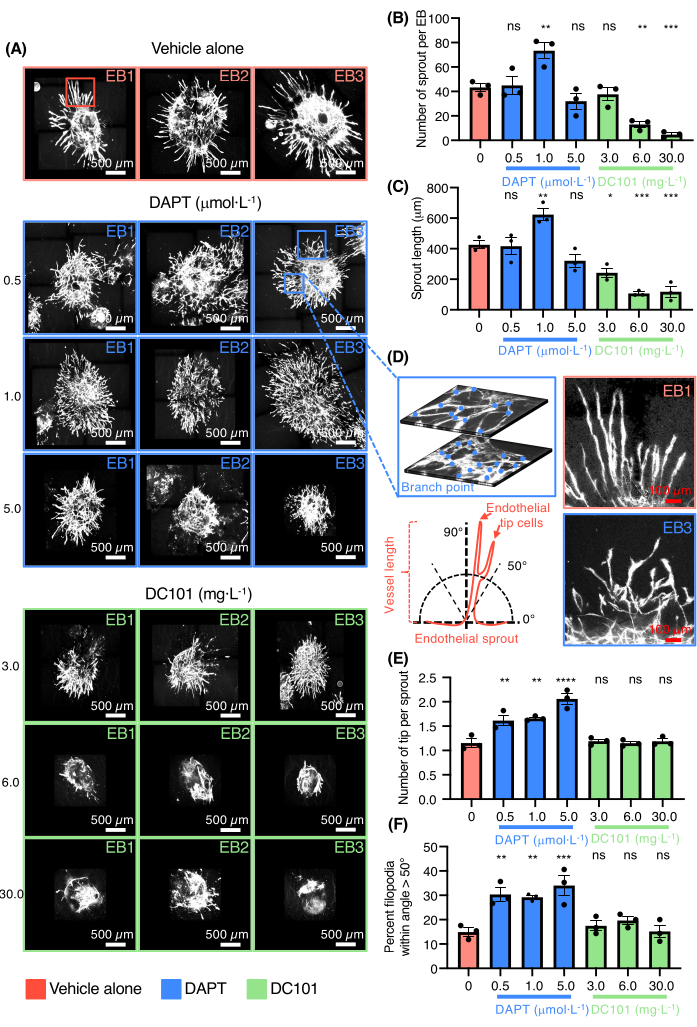
الشكل 3: مقايسة تولد الأوعية الدموية ثلاثية الأبعاد لاختبار الأدوية. (أ) صور متحدة البؤر لثلاثة EBs تمثيلية ملطخة ل Pecam-1 (خلايا بيضاء بطانية) تعامل بالمركبة وحدها ، DAPT (0.5 μmol · L-1 ، 1.0 ميكرومول · L-1 ، 5.0 ميكرومول · L-1) أو DC101 (3 ملغ · L-1 ، 6 ملغ · L-1 ، 30 ملغ · L-1). (ب) التحديد الكمي لعدد البراعم لكل EB. ج: تحديد طول البرعم. (د) في اللوحة العلوية اليسرى ، تكبير عال للبراعم البطانية يوضح تعقيد الشبكة ونقطة الفرع التي تعد على طبقتين مختلفتين من نفس EB ، على اللوحة السفلية اليسرى رسم تخطيطي يمثل طريقة قياس اتجاه البرعم البطاني. على اللوحة العلوية اليمنى ، تكبير عالي للبراعم البطانية من السيارة وحدها وعلى اللوحة اليمنى السفلية ، تكبير عالي للبراعم البطانية من DAPT (0.5 ميكرومول · L-1) الشرط. ه: التحديد الكمي لعدد خلايا الأطراف لكل برعم. (F) التحديد الكمي للنسبة المئوية للفيلوبوديا ضمن الزاوية >50 درجة. تمثل جميع الأشرطة متوسط قيم SEM و p ± من اختبار ANOVA أحادي الاتجاه غير المقترن. ns = غير معنوي ، * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 ، و ****p < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الأوعية المعيبة التي تنبت في توسع الشعيرات النزفي الوراثي EBs. في اللوحة العلوية ، صور متحدة البؤر ل EBs تمثيلية عمرها 12 يوما من Acvrl1 +/+ و Acvrl1 +/- الأنماط الجينية الملطخة ل Pecam-1 (الخلايا البطانية البيضاء). على اللوحة السفلية ، يظهر التكبير العالي للبراعم البطانية Acvrl1 + / - (مربع أبيض من اللوحة العلوية) العديد من خلايا الطرف (الأسهم الحمراء) ونقاط الفرع البطانية (النقاط الزرقاء) والنمط الظاهري المضلل (الأسهم الخضراء). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: دراسة موضع خلية الطرف / الساق ونضج الوعاء باستخدام مقايسة تنبت 3D. (أ) صورة متحدة البؤر ل EB خيمري تمثيلي عمره 12 يوما مصنوع من خط خلية من النوع البري R1 مختلط 1: 1 مع خط خلية من النوع البري 7ACS / EYFP ملطخ ل Pecam-1 (خلايا حمراء بطانية). تشير الأسهم الحمراء إلى خلايا تلميح من خط خلية R1 وتشير الأسهم الخضراء إلى خلايا تلميح من خط خلية 7ACS / EYFP. (ب) تكبير كبير لبرعم بطاني يوضح توزيع الخلية البطانية R1 و 7ACS / EYFP على طول البرعم. (ج) التحديد الكمي لخلايا طرف التنميط الجيني النسبي من EBs من النوع البري التمثيلي. (د) صورة متحدة البؤر ل EB تمثيلي يبلغ من العمر 12 يوما ملطخا ب Pecam-1 (خلايا حمراء بطانية) و α-SMA (خلايا جدارية خضراء). (ه) تكبير كبير لتنبت بطاني (مربع أبيض مستطيل منقط من د) يوضح تفاعل الخلايا الجدارية / البطانية. (ف-ز) صور البرعم البطاني الملون والصور المحولة الثنائية المرتبطة بها. (H) صورة ثنائية لتلطيخ Pecam-1 و α-SMA الموضعي المشترك. نسبة براعم الخلايا البطانية التي تغطيها الخلايا الجدارية. تمثل جميع الأشرطة متوسط ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول مقايسة تنبت الأوعية الدموية غير المتحيزة والقوية والقابلة للتكرار القائمة على 3D EB والتي تكون قابلة لفحص الأدوية والجينات التي تعدل تكوين الأوعية. توفر هذه الطريقة مزايا على العديد من المقايسات ثنائية الأبعاد (2D) المستخدمة على نطاق واسع باستخدام ثقافات الخلايا البطانية مثل الخلايا البطانية الوريدية للوريد السري البشري (HUVECs) لمراقبة الهجرة (مقايسة الخدش الجانبي أو مقايسة غرفة بويدن)22،23 أو الانتشار (عد رقم الخلية ، والكشف عن تخليق الحمض النووي ، والكشف عن علامات الانتشار ، أو المقايسات الأيضية)24 من حيث أنه يسمح بشكل فريد بدراسة كل من تمايز الخلايا البطانية والجدارية وتنظيمها في شبكة الأوعية الدموية التي تحاكي الخطوات الرئيسية لتنبت تولد الأوعية. تتضمن هذه الخطوات اختيار خلايا الطرف البطاني ، وتكاثر خلايا الساق ، والتوجه المكاني وهجرة تنبت الوعاء ، وتجنيد الخلايا الجدارية إلى الأوعية الدموية الوليدة25. كما يوفر مزايا للعديد من نماذج تولد الأوعية 3D. عادة ما تستخدم حبة الفيبرين26،27 أو مقايسة هلام الكولاجين28،29،30 التي تحاكي تكوين الأنابيب HUVECs أو الخلايا البطانية المكونة للمستعمرة البطانية (ECFC-EC) لأنها تتمتع بمعدل تكاثري مرتفع ولكنها غير مناسبة للخلايا البطانية الأولية للفأر التي يصعب الحفاظ عليها في الثقافة. يمكن لشبكية العين خارج الجسم الحي31 أو فحص الأعضاء الدقيقةالوعائية 32 أن يلخص جيدا جميع خطوات تكوين الأوعية الدموية ولكن لديهم إجراءات تجريبية معقدة وليسوا مناسبين للأدوية عالية الإنتاجية أو الفحص الجيني. وينطبق هذا أيضا على مقايسة الحلقة الأبهرية خارج الجسم الحي 33,34 وبالنسبة للعديد من المقايسات في الجسم الحي مثل الورم المزروع في الفئران أو دراسات فقدان الوظيفة في الفئران التي غالبا ما تكون التكلفة العالية والصعوبات في الحصول على كمية كبيرة من البيانات 35. يكمل هذا البروتوكول أيضا بشكل جيد فحوصات تكوين الأوعية الدموية المماثلة في المختبر باستخدام iPSCs البشرية مما يسمح بإجراء مقارنات بين بيانات الماوس والإنسان. على الرغم من أنه من المهم ملاحظة أن الخلايا البطانية البشرية المشتقة من iPSC تظهر قدرة أقل على الإنبات من خلايا الفئران36,37.
الطريقة التي تم تطويرها هنا لها أيضا بعض القيود. لا يمكنه تقييم آثار تدفق السوائل على نضوج الأوعية الدموية ونفاذية الأوعية الدموية ولا ينتج أوعية دموية ناشئة في بيئة أنسجة معينة مقارنة بالأجهزة المصنعة الدقيقة الحديثة قيد التطوير. في الواقع ، يمكن لتقنيات الأعضاء على الرقاقة التي تجمع بين الموائع الدقيقة وهندسة الأنسجة أن توفر للخلايا البطانية المستزرعة بيئة دقيقة مماثلة لتلك الموجودة في الجسم الحي38,39. تحتوي أنظمة الموائع الدقيقة على تركيبة المصفوفة الصحيحة خارج الخلية وهي مصممة لإنتاج إشارات ميكانيكية مثل إجهاد القص. تم تصميم بعضها لدمج الخلايا الجدارية والخلايا الداعمة الأخرى لنسيج معين أو يمكن أن تولد تدرجات كيميائية. أنها تحتوي على شبكات من القنوات المملوءة بالسوائل على نطاق ميكرون والتي تشبه في الحجم والبنية الشعيرات الدموية. تتيح تقنيات الجهاز على الرقاقة أيضا القياس الكمي لوظائف الأوعية الدموية المحددة ، بما في ذلك النفاذية والمقاومة الكهربائية البطانية المتحولة. على الرغم من أن تقنيات الجهاز على الرقاقة تبشر بالخير ، إلا أنها تتجاوز بكثير الخبرة البحثية لمعظم مختبرات الأحياء ، ولا تزال بحاجة إلى توحيد مناسب ، وتتطلب تقنيات تصنيع متخصصة. إن تسويق تصنيع تكنولوجيا الأعضاء على الرقاقة قد بدأ للتو ، وتعتبر هذه الأنظمة باهظة التكلفة والوقت لشركات الأدوية في الوقت الحالي40,41.
هناك العديد من الخطوات الحاسمة التي يجب أخذها في الاعتبار. استخدم خلايا عالية الجودة تعبر بقوة عن علامات مقبولة جيدا (Nanog و Oct4 و Sox2 و SSEA-1) للحالة متعددة القدرات. من الضروري مراقبة نموها بعناية وشكل خلية mES وحجم وشكل مستعمرات mES. نظرا لأن استقرار النمط النووي عشوائي في الخلايا المستزرعة ، فإن إعادة تقييمه بعد مرور واسع النطاق أمر ضروري. يوصى باستخدام المنتجات التي تم اختبارها بالفعل لثقافة mESC واختبار مغذيات MEF ومصل العجل الجنيني وجميع المركبات الكيميائية لعدة مقاطع لاكتشاف ما إذا كانت mESCs تحافظ على خصائصها الخلوية أو ما إذا كانت تمايز أو تكتسب نمطا ظاهريا فوق الأرومة. يجب تحديث الوسط يوميا ويجب عدم السماح لمستعمرات mESC بأن تصبح كبيرة جدا وكثيفة. أخيرا ، يجب زراعة mESCs على الأقل لفترتين بدون 2i قبل التمايز لضمان أفضل إنتاجية للخلايا البطانية.
يتضمن التمايز البطاني خطوتين مهمتين: تكوين EBs باستخدام طريقة السقوط المعلق وثقافتها في ظل ظروف عائمة في وجود وسط تمايز الأوعية الدموية13,14. يجب تقليل حركة أطباق القطرة المعلقة لتحقيق تجميع موحد للخلايا. يتراوح عدد mESCs المستخدمة لتشكيل إجمالي في معظم الحالات بين 800-1000 خلية ، ولكن قد تحتاج إلى تحسين إذا كان لدى mESCs خلفية وراثية مختلفة عن 129 / ola لضمان التمايز الأمثل إلى EBs الوعائية. عند الاستزراع في ظل ظروف عائمة ، يجب توزيع EBs بعناية وتجنب الحركة التي تفضل تكتل EB.
يتم استزراع EBs أخيرا في هلام الكولاجين الأول لتشكيل براعم الأوعية. يجب تحضير الوسط الوعائي طازجا وبمجرد مزجه مع الكولاجين ، يجب الحفاظ عليه على الجليد لتجنب الهلام التلقائي. في حالة اختبار المخدرات ، تضاف الأدوية في الخليط البارد بالتركيز الصحيح خلال هذه الخطوة. يعد ضبط الأس الهيدروجيني باستخدام هيدروكسيد الصوديوم قبل تعليق EBs أمرا بالغ الأهمية ، وإلا فإن حموضة الكولاجين ستسبب سمية الخلايا. وأخيرا، ينبغي أن تنتشر EBs على مسافة متساوية من بعضها البعض لضمان نتائج قابلة للتكرار.
في الختام ، تقدم هذه الطريقة مقايسة تنبت الأوعية الدموية 3D على أساس mESC التي لديها المتانة المطلوبة وقابلية التوسع لاستخدامها في الفحص الجيني كما وصفه مؤخرا Elling U. et al. التي ولدت بنك هابلوبانك كبير من mESC16 الطافر هيمي / متماثل الزيجوت ولبرنامج اكتشاف الأدوية المظهرية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من خلال منح من Nederlandse organisatie voor gezondheidsonderzoek en zorginnovatie (ZonMW 446002501) ، Health Holland (LSHM19057-H040) ، برنامج الزملاء الرائد Marie Skłodowska-Curie COFUND ، ومن قبل جمعية Maladie de Rendu-Osler (AMRO).
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Milipore, Merck | 805740 | Biohazard: adequate safety instructions should be taken when handling |
| Agar Noble | Difco, BD Pharmigen | 214220 | |
| Alexa Fluo 555 goat anti rat IgG | Life technologies | A21434 | |
| APC conjugated rat anti-mouse PECAM-1 antibody (clone MEC13.3) | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control (Clone R35-95) | BD Biosciences | 553932 | |
| Axiovert 25 inverted phase contrast tissue culture microscope | ZEISS | ||
| Basic Fibroblast Growth Factor-2 (bFGF) | Peprotech | 450-33 | |
| Benchtop Centrifuge, Allegra X-15R | Beckman Coulter | 392932 | |
| Biosafety cabinet BioVanguard (Green Line) | Telstar | 133H401001 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| Cell counting chamber, Buerker, 0.100mm | Marienfeld | 640211 | |
| Cell culture dishes 60 x 15mm | Corning | 353802 | |
| Cell culture dishes, 35 x 10 mm | Corning | 353801 | |
| Cell culture plates 12-well | Corning | 3512 | |
| CFX96 Touch Real-Time PCR Detection System | Biorad | 1855196 | |
| Chicken serum | Sigma-Aldrich | C5405 | |
| CHIR-99021 (CT99021) HCl | Selleckchem | S2924 | |
| Collagen I, High Concentration, Rat Tail, 100mg | Corning | 354249 | |
| Collagenase A | Roche | 10103586001 | |
| Confocal Laser Scanning Microscope, TCS SP5 | Leica | ||
| Cover glasses, 24 × 50 mm | Vwr | 631-0146 | |
| DAPT γ?secretase inhibitor | Sigma Aldrich | D5942 | |
| DC101 anti mouse VEGFR-2 Clone | BioXcell | BP0060 | |
| DC101 isotype rat IgG1 | BioXcell | BP0290 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2438-5X | Biohazard: adequate safety instructions should be taken when handling |
| DPBS (10x), no calcium, no magnesium | Gibco, Thermofisher scientific | 14200067 | |
| EDTA 40 mM | Gibco, Thermofisher scientific | 15575-038 | |
| Embryonic stem-cell Fetal Bovine Serum | Gibco, Thermofisher scientific | 16141-079 | Should be lot-tested for maximum ES cell viability and growth. Heat inactivate at 60°C and store at −20 °C for up to 1 year |
| Eppendorf Microcentrifuge 5415R | Eppendorf AG | Z605212 | |
| Erythropoietin, human (hEPO), 250 U (2.5 µg) (1 mL) | Roche | 11120166001 | |
| ESGRO Recombinant Mouse LIF Protein (10? units 1 mL) | Milipore, Merck | ESG1107 | |
| Falcon tubes 15 mL | Greiner Bio-One | 188271 | |
| Falcon tubes 50 mL | Greiner Bio-0ne | 227270 | |
| Filter tip ,clear ,sterile F.Gilson, P-200 | Greiner Bio-One | 739288 | |
| Filter tip ,clear ,sterile F.Gilson, P10 | Greiner Bio-One | 771288 | |
| Filter tip ,clear ,sterile F.Gilson, P1000 | Greiner Bio-One | 740288 | |
| FITC conjugated anti-α Smooth Muscle Actin (SMA) (clone 1A4) | Sigma Aldrich | F3777 | |
| FITC conjugated rat anti-mouse CD45 (clone 30-F11) | Biolegend | 103107 | |
| FITC Rat IgG2b, κ Isotype Ctrl Antibody (clone RTK4530) | Biolegend | 400605 | |
| Fluorscent mounting media | DAKO | S3023 | |
| Gascompress | Cutisoft | 45846 | |
| Gauze Cutisoft 10 x 10 cm | Bsn Medical | 45844_00 | |
| Gel blotting paper, Grade GB003 | Whatman | WHA10547922 | |
| Gelatin solution, type B | Sigma-Aldrich | G1393-100 ml | |
| Glasgow's MEM (GMEM) | Gibco, Thermofisher scientific | 21710082 | |
| IHC Zinc Fixative | BD Pharmigen | 550523 | |
| IncuSafe CO2 Incubator | PHCBi | MCO-170AICUV-PE | |
| Interleukin-6, human (hIL-6) | Roche | 11138600001 | |
| L-Glutamine 200 mM | Gibco, Thermofisher scientific | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco, Thermofisher scientific | 11140035 | |
| Microscope slide box | Kartell Labware | 278 | |
| Microscope slide, Starfrost | Knittel glass | VS113711FKB.0 | |
| Mm_Cdh5_1_SG QuantiTect Primer Assay | Qiagen | QT00110467 | |
| Mm_Eng_1_SG QuantiTect Primer Assay | Qiagen | QT00148981 | |
| Mm_Epha4_1_SG QuantiTect Primer Assay | Qiagen | QT00093576 | |
| Mm_Ephb2_1_SG QuantiTect Primer Assay | Qiagen | QT00154014 | |
| Mm_Flt1_1_SG QuantiTect Primer Assay | Qiagen | QT00096292 | |
| Mm_Flt4_1_SG QuantiTect Primer Assay | Qiagen | QT00099064 | |
| Mm_Gapdh_3_SG QuantiTect Primer Assay | Qiagen | QT01658692 | |
| Mm_Kdr_1_SG QuantiTect Primer Assay | Qiagen | QT00097020 | |
| Mm_Notch1_1_SG QuantiTect Primer | Qiagen | QT00156982 | |
| Mm_Nr2f2_1_SG QuantiTect Primer Assay | Qiagen | QT00153104 | |
| Mm_Pecam1_1_SG QuantiTect Primer | Qiagen | QT01052044 | |
| Mm_Tek_1_SG QuantiTect Primer Assay | Qiagen | QT00114576 | |
| Mouse (ICR) Inactivated Embryonic Fibroblasts (2 M) | Gibco, Thermofisher scientific | A24903 | Store vials in liquid nitrogen (195.79 °C) indefinitely |
| Mouse embryonic stem cell line 7AC5/EYFP (ATCC SCRC-1033) | ATCC | SCRC-1033 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Hadjantonakis, A. K., et al. Mechanisms of Development. 76 (1–2), 79–90 (1998)]. |
| Mouse embryonic stem cell lines Acvrl1 +/- and Acvrl1 +/+ | Generated at Leiden University Medical Centre [Thalgott, J.H. et al. Circulation. 138 (23), 2698–2712 (2018)]. | ||
| Mouse embryonic stem cells line E14 | Provided by M Letarte laboratory and generated according to Cho, S. K., et al. Blood. 98 (13), 3635–3642 (2001). | ||
| Mouse embryonic stem cells line R1 (ATCC SCRC-1011) | ATCC | SCRC-1011 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Nagy, A., et al. Procedings of the National Academy of Sciences of the United States of America. 90 (18), 8424–8428 (1993)]. |
| Mouse embryonic stem cells line Z/Red (strain 129/Ola) | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada [Vintersten, K., et al. Genesis. 40 (4), 241–246 (2004)]. | ||
| NanoDrop 1000 UV/VIS Spectrophotometer | Thermo Fischer Scientific | ND-1000 | |
| PD0325901 | Selleckchem | S1036 | |
| PDGF-BB, Recombinant Human | Peprotech | 100-14B | |
| Pecam-1 antibody, Rat Anti-Mouse | BD Biosciences | 550274 | |
| Penicillin-streptomycin (10,000 U/mL) | Gibco, Thermofisher scientific | 15140122 | |
| Petri dish, PS, 94/16 mm, standard ,with vents, sterile | Greiner Bio-One | 633181 | |
| Pipetboy acu 2 | Integra-Biosciences | 155 019 | |
| Pipetman G Multichannel P8 x 200G | Gilson | F144072 | |
| Pipetman G Starter Kit, 4 Pipette Kit, P2G, P20G, P200G, P1000G | Gilson | F167360 | |
| Recombinant Human BMP-4 Protein | R&D Systems | 314-BP | |
| RNeasy Plus mini Kit | QIAGEN | 74134 | |
| Serological pipettes, 10 mL | Greiner Bio-One | 607 180 | |
| Serological pipettes, 25 mL | Greiner Bio-One | 760 180 | |
| Serological pipettes, 5 mL | Greiner Bio-One | 606 180 | |
| Sodium hydroxide (NaOH) | Merck | 106498 | |
| Sodium pyruvate 100 mM | Gibco, Thermofisher scientific | 11360039 | |
| Test tubes 5ml round-bottom with cell-strainer cap | Corning | 352235 | |
| Thermal cycler, T100 | Biorad | 1861096 | |
| Triton X-100 (BioXtra) | Sigma Aldrich | T9284 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher scientific | 15250061 | |
| Trypsin (2.5%) | Gibco, Thermofisher scientific | 15090046 | |
| Vacuum Filter/Storage Bottle System, 500 mL | Corning | 430758 | |
| VEGFA165 , recombinant murine | Peprotech | 450-32 | |
| Water, Sterile | Fresenius-Kabi | B230531 | |
| Waterbath, Lab-Line Digital | Thermo Fischer Scientific | 18052A |
References
- Moffat, J. G., Vincent, F., Lee, J. A., Eder, J., Prunotto, M. Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nature Reviews Drug Discovery. 16 (8), 531-543 (2017).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews. Drug Discovery. 15 (11), 751-769 (2016).
- Low, L. A., Mummery, C., Berridge, B. R., Austin, C. P., Tagle, D. A. Organs-on-chips: into the next decade. Nature Reviews. Drug Discovery. , (2020).
- Ma, C., Peng, Y., Li, H., Chen, W. Organ-on-a-Chip: A new paradigm for drug development. Trends in Pharmacological Sciences. 42 (2), 119-133 (2021).
- Swinney, D. C., Anthony, J. How were new medicines discovered. Nature Reviews Drug Discovery. 10 (7), 507-519 (2011).
- Hussain, S., et al. High-content image generation for drug discovery using generative adversarial networks. Neural Networks: The Official Journal of the INternational Neural Network Society. 132, 353-363 (2020).
- Scheeder, C., Heigwer, F., Boutros, M. Machine learning and image-based profiling in drug discovery. Current Opinion in Systems Biology. 10, 43-52 (2018).
- Wagner, B. K., Schreiber, S. L. The power of sophisticated phenotypic screening and modern mechanism-of-action methods. Cell Chemical Biology. 23 (1), 3-9 (2016).
- Scannell, J. W., Bosley, J. When quality beats quantity: Decision theory, drug discovery, and the reproducibility crisis. PLoS One. 11 (2), 0147215(2016).
- Webster, J. D., Santagostino, S. F., Foreman, O. Applications and considerations for the use of genetically engineered mouse models in drug development. Cell and Tissue Research. 380 (2), 325-340 (2020).
- Howland, D. S., Munoz-Sanjuan, I. Mind the gap: models in multiple species needed for therapeutic development in Huntington's disease. Movement Disorders: Official Journal of the Movement Disorder Scoiety. 29 (11), 1397-1403 (2014).
- Galaris, G., Thalgott, J. H., Lebrin, F. P. G. Pericytes in hereditary hemorrhagic telangiectasia. Advances in Experimental Medicine and Biology. 1147, 215-246 (2019).
- Thalgott, J. H., et al. Decreased expression of vascular endothelial growth factor receptor 1 contributes to the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Circulation. 138 (23), 2698-2712 (2018).
- Lebrin, F., et al. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia. Nature Medicine. 16 (4), 420-428 (2010).
- Czechanski, A., et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nature Protocols. 9 (3), 559-574 (2014).
- Elling, U., et al. A reversible haploid mouse embryonic stem cell biobank resource for functional genomics. Nature. 550 (7674), 114-118 (2017).
- Cheng, J., et al. Targeting pericytes for therapeutic approaches to neurological disorders. Acta Neuropathologica. 136 (4), 507-523 (2018).
- Chade, A. R. Small vessels, big role: Renal microcirculation and progression of renal injury. Hypertension. 69 (4), 551-563 (2017).
- Jourde-Chiche, N., et al. Endothelium structure and function in kidney health and disease. Nature Reviews. Nephrology. 15 (2), 87-108 (2019).
- van Duinen, V., et al. Standardized and scalable assay to study perfused 3D angiogenic sprouting of iPSC-derived endothelial cells in vitro. Journal of Visualized Experiment: JoVE. (153), e59678(2019).
- Chappell, J. C., Taylor, S. M., Ferrara, N., Bautch, V. L. Local guidance of emerging vessel sprouts requires soluble Flt-1. Developmental Cell. 17 (3), 377-386 (2009).
- Sato, Y., Rifkin, D. B. Inhibition of endothelial cell movement by pericytes and smooth muscle cells: activation of a latent transforming growth factor-beta 1-like molecule by plasmin during co-culture. Journal of Cell Biology. 109 (1), 309-315 (1989).
- Tchaikovski, V., Olieslagers, S., Bohmer, F. D., Waltenberger, J. Diabetes mellitus activates signal transduction pathways resulting in vascular endothelial growth factor resistance of human monocytes. Circulation. 120 (2), 150-159 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. International Journal of Experimental Pathology. 90 (3), 195-221 (2009).
- Herbert, S. P., Stainier, D. Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis. Nature Reviews Molecular Cell Biology. 12 (9), 551-564 (2011).
- Nakatsu, M. N., Hughes, C. C. An optimized three-dimensional in vitro model for the analysis of angiogenesis. Methods in Enzymology. 443, 65-82 (2008).
- Nakatsu, M. N., Davis, J., Hughes, C. C. Optimized fibrin gel bead assay for the study of angiogenesis. Journal of Visualized Experiments: JoVE. (186), (2007).
- Gau, D., et al. Pharmacological intervention of MKL/SRF signaling by CCG-1423 impedes endothelial cell migration and angiogenesis. Angiogenesis. 20 (4), 663-672 (2017).
- Torres-Estay, V., et al. Androgens modulate male-derived endothelial cell homeostasis using androgen receptor-dependent and receptor-independent mechanisms. Angiogenesis. 20 (1), 25-38 (2017).
- Merjaneh, M., et al. Pro-angiogenic capacities of microvesicles produced by skin wound myofibroblasts. Angiogenesis. 20 (3), 385-398 (2017).
- Rezzola, S., et al. In vitro and ex vivo retina angiogenesis assays. Angiogenesis. 17 (3), 429-442 (2014).
- Wang, X., Phan, D. T. T., George, S. C., Hughes, C. C. W., Lee, A. P. 3D Anastomosed microvascular network model with living capillary networks and endothelial cell-lined microfluidic channels. Methods in Molecular Biology. 1612, Clifton, N.J. 325-344 (2017).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Laboratory Investigation; A Journal of Technical Methods and Pathology. 63 (1), 115-122 (1990).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. Journal of Cellular and Molecular Medicine. 13 (10), 4113-4136 (2009).
- Nowak-Sliwinska, P., et al. Consensus guidelines for the use and interpretation of angiogenesis assays. Angiogenesis. 21 (3), 425(2018).
- Belair, D. G., Schwartz, M. P., Knudsen, T., Murphy, W. L. Human iPSC-derived endothelial cell sprouting assay in synthetic hydrogel arrays. Acta Biomaterialia. 39, 12-24 (2016).
- Bezenah, J. R., Kong, Y. P., Putnam, A. J. Evaluating the potential of endothelial cells derived from human induced pluripotent stem cells to form microvascular networks in 3D cultures. Scientific Reports. 8 (1), 2671(2018).
- Henderson, A. R., Choi, H., Lee, E. Blood and lymphatic vasculatures on-chip platforms and their applications for organ-specific in vitro modeling. Micromachines (Basel). 11 (2), 147(2020).
- Lin, D. S. Y., Guo, F., Zhang, B. Modeling organ-specific vasculature with organ-on-a-chip devices. Nanotechnology. 30 (2), 024002(2019).
- Pollet, A., den Toonder, J. M. J. Recapitulating the vasculature using organ-on-chip technology. Bioengineering. 7 (1), Basel, Switzerland. 17(2020).
- Cochrane, A., et al. Advanced in vitro models of vascular biology: Human induced pluripotent stem cells and organ-on-chip technology. Advanced Drug Delivery Reviews. 140, 68-77 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.