Method Article
체외 혈관 질환 모델링 및 약물 검사를 위한 마우스 배아 줄기 세포를 이용한 혈관신생의 3차원 발아 분석
요약
이 분석은 3D 콜라겐 젤에서 배양된 배아체로 분화된 마우스 배아 줄기 세포를 활용하여 시험관 내에서 발아 혈관신생을 제어하는 생물학적 과정을 분석합니다. 이 기술은 약물 테스트, 질병 모델링 및 배아적으로 치명적인 결실의 맥락에서 특정 유전자를 연구하는 데 적용될 수 있습니다.
초록
유도만능줄기세포(iPSC) 및 유전자 편집 기술의 최근 발전으로 표현형 약물 발견(PDD) 프로그램을 위한 새로운 인간 세포 기반 질병 모델을 개발할 수 있습니다. 이러한 새로운 장치는 인간에서 시험용 약물의 안전성과 효능을 보다 정확하게 예측할 수 있지만, 클리닉으로의 개발은 여전히 포유류 데이터, 특히 마우스 질병 모델의 사용에 크게 의존하고 있습니다. 따라서 인간 오가노이드 또는 장기 온 칩 질병 모델과 병행하여 관련 시험관 내 마우스 모델의 개발은 종과 생체 내 및 시험관 내 조건 간의 직접적인 약물 효능 및 안전성 비교를 평가하기 위한 충족되지 않은 요구입니다. 여기에서는 배아체(EB)로 분화된 마우스 배아줄기세포를 활용하는 혈관 발아 분석법을 설명합니다. 3D 콜라겐 젤에 배양된 혈관화된 EB는 확장되는 새로운 혈관을 발달시키는데, 이를 발아 혈관신생이라고 합니다. 이 모델은 내피 팁 세포 선택, 내피 세포 이동 및 증식, 세포 유도, 튜브 형성 및 벽화 세포 모집을 포함하여 기존 혈관 네트워크에서 혈관의 생체 내 발아 혈관 신생의 주요 특징을 요약합니다. 혈관신생을 조절하는 약물 및 유전자를 스크리닝할 수 있으며 인간 iPSC 기술을 기반으로 하는 최근 설명된 3차원(3D) 혈관 분석과 유사성을 보여줍니다.
서문
지난 삼십 년 동안 표적 기반 약물 발견(TDD)은 제약 산업의 약물 발견에 널리 사용되었습니다. TDD는 질병에서 중요한 역할을 하는 정의된 분자 표적을 통합하고 약물 스크리닝을 위한 비교적 간단한 세포 배양 시스템 및 판독값의 개발에 의존합니다1. TDD 프로그램에 사용되는 가장 일반적인 질병 모델에는 암세포 또는 인공 환경 및 비생리학적 기질 내에서 성장한 불멸화된 세포주와 같은 전통적인 세포 배양 방법이 포함됩니다. 이러한 모델 중 다수가 성공적인 약물 후보를 식별하기 위한 실행 가능한 도구를 제공했지만, 질병 관련성이 낮기 때문에 이러한 시스템의 사용은 의심스러울 수 있다2.
대부분의 질병에서 기본 메커니즘은 실제로 복잡하며 다양한 세포 유형, 독립적인 신호 전달 경로 및 여러 유전자 세트가 특정 질병 표현형에 기여하는 것으로 종종 발견됩니다. 이것은 주요 원인이 단일 유전자의 돌연변이인 유전 질환의 경우에도 마찬가지입니다. 최근 인간 유도만능줄기세포(iPSC) 기술과 유전자 편집 도구의 출현으로 이제 생체 내 인간 복잡성을 더 잘 요약할 수 있는 3D 오가노이드 및 장기 칩 질병 모델을 생성할 수 있습니다 3,4. 이러한 기술의 개발은 표현형 약물 발견(phenotypic drug discovery, PDD) 프로그램에 대한 관심의 부활과 관련이 있다1. PDD는 특정 약물 표적의 정체성에 대한 지식이나 질병에서의 역할에 대한 가설에 의존하지 않기 때문에 경험적 스크리닝과 비교할 수 있습니다. PDD 접근법은 이제 first-in-class 약물 발견에 크게 기여하는 것으로 점점 더 인식되고 있다5. 인간 오가노이드 및 장기 온 칩 기술의 개발은 아직 초기 단계에 있기 때문에 iPSC 모델(혁신적인 이미징 및 기계 학습 도구6,7로 보완됨)은 가까운 장래에 TDD 접근 방식의 낮은 생산성을 극복하기 위해 약물 스크리닝 및 관련 PDD 프로그램을 위한 여러 새로운 복합 세포 기반 질병 모델을 제공할 것으로 예상됩니다8, 9입니다.
인간 오가노이드 및 장기 칩 모델은 질병의 복잡성과 신약 식별에 대한 중요한 통찰력을 제공할 수 있지만, 약물을 새로운 임상 실습에 도입하는 것은 효능과 안전성을 평가하기 위해 동물 모델의 데이터에 크게 의존합니다. 그 중에서도 유전자 변형 마우스는 확실히 가장 선호되는 포유류 모델입니다. 그들은 포유류의 생성 시간이 비교적 짧고 인간 질병과 유사한 표현형이 많으며 유전적으로 쉽게 조작할 수 있기 때문에 많은 장점이 있습니다. 따라서 약물 발견 프로그램10에서 광범위하게 사용된다. 그러나 생쥐와 인간 사이의 격차를 해소하는 것은 여전히 중요한 과제로 남아 있습니다11. 인간 오가노이드 및 장기 칩 모델과 동등한 시험관 내 마우스 모델의 개발은 생체 내 마우스와 체외 인간 데이터 간의 직접적인 약물 효능 및 안전성 비교를 허용하기 때문에 이 격차를 적어도 부분적으로 채울 수 있습니다.
여기서, 마우스 배아체(EB)의 혈관 발아 분석이 설명됩니다. 혈관은 내피 세포(혈관벽의 내벽), 벽화 세포(혈관 평활근 세포 및 혈관주위세포)로 구성됩니다12. 이 프로토콜은 새로운 내피 세포 및 벽화 세포 분화를 요약하는 매달린 물방울을 사용하여 마우스 배아 줄기 세포(mESC)를 혈관화된 EB로 분화하는 것을 기반으로 합니다13,14. 마우스 배반포는 상이한 유전적 배경을 갖는 3.5일째 마우스 배반포로부터 배양물에서 쉽게 확립될 수 있다15. 그들은 또한 클론 분석, 혈통 추적에 대한 가능성을 제공하며 질병 모델13,16을 생성하기 위해 유전적으로 쉽게 조작할 수 있습니다.
혈관이 모든 장기에 영양을 공급하기 때문에 전부는 아니더라도 많은 질병이 미세 혈관 구조의 변화와 관련이 있다는 것은 놀라운 일이 아닙니다. 병리학적 상태에서, 내피 세포는 활성화된 상태를 채택하거나 기능 장애를 일으켜 벽화 세포 사멸 또는 혈관으로부터의 이동을 초래할 수 있다. 이들은 과도한 혈관신생 또는 혈관 희박화를 초래할 수 있고, 비정상적인 혈류를 유도할 수 있고, 면역 세포 유출 및 염증을 유발하는 혈관 장벽 결함을 유발할 수 있다12,17,18,19. 따라서 혈관을 조절하는 약물 개발에 대한 연구가 많이 이루어지고 있으며 치료 표적화에 대한 여러 분자 플레이어와 개념이 이미 확인되었습니다. 이러한 맥락에서 설명된 프로토콜은 내피 팁 및 줄기 세포 선택, 내피 세포 이동 및 증식, 내피 세포 안내, 튜브 형성 및 벽화 세포 모집을 포함하여 생체 내 발아 혈관신생의 주요 특징을 요약하기 때문에 질병 모델 구축 및 약물 테스트에 특히 적합합니다. 또한 인간 iPSC 기술20을 기반으로 최근에 기술된 3D 혈관 분석과 유사성을 보여줍니다.
프로토콜
1. mESC의 배지 준비 및 배양
- 보충제를 사용하여 컨디셔닝된 배지 +/-(CM+/-)를 준비합니다. 10%(vol/vol) 열 비활성화 태아 소 혈청(FBS), 0.05mM β-메르캅토에탄올, 1x 비필수 아미노산(NEAA 1x), 2mM L-글루타민 및 1mM 피루브산나트륨이 포함된 1x Glasgow MEM(G-MEM BHK-1) 배지.
- 백혈병 억제 인자(LIF)(1,500U/mL) 및 0.1mM β-메르캅토에탄올이 포함된 보충 CM+/- 배지를 사용하여 조건화된 배지 +/+(CM+/+)를 준비합니다.
- 1μM PD0325901 및 3μM CHIR99021과 함께 보충 CM+/+ 배지를 사용하여 두 가지 억제제(CM+/+ 2i)가 있는 상태에서 조건화된 배지 +/+를 준비합니다.
- 칼슘과 마그네슘(DPBS)이 없는 인산염 완충 식염수 500mL에 미리 예열된 2% 젤라틴 용액 25mL를 혼합하여 0.1% 젤라틴 용액을 준비합니다.
- 트립신(2.5%)과 TVP 1x(9.5% 10x DPBS, 1mM EDTA, 0.01% 치킨 혈청, 0.01% 트립신(2.5%) H2O)(1:10 비율, vol/vol).
알림: 0.22μm 기공 필터를 통해 모든 용액을 필터링합니다. 배양 배지를 -20°C에서 장기간 보관하고 다른 시약은 4°C에서 최대 3주 동안 보관합니다( 재료 표 참조). - 2개의 12-웰 세포 배양 플레이트를 0.1% 젤라틴 용액(웰당 500μL)으로 코팅하고 CO2 인큐베이터(37°C, 5%CO2, 습한 분위기)에서 30분 동안 배양합니다.
- PBS로 젤라틴 코팅된 플레이트를 세척하고 500μL의 CM+/- 배지를 추가합니다.
- 37°C에서 1 x 106 냉동 보존된 방사선 조사된 마우스 배아 섬유아세포(MEF)의 두 바이알을 해동하고 세포 현탁액을 5mL의 CM+/- 배지가 있는 원뿔형 튜브로 옮깁니다.
- 실온(RT)에서 5분 동안 200 x g 에서 세포를 원심분리합니다. 배지를 흡인하고 mL당 1.67 x 105 세포의 농도로 CM+/- 배지 12mL에 세포 펠릿을 부드럽게 재현탁합니다.
- 500 μL의 MEF 현탁액을 12-웰 세포 배양 플레이트(2.4 x 10 cm2당5개 세포)에 시드하고, 플레이트를CO2 인큐베이터에서 밤새(o/n) 배양한다.
- 냉동보존된 mESC 바이알 1개(1 x 106)를 CM+/+ 2i 배지에서 해동합니다.
- 1mL의 CM+/+ 2i 배지에서 MEF로 미리 세척된 12웰 플레이트에 mESC 현탁액을 시딩하고 플레이트를CO2 인큐베이터로 옮깁니다. 매일 매체를 새로 고칩니다.
- 70% 밀도에서 mESC 콜로니를 DPBS로 세척합니다. 따뜻한 10x TVP 버퍼 150μL를 추가하고 RT에서 30초 동안 배양하여 효소 해리를 시작합니다.
- TVP 버퍼를 조심스럽게 제거하고 1mL의 CM+/+ 2i 배지에 세포를 재현탁하고 부드러운 피펫팅으로 콜로니를 단일 세포로 해리합니다.
- 세포를 MEF가 있는 새로운 12웰 세포 배양 플레이트로 옮겨 계대배양합니다(분할 비율: 1:3-1:5). 세포를 분산시키기 위해 부드럽게 혼합하고CO2 인큐베이터에서 배양합니다.
- 배양 배지(2-3mL)를 새로 고치고 매일 세포 성장/형태를 관찰합니다. 2일마다 70% 밀도로 연속 패시징을 반복합니다. 세포 분화를 시작하기 전에 두 계대 동안 CM+/+ 배지로 전환합니다.
2. 거는 하락에 있는 EB 형성
- CM+/- 배지에 염기성 섬유아세포 성장 인자(bFGF)(50ng·mL-1)와 골형성 단백질 4(BMP-4)(5ng·mL-1)를 보충하여 신선한 중배엽 분화 배지를 준비하고 사용할 때까지 4°C에서 유지합니다.
- 6-웰 세포 배양 플레이트의 한 웰을 0.1% 젤라틴 용액 500μL로 코팅하고 30분 동안CO2 인큐베이터에 넣습니다.
- PBS로 젤라틴 코팅된 플레이트를 세척하고 500μL의 CM+/- 배지를 추가합니다.
- mESC의 순수한 집단을 얻기 위해, 세포 배양 플레이트를 RT에서 30초 동안 10x TVP 완충액으로 트립신화하고, 세포를 1mL 중배엽 분화 배지에 재현탁한 다음, 30분 동안 젤라틴으로 코팅된 6웰 플레이트로 옮겨 mESC가 현탁액에 머무르는 동안 MEF가 부착되도록 합니다.
- 50mL 원뿔형 튜브에 세포 현탁액을 수집하고 Neubauer 혈구계와 Trypan blue 염료를 사용하여 세포 수를 계수하여 살아있는/죽은 세포를 배제합니다.
- RT에서 5분 동안 200 x g 에서 세포를 원심분리하고, 상층액을 제거하고, 세포 펠릿을 중배엽 분화 배지에 재현탁하여 mL당 4.55 x 104 세포에 도달하도록 한다.
- 94mm 저부착 폴리스티렌 접시의 바닥을 15mL의 멸균수로 채웁니다.
참고: 3D 발아 혈관신생 분석을 사용하여 하나의 특정 조건을 테스트하려면 매달린 방울(3.52mL 배지에 1.6 x 105 세포)이 포함된 4개의 접시가 필요합니다. - 세포 현탁액을 멸균 플라스틱 저장소로 옮기고 채널당 22 μL의 세포 현탁액(22 μL 방울당 1 x 103 세포)과 함께 다중 채널 피펫의 4개 위치를 로드합니다.
- 94mm 접시의 뚜껑을 들어 올려 뒤집어 내부가 위를 향하도록 플로우 캐비닛의 깨끗한 표면에 놓습니다.
- 각 뚜껑의 내부 표면에 세포 현탁액 40 방울을 떨어 뜨립니다. 방해받지 않고 뚜껑을 조심스럽게 뒤집어 접시에 다시 올려 놓아 방울이 물을 향하도록 합니다.
- 접시를CO2 인큐베이터에서 배양합니다. 이것을 차별화 0일로 간주하십시오. 플레이트를 4일 동안 유지하여 EB를 형성합니다.
3. 팁 셀 위치에 대한 경쟁 분석
- 13개의 앞서 기술한 바와 같이 하나의 형광 및 하나의 비형광 mESC 라인을 배양한다. 예를 들어, 노란색으로 표시된 7ACS/EYFP mESC와 R1 mESC가 사용됩니다.
- 동일한 양의 두 mESC 라인(1:1 비율)을 혼합하여 모자이크 EB를 준비하고 2단계에 설명된 대로CO2 인큐베이터에서 행잉 드롭 접시를 배양합니다.
4. 혈관 분화를 위한 Floating EBs 배양
- 매달린 방울에서 EB를 수집하기 전에 다음을 준비하십시오.
- H2O중 5% 한천 용액을 제조하고 이를 오토클레이빙(120°C에서 20분)하여 멸균한다.
- 따뜻한 5% 한천 용액을 사용하여 1% 한천을 함유한 G-MEM BHK-21 배지를 준비하고 60mm 폴리스티렌 접시 중 하나에 3mL를 빠르게 붓습니다. 한천이 RT에서 1시간 동안 굳도록 합니다. 사용할 때까지 접시를 4°C에서 보관하십시오.
- CM+/- 배지에 bFGF(100ng·mL-1) 및 VEGF-A(50ng·mL-1)를 보충하여 신선한 2x 혈관 분화 배지를 준비합니다. 사용할 때까지 배지를 4°C에서 보관하십시오.
- P1000 피펫을 사용하여 15mL 원뿔형 튜브에 매달린 방울을 수집하고 EB 침전 몇 분 후에 상층액을 제거합니다.
- 3mL의 2x 혈관 분화 배지에 EB를 재현탁하고 EB 현탁액을 한천으로 코팅된 하나의 접시에 옮기고 응집을 피하기 위해 EB를 균질하게 분배합니다.
- 접시를CO2 인큐베이터에서 배양하고, bFGF(50 ng·mL-1) 및 VEGF-A(25 ng·mL-1)의 존재 하에 1x 혈관 분화 배지를 사용하여 9일까지 2일마다 배지를 상쾌하게 한다.
- 또는 혈소판 유래 성장 인자-BB(PDGF-BB)(4일에 10ng·mL-1 , 6일 및 8일에 5ng·mL-1 )를 혈관 분화 배지에 추가하여 벽화 세포 분화를 촉진합니다.
5. 유세포 분석
- P1000 피펫을 사용하여 15mL 원뿔형 튜브에 9일 된 EB를 수집하고 따뜻한 PBS로 한 번 세척합니다.
- 0.2mg·mL-1 의 콜라게나제 A를 함유한 G-MEM BHK-21 배지 1mL를 넣고CO2 인큐베이터에서 5분 동안 세포를 배양합니다.
- P1000 피펫으로 위아래로 부드럽게 피펫팅하여 EB를 분리합니다.
- 10% FBS가 함유된 차가운 G-MEM BHK-21 배지 1mL를 첨가하여 콜라게나제 활성을 중지합니다.
- 실온에서 5분 동안 200 x g 에서 세포를 원심분리합니다.
- 세포를 2% FBS와 함께 500μL의 PBS에 재현탁합니다.
- Neubauer 혈구계를 사용하여 세포를 계수합니다.
- 400,000개의 세포를 염색 조건당 2% FBS로 100μL의 PBS에 재현탁합니다.
- 세포를 다음 항체와 함께 4°C에서 45분 동안 인큐베이션한다: APC 접합 래트 항-마우스 PECAM-1 항체 (클론 MEC13.3) 및 FITC 접합 래트 항-마우스 CD45 (클론 30-F11) 또는 이소타입 대조군 항체.
- 세포를 2% FBS를 함유하는 PBS 1mL로 2회 세척한다.
- mL당 5 x 106 세포의 최종 농도에 도달하도록 세포를 재현탁합니다.
- 세포 스트레이너 스냅 캡이 있는 둥근 바닥 폴리스티렌 시험관을 사용하여 세포를 여과합니다.
- 유세포 분석을 통해 20,000개의 PECAM-1(+) 이벤트를 분석합니다.
6.3D 발아 혈관신생 분석 및 면역형광 염색
- 9일째에 10% FBS(vol/vol), bFGF(50ng·mL-1), VEGF-A(25ng·mL-1), 인간 재조합 에리스로포이에틴(hEPO)(20ng·mL-1), 인간 인터루킨-6(IL-6)(10ng·mL-1), 0.05mM β-메르캅토에탄올, NEAA(1x), L-글루타민(1x), 피루브산나트륨(1x), I형 쥐꼬리 콜라겐(1.25mg·mL-1), 및 NaOH (3.1 mM)를 GMEM BHK-1 배지에 첨가하였다.
- 콜라겐 겔화를 방지하려면 발아 배지를 사용할 때까지 얼음 위에 유지하십시오.
- 프로/항-혈관신생 분자의 효과를 평가하기 위해, 선택된 약물 또는 비히클을 선택된 농도의 발아 배지에 첨가한다.
- 15mL 원뿔형 튜브(한 가지 조건에 해당)에 있는 60mm 한천 접시 하나에서 9일 된 EB를 수집하고 몇 분 동안 침전된 후 상층액을 제거합니다.
- 35mm 배양 접시의 바닥을 발아 배지 1mL로 덮고 37°C에서 5분 동안 배양하여 겔화를 유도합니다.
- EB를 2mL의 저온 발아 배지에 재현탁합니다.
- 현탁액을 발아 배지의 첫 번째 층으로 코팅된 35mm 배양 접시로 옮깁니다.
- EB를 플레이트 전체에 분배하고 서로 동일한 거리에 있는지 확인합니다. 접시를CO2 인큐베이터에서 배양합니다. 첫 번째 새싹 형성은 24-48 시간 내에 발생합니다.
- 12일째에 EB를 함유한 콜라겐 젤을 주걱을 사용하여 유리 슬라이드(75 x 26mm)로 조심스럽게 옮깁니다.
- 피펫(P1000)을 사용하여 과량의 액체를 제거하고 나일론 린넨의 거즈 시트와 흡수성 필터 카드(겔 블로팅 페이퍼)를 겔 위에 올려 놓음으로써 겔을 탈수시킨다. 무게추(250g)를 2분 동안 가하여 압력을 가합니다. 나일론/여과지를 조심스럽게 제거하고 슬라이드를 실온에서 30분 동안 자연 건조시킵니다.
- 슬라이드를 RT에서 5분 동안 PBS로 3회 세척한다.
- 4°C에서 아연 용액( 재료 표 참조) o/n을 사용하여 EB를 고정합니다. 또는 모자이크 형광 EB를 파라포름알데히드(PFA)(4%) o/n으로 4°C에서 어두운 곳에서 고정합니다.
- 고정액을 제거하십시오. 슬라이드를 RT에서 5분 동안 PBS로 5회 세척한다.
- RT에서 15분 동안 0.1% Triton-X100을 함유한 PBS에서 EB를 투과화합니다.
- 투과화 용액을 제거합니다. 슬라이드를 PBS로 5분 동안 5회 세척합니다.
- EB를 블로킹 완충액(PBS with 2% Bovine Serum Albumin, BSA)에서 RT에서 1시간 동안 배양합니다.
- 내피 새싹을 염색하려면 4°C에서 차단 완충액 o/n에 쥐 항-마우스 항-PECAM-1 1차 항체(1:100 희석)를 사용합니다.
- 슬라이드를 PBS로 5분 동안 5회 세척합니다.
- 슬라이드를 블로킹 완충액(1:250 희석)에서 염소 항-쥐 Alexa 555 2차 항체와 함께 배양하고, 필요한 경우 블로킹 완충액(1:250 희석)에서 FITC 접합 항-α-SMA 항체와 함께 암흑 RT에서 2시간 동안 벽화 세포를 염색합니다.
- 슬라이드를 장착하기 전에 PBS로 5분 동안 세 번, H20으로 한 번 세척합니다.
7. EB 내피 새싹의 공초점 이미징, 형태 측정 및 정량 분석
- 컨포칼 현미경을 사용하여 초점면 병합(z-stacking)을 통해 면역염색된 EB의 고해상도 이미지를 획득합니다. 10x 배율 대물렌즈를 사용하여 전체 EB를 이미지화합니다.
- ImageJ를 사용하여 획득한 이미지를 분석하여 형태를 평가하고 확립된 정량화 방법 13,14,21에 따라 PECAM-1 양성 내피 새싹의 특성을 정량화합니다.
- 개별 EB당 총 새싹 수를 수동으로 계산하여 EB당 평균 내피 새싹 수를 계산합니다.
- ImageJ 그리기 도구를 사용하여 개별 새싹 길이를 측정합니다. EB 코어 영역에서 시작하여 내피 새싹의 기저부를 정의하고 새싹 끝이 끝날 때까지 수동으로 선을 그립니다.
- 개별 새싹 당 팁 세포 수를 수동으로 계산하여 새싹 당 평균 팁 세포 수를 계산 한 다음 EB 당 평균을 계산합니다.
- 부모 새싹의 축을 수동으로 결정하여 필로포디아 방향을 계산하고 ImageJ 소프트웨어 각도 도구를 사용하여 새싹 사이의 예각을 측정합니다. >50° 방향의 새싹 수를 계산하고 관심 있는 EB의 총 새싹 수로 나눕니다.
알림: 각도는 항상 0°에서 90° 사이였습니다.
- 컨포칼 현미경을 사용하여 면역염색된 EB의 고해상도 이미지를 획득합니다. 40x 배율 대물렌즈를 사용하여 단일 내피 새싹의 고해상도 이미지를 실현합니다.
- ImageJ 소프트웨어를 사용하여 α-SMA 양성 MC로 둘러싸인 PECAM-1 양성 EC 새싹의 혈관 커버리지를 정량화합니다.
- 병합된 이미지를 별도의 빨강 및 녹색 채널로 분할합니다.
- 이미지를 이진 형식으로 변환합니다.
- PECAM-1(빨간색으로 표지된 내피세포)과 α-SMA(녹색으로 표지된 벽세포) 양성세포가 각각 차지하는 새싹의 총 세포 면적을 측정합니다.
- 이미지 계산기 함수와 AND 연산자를 사용하여 병합된 이미지를 생성합니다. 이미지의 전체 세포 영역을 측정합니다. 커버리지를 계산하려면 공국소화된 영상의 면적을 PECAM-1 이진 영상의 면적으로 나눕니다.
- 모자이크 EB에 의해 개발된 새싹의 내피 팁/줄기 세포 위치에 대한 세포 경쟁을 분석하기 위해 팁 세포의 수를 수동으로 점수화하고 형광 신호를 기반으로 유전형 기원을 표시합니다. EB당 평균값을 계산합니다.
결과
혈관 발아 분석의 프로토콜 개요는 그림 1에 나와 있습니다. 3개의 독립적인 129/Ola mESC 라인(Z/Red, R1 및 E14)에서 유래한 9일 된 EB를 콜라게나제 A를 사용하여 단일 세포로 효소적으로 해리시켰습니다. 모든 세포주는 강력한 내피 분화를 나타내었고, 내피 세포로 분화하는 능력의 차이는 관찰되지 않았다. 모든 세포주는 내피 세포의 약 10.5% ± 1.3%를 생산하였다(도 2A). PECAM-1(+) 세포 집단에서 PAN-endotelial 세포 마커의 상대적 발현 수준도 정량화되었습니다. 분석된 모든 마커(Flk1, Flt1, Flt4, Eng, Tie2 및 Cdh5)의 mRNA 발현 수준은 세포주와 실험 간에 비교할 수 있어 분화 프로토콜의 견고성을 확인했습니다(그림 2B). PECAM-1(+) 세포 집단은 프로토콜에 의해 생성된 내피 세포의 상대적으로 미성숙 상태를 뒷받침하는 동맥(Notch1 및 Efnb2) 또는 정맥(Couptf2 및 Ephb4) 마커의 매우 낮은 mRNA 수준만을 발현했습니다(그림 2C).
그런 다음 혈관 신생을 조절하는 약물을 스크리닝하는 혈관 발아 EB 모델의 능력이 입증되었습니다(그림 3). DC101 및 DAPT(N-[N-(3,5-디플루오로페나세틸)-랄라닐]-S-페닐글리신 t-부틸에스터)를 테스트했습니다. 이들 화합물은 VEGFR2 활성을 억제하여 혈관신생을 각각 차단하거나 Notch 신호전달을 표적으로 하여 내피 팁 세포 분화 및 치밀한 혈관 신경총의 형성을 촉진하기 위해 마우스에서 널리 사용됩니다(그림 3A). VEGF 및 Notch 신호 전달 경로는 모두 생체 내에서 발아 혈관신생의 핵심 조절자입니다. 콜라겐 I에 도말된 EB에서 다양한 농도의 DC101 및 DAPT의 효과를 평가했습니다. 6-30 mg· L-1은 새싹의 수와 길이를 모두 억제한 반면 DAPT는 1μmol· L-1 (그림 3B-C). DAPT의 존재 하에 배양된 EBs의 PECAM-1에 대해 염색된 새싹 용기의 고배율 사진도 제공된다(도 3D). DAPT는 0.5-1 μmol· L-1은 잘못된 유도 표현형을 가진 혈관 새싹이 있는 내피 팁 세포의 수를 크게 증가시켰습니다(그림 3D-F). 고용량의 DAPT는 또한 혈관 유착 및 조직 없이 크고 평평한 내피 세포 영역의 형성을 유도했습니다(그림 3A). 결과는 혈관 신생을 촉진하거나 억제하는 약물을 테스트하는 모델의 능력을 확인했습니다.
이 모델이 혈관 질환 모방에 적합한지 확인하기 위해 Acvrl1+/- mESC에서 파생된 EB의 컨포칼 이미지가 제공됩니다. Acvrl1 유전자는 내피 세포에서 특이적으로 발현되는 수용체인 ALK1(Activin Receptor-like Kinase 1)을 암호화하며, 돌연변이가 발생하면 유전성 출혈성 모세혈관확장증(HHT)이라는 혈관이형성증을 동반한 혈관성 희귀 질환의 발병을 담당합니다. Acvrl1+/- 내피 새싹의 고배율 사진은 모체에 대해 임의의 각도로 새싹당 더 많은 내피 팁 세포와 더 많은 가지를 가지고 있음을 보여주었습니다. 이들은 시험관 내에서 HHT 마우스에서 관찰된 잘못된 표현형을 확인했습니다(그림 4).
형광 표지된 분화된 mESC 및 특정 유전자형의 mESC를 포함하는 키메라 EB를 형성함으로써, 내피 팁 선택 과정을 연구하기 위한 대체 프로토콜이 포함된다(도 5A-C). PECAM-1 표지된 혈관 새싹의 공초점 이미지는 주요 내피 팁 세포의 유전형 기원을 확인했습니다(그림 5B). 1:1 비율의 야생형 YFP(노란색 형광 단백질) mESC 라인과 표지되지 않은 하나의 mESC 야생형 라인의 혼합물은 주요 내피 팁 세포에 대한 각 집단의 동일한 기여를 일관되게 유도했습니다(그림 5C).
이 프로토콜은 또한 혈관 새싹의 벽화 세포 범위를 정량화하는 데 적합합니다. 혈관신생을 겪은 EB를 고정하고 PECAM-1(내피 세포, 빨간색) 및 α-평활근 액틴(α-SMA)(벽화 세포, 녹색)에 대해 염색했습니다(그림 5D). 고배율 이미지는 하나의 개별 혈관 새싹이 벽화 세포로 둘러싸인 방법을 보여주었습니다(그림 5E, 왼쪽). ImageJ 소프트웨어를 사용하여 α-SMA(+) 벽화 세포로 덮인 PECAM-1(+) 혈관의 비율을 정량화하기 위해 색상 채널 분리(그림 F-G) 후 이진 변환을 수행했습니다(그림 5H).

그림 1: 프로토콜 절차의 타임라인 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
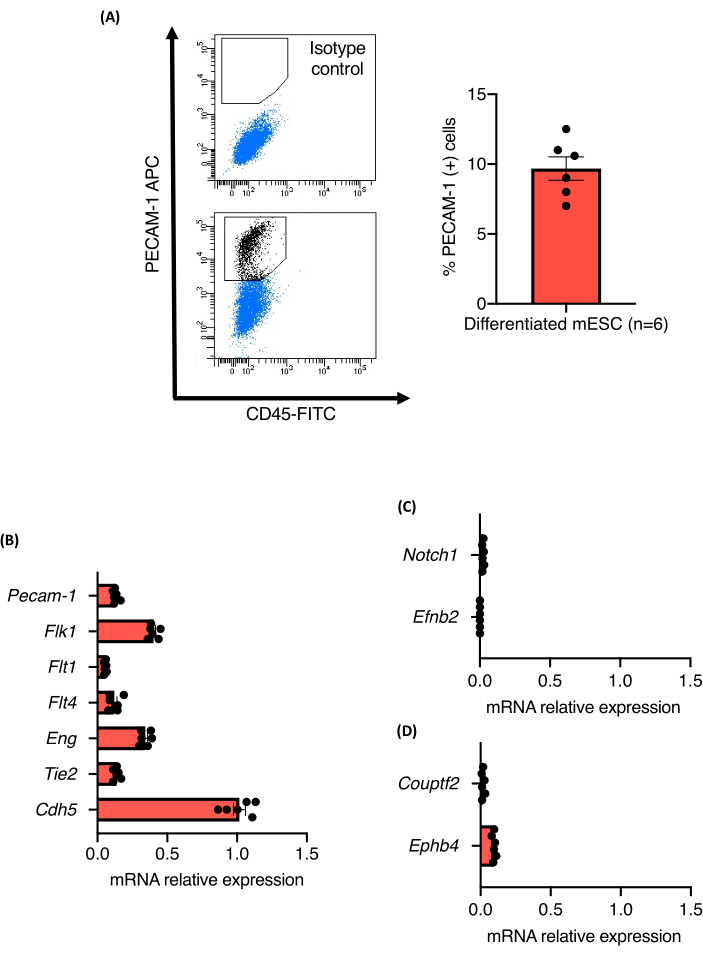
그림 2: EB 내부의 mESC 혈관 분화에서 파생된 EC의 특성화. (A) 9일령 EB로부터의 CD31 발현의 유세포 분석 및 Pecam-1(+) 세포의 백분율 정량화. (B-D) 9일령 EB의 분류된 내피 세포에서 Pecam-1, Flk1, Flt1, Flt4, Eng, Tie2, Cdh5, Notch1, EfnB2, Couptf2 및 EphB4의 mRNA 발현 수준. 오차 막대는 평균의 평균 ± 표준 오차(SEM)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
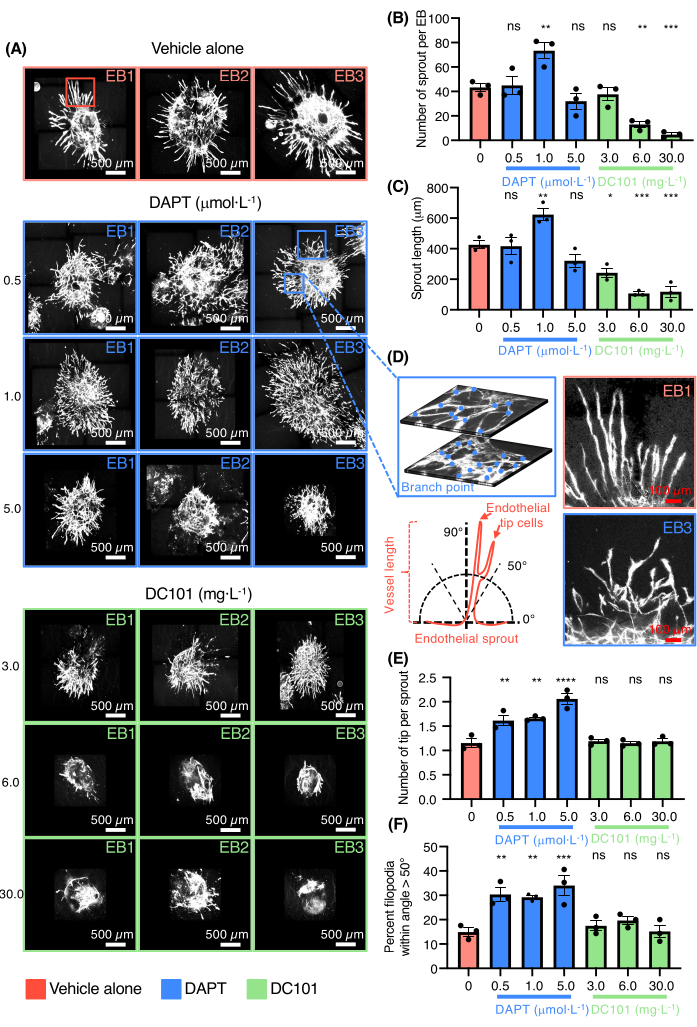
그림 3: 약물 검사를 위한 3D 발아 혈관신생 분석. (A) 비히클 단독으로 처리된 Pecam-1(백색, 내피 세포)에 대해 염색된 3개의 대표적인 EB의 컨포칼 이미지, DAPT(0.5 μmol· L-1, 1.0 μmol· L-1, 5.0 μmol· L-1) 또는 DC101(3mg· L-1, 6 mg· L-1, 30 mg· L-1)입니다. (B) EB 당 콩나물 수의 정량화. (C) 새싹 길이의 정량화. (D) 왼쪽 상단 패널에는 내피 새싹의 고배율이 동일한 EB의 두 개의 다른 레이어에서 네트워크 복잡성과 분기점 계수를 보여주고, 왼쪽 하단 패널에는 내피 새싹 방향의 측정 방법을 나타내는 개략도가 있습니다. 우측 상단 패널은 차량 단독으로 내피 새싹을 고배율로 하고, 우측 하단 패널은 DAPT(0.5μmol· L-1) 조건. (E) 새싹 당 팁 세포 수의 정량화. (F) 각도 >50° 이내의 필로포디아 백분율 정량화. 모든 막대는 짝을 이루지 않은 일원 분산 분석의 평균 ± SEM 및 p 값을 나타냅니다. ns = 유의하지 않음, *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 유전성 출혈성 모세혈관확장증 EB에서 돋아나는 결함 있는 혈관. 상단 패널에는 Pecam-1(흰색, 내피 세포)에 대해 염색된 Acvrl1+/+ 및 Acvrl1+/- 유전자형의 대표적인 12일 된 EB의 컨포칼 이미지입니다. 하단 패널에는 Acvrl1+/- 내피 새싹(상단 패널의 흰색 상자)의 고배율이 있으며 수많은 팁 세포(빨간색 화살표), 내피 분기점(파란색 점) 및 발아 잘못된 안내 표현형(녹색 화살표)을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 3D 발아 분석을 사용한 팁/줄기 세포 위치 및 혈관 성숙 연구. (A) Pecam-1(빨간색, 내피 세포)에 대해 염색된 7ACS/EYFP 야생형 세포주와 1:1로 혼합된 R1 야생형 세포주로 만든 대표적인 12일 된 키메라 EB의 컨포칼 이미지. 빨간색 화살표는 R1 세포주의 팁 세포를 나타내고 녹색 화살표는 7ACS/EYFP 세포주의 팁 세포를 나타냅니다. (B) 새싹을 따라 R1 및 7ACS/EYFP 내피 세포의 분포를 보여주는 내피 새싹의 고배율. (C) 대표적인 야생형 EB에서 상대적 유전자형 팁 세포의 정량화. (D) Pecam-1(빨간색, 내피 세포) 및 α-SMA(녹색, 벽화 세포)에 대해 염색된 대표적인 12일 된 EB의 컨포칼 이미지. (E) 벽화/내피 세포 상호작용을 보여주는 내피 새싹(D에서 흰색 직사각형 점선 상자)의 고배율. (에프지) 착색된 내피 새싹의 이미지와 관련 이진 변환된 이미지. (H) co-localized Pecam-1 및 α-SMA 염색의 이진 이미지. 벽화 세포로 덮인 내피 세포 새싹의 비율. 모든 막대는 평균 ± SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 혈관신생을 조절하는 약물 및 유전자를 스크리닝할 수 있는 편향되지 않고 강력하며 재현 가능한 3D EB 기반 혈관 발아 분석을 설명합니다. 이 방법은 이동(측면 스크래치 분석 또는 Boyden 챔버 분석)22,23 또는 증식(세포 수 계산, DNA 합성 검출, 증식 마커 검출 또는 대사 분석)24을 모니터링하기 위해 HUVEC(Human Umbilical Vein Endothelial Cells)와 같은 내피 세포 배양을 사용하는 널리 사용되는 많은 2차원(2D) 분석에 비해 이점을 제공합니다 내피 및 벽화 세포 분화와 혈관 신생의 주요 단계를 모방하는 혈관 네트워크로의 조직을 독특하게 연구할 수 있다는 점에서. 이러한 단계들은 내피 팁 세포 선택, 줄기 세포의 증식, 혈관 새싹의 공간적 배향 및 이동, 및 초기 혈관으로의 벽화 세포의 모집을 포함한다(25). 또한 많은 3D 혈관신생 모델에 이점을 제공합니다. 세뇨관 형성을 모방한 피브린 비드 26,27 또는 콜라겐 겔 분석28,29,30은 높은 증식률을 갖지만 배양에서 유지하기 어려운 마우스 일차 내피 세포에는 적합하지 않기 때문에 일반적으로 HUVEC 또는 ECFC-EC(Endothelial Colony Forming Cells derived Endothelial Cells)를 사용합니다. 생체 외 망막 외식편(31) 또는 혈관화된 미세 장기 분석(32)은 모든 혈관 형성 단계를 잘 요약할 수 있지만 복잡한 실험 절차를 가지고 있어 고처리량 약물 또는 유전자 스크리닝에는 적합하지 않습니다. 이는 생체 외 대동맥 고리 분석(ex vivo aortic ring assay)33,34 및 종종 비용이 많이 들고 많은 양의 데이터를 얻는 데 어려움이 있는 마우스에 이식된 종양 또는 마우스의 기능 상실 연구와 같은 많은 생체 내 분석에도 해당된다(35). 이 프로토콜은 또한 인간 iPSC를 사용하여 유사한 시험관 내 혈관신생 분석을 훌륭하게 보완하여 마우스와 인간 데이터 간의 비교를 가능하게 합니다. 인간 iPSC 유래 내피 세포가 마우스 세포보다 발아 능력이 낮다는 점에 유의하는 것이 중요합니다36,37.
여기에서 개발된 방법에도 몇 가지 제한 사항이 있습니다. 혈관 성숙, 혈관 투과성에 대한 유체 흐름의 영향을 평가할 수 없으며 최근 개발 중인 미세 가공 장치와 비교하여 특정 조직 환경에서 초기 혈관을 생성하지 않습니다. 실제로, 미세 유체 공학과 조직 공학을 결합한 장기 온 칩 기술은 배양된 내피 세포에 생체 내와 유사한 미세 환경을 제공할 수 있습니다 38,39. 미세 유체 시스템은 올바른 세포외 기질 구성을 포함하며 전단 응력과 같은 기계적 신호를 생성하도록 설계되었습니다. 일부는 주어진 조직의 벽화 세포 및 기타 지지 세포를 통합하도록 설계되거나 화학적 구배를 생성할 수 있습니다. 그들은 모세혈관과 크기와 구조가 유사한 미크론 규모의 유체 충전 채널 네트워크를 포함합니다. organ-on-chip 기술은 또한 투과성 및 경내피 전기 저항을 포함한 특정 혈관 기능의 정량화를 가능하게 합니다. 장기 칩 기술은 약속을 제공하지만 대부분의 생물학 실험실의 연구 전문성을 훨씬 뛰어 넘고 여전히 적절한 표준화가 필요하며 전문 제조 기술이 필요합니다. 장기 칩 기술 제조의 상용화는 이제 막 시작되었으며 이러한 시스템은 현재 제약 회사에게 엄청난 비용과 시간으로 간주됩니다40,41.
고려해야 할 몇 가지 중요한 단계가 있습니다. 만능 상태의 잘 수용된 마커(Nanog, Oct4, Sox2 및 SSEA-1)를 강력하게 발현하는 고품질 세포를 사용합니다. 이들의 성장, mES 세포 형태, mES 콜로니의 크기와 형태를 주의 깊게 모니터링하는 것이 중요합니다. 핵형 안정성은 배양된 세포에서 확률적이기 때문에 광범위한 계대배양 후 이를 재평가하는 것이 필수적입니다. mESC 배양에 대해 이미 테스트된 제품을 사용하고 MEF 피더, 태아 송아지 혈청 및 모든 화합물을 여러 계대에 테스트하여 mESC가 세포 특성을 유지하는지 또는 epiblastic 표현형을 구별 또는 획득하는지 여부를 감지하는 것이 좋습니다. 배지는 매일 새로 고쳐야하며 mESC 콜로니가 너무 크고 조밀 해져서는 안됩니다. 마지막으로, mESC는 내피 세포의 최상의 수율을 보장하기 위해 분화 전에 2i 없이 최소 2계대 동안 배양해야 합니다.
내피 분화는 두 가지 중요한 단계를 포함한다: 행잉 드롭 방법을 사용한 EB의 형성 및 혈관 분화 배지의 존재 하에 부유 조건 하에서의 배양13,14. 매달린 드롭 접시의 움직임은 균일한 세포 응집을 달성하기 위해 최소화되어야 합니다. 대부분의 경우 응집체를 형성하는 데 사용되는 mESC의 수는 800-1,000개 사이이지만, mESC가 129/ola와 다른 유전적 배경을 가지고 있는 경우 혈관화된 EB로의 최적 분화를 보장하기 위해 최적화가 필요할 수 있습니다. 부유 조건에서 배양할 때 EB는 조심스럽게 분배되어야 하며 EB 덩어리에 유리한 움직임을 피해야 합니다.
EB는 최종적으로 콜라겐 I 겔에서 배양되어 혈관 새싹을 형성합니다. 혈관신생 배지는 신선하게 준비해야 하며 콜라겐 I과 혼합되면 자발적인 겔화를 피하기 위해 얼음 위에서 유지해야 합니다. 약물 검사의 경우, 이 단계에서 적절한 농도로 차가운 혼합물에 약물을 첨가합니다. EB를 재현탁하기 전에 NaOH로 pH를 조정하는 것이 중요하며, 그렇지 않으면 콜라겐 산도가 세포 독성을 유발합니다. 마지막으로, EB는 재현 가능한 결과를 보장하기 위해 서로 등거리에 분산되어야 합니다.
결론적으로, 이 방법은 최근 Elling U. et al.에 의해 기술된 바와 같이 유전자 스크리닝에 사용되는 데 필요한 견고성과 확장성을 갖는 mESC를 기반으로 하는 3D 혈관 발아 분석을 도입합니다. 이는 반/동형접합 돌연변이 mESC16 의 큰 하플로뱅크를 생성하고 표현형 약물 발견 프로그램을 위한 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 Nederlandse organisatie voor gezondheidsonderzoek en zorginnovatie (ZonMW 446002501), Health Holland (LSHM19057-H040), Leading Fellows Program Marie Skłodowska-Curie COFUND 및 Association Maladie de Rendu-Osler (AMRO)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Milipore, Merck | 805740 | Biohazard: adequate safety instructions should be taken when handling |
| Agar Noble | Difco, BD Pharmigen | 214220 | |
| Alexa Fluo 555 goat anti rat IgG | Life technologies | A21434 | |
| APC conjugated rat anti-mouse PECAM-1 antibody (clone MEC13.3) | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control (Clone R35-95) | BD Biosciences | 553932 | |
| Axiovert 25 inverted phase contrast tissue culture microscope | ZEISS | ||
| Basic Fibroblast Growth Factor-2 (bFGF) | Peprotech | 450-33 | |
| Benchtop Centrifuge, Allegra X-15R | Beckman Coulter | 392932 | |
| Biosafety cabinet BioVanguard (Green Line) | Telstar | 133H401001 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| Cell counting chamber, Buerker, 0.100mm | Marienfeld | 640211 | |
| Cell culture dishes 60 x 15mm | Corning | 353802 | |
| Cell culture dishes, 35 x 10 mm | Corning | 353801 | |
| Cell culture plates 12-well | Corning | 3512 | |
| CFX96 Touch Real-Time PCR Detection System | Biorad | 1855196 | |
| Chicken serum | Sigma-Aldrich | C5405 | |
| CHIR-99021 (CT99021) HCl | Selleckchem | S2924 | |
| Collagen I, High Concentration, Rat Tail, 100mg | Corning | 354249 | |
| Collagenase A | Roche | 10103586001 | |
| Confocal Laser Scanning Microscope, TCS SP5 | Leica | ||
| Cover glasses, 24 × 50 mm | Vwr | 631-0146 | |
| DAPT γ?secretase inhibitor | Sigma Aldrich | D5942 | |
| DC101 anti mouse VEGFR-2 Clone | BioXcell | BP0060 | |
| DC101 isotype rat IgG1 | BioXcell | BP0290 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2438-5X | Biohazard: adequate safety instructions should be taken when handling |
| DPBS (10x), no calcium, no magnesium | Gibco, Thermofisher scientific | 14200067 | |
| EDTA 40 mM | Gibco, Thermofisher scientific | 15575-038 | |
| Embryonic stem-cell Fetal Bovine Serum | Gibco, Thermofisher scientific | 16141-079 | Should be lot-tested for maximum ES cell viability and growth. Heat inactivate at 60°C and store at −20 °C for up to 1 year |
| Eppendorf Microcentrifuge 5415R | Eppendorf AG | Z605212 | |
| Erythropoietin, human (hEPO), 250 U (2.5 µg) (1 mL) | Roche | 11120166001 | |
| ESGRO Recombinant Mouse LIF Protein (10? units 1 mL) | Milipore, Merck | ESG1107 | |
| Falcon tubes 15 mL | Greiner Bio-One | 188271 | |
| Falcon tubes 50 mL | Greiner Bio-0ne | 227270 | |
| Filter tip ,clear ,sterile F.Gilson, P-200 | Greiner Bio-One | 739288 | |
| Filter tip ,clear ,sterile F.Gilson, P10 | Greiner Bio-One | 771288 | |
| Filter tip ,clear ,sterile F.Gilson, P1000 | Greiner Bio-One | 740288 | |
| FITC conjugated anti-α Smooth Muscle Actin (SMA) (clone 1A4) | Sigma Aldrich | F3777 | |
| FITC conjugated rat anti-mouse CD45 (clone 30-F11) | Biolegend | 103107 | |
| FITC Rat IgG2b, κ Isotype Ctrl Antibody (clone RTK4530) | Biolegend | 400605 | |
| Fluorscent mounting media | DAKO | S3023 | |
| Gascompress | Cutisoft | 45846 | |
| Gauze Cutisoft 10 x 10 cm | Bsn Medical | 45844_00 | |
| Gel blotting paper, Grade GB003 | Whatman | WHA10547922 | |
| Gelatin solution, type B | Sigma-Aldrich | G1393-100 ml | |
| Glasgow's MEM (GMEM) | Gibco, Thermofisher scientific | 21710082 | |
| IHC Zinc Fixative | BD Pharmigen | 550523 | |
| IncuSafe CO2 Incubator | PHCBi | MCO-170AICUV-PE | |
| Interleukin-6, human (hIL-6) | Roche | 11138600001 | |
| L-Glutamine 200 mM | Gibco, Thermofisher scientific | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco, Thermofisher scientific | 11140035 | |
| Microscope slide box | Kartell Labware | 278 | |
| Microscope slide, Starfrost | Knittel glass | VS113711FKB.0 | |
| Mm_Cdh5_1_SG QuantiTect Primer Assay | Qiagen | QT00110467 | |
| Mm_Eng_1_SG QuantiTect Primer Assay | Qiagen | QT00148981 | |
| Mm_Epha4_1_SG QuantiTect Primer Assay | Qiagen | QT00093576 | |
| Mm_Ephb2_1_SG QuantiTect Primer Assay | Qiagen | QT00154014 | |
| Mm_Flt1_1_SG QuantiTect Primer Assay | Qiagen | QT00096292 | |
| Mm_Flt4_1_SG QuantiTect Primer Assay | Qiagen | QT00099064 | |
| Mm_Gapdh_3_SG QuantiTect Primer Assay | Qiagen | QT01658692 | |
| Mm_Kdr_1_SG QuantiTect Primer Assay | Qiagen | QT00097020 | |
| Mm_Notch1_1_SG QuantiTect Primer | Qiagen | QT00156982 | |
| Mm_Nr2f2_1_SG QuantiTect Primer Assay | Qiagen | QT00153104 | |
| Mm_Pecam1_1_SG QuantiTect Primer | Qiagen | QT01052044 | |
| Mm_Tek_1_SG QuantiTect Primer Assay | Qiagen | QT00114576 | |
| Mouse (ICR) Inactivated Embryonic Fibroblasts (2 M) | Gibco, Thermofisher scientific | A24903 | Store vials in liquid nitrogen (195.79 °C) indefinitely |
| Mouse embryonic stem cell line 7AC5/EYFP (ATCC SCRC-1033) | ATCC | SCRC-1033 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Hadjantonakis, A. K., et al. Mechanisms of Development. 76 (1–2), 79–90 (1998)]. |
| Mouse embryonic stem cell lines Acvrl1 +/- and Acvrl1 +/+ | Generated at Leiden University Medical Centre [Thalgott, J.H. et al. Circulation. 138 (23), 2698–2712 (2018)]. | ||
| Mouse embryonic stem cells line E14 | Provided by M Letarte laboratory and generated according to Cho, S. K., et al. Blood. 98 (13), 3635–3642 (2001). | ||
| Mouse embryonic stem cells line R1 (ATCC SCRC-1011) | ATCC | SCRC-1011 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Nagy, A., et al. Procedings of the National Academy of Sciences of the United States of America. 90 (18), 8424–8428 (1993)]. |
| Mouse embryonic stem cells line Z/Red (strain 129/Ola) | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada [Vintersten, K., et al. Genesis. 40 (4), 241–246 (2004)]. | ||
| NanoDrop 1000 UV/VIS Spectrophotometer | Thermo Fischer Scientific | ND-1000 | |
| PD0325901 | Selleckchem | S1036 | |
| PDGF-BB, Recombinant Human | Peprotech | 100-14B | |
| Pecam-1 antibody, Rat Anti-Mouse | BD Biosciences | 550274 | |
| Penicillin-streptomycin (10,000 U/mL) | Gibco, Thermofisher scientific | 15140122 | |
| Petri dish, PS, 94/16 mm, standard ,with vents, sterile | Greiner Bio-One | 633181 | |
| Pipetboy acu 2 | Integra-Biosciences | 155 019 | |
| Pipetman G Multichannel P8 x 200G | Gilson | F144072 | |
| Pipetman G Starter Kit, 4 Pipette Kit, P2G, P20G, P200G, P1000G | Gilson | F167360 | |
| Recombinant Human BMP-4 Protein | R&D Systems | 314-BP | |
| RNeasy Plus mini Kit | QIAGEN | 74134 | |
| Serological pipettes, 10 mL | Greiner Bio-One | 607 180 | |
| Serological pipettes, 25 mL | Greiner Bio-One | 760 180 | |
| Serological pipettes, 5 mL | Greiner Bio-One | 606 180 | |
| Sodium hydroxide (NaOH) | Merck | 106498 | |
| Sodium pyruvate 100 mM | Gibco, Thermofisher scientific | 11360039 | |
| Test tubes 5ml round-bottom with cell-strainer cap | Corning | 352235 | |
| Thermal cycler, T100 | Biorad | 1861096 | |
| Triton X-100 (BioXtra) | Sigma Aldrich | T9284 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher scientific | 15250061 | |
| Trypsin (2.5%) | Gibco, Thermofisher scientific | 15090046 | |
| Vacuum Filter/Storage Bottle System, 500 mL | Corning | 430758 | |
| VEGFA165 , recombinant murine | Peprotech | 450-32 | |
| Water, Sterile | Fresenius-Kabi | B230531 | |
| Waterbath, Lab-Line Digital | Thermo Fischer Scientific | 18052A |
참고문헌
- Moffat, J. G., Vincent, F., Lee, J. A., Eder, J., Prunotto, M. Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nature Reviews Drug Discovery. 16 (8), 531-543 (2017).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews. Drug Discovery. 15 (11), 751-769 (2016).
- Low, L. A., Mummery, C., Berridge, B. R., Austin, C. P., Tagle, D. A. Organs-on-chips: into the next decade. Nature Reviews. Drug Discovery. , (2020).
- Ma, C., Peng, Y., Li, H., Chen, W. Organ-on-a-Chip: A new paradigm for drug development. Trends in Pharmacological Sciences. 42 (2), 119-133 (2021).
- Swinney, D. C., Anthony, J. How were new medicines discovered. Nature Reviews Drug Discovery. 10 (7), 507-519 (2011).
- Hussain, S., et al. High-content image generation for drug discovery using generative adversarial networks. Neural Networks: The Official Journal of the INternational Neural Network Society. 132, 353-363 (2020).
- Scheeder, C., Heigwer, F., Boutros, M. Machine learning and image-based profiling in drug discovery. Current Opinion in Systems Biology. 10, 43-52 (2018).
- Wagner, B. K., Schreiber, S. L. The power of sophisticated phenotypic screening and modern mechanism-of-action methods. Cell Chemical Biology. 23 (1), 3-9 (2016).
- Scannell, J. W., Bosley, J. When quality beats quantity: Decision theory, drug discovery, and the reproducibility crisis. PLoS One. 11 (2), 0147215 (2016).
- Webster, J. D., Santagostino, S. F., Foreman, O. Applications and considerations for the use of genetically engineered mouse models in drug development. Cell and Tissue Research. 380 (2), 325-340 (2020).
- Howland, D. S., Munoz-Sanjuan, I. Mind the gap: models in multiple species needed for therapeutic development in Huntington's disease. Movement Disorders: Official Journal of the Movement Disorder Scoiety. 29 (11), 1397-1403 (2014).
- Galaris, G., Thalgott, J. H., Lebrin, F. P. G. Pericytes in hereditary hemorrhagic telangiectasia. Advances in Experimental Medicine and Biology. 1147, 215-246 (2019).
- Thalgott, J. H., et al. Decreased expression of vascular endothelial growth factor receptor 1 contributes to the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Circulation. 138 (23), 2698-2712 (2018).
- Lebrin, F., et al. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia. Nature Medicine. 16 (4), 420-428 (2010).
- Czechanski, A., et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nature Protocols. 9 (3), 559-574 (2014).
- Elling, U., et al. A reversible haploid mouse embryonic stem cell biobank resource for functional genomics. Nature. 550 (7674), 114-118 (2017).
- Cheng, J., et al. Targeting pericytes for therapeutic approaches to neurological disorders. Acta Neuropathologica. 136 (4), 507-523 (2018).
- Chade, A. R. Small vessels, big role: Renal microcirculation and progression of renal injury. Hypertension. 69 (4), 551-563 (2017).
- Jourde-Chiche, N., et al. Endothelium structure and function in kidney health and disease. Nature Reviews. Nephrology. 15 (2), 87-108 (2019).
- van Duinen, V., et al. Standardized and scalable assay to study perfused 3D angiogenic sprouting of iPSC-derived endothelial cells in vitro. Journal of Visualized Experiment: JoVE. (153), e59678 (2019).
- Chappell, J. C., Taylor, S. M., Ferrara, N., Bautch, V. L. Local guidance of emerging vessel sprouts requires soluble Flt-1. Developmental Cell. 17 (3), 377-386 (2009).
- Sato, Y., Rifkin, D. B. Inhibition of endothelial cell movement by pericytes and smooth muscle cells: activation of a latent transforming growth factor-beta 1-like molecule by plasmin during co-culture. Journal of Cell Biology. 109 (1), 309-315 (1989).
- Tchaikovski, V., Olieslagers, S., Bohmer, F. D., Waltenberger, J. Diabetes mellitus activates signal transduction pathways resulting in vascular endothelial growth factor resistance of human monocytes. Circulation. 120 (2), 150-159 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. International Journal of Experimental Pathology. 90 (3), 195-221 (2009).
- Herbert, S. P., Stainier, D. Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis. Nature Reviews Molecular Cell Biology. 12 (9), 551-564 (2011).
- Nakatsu, M. N., Hughes, C. C. An optimized three-dimensional in vitro model for the analysis of angiogenesis. Methods in Enzymology. 443, 65-82 (2008).
- Nakatsu, M. N., Davis, J., Hughes, C. C. Optimized fibrin gel bead assay for the study of angiogenesis. Journal of Visualized Experiments: JoVE. (186), (2007).
- Gau, D., et al. Pharmacological intervention of MKL/SRF signaling by CCG-1423 impedes endothelial cell migration and angiogenesis. Angiogenesis. 20 (4), 663-672 (2017).
- Torres-Estay, V., et al. Androgens modulate male-derived endothelial cell homeostasis using androgen receptor-dependent and receptor-independent mechanisms. Angiogenesis. 20 (1), 25-38 (2017).
- Merjaneh, M., et al. Pro-angiogenic capacities of microvesicles produced by skin wound myofibroblasts. Angiogenesis. 20 (3), 385-398 (2017).
- Rezzola, S., et al. In vitro and ex vivo retina angiogenesis assays. Angiogenesis. 17 (3), 429-442 (2014).
- Wang, X., Phan, D. T. T., George, S. C., Hughes, C. C. W., Lee, A. P. 3D Anastomosed microvascular network model with living capillary networks and endothelial cell-lined microfluidic channels. Methods in Molecular Biology. 1612, 325-344 (2017).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Laboratory Investigation; A Journal of Technical Methods and Pathology. 63 (1), 115-122 (1990).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. Journal of Cellular and Molecular Medicine. 13 (10), 4113-4136 (2009).
- Nowak-Sliwinska, P., et al. Consensus guidelines for the use and interpretation of angiogenesis assays. Angiogenesis. 21 (3), 425 (2018).
- Belair, D. G., Schwartz, M. P., Knudsen, T., Murphy, W. L. Human iPSC-derived endothelial cell sprouting assay in synthetic hydrogel arrays. Acta Biomaterialia. 39, 12-24 (2016).
- Bezenah, J. R., Kong, Y. P., Putnam, A. J. Evaluating the potential of endothelial cells derived from human induced pluripotent stem cells to form microvascular networks in 3D cultures. Scientific Reports. 8 (1), 2671 (2018).
- Henderson, A. R., Choi, H., Lee, E. Blood and lymphatic vasculatures on-chip platforms and their applications for organ-specific in vitro modeling. Micromachines (Basel). 11 (2), 147 (2020).
- Lin, D. S. Y., Guo, F., Zhang, B. Modeling organ-specific vasculature with organ-on-a-chip devices. Nanotechnology. 30 (2), 024002 (2019).
- Pollet, A., den Toonder, J. M. J. Recapitulating the vasculature using organ-on-chip technology. Bioengineering. 7 (1), 17 (2020).
- Cochrane, A., et al. Advanced in vitro models of vascular biology: Human induced pluripotent stem cells and organ-on-chip technology. Advanced Drug Delivery Reviews. 140, 68-77 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유