Method Article
体外 使用小鼠胚胎干细胞进行血管疾病建模和药物测试的血管生成的三维发芽测定
摘要
该测定利用分化成在3D胶原蛋白凝胶中培养的拟胚体的小鼠胚胎干细胞来分析体 外控制发芽血管生成的生物学过程。该技术可用于测试药物,模拟疾病以及在胚胎致命的缺失背景下研究特定基因。
摘要
诱导多能干细胞(iPSC)和基因编辑技术的最新进展使得为表型药物发现(PDD)程序开发了基于人类细胞的新型疾病模型。尽管这些新型设备可以更准确地预测研究药物在人类中的安全性和有效性,但它们的开发仍然强烈依赖于哺乳动物数据,特别是小鼠疾病模型的使用。因此,与人类类器官或器官芯片疾病模型并行,相关 体 外小鼠模型的开发对于评估物种与 体内 和 体外 条件之间的直接药物疗效和安全性比较的需求尚未得到满足。在这里,描述了利用分化成拟胚体(EB)的小鼠胚胎干细胞的血管发芽测定。培养到3D胶原凝胶上的血管化EB可形成扩张的新血管,这一过程称为发芽血管生成。该模型概括了 体内 萌芽血管生成的关键特征 - 从预先存在的血管网络形成血管 - 包括内皮尖端细胞选择,内皮细胞迁移和增殖,细胞引导,管形成和壁细胞募集。它适用于筛选调节血管生成的药物和基因,并与最近描述的基于人类 iPSC 技术的三维 (3D) 血管测定有相似之处。
引言
在过去的三十年中,基于靶点的药物发现(TDD)已被制药行业广泛用于药物发现。TDD包含明确的分子靶标,在疾病中起重要作用,并依赖于相对简单的细胞培养系统的开发以及用于药物筛选的读数1。TDD项目中使用的大多数典型疾病模型包括传统的细胞培养方法,例如癌细胞或在人工环境中生长的永生化细胞系和非生理基质。尽管其中许多模型为识别成功的候选药物提供了可行的工具,但由于其疾病相关性差,使用此类系统可能值得怀疑2。
对于大多数疾病,潜在的机制确实是复杂的,并且经常发现各种细胞类型,独立的信号通路和多组基因有助于特定的疾病表型。对于遗传性疾病也是如此,其中主要原因是单个基因的突变。随着最近人类诱导多能干细胞(iPSC)技术和基因编辑工具的出现,现在可以生成3D类器官和器官芯片疾病模型,可以更好地概括体内人类的复杂性3,4。这些技术的发展与对表型药物发现(PDD)计划的兴趣重新抬头有关1。PDD可以与经验性筛查进行比较,因为它们不依赖于对特定药物靶标身份的了解或关于其在疾病中的作用的假设。PDD方法现在越来越被公认为对发现一流药物做出了巨大贡献5。由于人类类器官和器官芯片技术的发展仍处于起步阶段,预计iPSC模型(辅以创新的成像和机器学习工具6,7)将在不久的将来提供多种新型的基于复杂细胞的疾病模型,用于药物筛选和相关PDD程序,以克服TDD方法的低生产率8,9.
虽然人类类器官和器官芯片模型可以为疾病复杂性和新药的鉴定提供重要的见解,但将药物带入新的临床实践也强烈依赖动物模型的数据来评估其疗效和安全性。其中,转基因小鼠无疑是哺乳动物最青睐的模型。它们具有许多优点,因为它们对哺乳动物的生成时间相对较短,具有许多与人类疾病相似的表型,并且可以很容易地进行遗传操作。因此,它们被广泛用于药物发现计划10。然而,弥合小鼠和人类之间的差距仍然是一个重要的挑战11。开发相当于人类类器官和器官芯片模型的 体 外小鼠模型可以至少部分填补这一空白,因为它将允许在 体内 小鼠和 体外 人类数据之间进行直接的药物疗效和安全性比较。
在这里,描述了小鼠拟胚体(EB)中的血管萌芽测定。血管由内皮细胞(血管壁内壁)、壁细胞(血管平滑肌细胞和周细胞)组成12。该协议基于小鼠胚胎干细胞(mESCs)的分化为血管化EB,使用悬挂液滴概括 从头 内皮细胞和壁细胞分化13,14。小鼠ESC可以很容易地在具有不同遗传背景的小鼠囊胚的分离第3.5天培养物中建立15。它们还为克隆分析、谱系追踪提供了可能性,并且可以很容易地进行基因操作以生成疾病模型13,16。
由于血管滋养所有器官,因此许多疾病(如果不是全部)与微脉管系统的变化有关也就不足为奇了。在病理条件下,内皮细胞可以采用活化状态或功能障碍,导致壁细胞死亡或从血管迁移。这些可导致血管生成过多或血管稀疏,可诱发异常血流和血管屏障缺陷,导致免疫细胞外渗和炎症12,17,18,19。因此,开发调节血管的药物的研究很高,并且已经确定了用于治疗靶向的多个分子参与者和概念。在这种情况下,所描述的方案特别适用于构建疾病模型和药物测试,因为它概括了体内发芽血管生成的关键特征,包括内皮尖端和茎细胞选择、内皮细胞迁移和增殖、内皮细胞引导、管形成和壁细胞募集。它还显示出与最近描述的基于人类iPSC技术的3D血管测定的相似之处20。
研究方案
1. mESC的培养基制备与培养
- 使用补充剂 1x 格拉斯哥 MEM (G-MEM BHK-21) 培养基与 10%(体积/体积)热灭活胎牛血清 (FBS)、0.05 mM β-巯基乙醇、1x 非必需氨基酸 (NEAA 1x)、2 mM L-谷氨酰胺和 1 mM 丙酮酸钠制备条件培养基 +/- (CM+/-)。
- 使用含有白血病抑制因子 (LIF) (1,500 U/mL) 和 0.1 mM β-巯基乙醇的补充剂 CM+/+ (CM+/+) 制备条件培养基 +/+ (CM+/+)。
- 使用含有1μM PD0325901和3μM CHIR99021的补充剂CM + / +培养基在两种抑制剂(CM + / + 2i)存在下制备条件培养基+ / +。
- 通过将 25 mL 预热的 2% 明胶溶液与不含钙和镁 (DPBS) 的 500 mL 磷酸盐缓冲盐水中混合来制备 0.1% 明胶溶液。
- 通过将胰蛋白酶 (2.5%) 与 TVP 1x(9.5% 10x DPBS、1 mM EDTA、0.01% 鸡血清、0.01% 胰蛋白酶 (2.5%) 在 H2O 中混合来制备 10x 胰蛋白酶磷酸 (TVP 10x) 缓冲液(1:10 比例,体积/体积)。
注意:通过0.22μm孔过滤器过滤所有溶液。将培养基长期储存在-20°C,并将其他试剂在4°C下保存长达3周(参见 材料表)。 - 用0.1%明胶溶液(每孔500μL)包覆两个12孔细胞培养板,并在CO 2培养箱(37°C,5%CO2,潮湿气氛)中孵育30分钟。
- 用PBS清洗明胶包被的板,并加入500μL CM + / -培养基。
- 在37°C下解冻两瓶1 x 106 冷冻保存的辐照小鼠胚胎成纤维细胞(MEF),并将细胞悬液转移到装有5mL CM + / -培养基的锥形管中。
- 在室温(RT)下以200× g 离心细胞5分钟。吸出培养基并将细胞沉淀轻轻重悬于12 mL CM + / -培养基中,浓度为1.67 x 105 个细胞/mL。
- 在 12 孔细胞培养板(2.4 x 105 个细胞/cm 2)中接种 500 μL MEF 悬浮液,并将板在 CO2 培养箱中孵育过夜 (o/n)。
- 在CM + / + 2i培养基中解冻一瓶冷冻保存的mESC (1 x 106)。
- 将 mESC 悬浮液接种在 1 mL CM + / + 2i 培养基中带有 MEF 的预洗 12 孔板上,并将板转移到 CO2 培养箱中。每天刷新介质。
- 在70%汇合时,用DPBS洗涤mESC菌落。加入 150 μL 温热的 10x TVP 缓冲液,并在室温下孵育 30 秒以启动酶解离。
- 小心地取出 TVP 缓冲液,将细胞重悬于 1 mL CM+/+ 2i 培养基中,并通过轻柔移液将菌落解离成单个细胞。
- 通过将细胞转移到带有MEF的新12孔细胞培养板(分裂比:1:3-1:5)来传代细胞。轻轻混合以分散细胞并在CO2 培养箱中孵育。
- 刷新培养基(2-3 mL)并每天观察细胞生长/形态。每 2 天以 70% 汇合度重复连续传代。在开始细胞分化之前切换到CM + / +培养基两次传代。
2. 吊坠液中的EB形成
- 通过补充碱性成纤维细胞生长因子(bFGF)(50 ng·mL-1)和骨形态发生蛋白4(BMP-4)(5 ng·mL-1)的CM + / -培养基来制备新鲜中胚层分化培养基,并保持在4°C直至使用。
- 用 500 μL 0.1% 明胶溶液涂覆 6 孔细胞培养板的一个孔,并将其置于 CO2 培养箱中 30 分钟。
- 用PBS清洗明胶包被的板,并加入500μL CM + / -培养基。
- 为了获得纯的mESC群体,在室温下用10x TVP缓冲液胰蛋白酶消化细胞培养板30秒,将细胞重悬于1mL中胚层分化培养基中,然后将它们转移到明胶包被的6孔板中30分钟,允许MEF附着,同时mESC保持悬浮状态。
- 将细胞悬液收集在 50 mL 锥形管中,并使用 Neubauer 血细胞计数器和台盼蓝染料对细胞进行活/死细胞排除。
- 在室温下以200× g 离心细胞5分钟。 除去上清液并将细胞沉淀重悬于中胚层分化培养基中,以达到每毫升4.55 x 104 个细胞。
- 用 15 mL 无菌水填充 94 mm 低附着聚苯乙烯培养皿的底部。
注意:使用3D发芽血管生成测定法测试一种特定条件时,需要四个含有悬挂液滴的培养皿(3.52 mL培养基中的1.6 x 105 个细胞)。 - 将细胞悬液转移到无菌塑料储液槽中,并在多通道移液器的四个位置上样,每通道 22 μL 细胞悬液(每 22 μL 液滴 1 x 103 个细胞)。
- 提起并倒置 94 毫米培养皿的盖子,并将其放在流动柜的干净表面上,内侧朝上。
- 在每个盖子的内表面上沉积40滴细胞悬液。小心地将盖子倒置,不要受到干扰,然后将其放回盘子上,使水滴面向水。
- 将培养皿在CO2 培养箱中孵育。将此视为分化第 0 天。将板保持4天以形成EB。
3. 尖端细胞位置的竞争测定
- 如前所述培养一种荧光和一种非荧光mESC系13。例如,使用标记为黄色和R1 mESC的7ACS/EYFP mESC。
- 通过混合等量的两条mESC线(1:1比例)来制备马赛克EB,并按照步骤2中所述在CO2 培养箱中孵育悬挂式滴式培养皿。
4. 用于血管分化的浮动EBs培养
- 在从悬挂液滴中收集EB之前,请准备以下内容。
- 在H2O中制备5%琼脂溶液,并通过高压灭菌(在120°C下20分钟)灭菌。
- 使用温热的 5% 琼脂溶液制备含有 1% 琼脂的 G-MEM BHK-21 培养基,并快速将 3 mL 倒入其中一个 60 mm 聚苯乙烯培养皿中。让琼脂在室温下凝固1小时。 将培养皿储存在4°C直至使用。
- 通过在CM+/-培养基中补充bFGF (100 ng·mL-1)和VEGF-A (50 ng·mL-1)来制备新鲜的2x血管分化培养基。将培养基储存在4°C直至使用。
- 使用 P1000 移液管将悬挂液滴收集在 15 mL 锥形管中,并在 EB 沉降几分钟后除去上清液。
- 将EB重悬于3 mL的2x血管分化培养基中,将EB悬浮液转移到一个琼脂包被的培养皿中,均匀分布EB以避免聚集。
- 在 CO2 培养箱中孵育培养皿,并在 bFGF (50 ng·mL-1) 和 VEGF-A (25 ng·mL-1) 存在下使用 1x 血管分化培养基每 2 天刷新培养基,直到第 9 天。
- 或者,在血管分化培养基中加入血小板衍生生长因子-BB(PDGF-BB)(第4天10 ng·mL-1,第6天和第8天5 ng·mL-1)以促进壁细胞分化。
5. 流式细胞术分析
- 使用 P1000 移液管将 9 天大的 EB 收集在 15 mL 锥形管中,并用温热的 PBS 清洗一次。
- 加入含有0.2mg·mL-1胶原酶A的1mL G-MEM BHK-21培养基,将细胞在CO2 培养箱中孵育5分钟。
- 用 P1000 移液器轻轻上下移液,解离 EB。
- 通过加入 1 mL 含有 10% FBS 的冷 G-MEM BHK-21 培养基来停止胶原酶活性。
- 在室温下以200× g 离心细胞5分钟。
- 将细胞重悬于含有 2% FBS 的 500 μL PBS 中。
- 使用Neubauer血细胞计数器计数细胞。
- 将 400,000 个细胞重悬于 100 μL PBS 中,每个染色条件含有 2% FBS。
- 将细胞在4°C下与以下抗体孵育45分钟:APC偶联大鼠抗小鼠PECAM-1抗体(克隆MEC13.3)和FITC偶联大鼠抗小鼠CD45(克隆30-F11)或同种型对照抗体。
- 用含有 1% FBS 的 1 mL PBS 洗涤细胞两次。
- 重悬细胞以达到每毫升 5 x 106 个 细胞的终浓度。
- 使用带有细胞过滤器卡扣盖的圆底聚苯乙烯试管过滤细胞。
- 通过流式细胞术分析 20,000 个 PECAM-1 (+) 事件。
6.3D 发芽血管生成测定和免疫荧光染色
- 在第9天,通过加入10%FBS(体积/体积)、bFGF(50 ng·mL-1)、VEGF-A(25 ng·mL-1)、人重组促红细胞生成素(hEPO)(20 ng·mL-1)、人白细胞介素-6(IL-6)(10 ng·mL-1)、0.05 mM β-巯基乙醇、NEAA(1x)、L-谷氨酰胺(1x)、丙酮酸钠(1x)、I.型大鼠尾部胶原蛋白(1.25 mg·mL-1)、制备发芽培养基, 和氢氧化钠(3.1 mM)至GMEM BHK-1培养基。
- 为避免胶原蛋白凝胶化,请在使用前将发芽培养基保持在冰上。
- 为了评估促/抗血管生成分子的作用,将选定的药物或载体以选定的浓度添加到发芽培养基中。
- 从 15 mL 锥形管(相当于一种条件)中的一个 60 mm 琼脂培养皿中收集 9 天大的 EB,并在沉降几分钟后除去上清液。
- 用1mL发芽培养基覆盖35mm培养皿的底部,并在37°C下孵育5分钟以诱导凝胶化。
- 将 EB 重悬于 2 mL 冷发芽培养基中。
- 将悬浮液转移到涂有第一层发芽培养基的35mm培养皿中。
- 将EB分布在整个板上,并确保它们彼此之间的距离相等。将培养皿在CO2 培养箱中孵育。第一个发芽形成发生在24-48小时内。
- 在第12天,使用刮刀将含有EB的胶原蛋白凝胶小心地转移到载玻片(75 x 26 mm)上。
- 使用移液管(P1000)除去多余的液体,并通过在凝胶顶部放置尼龙亚麻纱布片和吸收性滤纸(凝胶吸墨纸)来脱水凝胶。通过放置重物(250克)2分钟来施加压力。小心地取出尼龙/滤纸,让载玻片在室温下风干30分钟。
- 用PBS在室温下洗涤载玻片三次5分钟。
- 使用锌溶液(见 材料表)在4°C下固定EB。 或者,在黑暗中用多聚甲醛(PFA)(4%)o / n在4°C下固定马赛克荧光EB。
- 取出固定剂。用PBS在室温下清洗载玻片五次5分钟。
- 在室温下透化含有0.1%Triton-X100的PBS中的EB15分钟。
- 取出透化溶液。用PBS清洗载玻片五次5分钟。
- 将EB在封闭缓冲液(PBS与2%牛血清白蛋白,BSA)中在室温下孵育1小时。
- 为了染色内皮芽,在4°C的封闭缓冲液o / n中使用大鼠抗小鼠抗PECAM-1一抗(1:100稀释)。
- 用PBS清洗载玻片五次5分钟。
- 将载玻片与山羊抗大鼠Alexa 555二抗在封闭缓冲液(1:250稀释)中孵育,并在需要时在封闭缓冲液(1:250稀释)中与FITC偶联的抗α-SMA抗体一起在黑暗中的RT下染色壁细胞2小时。
- 在安装之前,用PBS清洗载玻片三次5分钟,用H20清洗一次。
7. EB内皮芽的共聚焦成像、形态测量和定量分析
- 通过使用共聚焦显微镜通过焦平面合并(z 堆叠)获取免疫染色 EB 的高分辨率图像。使用10倍放大物镜对整个EB进行成像。
- 分析使用 ImageJ 获取的图像,以评估形态并根据既定的定量方法13,14,21 量化 PECAM-1 阳性内皮芽的特征。
- 通过手动计算每个EB的总芽数来计算每个EB的平均内皮芽数。
- 使用 ImageJ 绘图工具测量各个芽的长度。从EB核心区域开始定义内皮芽的底部,并手动绘制一条线,直到芽尖结束。
- 通过手动计算每个芽芽的尖端细胞数来计算每个芽的尖端细胞数,然后计算每个EB的平均值。
- 通过手动确定亲本芽的轴来计算丝状伪足方向,并使用 ImageJ 软件角度工具测量它们之间的锐角。计算方向>50°的芽芽数,并将其除以感兴趣的EB的芽总数。
注意:角度始终在 0° 到 90° 之间。
- 使用共聚焦显微镜获取免疫染色EB的高分辨率图像。使用40倍放大物镜实现单个内皮芽的高分辨率图像。
- 使用 ImageJ 软件量化被 α-SMA 阳性 MC 包围的 PECAM-1 阳性 EC 芽的血管覆盖率。
- 将合并的图像拆分为单独的红色和绿色通道。
- 将图像转换为其二进制形式。
- 测量由PECAM-1(红色标记的内皮细胞)和α-SMA(绿色标记的壁细胞)阳性细胞分别占据的芽的总细胞面积。
- 使用图像计算器函数和 AND 运算符生成合并的图像。测量图像的总蜂窝面积。要计算覆盖范围,请将共定位图像的面积除以 PECAM-1 二值图像的面积。
- 为了分析由镶嵌EB开发的芽的内皮尖端/茎细胞位置的细胞竞争,手动评分尖端细胞的数量并根据荧光信号标记其基因型来源。计算每个EB的平均值。
结果
血管发芽测定的方案概述如图1所示。使用胶原酶A将来自三个独立的129 / Ola mESC系(Z / Red,R1和E14)的9天大的EB酶解散成单个细胞.对细胞进行PECAM-1染色并通过荧光激活细胞分选(FACS)进行分析。所有细胞系均表现出强大的内皮分化,并且未观察到其分化为内皮细胞的能力存在差异。所有细胞系产生约10.5%±1.3%的内皮细胞(图2A)。还定量了PECAM-1(+)细胞群中PAN内层细胞标志物的相对表达水平。所有分析的标记物(Flk1、Flt1、Flt4、Eng、Tie2 和 Cdh5)的 mRNA 表达水平在细胞系和实验之间相当,证实了分化方案的稳健性(图 2B)。 PECAM-1(+)细胞群仅表达非常低的动脉(Notch1和Efnb2)或静脉(Couptf2和Ephb4)标记物的mRNA水平,支持该方案产生的内皮细胞的相对不成熟状态(图2C)。
然后证明了血管萌芽EB模型筛选调节血管生成的药物的能力(图3)。测试DC101和DAPT(N-[N-(3,5-二氟苯乙酰基)-拉兰基]-S-苯基甘氨酸叔丁酯)。这些化合物广泛用于小鼠中,通过抑制VEGFR2活性分别阻断血管生成,或通过靶向Notch信号促进内皮尖端细胞分化和致密血管丛的形成(图3A)。VEGF和Notch信号通路都是体内发芽血管生成的关键调节因子。评估了不同浓度的DC101和DAPT在接种在胶原蛋白I中的EB中的影响。DC101的高剂量范围为6-30毫克·L-1抑制血管芽的数量和长度,而DAPT在1 μmol·L-1(图3B-C)。 还提供了在DAPT存在下培养的EB的PECAM-1染色的血管芽的高放大倍率图像(图3D)。DAPT即使在0.5-1μmol·的低剂量范围内也是如此。L-1强烈增加了具有误导表型的血管芽的内皮尖端细胞的数量(图3D-F)。 高剂量的DAPT也导致血管聚结和形成大而平坦的内皮细胞区域而没有组织(图3A)。结果证实了该模型测试促进或抑制血管生成的药物的能力。
为了确认该模型适用于模拟血管疾病,提供了源自 Acvrl1 + / - mESC的EB的共聚焦图像。 Acvrl1 基因编码ALK1(激活素受体样激酶1),ALK1是一种在内皮细胞中特异性表达的受体,如果突变,则会导致血管发育不良的血管罕见疾病的发展,称为遗传性出血性毛细血管扩张症(HHT)。 Acvrl1+/- 内皮芽的高放大倍率图片显示,它们具有更多的内皮尖端细胞和每个芽的分支,相对于母体血管呈随机角度。这些在 体外 证实了在HHT小鼠中观察到的误导表型(图4)。
通过形成含有分化mESC荧光标记和特定基因型mESC的嵌合EB,包括研究内皮尖端选择过程的替代方案(图5A-C)。PECAM-1标记的血管芽的共聚焦图像确定了领先的内皮尖端细胞的基因型起源(图5B)。以1:1的比例将野生型YFP(黄色荧光蛋白)mESC系与一个未标记的mESC野生型系的混合物一致导致每个群体对领先的内皮尖端细胞的贡献相等(图5C)。
该协议也适用于量化血管芽的壁细胞覆盖率。固定并染色进行血管生成的EB进行PECAM-1(内皮细胞,红色)和α-平滑肌肌动蛋白(α-SMA)(壁细胞,绿色)染色(图5D)。高放大倍率图像揭示了一个单独的血管发芽是如何被壁细胞包围的(图5E,左)。在颜色通道分离后进行二元变换(图 F-G),以使用 ImageJ 软件量化 α-SMA (+) 壁画细胞覆盖的 PECAM-1 (+) 血管的比例(图 5H)。

图 1:协议程序的时间表。 请点击此处查看此图的大图。
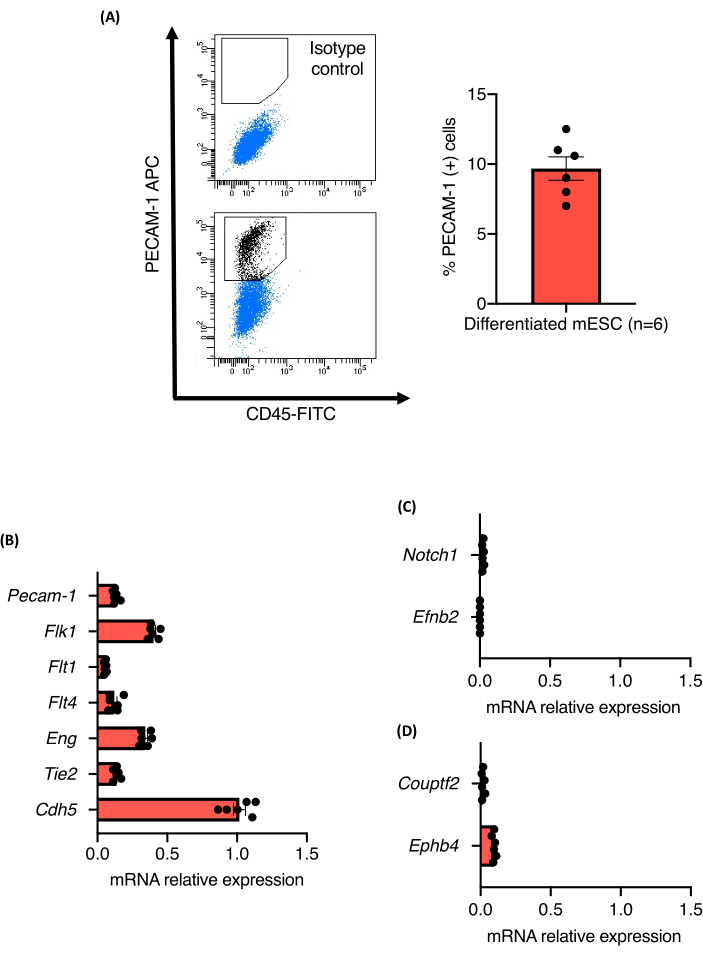
图 2:源自 EB 内 mESC 血管分化的 EC 的表征。 (A)9天大的EB的CD31表达的流式细胞术分析和Pecam-1(+)细胞百分比的定量。(B-D) 来自 9 天龄 EB 的分选内皮细胞中 Pecam-1、Flk1、Flt1、Flt4、Eng、Tie2、Cdh5、Notch1、EfnB2、Couptf2 和 EphB4 的 mRNA 表达水平。 误差线表示平均值±平均值的标准误差 (SEM)。请点击此处查看此图的大图。
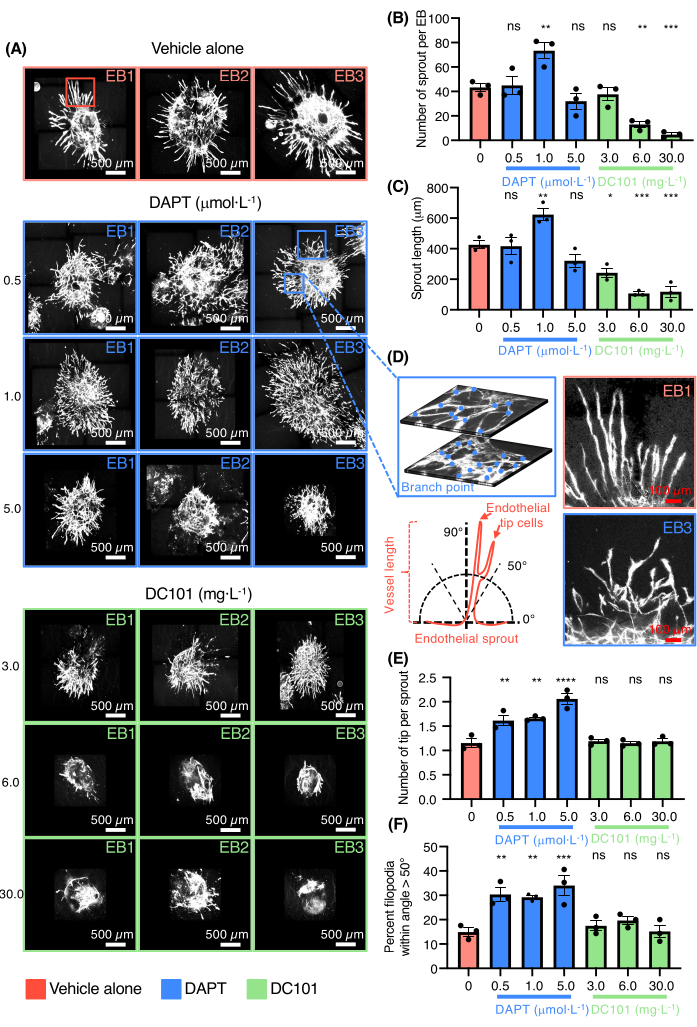
图 3:用于药物测试的 3D 发芽血管生成测定。 (A) 仅用载体 DAPT 处理的 Pecam-1(白色内皮细胞)染色的三个代表性 EB 的共聚焦图像(0.5 μmol·L-1, 1.0 μmol·L-1, 5.0 μmol·L-1)或DC101(3毫克·L-1, 6 毫克·L-1, 30毫克·L-1)。(B)量化每个EB的芽数。(C)萌芽长度的量化。(D)在左上图上,内皮芽的高放大倍率显示了网络复杂性和分支点计数在来自同一EB的两个不同层上,在左下面板上是表示内皮芽定向测量方法的示意图。在右上方的面板上,仅来自车辆的内皮芽的高放大倍率,在右下面板上,来自DAPT的内皮芽的高放大倍率(0.5μmol·L-1)条件。(E)定量每个芽的尖端细胞数量。(F)角>50°内丝状伪足百分比的量化。所有条形均表示未配对单因素方差分析检验的 SEM 和 p 值平均值±。ns = 不显著,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。 请点击此处查看此图的大图。

图 4:遗传性出血性毛细血管扩张 EB 中有缺陷的血管发芽。 在顶部面板上,来自 Acvrl1+/+ 和 Acvrl1+/ - 基因型的代表性 12 天大 EB 的共聚焦图像染色为 Pecam-1(白色内皮细胞)。在底部面板上, Acvrl1 + / - 内皮芽的高放大倍率(顶部面板的白框)显示许多尖端细胞(红色箭头),内皮分支点(蓝点)和发芽误导表型(绿色箭头)。 请点击此处查看此图的大图。

图 5:使用 3D 发芽测定法研究尖端/茎细胞位置和血管成熟。 (A) 由 R1 野生型细胞系与 Pecam-1(红色内皮细胞)染色的 7ACS/EYFP 野生型细胞系 1:1 混合而成的代表性 12 天龄嵌合 EB 的共聚焦图像。红色箭头表示来自R1细胞系的尖端细胞,绿色箭头表示来自7ACS / EYFP细胞系的尖端细胞。(B)内皮芽的高放大倍率显示R1和7ACS / EYFP内皮细胞沿芽的分布。(C)定量来自代表性野生型EB的相对基因分型尖端细胞。(D) 对Pecam-1(红色内皮细胞)和α-SMA(绿色壁细胞)染色的代表性 12 天大 EB 的共聚焦图像。(E)内皮芽的高放大倍率(D的白色矩形虚线框)显示壁画/内皮细胞相互作用。(F-G)彩色内皮芽的图像及其相关的二元转换图像。(H) 共定位 Pecam-1 和 α-SMA 染色的二值图像。壁细胞覆盖的内皮细胞芽的比例。所有条形均值代表 SEM ±平均值。 请点击此处查看此图的大图。
讨论
该协议描述了一种无偏倚,稳健且可重复的基于3D EB的血管发芽测定,该测定适用于筛选调节血管生成的药物和基因。与许多广泛使用的二维 (2D) 测定相比,该方法具有优势,使用内皮细胞培养物(例如人脐静脉内皮细胞 (HUVEC)来监测迁移(横向划痕测定或 Boyden 室测定)22,23 或增殖(计数细胞数量、DNA 合成检测、增殖标志物检测或代谢测定)24因为它独特地允许研究内皮细胞和壁细胞分化及其组织成模拟发芽血管生成关键步骤的血管网络。这些步骤包括内皮尖端细胞的选择,茎细胞的增殖,血管芽的空间取向和迁移,以及壁细胞募集到新生血管25。它还为许多3D血管生成模型提供了优势。模拟肾小管生成的纤维蛋白珠26,27或胶原凝胶测定28,29,30通常使用HUVEC或内皮集落形成细胞衍生的内皮细胞(ECFC-EC),因为它们具有高增殖率,但不适用于难以维持培养的小鼠原代内皮细胞。离体视网膜外植体31或血管化微器官测定32可以很好地概括所有血管形成步骤,但它们具有复杂的实验程序,不适合高通量药物或遗传筛选。对于离体主动脉环测定33,34和许多体内测定也是如此,例如植入小鼠的肿瘤或小鼠的功能丧失研究,这些研究通常具有高成本且难以获得大量数据35。该协议还很好地补充了使用人iPSC的类似体外血管生成测定,允许在小鼠和人类数据之间进行比较。尽管需要注意的是,人iPSC来源的内皮细胞表现出比小鼠细胞更低的发芽能力36,37。
这里开发的方法也有一些局限性。与最近正在开发的微加工设备相比,它无法评估液体流动对血管成熟,血管通透性的影响,并且不会在特定组织环境中产生新生血管。事实上,将微流体与组织工程相结合的器官芯片技术可以为培养的内皮细胞提供类似于体内的微环境38,39。微流体系统包含正确的细胞外基质组成,旨在产生剪切应力等机械信号。有些旨在结合壁细胞和给定组织的其他支持细胞,或者可以产生化学梯度。它们包含微米级流体填充通道网络,其大小和结构与毛细血管相似。器官芯片技术还可以量化特定的血管功能,包括通透性和经内皮电阻。尽管器官芯片技术提供了希望,但它们远远超出了大多数生物实验室的研究专业知识,仍然需要适当的标准化,并且需要专门的制造技术。器官芯片技术制造的商业化才刚刚开始,这些系统目前被认为对制药公司的成本和时间令人望而却步40,41.
应该考虑几个关键步骤。使用高质量细胞,这些细胞能有力地表达多能状态的广为接受的标记物(Nanog,Oct4,Sox2和SSEA-1)。必须仔细监测它们的生长、mES 细胞形状以及 mES 集落的大小和形态。由于核型稳定性在培养细胞中是随机的,因此在广泛传代后重新评估它是必不可少的。建议使用已经测试过 mESC 培养的产品,并检测 MEF 喂养器、胎牛血清和所有化合物多次传代,以检测 mESC 是否保持其细胞特性,或者它们是否分化或获得外胚层表型。培养基应每天更新,并且不应允许mESC菌落变得太大和致密。最后,在分化前,mESCs需要至少培养两次没有2i的传代,以确保内皮细胞的最佳产量。
内皮分化包括两个重要步骤:使用悬挂滴法形成EBs,并在血管分化培养基13,14存在下在漂浮条件下培养。应尽量减少悬挂液滴培养皿的移动,以实现均匀的细胞聚集。在大多数情况下,用于形成聚集体的mESC数量在800-1,000个细胞之间,但如果mESC的遗传背景与129 / ola不同,则可能需要优化,以确保最佳分化为血管化EB。在漂浮条件下培养时,EB需要仔细分布,避免有利于EB结块的移动。
EB最终在胶原蛋白I凝胶中培养以形成血管芽。血管生成培养基应新鲜制备,一旦与胶原蛋白混合,I必须保持在冰上以避免自发凝胶化。在药物测试的情况下,在此步骤中以正确的浓度将药物添加到冷混合物中。在重悬EB之前用NaOH调节pH值至关重要,否则胶原蛋白酸度会导致细胞毒性。最后,EB应彼此等距分布,以确保结果可重复。
总之,该方法引入了一种基于mESC的3D血管发芽测定,该测定具有用于遗传筛选所需的稳健性和可扩展性,如Elling U.等人最近描述的那样。 产生了半/纯合突变mESC16 的大型单倍银行和表型药物发现计划。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了荷兰组织(ZonMW 446002501),荷兰卫生(LSHM19057-H040),主要研究员计划Marie Skłodowska-Curie联合基金和Maladie de Rendu-Osler协会(AMRO)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Milipore, Merck | 805740 | Biohazard: adequate safety instructions should be taken when handling |
| Agar Noble | Difco, BD Pharmigen | 214220 | |
| Alexa Fluo 555 goat anti rat IgG | Life technologies | A21434 | |
| APC conjugated rat anti-mouse PECAM-1 antibody (clone MEC13.3) | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control (Clone R35-95) | BD Biosciences | 553932 | |
| Axiovert 25 inverted phase contrast tissue culture microscope | ZEISS | ||
| Basic Fibroblast Growth Factor-2 (bFGF) | Peprotech | 450-33 | |
| Benchtop Centrifuge, Allegra X-15R | Beckman Coulter | 392932 | |
| Biosafety cabinet BioVanguard (Green Line) | Telstar | 133H401001 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| Cell counting chamber, Buerker, 0.100mm | Marienfeld | 640211 | |
| Cell culture dishes 60 x 15mm | Corning | 353802 | |
| Cell culture dishes, 35 x 10 mm | Corning | 353801 | |
| Cell culture plates 12-well | Corning | 3512 | |
| CFX96 Touch Real-Time PCR Detection System | Biorad | 1855196 | |
| Chicken serum | Sigma-Aldrich | C5405 | |
| CHIR-99021 (CT99021) HCl | Selleckchem | S2924 | |
| Collagen I, High Concentration, Rat Tail, 100mg | Corning | 354249 | |
| Collagenase A | Roche | 10103586001 | |
| Confocal Laser Scanning Microscope, TCS SP5 | Leica | ||
| Cover glasses, 24 × 50 mm | Vwr | 631-0146 | |
| DAPT γ?secretase inhibitor | Sigma Aldrich | D5942 | |
| DC101 anti mouse VEGFR-2 Clone | BioXcell | BP0060 | |
| DC101 isotype rat IgG1 | BioXcell | BP0290 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2438-5X | Biohazard: adequate safety instructions should be taken when handling |
| DPBS (10x), no calcium, no magnesium | Gibco, Thermofisher scientific | 14200067 | |
| EDTA 40 mM | Gibco, Thermofisher scientific | 15575-038 | |
| Embryonic stem-cell Fetal Bovine Serum | Gibco, Thermofisher scientific | 16141-079 | Should be lot-tested for maximum ES cell viability and growth. Heat inactivate at 60°C and store at −20 °C for up to 1 year |
| Eppendorf Microcentrifuge 5415R | Eppendorf AG | Z605212 | |
| Erythropoietin, human (hEPO), 250 U (2.5 µg) (1 mL) | Roche | 11120166001 | |
| ESGRO Recombinant Mouse LIF Protein (10? units 1 mL) | Milipore, Merck | ESG1107 | |
| Falcon tubes 15 mL | Greiner Bio-One | 188271 | |
| Falcon tubes 50 mL | Greiner Bio-0ne | 227270 | |
| Filter tip ,clear ,sterile F.Gilson, P-200 | Greiner Bio-One | 739288 | |
| Filter tip ,clear ,sterile F.Gilson, P10 | Greiner Bio-One | 771288 | |
| Filter tip ,clear ,sterile F.Gilson, P1000 | Greiner Bio-One | 740288 | |
| FITC conjugated anti-α Smooth Muscle Actin (SMA) (clone 1A4) | Sigma Aldrich | F3777 | |
| FITC conjugated rat anti-mouse CD45 (clone 30-F11) | Biolegend | 103107 | |
| FITC Rat IgG2b, κ Isotype Ctrl Antibody (clone RTK4530) | Biolegend | 400605 | |
| Fluorscent mounting media | DAKO | S3023 | |
| Gascompress | Cutisoft | 45846 | |
| Gauze Cutisoft 10 x 10 cm | Bsn Medical | 45844_00 | |
| Gel blotting paper, Grade GB003 | Whatman | WHA10547922 | |
| Gelatin solution, type B | Sigma-Aldrich | G1393-100 ml | |
| Glasgow's MEM (GMEM) | Gibco, Thermofisher scientific | 21710082 | |
| IHC Zinc Fixative | BD Pharmigen | 550523 | |
| IncuSafe CO2 Incubator | PHCBi | MCO-170AICUV-PE | |
| Interleukin-6, human (hIL-6) | Roche | 11138600001 | |
| L-Glutamine 200 mM | Gibco, Thermofisher scientific | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco, Thermofisher scientific | 11140035 | |
| Microscope slide box | Kartell Labware | 278 | |
| Microscope slide, Starfrost | Knittel glass | VS113711FKB.0 | |
| Mm_Cdh5_1_SG QuantiTect Primer Assay | Qiagen | QT00110467 | |
| Mm_Eng_1_SG QuantiTect Primer Assay | Qiagen | QT00148981 | |
| Mm_Epha4_1_SG QuantiTect Primer Assay | Qiagen | QT00093576 | |
| Mm_Ephb2_1_SG QuantiTect Primer Assay | Qiagen | QT00154014 | |
| Mm_Flt1_1_SG QuantiTect Primer Assay | Qiagen | QT00096292 | |
| Mm_Flt4_1_SG QuantiTect Primer Assay | Qiagen | QT00099064 | |
| Mm_Gapdh_3_SG QuantiTect Primer Assay | Qiagen | QT01658692 | |
| Mm_Kdr_1_SG QuantiTect Primer Assay | Qiagen | QT00097020 | |
| Mm_Notch1_1_SG QuantiTect Primer | Qiagen | QT00156982 | |
| Mm_Nr2f2_1_SG QuantiTect Primer Assay | Qiagen | QT00153104 | |
| Mm_Pecam1_1_SG QuantiTect Primer | Qiagen | QT01052044 | |
| Mm_Tek_1_SG QuantiTect Primer Assay | Qiagen | QT00114576 | |
| Mouse (ICR) Inactivated Embryonic Fibroblasts (2 M) | Gibco, Thermofisher scientific | A24903 | Store vials in liquid nitrogen (195.79 °C) indefinitely |
| Mouse embryonic stem cell line 7AC5/EYFP (ATCC SCRC-1033) | ATCC | SCRC-1033 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Hadjantonakis, A. K., et al. Mechanisms of Development. 76 (1–2), 79–90 (1998)]. |
| Mouse embryonic stem cell lines Acvrl1 +/- and Acvrl1 +/+ | Generated at Leiden University Medical Centre [Thalgott, J.H. et al. Circulation. 138 (23), 2698–2712 (2018)]. | ||
| Mouse embryonic stem cells line E14 | Provided by M Letarte laboratory and generated according to Cho, S. K., et al. Blood. 98 (13), 3635–3642 (2001). | ||
| Mouse embryonic stem cells line R1 (ATCC SCRC-1011) | ATCC | SCRC-1011 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Nagy, A., et al. Procedings of the National Academy of Sciences of the United States of America. 90 (18), 8424–8428 (1993)]. |
| Mouse embryonic stem cells line Z/Red (strain 129/Ola) | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada [Vintersten, K., et al. Genesis. 40 (4), 241–246 (2004)]. | ||
| NanoDrop 1000 UV/VIS Spectrophotometer | Thermo Fischer Scientific | ND-1000 | |
| PD0325901 | Selleckchem | S1036 | |
| PDGF-BB, Recombinant Human | Peprotech | 100-14B | |
| Pecam-1 antibody, Rat Anti-Mouse | BD Biosciences | 550274 | |
| Penicillin-streptomycin (10,000 U/mL) | Gibco, Thermofisher scientific | 15140122 | |
| Petri dish, PS, 94/16 mm, standard ,with vents, sterile | Greiner Bio-One | 633181 | |
| Pipetboy acu 2 | Integra-Biosciences | 155 019 | |
| Pipetman G Multichannel P8 x 200G | Gilson | F144072 | |
| Pipetman G Starter Kit, 4 Pipette Kit, P2G, P20G, P200G, P1000G | Gilson | F167360 | |
| Recombinant Human BMP-4 Protein | R&D Systems | 314-BP | |
| RNeasy Plus mini Kit | QIAGEN | 74134 | |
| Serological pipettes, 10 mL | Greiner Bio-One | 607 180 | |
| Serological pipettes, 25 mL | Greiner Bio-One | 760 180 | |
| Serological pipettes, 5 mL | Greiner Bio-One | 606 180 | |
| Sodium hydroxide (NaOH) | Merck | 106498 | |
| Sodium pyruvate 100 mM | Gibco, Thermofisher scientific | 11360039 | |
| Test tubes 5ml round-bottom with cell-strainer cap | Corning | 352235 | |
| Thermal cycler, T100 | Biorad | 1861096 | |
| Triton X-100 (BioXtra) | Sigma Aldrich | T9284 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher scientific | 15250061 | |
| Trypsin (2.5%) | Gibco, Thermofisher scientific | 15090046 | |
| Vacuum Filter/Storage Bottle System, 500 mL | Corning | 430758 | |
| VEGFA165 , recombinant murine | Peprotech | 450-32 | |
| Water, Sterile | Fresenius-Kabi | B230531 | |
| Waterbath, Lab-Line Digital | Thermo Fischer Scientific | 18052A |
参考文献
- Moffat, J. G., Vincent, F., Lee, J. A., Eder, J., Prunotto, M. Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nature Reviews Drug Discovery. 16 (8), 531-543 (2017).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews. Drug Discovery. 15 (11), 751-769 (2016).
- Low, L. A., Mummery, C., Berridge, B. R., Austin, C. P., Tagle, D. A. Organs-on-chips: into the next decade. Nature Reviews. Drug Discovery. , (2020).
- Ma, C., Peng, Y., Li, H., Chen, W. Organ-on-a-Chip: A new paradigm for drug development. Trends in Pharmacological Sciences. 42 (2), 119-133 (2021).
- Swinney, D. C., Anthony, J. How were new medicines discovered. Nature Reviews Drug Discovery. 10 (7), 507-519 (2011).
- Hussain, S., et al. High-content image generation for drug discovery using generative adversarial networks. Neural Networks: The Official Journal of the INternational Neural Network Society. 132, 353-363 (2020).
- Scheeder, C., Heigwer, F., Boutros, M. Machine learning and image-based profiling in drug discovery. Current Opinion in Systems Biology. 10, 43-52 (2018).
- Wagner, B. K., Schreiber, S. L. The power of sophisticated phenotypic screening and modern mechanism-of-action methods. Cell Chemical Biology. 23 (1), 3-9 (2016).
- Scannell, J. W., Bosley, J. When quality beats quantity: Decision theory, drug discovery, and the reproducibility crisis. PLoS One. 11 (2), 0147215 (2016).
- Webster, J. D., Santagostino, S. F., Foreman, O. Applications and considerations for the use of genetically engineered mouse models in drug development. Cell and Tissue Research. 380 (2), 325-340 (2020).
- Howland, D. S., Munoz-Sanjuan, I. Mind the gap: models in multiple species needed for therapeutic development in Huntington's disease. Movement Disorders: Official Journal of the Movement Disorder Scoiety. 29 (11), 1397-1403 (2014).
- Galaris, G., Thalgott, J. H., Lebrin, F. P. G. Pericytes in hereditary hemorrhagic telangiectasia. Advances in Experimental Medicine and Biology. 1147, 215-246 (2019).
- Thalgott, J. H., et al. Decreased expression of vascular endothelial growth factor receptor 1 contributes to the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Circulation. 138 (23), 2698-2712 (2018).
- Lebrin, F., et al. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia. Nature Medicine. 16 (4), 420-428 (2010).
- Czechanski, A., et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nature Protocols. 9 (3), 559-574 (2014).
- Elling, U., et al. A reversible haploid mouse embryonic stem cell biobank resource for functional genomics. Nature. 550 (7674), 114-118 (2017).
- Cheng, J., et al. Targeting pericytes for therapeutic approaches to neurological disorders. Acta Neuropathologica. 136 (4), 507-523 (2018).
- Chade, A. R. Small vessels, big role: Renal microcirculation and progression of renal injury. Hypertension. 69 (4), 551-563 (2017).
- Jourde-Chiche, N., et al. Endothelium structure and function in kidney health and disease. Nature Reviews. Nephrology. 15 (2), 87-108 (2019).
- van Duinen, V., et al. Standardized and scalable assay to study perfused 3D angiogenic sprouting of iPSC-derived endothelial cells in vitro. Journal of Visualized Experiment: JoVE. (153), e59678 (2019).
- Chappell, J. C., Taylor, S. M., Ferrara, N., Bautch, V. L. Local guidance of emerging vessel sprouts requires soluble Flt-1. Developmental Cell. 17 (3), 377-386 (2009).
- Sato, Y., Rifkin, D. B. Inhibition of endothelial cell movement by pericytes and smooth muscle cells: activation of a latent transforming growth factor-beta 1-like molecule by plasmin during co-culture. Journal of Cell Biology. 109 (1), 309-315 (1989).
- Tchaikovski, V., Olieslagers, S., Bohmer, F. D., Waltenberger, J. Diabetes mellitus activates signal transduction pathways resulting in vascular endothelial growth factor resistance of human monocytes. Circulation. 120 (2), 150-159 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. International Journal of Experimental Pathology. 90 (3), 195-221 (2009).
- Herbert, S. P., Stainier, D. Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis. Nature Reviews Molecular Cell Biology. 12 (9), 551-564 (2011).
- Nakatsu, M. N., Hughes, C. C. An optimized three-dimensional in vitro model for the analysis of angiogenesis. Methods in Enzymology. 443, 65-82 (2008).
- Nakatsu, M. N., Davis, J., Hughes, C. C. Optimized fibrin gel bead assay for the study of angiogenesis. Journal of Visualized Experiments: JoVE. (186), (2007).
- Gau, D., et al. Pharmacological intervention of MKL/SRF signaling by CCG-1423 impedes endothelial cell migration and angiogenesis. Angiogenesis. 20 (4), 663-672 (2017).
- Torres-Estay, V., et al. Androgens modulate male-derived endothelial cell homeostasis using androgen receptor-dependent and receptor-independent mechanisms. Angiogenesis. 20 (1), 25-38 (2017).
- Merjaneh, M., et al. Pro-angiogenic capacities of microvesicles produced by skin wound myofibroblasts. Angiogenesis. 20 (3), 385-398 (2017).
- Rezzola, S., et al. In vitro and ex vivo retina angiogenesis assays. Angiogenesis. 17 (3), 429-442 (2014).
- Wang, X., Phan, D. T. T., George, S. C., Hughes, C. C. W., Lee, A. P. 3D Anastomosed microvascular network model with living capillary networks and endothelial cell-lined microfluidic channels. Methods in Molecular Biology. 1612, 325-344 (2017).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Laboratory Investigation; A Journal of Technical Methods and Pathology. 63 (1), 115-122 (1990).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. Journal of Cellular and Molecular Medicine. 13 (10), 4113-4136 (2009).
- Nowak-Sliwinska, P., et al. Consensus guidelines for the use and interpretation of angiogenesis assays. Angiogenesis. 21 (3), 425 (2018).
- Belair, D. G., Schwartz, M. P., Knudsen, T., Murphy, W. L. Human iPSC-derived endothelial cell sprouting assay in synthetic hydrogel arrays. Acta Biomaterialia. 39, 12-24 (2016).
- Bezenah, J. R., Kong, Y. P., Putnam, A. J. Evaluating the potential of endothelial cells derived from human induced pluripotent stem cells to form microvascular networks in 3D cultures. Scientific Reports. 8 (1), 2671 (2018).
- Henderson, A. R., Choi, H., Lee, E. Blood and lymphatic vasculatures on-chip platforms and their applications for organ-specific in vitro modeling. Micromachines (Basel). 11 (2), 147 (2020).
- Lin, D. S. Y., Guo, F., Zhang, B. Modeling organ-specific vasculature with organ-on-a-chip devices. Nanotechnology. 30 (2), 024002 (2019).
- Pollet, A., den Toonder, J. M. J. Recapitulating the vasculature using organ-on-chip technology. Bioengineering. 7 (1), 17 (2020).
- Cochrane, A., et al. Advanced in vitro models of vascular biology: Human induced pluripotent stem cells and organ-on-chip technology. Advanced Drug Delivery Reviews. 140, 68-77 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。