Method Article
インビトロ 血管疾患モデリングおよび薬物検査のためのマウス胚性幹細胞を用いた血管新生の三次元発芽アッセイ
要約
このアッセイは、3Dコラーゲンゲルで培養した胚様体に分化したマウス胚性幹細胞を利用して、 in vitroで発芽血管新生を制御する生物学的プロセスを解析します。この技術は、薬物の検査、疾患のモデリング、および胚的に致命的な欠失の文脈での特定の遺伝子の研究に適用できます。
要約
人工多能性幹細胞(iPSC)および遺伝子編集技術の最近の進歩により、表現型創薬(PDD)プログラムのための新しいヒト細胞ベースの疾患モデルの開発が可能になりました。これらの新しいデバイスは、ヒトにおける治験薬の安全性と有効性をより正確に予測することができますが、臨床への開発は依然として哺乳類のデータ、特にマウス疾患モデルの使用に強く依存しています。したがって、ヒトオルガノイドまたは臓器オンチップ疾患モデルと並行して、関連するin vitroマウスモデルの開発は、種間およびin vivoおよびin vitro条件との間の直接的な薬効および安全性比較を評価するための満たされていないニーズです。 ここでは、胚様体(EB)に分化させたマウス胚性幹細胞を利用する血管発芽アッセイについて説明する。3Dコラーゲンゲル上で培養された血管新生EBは、発芽血管新生と呼ばれるプロセスである拡張する新しい血管を発達させます。このモデルは、内皮先端細胞の選択、内皮細胞の移動と増殖、細胞誘導、管形成、壁細胞動員など、既存の血管網からの血管の形成であるin vivo発芽血管新生の重要な特徴を要約しています。血管新生を調節する薬物や遺伝子のスクリーニングに適しており、最近記載されたヒトiPS細胞技術に基づく3次元(3D)血管アッセイとの類似性を示しています。
概要
過去30年間、ターゲットベースの創薬(TDD)は、製薬業界による創薬に広く採用されてきました。TDDは、疾患において重要な役割を果たす定義された分子標的を組み込んでおり、比較的単純な細胞培養システムの開発と薬物スクリーニングのための読み出しに依存しています1。TDDプログラムで使用される最も典型的な疾患モデルには、人工環境および非生理学的基質内で増殖した癌細胞または不死化細胞株などの従来の細胞培養方法が含まれる。これらのモデルの多くは、成功した薬剤候補を特定するための実行可能なツールを提供していますが、そのようなシステムの使用は、疾患との関連性が低いため、疑わしい場合があります2。
ほとんどの疾患では、根底にあるメカニズムは確かに複雑であり、さまざまな細胞型、独立したシグナル伝達経路、および複数の遺伝子セットが特定の疾患表現型に寄与することがしばしば見られます。これは、主な原因が1つの遺伝子の突然変異である遺伝性疾患にも当てはまります。ヒト人工多能性幹細胞(iPSC)技術と遺伝子編集ツールの最近の登場により、in vivoのヒトの複雑さをよりよく再現できる3Dオルガノイドと臓器チップ疾患モデルを生成できるようになりました3,4。このような技術の開発は、表現型創薬(PDD)プログラムへの関心の復活に関連しています1。PDDは、特定の薬物標的の同一性に関する知識や疾患におけるその役割に関する仮説に依存しないため、経験的スクリーニングと比較することができます。PDDアプローチは、ファーストインクラスの医薬品の発見に大きく貢献することがますます認識されています5。ヒトオルガノイドおよび臓器オンチップ技術の開発はまだ初期段階にあるため、iPS細胞モデル(革新的なイメージングおよび機械学習ツール6,7で補完)は、近い将来、TDDアプローチの生産性の低さを克服するための薬物スクリーニングおよび関連するPDDプログラムのための複数の新しい複雑な細胞ベースの疾患モデルを提供することが期待されています8。9.
ヒトオルガノイドおよび臓器オンチップモデルは、疾患の複雑さと新薬の同定に関する重要な洞察を提供することができますが、薬物を新しい臨床診療に持ち込むには、動物モデルからのデータにも大きく依存して、その有効性と安全性を評価します。その中で、遺伝子改変マウスは確かに最も好ましい哺乳類モデルである。哺乳類の世代時間が比較的短く、人間の病気と多くの表現型が類似しており、簡単に遺伝子操作できるため、多くの利点があります。したがって、それらは創薬プログラムで広く使用されています10。しかし、マウスとヒトの間のギャップを埋めることは、依然として重要な課題です11。ヒトオルガノイドおよび臓器オンチップモデルと同等のin vitroマウスモデルの開発は、in vivoマウスとin vitroヒトデータ間の直接的な薬効および安全性比較を可能にするため、このギャップを少なくとも部分的に埋めることができます。
ここでは、マウス胚様体(EB)における血管発芽アッセイについて説明する。血管は、内皮細胞(血管壁の内層)、壁細胞(血管平滑筋細胞および周皮細胞)で構成されています12。このプロトコルは、de novo内皮細胞および壁細胞の分化を再現するハンギング液滴を使用して、マウス胚性幹細胞(mESC)を血管化EBに分化することに基づいています13,14。マウスESCは、異なる遺伝的背景を有する単離された3.5日目のマウス胚盤胞からの培養において容易に確立することができる15。それらはまた、クローン分析、系統追跡の可能性を提供し、疾患モデルを生成するために容易に遺伝子操作することができる13,16。
血管はすべての臓器に栄養を与えるので、すべてではないにしても多くの病気が微小血管系の変化に関連していることは驚くべきことではありません。病理学的状態では、内皮細胞は活性化状態をとるか、機能不全になり、壁細胞の死または血管からの遊走を引き起こす可能性があります。これらは、過剰な血管新生または血管希薄化をもたらす可能性があり、免疫細胞血管外漏出、および炎症につながる異常な血流および血管バリアの欠陥を誘発し得る12、17、18、19。したがって、血管を調節する薬物の開発のための研究は高度であり、治療標的のための複数の分子プレーヤーおよび概念がすでに同定されている。これに関連して、記載されたプロトコルは、内皮先端および茎細胞の選択、内皮細胞の遊走および増殖、内皮細胞の誘導、チューブ形成、および壁細胞動員を含むin vivo発芽血管新生の重要な特徴を要約するため、疾患モデルの構築および薬物試験に特に適している。また、ヒトiPS細胞技術に基づく最近記載された3D血管アッセイとの類似性も示しています20。
プロトコル
1. mESCの培地調製と培養
- サプリメント1xグラスゴーMEM(G-MEM BHK-21)培地を使用して、10%(vol/vol)熱不活化ウシ胎児血清(FBS)、0.05 mM β-メルカプトエタノール、1x非必須アミノ酸(NEAA 1x)、2 mM L-グルタミン、および1 mMピルビン酸ナトリウムを含むサプリメント1xグラスゴーMEM(G-MEM BHK-21)培地を使用して、コンディショニング培地+/-(CM+/-)を準備します。
- 白血病抑制因子(LIF)(1,500 U/mL)および0.1 mM β-メルカプトエタノールを含むサプリメントCM+/-培地を使用して、コンディショニング培地+/+(CM+/+)を調製します。
- 1 μM PD0325901および3 μM CHIR99021を含むサプリメントCM+/+培地を使用して、2つの阻害剤(CM+/+ 2i)の存在下でコンディショニング培地+/+を調製します。
- カルシウムとマグネシウムを含まないリン酸緩衝生理食塩水(DPBS)500 mLに25 mLの予熱した2%ゼラチン溶液を混合することにより、0.1%ゼラチン溶液を調製します。
- トリプシン(2.5%)とTVP 1x(9.5% 10x DPBS、1 mM EDTA、0.01%ニワトリ血清、0.01% トリプシン(2.5%)をH2O溶液中で混合することにより、10xリン酸トリプシンバーセン(TVP 10x)バッファーを調製します(1:10比、体積/体積)。
注:0.22μmのポアフィルターですべての溶液をろ過します。培養液を-20°Cで長期間保存し、他の試薬を4°Cで最大3週間保持します(材料表を参照)。 - 2枚の12ウェル細胞培養プレートを0.1%ゼラチン溶液(ウェルあたり500 μL)でコーティングし、CO2インキュベーター(37°C、5%CO2、湿潤雰囲気)で30分間インキュベートします。
- ゼラチンコーティングされたプレートをPBSで洗浄し、500 μLのCM+/-培地を加えます。
- 1 x 106 凍結保存された照射マウス胚性線維芽細胞(MEF)の2つのバイアルを37°Cで解凍し、細胞懸濁液を5 mLのCM+/-培地を含むコニカルチューブに移します。
- 細胞を200 x g で室温(RT)で5分間遠心分離します。培地を吸引し、細胞ペレットを12 mLのCM+/-培地に1.67 x 105 細胞/mLの濃度で静かに再懸濁します。
- 500 μLのMEF懸濁液を12ウェル細胞培養プレート(2.4 x 105 細胞/cm2)に播種し、CO2 インキュベーター内でプレートを一晩(o/n)インキュベートします。
- 凍結保存されたmESC(1 x 106)のバイアル1本をCM+/+ 2i培地で解凍します。
- 1 mLのCM+/+ 2i培地中のMEFを含む事前に洗浄した12ウェルプレートにmESC懸濁液を播種し、プレートをCO2 インキュベーターに移します。メディアを毎日更新します。
- 70%コンフルエントで、mESCコロニーをDPBSで洗浄します。150 μLの温かい10x TVPバッファーを加え、RTで30秒間インキュベートして酵素解離を開始します。
- TVPバッファーを注意深く除去し、細胞を1 mLのCM+/+ 2i培地に再懸濁し、穏やかなピペッティングによってコロニーを単一細胞に解離させます。
- 細胞をMEFを含む新しい12ウェル細胞培養プレートに移して継代します(分割比:1:3-1:5)。穏やかに混合して細胞を分配し、CO2 インキュベーター内でインキュベートする。
- 培地(2〜3 mL)をリフレッシュし、細胞の成長/形態を毎日観察します。2日ごとに70%のコンフルエンシーでシリアル継代を繰り返します。細胞分化を開始する前に、CM+/+培地に2回継代します。
2. ハンギングドロップでのEB形成
- CM+/-培地に塩基性線維芽細胞増殖因子(bFGF)(50 ng·mL-1)および骨形成タンパク質4(BMP-4)(5 ng・mL-1)を添加して、新鮮な中胚葉分化培地を調製し、使用するまで4°Cに保ってください。
- 6ウェル細胞培養プレートの1ウェルを500 μLの0.1%ゼラチン溶液でコーティングし、CO2 インキュベーターに30分間入れます。
- ゼラチンコーティングされたプレートをPBSで洗浄し、500 μLのCM+/-培地を加えます。
- 純粋なmESC集団を得るには、細胞培養プレートを10x TVPバッファーでRTで30秒間トリプシン処理し、細胞を1 mLの中胚葉分化培地に再懸濁した後、ゼラチンコーティングされた6ウェルプレートに30分間移し、mESCが懸濁したままMEFを付着させます。
- 50 mLのコニカルチューブに細胞懸濁液を採取し、ノイバウアー血球計算盤とトリパンブルー染料を使用して細胞をカウントし、生細胞/死細胞を排除します。
- 細胞を200 x g でRTで5分間遠心分離します。 上清を取り除き、細胞ペレットを中胚葉分化培地に再懸濁して、4.55 x 104 細胞/mLに到達させます。
- 94 mmの低アタッチメントポリスチレン皿の底に15 mLの滅菌水を入れます。
注:3D発芽血管新生アッセイを使用して1つの特定の状態をテストするには、ハンギングドロップ(3.52 mLの培地に1.6 x 105 細胞)を含む4つの皿が必要になります。 - 細胞懸濁液を滅菌プラスチックリザーバーに移し、マルチチャンネルピペットの4つの位置にチャンネルあたり22 μLの細胞懸濁液をロードします(22 μLドロップあたり1 x 103 セル)。
- 94 mmディッシュの蓋を持ち上げて反転させ、内側を上に向けてフローキャビネットのきれいな面に置きます。
- 各蓋の内面に40滴の細胞懸濁液を堆積させる。蓋を邪魔せずに慎重にひっくり返し、皿に戻して、滴が水に面するようにします。
- CO2 インキュベーターで皿をインキュベートします。これを分化 0 日目と考えてください。プレートを4日間維持してEBを形成します。
3. 先端細胞位置の競合アッセイ
- 前述のように1つの蛍光および1つの非蛍光mESC株を培養する13。例として、黄色でラベル付けされた7ACS/EYFP mESCおよびR1 mESCが使用されます。
- 等量の2つのmESCライン(1:1の比率)を混合してモザイクEBを調製し、ステップ2で説明したようにCO2 インキュベーター内でハンギングドロップディッシュをインキュベートします。
4. 血管分化のための浮遊EB培養
- ぶら下がっているドロップからEBを収集する前に、以下を準備します。
- H2O中の5%寒天溶液を調製し、オートクレーブ滅菌(120°Cで20分)して滅菌する。
- 温かい5%寒天溶液を使用して、1%寒天を含むG-MEM BHK-21培地を調製し、60 mmポリスチレン皿の1つに3 mLをすばやく注ぎます。寒天をRTで1時間固化させ、使用するまで皿を4°Cで保管します。
- CM+/-培地にbFGF(100 ng·mL-1)およびVEGF-A(50 ng·mL-1)を添加して、新鮮な2x血管分化培地を調製します。使用するまで培地を4°Cで保存してください。
- P1000ピペットを使用して15 mLコニカルチューブに吊り下げられた滴を集め、数分のEB沈降後に上清を除去します。
- EBを3 mLの2x血管分化培地に再懸濁し、EB懸濁液を1つの寒天コーティングされた皿に移し、凝集を避けるためにEBを均一に分配します。
- CO 2インキュベーターで皿をインキュベートし、bFGF(50 ng・mL-1)およびVEGF-A(25 ng・mL-1)の存在下で1x血管分化培地を使用して、9日目まで2日ごとに培地をリフレッシュします。
- あるいは、血小板由来成長因子-BB(PDGF-BB)(4日目に10 ng・mL-1、6日目と8日目に5 ng・mL-1)を血管分化培地に追加して、壁細胞の分化を促進します。
5. フローサイトメトリー解析
- P1000ピペットを使用して15 mLのコニカルチューブに生後9日目のEBを収集し、温かいPBSで1回洗浄します。
- 0.2 mg·mL-1のコラゲナーゼAを含むG-MEM BHK-21培地を1mL加え、細胞をCO2 インキュベーター内で5分間インキュベートします。
- P1000ピペットでゆっくりと上下にピペッティングしてEBを解離します。
- 10%FBSを含む1mLの冷たいG-MEM BHK-21培地を加えて、コラゲナーゼ活性を停止します。
- 細胞を200 x g でRTで5分間遠心分離します。
- 細胞を2%FBSを含む500 μLのPBSに再懸濁します。
- ノイバウアー血球計算盤を使用して細胞をカウントします。
- 染色条件ごとに2%FBSで100 μLのPBSで400,000細胞を再懸濁します。
- APC標識ラット抗マウスPECAM-1抗体(クローンMEC13.3)およびFITC標識ラット抗マウスCD45(クローン30-F11)またはアイソタイプコントロール抗体を用いて細胞を4°Cで45分間インキュベートします。
- 2%FBSを含む1 mLのPBSで細胞を2回洗浄します。
- 細胞を再懸濁して、mLあたり5 x 106 細胞の最終濃度に達します。
- セルストレーナースナップキャップ付きの丸底ポリスチレン試験管を使用して細胞をろ過します。
- フローサイトメトリーで20,000件のPECAM-1(+)イベントを解析します。
6.3D発芽血管新生アッセイおよび免疫蛍光染色
- 9日目に、10%FBS(容量/容量)、bFGF(50 ng·mL-1)、VEGF-A(25 ng·mL-1)、ヒト組換えエリスロポエチン(hEPO)(20 ng·mL-1)、ヒトインターロイキン-6(IL-6)(10 ng·mL-1)、0.05 mM β-メルカプトエタノール、NEAA(1x)、L-グルタミン(1x)、ピルビン酸ナトリウム(1x)、I型ラットテールコラーゲン(1.25 mg·mL-1)、 NaOH(3.1 mM)をGMEM BHK-1培地に置き換えます。
- コラーゲンのゲル化を避けるために、使用するまで発芽培地を氷の上に置いてください。
- 血管新生促進分子/抗血管新生分子の効果を評価するには、選択した薬物またはビヒクルを選択した濃度で発芽培地に追加します。
- 15 mLのコニカルチューブ(1つの条件に相当)の60 mm寒天ディッシュ1枚から9日齢のEBを収集し、数分の沈降後に上清を除去します。
- 35 mmの培養皿の底に1 mLの発芽培地を覆い、37°Cで5分間インキュベートしてゲル化を誘導します。
- EBを2 mLの冷発芽培地に再懸濁します。
- 懸濁液を発芽培地の第1層でコーティングした35 mm培養皿に移します。
- EBをプレート全体に分散させ、互いに等しい距離にあることを確認します。CO2 インキュベーターで皿をインキュベートします。最初の芽形成は24〜48時間以内に起こります。
- 12日目に、EBを含むコラーゲンゲルをスパチュラを使用してスライドガラス(75 x 26 mm)に注意深く移します。
- ピペット(P1000)を使用して余分な液体を取り除き、ナイロンリネンのガーゼシートと吸収性フィルターカード(ゲルブロッティング紙)をゲルの上に置いてゲルを脱水します。重り(250 g)を2分間置き、圧力をかけます。ナイロン/ろ紙を慎重に取り外し、スライドをRTで30分間風乾させます。
- スライドをPBSでRTで5分間3回洗浄します。
- 亜鉛溶液( 材料表を参照)を使用してEBを4°Cで固定します。 あるいは、モザイク蛍光EBをパラホルムアルデヒド(PFA)(4%)o/nで4°C暗所で固定します。
- 固定液を取り外します。スライドをPBSで5回RTで5分間洗浄します。
- 0.1%トリトン-X100を含むPBS中でEBをRTで15分間透過処理します。
- 透過処理液を取り除きます。スライドをPBSで5分間5回洗浄します。
- ブロッキングバッファー(PBSと2%ウシ血清アルブミン、BSA)でRTで1時間インキュベートします。
- 内皮スプラウトを染色するには、ラット抗マウス抗PECAM-1一次抗体(1:100希釈)をブロッキングバッファーo/nで4°Cで使用します。
- スライドをPBSで5分間5回洗浄します。
- ブロッキングバッファー(1:250希釈)中のヤギ抗ラットAlexa 555二次抗体でスライドをインキュベートし、必要に応じてブロッキングバッファー(1:250希釈)中のFITC結合抗α-SMA抗体を使用して、暗所でRTで2時間壁画細胞を染色します。
- スライドを取り付ける前に、スライドをPBSで5分間3回、H20で1回洗浄します。
7. EB内皮芽の共焦点イメージング、形態測定、定量解析
- 共焦点顕微鏡を用いた焦点面マージ(zスタッキング)により、免疫染色されたEBの高解像度画像を取得します。10倍の倍率対物レンズを使用して、EB全体を画像化します。
- ImageJを用いて取得した画像を解析し、確立された定量法に従ってPECAM-1陽性内皮スプラウトの特徴を定量化するために形態を評価した13、14、21。
- 個々のEBあたりの総芽数を手動でカウントすることにより、EBあたりの内皮スプラウトの平均数を計算します。
- ImageJ描画ツールを使用して、個々の芽の長さを測定します。EBコア領域から始まる内皮スプラウトの基部を定義し、スプラウト先端が終了するまで手動で線を引きます。
- 個々の芽あたりの先端細胞の数を手動で数えて、芽あたりの先端細胞の平均数を計算し、EBあたりの平均を計算します。
- 親芽の軸を手動で決定して糸足の向きを計算し、ImageJソフトウェア角度ツールを使用してそれらの間の鋭角を測定します。向きが>50°の芽の数を計算し、それを関心のあるEBの芽の総数で割ります。
注意: 角度は常に0°から90°の範囲でした。
- 共焦点顕微鏡を使用して免疫染色されたEBの高解像度画像を取得します。40倍の倍率対物レンズを使用して、単一の内皮芽の高解像度画像を実現します。
- ImageJソフトウェアを使用して、α-SMA陽性MCに囲まれたPECAM-1陽性ECスプラウトの血管被覆率を定量化します。
- マージされた画像を別々の赤と緑のチャンネルに分割します。
- 画像をバイナリ形式に変換します。
- PECAM-1(赤色で標識された内皮細胞)およびα-SMA(緑色で標識された壁画細胞)陽性細胞によって別々に占められたスプラウトの総細胞面積を測定する。
- 画像計算機関数とAND演算子を使用して、マージされた画像を生成します。画像の総セルラー面積を測定します。カバレッジを計算するには、共局在画像の面積を PECAM-1 バイナリ画像の面積で割ります。
- モザイクEBによって開発されたスプラウトの内皮先端/茎細胞位置の細胞競合を分析するには、先端細胞の数を手作業でスコアリングし、蛍光シグナルに基づいて遺伝子型起源をマークします。EB あたりの平均値を計算します。
結果
血管発芽アッセイのプロトコル概要を図1に示す。3つの独立した129/Ola mESC株(Z/Red、R1、およびE14)に由来する9日齢のEBを、コラゲナーゼAを用いて酵素的に単一細胞に解離させた。すべての細胞株が強固な内皮分化を示し、内皮細胞への分化能に差は認められなかった。全ての細胞株は、内皮細胞の約10.5%±1.3%を産生した(図2A)。PECAM-1(+)細胞集団におけるPANエンドテリアル細胞マーカーの相対発現レベルも定量化した。解析したすべてのマーカー(Flk1、Flt1、Flt4、 Eng、Tie2、Cdh5)のmRNA発現レベルは、細胞株と実験の間で同等であり、分化プロトコルの堅牢性が確認されました(図2B)。PECAM-1(+)細胞集団は、プロトコルによって生成された内皮細胞の比較的未成熟な状態を支持する動脈(Notch1およびEfnb2)または静脈(Couptf2およびEphb4)マーカーの非常に低いmRNAレベルのみを発現した(図2C)。
血管発芽EBモデルが血管新生を調節する薬物をスクリーニングする能力が実証されました(図3)。DC101およびDAPT(N-[N-(3,5-ジフルオロフェナアセチル)-ララニル]-S-フェニルグリシンt-ブチルエステル)を試験した。これらの化合物は、VEGFR2活性を阻害することによって血管新生をそれぞれブロックするか、またはNotchシグナル伝達を標的とすることによって内皮先端細胞分化および高密度血管神経叢の形成を促進するためにマウスにおいて広く使用されている(図3A)。VEGFおよびNotchシグナル伝達経路はどちらも、in vivoでの発芽血管新生の重要な調節因子である。コラーゲンにめっきしたEBsにおける様々な濃度のDC101およびDAPTの効果を評価した。6〜30mg·L-1は血管の芽の数と長さの両方を阻害しましたが、DAPTは1 μmol·L-1(図3B-C)。 DAPTの存在下で培養したEBsのPECAM-1について染色された血管スプラウトの高倍率写真も提供される(図3D)。0.5〜1μmol·L-1は、誤った誘導表現型を有する血管スプラウトを有する内皮先端細胞の数を強く増加させた(図3D-F)。 高用量のDAPTはまた、血管合体および組織化のない大きくて平らな内皮細胞領域の形成をもたらした(図3A)。結果は、血管新生を促進または阻害する薬物をテストするモデルの能力を確認しました。
このモデルが血管疾患の模倣に適していることを確認するために、 Acvrl1+/- mESCに由来するEBの共焦点画像が提供されます。 Acvrl1 遺伝子は、内皮細胞に特異的に発現する受容体であるALK1(アクチビン受容体様キナーゼ1)をコードしており、変異すると遺伝性出血性毛細血管拡張症(HHT)と呼ばれる血管異形成を伴う血管希少疾患の発症に関与します。 Acvrl1+/- 内皮芽の高倍率画像は、それらがより多くの内皮先端細胞を有し、親血管に対してランダムな角度にある芽当たりより多くの枝を有することを明らかにした。これらは、HHTマウスで観察されるような誤った指導表現型を インビトロ で確認した(図4)。
特定の遺伝子型の蛍光標識されたmESCおよびmESCを含むキメラEBを形成することにより、内皮先端選択のプロセスを研究するための代替プロトコルが含まれる(図5A−C)。PECAM-1標識血管芽の共焦点画像は、主要な内皮先端細胞の遺伝子型起源を同定した(図5B)。野生型YFP(黄色蛍光タンパク質)mESC株と1:1の比率の混合物は、1つの非標識mESC野生型株と一貫して、主要な内皮先端細胞に対する各集団の等しい寄与をもたらした(図5C)。
このプロトコルは、血管芽の壁画細胞被覆率を定量化するのにも適しています。血管新生を受けるEBを固定し、PECAM-1(内皮細胞、赤色)およびα平滑筋アクチン(α-SMA)(壁細胞、緑色)について染色した(図5D)。高倍率の画像は、1つの個々の血管芽が壁画細胞に囲まれている様子を明らかにしました(図5E、左)。二値変換は、ImageJソフトウェアを用いてα−SMA(+)壁画細胞で覆われたPECAM−1(+)血管の比率を定量するために、カラーチャネル分離後に実施した(図F−G)。

図1:プロトコル手順のタイムライン。 この図の拡大版を表示するには、ここをクリックしてください。
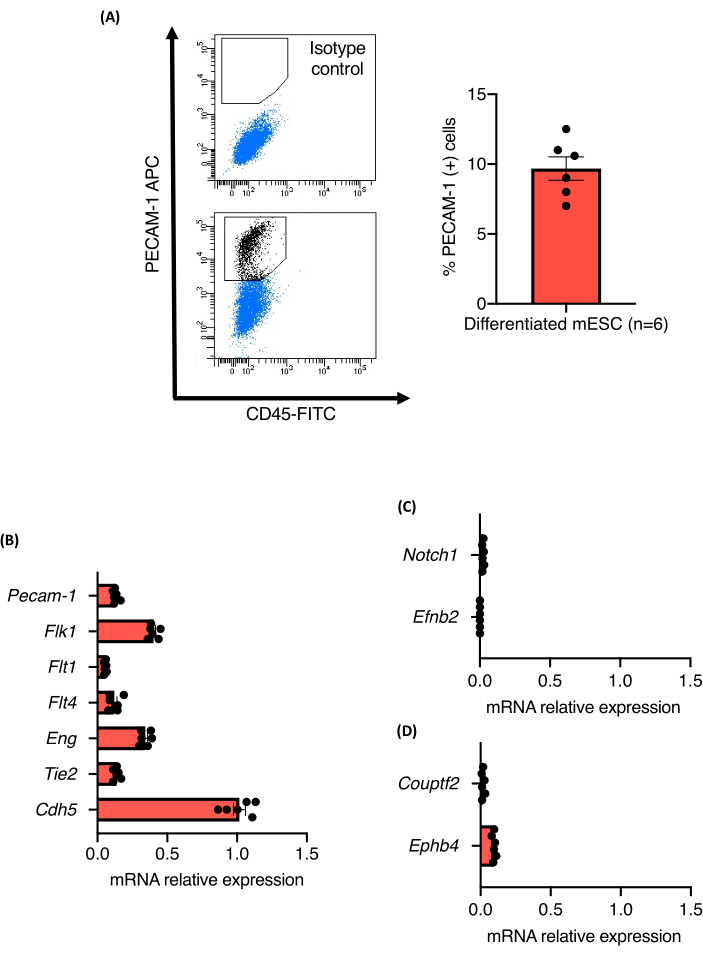
図2:EB内のmESC血管分化に由来するECの特性評価。 (A)9日齢EBからのCD31発現のフローサイトメトリー分析およびPecam-1(+)細胞の割合の定量。(B-D)9日齢のEBから選別された内皮細胞におけるPecam-1、Flk1、Flt1、Flt4、Eng、Tie2、Cdh5、Notch1、EfnB2、Couptf2、およびEphB4のmRNA発現レベル。 エラーバーは、平均(SEM)の平均±標準誤差を表します。この図の拡大版を表示するには、ここをクリックしてください。
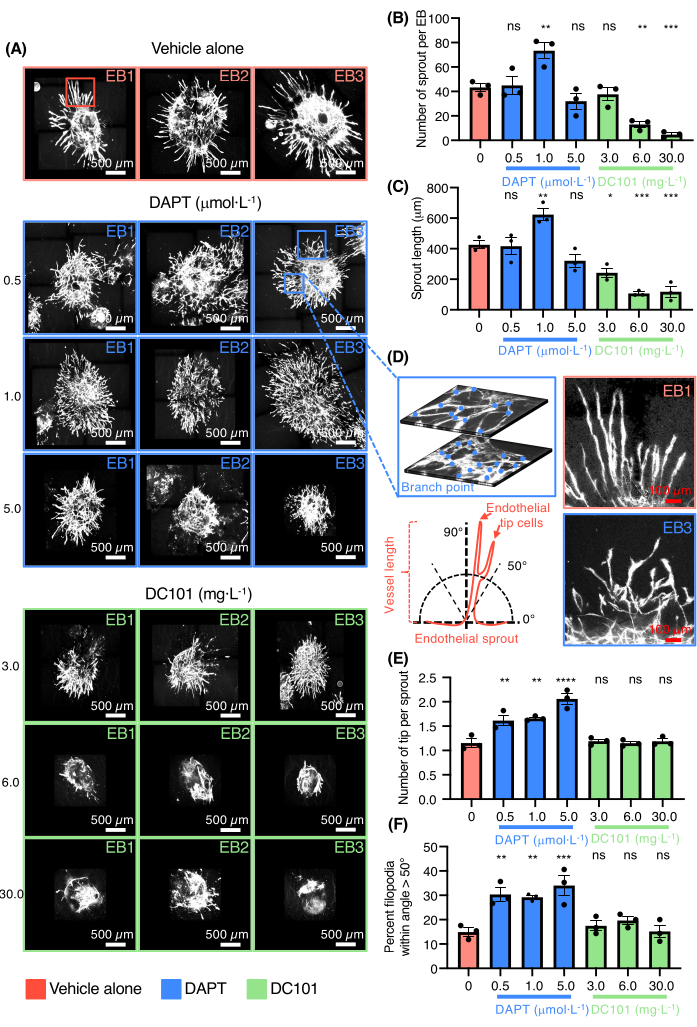
図3:薬物検査のための3D発芽血管新生アッセイ。 (A)Pecam-1(白色、内皮細胞)をビヒクル単独DAPT(0.5 μmol·L-1, 1.0 マイクロモル·L-1, 5.0 μmol·L-1)またはDC101(3mg·L-1, 6ミリグラム·L-1, 30ミリグラム·L-1)。(B)EBあたりのスプラウト数の定量化。(C)芽の長さの定量化。(d)左上のパネルに、同じEBから2つの異なる層上での網の複雑さと分岐点カウントを示す内皮スプラウトの高倍率、左下のパネルに内皮スプラウト方位の測定方法を表す模式図を示す。右上パネルでは、ビヒクル単独由来の内皮スプラウトの高倍率、右下パネルでは、DAPT由来の内皮スプラウトの高倍率(0.5 μmol・s)L-1)条件。(E)芽当たりの先端細胞数の定量化。(F)角度>50°以内の糸状足の割合の定量化。すべての棒は、対応のない一元配置分散分析分析±SEMおよびpの平均値を表します。ns = 有意でない、*p < 0.05、**p < 0.01、***p < 0.001、****p < 0.0001。 この図の拡大版を表示するには、ここをクリックしてください。

図4:遺伝性出血性毛細血管拡張症EBにおける血管発芽の欠陥。トップパネルには、Pecam-1(白色の内皮細胞)で染色されたAcvrl1+/+およびAcvrl1+/-遺伝子型の代表的な12日齢EBの共焦点画像。下パネルでは、Acvrl1+/-内皮芽の高倍率(上パネルから白いボックス)で、多数の先端細胞(赤い矢印)、内皮の分岐点(青い点)、および発芽の誤った誘導表現型(緑の矢印)を示しています。この図の拡大版を表示するには、ここをクリックしてください。

図5:3D発芽アッセイを使用した先端/茎細胞の位置と血管の成熟の研究。 (A)Pecam-1(赤色、内皮細胞)で染色された7ACS/EYFP野生型細胞株と1:1を混合したR1野生型細胞株から作製した代表的な12日齢のキメラEBの共焦点画像。赤い矢印はR1細胞株からの先端細胞を示し、緑の矢印は7ACS/EYFP細胞株からの先端細胞を示します。(B)スプラウトに沿ったR1および7ACS/EYFP内皮細胞の分布を示す内皮スプラウトの高倍率。(C)代表的な野生型EBからの相対的ジェノタイピングチップ細胞の定量。(D)Pecam-1(赤色、内皮細胞)およびα-SMA(緑色、壁画細胞)について染色された代表的な12日齢EBの共焦点画像。(E)壁画/内皮細胞の相互作用を示す内皮芽(Dから白い長方形の点線のボックス)の高倍率。(F-G)着色された内皮芽の画像およびそれらに関連するバイナリ変換画像。(H)共局在化Pecam-1およびα-SMA染色のバイナリ画像。壁画細胞で覆われた内皮細胞芽の比率。すべてのバーはSEM±平均値を表します。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、血管新生を調節する薬物および遺伝子のスクリーニングに適した、偏りのない、堅牢で再現性のある3D EBベースの血管発芽アッセイについて説明しています。この方法は、ヒト臍帯静脈内皮細胞(HUVEC)などの内皮細胞培養を使用して、遊走(ラテラルスクラッチアッセイまたはボイデンチャンバーアッセイ)22,23または増殖(細胞数のカウント、DNA合成の検出、増殖マーカーの検出、または代謝アッセイ)24を監視するために、広く使用されている多くの2次元(2D)アッセイよりも優れています。内皮細胞と壁細胞の両方の分化と、発芽血管新生の重要なステップを模倣する血管網へのそれらの組織の研究を独自に可能にするという点で。これらのステップには、内皮先端細胞の選択、茎細胞の増殖、血管スプラウトの空間的配向および遊走、ならびに新生血管25への壁細胞の動員が含まれる。また、多くの3D血管新生モデルにも利点があります。尿細管形成を模倣したフィブリンビーズ26、27またはコラーゲンゲルアッセイ28、29、30は、増殖率が高いが、培養での維持が困難なマウス初代内皮細胞には適していないため、HUVECまたは内皮コロニー形成細胞由来内皮細胞(ECFC-EC)を一般的に使用します。ex vivo網膜外植片31または血管化微小臓器アッセイ32は、全ての血管形成ステップを十分に再現することができるが、それらは複雑な実験手順を有し、ハイスループット薬物または遺伝子スクリーニングには適していない。これは、ex vivo大動脈リングアッセイ33、34、およびマウスに移植された腫瘍や、大量のデータを得るのが困難なことが多いマウスの機能喪失研究などの多くのインビボアッセイにも当てはまる35。このプロトコルはまた、ヒトiPS細胞を用いた同様のin vitro血管新生アッセイをうまく補完し、マウスとヒトのデータの比較を可能にします。ヒトiPS細胞由来内皮細胞はマウス細胞よりも発芽能力が低いことに注意することは重要であるが36、37。
ここで開発した方法にもいくつかの制限があります。血管の成熟、血管透過性に対する流体の流れの影響を評価することはできず、開発中の最近の微細加工デバイスと比較して、特定の組織環境で新生血管を生成しません。実際、マイクロフルイディクスと組織工学を組み合わせた臓器オンチップ技術は、培養内皮細胞にin vivoと同様の微小環境を提供することができます38,39。マイクロ流体システムは、正しい細胞外マトリックス組成を含み、せん断応力などの機械的信号を生成するように設計されています。いくつかは、特定の組織の壁細胞および他の支持細胞を組み込むように設計されているか、化学的勾配を生成することができる。それらは、毛細血管とサイズと構造が類似しているミクロンスケールの流体充填チャネルのネットワークを含んでいます。臓器オンチップ技術は、透過性や経内皮電気抵抗などの特定の血管機能の定量化も可能にします。臓器チップ技術は有望ですが、ほとんどの生物学研究所の研究専門知識をはるかに超えており、依然として適切な標準化が必要であり、特殊な製造技術が必要です。臓器チップ技術製造の商業化は始まったばかりであり、これらのシステムは現在製薬会社にとって法外なコストと時間であると考えられています40,41。
考慮すべきいくつかの重要なステップがあります。多能性状態のよく受け入れられたマーカー(Nanog、Oct4、Sox2、およびSSEA-1)を堅牢に発現する高品質の細胞を使用してください。それらの成長、mES細胞の形状、およびmESコロニーのサイズと形態を注意深く監視することが不可欠です。核型の安定性は培養細胞では確率的であるため、広範な継代後に再評価することが不可欠です。mESC培養用にすでにテストされた製品を使用し、MEFフィーダー、ウシ胎児血清、およびすべての化合物を数回継代してテストして、mESCが細胞特性を維持しているかどうか、またはエピブラスト表現型を分化または獲得するかどうかを検出することをお勧めします。培地は毎日更新する必要があり、mESCコロニーが大きくなりすぎたり密度が高くなりすぎたりしないようにする必要があります。最後に、内皮細胞の最高の収量を確保するために、mESCは分化前に2iなしで少なくとも2継代培養する必要があります。
内皮分化には、ハンギングドロップ法を用いたEBの形成と、血管分化培地の存在下での浮遊条件下でのそれらの培養という2つの重要なステップが含まれます13,14。均一な細胞凝集を達成するために、ハンギングドロップ皿の動きを最小限に抑える必要があります。ほとんどの場合、凝集体を形成するために使用されるmESCの数は800〜1,000細胞の範囲ですが、mESCが129 / olaとは異なる遺伝的背景を持っている場合は、血管新生EBへの最適な分化を確実にするために最適化する必要があります。浮遊条件下で培養する場合、EBは慎重に分布し、EB凝集に有利な動きを避ける必要があります。
EBは最終的にコラーゲンIゲルで培養され、血管スプラウトを形成します。血管新生培地は新たに調製する必要があり、コラーゲンと混合したら、自発的なゲル化を避けるために氷上で維持する必要があります。薬物検査の場合、薬物はこのステップの間に適切な濃度で冷たい混合物に添加される。EBを再懸濁する前にNaOHでpHを調整することは非常に重要であり、そうでなければコラーゲン酸性度は細胞毒性を引き起こす。最後に、再現性のある結果を確実にするために、EBを互いに等距離に広げる必要があります。
結論として、この方法は、Elling U.らによって最近記載されたように、遺伝子スクリーニングに使用されるために必要な堅牢性とスケーラビリティを備えたmESCに基づく3D血管発芽アッセイを導入します。 これにより、ヘミ/ホモ接合変異体mESC16 の大規模なハプロバンクが生成され、表現型創薬プログラムが生成されました。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、オランダの組織団体(ZonMW 446002501)、Health Holland(LSHM19057-H040)、Leading Fellows Program Marie Skłodowska-Curie COFUND、およびMaladie de Rendu-Osler協会(AMRO)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Milipore, Merck | 805740 | Biohazard: adequate safety instructions should be taken when handling |
| Agar Noble | Difco, BD Pharmigen | 214220 | |
| Alexa Fluo 555 goat anti rat IgG | Life technologies | A21434 | |
| APC conjugated rat anti-mouse PECAM-1 antibody (clone MEC13.3) | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control (Clone R35-95) | BD Biosciences | 553932 | |
| Axiovert 25 inverted phase contrast tissue culture microscope | ZEISS | ||
| Basic Fibroblast Growth Factor-2 (bFGF) | Peprotech | 450-33 | |
| Benchtop Centrifuge, Allegra X-15R | Beckman Coulter | 392932 | |
| Biosafety cabinet BioVanguard (Green Line) | Telstar | 133H401001 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9418 | |
| Cell counting chamber, Buerker, 0.100mm | Marienfeld | 640211 | |
| Cell culture dishes 60 x 15mm | Corning | 353802 | |
| Cell culture dishes, 35 x 10 mm | Corning | 353801 | |
| Cell culture plates 12-well | Corning | 3512 | |
| CFX96 Touch Real-Time PCR Detection System | Biorad | 1855196 | |
| Chicken serum | Sigma-Aldrich | C5405 | |
| CHIR-99021 (CT99021) HCl | Selleckchem | S2924 | |
| Collagen I, High Concentration, Rat Tail, 100mg | Corning | 354249 | |
| Collagenase A | Roche | 10103586001 | |
| Confocal Laser Scanning Microscope, TCS SP5 | Leica | ||
| Cover glasses, 24 × 50 mm | Vwr | 631-0146 | |
| DAPT γ?secretase inhibitor | Sigma Aldrich | D5942 | |
| DC101 anti mouse VEGFR-2 Clone | BioXcell | BP0060 | |
| DC101 isotype rat IgG1 | BioXcell | BP0290 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2438-5X | Biohazard: adequate safety instructions should be taken when handling |
| DPBS (10x), no calcium, no magnesium | Gibco, Thermofisher scientific | 14200067 | |
| EDTA 40 mM | Gibco, Thermofisher scientific | 15575-038 | |
| Embryonic stem-cell Fetal Bovine Serum | Gibco, Thermofisher scientific | 16141-079 | Should be lot-tested for maximum ES cell viability and growth. Heat inactivate at 60°C and store at −20 °C for up to 1 year |
| Eppendorf Microcentrifuge 5415R | Eppendorf AG | Z605212 | |
| Erythropoietin, human (hEPO), 250 U (2.5 µg) (1 mL) | Roche | 11120166001 | |
| ESGRO Recombinant Mouse LIF Protein (10? units 1 mL) | Milipore, Merck | ESG1107 | |
| Falcon tubes 15 mL | Greiner Bio-One | 188271 | |
| Falcon tubes 50 mL | Greiner Bio-0ne | 227270 | |
| Filter tip ,clear ,sterile F.Gilson, P-200 | Greiner Bio-One | 739288 | |
| Filter tip ,clear ,sterile F.Gilson, P10 | Greiner Bio-One | 771288 | |
| Filter tip ,clear ,sterile F.Gilson, P1000 | Greiner Bio-One | 740288 | |
| FITC conjugated anti-α Smooth Muscle Actin (SMA) (clone 1A4) | Sigma Aldrich | F3777 | |
| FITC conjugated rat anti-mouse CD45 (clone 30-F11) | Biolegend | 103107 | |
| FITC Rat IgG2b, κ Isotype Ctrl Antibody (clone RTK4530) | Biolegend | 400605 | |
| Fluorscent mounting media | DAKO | S3023 | |
| Gascompress | Cutisoft | 45846 | |
| Gauze Cutisoft 10 x 10 cm | Bsn Medical | 45844_00 | |
| Gel blotting paper, Grade GB003 | Whatman | WHA10547922 | |
| Gelatin solution, type B | Sigma-Aldrich | G1393-100 ml | |
| Glasgow's MEM (GMEM) | Gibco, Thermofisher scientific | 21710082 | |
| IHC Zinc Fixative | BD Pharmigen | 550523 | |
| IncuSafe CO2 Incubator | PHCBi | MCO-170AICUV-PE | |
| Interleukin-6, human (hIL-6) | Roche | 11138600001 | |
| L-Glutamine 200 mM | Gibco, Thermofisher scientific | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco, Thermofisher scientific | 11140035 | |
| Microscope slide box | Kartell Labware | 278 | |
| Microscope slide, Starfrost | Knittel glass | VS113711FKB.0 | |
| Mm_Cdh5_1_SG QuantiTect Primer Assay | Qiagen | QT00110467 | |
| Mm_Eng_1_SG QuantiTect Primer Assay | Qiagen | QT00148981 | |
| Mm_Epha4_1_SG QuantiTect Primer Assay | Qiagen | QT00093576 | |
| Mm_Ephb2_1_SG QuantiTect Primer Assay | Qiagen | QT00154014 | |
| Mm_Flt1_1_SG QuantiTect Primer Assay | Qiagen | QT00096292 | |
| Mm_Flt4_1_SG QuantiTect Primer Assay | Qiagen | QT00099064 | |
| Mm_Gapdh_3_SG QuantiTect Primer Assay | Qiagen | QT01658692 | |
| Mm_Kdr_1_SG QuantiTect Primer Assay | Qiagen | QT00097020 | |
| Mm_Notch1_1_SG QuantiTect Primer | Qiagen | QT00156982 | |
| Mm_Nr2f2_1_SG QuantiTect Primer Assay | Qiagen | QT00153104 | |
| Mm_Pecam1_1_SG QuantiTect Primer | Qiagen | QT01052044 | |
| Mm_Tek_1_SG QuantiTect Primer Assay | Qiagen | QT00114576 | |
| Mouse (ICR) Inactivated Embryonic Fibroblasts (2 M) | Gibco, Thermofisher scientific | A24903 | Store vials in liquid nitrogen (195.79 °C) indefinitely |
| Mouse embryonic stem cell line 7AC5/EYFP (ATCC SCRC-1033) | ATCC | SCRC-1033 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Hadjantonakis, A. K., et al. Mechanisms of Development. 76 (1–2), 79–90 (1998)]. |
| Mouse embryonic stem cell lines Acvrl1 +/- and Acvrl1 +/+ | Generated at Leiden University Medical Centre [Thalgott, J.H. et al. Circulation. 138 (23), 2698–2712 (2018)]. | ||
| Mouse embryonic stem cells line E14 | Provided by M Letarte laboratory and generated according to Cho, S. K., et al. Blood. 98 (13), 3635–3642 (2001). | ||
| Mouse embryonic stem cells line R1 (ATCC SCRC-1011) | ATCC | SCRC-1011 | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada. [Nagy, A., et al. Procedings of the National Academy of Sciences of the United States of America. 90 (18), 8424–8428 (1993)]. |
| Mouse embryonic stem cells line Z/Red (strain 129/Ola) | Generated by Dr A Nagy, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, 600 University Ave, Toronto, Ontario, M5G 1X5, Canada [Vintersten, K., et al. Genesis. 40 (4), 241–246 (2004)]. | ||
| NanoDrop 1000 UV/VIS Spectrophotometer | Thermo Fischer Scientific | ND-1000 | |
| PD0325901 | Selleckchem | S1036 | |
| PDGF-BB, Recombinant Human | Peprotech | 100-14B | |
| Pecam-1 antibody, Rat Anti-Mouse | BD Biosciences | 550274 | |
| Penicillin-streptomycin (10,000 U/mL) | Gibco, Thermofisher scientific | 15140122 | |
| Petri dish, PS, 94/16 mm, standard ,with vents, sterile | Greiner Bio-One | 633181 | |
| Pipetboy acu 2 | Integra-Biosciences | 155 019 | |
| Pipetman G Multichannel P8 x 200G | Gilson | F144072 | |
| Pipetman G Starter Kit, 4 Pipette Kit, P2G, P20G, P200G, P1000G | Gilson | F167360 | |
| Recombinant Human BMP-4 Protein | R&D Systems | 314-BP | |
| RNeasy Plus mini Kit | QIAGEN | 74134 | |
| Serological pipettes, 10 mL | Greiner Bio-One | 607 180 | |
| Serological pipettes, 25 mL | Greiner Bio-One | 760 180 | |
| Serological pipettes, 5 mL | Greiner Bio-One | 606 180 | |
| Sodium hydroxide (NaOH) | Merck | 106498 | |
| Sodium pyruvate 100 mM | Gibco, Thermofisher scientific | 11360039 | |
| Test tubes 5ml round-bottom with cell-strainer cap | Corning | 352235 | |
| Thermal cycler, T100 | Biorad | 1861096 | |
| Triton X-100 (BioXtra) | Sigma Aldrich | T9284 | |
| Trypan Blue Solution, 0.4% | Gibco, Thermofisher scientific | 15250061 | |
| Trypsin (2.5%) | Gibco, Thermofisher scientific | 15090046 | |
| Vacuum Filter/Storage Bottle System, 500 mL | Corning | 430758 | |
| VEGFA165 , recombinant murine | Peprotech | 450-32 | |
| Water, Sterile | Fresenius-Kabi | B230531 | |
| Waterbath, Lab-Line Digital | Thermo Fischer Scientific | 18052A |
参考文献
- Moffat, J. G., Vincent, F., Lee, J. A., Eder, J., Prunotto, M. Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nature Reviews Drug Discovery. 16 (8), 531-543 (2017).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews. Drug Discovery. 15 (11), 751-769 (2016).
- Low, L. A., Mummery, C., Berridge, B. R., Austin, C. P., Tagle, D. A. Organs-on-chips: into the next decade. Nature Reviews. Drug Discovery. , (2020).
- Ma, C., Peng, Y., Li, H., Chen, W. Organ-on-a-Chip: A new paradigm for drug development. Trends in Pharmacological Sciences. 42 (2), 119-133 (2021).
- Swinney, D. C., Anthony, J. How were new medicines discovered. Nature Reviews Drug Discovery. 10 (7), 507-519 (2011).
- Hussain, S., et al. High-content image generation for drug discovery using generative adversarial networks. Neural Networks: The Official Journal of the INternational Neural Network Society. 132, 353-363 (2020).
- Scheeder, C., Heigwer, F., Boutros, M. Machine learning and image-based profiling in drug discovery. Current Opinion in Systems Biology. 10, 43-52 (2018).
- Wagner, B. K., Schreiber, S. L. The power of sophisticated phenotypic screening and modern mechanism-of-action methods. Cell Chemical Biology. 23 (1), 3-9 (2016).
- Scannell, J. W., Bosley, J. When quality beats quantity: Decision theory, drug discovery, and the reproducibility crisis. PLoS One. 11 (2), 0147215 (2016).
- Webster, J. D., Santagostino, S. F., Foreman, O. Applications and considerations for the use of genetically engineered mouse models in drug development. Cell and Tissue Research. 380 (2), 325-340 (2020).
- Howland, D. S., Munoz-Sanjuan, I. Mind the gap: models in multiple species needed for therapeutic development in Huntington's disease. Movement Disorders: Official Journal of the Movement Disorder Scoiety. 29 (11), 1397-1403 (2014).
- Galaris, G., Thalgott, J. H., Lebrin, F. P. G. Pericytes in hereditary hemorrhagic telangiectasia. Advances in Experimental Medicine and Biology. 1147, 215-246 (2019).
- Thalgott, J. H., et al. Decreased expression of vascular endothelial growth factor receptor 1 contributes to the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Circulation. 138 (23), 2698-2712 (2018).
- Lebrin, F., et al. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia. Nature Medicine. 16 (4), 420-428 (2010).
- Czechanski, A., et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nature Protocols. 9 (3), 559-574 (2014).
- Elling, U., et al. A reversible haploid mouse embryonic stem cell biobank resource for functional genomics. Nature. 550 (7674), 114-118 (2017).
- Cheng, J., et al. Targeting pericytes for therapeutic approaches to neurological disorders. Acta Neuropathologica. 136 (4), 507-523 (2018).
- Chade, A. R. Small vessels, big role: Renal microcirculation and progression of renal injury. Hypertension. 69 (4), 551-563 (2017).
- Jourde-Chiche, N., et al. Endothelium structure and function in kidney health and disease. Nature Reviews. Nephrology. 15 (2), 87-108 (2019).
- van Duinen, V., et al. Standardized and scalable assay to study perfused 3D angiogenic sprouting of iPSC-derived endothelial cells in vitro. Journal of Visualized Experiment: JoVE. (153), e59678 (2019).
- Chappell, J. C., Taylor, S. M., Ferrara, N., Bautch, V. L. Local guidance of emerging vessel sprouts requires soluble Flt-1. Developmental Cell. 17 (3), 377-386 (2009).
- Sato, Y., Rifkin, D. B. Inhibition of endothelial cell movement by pericytes and smooth muscle cells: activation of a latent transforming growth factor-beta 1-like molecule by plasmin during co-culture. Journal of Cell Biology. 109 (1), 309-315 (1989).
- Tchaikovski, V., Olieslagers, S., Bohmer, F. D., Waltenberger, J. Diabetes mellitus activates signal transduction pathways resulting in vascular endothelial growth factor resistance of human monocytes. Circulation. 120 (2), 150-159 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. International Journal of Experimental Pathology. 90 (3), 195-221 (2009).
- Herbert, S. P., Stainier, D. Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis. Nature Reviews Molecular Cell Biology. 12 (9), 551-564 (2011).
- Nakatsu, M. N., Hughes, C. C. An optimized three-dimensional in vitro model for the analysis of angiogenesis. Methods in Enzymology. 443, 65-82 (2008).
- Nakatsu, M. N., Davis, J., Hughes, C. C. Optimized fibrin gel bead assay for the study of angiogenesis. Journal of Visualized Experiments: JoVE. (186), (2007).
- Gau, D., et al. Pharmacological intervention of MKL/SRF signaling by CCG-1423 impedes endothelial cell migration and angiogenesis. Angiogenesis. 20 (4), 663-672 (2017).
- Torres-Estay, V., et al. Androgens modulate male-derived endothelial cell homeostasis using androgen receptor-dependent and receptor-independent mechanisms. Angiogenesis. 20 (1), 25-38 (2017).
- Merjaneh, M., et al. Pro-angiogenic capacities of microvesicles produced by skin wound myofibroblasts. Angiogenesis. 20 (3), 385-398 (2017).
- Rezzola, S., et al. In vitro and ex vivo retina angiogenesis assays. Angiogenesis. 17 (3), 429-442 (2014).
- Wang, X., Phan, D. T. T., George, S. C., Hughes, C. C. W., Lee, A. P. 3D Anastomosed microvascular network model with living capillary networks and endothelial cell-lined microfluidic channels. Methods in Molecular Biology. 1612, 325-344 (2017).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Laboratory Investigation; A Journal of Technical Methods and Pathology. 63 (1), 115-122 (1990).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. Journal of Cellular and Molecular Medicine. 13 (10), 4113-4136 (2009).
- Nowak-Sliwinska, P., et al. Consensus guidelines for the use and interpretation of angiogenesis assays. Angiogenesis. 21 (3), 425 (2018).
- Belair, D. G., Schwartz, M. P., Knudsen, T., Murphy, W. L. Human iPSC-derived endothelial cell sprouting assay in synthetic hydrogel arrays. Acta Biomaterialia. 39, 12-24 (2016).
- Bezenah, J. R., Kong, Y. P., Putnam, A. J. Evaluating the potential of endothelial cells derived from human induced pluripotent stem cells to form microvascular networks in 3D cultures. Scientific Reports. 8 (1), 2671 (2018).
- Henderson, A. R., Choi, H., Lee, E. Blood and lymphatic vasculatures on-chip platforms and their applications for organ-specific in vitro modeling. Micromachines (Basel). 11 (2), 147 (2020).
- Lin, D. S. Y., Guo, F., Zhang, B. Modeling organ-specific vasculature with organ-on-a-chip devices. Nanotechnology. 30 (2), 024002 (2019).
- Pollet, A., den Toonder, J. M. J. Recapitulating the vasculature using organ-on-chip technology. Bioengineering. 7 (1), 17 (2020).
- Cochrane, A., et al. Advanced in vitro models of vascular biology: Human induced pluripotent stem cells and organ-on-chip technology. Advanced Drug Delivery Reviews. 140, 68-77 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved