Method Article
Preparação e caracterização de microbolhas direcionadas
Neste Artigo
Resumo
O objetivo deste protocolo é preparar, purificar e caracterizar microbolhas cheias de gás (agentes de contraste direcionados para imagens moleculares de ultrassom). Dois sistemas de direcionamento são descritos: bolhas biotiniladas aderentes à estreptavidina e microbolhas de peptídeo RGD cíclico que se ligam ao αvβ3, um conhecido biomarcador de neovasculatura tumoral.
Resumo
O direcionamento de microbolhas (agentes de contraste de ultrassom para imagens moleculares) tem sido pesquisado há mais de duas décadas. No entanto, os métodos de preparação de microbolhas e fixação de ligantes direcionados são complicados, complicados e demorados. Portanto, é necessário simplificar o procedimento de preparação de microbolhas direcionadas para aproximá-lo da tradução clínica. O objetivo desta publicação é fornecer uma descrição detalhada e explicação das etapas necessárias para a preparação, caracterização funcional e teste de microbolhas direcionadas. Uma sequência dos procedimentos otimizados e simplificados é apresentada para dois sistemas: um modelo de par direcionado à biotina-estreptavidina e um peptídeo RGD cíclico direcionado à proteína recombinante αvβ3 , que é superexpressa no revestimento endotelial da neovasculatura tumoral.
Aqui, mostramos o seguinte: acoplamento covalente do ligante alvo a uma âncora lipídica, avaliação da qualidade do reagente e testes que confirmam a conclusão bem-sucedida da reação; preparação do meio precursor aquoso contendo componentes do invólucro de microbolhas, seguido de preparação de microbolhas por amalgamação; avaliação da eficácia da transferência de lipídios para o invólucro estabilizador de microbolhas; Ajuste da distribuição do tamanho das microbolhas por flotação em gravidade normal para remover microbolhas maiores que podem ser prejudiciais para uso in vivo; avaliação da distribuição do tamanho das microbolhas por sensoriamento por eletrozona; avaliação da ligação direcionada das microbolhas à superfície revestida por receptor em um teste de ensaio de ligação estática (em um prato invertido); e avaliação da ligação direcionada das microbolhas à superfície revestida por receptor em um teste de câmara de fluxo de placa paralela.
Introdução
A imagem molecular com microbolhas direcionadas está em pesquisa e teste há mais de duas décadas. O conceito geral é simples: microbolhas cheias de gás que possuem afinidade seletiva com o biomarcador molecular específico do endotélio vascular na área da doença são injetadas por via intravenosa. Essas partículas circulam e se acumulam no alvo (por exemplo, neovasculatura tumoral ou área de lesão inflamatória isquêmica). As microbolhas aderentes são então detectadas por ultrassom de contraste. Os primeiros esforços de pesquisa de conceito do século passado 1,2 estão agora progredindo gradualmente em direção à adoção clínica: eles atingiram o estágio de ensaio clínico de média escala há apenas alguns anos 3,4. O objetivo deste manuscrito é fornecer a explicação detalhada sobre a preparação e caracterização de tais microbolhas direcionadas, com base em dois exemplos publicados 1,5.
O procedimento para a preparação do peptídeo-PEG-fosfolipídio, um componente crucial para a formulação dessas microbolhas direcionadas, é complementado com a descrição do controle de qualidade do reagente, conforme necessário para a conclusão bem-sucedida da reação. Infelizmente, alguns fornecedores de reagentes lipídicos de éster ativo fornecem material que é hidrolisado na chegada e, portanto, é incapaz de participar da formação da ligação amida. São fornecidas informações sobre quanto do material lipídico é transferido para o invólucro de microbolhas do meio aquoso durante a preparação das microbolhas, bem como a técnica para obter essas informações.
É importante preparar microbolhas com uma distribuição de tamanho de partícula relativamente estreita: a co-presença de grandes microbolhas no meio injetável para testes intravasculares in vivo pode levar ao entupimento da microvasculatura; O acúmulo inespecífico de microbolhas que contornam os shunts pulmonares pode causar realce tecidual falso-positivo inespecífico6, que é evitado com a remoção de microbolhas de tamanhos maiores. Portanto, é apresentado um procedimento simples para obter a seleção do tamanho das partículas, complementado pela descrição de um método para avaliar a concentração e a distribuição do tamanho das partículas com um contador de partículas.
O primeiro protocolo de teste para avaliação de direcionamento de microbolhas, conforme apresentado abaixo, descreve um sistema puramente modelo, com microbolhas biotiniladas direcionadas à superfície revestida de estreptavidina1. O segundo protocolo é baseado em um manuscrito que descreve a preparação simplificada de microbolhas direcionadas a peptídeos, decoradas com um peptídeo RGD cíclico que possui afinidade específica com αvβ3, um biomarcador molecular da neovasculatura tumoral5. Microbolhas decoradas com este ciclo[Arg-Gly-Asp-D-Phe-Lys], ou seja, peptídeo c(RGDfK) pela técnica apresentada, demonstraram ter como alvo a neovasculatura tumoral e obter imagens moleculares de ultrassom em um modelo de tumor murino.
Protocolo
1. Acoplamento covalente do peptídeo ao NHS-PEG-DSPE
- Dissolver o peptídeo c(RGDfK) com o ε-aminogrupo primário da lisina desprotegido e disponível para acoplamento, em dimetilsulfóxido (DMSO, 10 mg/ml). Preparar uma solução de metanol ou clorofórmio de éster N-hidroxisuccinimida de poli(etilenoglicol)-3400-distearoil fosfatidiletanolamina (NHS-PEG-DSPE, 200 mg/ml) e adicionar 1 mg de péptido em DMSO. Adicione 3 μL de N,N-diisopropil etilamina (DIPEA).
- Mantenha uma proporção molar de peptídeo para NHS-PEG-DSPE de pelo menos 1:1,2, para que todos os grupos aminoácidos primários possam reagir. Mantenha uma proporção molar DIPEA:peptídeo de pelo menos 2:1 para garantir as condições básicas do meio.
CUIDADO: Clorofórmio, metanol e DIPEA são materiais perigosos. Use proteção adequada, como luvas, jaleco, óculos de proteção e exaustor.
NOTA: Qualquer outro peptídeo ou mimético com um grupo amino primário pode ser usado em vez de c (RGDfK), com N-terminal desprotegido ou uma lisina localizada fora do local de ligação. Para que a reação prossiga, todos os componentes (ou seja, ligante e lipídio direcionados) devem ser solúveis em mistura DMSO-clorofórmio. Podem também ser ensaiados solventes alternativos, como a dimetilformamida, ou as suas misturas. A reação em meio aquoso também é possível, mas o rendimento do acoplamento será muito menor devido à rápida hidrólise do éster ativo.
- Mantenha uma proporção molar de peptídeo para NHS-PEG-DSPE de pelo menos 1:1,2, para que todos os grupos aminoácidos primários possam reagir. Mantenha uma proporção molar DIPEA:peptídeo de pelo menos 2:1 para garantir as condições básicas do meio.
- Após a incubação noturna à temperatura ambiente, remova o material orgânico volátil por evaporação (use fluxo de gás nitrogênio ou um evaporador rotativo, seguido de evaporação noturna sob uma bomba de alto vácuo, para remover o DMSO). Dissolva novamente o resíduo não volátil em clorofórmio a 1 mg / mL para amostragem controlada.
- Confirmar a conclusão da reação por cromatografia em camada delgada (desenvolver placas TLC em meio solvente clorofórmio:metanol, 2:1 v/v). Confirme a presença ou ausência do grupo amino primário com spray de ninidrina ao aquecer a placa em um bloco de aquecimento a 150 ° C.
CUIDADO: A ninidrina é um material perigoso. Use proteção adequada, conforme descrito acima. O tratamento do bloco de aquecimento das placas TLC deve ser realizado em uma capela de exaustão. O bloco de aquecimento é um risco potencial de incêndio. - Antes da preparação de microbolhas, alíquota de uma amostra de peptídeo-PEG-DSPE do clorofórmio (por exemplo, 1 mL de solução de 1 mg/mL), evapora o clorofórmio até a secura em uma corrente de gás nitrogênio, com subsequente incubação da bomba de alto vácuo, e adiciona solução salina a 1 mg/mL, para obter uma solução micelar transparente.
- Se for desejável uma purificação adicional da mistura de reação, dissolva novamente em solução salina normal. Em seguida, submeta a mistura micelar resultante à diálise (corte de peso molecular de 6-8 kDa ou similar), primeiro contra solução salina normal e depois contra várias mudanças de água deionizada.
- Confirme a conclusão da diálise por meio de uma verificação da condutividade do dialisato. Remova o material dialisado da bolsa de diálise, coloque em um frasco com massa conhecida e liofilize até a secura completa.
NOTA: Uma reação covalente alternativa para ligar o ligante ao terminal do lipídio PEG está disponível (por exemplo, uma reação de maleimida-PEG-DSPE com ligante de tiol). A principal vantagem dessa abordagem é o acoplamento orientado, se um único tiol estiver disponível na molécula ligante 7. A principal preocupação é a estabilidade a longo prazo: a ligação resultante entre maleimida e tiol pode ser propensa à degradação por uma reação retro-Michael, dependendo das condições de armazenamento 8.
NOTA: A qualidade dos reagentes de éster ativo varia muito entre os fabricantes: pode depender das condições de transferência e armazenamento (se o material não for armazenado ou transportado adequadamente, o éster ativo irá hidrolisar e não será capaz de acoplar com o peptídeo). Consequentemente, há um sentimento de obrigação de descrever um procedimento (veja abaixo) para a determinação do grau de degradação do NHS-PEG-DSPE, um reagente para ligação covalente de ligantes direcionados a microbolhas. O NHS-PEG-DSPE, fornecido como pó seco sob argônio, é armazenado em ultracongelamento. Um frasco para injetáveis é levado à temperatura ambiente (para evitar a condensação de umidade), uma amostra pesada, usando balança analítica, e dissolvida em metanol ou DMSO. Um frasco com reagente seco a granel deve ser fechado sob argônio e devolvido ao congelamento, em um recipiente selado com dessecante, até uso posterior. - Prepare uma solução micelar aquosa de peptídeo-PEG-DSPE (Etapa 1.4), bem como biotina-PEG-DSPE, por simples adição de reagente seco à solução salina aquosa e incubação. Pequenas micelas esféricas são formadas. Para acelerar a transferência do reagente do estado a granel para a forma micelar, pode-se aplicar sonicação e banho-maria.
- Avalie a qualidade do reagente do éster ativo NHS-PEG-DSPE.
- Confirmar se o NHS presente no reagente está sob a forma de éster ativo, para poder realizar a reacção de acoplamento com a formação da ligação amida.
- Coloque 0,99 mL de tampão tetraborato de sódio 0,1 M, pH 9,2, em uma cubeta de quartzo ou plástico transparente ultravioleta (não vidro) em um espectrofotômetro e zero no comprimento de onda de 260 nm.
- Adicionar 10 μL da solução de 200 mg/ml de NHS-PEG-DSPE em metanol à cubeta recentemente preparada. Ao mesmo tempo, inicie o cronômetro. Misture rápida e vigorosamente o conteúdo da cubeta para obter uniformidade. Coloque a cubeta no fotômetro, feche a tampa e inicie a medição.
- No início da medição do espectrofotômetro, marque a hora do início do registro e execute continuamente medições de absorbância fotométrica a 260 nm a cada 10 s por ~ 10 min ou até a estabilização do valor de absorbância.
- Plote a curva cinética, verifique os pontos de tempo iniciais A260 e extrapole a curva para o tempo de início da reação (ou seja, descubra A260 no ponto em que o reagente foi adicionado ao tampão aquoso e a reação de hidrólise começou). Suponha que antes da adição de NHS-PEG-DSPE ao tampão na cubeta não tenha ocorrido hidrólise em solvente orgânico devido à falta de água.
- Calcule a razão entre A260 no início da reação e na conclusão da hidrólise; Representa a fração do éster ativo degradado. Use essas informações para selecionar a quantidade adequada de NHS-PEG-DSPE para a modificação completa do grupo amino primário do peptídeo.
2. Preparação de microbolhas por amalgamação
- Preparação de microbolhas biotiniladas
- Co-dissolver distearoil fosfatidilcolina (DSPC) e estearato de PEG em propilenoglicol (PG, concentração de 10 mg/mL para cada um em solvente puro). Use um banho-maria quente para solubilizar os materiais.
- Adicione 0,1 mL desta solução PG quente a um frasco contendo 0,85 mL de solução salina normal quente, misture rapidamente e adicione biotina-PEG-DSPE micelar (50 μL, 1 mg / mL em solução salina) em uma proporção de massa de 1:20 para DSPC.
NOTA: A solubilidade dos componentes lipídicos no PG depende da temperatura, portanto, é necessário um banho de água quente. É útil aquecer o frasco de vidro contendo solução salina em banho-maria antes da adição de lipídios, para criar um meio uniforme sem partículas visíveis. - Leve o frasco para injetáveis à temperatura ambiente, coloque uma rolha de borracha no frasco para injetáveis, inserida até a metade, e insira o tubo capilar de PTFE no frasco para injetáveis. Use o fluxo de gás decafluorobutano para encher o frasco e, em seguida, feche a rolha, enquanto remove o capilar.
NOTA: A temperatura do frasco durante a amalgamação pode ter um efeito significativo na distribuição de tamanho das microbolhas resultantes 9. - Aperte o frasco para injetáveis rolhado, à temperatura ambiente, e coloque num aparelho amálgama. Inicie o amálgama. A unidade clínica utilizada é pré-ajustada para operar a 4300 rpm por 45 segundos.
- Quando a amalgamação estiver concluída, remova o frasco com as microbolhas resultantes do amalgamador. De preferência, caracterize a distribuição e composição do tamanho das microbolhas e use-as dentro de várias horas após a preparação.
- Preparação de microbolhas decoradas com peptídeos
- Co-dissolva DSPC e estearato de PEG em PG puro (concentração de 10 mg / mL para cada material). Use um banho-maria quente para solubilizar. Adicione 0,1 mL desta solução quente em PG a um frasco contendo 0,85 mL de solução salina normal quente, misture rapidamente e adicione peptídeo micelar-PEG-DSPE (50 μL, 1 mg / mL em solução salina) adicionado a uma proporção de massa de 1:20 ao DSPC.
- Leve o frasco para injetáveis à temperatura ambiente, coloque uma rolha de borracha em cima do frasco para injetáveis, inserida até a metade, e insira um tubo capilar de politetrafluoretileno (PTFE) no frasco para injetáveis. Use o fluxo de gás decafluorobutano para encher o frasco e, em seguida, feche a rolha, enquanto remove o capilar.
- Aperte o frasco com tampa e coloque em um amálgama para misturar. O frasco com dispersão de microbolhas fica pronto em 45 s.
- Preparação de microbolhas lipídicas de corante para avaliação da transferência de lipídios para o invólucro de microbolhas
- Co-dissolver DSPC e estearato de PEG em PG puro, conforme descrito acima (usar um banho de água quente) (concentração de 10 mg / mL para cada material).
- Adicione 0,1 mL desta solução quente de PG a um frasco com 0,89 mL de solução salina normal quente, misture rapidamente, adicione 10 μL de solução de corante DiI (1 mg / mL em PG puro) e misture. Leve o frasco para injetáveis à temperatura ambiente.
- Encha o headspace do frasco com gás decafluorobutano como acima, pare o frasco, prenda e amalgame conforme descrito acima.
3. Teste a transferência de lipídios DiI do meio aquoso micelar para o invólucro da bolha
- Para a confirmação microscópica de que o material lipídico fluorescente foi transferido do meio aquoso para o invólucro de microbolhas, amostrar uma alíquota de microbolhas do frasco para injetáveis através do septo com uma seringa de insulina.
- Em seguida, adicione uma gota a uma lâmina de vidro e cubra-a com uma lamínula padrão. Dilua primeiro com uma gota de soro fisiológico desgaseificado.
- Realize a microscopia com um microscópio de vídeo, equipado com uma epi-iluminação de fluorescência, objetiva de óleo 100x e câmera de vídeo de alta sensibilidade.
- Para determinar a eficácia da transferência de material lipídico do meio aquoso de solução salina / PG para a concha da bolha durante a amalgamação, pegue um frasco selado de microbolhas, inverta-o e coloque-o em um tubo cônico de 50 mL.
- Realize a centrifugação em um rotor de caçamba (10 min, 200 x g). Retire o frasco da centrífuga e mantenha-o invertido.
- Insira uma agulha de uma seringa de insulina no septo do frasco invertido. Aspire um pequeno volume (~ 50 μL) de infranadante claro lentamente.
NOTA: A ponta chanfrada da agulha para aspiração do infranadante do frasco invertido após a centrifugação deve estar localizada o mais próximo possível do septo, para minimizar as chances de ingestão de microbolhas.
- Colocar as amostras de infranadante (2 μL), bem como as amostras do meio lipídico-PG-salino original que foi utilizado para gerar microbolhas (2 μL) em uma placa de 96 poços com 0,1 mL de solução salina tamponada com fosfato (PBS):etanol 1:1 com 1% de Triton X-100.
- Meça a fluorescência vermelha do corante DiI (excitação de 555 nm, emissão de 620 nm) com um leitor de microplacas de fluorescência.
- Use placas pretas com fundo não transparente para espectroscopia de fluorescência devido ao fundo mais baixo e à falta de transferência de sinal entre poços que pode se tornar um problema para placas transparentes.
- Certifique-se de que o sinal de fluorescência esteja dentro da faixa de calibração linear: a concentração excessiva de corante nos poços pode levar à atenuação da luz e ao sinal subnotificado.
NOTA: Às vezes, pode ser desejável remover o material residual da casca que permanece no meio aquoso após a amalgamação. Para fazer isso, após a centrifugação por flotação de microbolhas, retire todo o volume do infranadante por aspiração lenta do frasco invertido e substitua-o por solução salina normal desgaseificada. Para evitar uma alteração excessiva da pressão ambiente no frasco para injetáveis devido à remoção ou adição de líquido, insira uma agulha longa adicional no septo para alcançar a fase gasosa no interior do frasco para injetáveis. Para manter a fase gasosa dentro do frasco, primeiro conecte a agulha a uma seringa cheia de gás fluorocarbono, para evitar o contato do ar com a preparação de microbolhas.
4. Ajuste da distribuição do tamanho de Microbubble
- Use a flutuação por gravidade normal em um frasco invertido estático para ajustar a distribuição de tamanho das microbolhas, ou seja, para remover as maiores microbolhas de forma rápida e eficiente 5,10.
- Tomar um frasco para injetáveis de microbolhas imediatamente após a preparação, conforme descrito na secção 2. Inverta e coloque de cabeça para baixo em uma superfície estável e sem vibração por 15-20 min.
- Após esta incubação, insira uma agulha de seringa de insulina no septo do frasco, enquanto ainda está invertido, e colete suavemente 300-500 μL de microbolhas da camada inferior.
NOTA: A agulha da seringa deve ficar perto da superfície interna do septo para evitar o acúmulo de bolhas maiores presentes mais perto do topo do líquido no frasco para injetáveis.- Puxe o êmbolo da seringa para trás lentamente, para evitar turbulência e expansão hidrostática das bolhas no corpo da seringa. Quando a amostra coletada for retirada da seringa, evite sobrepressão para evitar o colapso da bolha.
- Transfira a dispersão de microbolhas da seringa para um frasco para injetáveis de pequeno volume. Em seguida, encha com gás perfluorado, rolha e crimpagem, para armazenamento de curto prazo, contagem de partículas (veja abaixo) e uso posterior.
- Se a amostragem for realizada diretamente da seringa, segure horizontalmente e gire para evitar a flutuação de bolhas e obter a uniformidade da amostra.
5. Avaliação da distribuição do tamanho das microbolhas
- Use um contador de partículas (com base na detecção de eletrozona ou no princípio de obscurecimento da luz) para avaliar a distribuição e a concentração do tamanho das partículas. Como alternativa, use um hemocitômetro e um microscópio.
- Resumidamente, adicione uma alíquota de amostra de microbolhas em solução salina normal ou isotônico em uma contracâmara (normalmente, volume de 60-100 mL) e conte. Compare as distribuições de tamanho de microbolhas antes e depois da purificação por flotação.
NOTA: Submeta o frasco a uma mistura suave (não vórtice) imediatamente antes da amostragem, para obter medições representativas e reprodutíveis. Amostra do centro do volume testado. - Encha um béquer de 100 mL com pelo menos 60 mL de diluente de solução salina a 0,9% e coloque-o no stage do instrumento de envio de eletrozona. Levante o stage para que o tubo, a placa externa do eletrodo e o agitador fiquem completamente imersos no diluente e o agitador possa girar.
NOTA: O volume do diluente no béquer pode ser determinado com precisão usando sua massa, com uma escala (a densidade salina é próxima de 1). Alternativamente, uma bomba dosadora pode ser usada. Os eletrodos durante o estudo de detecção de eletrozona devem ser totalmente imersos. - Registre o volume do eletrólito do diluente no software de controle da unidade. O contador de detecção de eletrozona está equipado com orifício de 50 μm, que permite a medição de partículas entre 1 e 30 μm de diâmetro. Execute uma execução em segundo plano primeiro; espera-se que tenha menos de 5000 contagens em 0,5 mL de diluente como branco. Os melhores níveis de plano de fundo podem ter menos de 100 contagens.
- Defina o volume da amostra no software de controle da unidade, para levar em conta o fator de diluição. Adicione 10-20 μL da mistura de microbolhas ao béquer e execute a segunda tentativa.
- Use os dados de distribuição do tamanho do plano de fundo para levar em conta o uso da função "subtrair execução do plano de fundo" no software. Obter a concentração das partículas na amostra original de microbolhas como número de partículas/ml; Inclui o fator de diluição.
- A superfície externa da ponta da pipeta também pode ser coberta por bolhas durante a amostragem; Certifique-se de limpá-lo antes de inserir a ponta no meio de contagem. Não toque no orifício da ponta da pipeta com um pano.
- Evite diluições insuficientes de partículas de amostra durante a contagem, para minimizar os problemas com a correção de coincidências, onde mais de uma partícula por vez está dentro do orifício do sensor: o sistema pode então subestimar a concentração de partículas.
NOTA: O diâmetro do orifício para contagem de partículas pode variar. A seleção do orifício de 50 μm permite a detecção de microbolhas com diâmetro inferior a 1 μm, mas não é tão propensa a entupimento quanto as opções de diâmetro menor. - Calibre o contador de detecção de eletrozona para o mesmo meio de teste de diluente (por exemplo, solução de irrigação salina normal filtrada estéril) usada em testes reais. Uma alternativa de obscurecimento a laser para detecção de eletrozona tem a vantagem de não precisar de solução salina filtrada com concentração de sal e condutividade elétrica controladas.
- Resumidamente, adicione uma alíquota de amostra de microbolhas em solução salina normal ou isotônico em uma contracâmara (normalmente, volume de 60-100 mL) e conte. Compare as distribuições de tamanho de microbolhas antes e depois da purificação por flotação.
6. Testar o direcionamento de microbolhas in vitro em um ensaio de adesão/retenção
- Preparar a superfície do receptor do biomarcador para o direcionamento de microbolhas para placas de Petri.
- Pegue pratos de poliestireno de 35 mm de diâmetro para serem usados como superfície alvo. Aproveite a adesão inespecífica de proteínas à superfície da placa de poliestireno a partir da solução salina normal. Use uma proteína modelo, estreptavidina, para testar o direcionamento de bolhas biotiniladas que contêm biotina-PEG-DSPE como parte da casca.
- Coloque uma gota de solução de estreptavidina (0,2 mL, 10 μg/mL em PBS) no centro de cada placa de Petri e cubra-a com uma lamínula de plástico de 22 mm x 22 mm para permitir um revestimento uniforme da superfície da placa. Após incubação durante a noite a 4 °C em um ambiente úmido fechado para evitar que o prato seque, remova as lamínulas.
- Lave imediata e exaustivamente as placas com água, PBS, e bloqueie-as por incubação com albumina de soro bovino (BSA) a 1,5% em PBS por pelo menos 4 h para minimizar a adesão inespecífica de microbolhas à superfície não revestida. Use as placas de cultura limpa bloqueadas com 1,5% de BSA como controles.
- Como alternativa, use solução recombinante de receptor αVβ3 (por exemplo, a 4 μg/mL em PBS)5 em vez de estreptavidina. Direcione as microbolhas para este biomarcador por meio do ligante peptídico RGD cíclico ligado à casca da microbolha.
- Mantenha o prato com o receptor-alvo depositado úmido: a proteína receptora pode ser inativada se secar.
NOTA: É importante usar proteínas receptoras livres de carreadores que não contenham proteínas carreadoras ou surfactantes no meio - sua presença inativará a adesão.
- Adesão de microbolhas em uma pequena gota: verifique rapidamente a adesão direcionada em condições estáticas.
- Deposite uma gota de microbolhas (5-20 μL) por baixo na superfície alvo (ou controle somente BSA) em uma placa de Petri invertida de cabeça para baixo. Isso trará as bolhas para a superfície revestida do receptor por flotação.
- Após 5-10 min de incubação do prato invertido em um ambiente úmido, inverta o prato de volta à posição normal, encha-o com PBS e enxágue suavemente para remover as microbolhas livres. Realize microscopia de campo claro para avaliar a adesão direcionada.
- Adesão de microbolhas na superfície da placa de Petri: realizar o direcionamento em uma placa cheia1.
- Pegue o prato, que tem revestimento de superfície receptor, e encha-o completamente com tampão PBS-BSA desgaseificado (mais de 10 mL para o prato de 35 mm), de modo que o menisco do tampão se estenda sobre a parte superior do prato e seja mantido por força capilar. Injete as bolhas (50 μL) na maior parte do tampão e misture rapidamente para obter homogeneidade. Evite a formação de bolhas de ar durante a mistura.
- Coloque um segmento de fita adesiva transparente ou uma fita seladora de placa de cultura, apoiada com um pedaço plano de plástico sobre o prato rapidamente. Sele o filme com pressão no prato, inverta o "conjunto" e coloque-o de cabeça para baixo por 30 min para permitir que as microbolhas flutuem para cima, toquem a superfície alvo e adiram.
- Inverta o "conjunto" do prato selado de volta para a configuração "de cabeça para baixo", remova o selo e lave as microbolhas não aderentes enxaguando com solução tampão desgaseificada. Observe as microbolhas direcionadas por microscopia ou por ultrassom.
NOTA: Quando o prato selado invertido completamente preenchido com a dispersão de microbolhas é incubado, ele pode ser colocado em um pequeno ângulo, portanto, se houver bolhas grandes, elas flutuarão até a borda do prato, fora da região central de interesse. O enxágue forçado com fluxo rápido proveniente de uma ponta de micropipeta durante a microscopia pode ser usado para avaliar a firmeza com que as bolhas estão aderidas ao alvo (as bolhas se desprendem completamente da superfície de controle, mesmo em fluxo lento) 11. O tampão desgaseificado é preferível para diluição de bolhas, porque o excesso de ar dissolvido levará ao crescimento descontrolado de microbolhas.
7. Teste o direcionamento de microbolhas in vitro: avalie ensaios dinâmicos de adesão/retenção em uma câmara de fluxo de placas paralelas
NOTA: Testamos a adesão de bolhas biotiniladas à camada de estreptavidina com imagens de ultrassom.
- Use uma câmara de fluxo de placa paralela disponível comercialmente com um suporte de inversor personalizado para observar a adesão direcionada a uma placa de Petri de 35 mm a partir do meio de fluxo. Após a adsorção da proteína-alvo na cápsula (ver 6.1.1), inserir o corpo da câmara com a junta pré-instalada na cápsula e selá-lo no suporte. Use juntas com altura do canal (ou seja, espessura da junta) 0.127 mm e largura do canal 2.5 mm.
NOTA: Durante a montagem da câmara de fluxo de placa paralela, a quantidade de graxa de silicone usada na junta deve ser mínima. Não permita que a gordura entre na área do canal: evite cobrir a superfície revestida de proteína do biomarcador com graxa. Para obter uma vedação adequada, selecione pratos de 35 mm com cuidado (consulte a Tabela de Materiais para obter informações sobre a câmara e o prato). - Para o conjunto da câmara de fluxo, não aperte a tampa e a estrutura que segura a combinação prato-câmara de fluxo com muita força, para evitar vazamentos.
- Conecte a tubulação de fluxo a uma bomba de seringa operada em modo de retirada e, no lado do alimentador, conecte uma tubulação fina de polietileno (PE50) ao frasco com uma dispersão diluída de microbolhas, submetida a mistura constante com uma barra de agitação por meio de um agitador magnético12. Controle o parâmetro de taxa de cisalhamento da parede (WSR) da câmara ajustando a vazão volumétrica da bomba com base na fórmula 6Q/bh2, onde Q é a vazão, 'b' é a largura do canal e 'h' é a altura do canal.
NOTA: Remova as bolhas de ar de todo o sistema antes da perfusão do meio contendo microbolhas ou PBS, pois qualquer bolha de ar que passe pelo canal desalojará as microbolhas aderentes da superfície alvo e invalidará o experimento. A conexão entre a tubulação da câmara de fluxo e a seringa deve ser devidamente vedada. - Prepare uma dispersão de microbolhas adicionando um volume calculado de bolhas concentradas ao reservatório de microbolhas (um frasco de cintilação de 20 mL) para atingir a concentração de 106 microbolhas / mL, em tampão PBS com 0,1% de BSA. Coloque o reservatório do alimentador em um agitador de placa magnética. Insira uma barra de agitação magnética de 1 cm x 2 cm e agite a ~ 400 RPM para manter a homogeneidade durante o estudo.
- Realize imagens de ultrassom da câmara de fluxo em um tanque de água13.
- Mergulhe o conjunto da câmara de fluxo em água desgaseificada e segure-o no lugar por um peso para evitar movimento durante os experimentos.
- Coloque a sonda de imagem fixada diretamente acima do canal e incline-a em um ângulo de 15° para trás, bem como em um ângulo de 5° no sentido horário para minimizar a reflexão especular da superfície do prato. Posicione o canal da câmara de fluxo dentro do plano de imagem.
- Use as seguintes condições de imagem: transdutor 15L8, modo de imagem específico de contraste, faixa dinâmica de 50 dB, 7 MHz, Índice Mecânico (MI) = 0,18, Ganho CPS = 0. Mantenha a compensação de ganho de tempo uniforme em toda a imagem.
- Coloque a face do transdutor de forma que ela toque a superfície da água, não profundamente imersa. Como alternativa, use uma capa protetora de borracha preenchida com gel de ultrassom.
NOTA: Para garantir o posicionamento reprodutível do sistema de câmara de fluxo para imagem, os marcadores devem ser colocados na bacia de água ou na tela do sistema de ultrassom.
- Puxe a dispersão de microbolhas do reservatório através da câmara e na bomba por 2 min.
- Mude o fluxo para PBS, para remover bolhas não aderentes do canal e avaliar o retroespalhamento acústico das bolhas aderentes restantes (direcionadas). Para obter uma imagem de fundo, aumente o IM para 1,9 para destruir as bolhas aderentes no campo de visão da imagem de ultrassom.
NOTA: A dispersão de microbolhas deve ser substituída por execuções repetidas: em alta diluição, as microbolhas se degradam gradualmente com o tempo.
- Mude o fluxo para PBS, para remover bolhas não aderentes do canal e avaliar o retroespalhamento acústico das bolhas aderentes restantes (direcionadas). Para obter uma imagem de fundo, aumente o IM para 1,9 para destruir as bolhas aderentes no campo de visão da imagem de ultrassom.
- Exporte imagens individuais do fluxo de vídeo de gravação de tela: antes da liberação do PBS, após a liberação e após a destruição, para serem importadas para o ImageJ para análise offline. Selecione a região de interesse (ROI) para excluir as partes de entrada e saída da câmara. Após a subtração do sinal de ROI de fundo, quantifique a intensidade do eco como a intensidade média de pixels dentro do ROI.
NOTA: Como alternativa à imagem de ultrassom, a adesão das microbolhas à superfície alvo pode ser observada por microscopia de vídeo, quando o conjunto da câmara de fluxo de placas paralelas no suporte invertido é colocado em um palco de um microscópio composto, com gravação de vídeo 5,11,12,14. Isso é especialmente útil para imagens de adesão direcionada de microbolhas a receptores de biomarcadores de superfície celular em cultura de células, quando as células que expressam receptores são cultivadas na placa de cultura de tecidos e o número de microbolhas ligadas a cada célula-alvo pode ser contado diretamente.
Resultados
Acoplamento covalente de peptídeo e lipídio
A conclusão da reação e a formação desejada do produto foram confirmadas por TLC. Um controle peptídico não reagido separado não subiu durante a TLC: ele foi retido no início e sua mancha foi positiva para o grupo amino primário, como observado após a pulverização de ninidrina, após o aquecimento. Esta mancha de peptídeo livre positiva para ninidrina não foi mais observada na mistura após a conclusão da reação, após a TLC da amostra da mistura de reação, após a remoção de DIPEA, DMSO e redissolução em clorofórmio. Quanto à questão crucial da qualidade do reagente de éster NHS, a Figura 1 apresenta a trilha espectrofotométrica da cinética de hidrólise, com o ponto de tempo zero no início da reação sendo quando o éster NHS em um solvente orgânico foi adicionado à cubeta. Isso confirma a funcionalidade do éster ativo NHS de carboxi-PEG-DSPE (consulte a Seção 1 dos Métodos). No ponto de tempo zero, o extrapolado A260 = 0,33 representa o material que já foi hidrolisado antes do teste. Na conclusão da reação de hidrólise, em excesso de 10-15 min, A260 = 1,54 (quando a absorbância não aumenta mais consideravelmente). Isso confirma a presença de éster ativo. Ele também fornece dados quantitativos, que mais de 78% do material não é NHS pré-hidrolisado e, portanto, pode ser usado com sucesso para acoplamento de peptídeos, com o ajuste adequado da quantidade de reagente.
Preparação e transferência de material lipídico do meio aquoso para o invólucro da bolha: lipídio de fluorescência
As microbolhas para este estudo foram preparadas para conter uma quantidade vestigial (inferior a 1%) do corante fluorescente DiI, com fluorescência vermelha característica, que foi adicionada como uma solução em PG à solução salina-PG de DSPC e estearato de PEG. As microbolhas resultantes demonstram claramente a fluorescência da concha quando a excitação de luz verde e os filtros de emissão vermelha são usados no microscópio (veja a Figura 2, à esquerda). A microscopia de campo claro da fase gasosa de microbolhas (Figura 2, à direita) pode ser comparada com a fluorescência da casca de microbolhas. Para a avaliação quantitativa da transferência de material lipídico da fase aquosa para a casca da bolha, as microbolhas foram flutuadas usando centrifugação, e o sinal de fluorescência da fase infranadante clara foi comparado com a fluorescência da solução inicial, antes da amalgamação das microbolhas. Quase uma redução de sinal de ordem de magnitude foi observada (Figura 3), ou seja, mais de 85% do material lipídico foi transferido para a casca da microbolha por amalgamação.
Preparação e correção da distribuição de tamanho de microbolhas
As microbolhas geradas pela amalgamação demonstraram uma distribuição de tamanho típica, com alta concentração (por exemplo, ~ 4,8 x 109 partículas por mL para bolhas biotiniladas). A distribuição de tamanho foi ampla, com partículas presentes dentro da faixa medida (entre 1 e 30 μm); ~ 6,3% das microbolhas excedem 5 μm de diâmetro (Figura 4, curva verde). A administração intravascular de grandes microbolhas pode levar ao seu acúmulo inespecífico nos capilares sanguíneos e deve ser evitada. Uma flutuação curta (15-17 min) do frasco invertido em gravidade normal, com a subsequente coleta de 0,3 mL perto da superfície do septo, permite a remoção completa de microbolhas maiores, com pequena perda na concentração do número total de partículas, até ~ 4,6 x 109: após a flutuação, apenas 0,01% das partículas na amostra purificada têm diâmetros acima de 5 μm (Figura 4, curva vermelha).
Adesão de microbolhas à superfície revestida por receptor: ensaio estático
Este procedimento foi descrito pela primeira vez no século anterior1 e está sendo usado como um teste rápido que confirma a funcionalidade das microbolhas direcionadas. As microbolhas podem entrar em contato com a superfície do prato que transporta o receptor. Se a interação ligante-receptor ocorrer, as bolhas podem ser retidas na superfície, apesar da lavagem vigorosa. Um exemplo de um teste rápido da adesão funcional de microbolhas c (RGDfK) na superfície revestida com αrecombinante vβ3 é apresentado. A Figura 5 é uma imagem representativa de microscopia de campo claro de microbolhas aderentes na superfície do receptor em uma placa de Petri, após uma lavagem com PBS, para remover bolhas não ligadas. As bolhas neste tipo de microscopia apresentam-se como padrões circulares escuros. Em condições semelhantes, se a superfície for revestida apenas com albumina (para bloquear a adesão inespecífica), as microbolhas não aderirão e serão facilmente lavadas mesmo com o enxágue suave.
Ligação de microbolhas do meio de fluxo: câmara de fluxo de placa paralela
Este procedimento foi inicialmente proposto como uma ferramenta para o estudo da adesão celular em um ambiente de fluxo controlado15 e adaptado para o estudo do direcionamento de microbolhas décadas depois11. O teste em um sistema de fluxo, ao contrário de um ensaio estático, é muito mais realista para um cenário de imagem clínica, em que bolhas circulantes em um fluxo de sangue tocam brevemente a parede do vaso e podem aderir a ela se o receptor-alvo estiver presente. Dois exemplos de tais estudos são apresentados. O primeiro exemplo é uma abordagem mais tradicional, onde a adesão de microbolhas decoradas com peptídeos à superfície revestida por receptor é monitorada por microscopia de vídeo. A microscopia permite distinguir as microbolhas aderentes das que fluem. Também permite quantificar essas microbolhas aderentes na estrutura de imagem do microscópio: muito mais microbolhas c (RGDfK) (coluna esquerda) aderem à superfície, quando comparadas com o controle, onde o peptídeo c (RADfK) embaralhado é usado, ou se a superfície é revestida apenas com BSA (Figura 6).
O segundo exemplo é a imagem de ultrassom de contraste da placa de Petri revestida com estreptavidina (Figura 7, lado direito) na qual microbolhas biotiniladas adsorvem com sucesso do meio de fluxo e podem ser detectadas por imagens de ultrassom de contraste após uma lavagem com PBS. A superfície do prato de controle não retém nenhuma microbolha aderente do fluxo, portanto, essencialmente, todo o sinal de contraste de ultrassom é removido com o fluxo PBS. A quantificação do sinal de contraste ultrassonográfico mostra forte significância estatística da diferença observada; a proporção de sinais de alvo e controle excedeu uma ordem de magnitude.
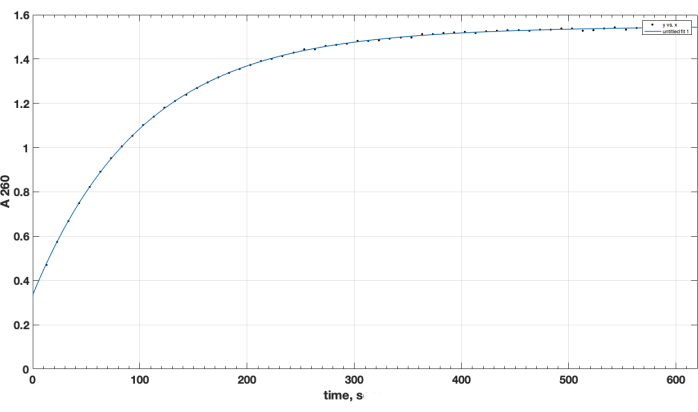
Figura 1. Cinética de hidrólise do éster ativo NHS-PEG-DSPE, observada por liberação de NHS em meio alcalino por teste espectrofotométrico no comprimento de onda de 260 nm. O ponto de tempo zero é o tempo de adição de NHS-PEG-DSPE em solvente orgânico ao tampão borato 0,1 M, pH 9,2. Clique aqui para ver uma versão maior desta figura.

Figura 2. Microscopia de microbolhas cheias de gás após amalgamação. Esquerda, microscopia de fluorescência (excitação verde, emissão vermelha, corante de casca lipídica DiI). Direita, microscopia de campo claro (observação em fase gasosa), mesma ampliação. Largura do quadro, 85 um (micrômetro de estágio de 10 μm embutido no canto inferior direito de cada imagem). Clique aqui para ver uma versão maior desta figura.
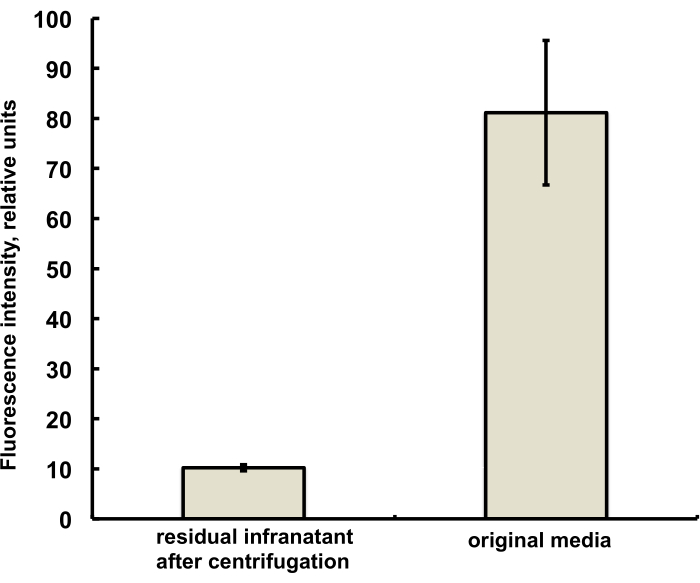
Figura 3. Espectroscopia de fluorescência da amostra de corante lipídico DiI do meio de preparação de microbolhas antes da amalgamação (direita) e após a amalgamação e remoção de microbolhas por flotação centrífuga (esquerda). Excitação de fluorescência - 555 nm, emissão - 620 nm. Dados apresentados como Média ± Desvio Padrão. Clique aqui para ver uma versão maior desta figura.
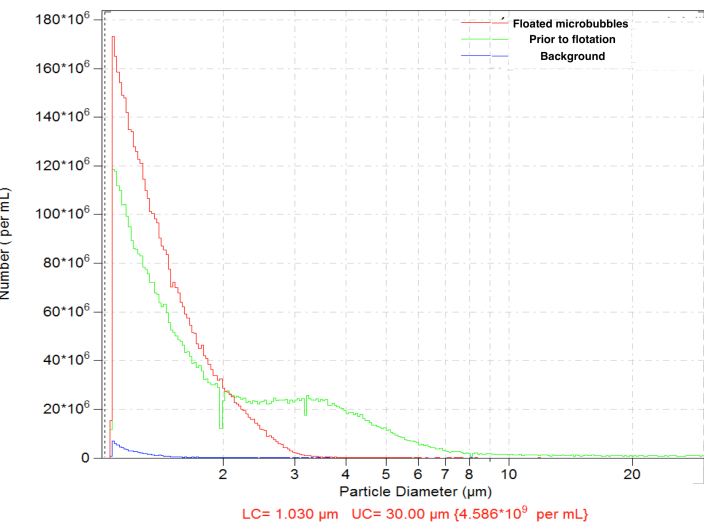
Figura 4. Distribuição granulométrica do número de concentrações de microbolhas após a preparação da amalgamação (verde), com subsequente flotação por gravidade normal para a remoção de microbolhas grandes (vermelho) e contagem de fundo apenas com diluente (azul). Contagem de partículas com sensor de eletrozona em solução salina normal, orifício de 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5. Microscopia de campo claro de microbolhas c(RGDfK) em uma placa revestida com αvβ3. A largura do quadro da imagem é de 106 μm; a barra é de 10 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6. In vitro direcionamento da câmara de fluxo de placa paralela de microbolhas decoradas com peptídeos para a superfície revestida com α recombinante vβ3. microbolhas decoradas com cRGDfK aderiram eficientemente ao prato (esquerda), a fixação de microbolhas de cRADfK não direcionadas de controle (embaralhadas, centro) foi mínima (p<0,00005), assim como a retenção de microbolhas na superfície de controle somente albumina (direita, p<0,0025). Tensão de cisalhamento da parede de fluxo da câmara a 1 din/cm2. Adesão de microbolhas monitorada por microscopia de vídeo; O número de partículas no campo de visão é apresentado. O tempo de acumulação é de 4 min. Dados apresentados como Média ± Desvio Padrão. Reproduzido com permissão de5. Direitos autorais, 2018, American Chemical Society. Clique aqui para ver uma versão maior desta figura.
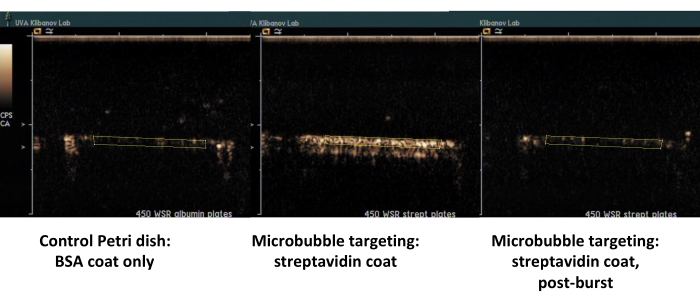
Figura 7. Imagem de ultrassom de contraste de uma câmara de fluxo de placa paralela após adesão direcionada e descarga tampão de microbolhas biotiniladas no prato revestido com estreptavidina (microbolhas direcionadas ao meio, aderentes, à direita, mesmo prato, após explosão de ultrassom de alto IM) e prato de controle revestido apenas com albumina (esquerda). Dois minutos de perfusão de dispersão de microbolhas (PBS/BSA, 106 partículas/mL) a 450 s-1 de taxa de cisalhamento, seguido de descarga do tampão. A quantificação do sinal de ultrassom é realizada a partir das regiões de interesse nos quadros de vídeo após a subtração do fundo. Clique aqui para ver uma versão maior desta figura.
Discussão
A importância de uma técnica simples para a preparação de microbolhas decoradas com ligantes é evidente. O uso da técnica de amalgamação para preparação de microbolhas, como pioneiro de Unger et al.,16 pode servir a esse propósito por uma série de razões. A fabricação de microbolhas por amalgamador é fácil de executar. Uma unidade monofásica de 120 V de mesa de pequeno porte está disponível e é barata. O procedimento é rápido (45 segundos) e eficiente: 1 mL de dispersão de microbolhas em meio aquoso é preparado de uma só vez. Ele contém bilhões de partículas por mL, mais do que suficiente para estudos de pesquisa. A fabricação ocorre em um frasco selado com headspace de gás perfluorado. Se necessário, o conteúdo do frasco permanecerá estéril desde o momento do enchimento asséptico, durante a fabricação (amalgamação) e até o uso. Isso torna a abordagem relevante para uso clínico, pois não requer preparações elaboradas em um ambiente estéril dedicado na clínica.
O procedimento é baseado na automontagem: durante a mistura, à medida que o alto cisalhamento é aplicado à interface gás-água dentro do frasco móvel, pequenos fragmentos de gás são formados, que assumem forma esférica devido à ação da tensão superficial. O PG, como cosurfactante, presente no meio em alta concentração, reduz a tensão superficial e a energia necessária para gerar a interface gás-água durante o cisalhamento. Em seguida, surfactantes mais "clássicos", como lipídios PEG e fosfolipídios, que estão presentes em concentrações muito mais baixas, chegam à interface, provavelmente deslocando o PG e estabelecendo uma camada monomolecular na superfície da bolha. Esta concha é razoavelmente estável; é provável que seja devido a uma combinação de um lipídio "sólido" (a temperatura de transição de fase DSPC é de 56 ° C, portanto, não é propensa à fusão entre membranas) e uma camada de escova PEG estendida que envolve as microbolhas e inibe o contato direto da monocamada das bolhas vizinhas. Pode-se especular que a presença de uma alta concentração de PG no meio pode diminuir a estabilidade da casca das microbolhas. Na sua ausência, as microbolhas são estáveis nos frascos selados sob atmosfera de fluorocarbono por muitos meses, com fusão apenas moderada entre as bolhas. Para uso clínico, com um pequeno dispositivo amalgamador à beira do leito, o intervalo entre a preparação e o uso das microbolhas pode ser curto, minutos ou horas. Com o PG presente no meio, a concentração de microbolhas não apresenta queda significativa, pelo menos por várias horas de armazenamento refrigerado.
Uma vantagem adicional do procedimento descrito (auxiliado pelo uso de cossurfactante PG no meio de preparação de bolhas) é a alta eficácia (>85%) da transferência de lipídios para a casca, enquanto a sonicação tradicional fornece ~ 20% de eficácia5 e os métodos microfluídicos modernos ainda mais baixos17. O alto nível de eficiência de transferência é importante não apenas porque o desperdício de material lipídico e ligante caro é reduzido, mas também porque a quantidade de ligante sem bolhas co-presente no meio também é minimizada. Então, o ligante livre pode não ter a oportunidade de bloquear o receptor alvo do biomarcador ao qual se espera que as microbolhas se liguem via ligante em sua superfície. A quantidade geral do receptor do biomarcador na vasculatura alvo costuma ser bastante alta, portanto, isso pode não ser de extrema importância. A partir da literatura de patentes disponível18 , pode-se sugerir que pelo menos 50% do material da casca lipídica e do ligante alvo nas formulações de microbolhas em testes clínicos podem estar associados à casca da bolha. Isso geralmente pode ser comparado com anticorpos radiomarcados ou peptídeos que são amplamente utilizados em estudos de imagem de receptores de medicina nuclear: a maioria daqueles que visam moléculas de ligante na verdade não carregam radioisótopo "quente", mesmo para a atividade específica mais alta relatada19, enquanto para microbolhas direcionadas, o material da casca neste estudo (incluindo ligante-lipídio) está principalmente ligado a microbolhas.
A adesão seletiva de microbolhas direcionadas preparadas por esta técnica in vitro foi demonstrada, em dois conjuntos de modelos de direcionamento: adesão estática e um experimento de direcionamento em câmara de fluxo. Em um ensaio estático, as microbolhas direcionadas aderiram firmemente à camada receptora alvo e não foram desalojadas com o enxágue tampão, ao contrário de um ambiente de controle, onde as microbolhas foram removidas da superfície mesmo com um enxágue suave. Da mesma forma, em um teste de fluxo, realizado em uma câmara de fluxo de placa paralela, bolhas biotiniladas demonstraram adesão estatisticamente significativa e excelente à camada de estreptavidina em uma placa de poliestireno, quando comparadas com a superfície controle somente de albumina. Microbolhas decoradas com peptídeo c (RGDfK) aderiram seletivamente a αvβ superfície revestida com3, tanto no ensaio de adesão estática quanto em uma câmara de fluxo de placa paralela.
Os seguintes problemas podem ser considerados como as limitações do protocolo descrito. Primeiro, o procedimento não leva em conta as partículas submicrônicas. O instrumento usado no estudo não foi configurado para detectar nanobolhas (ou seja, partículas com menos de 1 μm de diâmetro). Essas partículas podem estar presentes na formulação. Embora seu sinal de retroespalhamento acústico seja geralmente conhecido por ser baixo, e eles não tenham sido observados neste estudo por microscopia, a presença de nanobolhas ainda deve ser considerada. A segunda questão significativa é a heterogeneidade de tamanho das microbolhas. Apesar da remoção de partículas maiores, o tamanho das bolhas resultantes está longe de ser uniforme. Esta deve ser uma consideração e justificativa para pesquisas futuras na área de formulação de microbolhas.
Em conclusão, a narrativa dada neste manuscrito deve fornecer nível suficiente de detalhes técnicos para fabricar microbolhas direcionadas de forma rápida e fácil. São fornecidas as etapas para realizar purificação adicional (se desejável), ajustar o tamanho e/ou avaliar a pequena quantidade do material do invólucro que permanece no meio aquoso. As ferramentas analíticas detalhadas para a avaliação dos parâmetros das microbolhas, como distribuição de tamanho e concentração, e capacidade in vitro das microbolhas decoradas com ligantes de aderir aos receptores-alvo são descritas.
Divulgações
A. Klibanov é cofundador e acionista minoritário da Targeson Inc, uma startup na área de microbolhas pré-clínicas direcionadas, agora dissolvida. Seu laboratório UVA tem um subcontrato via NIH R44 HL139241 da SoundPipe Therapeutics.
Agradecimentos
A.L. Klibanov reconhece o apoio em parte via NIH R01EB023055, concedido pelo Instituto Nacional de Imagens Biomédicas e Bioengenharia dos Institutos Nacionais de Saúde, um subcontrato com a Universidade da Virgínia via NIH R01NS076726, concedido à UCSF pelo Instituto Nacional de Distúrbios Neurológicos e Derrame dos Institutos Nacionais de Saúde, e um subcontrato com a Universidade da Virgínia via R44HL139241 de concessão do NIH, concedido à SoundPipe Therapeutics pelo National Heart, Lung, and Blood Institute. O conteúdo desta publicação é de responsabilidade exclusiva do autor e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
Referências
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados