Method Article
ターゲットマイクロバブルの調製と特性評価
要約
このプロトコルの目標は、ガス充填マイクロバブル(超音波分子イメージング用の標的造影剤)を調製、精製、および特性評価することです。ストレプトアビジンに付着するビオチン化バブルと、既知の腫瘍血管新生バイオマーカーであるαvβ3に結合する環状RGDペプチドマイクロバブルの2つのターゲティングシステムが記載されている。
要約
マイクロバブル(分子イメージング用の超音波造影剤)の標的化は、20年以上にわたって研究されてきました。しかし、マイクロバブルの調製方法や標的化リガンドの結合方法は、煩雑で複雑で、時間がかかります。そのため、標的マイクロバブルの調製手順を簡素化し、臨床応用に近づける必要があります。本書の目的は、ターゲットマイクロバブルの調製、機能特性評価、および試験に必要なステップの詳細な説明と説明を提供することです。ビオチン-ストレプトアビジンターゲティングペアモデルと、腫瘍血管系の内皮に過剰発現する組換えαv β3タンパク質を標的とする環状RGDペプチドの2つのシステムについて、最適化および簡素化された手順のシーケンスを示します。
ここでは、ターゲティングリガンドの脂質アンカーへの共有結合、試薬の品質の評価、および反応の成功を確認するテストを示します。マイクロバブルシェル成分を含む水性前駆体媒体の調製、続いてアマルガメーションによるマイクロバブルの調製、マイクロバブル安定剤シェルへの脂質移動の有効性の評価;in vivoでの使用に有害となる可能性のあるより大きなマイクロバブルを除去するための、常重力での浮遊によるマイクロバブルサイズ分布の調整。エレクトロゾーンセンシングによるマイクロバブルサイズ分布の評価;静的結合アッセイ試験(逆皿内)における受容体被覆表面へのマイクロバブルの標的結合の評価;パラレルプレートフローチャンバー試験における受容体コーティング表面へのマイクロバブルの標的結合の評価。
概要
ターゲットマイクロバブルを用いた分子イメージングは、20年以上にわたって研究と試験が行われてきました。一般的な概念は単純明快で、疾患領域の血管内皮に特異的な分子バイオマーカーに選択的な親和性を持つガス充填マイクロバブルを静脈内注射します。これらの粒子は、標的(腫瘍腫瘍血管系または虚血性炎症性損傷の領域など)内を循環して蓄積します。次に、付着したマイクロバブルを造影超音波イメージングによって検出します。前世紀1,2からの初期のコンセプト研究の取り組みは、現在、臨床採用に向けて徐々に進んでおり、わずか数年前に中規模の臨床試験段階に達しました3,4。この原稿の目的は、このような標的マイクロバブルの調製と特性評価について、公開された2つの例1,5に基づいて詳細に説明することです。
これらの標的マイクロバブルの製剤化に重要な成分であるペプチド-PEG-リン脂質の調製手順には、反応を成功裏に完了するために必要な試薬の品質管理の説明が補足されています。残念ながら、一部の活性エステル脂質試薬サプライヤーは、到着時に加水分解される材料を提供しているため、アミド結合の形成に参加できません。マイクロバブル調製中に水性媒体からマイクロバブルシェルにどれだけの脂質物質が移動するかに関する情報と、この情報を取得する技術が提供されます。
比較的狭い粒度分布のマイクロバブルを調製することが重要です:血管内in vivo試験用の注射剤中に大きなマイクロバブルが共存すると、微小血管系の詰まりにつながる可能性があります。肺シャントを迂回するマイクロバブルの非特異的蓄積は、非特異的偽陽性組織増強6を引き起こす可能性があり、これはより大きなサイズのマイクロバブルを除去することによって回避されます。したがって、粒子サイズの選択を達成するための簡単な手順が示され、粒子カウンターを使用して粒子濃度とサイズ分布を評価する方法の説明によって補足されます。
以下に示すマイクロバブルターゲティング評価の最初の試験プロトコルは、ストレプトアビジンコーティング表面1を標的とするビオチン化マイクロバブルを用いた純粋なモデルシステムを示しています。第2のプロトコールは、腫瘍新生血管5の分子バイオマーカーであるαvβ3に対して特異的な親和性を有する環状RGDペプチドで装飾されたペプチド標的マイクロバブルの簡便な調製を説明する原稿に基づいている。このシクロ[Arg-Gly-Asp-D-Phe-Lys]、すなわちc(RGDfK)ペプチドで装飾されたマイクロバブルは、マウス腫瘍モデルにおいて腫瘍新生血管を標的とし、超音波分子イメージングを達成することが示されています。
プロトコル
1. ペプチドとNHS-PEG-DSPEの共有結合
- c(RGDfK)ペプチドを、保護されておらずカップリング可能なリジンの第一級ε-アミノグループと共に、ジメチルスルホキシド(DMSO、10 mg/mL)に溶解します。ポリ(エチレングリコール)-3400-ジステアロイルホスファチジルエタノールアミン(NHS-PEG-DSPE、200 mg / mL)のN-ヒドロキシスクシンイミドエステルのメタノールまたはクロロホルム溶液を調製し、DMSO中のペプチド1 mgに添加します。N,N-ジイソプロピルエチルアミン(DIPEA)を3 μL加えます。
- ペプチドとNHS-PEG-DSPEのモル比を少なくとも1:1.2に維持して、すべての主要なアミノ基が反応できるようにします。DIPEA:ペプチドのモル比を少なくとも2:1に維持して、基本的な培地条件を確保します。
注意:クロロホルム、メタノール、DIPEAは危険物です。手袋、白衣、ゴーグル、ドラフトなどの適切な保護具を使用してください。
注:c(RGDfK)の代わりに、第一級アミノ基を有する他のペプチドまたは模倣物を使用し、結合部位の外側に保護されていないN末端またはリジンを配置することができる。反応を進行させるためには、すべての成分(すなわち、標的配位子および脂質)がDMSO-クロロホルム混合物に可溶でなければなりません。ジメチルホルムアミドまたはその混合物などの代替溶媒も試験できます。水性媒体中での反応も可能ですが、活性エステルの急速な加水分解により、カップリング収率は大幅に低下します。
- ペプチドとNHS-PEG-DSPEのモル比を少なくとも1:1.2に維持して、すべての主要なアミノ基が反応できるようにします。DIPEA:ペプチドのモル比を少なくとも2:1に維持して、基本的な培地条件を確保します。
- 室温で一晩インキュベートした後、揮発性有機物を蒸発させて除去します(窒素ガスまたはロータリーエバポレーターの流れを使用し、その後、高真空ポンプで一晩蒸発させてDMSOを除去します)。不揮発性残留物をクロロホルムに1 mg/mLで再溶解し、サンプリングを制御します。
- 薄層クロマトグラフィー(クロロホルム:メタノール溶媒媒体、2:1 v/v)でTLCプレートを現像)により反応完了を確認します。150°Cの加熱ブロックでプレートを加熱する際に、ニンヒドリンスプレーで第一級アミノ基の有無を確認します。
注意: ニンヒドリンは危険物です。上記のように、適切な保護を使用してください。TLCプレートの加熱ブロック処理は、ドラフト内で行う必要があります。加熱ブロックは潜在的な火災の危険があります。 - マイクロバブル調製に先立ち、クロロホルムからペプチド-PEG-DSPEのサンプル(例:1 mL 1 mg/mL溶液)を分注し、窒素ガスの流れでクロロホルムを蒸発させて乾燥させ、その後の高真空ポンプインキュベーションを行い、生理食塩水を1 mg/mLに添加して透明なミセル溶液を調製します。
- 反応混合物のさらなる精製が望ましい場合は、生理食塩水に再溶解してください。次に、得られたミセル混合物を透析(6〜8 kDa分子量カットオフ、または類似)にかけ、最初に生理食塩水に対して、次に脱イオン水のいくつかの交換に対して行います。
- 透析液の導電率チェックにより透析完了を確認します。透析バッグから透析材料を取り出し、質量がわかっているバイアルに入れ、完全に乾くまで凍結乾燥します。
注:リガンドをPEG脂質の末端に結合させるための代替共有結合反応が利用可能です(例えば、マレイミド-PEG-DSPEとチオール-リガンドとの反応)。このアプローチの主な利点は、配向結合であり、リガンド分子 7に単一のチオールが利用可能な場合です。主な懸念事項は長期安定性である:結果として生じるマレイミドとチオールとの間の結合は、 貯蔵条件によっては、レトロマイケル反応によって分解されやすい可能性がある8。
注:活性エステル試薬の品質はメーカーによって大きく異なります:それは転写および保管条件に依存する場合があります(材料が適切に保管または輸送されていない場合、活性エステルは加水分解し、ペプチドと結合できなくなります)。したがって、マイクロバブルへの標的配位子の共有結合試薬であるNHS-PEG-DSPEの分解度を決定するための手順(下記参照)を説明する義務感があります。NHS-PEG-DSPEは、アルゴン下で乾燥粉末として供給され、急速冷凍保存されます。バイアルを室温に戻して(結露を防ぐため)、分析天びんを使用してサンプルを秤量し、メタノールまたはDMSOに溶解します。バルク乾燥試薬の入ったバイアルは、アルゴンで閉じ、乾燥剤の入った密閉容器に入れて、さらに使用するまで冷凍保存する必要があります。 - 食塩水に乾燥試薬を添加してインキュベートすることにより、ペプチド-PEG-DSPEおよびビオチン-PEG-DSPEのミセル水溶液(ステップ1.4)を調製します。小さな球状ミセルが形成されます。試薬のバルク状態からミセル形態への移動を促進するために、超音波処理および温水浴を適用することができる。
- NHS-PEG-DSPE活性エステルの試薬品質を評価します。
- 試薬中に存在するNHSが活性エステルの形態であることを確認し、アミド結合形成とのカップリング反応を行えるようにする。
- 0.99 mLの0.1 M四ホウ酸ナトリウム緩衝液(pH 9.2)を、分光光度計の石英または紫外透明プラスチックキュベット(ガラスではない)に入れ、波長260 nmでゼロにします。
- 新たに調製したNHS-PEG-DSPEのメタノール溶液200 mg/mL溶液10 μLをキュベットに加えます。同時に、ストップウォッチをスタートさせます。キュベットの内容物を迅速かつ激しく混合して、均一性を実現します。キュベットを光度計に置き、蓋を閉めて測定を開始します。
- 分光光度計の測定開始時に、記録の開始時刻をマークし、10秒ごとに260nmの光度吸光度測定を~10分間、または吸光度値が安定するまで連続して行います。
- 速度論曲線をプロットし、初期 A260 の時点を確認し、反応開始時間に曲線を外挿します (つまり、試薬が水性バッファーに添加され、加水分解反応が開始された点で A260 を見つけます)。キュベットのバッファーにNHS-PEG-DSPEを添加する前に、水不足のために有機溶媒中で加水分解が起こらなかったと仮定します。
- 反応開始時と加水分解完了時のA260 の比を計算します。これは、分解された活性エステルの割合を表します。この情報を使用して、ペプチドの一次アミノ基を完全に修飾するための適切な量のNHS-PEG-DSPEを選択します。
2. 合体によるマイクロバブルの調製
- ビオチン化マイクロバブルの調製
- ジステアロイルホスファチジルコリン(DSPC)とPEGステアリン酸をプロピレングリコールに共溶解します(PG、ニート溶媒中でそれぞれ10 mg / mLの濃度)。熱湯浴を使用して材料を可溶化します。
- 0.85 mLの高温生理食塩水を含むバイアルにこのホットPG溶液0.1 mLを加え、迅速に混合し、ミセルビオチン-PEG-DSPE(50 μL、生理食塩水中1 mg/mL)をDSPCに対して1:20の質量比で加えます。
注:PGへの脂質成分の溶解度は温度に依存するため、温水浴が必要です。脂質を添加する前に、生理食塩水を含むガラスバイアルを温水浴で加熱すると、目に見える粒子のない均一な培地を作り出すのに役立ちます。 - バイアルを室温に戻して、バイアルにゴム栓を取り付け、半分挿入し、バイアルにPTFEキャピラリーチューブを挿入します。デカフルオロブタンガスの流れを使用してバイアルを充填し、キャピラリーを取り外しながらストッパーを閉じます。
注:融合中のバイアルの温度は、得られるマイクロバブル 9のサイズ分布に有意な影響を及ぼし得る。 - ストッパー付きのバイアルを室温で圧着し、アマルガメーター装置に入れます。アマルガメーターを起動します。使用される臨床ユニットは、4300rpmで45秒間動作するようにプリセットされています。
- アマルガメーションが完了したら、得られたマイクロバブルの入ったバイアルをアマルガメーターから取り出します。好ましくは、マイクロバブルのサイズ分布および組成を特徴付け、調製後数時間以内にそれらを使用すること。
- ペプチドデコニングマイクロバブルの調製
- DSPCとPEGステアリン酸をニートPG(各材料あたり10 mg / mL濃度)に共溶解します。熱湯浴を使用して可溶化します。この熱い生理食塩水0.85 mLを含むバイアルにPG中のこのホット溶液0.1 mLを加え、急速に混合し、ミセルペプチド-PEG-DSPE(50 μL、生理食塩水1 mg/mL)をDSPCに1:20質量比で加えます。
- バイアルを室温に戻して、バイアルの上にゴム栓を置き、途中に挿入し、バイアルにポリテトラフルオロエチレン(PTFE)キャピラリーチューブを挿入します。デカフルオロブタンガスの流れを使用してバイアルを充填し、キャピラリーを取り外しながらストッパーを閉じます。
- ストッパー付きのバイアルを圧着し、アマルガメーターに入れて混合します。マイクロバブル分散液のバイアルは45秒で準備が整います。
- マイクロバブルシェルへの脂質移動評価のための色素脂質マイクロバブルの調製
- 上記のように、DSPCとPEGステアリン酸をニートPGに共溶解します(温水浴を使用)(各材料あたり10 mg / mLの濃度)。
- このホットPG溶液0.1mLを0.89mLのホットノーマル生理食塩水が入ったバイアルに加え、急速に混合し、10μLのDiI色素溶液(ニートPGで1 mg / mL)を加えて混合します。バイアルを室温に戻します。
- 上記のようにバイアルのヘッドスペースをデカフルオロブタンガスで満たし、バイアルをストッパーし、クリンプして上記のように融合させます。
3. ミセル水性媒体から気泡殻へのDiI脂質移動試験
- 蛍光脂質物質が水性媒体からマイクロバブルシェルに移動したことを顕微鏡で確認するために、バイアルからセプタムを介してマイクロバブルのアリコートをインスリン注射器でサンプリングします。
- 次に、スライドガラスにドロップを追加し、標準のカバースリップで覆います。まず、脱気した生理食塩水の液滴で希釈します。
- 蛍光エピ照明、100倍オイル対物レンズ、高感度ビデオカメラを装備したビデオ顕微鏡で顕微鏡検査を行います。
- 融合中に生理食塩水/PG水溶液からバブルシェルへの脂質物質の移動の有効性を判断するには、マイクロバブルの密封されたバイアルを取り、それを反転させて円錐形の50mLチューブに入れます。
- バケットローター(10分、200 x g)で遠心分離を行います。バイアルを遠心分離機から取り出し、逆さまにしておきます。
- インスリン注射器の針を倒立バイアルの中隔に挿入します。少量 (~50 μL) の透明なインフラストラクチャーをゆっくりと吸引します。
注:遠心分離後の倒立バイアルからの被清下吸引用の針の斜角先端は、マイクロバブルの摂取の可能性を最小限に抑えるために、できるだけ中隔の近くに配置する必要があります。.
- 溜め物のサンプル(2 μL)と、マイクロバブルの生成に使用した元の脂質-PG-生理食塩水(2 μL)のサンプルを、0.1 mLのリン酸緩衝生理食塩水(PBS):エタノール1:1培地と1% Triton X-100を入れた96ウェルプレートに入れます。
- DiI色素の赤色蛍光(励起555 nm、発光620 nm)を蛍光マイクロプレートリーダーで測定します。
- 蛍光分光法には、バックグラウンドが低く、クリアプレートの問題となる可能性のあるウェル間シグナル伝達の欠如により、底部が不透明な黒色のプレートを使用してください。
- 蛍光シグナルが線形キャリブレーション範囲内にあることを確認してください:ウェル内の色素濃度が高すぎると、光が減衰し、シグナルが過小に報告される可能性があります。
注:合併後に水性媒体に残っている残留シェル材料を除去することが望ましい場合があります。これを行うには、マイクロバブル浮遊選鉱遠心分離後、倒立バイアルからゆっくりと吸引してすべてのインフララント量を取り出し、脱気した通常の生理食塩水と交換します。液体の除去または追加によるバイアル内の周囲圧力の過度の変化を避けるために、セプタムに追加の長い針を挿入して、バイアル内の気相に到達します。バイアル内の気相を維持するために、まず、針をフルオロカーボンガスで満たされたシリンジに接続し、マイクロバブル調製物との空気接触を防ぎます。
4. マイクロバブルサイズ分布の調整
- 静的な逆さまのバイアルで通常の重力浮遊を使用して、マイクロバブルのサイズ分布を調整する、つまり、最大のマイクロバブルを迅速かつ効率的に除去します5,10。
- セクション2で説明したように、調製直後にマイクロバブルのバイアルを取ります。ひっくり返して、安定した非振動面に逆さまに15〜20分間置きます。
- このインキュベーション後、バイアルの中隔にインスリン注射針を逆さまにしたまま挿入し、下層から300〜500μLのマイクロバブルを静かに収集します。
注:シリンジの針は、バイアル内の液体の上部近くに存在する大きな泡の収集を避けるために、中隔内面の近くに留まる必要があります。- シリンジ本体の気泡の乱流と静水圧膨張を避けるために、シリンジプランジャーをゆっくりと引き戻します。採取したサンプルをシリンジから取り出すときは、気泡の崩壊を防ぐために過圧を避けてください。
- マイクロバブル分散液をシリンジから小容量バイアルに移します。次に、パーフルオロガス、ストッパー、クリンプを充填し、短期保存、粒子計数(下記参照)、およびさらなる使用に使用します。
- シリンジから直接サンプリングを行う場合は、水平に保持して回転させ、気泡の浮遊を防ぎ、サンプルの均一性を確保します。
5. マイクロバブルサイズ分布評価
- パーティクルカウンター(エレクトロゾーンセンシングまたは光遮蔽原理に基づく)を使用して、粒子径の分布と濃度を評価します。または、血球計算盤と顕微鏡を使用します。
- 簡単に説明すると、カウンターチャンバー(通常は60〜100 mLの容量)で通常の生理食塩水またはアイソトーンにマイクロバブルサンプルアリコートを加えてカウントします。浮選精製前と浮遊選鉱後のマイクロバブルサイズ分布を比較します。
注:サンプリングの直前にバイアルを穏やかな混合(ボルテックスではない)にさらして、代表的で再現性のある測定を達成します。テストボリュームの中心からのサンプル。 - 100 mLビーカーに少なくとも60 mLの0.9%生理食塩水希釈液を入れ、エレクトロゾーン送信装置のステージに置きます。ステージを持ち上げて、チューブ、外部電極プレート、スターラーがすべて希釈液に完全に浸され、スターラーが回転できるようにします。
注:ビーカー内の希釈液の量は、その質量を使用してスケール(生理食塩水密度は1に近い)で正確に決定できます。あるいは、定量ポンプを使用することもできます。エレクトロゾーンセンシング研究中の電極は、完全に浸漬する必要があります。 - 希釈液電解液量をユニット制御ソフトウェアに記録します。エレクトロゾーンセンシングカウンターには50μmのオリフィスが装備されており、直径1〜30μmの粒子を測定できます。最初にバックグラウンド実行を実行します。0.5 mLの希釈液中がブランクの場合、5000カウント未満であることが予想されます。最適な背景レベルは 100 カウント未満にすることができます。
- ユニット制御ソフトウェアでサンプル量を設定し、希釈係数を考慮します。ビーカーに10-20μLのマイクロバブル混合物を加え、2回目の実行を行います。
- バックグラウンド サイズ分布データを使用して、ソフトウェア内の "バックグラウンド ランの減算" 機能を使用して考慮します。元のマイクロバブルサンプル中の粒子の濃度を粒子数/mLとして取得します。これには希釈係数が含まれます。
- ピペットチップの外面も、サンプリング中に気泡で覆われることがあります。先端を計数媒体に挿入する前に、必ず拭き取ってください。ピペットの先端オリフィスにワイプで触れないでください。
- カウント中にサンプル粒子の希釈が不十分になるのを避けることで、一度に複数の粒子がセンサーオリフィス内にある場合の一致補正の問題を最小限に抑えることができます。これにより、システムは粒子濃度を過小評価する可能性があります。
注:粒子計数用のオリフィス径は異なる場合があります。50 μmのオリフィスを選択することで、直径が1 μmまでのマイクロバブルを検出できますが、直径が小さいオプションほど目詰まりしにくいです。 - 実際の試験で使用されるのと同じ希釈剤試験媒体(滅菌ろ過された通常の生理食塩水灌漑液など)のエレクトロゾーンセンシングカウンターを校正します。エレクトロゾーンセンシングに代わるレーザーオブスキュレーションには、塩分濃度と電気伝導率が制御されたろ過された生理食塩水が不要であるという利点があります。
- 簡単に説明すると、カウンターチャンバー(通常は60〜100 mLの容量)で通常の生理食塩水またはアイソトーンにマイクロバブルサンプルアリコートを加えてカウントします。浮選精製前と浮遊選鉱後のマイクロバブルサイズ分布を比較します。
6. 接着/保持アッセイにおけるin vitroでのマイクロバブルターゲティングの試験
- バイオマーカー受容体表面を調製し、ペトリ皿を標的としたマイクロバブルを調製します。
- ターゲット表面として使用するポリスチレン直径35mmの皿を取ります。通常の生理食塩水からポリスチレン皿表面へのタンパク質の非特異的接着を利用します。モデルタンパク質であるストレプトアビジンを使用して、シェルの一部としてビオチン-PEG-DSPEを含むビオチン化バブルのターゲティングを試験します。
- ストレプトアビジン溶液(0.2 mL、PBS中10 μg/mL)の液滴を各ペトリ皿の中央に置き、22 mm x 22 mmのプラスチックカバースリップで覆って、皿の表面を均一にコーティングできるようにします。密閉された湿った環境で4°Cで一晩インキュベートした後、皿が乾燥するのを防ぎ、カバースリップをはがします。
- プレートを水、PBSで直ちに徹底的に洗浄し、PBS中の1.5%ウシ血清アルブミン(BSA)と少なくとも4時間インキュベートしてブロックし、コーティングされていない表面へのマイクロバブルの非特異的な付着を最小限に抑えます。コントロールとして1.5%BSAでブロックされたクリーンカルチャーディッシュを使用してください。
- あるいは、ストレプトアビジンの代わりに、α Vβ3 受容体溶液(例:PBSで4μg/mL)5 を使用してください。マイクロバブルシェルに結合した環状RGDペプチドリガンドを介して、このバイオマーカーにマイクロバブルを標的とします。
- 沈着した標的受容体のある皿を濡らしてください:受容体タンパク質が乾燥すると不活性化される可能性があります。
注:培地中にキャリアタンパク質や界面活性剤を含まないキャリアフリー受容体タンパク質を使用することが重要です-それらの存在は接着を不活性化します。
- 小さな液滴へのマイクロバブルの接着:静的な状態での目標とする接着を迅速に確認します。
- マイクロバブルの液滴(5〜20μL)を下から、逆さまにしたペトリ皿内のターゲット(または制御BSAのみ)の表面に堆積させます。これにより、浮選によって気泡が受容体被覆表面に運ばれます。
- 湿った環境で反転した皿を5〜10分間インキュベートした後、皿を通常の位置に戻し、PBSで満たし、穏やかですすいで遊離したマイクロバブルを取り除きます。明視野顕微鏡検査を実施して、標的接着を評価します。
- シャーレ表面へのマイクロバブルの付着:フルディッシュでターゲティングを行います1。
- 受容体表面コーティングが施されたディッシュを取り、脱気したPBS-BSAバッファー(35mmディッシュの場合は10mL以上)で完全に充填し、バッファーのメニスカスがディッシュの上部に伸びて毛細管現象によって保持されるようにします。気泡(50 μL)をバッファーの大部分に注入し、急速に混合して均質性を実現します。混合中に気泡が形成されないようにしてください。
- 透明な包装テープまたは培養プレートシーラーテープのセグメントを、平らなプラスチック片で裏打ちした皿にすばやく置きます。フィルムをディッシュに圧力シールし、「アセンブリ」を反転させ、逆さまに30分間置くと、マイクロバブルが上向きに浮き上がり、ターゲット表面に触れて接着します。
- 密封されたディッシュの「アセンブリ」を「ダウンサイドダウン」構成に戻し、シールを取り外し、脱気バッファー溶液ですすいで非付着性のマイクロバブルを洗い流します。顕微鏡または超音波イメージングにより、標的となるマイクロバブルを観察します。
(注)マイクロバブル分散液を完全に充填した逆シールディッシュをインキュベートすると、わずかな角度で配置できるため、大きな気泡が存在する場合、それらはディッシュの端、つまり対象領域の中心領域の外側に浮遊します。顕微鏡観察中にマイクロピペットチップからの高速流による強制すすぎを使用して、気泡がターゲットにどの程度しっかりと付着しているか(低速流でも気泡は制御面から完全に剥離する) 11。脱気バッファーは、過剰な溶存空気がマイクロバブルの制御不能な成長につながるため、気泡希釈に適しています。
7. in vitroでのマイクロバブルターゲティング試験:パラレルプレートフローチャンバーでの動的接着/保持アッセイの評価
注:ビオチン化気泡のストレプトアビジン層への接着を超音波イメージングで試験します。
- カスタムメイドのインバータホルダーを備えた市販のパラレルプレートフローチャンバーを使用して、流れる媒体から35mmのペトリ皿への標的接着を観察します。標的タンパク質をディッシュに吸着した後(6.1.1参照)、ガスケットがあらかじめ取り付けられているチャンバー本体をディッシュに挿入し、ホルダーに密封します。チャネルの高さ(つまり、ガスケットの厚さ)0.127 mm、チャネル幅2.5 mmのガスケットを使用します。
注:平行プレートフローチャンバーの組み立て中、ガスケットに使用されるシリコングリースの量は最小限に抑える必要があります。チャネル領域にグリースが入らないようにする:バイオマーカータンパク質でコーティングされた表面をグリースで覆うことは避けてください。適切なシールを実現するには、35 mmのディッシュを慎重に選択してください(チャンバーとディッシュの情報については 、材料の表 を参照してください)。 - フローチャンバーアセンブリの場合、漏れを防ぐために、ディッシュフローチャンバーの組み合わせをしっかりと保持するキャップとフレームをねじ込みすぎないでください。
- フローチューブを回収モードで作動するシリンジポンプに接続し、フィーダー側では、薄いポリエチレンチューブ(PE50)を希薄なマイクロバブル分散液でバイアルに接続し、マグネチックスターラー12を介して攪拌棒で常時混合する。式 6Q/bh2 ( Q は流量、'b' はチャネルの幅、'h' はチャネルの高さ) に基づいてポンプの体積流量を調整することにより、チャンバーの壁面せん断速度 (WSR) パラメータを制御します。
注:チャネルを通過する気泡は、ターゲット表面から付着したマイクロバブルを除去し、実験を無効にするため、マイクロバブル含有培地またはPBSを灌流する前に、システム全体から気泡を除去してください。フローチャンバーチューブとシリンジの間の接続は、適切に密閉する必要があります。 - マイクロバブルリザーバー(20 mLシンチレーションバイアル)に計算量の濃縮バブルを添加して、0.1% BSAを含むPBSバッファーで106 マイクロバブル/mLの濃度を達成することにより、マイクロバブル分散液を調製します。フィーダーリザーバーを磁気プレートスターラーに置きます。1 cm x 2 cm のマグネチックスターバーを挿入し、~400 RPMで攪拌して、研究中に均質性を維持します。
- 水タンク13内のフローチャンバーの超音波イメージングを行う。
- フローチャンバーアセンブリを脱気水に浸し、実験中の動きを防ぐために重りで所定の位置に保持します。
- イメージングプローブをクランプしてチャンネルの真上に置き、ディッシュ表面からの鏡面反射を最小限に抑えるために、後方に15°の角度で傾け、時計回りに5°の角度で傾けます。フローチャンバーチャネルをイメージング平面内に配置します。
- 次のイメージング条件を使用します:15L8トランスデューサー、コントラスト特異的イメージングモード、ダイナミックレンジ50 dB、7 MHz、メカニカルインデックス(MI)= 0.18、CPSゲイン= 0。タイムゲイン補正は、画像全体で均一に保ちます。
- トランスデューサーの面は、深く浸さないように水面に触れるように配置します。または、超音波ジェルで満たされたゴム製の保護スリーブを使用します。
注:イメージングのためのフローチャンバーシステムの再現性のある位置決めを保証するために、マーカーは水盤または超音波システムの画面に配置する必要があります。
- マイクロバブル分散液をリザーバーからチャンバーを通ってポンプに2分間引き込みます。
- 流れをPBSに切り替えて、チャネルから非付着性気泡を除去し、残りの付着性(標的)気泡の音響後方散乱を評価します。背景画像を取得するには、MIを1.9に増やして、超音波イメージング視野内の付着した気泡を破壊します。
注:マイクロバブル分散液は、繰り返し実行するために交換する必要があります:高希釈では、マイクロバブルは時間とともに徐々に劣化します。
- 流れをPBSに切り替えて、チャネルから非付着性気泡を除去し、残りの付着性(標的)気泡の音響後方散乱を評価します。背景画像を取得するには、MIを1.9に増やして、超音波イメージング視野内の付着した気泡を破壊します。
- 画面録画ビデオストリームから個々の画像をエクスポートします:PBSフラッシュ前、フラッシュ後、破棄後、オフライン分析のためにImageJにインポートします。関心領域(ROI)を選択して、チャンバーの入口部分と出口部分を除外します。バックグラウンドROI信号を減算した後、エコー強度をROI内の平均ピクセル強度として定量化します。
注:超音波イメージングの代替として、マイクロバブルのターゲット表面への付着は、ビデオ録画5,11,12,14を使用して、倒立ホルダー内の平行プレートフローチャンバーアセンブリを複合顕微鏡のステージに置いたときに、ビデオ顕微鏡で観察することができます。これは、受容体発現細胞を組織培養皿上で増殖させ、各標的細胞に結合したマイクロバブルの数を直接カウントできる場合に、細胞培養中の細胞表面バイオマーカー受容体へのマイクロバブルの標的接着をイメージングするのに特に有用です。
結果
ペプチドと脂質の共有結合
反応の完了と目的の生成物形成はTLCによって確認されました。別の未反応ペプチドコントロールはTLC中に上昇しなかった:開始時に保持され、そのスポットは、加熱時にニンヒドリン噴霧後に観察されたように、一次アミノ基に対して陽性であった。このニンヒドリン陽性遊離ペプチドスポットは、反応完了後、反応混合物サンプルのTLC後、DIPEA、DMSOの除去、およびクロロホルムへの再溶解後、混合物中には観察されなくなりました。NHSエステル試薬の品質に関する重要な問題については、 図1 に加水分解速度の分光光度法の軌跡が示されており、反応開始時のゼロ時点は有機溶媒中のNHSエステルがキュベットに添加されたときです。これにより、カルボキシ-PEG-DSPEのNHS活性エステルの機能が確認されています(方法セクション1を参照)。ゼロ時点では、外挿された A260=0.33 は、試験前にすでに加水分解された材料を表します。加水分解反応の完了時に、10〜15分を超えると、A260 = 1.54(吸光度がこれ以上大幅に増加しない場合)。これにより、活性エステルの存在が確認されます。また、材料の78%以上が事前に加水分解されたNHSではないため、試薬量を適切に調整することでペプチドカップリングにうまく使用できるという定量的データも提供します。
水性媒体から気泡殻への脂質材料の調製と移動:蛍光脂質
この研究のためのマイクロバブルは、DSPCおよびPEGステアリン酸の生理食塩水-PG溶液にPG溶液として添加された、特徴的な赤色蛍光を有する蛍光色素DiIを微量(1%未満)含むように調製されました。得られたマイクロバブルは、顕微鏡で緑色光励起フィルターと赤色発光フィルターを使用すると、シェル蛍光をはっきりと示します(図2左を参照)。マイクロバブル気相の明視野顕微鏡(図2右)は、マイクロバブルシェル蛍光と比較できます。水相から気泡殻への脂質物質移動の定量的評価のために、遠心分離を使用してマイクロバブルを浮遊させ、マイクロバブル融合前に透明なインフラナクト相の蛍光シグナルを初期溶液の蛍光と比較しました。ほぼ一桁のシグナル減少が観察され(図3)、すなわち、脂質材料の85%以上が融合によってマイクロバブルシェルに移行しました。
マイクロバブルの調製と粒度分布補正
アマルガメーションによって生成されたマイクロバブルは、高濃度(例えば、ビオチン化バブルの場合、1mLあたり~4.8 x 109 粒子)の典型的なサイズ分布を示しました。サイズ分布は広く、粒子は測定範囲(1〜30μm)に存在していました。~6.3%のマイクロバブルが直径5μmを超えます(図4、緑の曲線)。大きなマイクロバブルの血管内投与は、毛細血管に非特異的に蓄積する可能性があるため、避けるべきです。逆さバイアルを通常の重力で短時間(15〜17分)浮遊させ、その後、セプタム表面近くで0.3mLを回収すると、より大きなマイクロバブルを完全に除去でき、総粒子数濃度がわずかの損失で、~4.6 x 109まで減少します:浮遊選鉱後、精製されたサンプル中の粒子のわずか0.01%が5μmを超える直径を持っています(図4、 赤い曲線)。
受容体被覆表面へのマイクロバブルの接着:静的アッセイ
この手順は、前世紀に初めて記載され、標的マイクロバブルの機能を確認するクイックテストとして使用されています。マイクロバブルは、受容体を運ぶ皿の表面に接触することができます。リガンドと受容体の相互作用が起こると、激しい洗浄にもかかわらず、気泡が表面に保持される可能性があります。組換え αv β3 でコーティングされた表面への c(RGDfK)-マイクロバブルの機能接着のこのような迅速なテストの例が提示されます。図5は、PBSで洗浄した後、ペトリ皿内の受容体表面に付着したマイクロバブルの代表的な明視野顕微鏡画像であり、結合していない気泡を除去します。このタイプの顕微鏡では、気泡は暗い円形のパターンとして現れます。同様に、表面をアルブミンでコーティングする(非特異的な接着をブロックするため)場合、マイクロバブルは付着せず、穏やかなすすぎでも簡単に洗い流されます。
流れる媒体からのマイクロバブルの結合:平行プレートフローチャンバー
この手順は、当初、制御されたフロー設定15 における細胞接着の研究のためのツールとして提案され、数十年後のマイクロバブルターゲティングの研究11に適応した。フロースルーシステムでの試験は、静的アッセイとは異なり、血液の流れ中の循環気泡が血管壁に短時間触れ、標的受容体が存在する場合は血管壁に付着する可能性のある臨床イメージングシナリオでは、はるかに現実的です。そのような研究の2つの例が提示されます。最初の例は、ペプチドで装飾されたマイクロバブルの受容体被覆表面への接着をビデオ顕微鏡で監視する、より伝統的なアプローチです。顕微鏡検査では、付着したマイクロバブルと流れるマイクロバブルを区別することができます。また、顕微鏡イメージングフレーム内の付着性マイクロバブルを定量化することも可能にします:スクランブルされたc(RADfK)ペプチドが使用されているコントロールと比較した場合、または表面がBSAのみでコーティングされている場合(図6)は、より多くのc(RGDfK)マイクロバブルが表面に付着します(図6)。
2番目の例は、ストレプトアビジンでコーティングされたペトリ皿(図7、右側)の造影超音波イメージングであり、ビオチン化マイクロバブルが流れる媒体からうまく吸着し、PBSとのフラッシュ後の造影超音波イメージングによって検出できます。コントロールディッシュの表面は、流れから付着したマイクロバブルを保持しないため、基本的にすべての超音波コントラスト信号はPBSフローで除去されます。超音波造影信号の定量化は、観察された差の強い統計的有意性を示しています。ターゲット信号と制御信号の比率は桁違いを超えていました。
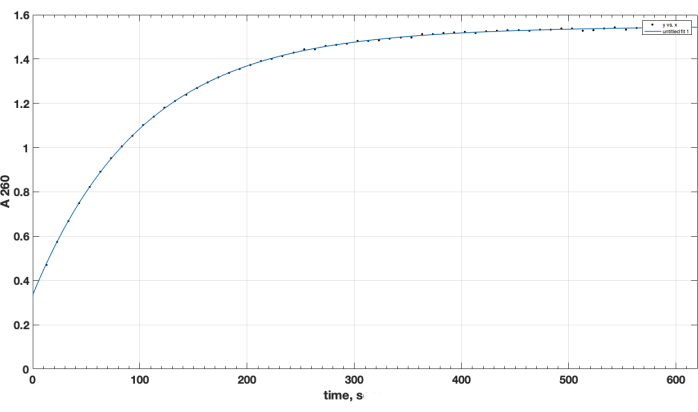
図 1.260 nm波長の分光光度試験によるアルカリ性媒体中のNHS放出により観察されたNHS-PEG-DSPE活性エステルの加水分解の動力学。 ゼロ時点は、有機溶媒中のNHS-PEG-DSPEを0.1 Mホウ酸緩衝液(pH 9.2)に添加した時間です。 この図の拡大版を表示するには、ここをクリックしてください。

図 2.融合後のガス充填マイクロバブルの顕微鏡検査。 左、蛍光顕微鏡(緑色励起、赤色発光、DiI脂質シェル色素)。右、明視野顕微鏡(気相観察)、同倍率。フレーム幅、85 um(各画像の右下に埋め込まれた10 μmステージマイクロメーター)。 この図の拡大版を表示するには、ここをクリックしてください。
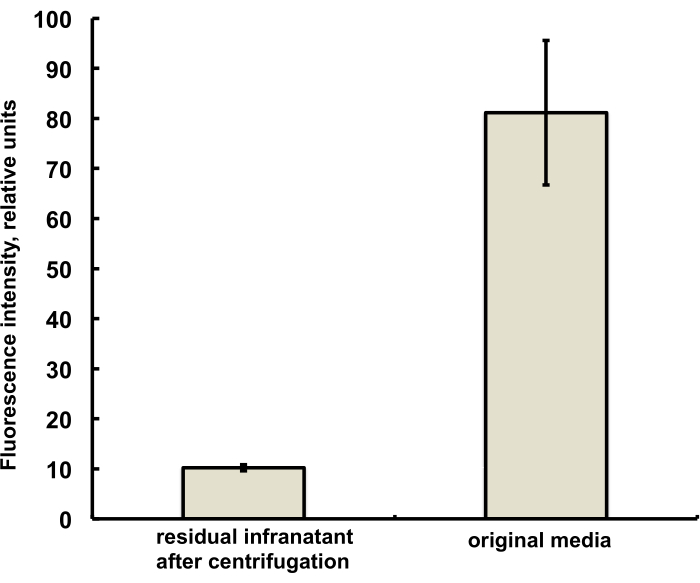
図 3.融合前のマイクロバブル調製媒体からのDiI脂質色素サンプルの蛍光分光法(右)と、遠心浮選によるマイクロバブルの融合と除去後の(左)。 蛍光励起 - 555nm、発光 - 620nm。データは平均±標準偏差として表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
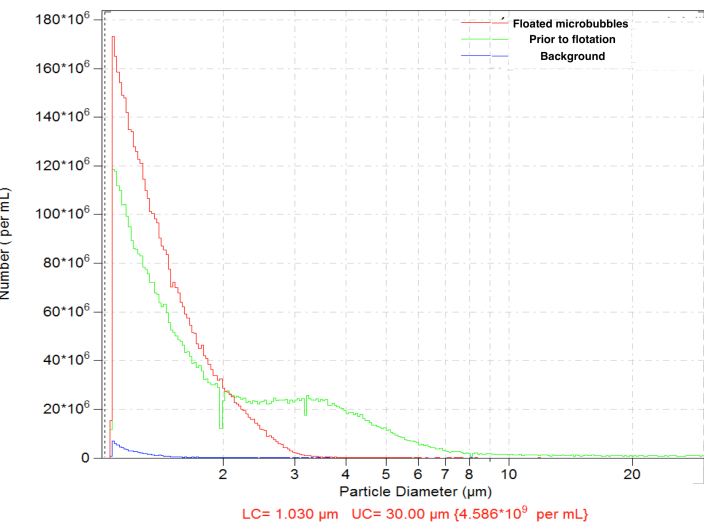
図 4.アマルガメーション調製後のマイクロバブルの数濃度の粒度分布(緑)、その後の大きなマイクロバブルの除去のための通常の重力浮遊(赤)、希釈剤のみのバックグラウンドカウント(青)。 通常の生理食塩水、50 μmオリフィスでのエレクトロゾーンセンシング粒子計数。 この図の拡大版を表示するには、ここをクリックしてください。

図 5.αvβ3で コーティングされた皿上のc(RGDfK)-マイクロバブルの明視野顕微鏡。画像フレーム幅は106 μm、 バーは10 μmです。 この図の拡大版を表示するには、ここをクリックしてください。

図 6. 組換え αvβ3. cRGDfK でコーティングされたマイクロバブルがディッシュに効率的に付着し(左)、コントロールの非標的 cRADfK マイクロバブル (スクランブル、中央) マイクロバブルの付着は最小限 (p<0.00005)、アルブミンのみのコントロール表面でのマイクロバブルの保持 (右、p<0.0025) も最小限に抑えられました。1 dyn/cm2 でのチャンバー フロー ウォールせん断応力。ビデオ顕微鏡によるマイクロバブル接着のモニタリング。視野内の粒子の数が表示されます。蓄積時間は4分です。データは平均±標準偏差として表示されます。5の許可を得て転載。著作権、2018年、アメリカ化学会。この図の拡大版を表示するには、ここをクリックしてください。
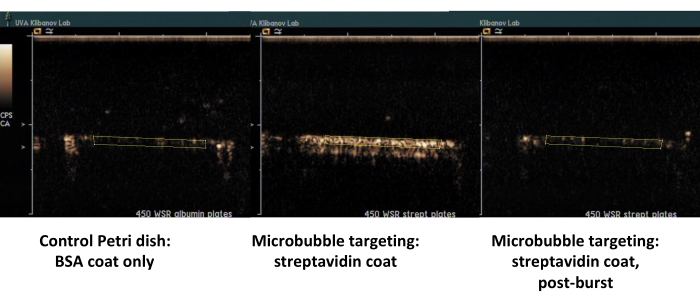
図 7.ストレプトアビジンでコーティングされたディッシュ上のビオチン化マイクロバブルの標的接着およびバッファーフラッシュ後のパラレルプレートフローチャンバーのコントラスト超音波イメージング(中央、接着標的マイクロバブル、右、同じディッシュ、高MI超音波バースト後)、およびアルブミンのみでコーティングされたコントロールディッシュ(左)。450 s-1 せん断速度でマイクロバブル分散液(PBS/BSA、106 粒子/mL)を 2 分間灌流し、続いてバッファーフラッシュを行います。超音波信号の定量化は、バックグラウンド減算後のビデオフレーム内の関心領域から実行されます。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
配位子で装飾されたマイクロバブルを調製するための簡単な技術の重要性は明らかです。Ungerらによって開拓されたように、マイクロバブル調製のためのアマルガメーション技術の使用16 は、いくつかの理由でこの目的に役立つ可能性があります。アマルガメーターによるマイクロバブルの製造は簡単に行うことができます。フットプリントの小さいデスクトップ単相120Vユニットが利用可能で安価です。この手順は迅速(45秒)かつ効率的で、水性媒体中の1 mLのマイクロバブル分散液を一度に調製します。1mLあたり数十億個の粒子が含まれており、調査研究には十分すぎるほどです。製造は、パーフルオロガスヘッドスペースを備えた密封されたバイアルで行われます。必要に応じて、バイアルの内容物は、無菌充填時から製造時(合併)、および使用まで無菌状態のままになります。これにより、このアプローチは臨床での使用に関連性があり、クリニックの専用の無菌環境での精巧な準備は必要ありません。
この手順は自己組織化に基づいています:混合中に、移動するバイアル内のガスと水の界面に高いせん断が加えられると、表面張力の作用により球形をとる小さなガス片が形成されます。PGは、共界面活性剤として、高濃度で媒体中に存在するため、せん断中にガスと水の界面を生成するために必要な表面張力とエネルギーを減少させます。次に、PEG脂質やリン脂質など、はるかに低い濃度で存在するより「古典的な」界面活性剤が界面に到達し、おそらくPGを置換して、気泡表面に単分子層を確立します。このシェルは適度に安定しています。これは、「固体」脂質(DSPCの相転移温度が56°Cであるため、膜間融合を起こしにくい)と、マイクロバブルを囲み、隣接する気泡の直接の単層接触を阻害する拡張PEGブラシコートの組み合わせによるものと考えられます。媒体中に高濃度のPGが存在すると、マイクロバブルシェルの安定性が低下する可能性があると推測できます。マイクロバブルがない場合、マイクロバブルはフルオロカーボン雰囲気下で密封されたバイアル内で何ヶ月も安定しており、気泡間の融合は中程度です。臨床使用では、ベッドサイドに小型のアマルガメーターデバイスを設置することで、マイクロバブルの調製から使用までの間隔を短く、数分または数時間にすることができます。PGが培地中に存在すると、マイクロバブル濃度は、少なくとも数時間の冷蔵保存では有意な低下を示さない。
記載された手順の追加の利点(気泡調製媒体中のPGコサーファクタントの使用によって支援される)は、シェルへの脂質移動の高い有効性(>85%)であるのに対し、従来の超音波処理は~20%の有効性5 を提供し、現代のマイクロ流体法はさらに低い17を提供する。脂質材料や高価な配位子の無駄が削減されるだけでなく、培地中に共存する気泡のない配位子の量も最小限に抑えられるため、高い転写効率が重要です。そうなると、遊離リガンドは、マイクロバブルが表面上のリガンドを介して結合すると予想されるバイオマーカー標的受容体をブロックする機会がない可能性があります。標的血管系上のバイオマーカー受容体の一般的な量はしばしば非常に多いため、これは最も重要ではないかもしれません。入手可能な特許文献18 から、臨床試験におけるマイクロバブル製剤中の脂質シェル材料およびターゲティングリガンドの少なくとも50%がバブルシェルに関連している可能性があることを示唆するかもしれない。これは一般的に、核医学受容体イメージング研究で広く使用されている放射性標識抗体またはペプチドと比較することができる:リガンド分子を標的とするもののほとんどは、報告された最も高い比活性に対してさえ実際には「高温」の放射性同位元素を保有していない19のに対し、標的マイクロバブルについては、この研究のシェル材料(リガンド-脂質を含む)は主にマイクロバブルに結合している。
この手法でin vitroで調製した標的マイクロバブルの選択的接着を、静的接着とフローチャンバーターゲティング実験の2組のターゲティングモデルで実証しました。静的アッセイでは、標的マイクロバブルは標的受容体層にしっかりと付着し、バッファーリンスでは取り除かれませんでした。これは、穏やかなすすぎでもマイクロバブルが表面から除去される対照環境とは異なりでした。同様に、平行プレートフローチャンバーで実施されたフロースルー試験では、ビオチン化気泡は、対照のアルブミンのみの表面と比較した場合、ポリスチレン皿上のストレプトアビジン層に統計的に有意で優れた接着性を示しました。ペプチドc(RGDfK)で装飾されたマイクロバブルは、静的接着アッセイと平行プレートフローチャンバーの両方で、αvβ3コーティング表面に選択的に接着しました。
以下の問題は、説明されているプロトコルの制限として考えられます。まず、この手順ではサブミクロン粒子が考慮されていません。この研究で使用された機器は、ナノバブル(つまり、直径1μm未満の粒子)を検出するようには設定されていませんでした。これらの粒子は、配合中に存在していた可能性があります。それらの音響後方散乱信号は一般に低いことが知られており、この研究では顕微鏡法では観察されませんでしたが、それでもナノバブルの存在を考慮する必要があります。2つ目の大きな問題は、マイクロバブルのサイズの不均一性です。より大きな粒子が除去されたにもかかわらず、結果として生じる気泡のサイズは均一とはほど遠いです。これは、マイクロバブル製剤の分野におけるさらなる研究のための考慮と正当化であるべきです。
結論として、この原稿で述べられている物語は、標的とするマイクロバブルを迅速かつ容易に製造するのに十分なレベルの技術的詳細を提供するべきである。追加の精製(望ましい場合)、サイズの調整、および/または水性媒体に残存する少量のシェル材料の評価を行うステップが提供される。サイズ分布や濃度、およびリガンドで装飾されたマイクロバブルが標的受容体に付着するin vitro能力などのマイクロバブルパラメータを評価するための詳細な分析ツールについて説明します。
開示事項
A. Klivanovは、前臨床標的マイクロバブル分野のスタートアップであるTargeson Inc.の共同創設者であり、少数株主です。彼のUVA研究所は、SoundPipe TherapeuticsからNIH R44 HL139241を介して下請け契約を結んでいます。
謝辞
A.L. Klibanovは、NIH R01EB023055、国立衛生研究所の国立生物医学イメージングおよびバイオエンジニアリング研究所から授与されたNIH、NIH R01NS076726を介したバージニア大学への下請け、国立衛生研究所の国立神経障害および脳卒中研究所からUCSFに授与された、およびNIH助成金によるバージニア大学への下請けを通じて、支援を部分的に認めていますR44HL139241。 SoundPipe TherapeuticsにNational Heart, Lung, and Blood Instituteから授与されました。この出版物の内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
参考文献
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。
