Method Article
הכנה ואפיון של מיקרו-בועות ממוקדות
In This Article
Summary
מטרת פרוטוקול זה היא להכין, לטהר ולאפיין מיקרו-בועות מלאות בגז (חומרי ניגוד ממוקדים להדמיה מולקולרית אולטרסאונד). מתוארות שתי מערכות מיקוד: בועות ביוטיניליות הדבקות בסטרפטווידין, ומיקרו-בועות פפטיד RGD מחזוריות הנקשרות ל-αvβ3, סמן ביולוגי ידוע של גידול.
Abstract
מיקוד של מיקרו-בועות (חומרי ניגוד אולטרסאונד להדמיה מולקולרית) נחקר כבר יותר משני עשורים. עם זאת, שיטות הכנת מיקרו-בועות ומיקוד הצמדת ליגנד הן מסורבלות, מסובכות וארוכות. לכן, יש צורך לפשט את הליך הכנת המיקרו-בועות הממוקד כדי לקרב אותו לתרגום קליני. מטרת פרסום זה היא לספק תיאור מפורט והסבר של השלבים הדרושים להכנת מיקרו-בועות ממוקדות, אפיון פונקציונלי ובדיקה. רצף של ההליכים המותאמים והפשוטים מוצג עבור שתי מערכות: מודל זוג מכוון ביוטין-סטרפטווידין, ופפטיד RGD מחזורי המכוון לחלבון הרקומביננטיα vβ3 , המתבטא יתר על המידה ברירית האנדותל של הניאו-וסקולטורה של הגידול.
כאן, אנו מראים את הדברים הבאים: צימוד קוולנטי של ליגנד המטרה לעוגן שומנים, הערכת איכות המגיב ובדיקות המאשרות את ההשלמה המוצלחת של התגובה; הכנת המדיום המבשר המימי המכיל רכיבי מעטפת מיקרו-בועות, ואחריו הכנת מיקרו-בועות באמצעות מיזוג; הערכת יעילות העברת השומנים על מעטפת מייצב המיקרו-בועות; התאמת התפלגות גודל המיקרו-בועות על ידי ציפה בכוח משיכה רגיל כדי להסיר מיקרו-בועות גדולות יותר שעלולות להזיק לשימוש in vivo; הערכת התפלגות גודל המיקרו-בועות על ידי חישת אלקטרו-זון; הערכת קשירה ממוקדת של המיקרו-בועות למשטח מצופה קולטן בבדיקת מבחן קשירה סטטית (בצלחת הפוכה); והערכת קשירה ממוקדת של המיקרו-בועות למשטח מצופה קולטן בבדיקת תא זרימת צלחת מקבילה.
Introduction
הדמיה מולקולרית עם מיקרו-בועות ממוקדות נמצאת במחקר ובדיקה כבר יותר משני עשורים. הרעיון הכללי פשוט: מיקרו-בועות מלאות בגז בעלות זיקה סלקטיבית לסמן הביולוגי המולקולרי הספציפי לאנדותל כלי הדם באזור המחלה מוזרקות תוך ורידי. חלקיקים אלה מסתובבים ומצטברים במטרה (למשל, ניאו-וסקולטורה של גידול או אזור של פגיעה דלקתית איסכמית). לאחר מכן מתגלות מיקרו-בועות דבקות על ידי הדמיית אולטרסאונד ניגודית. מאמצי מחקר קונספט מוקדמים מהמאה שעברה 1,2 מתקדמים כעת בהדרגה לקראת אימוץ קליני: הם הגיעו לשלב ניסויים קליניים בקנה מידה בינוני רק לפני מספר שנים 3,4. מטרת כתב היד הזה היא לספק את ההסבר המפורט על ההכנה והאפיון של מיקרו-בועות ממוקדות כאלה, בהתבסס על שתי דוגמאות שפורסמו 1,5.
הליך הכנת פפטיד-PEG-פוספוליפיד, מרכיב מכריע לניסוח מיקרו-בועות ממוקדות אלה, מתווסף לתיאור בקרת איכות המגיבים, כנדרש להשלמה מוצלחת של התגובה. למרבה הצער, חלק מספקי ריאגנטים פעילים של שומני אסטר מספקים חומר שעובר הידרוליזה עם הגעתו ולכן אינו מסוגל להשתתף ביצירת קשר אמיד. המידע על כמה מחומר השומנים מועבר למעטפת המיקרו-בועות מהמדיום המימי במהלך הכנת המיקרו-בועות מסופק, כמו גם הטכניקה להשגת מידע זה.
חשוב להכין מיקרו-בועות עם התפלגות גודל חלקיקים צרה יחסית: נוכחות משותפת של מיקרו-בועות גדולות במדיה הניתנת להזרקה לבדיקה תוך-וסקולרית in vivo עלולה להוביל לסתימת מיקרו-כלי דם; הצטברות לא ספציפית של מיקרו-בועות העוקפות את שאנט הריאות עלולה לגרום לשיפור רקמה חיובי כוזב לא ספציפי6, אשר נמנע על ידי הסרת מיקרו-בועות בגדלים גדולים יותר. לכן, מוצג הליך פשוט להשגת בחירת גודל החלקיקים, בתוספת תיאור של שיטה להערכת ריכוז החלקיקים והתפלגות הגודל עם מונה חלקיקים.
פרוטוקול הבדיקה הראשון להערכת מיקוד מיקרו-בועות, כפי שמוצג להלן, מתאר מערכת מודל טהורה, עם מיקרו-בועות ביוטיניליות הממוקדות למשטח1 מצופה סטרפטווידין. הפרוטוקול השני מבוסס על כתב יד המתאר הכנה פשוטה של מיקרו-בועות ממוקדות פפטיד, מעוטרות בפפטיד RGD מחזורי בעל זיקה ספציפית ל-αvβ3, סמן ביולוגי מולקולרי של ניאו-וסקולטורה של גידול5. מיקרו-בועות מעוטרות בציקלאו זה [Arg-Gly-Asp-D-Phe-Lys], כלומר, פפטיד c(RGDfK) על ידי הטכניקה המוצגת הוכחו כמכוונות לניאו-וסקולטורה של הגידול ומשיגות הדמיה מולקולרית אולטרסאונד במודל גידול עכברים.
Protocol
1. צימוד קוולנטי של הפפטיד ל-NHS-PEG-DSPE
- ממיסים את פפטיד c(RGDfK) עם קבוצת ε-אמינו-גרופ ראשונית של ליזין לא מוגן וזמין לצימוד, בדימתיל סולפוקסיד (DMSO, 10 מ"ג/מ"ל). הכינו תמיסת מתנול או כלורופורם של אסטר N-hydroxysuccinimide של פולי(אתילן גליקול)-3400-דיסטארויל פוספטידיל-אתנולמין (NHS-PEG-DSPE, 200 מ"ג/מ"ל), והוסיפו ל-1 מ"ג פפטיד ב-DMSO. הוסף 3 מיקרוליטר של N,N-diisopropyl ethylamine (DIPEA).
- שמור על יחס טוחנת של פפטיד ל-NHS-PEG-DSPE לפחות 1:1.2, כך שכל קבוצות האמינו העיקריות יוכלו להגיב. שמור על יחס מולארי של DIPEA:פפטיד לפחות 2:1 כדי להבטיח תנאי מדיה בסיסיים.
זהירות: כלורופורם, מתנול ו-DIPEA הם חומרים מסוכנים. השתמש בהגנה מתאימה, כגון כפפות, מעיל מעבדה, משקפי מגן ומכסה אדים.
הערה: ניתן להשתמש בכל פפטיד או חיקוי אחר עם קבוצת אמינו ראשונית במקום c(RGDfK), עם מסוף N לא מוגן או ליזין הממוקם מחוץ לאתר הקשירה. כדי שהתגובה תמשיך, כל המרכיבים (כלומר, ליגנד ושומנים) חייבים להיות מסיסים בתערובת DMSO-כלורופורם. ניתן לבדוק גם ממיסים חלופיים, כגון דימתילפורממיד, או תערובותיו. תגובה במדיה מימית אפשרית גם כן, אך תפוקת הצימוד תהיה נמוכה בהרבה עקב הידרוליזה מהירה של אסטר פעיל.
- שמור על יחס טוחנת של פפטיד ל-NHS-PEG-DSPE לפחות 1:1.2, כך שכל קבוצות האמינו העיקריות יוכלו להגיב. שמור על יחס מולארי של DIPEA:פפטיד לפחות 2:1 כדי להבטיח תנאי מדיה בסיסיים.
- לאחר דגירה של לילה בטמפרטורת החדר, הסר את החומר האורגני הנדיף על ידי אידוי (השתמש בזרם של גז חנקן או מאייד סיבובי, ולאחר מכן אידוי לילה תחת משאבת ואקום גבוהה, כדי להסיר DMSO). ממיסים מחדש את השאריות הלא נדיפות בכלורופורם ב-1 מ"ג/מ"ל לדגימה מבוקרת.
- אשר את השלמת התגובה על ידי כרומטוגרפיה של שכבה דקה (פתח לוחות TLC בכלורופורם: מדיה ממס מתנול, 2:1 v/v). אשר נוכחות או היעדר של קבוצת האמינו העיקרית עם תרסיס נינהידרין בעת חימום הצלחת על בלוק חימום של 150 מעלות צלזיוס.
זהירות: נינהידרין הוא חומר מסוכן. השתמש בהגנה מתאימה, כמתואר לעיל. טיפול בבלוק חימום של לוחות TLC חייב להתבצע במכסה אדים. גוש החימום מהווה סכנת שריפה פוטנציאלית. - לפני הכנת המיקרו-בועה, יש לקחת דגימה של פפטיד-PEG-DSPE מכלורופורם (למשל, 1 מ"ל של תמיסה של 1 מ"ג/מ"ל), לאדות כלורופורם ליובש בזרם של גז חנקן, עם דגירה של משאבת ואקום גבוהה לאחר מכן, ולהוסיף מי מלח ל-1 מ"ג/מ"ל, כדי להשיג תמיסה מיסלרית שקופה.
- אם רצוי טיהור נוסף של תערובת התגובה, יש להמיס מחדש במי מלח רגילים. לאחר מכן הכניסו את התערובת המיסלרית המתקבלת לדיאליזה (חתך משקל מולקולרי של 6-8 kDa, או דומה), תחילה כנגד מי מלח רגילים, ולאחר מכן כנגד מספר שינויים של מים נטולי יונים.
- אשר את השלמת הדיאליזה על ידי בדיקת מוליכות של דיאליזה. הסר חומר דיאליזה משקית הדיאליזה, הניח בבקבוקון עם מסה ידועה ועשה ליופיליזציה עד לייבוש מוחלט.
הערה: תגובה קוולנטית חלופית לחיבור הליגנד לקצה של PEG-lipid זמינה (למשל, תגובה של maleimide-PEG-DSPE עם תיול-ליגנד). היתרון העיקרי של גישה זו הוא צימוד מכוון, אם תיול בודד זמין על מולקולת הליגנד 7. הדאגה העיקרית היא יציבות לטווח ארוך: הקשר שנוצר בין מלימיד ותיול עשוי להיות נוטה להתפרק על ידי תגובת רטרו-מיכאל, בהתאם לתנאי האחסון 8.
הערה: איכות ריאגנטים אסטרים פעילים משתנה מאוד בין היצרנים: זה עשוי להיות תלוי בתנאי ההעברה והאחסון (אם החומר אינו מאוחסן או מועבר כראוי, האסטר הפעיל יעבור הידרוליזה ולא יוכל להתחבר לפפטיד). כתוצאה מכך, קיימת תחושת מחויבות לתאר הליך (ראה להלן) לקביעת מידת ההשפלה של NHS-PEG-DSPE, מגיב לחיבור קוולנטי של ליגנדים ממוקדים למיקרו-בועות. NHS-PEG-DSPE, המסופק כאבקה יבשה מתחת לארגון, מאוחסן בהקפאה עמוקה. בקבוקון מובא לטמפרטורת החדר (כדי למנוע עיבוי לחות), דגימה נשקלת, באמצעות איזון אנליטי, ומומסת במתנול או DMSO. יש לסגור בקבוקון עם ריאגנט יבש בתפזורת מתחת לארגון ולהחזירו להקפאה עמוקה, במיכל אטום עם חומר ייבוש, עד לשימוש נוסף. - הכן תמיסה מיסלרית מימית של פפטיד-PEG-DSPE (שלב 1.4), כמו גם ביוטין-PEG-DSPE, על ידי הוספה פשוטה של מגיב יבש למי מלח מימי, ודגירה. נוצרות מיצלות כדוריות קטנות. כדי להאיץ את העברת המגיב ממצב בתפזורת לצורה מיסלרית, ניתן ליישם סוניקציה ואמבט מים חמים.
- העריכו את איכות המגיב של אסטר פעיל NHS-PEG-DSPE.
- אשר כי NHS הקיים במגיב הוא בצורה של אסטר פעיל, כדי להיות מסוגל לבצע את תגובת הצימוד עם היווצרות קשר אמיד.
- הנח 0.99 מ"ל של מאגר נתרן טטרבוראט 0.1 M, pH 9.2, בקובט פלסטיק קוורץ או שקוף אולטרה סגול (לא זכוכית) בספקטרופוטומטר, ואפס באורך גל של 260 ננומטר.
- הוסף לקובט 10 מיקרוליטר מהתמיסה הטרייה של 200 מ"ג/מ"ל של NHS-PEG-DSPE במתנול. במקביל, הפעל את שעון העצר. ערבב במהירות ובמרץ את תוכן הקובט כדי להשיג אחידות. מניחים את הקובט בפוטומטר, סוגרים את המכסה ומתחילים במדידה.
- בתחילת מדידת הספקטרופוטומטר, סמנו את שעת תחילת ההקלטה, ובצעו ברציפות מדידות ספיגה פוטומטריות ב-260 ננומטר כל 10 שניות למשך ~10 דקות, או עד לייצוב ערך הספיגה.
- שרטט את העקומה הקינטית, בדוק את נקודות הזמן הראשוניות של A260 , ואקסטרפולציה של העקומה לזמן התחלת התגובה (כלומר, גלה A260 בנקודה שבה נוסף מגיב למאגר מימי ותגובת הידרוליזה החלה). נניח שלפני הוספת NHS-PEG-DSPE למאגר בקובט לא התרחשה הידרוליזה בממס אורגני עקב מחסור במים.
- חשב את היחס בין A260 בתחילת התגובה לסיום ההידרוליזה; הוא מייצג את החלק של האסטר הפעיל המתכלה. השתמש במידע זה כדי לבחור את הכמות המתאימה של NHS-PEG-DSPE לשינוי מלא של קבוצת האמינו העיקרית של הפפטיד.
2. הכנת מיקרו-בועות על ידי מיזוג
- הכנת מיקרו-בועות ביוטיניליות
- ממיסים במשותף דיסטארויל פוספטידילכולין (DSPC) ו-PEG סטארט בפרופילן גליקול (PG, ריכוז של 10 מ"ג/מ"ל לכל אחד בממס מסודר). השתמש באמבט מים חמים כדי להמיס את החומרים.
- הוסף 0.1 מ"ל מתמיסת PG חמה זו לבקבוקון המכיל 0.85 מ"ל של מי מלח רגילים חמים, ערבב במהירות והוסף ביוטין מיסלרי-PEG-DSPE (50 מיקרוליטר, 1 מ"ג/מ"ל במי מלח) ביחס מסה של 1:20 ל-DSPC.
הערה: המסיסות של רכיבי השומנים ב-PG תלויה בטמפרטורה, ולכן יש צורך באמבט מים חמים. כדאי לחמם את בקבוקון הזכוכית המכיל מי מלח באמבט מים חמים לפני הוספת שומנים, כדי ליצור מדיום אחיד ללא חלקיקים נראים לעין. - הביאו את הבקבוקון לטמפרטורת החדר, הניחו פקק גומי על הבקבוקון, מוכנס לאמצע הדרך, והכניסו צינורות נימי PTFE לבקבוקון. השתמש בזרימת גז דקפלואורובוטן כדי למלא את הבקבוקון, ולאחר מכן סגור את הפקק, תוך הסרת הנימים.
הערה: לטמפרטורת הבקבוקון במהלך המיזוג עשויה להיות השפעה משמעותית על התפלגות הגודל של המיקרו-בועות המתקבלות 9. - לחץ את הבקבוקון הסגור, בטמפרטורת החדר, והניח במנגנון מיזוג. הפעל את הממזג. היחידה הקלינית המשמשת מוגדרת מראש לפעול ב-4300 סל"ד למשך 45 שניות.
- לאחר השלמת המיזוג, הסר את הבקבוקון עם המיקרו-בועות שנוצרו מהמיזוג. רצוי לאפיין את התפלגות גודל המיקרו-בועה והרכבה ולהשתמש בהם תוך מספר שעות מההכנה.
- הכנת מיקרו-בועות מעוטרות בפפטיד
- ממיסים במשותף DSPC ו-PEG סטארט ב-PG מסודר (ריכוז 10 מ"ג/מ"ל לכל חומר). יש להשתמש באמבט מים חמים כדי להסיס. הוסף 0.1 מ"ל של תמיסה חמה זו ב-PG לבקבוקון המכיל 0.85 מ"ל של מי מלח רגילים חמים, ערבב במהירות והוסף פפטיד מיסלרי-PEG-DSPE (50 מיקרוליטר, 1 מ"ג/מ"ל במי מלח) שנוסף ביחס מסה של 1:20 ל-DSPC.
- הביאו את הבקבוקון לטמפרטורת החדר, הניחו פקק גומי על גבי הבקבוקון, מוכנס באמצע הדרך, והכניסו לבקבוקון צינורות נימיים פוליטטרפלואורואתילן (PTFE). השתמש בזרימת גז דקפלואורובוטן כדי למלא את הבקבוקון, ולאחר מכן סגור את הפקק, תוך הסרת הנימים.
- כווצים את הבקבוקון הפקוק ומניחים במיזוג לערבוב. הבקבוקון עם פיזור מיקרו-בועות מוכן תוך 45 שניות.
- הכנת מיקרו-בועות שומן צבע להערכת העברת שומנים למעטפת מיקרו-בועות
- ממיסים במשותף DSPC ו-PEG סטארט ב-PG מסודר, כמתואר לעיל (השתמש באמבט מים חמים) (ריכוז 10 מ"ג/מ"ל לכל חומר).
- הוסף 0.1 מ"ל מתמיסת PG חמה זו לבקבוקון עם 0.89 מ"ל של מי מלח רגילים חמים, ערבב במהירות, הוסף 10 מיקרוליטר של תמיסת צבע DiI (1 מ"ג/מ"ל ב-PG מסודר) וערבב. הביאו את הבקבוקון לטמפרטורת החדר.
- מלאו את חלל הבקבוקון בגז דקפלואורובוטן כאמור לעיל, עצרו את הבקבוקון, לחצו והתמזגו כמתואר לעיל.
3. בדוק העברת שומנים DiI מהמדיום המימי המיסלרי למעטפת הבועה
- לאישור המיקרוסקופיה שחומר שומני פלואורסצנטי עבר מהמדיום המימי למעטפת המיקרו-בועות, דגמו כמות של מיקרו-בועות מהבקבוקון דרך המחיצה בעזרת מזרק אינסולין.
- לאחר מכן הוסף טיפה למגלשת זכוכית וכסה אותה בכיסוי רגיל. ראשית יש לדלל אותו עם טיפת מי מלח נטולי גז.
- בצע מיקרוסקופיה עם מיקרוסקופ וידאו, מצויד בתאורת אפי פלואורסצנטית, אובייקט שמן פי 100 ומצלמת וידאו ברגישות גבוהה.
- כדי לקבוע את יעילות העברת חומר השומנים מחומר המלח/PG המימי למעטפת הבועה במהלך המיזוג, קח בקבוקון אטום של מיקרו-בועות, הפוך אותו והנח אותו בצינור חרוטי של 50 מ"ל.
- בצע צנטריפוגה ברוטור דלי (10 דקות, 200 x גרם). מוציאים את הבקבוקון מהצנטריפוגה ושומרים אותו הפוך.
- הכנס מחט של מזרק אינסולין למחיצת הבקבוקון ההפוך. שאפו נפח קטן (~50 מיקרוליטר) של אינפרנטנט צלול לאט.
הערה: קצה השיפוע של המחט לשאיבת אינפרנטנט מהבקבוקון ההפוך לאחר צנטריפוגה חייב להיות ממוקם קרוב ככל האפשר למחיצה, כדי למזער את הסיכוי לצריכת מיקרו-בועות.
- הנח את הדגימות של אינפרנטנט (2 מיקרוליטר), כמו גם את הדגימות של מדיום השומן-PG-מלח המקורי ששימש ליצירת מיקרו-בועות (2 מיקרוליטר) בצלחת של 96 בארות עם 0.1 מ"ל של מי מלח חוצץ פוספט (PBS): אתנול 1:1 בינוני עם 1% טריטון X-100.
- מדוד את הקרינה האדומה של צבע DiI (עירור של 555 ננומטר, פליטה של 620 ננומטר) עם קורא מיקרו-פלטות פלואורסצנטיות.
- השתמש בלוחות שחורים עם תחתית לא שקופה לספקטרוסקופיה פלואורסצנטית עקב רקע נמוך יותר והיעדר העברת אותות בין בארות שעלולה להפוך לבעיה עבור לוחות שקופים.
- ודא שאות הקרינה נמצא בטווח הכיול הליניארי: ריכוז צבע מוגזם בבארות עלול להוביל להנחתת אור ולאות לא מדווח.
הערה: לפעמים רצוי להסיר את חומר המעטפת שנותר בתווך המימי לאחר המיזוג. לשם כך, לאחר צנטריפוגה של ציפה של מיקרו-בועות, הוצא את כל נפח האינפראנטנט החוצה על ידי שאיפה איטית מהבקבוקון ההפוך, והחלף אותו במי מלח רגילים נטולי גז. כדי למנוע שינוי מוגזם של לחץ הסביבה בבקבוקון עקב הסרה או הוספת נוזל, הכנס מחט ארוכה נוספת למחיצה כדי להגיע לשלב הגז בתוך הבקבוקון. כדי לשמור על שלב הגז בתוך הבקבוקון, ראשית, חבר את המחט למזרק מלא בגז פלואורו-פחמן, כדי למנוע מגע אוויר עם תכשיר המיקרו-בועה.
4. התאמת התפלגות גודל מיקרו-בועות
- השתמש בציפה רגילה של כוח הכבידה בבקבוקון הפוך סטטי כדי להתאים את התפלגות הגודל של מיקרו-בועות, כלומר להסיר את המיקרו-בועות הגדולות ביותר במהירות וביעילות 5,10.
- קח בקבוקון של מיקרו-בועות מיד לאחר ההכנה כמתואר בסעיף 2. יש להפוך ולהניח הפוך על משטח יציב שאינו רוטט למשך 15-20 דקות.
- לאחר הדגירה הזו, הכניסו מחט מזרק אינסולין למחיצת הבקבוקון, כשהיא עדיין הפוכה, ואספו בעדינות 300-500 מיקרוליטר של מיקרו-בועות מהשכבה התחתונה.
הערה: מחט המזרק חייבת להישאר קרובה למשטח הפנימי של המחיצה כדי למנוע איסוף של בועות גדולות יותר הקיימות קרוב יותר לחלק העליון של הנוזל בבקבוקון.- משוך לאחור את בוכנת המזרק באיטיות, כדי למנוע מערבולת והתפשטות הידרוסטטית של הבועות בגוף המזרק. כאשר הדגימה שנאספה מוציאה מהמזרק, הימנע מלחץ יתר כדי למנוע קריסת בועות.
- העבירו את פיזור המיקרו-בועות מהמזרק לבקבוקון נפח קטן. לאחר מכן ממלאים בגז פרפלואור, פקק ולחיצה, לאחסון לטווח קצר, ספירת חלקיקים (ראה להלן) ושימוש נוסף.
- אם הדגימה מתבצעת ישירות מהמזרק, החזק אופקית וסובב כדי למנוע ציפה של בועות ולהשיג אחידות דגימה.
5. הערכת התפלגות גודל מיקרו-בועה
- השתמש במונה חלקיקים (המבוסס על חישת אלקטרוזון או עקרון ערפול אור) כדי להעריך את התפלגות וריכוז גודל החלקיקים. לחלופין, השתמש בהמוציטומטר ובמיקרוסקופ.
- בקצרה, הוסף דגימת מיקרו-בועה לתוך מי מלח רגילים או איזוטון בתא דלפק (בדרך כלל, נפח 60-100 מ"ל) וספרו. השווה את התפלגות גודל המיקרו-בועות לפני ואחרי טיהור הציפה.
הערה: הכניסו את הבקבוקון לערבוב עדין (לא מערבולת) מיד לפני הדגימה, כדי להשיג מדידות מייצגות וניתנות לשחזור. דגימה ממרכז הנפח שנבדק. - מלאו של 100 מ"ל לפחות ב-60 מ"ל של מדלל תמיסת מלח של 0.9%, והניחו אותה על הבמה של מכשיר שליחת האלקטרוזון. הרם את הבמה כך שהצינור, לוחית האלקטרודה החיצונית והמערבל, כולם שקועים לחלוטין בדילול, והמערבל יכול להסתובב.
הערה: ניתן לקבוע במדויק את נפח הדילול בכוס באמצעות המסה שלה, בקנה מידה (צפיפות המלח קרובה ל-1). לחלופין, ניתן להשתמש במשאבת מדידה. האלקטרודות במהלך מחקר חישת אלקטרוזון צריכות להיות שקועות במלואן. - רשום את נפח האלקטרוליט המדלל בתוכנת בקרת היחידה. מונה חישה אלקטרו-זון מצויד בפתח של 50 מיקרומטר, המאפשר מדידת חלקיקים בקוטר של 1 עד 30 מיקרומטר. בצע תחילה ריצת רקע; הוא צפוי לכלול פחות מ-5000 ספירות ב-0.5 מ"ל של מדלל כריק. רמות הרקע הטובות ביותר יכולות להיות מתחת ל-100 ספירות.
- הגדר את נפח הדגימה בתוכנת בקרת היחידה, כדי לקחת בחשבון את גורם הדילול. מוסיפים 10-20 מיקרוליטר מתערובת המיקרו-בועות לכוס, ומבצעים את הריצה השנייה.
- השתמש בנתוני התפלגות גודל הרקע כדי להסביר על ידי שימוש בפונקציה "הפחת ריצת רקע" בתוך התוכנה. השג את ריכוז החלקיקים בדגימת המיקרו-בועה המקורית כמספר חלקיקים/מ"ל; זה כולל את גורם הדילול.
- המשטח החיצוני של קצה הפיפט עשוי להיות מכוסה גם בבועות במהלך הדגימה; הקפד לנגב אותו לפני הכנסת הקצה למדיום הספירה. אל תיגע בפתח קצה הפיפט עם מגבון.
- הימנע מדילולים לא מספיקים של חלקיקי דגימה במהלך הספירה, כדי למזער את הבעיות בתיקון צירופי מקרים, כאשר יותר מחלקיק אחד בכל פעם נמצא בתוך פתח החיישן: המערכת עלולה להמעיט בהערכת ריכוז החלקיקים.
הערה: קוטר הפתח לספירת חלקיקים עשוי להשתנות. בחירת הפתח של 50 מיקרומטר מאפשרת גילוי של מיקרו-בועות בקוטר של עד 1 מיקרומטר, אך הוא אינו נוטה להיסתם כמו אפשרויות קוטר קטנות יותר. - כייל את מונה חישת האלקטרו-אזור עבור אותה מדיית בדיקה מדללת (למשל, תמיסת השקיה רגילה עם מי מלח מסוננים סטריליים) כפי שנעשה בבדיקות בפועל. לחלופת ערפול לייזר לחישת אלקטרו-אזור יש את היתרון בכך שאינה זקוקה למי מלח מסוננים עם ריכוז מלח מבוקר ומוליכות חשמלית.
- בקצרה, הוסף דגימת מיקרו-בועה לתוך מי מלח רגילים או איזוטון בתא דלפק (בדרך כלל, נפח 60-100 מ"ל) וספרו. השווה את התפלגות גודל המיקרו-בועות לפני ואחרי טיהור הציפה.
6. בדוק מיקוד מיקרו-בועות במבחנה במבחן הידבקות/שימור
- הכן את משטח קולטן הסמן הביולוגי למיקוד מיקרו-בועות לצלחות פטרי.
- קח כלי פוליסטירן בקוטר 35 מ"מ שישמשו כמשטח המטרה. נצל את ההידבקות הלא ספציפית של חלבונים למשטח צלחת הפוליסטירן ממלח רגיל. השתמש בחלבון מודל, סטרפטווידין, לבדיקת מיקוד של בועות ביוטיניליות המכילות ביוטין-PEG-DSPE כחלק מהקליפה.
- הניחו טיפה של תמיסת סטרפטווידין (0.2 מ"ל, 10 מיקרוגרם/מ"ל ב-PBS) במרכז כל צלחת פטרי וכסו אותה בכיסוי פלסטיק בגודל 22 מ"מ על 22 מ"מ כדי לאפשר ציפוי אחיד של משטח הכלי. לאחר דגירה של לילה ב-4 מעלות צלזיוס בסביבה לחה סגורה כדי למנוע את התייבשות התבשיל, הסר את החלקות הכיסוי.
- שטפו מיד וממצה את הצלחות במים, PBS, וחסמו אותן על ידי דגירה עם 1.5% אלבומין בסרום בקר (BSA) ב-PBS למשך 4 שעות לפחות כדי למזער הידבקות לא ספציפית של מיקרו-בועות למשטח לא מצופה. השתמש בכלי התרבות הנקייה חסומים עם 1.5% BSA כבקרות.
- לחלופין, השתמש בתמיסת קולטן רקומביננטיתα Vβ3 (למשל, ב-4 מיקרוגרם/מ"ל ב-PBS)5 במקום סטרפטווידין. כוון מיקרו-בועות לסמן ביולוגי זה באמצעות ליגנד פפטיד RGD מחזורי המחובר למעטפת המיקרו-בועות.
- שמור על המנה עם קולטן מטרה מופקד רטובה: חלבון הקולטן עלול להיות מושבת אם הוא מתייבש.
הערה: חשוב להשתמש בחלבוני קולטן נטולי נשא שאינם מכילים חלבוני נשא או פעילי שטח במדיום - נוכחותם תשבית את ההדבקה.
- הידבקות של מיקרו-בועות בטיפה קטנה: בדוק במהירות הידבקות ממוקדת בתנאים סטטיים.
- הפקידו טיפה של מיקרו-בועות (5-20 מיקרוליטר) מלמטה על משטח המטרה (או שליטה ב-BSA בלבד) בצלחת פטרי הפוכה. זה יביא את הבועות למשטח המצופה בקולטן על ידי ציפה.
- לאחר דגירה של 5-10 דקות של המנה ההפוכה בסביבה לחה, הפוך את המנה בחזרה למצב רגיל, מלא אותה ב-PBS ושטוף בעדינות כדי להסיר מיקרו-בועות חופשיות. בצע מיקרוסקופ שדה בהיר כדי להעריך הידבקות ממוקדת.
- הידבקות של מיקרו-בועות על פני צלחת פטרי: בצע מיקוד בצלחת מלאה1.
- קח את הצלחת, שיש לה ציפוי משטח קולטן, ומלא אותה לחלוטין במאגר PBS-BSA נטול גז (מעל 10 מ"ל לצלחת 35 מ"מ), כך שהמניסקוס של המאגר משתרע על החלק העליון של הצלחת ומוחזק על ידי כוח נימי. הזרקו את הבועות (50 מיקרוליטר) לחלק הארי של המאגר וערבבו במהירות כדי להשיג הומוגניות. הימנע מהיווצרות בועות אוויר במהלך הערבוב.
- הניחו במהירות קטע של סרט אריזה שקוף או סרט איטום של צלחת תרבות, מגובה בחתיכת פלסטיק שטוחה מעל הצלחת. אטום בלחץ את הסרט למנה, הפוך את ה"מכלול" והנח אותו הפוך למשך 30 דקות כדי לאפשר למיקרו-בועות לצוף כלפי מעלה, לגעת במשטח המטרה ולהיצמד.
- הפוך את "מכלול" הכלים האטומים בחזרה לתצורת "כלפי מטה", הסר את החותם ושטוף את המיקרו-בועות שאינן נדבקות על ידי שטיפה בתמיסת חיץ נטולת גז. התבונן במיקרו-בועות ממוקדות על ידי מיקרוסקופיה או על ידי הדמיית אולטרסאונד.
הערה: כאשר מודגרת התבנית האטומה ההפוכה המלאה לחלוטין בפיזור המיקרו-בועות, ניתן להניח אותה בזווית קלה, כך שאם קיימות בועות גדולות, הן יצופו לקצה המנה, מחוץ לאזור המרכז המעניין. ניתן להשתמש בשטיפה מאולצת עם זרימה מהירה המגיעה מקצה מיקרופיפטה במהלך מיקרוסקופיה כדי להעריך עד כמה הבועות נצמדות למטרה (בועות מתנתקות לחלוטין ממשטח הבקרה גם בזרימה איטית) 11. חיץ נטול גז עדיף לדילול בועות, מכיוון שעודף אוויר מומס יוביל לצמיחה בלתי מבוקרת של מיקרו-בועות.
7. בדוק מיקוד מיקרו-בועות במבחנה: הערך מבחני הידבקות/שימור דינמיים בתא זרימת צלחת מקביל
הערה: אנו בודקים את ההידבקות של בועות ביוטינילציה לשכבת סטרפטווידין באמצעות הדמיית אולטרסאונד.
- השתמש בתא זרימת צלחת מקביל זמין מסחרית עם מחזיק מהפך שנבנה בהתאמה אישית כדי לצפות בהדבקה ממוקדת לצלחת פטרי 35 מ"מ ממדיום זורם. לאחר ספיחה של חלבון המטרה למנה (ראה 6.1.1), הכנס את גוף החדר עם אטם מותקן מראש בכלי ואטום אותו במחזיק. השתמש באטמים עם גובה תעלה (כלומר, עובי אטם) 0.127 מ"מ ורוחב תעלה 2.5 מ"מ.
הערה: במהלך הרכבת תא זרימת צלחת מקביל, כמות שומן הסיליקון המשמשת על האטם צריכה להיות מינימלית. אל תאפשר לשומן להיכנס לאזור התעלה: הימנע מכיסוי המשטח המצופה בחלבון הסמן הביולוגי בשומן. כדי להשיג אטימה נכונה, בחר בקפידה כלים בגודל 35 מ"מ (ראה טבלת חומרים למידע על החדר והמנה). - עבור מכלול תא הזרימה, אל תבריג את המכסה והמסגרת המחזיקים את שילוב תא זרימת הכלים חזק מדי, כדי למנוע דליפה.
- חבר את צינור הזרימה למשאבת מזרק המופעלת במצב נסיגה, ובצד המזין, חבר צינור פוליאתילן דק (PE50) לבקבוקון עם פיזור מיקרו-בועות מדולל, הנתון לערבוב מתמיד עם מוט ערבוב באמצעות מערבל מגנטי12. שלוט בפרמטר קצב גזירת הקיר (WSR) של החדר על ידי התאמת קצב הזרימה הנפחי של המשאבה בהתבסס על הנוסחה 6Q/bh2, כאשר Q הוא קצב הזרימה, 'b' הוא רוחב הערוץ ו-'h' הוא גובה הערוץ.
הערה: הסר את בועות האוויר מכל המערכת לפני הזלוף של המדיום המכיל מיקרו-בועות או PBS, שכן כל בועת אוויר העוברת בתעלה תעקור מיקרו-בועות דבקות ממשטח המטרה, ותבטל את תוקף הניסוי. יש לאטום כראוי את החיבור בין צינורות תא הזרימה למזרק. - הכן פיזור מיקרו-בועות על ידי הוספת נפח מחושב של בועות מרוכזות למאגר המיקרו-בועות (בקבוקון נצנוץ של 20 מ"ל) כדי להשיג ריכוז של 106 מיקרו-בועות/מ"ל, במאגר PBS עם 0.1% BSA. הנח את מאגר המזין על מערבל צלחת מגנטית. הכנס מוט ערבוב מגנטי בגודל 1 ס"מ על 2 ס"מ וערבב ב-~400 סל"ד כדי לשמור על הומוגניות במהלך המחקר.
- בצע הדמיית אולטרסאונד של תא הזרימה במיכל מים13.
- טבלו את מכלול תא הזרימה במים נטולי גז והחזיקו אותו במקומו באמצעות משקולת כדי למנוע תנועה במהלך הניסויים.
- הנח את בדיקת ההדמיה clamp ישירות מעל התעלה, והטה אותה בזווית של 15° לאחור, כמו גם בזווית של 5° בכיוון השעון כדי למזער השתקפות ספקולרית משטח הצלחת. מקם את תעלת תא הזרימה בתוך מישור ההדמיה.
- השתמש בתנאי ההדמיה הבאים: מתמר 15L8, מצב הדמיה ספציפי לניגודיות, טווח דינמי 50 dB, 7 מגה-הרץ, אינדקס מכני (MI) = 0.18, רווח CPS = 0. שמור על פיצוי רווח זמן אחיד בכל התמונה.
- הנח את פני המתמר כך שהוא נוגע במשטח המים, לא שקוע עמוק. לחלופין, השתמש בשרוול מגן גומי מלא בג'ל אולטרסאונד.
הערה: כדי להצדיק מיקום ניתן לשחזור של מערכת תא הזרימה להדמיה, יש להניח את הסמנים על אגן המים, או על מסך מערכת האולטרסאונד.
- משוך את פיזור המיקרו-בועות מהמאגר דרך החדר ולתוך המשאבה למשך 2 דקות.
- העבר את הזרימה ל-PBS, כדי להסיר בועות שאינן דבקות מהתעלה ולהעריך את הפיזור האחורי האקוסטי של הבועות הדבקות (הממוקדות) הנותרות. כדי לקבל תמונת רקע, הגדל את ה-MI ל-1.9 כדי להרוס את הבועות הדבקות בשדה הראייה של הדמיית האולטרסאונד.
הערה: יש להחליף את פיזור המיקרו-בועות לריצות חוזרות ונשנות: בדילול גבוה, מיקרו-בועות מתכלות בהדרגה עם הזמן.
- העבר את הזרימה ל-PBS, כדי להסיר בועות שאינן דבקות מהתעלה ולהעריך את הפיזור האחורי האקוסטי של הבועות הדבקות (הממוקדות) הנותרות. כדי לקבל תמונת רקע, הגדל את ה-MI ל-1.9 כדי להרוס את הבועות הדבקות בשדה הראייה של הדמיית האולטרסאונד.
- ייצא תמונות בודדות מזרם הווידאו של הקלטת המסך: לפני שטיפת PBS, לאחר שטיפה ולאחר הרס, לייבוא ל-ImageJ לניתוח לא מקוון. בחר את אזור העניין (ROI) כדי לא לכלול את חלקי הכניסה והיציאה של החדר. לאחר הפחתת אות ה-ROI ברקע, כמת את עוצמת ההד כעוצמת הפיקסלים הממוצעת בתוך ה-ROI.
הערה: כחלופה להדמיית אולטרסאונד, ניתן לצפות בהדבקה של מיקרו-בועות למשטח המטרה על ידי מיקרוסקופ וידאו, כאשר מכלול תא זרימת הצלחת המקביל במחזיק ההפוך ממוקם על במה של מיקרוסקופ מורכב, עם הקלטת וידאו 5,11,12,14. זה שימושי במיוחד להדמיית הידבקות ממוקדת של מיקרו-בועות לקולטני סמנים ביולוגיים על פני התא בתרבית תאים, כאשר תאים המבטאים קולטנים גדלים על צלחת תרבית הרקמה, וניתן לספור ישירות את מספר המיקרו-בועות הקשורות לכל תא מטרה.
תוצאות
צימוד קוולנטי של פפטיד ושומנים
השלמת התגובה והיווצרות המוצר הרצויה אושרו על ידי TLC. בקרת פפטיד נפרדת שלא הגיבה לא עלתה במהלך TLC: היא נשמרה בהתחלה, והנקודה שלה הייתה חיובית לקבוצת האמינו הראשונית, כפי שנצפה לאחר ריסוס נינהידרין, בעת החימום. נקודת פפטיד חופשית חיובית לנינהידרין זו לא נצפתה עוד בתערובת לאחר השלמת התגובה, לאחר TLC של דגימת תערובת התגובה, לאחר הסרת DIPEA, DMSO ופירוק מחדש בכלורופורם. באשר לנושא המכריע של איכות ריאגנט אסטר NHS, איור 1 מציג מסלול ספקטרופוטומטרי של קינטיקה של הידרוליזה, כאשר נקודת הזמן האפסית בתחילת התגובה היא כאשר אסטר ה-NHS בממס אורגני נוסף לקובטה. זה מאשר את הפונקציונליות של אסטר פעיל NHS של קרבוקסי-PEG-DSPE (ראה שיטות סעיף 1). בנקודת הזמן האפס, האקסטרפולציה A260=0.33 מייצגת את החומר שכבר עבר הידרוליזה לפני הבדיקה. בסיום תגובת ההידרוליזה, מעל 10-15 דקות, A260=1.54 (כאשר הספיגה כבר לא עולה במידה ניכרת). זה מאשר את נוכחותה של אסתר פעילה. הוא גם מספק נתונים כמותיים, שלמעלה מ-78% מהחומר אינו NHS שעבר הידרוליזה מראש, ולכן ניתן להשתמש בו בהצלחה לצימוד פפטידים, עם התאמה נכונה של כמות המגיבים.
הכנה והעברה של חומר שומני מהמדיה המימית אל מעטפת הבועה: שומן פלואורסצנטי
המיקרו-בועות למחקר זה הוכנו כך שיכילו כמות עקבות (מתחת ל-1%) של הצבע הפלואורסצנטי DiI, עם פלואורסצנטיות אדומה אופיינית, שנוספה כתמיסה ב-PG לתמיסת המלח-PG של DSPC ו-PEG סטארט. מיקרו-בועות המתקבלות מדגימות בבירור פלואורסצנטיות של מעטפת כאשר עירור אור ירוק ומסנני פליטה אדומים משמשים במיקרוסקופ (ראו איור 2, משמאל). מיקרוסקופ שדה ברייטפילד של פאזת גז מיקרו-בועה (איור 2, מימין) ניתן להשוות עם פלואורסצנטיות של מעטפת מיקרו-בועה. לצורך הערכה כמותית של העברת חומר שומני מהפאזה המימית למעטפת הבועה, הוצפו מיקרו-בועות באמצעות צנטריפוגה, ואות הקרינה של שלב האינפרנטנט השקוף הושווה עם הקרינה של התמיסה הראשונית, לפני מיזוג המיקרו-בועות. נצפתה כמעט הפחתת אות בסדר גודל (איור 3), כלומר, למעלה מ-85% מחומר השומנים הועבר למעטפת המיקרו-בועות על ידי מיזוג.
הכנה ותיקון חלוקת גודל של מיקרו-בועות
מיקרו-בועות שנוצרו על ידי מיזוג הדגימו התפלגות גודל אופיינית, עם ריכוז גבוה (למשל, ~4.8 x 109 חלקיקים למ"ל עבור בועות ביוטיניליות). התפלגות הגודל הייתה רחבה, עם חלקיקים בטווח הנמדד (בין 1 ל-30 מיקרומטר); ~6.3% מיקרו-בועות בקוטר של יותר מ-5 מיקרומטר (איור 4, עקומה ירוקה). מתן תוך וסקולרי של מיקרו-בועות גדולות עלול להוביל להצטברות לא ספציפית שלהן בנימי הדם ויש להימנע ממנו. ציפה קצרה (15-17 דקות) של הבקבוקון ההפוך בכוח הכבידה הרגיל, עם איסוף של 0.3 מ"ל לאחר מכן קרוב לפני השטח של המחיצה, מאפשרת הסרה של מיקרו-בועות גדולות יותר לחלוטין, עם אובדן קל בריכוז מספר החלקיקים הכולל, עד ~4.6 x 109: לאחר הציפה, רק ל-0.01% מהחלקיקים בדגימה המטוהרת יש קוטר מעל 5 מיקרומטר (איור 4, עקומה אדומה).
הידבקות של מיקרו-בועות למשטח מצופה קולטן: בדיקה סטטית
הליך זה תואר לראשונה במאה הקודמת1, והוא משמש כבדיקה מהירה המאשרת את הפונקציונליות של מיקרו-בועות ממוקדות. מיקרו-בועות מורשות ליצור קשר עם משטח הכלי הנושא את הקולטן. אם מתרחשת אינטראקציה בין ליגנד-קולטן, בועות עשויות להישמר על פני השטח למרות הכביסה הנמרצת. מוצגת דוגמה לבדיקה כה מהירה של הידבקות פונקציונלית של מיקרו-בועות c(RGDfK) על פני השטח המצופים ב-αvβ 3 רקומביננטי. איור 5 הוא תמונת מיקרוסקופיה מייצגת של מיקרו-בועות דבקות על פני הקולטן בצלחת פטרי, לאחר שטיפה עם PBS, כדי להסיר בועות לא קשורות. בועות במיקרוסקופיה מסוג זה מופיעות כדפוסים מעגליים כהים. במצב דומה, אם המשטח מצופה רק באלבומין (כדי לחסום הידבקות לא ספציפית), מיקרו-בועות לא יידבקו ויישטפו בקלות גם על ידי השטיפה העדינה.
קשירת מיקרו-בועות מהמדיום הזורם: תא זרימת צלחת מקביל
הליך זה הוצע בתחילה ככלי לחקר הידבקות תאים בהגדרת זרימה מבוקרת15 והותאם לחקר מיקוד מיקרו-בועות עשרות שנים לאחר מכן11. בדיקה במערכת זרימה, בניגוד לבדיקה סטטית, היא הרבה יותר מציאותית עבור תרחיש הדמיה קלינית, שבו בועות במחזור בזרימת דם נוגעות לזמן קצר בדופן כלי הדם ועשויות להיצמד אליו אם קולטן המטרה קיים. מוצגות שתי דוגמאות למחקרים כאלה. הדוגמה הראשונה היא גישה מסורתית יותר, שבה ההידבקות של מיקרו-בועות מעוטרות בפפטיד למשטח המצופה בקולטן מנוטרת על ידי מיקרוסקופ וידאו. מיקרוסקופיה מאפשרת להבחין בין מיקרו-בועות דבקות לאלו הזורמות. זה גם מאפשר לכמת את המיקרו-בועות הדביקות הללו במסגרת הדמיית המיקרוסקופ: הרבה יותר מיקרו-בועות c(RGDfK) (עמודה שמאלית) נצמדות למשטח, בהשוואה לביקורת, שם נעשה שימוש בפפטיד c(RADfK) מקושקש, או אם המשטח מצופה רק ב-BSA (איור 6).
הדוגמה השנייה היא הדמיית אולטרסאונד ניגודיות של צלחת פטרי המצופה בסטרפטווידין (איור 7, צד ימין) שאליה מיקרו-בועות ביוטיניליות נספגות בהצלחה מהמדיום הזורם, וניתן לזהות אותן על ידי הדמיית אולטרסאונד ניגודיות לאחר שטיפה עם PBS. משטח צלחת הבקרה אינו שומר על מיקרו-בועות דבקות מהזרימה, כך שבעצם כל אות הניגודיות של האולטרסאונד מוסר עם זרימת PBS. כימות אותות ניגודיות אולטרסאונד מראה מובהקות סטטיסטית חזקה של ההבדל שנצפה; היחס בין אותות המטרה והבקרה עלה על סדר גודל.
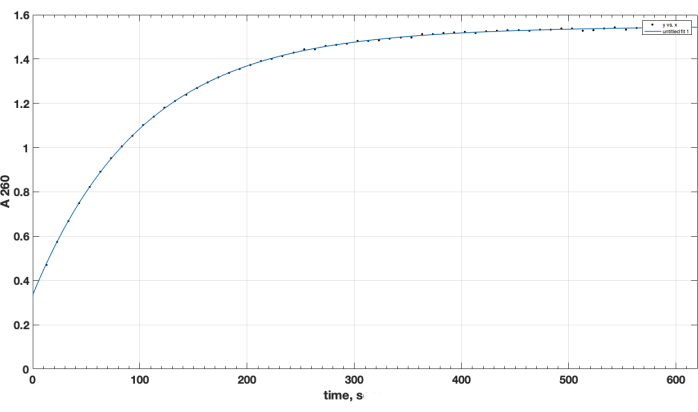
איור 1. קינטיקה של הידרוליזה של אסטר פעיל NHS-PEG-DSPE, שנצפתה על ידי שחרור NHS בתווך אלקליין על ידי בדיקה ספקטרופוטומטרית באורך גל של 260 ננומטר. נקודת זמן אפס היא זמן התוספת של NHS-PEG-DSPE בממס אורגני למאגר בוראט 0.1 M, pH 9.2. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2. מיקרוסקופיה של מיקרו-בועות מלאות בגז לאחר מיזוג. משמאל, מיקרוסקופיה פלואורסצנטית (עירור ירוק, פליטה אדומה, צבע מעטפת שומנים DiI). מימין, מיקרוסקופ שדה בהיר (תצפית פאזה גזית), אותה הגדלה. רוחב מסגרת, 85 אום (מיקרומטר שלב של 10 מיקרומטר מוטבע בפינה השמאלית התחתונה של כל תמונה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
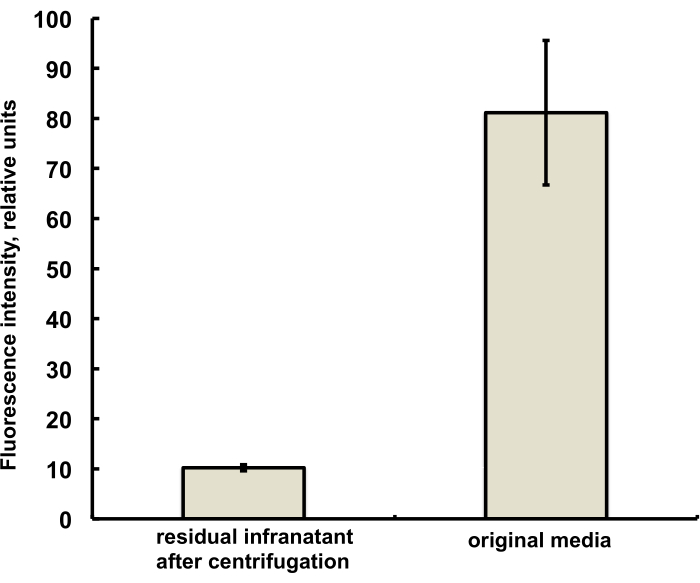
איור 3. ספקטרוסקופיה פלואורסצנטית של דגימת צבע ליפידים DiI ממדיום הכנת המיקרו-בועות לפני המיזוג (מימין) ולאחר מיזוג והסרה של מיקרו-בועות על ידי ציפה צנטריפוגלית (משמאל). עירור פלואורסצנטי - 555 ננומטר, פליטה - 620 ננומטר. הנתונים מוצגים כממוצע ± סטיית תקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
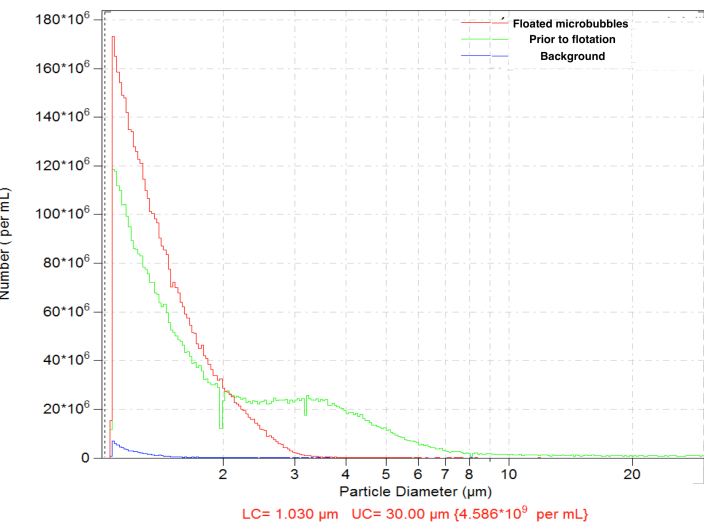
איור 4. התפלגות גודל החלקיקים של ריכוז מספר המיקרו-בועות לאחר הכנת מיזוג (ירוק), עם ציפה של כבידה רגילה לאחר מכן להסרת מיקרו-בועות גדולות (אדום) וספירת רקע מדללת בלבד (כחול). ספירת חלקיקים חישת אלקטרו-זון במי מלח רגילים, פתח של 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5. מיקרוסקופ ברייטפילד של מיקרו-בועות c(RGDfK) על צלחת מצופה ב-αvβ3. רוחב מסגרת התמונה הוא 106 μמ'; הסרגל הוא 10 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6. תא זרימת צלחת מקביל במבחנה מכוון מיקרו-בועות מעוטרות בפפטיד למשטח המצופה α v רקומביננטי β3. מיקרו-בועות מעוטרות ב-cRGDfK נדבקו ביעילות לצלחת (משמאל), החיבור של מיקרו-בועות cRADfK לא ממוקדות (מקושקש, מרכז) היה מינימלי (p<0.00005), וכך גם שימור מיקרו-בועות במשטח הבקרה של אלבומין בלבד (מימין, עמ<0.0025). מתח גזירה של קיר זרימת תא ב-1 דין/ס"מ2. הידבקות מיקרו-בועות המנוטרת על ידי מיקרוסקופ וידאו; מוצג מספר החלקיקים בשדה הראייה. זמן הצבירה הוא 4 דקות. הנתונים מוצגים כממוצע ± סטיית תקן. הודפס מחדשבאישור 5. זכויות יוצרים, 2018, האגודה האמריקאית לכימיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
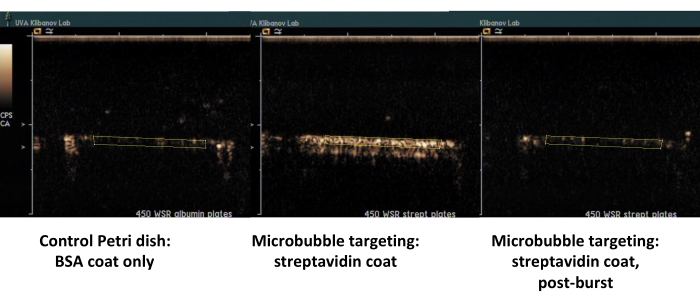
איור 7. הדמיית אולטרסאונד ניגודית של תא זרימת צלחת מקביל לאחר הידבקות ממוקדת ושטיפת חיץ של מיקרו-בועות ביוטיניליות על הצלחת המצופה בסטרפטווידין (מיקרו-בועות ממוקדות אמצעיות, דביקות, מימין, אותה צלחת, לאחר פרץ אולטרסאונד MI גבוה), וצלחת בקרה מצופה רק באלבומין (משמאל). שתי דקות של זלוף של פיזור מיקרו-בועות (PBS/BSA, 106 חלקיקים/מ"ל) בקצב גזירה של 450 s-1 , ואחריו שטיפת חיץ. כימות אות האולטרסאונד מתבצע מאזורי העניין במסגרות הווידאו לאחר חיסור רקע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
ניכרת חשיבותה של טכניקה פשוטה להכנת מיקרו-בועות מעוטרות בליגנד. השימוש בטכניקת מיזוג להכנת מיקרו-בועות, כפי שפותח על ידי Unger et al.,16 עשוי לשרת מטרה זו ממספר סיבות. ייצור מיקרו-בועות על ידי ממזג קל לביצוע. יחידת 120 וולט שולחנית חד-פאזית עם טביעת רגל קטנה זמינה וזולה. ההליך מהיר (45 שניות) ויעיל: מכינים 1 מ"ל של פיזור מיקרו-בועות במדיום מימי בבת אחת. הוא מכיל מיליארדי חלקיקים למ"ל, די והותר למחקרים. הייצור מתרחש בבקבוקון אטום עם מרווח ראש גז פרפלואור. במידת הצורך, תכולת הבקבוקון תישאר סטרילית מרגע המילוי האספטי, במהלך הייצור (מיזוג) ועד השימוש. זה הופך את הגישה לרלוונטית לשימוש קליני, מכיוון שהיא אינה דורשת הכנות משוכללות בסביבה סטרילית ייעודית במרפאה.
ההליך מבוסס על הרכבה עצמית: במהלך הערבוב, כאשר גזירה גבוהה מוחלת על ממשק גז-מים בתוך הבקבוקון הנע, נוצרים שברי גז קטנים, שלובשים צורה כדורית עקב פעולת מתח הפנים. PG, כחומר פעילי שטח, הקיים בתווך בריכוז גבוה, מפחית את מתח הפנים והאנרגיה הנדרשים ליצירת ממשק גז-מים במהלך הגזירה. לאחר מכן, חומרים פעילי שטח "קלאסיים" יותר, כגון PEG-lipids ופוספוליפידים, הנמצאים בריכוזים נמוכים בהרבה, מגיעים לממשק, ככל הנראה עוקרים PG ויוצרים שכבה מונומולקולרית על פני הבועה. מעטפת זו יציבה למדי; סביר להניח שזה נובע משילוב של ליפיד "מוצק" (טמפרטורת מעבר פאזה DSPC היא 56 מעלות צלזיוס, כך שהוא אינו נוטה לאיחוי בין ממברנות) ומעיל מברשת PEG מורחב המקיף את המיקרו-בועות ומעכב מגע חד-שכבתי ישיר של בועות שכנות. ניתן לשער שנוכחות של ריכוז גבוה של PG במדיה עשויה להוריד את יציבות מעטפת המיקרו-בועה. בהיעדרו, מיקרו-בועות יציבות בבקבוקונים האטומים תחת אטמוספירה פלואורו-פחמן במשך חודשים רבים, עם היתוך מתון בלבד בין הבועות. לשימוש קליני, עם מכשיר מיזוג קטן ליד המיטה, המרווח בין הכנת מיקרו-בועות לשימוש יכול להיות קצר, דקות או שעות. עם PG נוכח בתקשורת, ריכוז המיקרו-בועות אינו מראה ירידה משמעותית, לפחות למספר שעות של אחסון בקירור.
יתרון נוסף של ההליך המתואר (בסיוע שימוש בחומר פעילי שטח PG במדיום הכנת הבועות) הוא יעילות גבוהה (>85%) של העברת השומנים לקליפה, בעוד שהסוניקציה המסורתית מספקת יעילות של ~20%5 ושיטות מיקרופלואידיות מודרניות אפילו נמוכות יותר17. רמה גבוהה של יעילות העברה חשובה לא רק בגלל שבזבוז חומר השומנים והליגנד היקר מצטמצם, אלא מכיוון שכמות הליגנד נטול הבועות הקיימת במקביל במדיה ממוזערת גם כן. אז ייתכן שלליגנד החופשי לא תהיה הזדמנות לחסום את קולטן המטרה של הסמן הביולוגי שאליו המיקרו-בועות צפויות להיקשר באמצעות ליגנד על פני השטח שלהן. הכמות הכללית של קולטן הסמן הביולוגי בכלי הדם של המטרה היא לרוב גבוהה למדי, כך שייתכן שלא תהיה לכך חשיבות עליונה. מספרות הפטנטים הזמינה18 ניתן להציע שלפחות 50% מחומר מעטפת השומנים וליגנד המטרה בפורמולציות המיקרו-בועות בבדיקות קליניות עשויים להיות קשורים למעטפת הבועה. ניתן להשוות זאת באופן כללי לנוגדנים או פפטידים בעלי תווית רדיו הנמצאים בשימוש נרחב במחקרי הדמיה של קולטני רפואה גרעינית: רוב אלה המכוונים למולקולות ליגנד למעשה אינם נושאים רדיואיזוטופ "חם" אפילו עבור הפעילות הספציפית הגבוהה ביותר שדווחה19, בעוד שעבור מיקרו-בועות ממוקדות, חומר המעטפת במחקר זה (כולל ליגנד-ליפיד) מחובר בעיקר למיקרו-בועות.
הידבקות סלקטיבית של מיקרו-בועות ממוקדות שהוכנו בטכניקה זו במבחנה הודגמה, בשתי קבוצות של מודלים ממוקדים: הידבקות סטטית וניסוי מיקוד תא זרימה. בבדיקה סטטית, מיקרו-בועות ממוקדות נדבקו לשכבת קולטן המטרה בחוזקה ולא נעקרו בשטיפת חיץ, בניגוד לסביבת בקרה, שבה מיקרו-בועות הוסרו מהמשטח אפילו בשטיפה עדינה. כמו כן, בבדיקת זרימה, שבוצעה בתא זרימת צלחת מקביל, בועות ביוטיניליות הראו הידבקות מובהקת סטטיסטית ומעולה לשכבת סטרפטווידין על צלחת פוליסטירן, בהשוואה למשטח הביקורת של אלבומין בלבד. מיקרו-בועות מעוטרות בפפטיד c (RGDfK) נדבקו באופן סלקטיבי למשטח αVβ3 מצופים, הן בבדיקת ההדבקה הסטטית והן בתא זרימת צלחת מקביל.
ניתן להתייחס לבעיות הבאות כמגבלות של הפרוטוקול המתואר. ראשית, ההליך אינו מביא בחשבון את החלקיקים התת-מיקרוניים. המכשיר ששימש במחקר לא הוקם לאיתור ננו-בועות (כלומר, חלקיקים בקוטר של פחות מ-1 מיקרומטר). ייתכן שחלקיקים אלה היו נוכחים בניסוח. למרות שידוע בדרך כלל שאות הפיזור האחורי האקוסטי שלהם נמוך, והם לא נצפו במחקר זה במיקרוסקופיה, עדיין יש לקחת בחשבון את נוכחותן של ננו-בועות. הנושא המשמעותי השני הוא הטרוגניות הגודל של המיקרו-בועות. למרות הסרת חלקיקים גדולים יותר, גודל הבועות המתקבלות רחוק מלהיות אחיד. זה צריך להיות שיקול והצדקה למחקר נוסף בתחום ניסוח המיקרו-בועות.
לסיכום, הנרטיב הניתן בכתב יד זה אמור לספק רמה מספקת של פירוט טכני כדי לייצר מיקרו-בועות ממוקדות במהירות ובקלות. ניתנים השלבים לביצוע טיהור נוסף (אם רצוי), התאמת הגודל ו/או הערכת הכמות הקטנה של חומר הקליפה שנותר בתווך הימי. מתוארים הכלים האנליטיים המפורטים להערכת פרמטרי המיקרו-בועות, כגון התפלגות גודל וריכוז, ויכולת חוץ גופית של מיקרו-בועות מעוטרות בליגנד להיצמד לקולטני המטרה.
Disclosures
א. קליבנוב הוא מייסד שותף ובעל מניות מיעוט ב-Targeson Inc, סטארט-אפ בתחום המיקרו-בועות ממוקדות פרה-קליניות, שהתפרק כעת. למעבדת ה-UVA שלו יש חוזה משנה באמצעות NIH R44 HL139241 מ-SoundPipe Therapeutics.
Acknowledgements
א.ל. קליבנוב מכיר בתמיכה חלקית באמצעות NIH R01EB023055, שהוענק על ידי המכון הלאומי להדמיה ביו-רפואית וביו-הנדסה של המכונים הלאומיים לבריאות, חוזה משנה לאוניברסיטת וירג'יניה באמצעות NIH R01NS076726, שהוענק ל-UCSF על ידי המכון הלאומי להפרעות נוירולוגיות ושבץ מוחי של המכונים הלאומיים לבריאות, וחוזה משנה לאוניברסיטת וירג'יניה באמצעות מענק NIH R44HL139241, הוענק ל-SoundPipe Therapeutics על ידי המכון הלאומי ללב, ריאות ודם. תוכן פרסום זה הוא באחריות המחבר בלבד ואינו מייצג בהכרח את העמדות הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
References
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved