Method Article
目标微泡的制备和表征
摘要
该协议的目标是制备、纯化和表征充满气体的微泡(用于超声分子成像的靶向造影剂)。描述了两种靶向系统:粘附在链霉亲和素上的生物素化气泡,以及与已知肿瘤新生血管生物标志物 αVβ3 结合的环状 RGD 肽微泡。
摘要
以微泡为靶标(用于分子成像的超声造影剂)已经研究了二十多年。然而,微泡制备和靶向配体附着的方法繁琐、复杂且冗长。因此,需要简化靶向微泡制备程序,使其更接近临床转化。本出版物的目的是提供目标微泡制备、功能表征和测试所需步骤的详细说明和解释。为两个系统提出了一系列优化和简化的程序:生物素-链霉亲和素靶向对模型和靶向重组 αVβ3 蛋白的环状 RGD 肽,该蛋白在肿瘤新生血管系统的内皮内层上过表达。
在这里,我们展示了以下内容:靶向配体与脂质锚定的共价偶联,试剂质量的评估,以及确认反应成功完成的测试;制备含有微泡壳组分的水性前体培养基,然后通过汞齐制备微泡;评估脂质转移到微泡稳定剂壳上的功效;通过在正常重力下浮选来调整微泡大小分布,以去除可能不利于体内使用的较大微泡;通过电带传感评估微泡尺寸分布;在静态结合测定试验中评估微泡与受体包被表面的靶向结合(在倒置培养皿中);以及在平行板流室测试中评估微泡与受体包被表面的靶向结合。
引言
使用目标微泡进行分子成像的研究和测试已经进行了二十多年。一般概念很简单:静脉注射对疾病区域血管内皮特异性分子生物标志物具有选择性亲和力的充满气体的微泡。这些颗粒在靶标中循环并积累(例如,肿瘤新生血管系统或缺血性炎症损伤区域)。然后通过造影剂超声成像检测粘附的微泡。上个世纪的早期概念研究工作 1,2 现在正逐渐走向临床采用:它们在几年前才进入中等规模的临床试验阶段 3,4。本手稿的目的是根据两个已发表的示例 1,5 提供有关此类目标微泡的制备和表征的详细说明。
肽-PEG-磷脂的制备程序是制备这些目标微泡的关键成分,并补充了试剂质量控制的描述,以成功完成反应。遗憾的是,一些活性酯脂质试剂供应商提供的材料在到达时会发生水解,因此无法参与酰胺键的形成。提供了有关在微泡制备过程中有多少脂质物质从水性介质转移到微泡壳上的信息,以及获取此信息的技术。
制备粒径分布相对狭窄的微泡很重要:用于血管内体内测试的注射培养基中共存大微泡可能导致微血管系统堵塞;绕过肺分流术的微泡的非特异性积累可能会导致非特异性假阳性组织增强6 (non-specific false-positive tissue enhancement),这可以通过去除较大尺寸的微泡来避免。因此,提出了一种实现粒度选择的简单程序,并补充了一种使用粒子计数器评估颗粒浓度和粒度分布的方法的描述。
如下所示,微泡靶向评估的第一个测试方案描述了一个纯模型系统,其中生物素化微泡靶向链霉亲和素包被的表面1。第二个方案基于描述肽靶向微泡的简化制备的手稿,该微泡修饰有对 αvβ3(肿瘤新生血管系统的分子生物标志物5)具有特异性亲和力的环状 RGD 肽。通过所提出的技术用这种环 [Arg-Gly-Asp-D-Phe-Lys] 修饰的微泡,即 c(RGDfK) 肽已被证明可以靶向肿瘤新生血管系统并在小鼠肿瘤模型中实现超声分子成像。
研究方案
1. 肽与 NHS-PEG-DSPE 的共价偶联
- 将 c(RGDfK) 肽与赖氨酸的初级 ε-氨基溶解在二甲基亚砜 (DMSO, 10 mg/mL) 中,该赖氨酸未受保护且可用于偶联。制备聚(乙二醇)-3400-二硬脂酰磷脂酰乙醇胺 (NHS-PEG-DSPE, 200 mg/mL) 的 N-羟基琥珀酰亚胺酯的甲醇或氯仿溶液,并加入 1 mg DMSO 中的肽中。加入 3 μL N,N-二异丙基乙胺 (DIPEA)。
- 保持肽与 NHS-PEG-DSPE 的摩尔比至少为 1:1.2,以便所有伯氨基都能够反应。保持 DIPEA:肽摩尔比至少为 2:1,以确保基本的培养基条件。
注意: 氯仿、甲醇和 DIPEA 是有害物质。使用适当的防护措施,例如手套、实验服、护目镜和通风橱。
注:可以使用任何其他具有伯氨基的肽或模拟物来代替 c(RGDfK),其未受保护的 N 端或赖氨酸位于结合位点之外。为了使反应继续进行,所有组分(即靶向配体和脂质)必须可溶于 DMSO-氯仿混合物。也可以测试替代溶剂,例如二甲基甲酰胺或其混合物。在水性填料中也可以进行反应,但由于活性酯的快速水解,偶联产率会低得多。
- 保持肽与 NHS-PEG-DSPE 的摩尔比至少为 1:1.2,以便所有伯氨基都能够反应。保持 DIPEA:肽摩尔比至少为 2:1,以确保基本的培养基条件。
- 在室温下孵育过夜后,通过蒸发去除挥发性有机物质(使用氮气流或旋转蒸发器,然后在高真空泵下蒸发过夜,以去除 DMSO)。将非挥发性残留物以 1 mg/mL 的浓度重新溶解在氯仿中以进行对照采样。
- 通过薄层色谱确认反应完成(在氯仿:甲醇溶剂培养基中开发 TLC 板,2:1 v/v)。在 150 °C 加热块上加热板时,用茚三酮喷雾确认伯氨基的存在与否。
注意:茚三酮是有害物质。如上所述,使用适当的保护措施。TLC 板的加热块处理必须在通风橱中进行。加热块存在潜在的火灾隐患。 - 在微泡制备之前,从氯仿中分装肽-PEG-DSPE 样品(例如,1 mL 1 mg/mL 溶液),在氮气流中将氯仿蒸发至干,随后进行高真空泵孵育,并加入盐水至 1 mg/mL,以获得透明的胶束溶液。
- 如果需要进一步纯化反应混合物,则重新溶解在生理盐水中。然后将所得胶束混合物进行透析(截留分子量为 6-8 kDa 或类似物质),首先对生理盐水进行透析,然后对去离子水的几次变化进行透析。
- 通过透析液的电导率检查确认透析完成。从透析袋中取出透析材料,放入已知质量的小瓶中,冻干直至完全干燥。
注:可以使用将配体连接到 PEG-脂质末端的替代共价反应(例如,马来酰亚胺-PEG-DSPE 与硫醇-配体的反应)。这种方法的主要优点是定向偶联,如果配体分子上有单个巯基 7。主要问题是长期稳定性:马来酰亚胺和硫醇之间的连接可能容易被 retro-Michael 反应降解,具体取决于储存条件 8。
注:活性酯试剂的质量因制造商而异:这可能取决于转移和储存条件(如果材料储存或运输不当,活性酯会水解,无法与肽偶联)。因此,有一种义务描述确定 NHS-PEG-DSPE 降解程度的程序(见下文),NHS-PEG-DSPE 是一种将靶向配体共价连接到微泡的试剂。NHS-PEG-DSPE 在氩气下以干粉形式提供,以深度冷冻方式储存。将样品瓶置于室温下(以避免水分凝结),使用分析天平称量样品,并溶于甲醇或 DMSO 中。装有散装干燥试剂的小瓶应在氩气下密封,然后放回装有干燥剂的密封容器中进行深度冷冻,直到进一步使用。 - 通过将干试剂简单地添加到盐水中并孵育,制备肽-PEG-DSPE(步骤 1.4)以及生物素-PEG-DSPE 的水溶液。形成小的球形胶束。为了加速试剂从散装状态到胶束形式的转移,可以应用超声处理和热水浴。
- 评估 NHS-PEG-DSPE 活性酯的试剂质量。
- 确认试剂中存在的 NHS 为活性酯形式,以便能够进行酰胺键形成的偶联反应。
- 将 0.99 mL 0.1 M 四硼酸钠缓冲液(pH 值为 9.2)放入分光光度计中的石英或紫外线透明塑料比色皿(非玻璃)中,在 260 nm 波长处归零。
- 向比色皿中加入 10 μL 新鲜制备的 200 mg/mL NHS-PEG-DSPE 甲醇溶液。同时,启动秒表。快速、剧烈地混合比色皿内容物,以实现均匀性。将比色皿放入光度计中,盖上盖子,然后开始测量。
- 在分光光度计测量开始时,标记记录开始的时间,并每 10 秒在 260 nm 处连续进行光度吸光度测量 ~10 分钟,或直到吸光度值稳定。
- 绘制动力学曲线,检查初始 A的 260 个时间点,并将曲线外推到反应开始时间(即,在将试剂添加到水性缓冲液中并且水解反应已经开始的点找出 A260 )。假设在将 NHS-PEG-DSPE 添加到比色皿中的缓冲液中之前,由于缺水,没有在有机溶剂中发生水解。
- 计算反应开始时和水解完成时 A260 之间的比率;它代表降解的活性酯的分数。使用此信息选择合适的 NHS-PEG-DSPE 量,以完全修饰肽的伯氨基。
2. 通过汞齐制备微气泡
- 生物素化微泡的制备
- 将二硬脂酰磷脂酰胆碱 (DSPC) 和 PEG 硬脂酸酯共溶于丙二醇(PG,在纯溶剂中各浓度为 10 mg/mL)中。使用热水浴溶解材料。
- 将 0.1 mL 这种热 PG 溶液加入含有 0.85 mL 热生理盐水的小瓶中,快速混合,然后以 1:20 的质量比向 DSPC 添加胶束生物素-PEG-DSPE(50 μL,1 mg/mL 盐水溶液)。
注:脂质成分在 PG 中的溶解度与温度有关,因此需要热水浴。在添加脂质之前,在热水浴中加热含有盐水的玻璃瓶是有帮助的,以产生没有可见颗粒的均匀介质。 - 将样品瓶置于室温,在样品瓶上放置橡胶塞,插入一半,然后将 PTFE 毛细管插入样品瓶中。使用十氟丁烷气体流填充样品瓶,然后关闭塞子,同时去除毛细管。
注:汞齐过程中样品瓶的温度可能对所得微泡的尺寸分布有显著影响 9。 - 在室温下压接带塞的小瓶,并置于汞齐器装置中。启动 amalgamator。使用的临床装置预设为以 4300 rpm 的速度运行 45 秒。
- 汞齐完成后,从汞齐器中取出带有所得微泡的小瓶。最好表征微泡尺寸分布和组成,并在制备后几个小时内使用它们。
- 肽修饰微泡的制备
- 将 DSPC 和 PEG 硬脂酸酯共溶于纯 PG 中(每种材料的浓度为 10 mg/mL)。使用热水浴溶解。将 0.1 mL 这种热的 PG 溶液加入含有 0.85 mL 热生理盐水的小瓶中,快速混合,然后以 1:20 的质量比加入胶束肽-PEG-DSPE(50 μL,1 mg/mL 盐水中),加入 DSPC。
- 将样品瓶置于室温,在样品瓶顶部放置一个橡胶塞,插入一半,然后将聚四氟乙烯 (PTFE) 毛细管插入样品瓶中。使用十氟丁烷气体流填充样品瓶,然后关闭塞子,同时去除毛细管。
- 压接带塞的小瓶,放入汞齐器中混合。带有微气泡分散剂的小瓶在 45 秒内即可准备好。
- 染料脂质微泡的制备,用于评估脂质转移到微泡壳
- 如上所述,将 DSPC 和 PEG 硬脂酸酯共溶于纯 PG 中(使用热水浴)(每种材料的浓度为 10 mg/mL)。
- 将 0.1 mL 这种热 PG 溶液加入装有 0.89 mL 热生理盐水的小瓶中,快速混合,加入 10 μL DiI 染料溶液(1 mg/mL 在纯 PG 中)并混合。将样品瓶加热至室温。
- 如上所述,用十氟丁烷气体填充样品瓶顶部空间,塞住样品瓶,如上所述封口并汞齐。
3. 测试 DiI 脂质从胶束水性介质到气泡壳的转移
- 为了显微镜确认荧光脂质物质已从水性介质转移到微泡壳,用胰岛素注射器从小瓶中通过隔膜对等分试样的微泡进行采样。
- 然后向载玻片中加入一滴,并用标准盖玻片覆盖。首先用一滴脱气盐水稀释。
- 使用配备荧光落射照明、100 倍油物镜和高灵敏度摄像机的视频显微镜进行显微镜检查。
- 为了确定在汞齐过程中脂质物质从盐水/PG 培养基转移到气泡壳的功效,取一瓶密封的微泡,将其倒置并放入 50 mL 锥形管中。
- 在吊篮转子中进行离心(10 分钟,200 x g)。从离心机中取出样品瓶并保持倒置。
- 将胰岛素注射器的针头插入倒置小瓶的隔膜中。缓慢吸出少量 (~50 μL) 的透明红外线。
注:离心后用于从倒置小瓶中进行红外抽吸的针头的斜面尖端必须尽可能靠近隔膜,以尽量减少微泡吸入的机会。
- 将次钠样品 (2 μL) 以及用于产生微泡的原始脂质-PG-盐水培养基 (2 μL) 的样品放入含有 0.1 mL 磷酸盐缓冲盐水 (PBS):含 1% Triton X-100 的乙醇 1:1 培养基的 96 孔板中。
- 用荧光酶标仪测量 DiI 染料的红色荧光(555 nm 激发,620 nm 发射)。
- 使用底部不透明的黑色板进行荧光光谱分析,因为背景较低且缺乏孔间信号传输,这可能会成为透明板的问题。
- 确保荧光信号在线性校准范围内:孔中染料浓度过高可能导致光衰减和信号漏报。
注意:有时可能需要去除混汞齐后残留在水性介质中的残留壳材料。为此,在微泡浮选离心后,通过从倒置的小瓶中缓慢吸出所有次下钠体积,并用脱气的生理盐水代替。为避免因去除或添加液体而导致样品瓶中的环境压力发生过大变化,请在隔膜中插入一根额外的长针头,以到达样品瓶内的气相。为了保持样品瓶内的气相,首先,将针头连接到充满氟碳气体的注射器上,以防止空气接触微气泡制备物。
4. 微气泡尺寸分布调整
- 在静态倒置小瓶中使用正常重力浮选来调整微泡的大小分布,即快速有效地去除最大的微泡 5,10。
- 如第 2 节所述,制备后立即取一小瓶微泡。倒置并倒置在稳定的非振动表面上 15-20 分钟。
- 孵育后,将胰岛素注射器针头插入小瓶的隔膜中,趁其仍处于倒置状态,然后从下层轻轻收集 300-500 μL 微泡。
注:注射器的针头必须靠近隔膜内表面,以避免在靠近样品瓶中液体顶部的地方聚集较大的气泡。- 缓慢拉回注射器柱塞,以避免注射器主体中气泡的湍流和静水膨胀。当收集的样品从注射器中取出时,避免超压以防止气泡破裂。
- 将微气泡分散物从注射器转移到小体积样品瓶中。然后填充全氟气体、塞子和卷曲,用于短期储存、颗粒计数(见下文)和进一步使用。
- 如果直接从注射器进行采样,请水平握持并旋转以避免气泡浮选并实现样品均匀性。
5. 微泡尺寸分布评估
- 使用粒子计数器(基于电区传感或光阻原理)评估粒度分布和浓度。或者,使用血细胞计数器和显微镜。
- 简而言之,将微泡样品等分试样加入到反腔室(通常为 60-100 mL 体积)中的生理盐水或等同酯中并计数。比较浮选净化前后的微泡尺寸分布。
注:采样前立即对样品瓶进行温和混合(非涡旋),以实现具有代表性和可重现的测量结果。从被测体积的中心取样。 - 在 100 mL 烧杯中加入至少 60 mL 的 0.9% 盐水溶液稀释剂,并将其放在电区发送仪器的载物台上。提起载物台,使试管、外电极板和搅拌器都完全浸入稀释剂中,搅拌器可以旋转。
注:烧杯中的稀释剂体积可以使用其质量精确确定,刻度(盐水密度接近 1)。或者,可以使用计量泵。电区传感研究期间的电极应完全浸入。 - 在装置控制软件中记录稀释剂电解液体积。电区传感计数器配有 50 μm 孔口,可测量直径在 1 至 30 μm 之间的颗粒。首先执行后台运行;预计 0.5 mL 稀释剂中的空白计数将少于 5000 个。最佳背景级别可以低于 100 个计数。
- 在单元控制软件中设置样品体积,以考虑稀释因子。向烧杯中加入 10-20 μL 微泡混合物,然后进行第二次运行。
- 通过使用软件中的 “subtract background run” 函数来解释背景大小分布数据。获得原始微泡样品中颗粒的浓度,为颗粒数/mL;它包括稀释因子。
- 在采样过程中,移液器吸头的外表面也可能被气泡覆盖;确保在将吸头插入计数介质之前将其擦掉。请勿用抹布触摸移液器吸头孔口。
- 在计数过程中避免样品颗粒稀释不足,以最大限度地减少重合校正问题,即一次有多个颗粒位于传感器孔内:系统可能会低估颗粒浓度。
注意:用于颗粒计数的孔口直径可能会有所不同。选择 50 μm 孔口可以检测直径小至 1 μm 的微气泡,但不像较小直径的选项那样容易堵塞。 - 使用与实际测试中使用的相同稀释剂测试介质(例如,无菌过滤的生理盐水冲洗液)校准电区传感计数器。电区传感的激光遮挡替代方案的优点是不需要过滤盐水,盐浓度和电导率可控。
- 简而言之,将微泡样品等分试样加入到反腔室(通常为 60-100 mL 体积)中的生理盐水或等同酯中并计数。比较浮选净化前后的微泡尺寸分布。
6. 在粘附/保留试验中测试体外微泡靶向
- 准备生物标志物受体表面,以便将微泡靶向培养皿。
- 取直径为 35 毫米的聚苯乙烯培养皿作为目标表面。利用蛋白质从生理盐水到聚苯乙烯培养皿表面的非特异性粘附。使用模型蛋白链霉亲和素来测试含有生物素-PEG-DSPE 作为壳一部分的生物素化气泡的靶向性。
- 将一滴链霉亲和素溶液(0.2 mL、10 μg/mL 的 PBS 溶液)放在每个培养皿的中心,并用 22 mm x 22 mm 的塑料盖玻片覆盖,以便均匀涂覆培养皿表面。在 4 °C 下在封闭潮湿的环境中孵育过夜以防止培养皿变干以防止培养皿变干后,取下盖玻片。
- 立即用水、PBS 彻底清洗板,并与 1.5% 牛血清白蛋白 (BSA) 在 PBS 中孵育至少 4 小时来封闭它们,以尽量减少微泡对未涂层表面的非特异性粘附。使用用 1.5% BSA 封闭的干净培养皿作为对照。
- 或者,使用重组 αVβ3 受体溶液(例如,在 PBS 中为 4 μg/mL)5 代替链霉亲和素。通过连接到微泡壳上的环状 RGD 肽配体将微泡靶向该生物标志物。
- 保持存放有靶受体的培养皿湿润:如果受体蛋白变干,它可能会被灭活。
注:使用培养基中不含任何载体蛋白或表面活性剂的无载体蛋白非常重要 - 它们的存在会使粘附失活。
- 微气泡在小液滴中的粘附力:在静态条件下快速检查目标粘附力。
- 将一滴微泡 (5-20 μL) 从下方沉积到倒置的培养皿中的目标(或仅对照 BSA)表面上。这将通过浮选将气泡带到受体包被的表面。
- 将倒置培养皿在潮湿环境中孵育 5-10 分钟后,将培养皿倒置至正常位置,用 PBS 填充并轻轻冲洗以去除游离微泡。进行明场显微镜检查以评估目标粘附。
- 微气泡粘附在培养皿表面:在整皿1 中进行靶向。
- 取具有受体表面涂层的培养皿,用脱气的 PBS-BSA 缓冲液(35 mm 培养皿超过 10 mL)完全填充,使缓冲液的弯月面延伸到培养皿的顶部,并受到毛细管力的保持。将气泡 (50 μL) 注入大部分缓冲液中,并快速混合以实现均匀性。避免在混合过程中形成气泡。
- 在培养皿上快速放置一段透明包装胶带或培养板密封胶带,并用一块扁平塑料作为背衬。将薄膜压紧到培养皿上,倒置“组件”并将其倒置 30 分钟,让微气泡向上漂浮,接触目标表面并粘附。
- 将密封皿的“组件”倒置回“倒置”配置,取下密封件,然后用脱气的缓冲溶液冲洗掉不粘附的微泡。通过显微镜或超声成像观察目标微泡。
注意:当完全充满微气泡分散体的倒置密封培养皿被孵育时,可以将其放置在一个小角度,因此如果存在任何大气泡,它们将漂浮到培养皿的边缘,超出感兴趣的中心区域。在显微镜检查过程中,用来自微量移液器吸头的快速液流强制冲洗可用于评估气泡粘附在目标上的粘附程度(即使在慢速流动中,气泡也会完全从控制表面分离) 11。脱气缓冲液更适合用于气泡稀释,因为过量的溶解空气会导致微泡不受控制地生长。
7. 体外测试微泡靶向:在平行板流室中评估动态粘附/保留测定
注意:我们用超声成像测试生物素化气泡与链霉亲和素层的粘附性。
- 使用市售的平行板流槽和定制的逆变器支架,观察流动介质对 35 mm 培养皿的目标粘附性。将目标蛋白吸附到培养皿中后(参见 6.1.1),将带有预装垫圈的腔室体插入培养皿中,并将其密封在支架中。使用通道高度(即垫圈厚度)为 0.127 mm、通道宽度为 2.5 mm 的垫圈。
注意: 在平行板流通室的组装过程中,垫圈上使用的硅脂量应最少。不要让油脂进入通道区域:避免用油脂覆盖生物标志物蛋白包被的表面。为了实现适当的密封,请仔细选择 35 mm 培养皿(有关腔室和培养皿的信息,请参阅 材料表 )。 - 对于流通室组件,请勿将固定培养皿-流通室组合的盖子和框架拧得太紧,以免泄漏。
- 将流管连接到以抽取模式运行的注射泵,并在进料侧,将细聚乙烯管 (PE50) 连接到带有稀微气泡分散体的小瓶上,通过磁力搅拌器12 与搅拌棒不断混合。通过根据公式 6Q/bh2 调整泵体积流量来控制腔室的壁面剪切速率 (WSR) 参数,其中 Q 是流速,“b”是通道的宽度,“h”是通道的高度。
注:在灌注含有微泡的培养基或 PBS 之前,应从整个系统中去除气泡,因为任何通过通道的气泡都会使粘附的微气泡从目标表面脱落,并使实验无效。流通室管和注射器之间的连接必须正确密封。 - 通过在微泡储液器(20 mL 闪烁瓶)中加入计算体积的浓缩气泡来制备微泡分散液,以在含 0.1% BSA 的 PBS 缓冲液中达到 106 个微泡/mL 的浓度。将进料器储液槽放在磁力板搅拌器上。插入 1 cm x 2 cm 磁力搅拌棒并以 ~400 RPM 的速度搅拌,以在研究过程中保持均匀性。
- 对水箱13 中的流动室进行超声成像。
- 将流通室组件浸入脱气水中,并用重物将其固定到位,以防止在实验过程中移动。
- 将夹紧在通道正上方的成像探头,并将其向后倾斜 15° 角,顺时针倾斜 5° 角,以最大限度地减少来自碟形天线表面的镜面反射。将流室通道定位在成像平面内。
- 使用以下成像条件:15L8 传感器,对比特定成像模式,动态范围 50 dB,7 MHz,机械指数 (MI) = 0.18,CPS 增益 = 0。保持整个图像的时间增益补偿均匀。
- 放置传感器表面,使其接触水面,而不是深度浸入。或者,使用填充有超声凝胶的橡胶保护套。
注意:为了保证流动室系统用于成像的可重复定位,应将标记物放在水盆或超声系统屏幕上。
- 将微气泡分散液从储液罐中穿过腔室并进入泵中 2 分钟。
- 将流向切换到 PBS,以从通道中去除非粘附气泡并评估剩余粘附(目标)气泡的声学反向散射。为了获得背景图像,将 MI 增加到 1.9 以破坏超声成像视野中粘附的气泡。
注:重复运行时应更换微泡分散液:在高稀释度下,微泡会随着时间的推移而逐渐降解。
- 将流向切换到 PBS,以从通道中去除非粘附气泡并评估剩余粘附(目标)气泡的声学反向散射。为了获得背景图像,将 MI 增加到 1.9 以破坏超声成像视野中粘附的气泡。
- 从屏幕录制视频流中导出单个图像:PBS 刷新前、刷新后和销毁后,以导入 ImageJ 进行离线分析。选择感兴趣区域 (ROI) 以排除腔室的入口和出口部分。减去背景 ROI 信号后,将回波强度量化为 ROI 内的平均像素强度。
注意:作为超声成像的替代方案,当将倒置支架中的平行板流通室组件放置在复合显微镜的载物台上时,可以通过视频显微镜观察微气泡与目标表面的粘附,并记录视频 5,11,12,14。当表达受体的细胞在组织培养皿上生长时,这对于细胞培养中微泡与细胞表面生物标志物受体的靶向粘附成像特别有用,并且可以直接计算与每个靶细胞结合的微泡数量。
结果
肽和脂质的共价偶联
TLC 确认反应完成和所需的产物形成。在 TLC 期间,单独的未反应肽对照没有向上移动:它在开始时保留,并且其位置对伯氨基呈阳性,如在茚三酮喷雾后加热时观察到的那样。在反应完成后、反应混合物样品的 TLC 之后、去除 DIPEA、DMSO 并在氯仿中重新溶解后,在混合物中不再观察到这种茚三酮阳性游离肽点。至于 NHS 酯试剂质量的关键问题, 图 1 显示了分光光度法水解动力学轨迹,反应开始时的零时间点是将有机溶剂中的 NHS 酯添加到比色皿中。这证实了羧基-PEG-DSPE 的 NHS 活性酯的功能(参见方法第 1 节)。在零时间点,外推的 A260=0.33 表示在测试前已经水解的材料。水解反应完成后,超过 10-15 分钟,A260=1.54(当吸光度不再显著增加时)。这证实了活性酯的存在。它还提供了定量数据,表明超过 78% 的材料不是预水解的 NHS,因此可以通过适当调整试剂量成功地用于肽偶联。
脂质物质从水性介质的制备和转移到气泡壳上:荧光脂质
本研究的微泡制备含有微量(低于 1%)的荧光染料 DiI,具有特征性的红色荧光,将其作为 PG 溶液添加到 DSPC 和 PEG 硬脂酸盐水-PG 溶液中。当显微镜中使用绿光激发和红色发射滤光片时,所得微气泡清楚地显示出壳层荧光(参见图 2,左)。微气泡气相的明场显微镜(图 2,右)可以与微气泡壳荧光进行比较。为了定量评估脂质物质从水相到气泡壳的转移,使用离心法漂浮微泡,并在微泡汞齐之前将透明次下清相的荧光信号与初始溶液的荧光进行比较。观察到几乎一个数量级的信号减少(图 3),即超过 85% 的脂质物质通过汞齐转移到微泡壳中。
微泡的制备和尺寸分布校正
汞齐产生的微泡表现出典型的尺寸分布,浓度高(例如,生物素化气泡每 mL ~4.8 x 109 个颗粒)。粒度分布很宽,颗粒存在于测量范围内(1 到 30 μm 之间);~6.3% 的微泡直径超过 5 μm(图 4,绿色曲线)。血管内施用大微泡可能导致它们在毛细血管中的非特异性积累,应避免。在正常重力下对倒置样品瓶进行短时间(15-17 分钟)浮选,随后在隔膜表面附近收集 0.3 mL,可以完全去除较大的微泡,总颗粒数浓度损失很小,低至 ~4.6 x 109:浮选后,纯化样品中只有 0.01% 的颗粒直径超过 5 μm(图 4, 红色曲线)。
微泡与受体包被表面的粘附:静态测定
该程序在上个世纪1 中首次被描述,并被用作确认目标微泡功能的快速测试。允许微气泡接触携带受体的培养皿表面。如果发生配体-受体相互作用,尽管进行了剧烈洗涤,但气泡仍可能保留在表面。提出了一个快速测试c(RGDfK)-微气泡在涂有重组αvβ3 的表面上的功能粘附力的实例。 图 5 是培养皿中受体表面粘附微泡的代表性明场显微镜图像,在用 PBS 洗涤后,去除未结合的气泡。这种类型的显微镜中的气泡表现为深色圆形图案。在类似情况下,如果表面仅涂有白蛋白(以阻止非特异性粘附),微泡不会粘附,即使轻轻冲洗也很容易被冲走。
结合来自流动介质的微气泡:平行板流通室
该程序最初被提议作为在受控流量设置中研究细胞粘附的工具15 ,并适用于几十年后针对微泡的研究11。与静态分析不同,流通系统中的测试对于临床成像场景来说要真实得多,其中血流中循环的气泡会短暂接触血管壁,如果存在目标受体,则可能会粘附在血管壁上。提出了此类研究的两个示例。第一个例子是一种更传统的方法,其中肽修饰的微泡通过视频显微镜监测受体包被表面的粘附。显微镜可以区分粘附的微泡和流动的微泡。它还允许量化显微镜成像框中那些粘附的微泡:与对照相比,更多的 c(RGDfK) 微泡(左列)粘附在表面上,其中使用加扰的 c(RADfK) 肽,或者如果表面仅涂有 BSA(图 6)。
第二个例子是涂有链霉亲和素的培养皿的对比超声成像(图 7,右侧),生物素化微泡从流动介质中成功吸附到该培养皿上,并且可以在用 PBS 冲洗后通过造影超声成像进行检测。对照培养皿表面不会保留流路中任何粘附的微泡,因此基本上所有超声造影剂信号都被 PBS 流路去除。超声造影剂信号量化显示观察到的差异具有很强的统计学意义;目标信号和控制信号的比率超过了一个数量级。
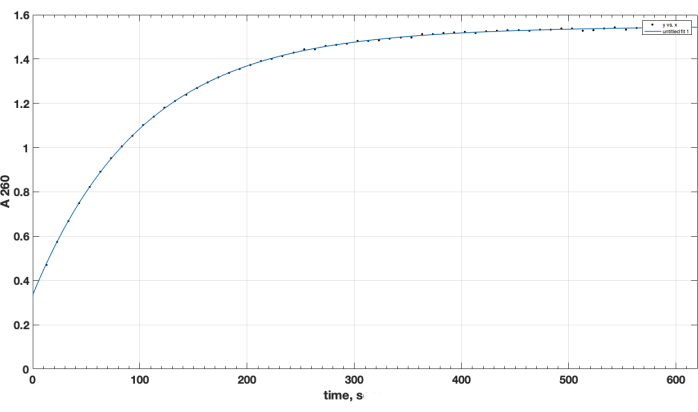
图 1.NHS-PEG-DSPE活性酯的水解动力学,通过在260 nm波长下进行分光光度法测试,通过NHS在碱性介质中的释放观察到。 零时间点是将 NHS-PEG-DSPE 在有机溶剂中加入到 0.1 M 硼酸盐缓冲液(pH 9.2)中的时间。 请单击此处查看此图的较大版本。

图 2.汞齐后充满气体的微泡的显微镜检查。 左图,荧光显微镜检查(绿色激发、红色发射、DiI 脂质壳染料)。右图,明场显微镜(气相观察),相同的放大倍率。框架宽度,85 um(10 μm 载物台千分尺嵌入每个图像的右下角)。 请单击此处查看此图的较大版本。
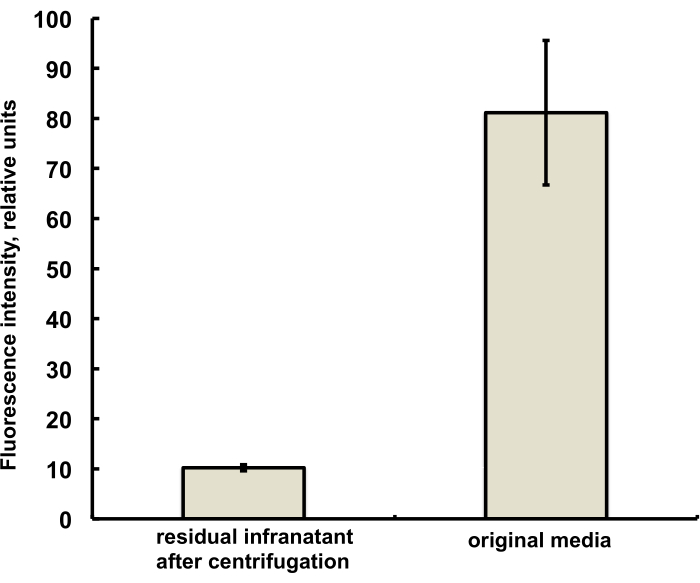
图 3.混汞齐前(右)和混汞齐后通过离心浮选去除微泡(左)的微泡制备培养基中 DiI 脂质染料样品的荧光光谱。 荧光激发 - 555 nm,发射 - 620 nm。数据以平均值±标准差表示。 请单击此处查看此图的较大版本。
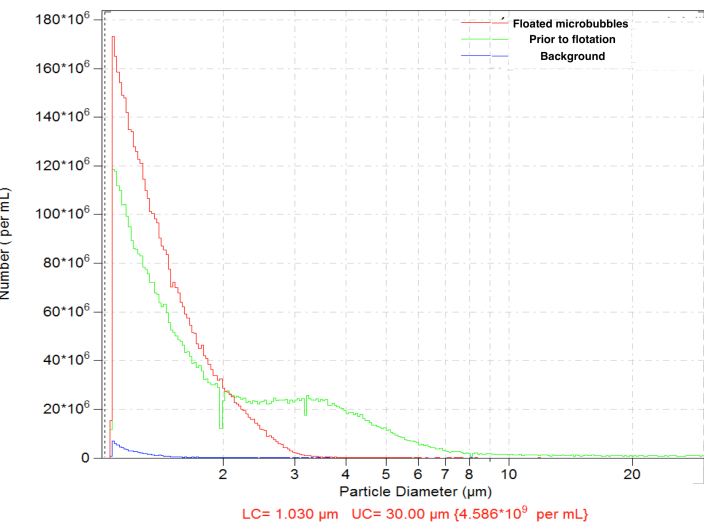
图 4.汞齐制备后微泡数量浓度的粒度分布(绿色),随后正常重力浮选以去除大微泡(红色)和仅稀释剂的背景计数(蓝色)。 电区感应颗粒计数,在 50 μm 盐水孔中。 请单击此处查看此图的较大版本。

图 5.涂有 αvβ3 的培养皿上 c(RGDfK) 微气泡的明场显微镜检查。图像框宽度为 106 μm;巴为 10 μm。请单击此处查看此图的较大版本。

图 6. 在体外 平行板流通室中,将肽修饰的微泡靶向涂有重组 αvβ3. cRGDfK 修饰的微泡有效地粘附在培养皿上(左),对照非靶向 cRADfK(加扰,中)微泡的附着最小 (p<0.00005),微泡在仅白蛋白对照表面的保留也是如此(右,p<0.0025)。腔室流壁剪切应力为 1 dyn/cm2。通过视频显微镜监测微气泡粘附;将显示 Field of View 中的粒子数。累积时间为 4 分钟。数据以平均值±标准差表示。经5 许可转载。版权所有,2018 年,美国化学会。 请单击此处查看此图的较大版本。
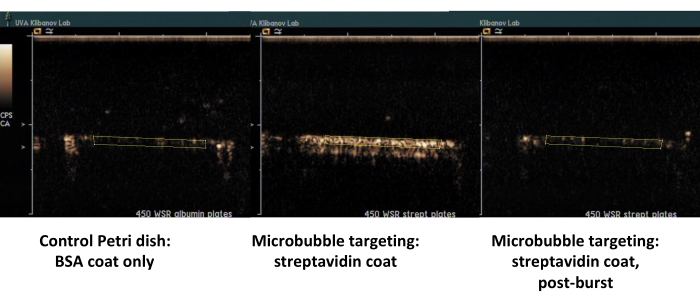
图 7.在涂有链霉亲和素的培养皿上(中间,贴壁靶向微泡,右,同一培养皿,在高 MI 超声爆发后)上对生物素化微泡进行靶向粘附和缓冲冲洗后,平行板流通室的对比超声成像,以及仅涂有白蛋白的对照培养皿(左)。以 450 s-1 剪切速率灌注微泡分散液(PBS/BSA,106 个颗粒/mL)2 分钟,然后冲洗缓冲液。在背景减去后,从视频帧中的感兴趣区域对超声信号进行量化。请单击此处查看此图的较大版本。
讨论
一种简单的技术对于制备配体修饰的微泡的重要性是显而易见的。Unger 等人率先使用汞齐技术制备微泡16 可能出于多种原因达到此目的。用 amalgamator 制造微气泡很容易。市面上提供占用空间小的台式单相 120 V 单元,价格低廉。该程序快速(45 秒)且高效:一次制备 1 mL 微泡分散液在水性介质中。它每毫升含有数十亿个颗粒,足以用于研究。在带有全氟气体顶部空间的密封样品瓶中进行生产。如有必要,样品瓶内容物将从无菌灌装时开始、生产(汞齐)期间一直保持无菌状态,直到使用为止。这使得该方法与临床使用相关,因为它不需要在临床专用的无菌环境中进行精心准备。
该程序基于自组装:在混合过程中,由于对移动小瓶内的气-水界面施加高剪切力,会形成小气体碎片,由于表面张力的作用,这些气体碎片呈球形。PG 作为一种高浓度存在于介质中的助表面活性剂,可降低剪切过程中产生气-水界面所需的表面张力和能量。接下来,更多“经典”表面活性剂,例如 PEG 脂质和磷脂,它们以低得多的浓度存在,到达界面,很可能会取代 PG 并在气泡表面建立单分子层。这个 shell 相当稳定;这可能是由于“固体”脂质(DSPC 相变温度为 56 °C,因此不易发生膜间融合)和扩展的 PEG 刷涂层的组合,该涂层围绕着微泡并抑制相邻气泡的直接单层接触。可以推测,介质中存在高浓度的 PG 可能会降低微气泡壳的稳定性。在没有微气泡的情况下,微气泡在碳氟化合物气氛下在密封的小瓶中稳定数月,气泡之间仅适度融合。对于临床使用,在床边使用小型汞齐器装置,微泡制备和使用之间的间隔可以很短,几分钟或几小时。当 PG 存在于培养基中时,微泡浓度不会明显下降,至少在冷藏储存数小时内是这样。
所述程序的另一个优点(通过在气泡制备培养基中使用 PG 辅助表面活性剂)是将脂质转移到壳中的高效 (>85%),而传统超声处理提供 ~20% 的功效5 和现代微流体方法甚至更低17。高水平的转印效率很重要,不仅因为减少了脂质材料和昂贵配体的浪费,还因为介质中共存的无气泡配体的量也降至最低。然后,游离配体可能没有机会阻断生物标志物靶受体,预计微泡会通过其表面的配体与该受体结合。目标脉管系统上生物标志物受体的一般数量通常相当高,因此这可能不是最重要的。从可用的专利文献18 中,人们可能表明,在临床试验中,微泡制剂中至少 50% 的脂质壳材料和靶向配体可能与气泡壳有关。这通常可以与核医学受体成像研究中广泛使用的放射性标记抗体或肽进行比较:大多数靶向配体分子的抗体实际上并不携带“热”放射性同位素,即使对于报道的最高比活性19,而对于靶向微泡,本研究中的壳材料(包括配体脂质)主要附着在微泡上。
在两组靶向模型中证明了通过该技术制备的目标微泡在体外的选择性粘附:静态粘附和流动室靶向实验。在静态检测中,目标微泡紧密粘附在目标受体层上,并且不会通过缓冲液冲洗脱落,这与在对照环境中不同,在对照环境中,即使轻轻冲洗,微泡也会从表面去除。同样,在平行板流通室中进行的流通测试中,与仅含白蛋白的对照表面相比,生物素化气泡对聚苯乙烯培养皿上的链霉亲和素层表现出统计学显著和极好的粘附力。肽 c(RGDfK) 修饰的微泡选择性地粘附在 αvβ3 包被的表面,无论是在静态粘附测定中,还是在平行板流通室中。
以下问题可以被视为所述协议的限制。首先,该程序没有考虑亚微米颗粒。研究中使用的仪器不是为了检测纳米气泡(即直径小于 1 μm 的颗粒)而设置的。这些颗粒可能存在于配方中。尽管通常已知它们的声学反向散射信号很低,并且在本研究中没有通过显微镜观察到它们,但仍应考虑纳米气泡的存在。第二个重要问题是微泡的大小异质性。尽管去除了较大的颗粒,但产生的气泡的大小远非均匀。这应该是微气泡配方领域进一步研究的考虑因素和理由。
总之,本手稿中给出的叙述应提供足够的技术细节水平,以快速轻松地制造目标微气泡。提供了进行额外纯化(如果需要)、调整大小和/或评估水性培养基中残留的少量壳材料的步骤。描述了用于评估微泡参数的详细分析工具,例如尺寸分布和浓度,以及配体修饰的微泡粘附靶受体的体外能力。
披露声明
A. Klibanov 是 Targeson Inc 的联合创始人和少数股东,该公司是一家临床前靶向微泡领域的初创公司,现已解散。他的 UVA 实验室通过 SoundPipe Therapeutics 的 NIH R44 HL139241签订了一份分包合同。
致谢
A.L. Klibanov 部分通过 NIH R01EB023055 表示支持,该由美国国立卫生研究院国家生物医学成像和生物工程研究所授予,通过 NIH R01NS076726 分包给弗吉尼亚大学,由美国国立卫生研究院国家神经疾病和中风研究所授予 UCSF,以及通过 NIH 赠款R44HL139241分包给弗吉尼亚大学, 美国国家心肺血液研究所授予 SoundPipe Therapeutics。本出版物的内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
参考文献
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
ISSN 2578-2614
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。