Method Article
표적 마이크로버블의 준비 및 특성화
요약
이 프로토콜의 목표는 가스로 채워진 마이크로버블(초음파 분자 이미징을 위한 표적 조영제)을 준비, 정제 및 특성화하는 것입니다. 두 가지 표적 시스템, 즉 스트렙타비딘에 부착된 비오틴화 기포와 알려진 종양 신생 혈관 β3 α 결합하는 고리형 RGD 펩티드 마이크로버블이 설명됩니다.
초록
마이크로버블(분자 이미징을 위한 초음파 조영제)의 표적으로 하는 것은 20년 이상 연구되어 왔습니다. 그러나 마이크로버블 준비 및 표적 리간드 부착 방법은 번거롭고 복잡하며 시간이 오래 걸립니다. 따라서 임상 번역에 더 가까이 다가가기 위해 표적 마이크로버블 준비 절차를 단순화할 필요가 있습니다. 이 간행물의 목적은 표적 마이크로버블 준비, 기능 특성화 및 테스트에 필요한 단계에 대한 자세한 설명과 설명을 제공하는 것입니다. 두 가지 시스템에 대해 최적화되고 단순화된 절차의 순서가 제시됩니다: 비오틴-스트렙타비딘 표적 쌍 모델과 종양 신생혈관 구조의 내피 내벽에서 과발현되는 재조합α vβ3 단백질을 표적으로 하는 고리형 RGD 펩타이드.
여기서, 우리는 다음을 보여줍니다: 표적 리간드와 지질 앵커의 공유 결합, 시약 품질 평가 및 반응의 성공적인 완료를 확인하는 테스트; microbubble shell 성분을 함유하는 수성 전구체 매체의 제조, 이어서 융합을 통한 microbubble 제조; microbubble stabilizer shell에 대한 지질 전달의 효능 평가; 생체 내 사용에 해로울 수 있는 더 큰 미세 기포를 제거하기 위해 정상 중력에서 부유선광에 의한 미세 기포 크기 분포 조정; Electrozone 감지에 의한 미세 기포 크기 분포 평가; 정적 결합 분석 테스트에서 수용체 코팅 표면에 대한 마이크로 버블의 표적 결합 평가(거꾸로 된 접시에서); 및 평행 플레이트 흐름 챔버 테스트에서 수용체 코팅 표면에 대한 마이크로 기포의 표적 결합 평가.
서문
표적 마이크로버블을 사용한 분자 이미징은 20년 이상 동안 연구 및 테스트에 있어 왔습니다. 일반적인 개념은 간단합니다: 질병의 지역에 있는 혈관 내피에 특정한 분자 biomarker에 선택적인 친화력을 소유하는 가스로 채워진 microbubbles는 정맥으로 주사됩니다. 이러한 입자는 표적(예: 종양, 신생혈관 구조 또는 허혈성 염증성 손상 부위)에서 순환하고 축적됩니다. 그런 다음 부착성 미세 기포는 조영제 초음파 영상으로 감지됩니다. 지난 세기부터 시작된 초기 개념 연구 노력 1,2 은 이제 점진적으로 임상 채택을 향해 진행되고 있습니다 : 불과 몇 년 전에 중간 규모의 임상 시험 단계에 도달했습니다 3,4. 이 원고의 목적은 2개의 간행된 예에 근거하여 그런 표적으로 한 microbubbles의 준비 그리고 성격 분석에 상세한 설명을, 제공하기 위한 것입니다 1,5.
이러한 표적 마이크로버블의 제형을 위한 중요한 구성 요소인 펩타이드-PEG-인지질의 제조 절차는 반응의 성공적인 완료에 필요한 시약 품질 관리에 대한 설명으로 보완됩니다. 불행히도 일부 활성 에스테르 지질 시약 공급업체는 도착 시 가수분해되는 물질을 제공하므로 아미드 결합 형성에 참여할 수 없습니다. 마이크로버블 준비 중에 수성 매질에서 마이크로버블 쉘로 얼마나 많은 지질 물질이 전달되는지에 대한 정보와 이 정보를 얻는 기술이 제공됩니다.
상대적으로 좁은 입자 크기 배급을 가진 microbubbles를 준비하는 것이 중요합니다: 생체 내 시험을 위한 주사 가능한 매체에 있는 큰 microbubbles의 동시 존재는 microvasculate의 막기로 이끌어 낼지도 모릅니다; 폐 션트를 우회하는 미세기포의 비특이적 축적은 비특이적 위양성 조직 강화(nonspecific false positive tissue enhancement)6를 유발할 수 있으며, 이는 더 큰 크기의 미세기포를 제거함으로써 피할 수 있습니다. 따라서 입자 크기 선택을 달성하기 위한 간단한 절차가 제시되며, 입자 계수기로 입자 농도 및 크기 분포를 평가하는 방법에 대한 설명이 보완됩니다.
아래에 제시된 바와 같이 마이크로버블 표적화 평가를 위한 첫 번째 테스트 프로토콜은 스트렙타비딘 코팅 표면1을 표적으로 하는 비오틴화된 마이크로버블을 사용하는 순수 모델 시스템을 설명합니다. 두 번째 프로토콜은 종양 신생 혈관 5의 분자 바이오마커인 αvβ3에 대한 특정 친화력을 갖는 고리형 RGD 펩타이드로 장식된 펩타이드 표적 마이크로버블의 단순화된 제조를 설명하는 원고를 기반으로합니다. 제시된 기술에 의해 이 cyclo[Arg-Gly-Asp-D-Phe-Lys], 즉 c(RGDfK) 펩타이드로 장식된 미세 기포는 종양 신생 혈관을 표적으로 하고 쥐 종양 모델에서 초음파 분자 이미징을 달성하는 것으로 나타났습니다.
프로토콜
1. 펩타이드와 NHS-PEG-DSPE의 공유 결합
- c(RGDfK) 펩타이드를 디메틸 설폭사이드(DMSO, 10 mg/mL)에 라이신이 보호되지 않고 커플링에 사용할 수 있는 1차 ε-아미노그룹으로 용해시킵니다. 폴리(에틸렌글리콜)-3400-디스테아로일 포스파티딜에탄올아민(NHS-PEG-DSPE, 200mg/mL)의 N-하이드록시숙신이미드 에스테르의 메탄올 또는 클로로포름 용액을 준비하고 DMSO에 펩타이드 1mg을 첨가합니다. 3μL의 N,N-디이소프로필 에틸아민(DIPEA)을 추가합니다.
- 펩타이드 대 NHS-PEG-DSPE 몰 비율을 최소 1:1.2로 유지하여 모든 1차 아미노산 그룹이 반응할 수 있도록 합니다. DIPEA:펩타이드 몰 비율을 최소 2:1로 유지하여 기본 배지 조건을 보장합니다.
주의 : 클로로포름, 메탄올 및 DIPEA는 위험 물질입니다. 장갑, 실험복, 고글 및 흄 후드와 같은 적절한 보호 장치를 사용하십시오.
참고: c(RGDfK) 대신 1차 아미노산기를 가진 다른 펩타이드 또는 모방체를 사용할 수 있으며, 보호되지 않은 N-말단 또는 결합 부위 외부에 라이신이 있습니다. 반응이 진행되려면 모든 성분(즉, 표적 리간드 및 지질)이 DMSO-클로로포름 혼합물에 용해되어야 합니다. 디메틸포름아미드 또는 그 혼합물과 같은 대체 용매도 테스트할 수 있습니다. 수성 매체에서의 반응도 가능하지만 활성 에스테르의 급격한 가수분해로 인해 커플링 수율이 훨씬 낮아집니다.
- 펩타이드 대 NHS-PEG-DSPE 몰 비율을 최소 1:1.2로 유지하여 모든 1차 아미노산 그룹이 반응할 수 있도록 합니다. DIPEA:펩타이드 몰 비율을 최소 2:1로 유지하여 기본 배지 조건을 보장합니다.
- 실온에서 하룻밤 배양 후 증발로 휘발성 유기 물질을 제거합니다(질소 가스 흐름 또는 회전 증발기를 사용한 다음 고진공 펌프에서 밤새 증발하여 DMSO를 제거). 제어된 샘플링을 위해 비휘발성 잔류물을 클로로포름에 1mg/mL로 재용해합니다.
- 박층 크로마토그래피로 반응 완료를 확인합니다(클로로포름:메탄올 용매 매체, 2:1 v/v에서 TLC 플레이트 현상). 150°C 가열 블록에서 플레이트를 가열할 때 닌히드린 스프레이로 1차 아미노산기의 존재 여부를 확인합니다.
주의 : 닌히드린은 위험 물질입니다. 위에서 설명한 대로 적절한 보호 장치를 사용하십시오. TLC 플레이트의 가열 블록 처리는 흄 후드에서 수행해야 합니다. 가열 블록은 잠재적인 화재 위험이 있습니다. - 마이크로버블 전처리 전에 클로로포름의 펩타이드-PEG-DSPE 샘플(예: 1mg/mL 용액 1mL)을 분취하고, 후속 고진공 펌프 배양으로 질소 가스 흐름에서 클로로포름을 건조하게 증발시키고 식염수를 1mg/mL에 첨가하여 투명한 미셀라 용액을 얻습니다.
- 반응 혼합물의 추가 정제가 바람직한 경우, 생리 식염수에 재용해시킨다. 그런 다음 생성된 미셀 혼합물을 투석(6-8 kDa 분자량 차단 또는 이와 유사한)을 실시하고, 먼저 일반 식염수에 대해 투석한 다음 탈이온수를 여러 번 변경합니다.
- 투석액의 전도도 검사로 투석 완료를 확인합니다. 투석 백에서 투석된 물질을 꺼내 질량이 알려진 바이알에 넣고 완전히 마를 때까지 동결 건조합니다.
참고: PEG-지질의 말단에 리간드를 부착하기 위한 선택적 공유 반응을 사용할 수 있습니다(예: maleimide-PEG-DSPE와 티올-리간드의 반응). 이 접근법의 주요 장점은 리간드 분자 7에서 단일 티올을 사용할 수 있는 경우 배향 결합입니다. 주요 관심사는 장기적인 안정성입니다: maleimide와 thiol 사이의 결과 연결은 저장 조건에 따라 retro-michael 반응에 의해 분해되기 쉬울 수 있습니다 8.
주: 활동적인 에스테르 시약의 질은 제조자에 의하여 매우 다릅니다: 전송과 저장 상태에 달려 있을지도 모릅니다 (물자가 제대로 저장되거나 수송되지 않는 경우에, 활동적인 에스테르는 가수분해하고 펩티드와 결합할 수 없을 것입니다). 결과적으로, 표적 리간드를 마이크로버블에 공유 부착하기 위한 시약인 NHS-PEG-DSPE의 분해 정도를 결정하기 위한 절차(아래 참조)를 설명해야 하는 의무감이 있습니다. 아르곤 아래에 건조 분말로 공급되는 NHS-PEG-DSPE는 급속 냉동 상태로 보관됩니다. 바이알을 실온(수분 응결을 방지하기 위해)으로 가져오고, 분석 저울을 사용하여 샘플의 무게를 측정하고, 메탄올 또는 DMSO에 용해시킵니다. 벌크 건조 시약이 들어 있는 바이알은 아르곤 아래에서 닫고 더 사용할 때까지 건조제가 든 밀봉된 용기에 넣어 급속 냉동 상태로 되돌려 놓아야 합니다. - 펩타이드-PEG-DSPE의 수성 미셀라 용액(단계 1.4)과 비오틴-PEG-DSPE를 수성 식염수에 건조 시약을 간단히 첨가하고 배양하여 준비합니다. 작은 구형 미셀이 형성됩니다. 벌크 상태에서 미셀 형태로의 시약 이동을 가속화하기 위해 초음파 처리 및 온수 수조를 적용할 수 있습니다.
- NHS-PEG-DSPE 활성 에스테르의 시약 품질을 평가합니다.
- 시약에 존재하는 NHS가 활성 에스테르 형태인지 확인하여 아미드 결합 형성과 결합 반응을 수행할 수 있습니다.
- 분광 광도계의 석영 또는 자외선 투명 플라스틱 큐벳(유리 아님)에 0.1M 사붕산나트륨 완충액 0.99mL, pH 9.2를 놓고 260nm 파장에서 영점을 설정합니다.
- 메탄올에 갓 준비한 200mg/mL NHS-PEG-DSPE 용액 10μL를 큐벳에 추가합니다. 동시에 스톱워치를 시작합니다. 균일성을 달성하기 위해 큐벳 함량을 빠르고 격렬하게 혼합합니다. 큐벳을 광도계에 놓고 뚜껑을 닫은 다음 측정을 시작합니다.
- 분광광도계 측정 시작 시 기록 시작 시간을 표시하고 ~10분 동안 또는 흡광도 값이 안정화될 때까지 10초마다 260nm에서 광도 측정 흡광도 측정을 지속적으로 수행합니다.
- kinetic curve를 플롯하고, 초기 A260 시점을 확인하고, 반응 시작 시간으로 곡선을 외삽합니다(즉, 시약이 수성 완충액에 첨가되고 가수분해 반응이 시작된 지점에서 A260 을 찾습니다). 큐벳의 완충액에 NHS-PEG-DSPE를 첨가하기 전에 물 부족으로 인해 유기 용매에서 가수분해가 발생하지 않았다고 가정합니다.
- 반응 시작 시 및 가수분해 완료 시 A260 사이의 비율을 계산합니다. 분해된 활성 에스테르의 분율을 나타냅니다. 이 정보를 사용하여 펩타이드의 1차 아미노기의 완전한 변형을 위한 적절한 양의 NHS-PEG-DSPE를 선택하십시오.
2. 융합에 의한 microbubbles의 준비
- 비오틴화 마이크로버블의 제조
- 프로필렌 글리콜에 디스테아로일 포스파티딜콜린(DSPC)과 PEG 스테아레이트를 동시 용해합니다(PG, 순수 용매에 각각 10mg/mL 농도). 뜨거운 물 목욕을 사용하여 재료를 용해시키십시오.
- 0.85mL의 고온 생리 식염수가 들어 있는 바이알에 이 고온 PG 용액 0.1mL를 첨가하고, 빠르게 혼합한 후 미셀 비오틴-PEG-DSPE(50μL, 식염수 내 1mg/mL)를 DSPC에 대해 1:20 질량 비율로 첨가합니다.
참고: PG에서 지질 성분의 용해도는 온도에 따라 달라지므로 뜨거운 수조가 필요합니다. 지질을 첨가하기 전에 식염수가 들어있는 유리 바이알을 뜨거운 물 수조에서 가열하여 눈에 보이는 입자가 없는 균일한 매체를 만드는 데 도움이 됩니다. - 바이알을 실온으로 가져오고 바이알에 고무 마개를 놓고 중간에 삽입한 다음 바이알에 PTFE 모세관 튜브를 삽입합니다. 데카플루오로부탄 가스의 흐름을 사용하여 바이알을 채운 다음 모세관을 제거하면서 마개를 닫습니다.
참고: 융합 중 바이알의 온도는 생성된 마이크로버블( 9)의 크기 분포에 상당한 영향을 미칠 수 있습니다. - 마개가 있는 바이알을 실온에서 압착하고 융합 장치에 넣습니다. 합병기를 시작합니다. 사용된 임상 장치는 4300초 동안 45rpm에서 작동하도록 사전 설정되어 있습니다.
- 융합이 완료되면 융합기에서 생성된 마이크로버블이 있는 바이알을 제거합니다. 바람직하게는, 마이크로버블 크기 분포 및 조성을 특성화하고 준비 후 몇 시간 이내에 사용하십시오.
- 펩타이드로 장식된 마이크로버블의 제조
- DSPC와 PEG 스테아레이트를 깔끔한 PG(각 재료당 10mg/mL 농도)에 함께 용해합니다. 뜨거운 물 목욕을 사용하여 가용화하십시오. 0.85mL의 고온 생리 식염수가 들어 있는 바이알에 PG의 이 뜨거운 용액 0.1mL를 첨가하고, 빠르게 혼합한 후 미셀 펩타이드-PEG-DSPE(50μL, 식염수 내 1mg/mL)를 DSPC에 1:20 질량비로 첨가합니다.
- 바이알을 실온으로 가져오고 바이알 위에 고무 마개를 놓고 중간에 삽입한 다음 바이알에 폴리테트라플루오로에틸렌(PTFE) 모세관 튜브를 삽입합니다. 데카플루오로부탄 가스의 흐름을 사용하여 바이알을 채운 다음 모세관을 제거하면서 마개를 닫습니다.
- 마개가 있는 바이알을 압착하고 혼합을 위해 융합기에 넣습니다. 마이크로 버블 분산액이 있는 바이알은 45초 안에 준비됩니다.
- 마이크로버블 쉘로의 지질 전달 평가를 위한 염료 지질 마이크로버블의 제조
- 위에서 설명한 대로 DSPC와 PEG 스테아레이트를 깔끔한 PG에 동시 용해합니다(온수 수조 사용)(각 재료당 10mg/mL 농도).
- 이 고온 PG 용액 0.1mL를 고온 생리 식염수 0.89mL가 담긴 바이알에 넣고 빠르게 혼합한 후 DiI 염료 용액 10μL(순수 PG의 경우 1mg/mL)를 첨가하고 혼합합니다. 바이알을 실온에 두십시오.
- 위와 같이 바이알 헤드 공간을 데카플루오로부탄 가스로 채우고 위에서 설명한 대로 바이알을 막고 압착 및 융합합니다.
3. 미셀 수성 매질에서 기포 쉘로의 DiI 지질 전달 테스트
- 형광 지질 물질이 수성 매체에서 마이크로버블 쉘로 이동했음을 현미경으로 확인하기 위해 인슐린 주사기로 바이알에서 격막을 통해 마이크로버블 분취량을 샘플링합니다.
- 그런 다음 유리 슬라이드에 한 방울을 떨어뜨리고 표준 커버 슬립으로 덮습니다. 먼저 가스가 제거된 식염수 한 방울로 희석합니다.
- 형광 에피 조명, 100x 오일 대물렌즈 및 고감도 비디오 카메라가 장착된 비디오 현미경으로 현미경을 수행합니다.
- 융합 중 수성 식염수/PG 매체에서 버블 쉘로 지질 물질이 이동하는 효능을 확인하려면 밀봉된 마이크로버블 바이알을 가져와서 뒤집어 원뿔형 50mL 튜브에 넣습니다.
- 버켓 로터에서 원심분리를 수행합니다(10분, 200 x g). 원심분리기에서 바이알을 제거하고 거꾸로 유지하십시오.
- 인슐린 주사기의 바늘을 거꾸로 된 바이알의 중격에 삽입합니다. 소량(~50μL)의 투명 인프라를 천천히 흡입합니다.
참고: 원심분리 후 거꾸로 된 바이알에서 인프라 흡인을 위한 바늘의 베벨 팁은 미세 기포 흡입 가능성을 최소화하기 위해 가능한 한 격막에 가깝게 위치해야 합니다.
- 인franatant 샘플(2 μL)과 마이크로버블(2 μL)을 생성하는 데 사용된 원래 지질-PG-식염수 배지 샘플을 0.1 mL의 인산염 완충 식염수(PBS)가 있는 96웰 플레이트에 넣습니다.:에탄올 1:1 배지와 1% Triton X-100.
- 형광 마이크로플레이트 리더로 DiI 염료의 적색 형광(555nm 여기, 620nm 방출)을 측정합니다.
- 투명 플레이트에서 문제가 될 수 있는 낮은 배경과 웰 간 신호 전달이 부족하기 때문에 형광 분광법에는 바닥이 투명하지 않은 검은색 플레이트를 사용하십시오.
- 형광 신호가 선형 보정 범위 내에 있는지 확인하십시오: 웰의 과도한 염료 농도는 광 감쇠 및 과소 보고된 신호로 이어질 수 있습니다.
참고: 때때로 융합 후 수성 매질에 남아 있는 잔류 쉘 물질을 제거하는 것이 바람직할 수 있습니다. 이렇게하려면 마이크로 버블 부유 원심 분리 후 거꾸로 된 바이알에서 느린 흡인으로 모든 인프라 부피를 제거하고 탈기 된 생리식염수로 교체하십시오. 액체의 제거 또는 추가로 인한 바이알 내 주변 압력의 과도한 변화를 방지하려면 바이알 내부의 기체 상태에 도달하도록 격막에 긴 바늘을 추가로 삽입하십시오. 바이알 내부의 기체 상태를 유지하려면 먼저 바늘을 플루오로카본 가스로 채워진 주사기에 연결하여 마이크로버블 제제와 공기가 접촉하지 않도록 합니다.
4. Microbubble 크기 분포 조정
- 마이크로 버블의 크기 분포를 조정하기 위해 정적 역 바이알에서 정상 중력 부유선을 사용하여 가장 큰 마이크로 버블을 빠르고 효율적으로 제거합니다 5,10.
- 섹션 2에 설명된 대로 준비 직후 미세 기포 바이알을 복용합니다. 뒤집어서 15-20분 동안 안정적이고 진동이 없는 표면에 거꾸로 놓습니다.
- 이 배양 후, 인슐린 주사기 바늘을 바이알의 격막에 삽입하고 여전히 거꾸로 된 상태에서 하층에서 300-500 μL의 미세 기포를 부드럽게 수집합니다.
참고: 주사기의 바늘은 바이알의 액체 상단 가까이에서 더 큰 기포가 모이는 것을 방지하기 위해 중격 내부 표면 가까이에 있어야 합니다.- 주사기 본체에서 기포의 난기류 및 정수압 팽창을 피하기 위해 주사기 플런저를 천천히 뒤로 당깁니다. 수집된 샘플을 주사기에서 꺼낼 때 기포 붕괴를 방지하기 위해 과압을 피하십시오.
- 주사기에서 소량의 바이알로 미세기포 분산액을 옮깁니다. 그런 다음 과불화 가스, 스토퍼 및 크림프를 채워 단기 보관, 입자 계수(아래 참조) 및 추가 사용을 위해 사용합니다.
- 주사기에서 직접 샘플링을 수행하는 경우 수평으로 유지하고 회전하여 기포 부유선을 방지하고 샘플 균일성을 달성합니다.
5. Microbubble 크기 분포 평가
- 입자 계수기(electrozone sensing 또는 light obscuration 원리 기반)를 사용하여 입자 크기 분포 및 농도를 평가합니다. 또는 혈구계와 현미경을 사용하십시오.
- 간단히 말해서, 카운터 챔버(일반적으로 60-100mL 용량)에서 일반 식염수 또는 이소톤에 마이크로버블 샘플 분취액을 추가하고 계수합니다. 부유 선광 정제 전과 후의 미세 기포 크기 분포를 비교합니다.
알림: 대표적이고 재현 가능한 측정을 달성하기 위해 샘플링 직전에 바이알을 부드럽게 혼합(와류 아님)하십시오. 테스트된 부피의 중앙에서 샘플. - 100mL 비커에 60mL 이상의 0.9% 식염수 희석제를 채우고 s에 놓습니다.tag일렉트로존 전송 기기의 e. 튜브, 외부 전극판 및 교반기가 모두 희석제에 완전히 잠기고 교반기가 회전할 수 있도록 스테이지를 들어 올립니다.
참고: 비커의 희석액 부피는 스케일과 함께 질량을 사용하여 정확하게 측정할 수 있습니다(식염수 밀도는 1에 가까움). 또는 정량 펌프를 사용할 수 있습니다. 일렉트로존 감지 연구 중 전극은 완전히 잠겨야 합니다. - 장치 제어 소프트웨어에서 희석제 전해질 부피를 기록합니다. Electrozone 감지 카운터에는 50μm 오리피스가 장착되어 있어 직경이 1μm에서 30μm 사이의 입자를 측정할 수 있습니다. 먼저 백그라운드 실행을 수행합니다. 0.5mL의 희석제에서 5000개 미만의 카운트가 공백으로 나타날 것으로 예상됩니다. 최상의 배경 수준은 100카운트 미만일 수 있습니다.
- 단위 제어 소프트웨어에서 샘플 부피를 설정하여 희석 계수를 고려합니다. 비커에 10-20 μL의 마이크로 버블 혼합물을 추가하고 두 번째 실행을 수행합니다.
- 소프트웨어 내에서 "subtract background run" 기능을 사용하여 설명할 배경 크기 분포 데이터를 사용합니다. 원래 마이크로버블 샘플의 입자 농도를 입자 수/mL로 얻습니다. 여기에는 희석 계수가 포함됩니다.
- 피펫 팁의 외부 표면은 샘플링 중에 거품으로 덮일 수도 있습니다. 팁을 계수 매체에 삽입하기 전에 반드시 닦아내십시오. 피펫 끝 오리피스를 물티슈로 만지지 마십시오.
- 계수 중 시료 입자의 불충분한 희석을 피하고, 한 번에 두 개 이상의 입자가 센서 오리피스 내에 있는 경우 우연 보정 문제를 최소화하십시오: 그러면 시스템이 입자 농도를 과소평가할 수 있습니다.
참고: 입자 계수를 위한 오리피스 직경은 다를 수 있습니다. 50μm 오리피스를 선택하면 직경이 1μm까지 내려가는 미세 기포를 감지할 수 있지만 더 작은 직경 옵션만큼 막히는 경향이 없습니다. - 실제 테스트에 사용된 것과 동일한 희석제 테스트 매체(예: 멸균 여과된 일반 식염수 세척 용액)에 대해 Electrozone 감지 카운터를 보정합니다. 일렉트로존 감지에 대한 레이저 은폐 대안은 염 농도와 전기 전도성이 제어된 여과된 식염수가 필요하지 않다는 장점이 있습니다.
- 간단히 말해서, 카운터 챔버(일반적으로 60-100mL 용량)에서 일반 식염수 또는 이소톤에 마이크로버블 샘플 분취액을 추가하고 계수합니다. 부유 선광 정제 전과 후의 미세 기포 크기 분포를 비교합니다.
6. 접착/머무름 분석법에서 시험관 내에서 마이크로버블 표적화 테스트
- 페트리 접시에 대한 마이크로버블을 표적으로 하기 위해 바이오마커 수용체 표면을 준비합니다.
- 직경 35mm의 폴리스티렌 접시를 대상 표면으로 사용합니다. 단백질이 생리식염수에서 폴리스티렌 접시 표면에 비특이적으로 접착되는 이점을 활용하십시오. 모델 단백질인 스트렙타비딘(streptavidin)을 사용하여 비오틴-PEG-DSPE를 껍질의 일부로 포함하는 비오틴화된 기포의 표적 검사를 수행합니다.
- 각 페트리 접시의 중앙에 스트렙타비딘 용액(0.2mL, PBS의 10μg/mL) 한 방울을 놓고 접시 표면이 균일하게 코팅될 수 있도록 22mm x 22mm 플라스틱 커버슬립으로 덮습니다. 접시가 마르는 것을 방지하기 위해 밀폐되고 습한 환경에서 4°C에서 하룻밤 배양한 후 커버 슬립을 제거합니다.
- 즉각적이고 철저하게 물, PBS로 플레이트를 세척하고, 코팅되지 않은 표면에 대한 미세 기포의 비특이적 부착을 최소화하기 위해 PBS에서 1.5% 소 혈청 알부민(BSA)으로 최소 4시간 동안 배양하여 차단합니다. 1.5% BSA로 차단된 클린 배양 접시를 대조군으로 사용하십시오.
- 또는 스트렙타비딘 대신 재조합α Vβ3 수용체 용액(예: PBS의 경우 4μg/mL)5 을 사용합니다. 마이크로버블 쉘에 부착된 고리형 RGD 펩타이드 리간드를 통해 이 바이오마커에 대한 마이크로버블을 표적으로 합니다.
- 표적 수용체가 침전된 접시를 젖은 상태로 유지하십시오: 수용체 단백질이 건조되면 비활성화될 수 있습니다.
참고: 배지에 운반체 단백질이나 계면활성제를 포함하지 않는 캐리어가 없는 수용체 단백질을 사용하는 것이 중요합니다 - 이들의 존재는 접착을 비활성화합니다.
- 작은 물방울에 있는 microbubbles의 접착: 정체되는 상태에 있는 표적인 접착을 빨리 검사하십시오.
- 아래에서 거꾸로 뒤집힌 페트리 접시의 대상(또는 제어 BSA 전용) 표면으로 미세 기포 방울(5-20 μL)을 증착합니다. 이것은 부유선광에 의해 기포를 수용체로 코팅된 표면으로 가져올 것입니다.
- 습한 환경에서 거꾸로 된 접시를 5-10분 동안 배양한 후 접시를 다시 정상 위치로 뒤집고 PBS로 채우고 부드럽게 헹궈 자유 미세 기포를 제거합니다. 명시야 현미경을 수행하여 표적 접착력을 평가합니다.
- 페트리 접시 표면에 미세 기포 접착: 전체 접시1에서 표적화를 수행합니다.
- 수용체 표면 코팅이 된 접시를 가져다가 탈기된 PBS-BSA 완충액(35mm 접시의 경우 10mL 이상)으로 완전히 채워 완충액의 반월판이 접시 위로 확장되고 모세혈관의 힘에 의해 유지되도록 합니다. 벌크의 버퍼에 기포(50 μL)를 주입하고 빠르게 혼합하여 균질성을 달성합니다. 혼합하는 동안 기포가 형성되지 않도록 하십시오.
- 투명 포장 테이프 또는 배양 플레이트 밀봉 테이프 조각을 접시 위에 빠르게 놓습니다. 필름을 접시에 압력 밀봉하고 "어셈블리"를 뒤집은 다음 30분 동안 거꾸로 놓아 미세 기포가 위쪽으로 뜨고 대상 표면에 닿고 접착되도록 합니다.
- 밀봉된 접시 "어셈블리"를 다시 "거꾸로" 구성으로 뒤집고 씰을 제거한 다음 탈기된 완충 용액으로 헹궈 접착되지 않는 미세 기포를 씻어냅니다. 현미경 검사 또는 초음파 영상으로 표적 미세 기포를 관찰합니다.
알림: 마이크로 버블 분산액으로 완전히 채워진 거꾸로 밀봉된 접시를 배양할 때 약간의 각도로 배치할 수 있으므로 큰 기포가 있으면 관심 중앙 영역 외부의 접시 가장자리로 떠오릅니다. 현미경 검사 중 마이크로피펫 팁에서 나오는 빠른 흐름으로 강제 헹굼을 사용하여 기포가 표적에 얼마나 단단히 부착되는지 평가할 수 있습니다(기포는 느린 흐름에서도 제어 표면에서 완전히 분리됨) 11. 탈기된 완충액은 기포 희석에 바람직한데, 용존 공기가 과도하게 생성되면 미세 기포가 제어되지 않게 성장하기 때문입니다.
7. 시험관 내 마이크로버블 표적화 테스트: 평행 플레이트 플로우 챔버에서 동적 접착/머무름 분석 평가
참고: 초음파 이미징을 통해 비오틴화된 기포와 스트렙타비딘 층의 접착력을 테스트합니다.
- 맞춤형 인버터 홀더가 있는 시중에서 판매되는 병렬 플레이트 플로우 챔버를 사용하여 유동 매체에서 35mm 페트리 접시에 대한 표적 접착력을 관찰합니다. 대상 단백질을 접시에 흡착한 후(6.1.1 참조) 가스켓이 사전 설치된 챔버 본체를 접시에 삽입하고 홀더에 밀봉합니다. 채널 높이(즉, 개스킷 두께)가 0.127mm이고 채널 너비가 2.5mm인 개스킷을 사용하십시오.
참고: 평행판 흐름 챔버를 조립하는 동안 개스킷에 사용되는 실리콘 그리스의 양은 최소화되어야 합니다. 채널 영역에 그리스가 들어가지 않도록 하십시오: 바이오마커 단백질로 코팅된 표면을 그리스로 덮지 마십시오. 적절한 밀봉을 위해서는 35mm 접시를 조심스럽게 선택하십시오(챔버 및 접시 정보는 재료 표 참조). - 흐름 챔버 어셈블리의 경우 누출을 방지하기 위해 접시 흐름 챔버 조합을 고정하는 캡과 프레임을 너무 세게 조이지 마십시오.
- 플로우 튜빙을 인출 모드로 작동하는 주사기 펌프에 연결하고, 피더 측에서 얇은 폴리에틸렌 튜빙(PE50)을 희석된 마이크로 버블 분산액으로 바이알에 연결하고 자석 교반기12를 통해 교반 막대와 지속적으로 혼합합니다. 공식 6Q/bh2에 따라 펌프 체적 유량을 조정하여 챔버의 WSR(Wall Shear Rate) 매개변수를 제어하며, 여기서 Q 는 유량, 'b'는 채널의 너비, 'h'는 채널의 높이입니다.
참고: 채널을 통과하는 기포는 대상 표면에서 부착된 미세 기포를 제거하고 실험을 무효화하므로 마이크로 버블 함유 매체 또는 PBS를 관류하기 전에 전체 시스템에서 기포를 제거합니다. 플로우 챔버 튜브와 주사기 사이의 연결은 적절하게 밀봉되어야 합니다. - 계산된 부피의 농축된 기포를 미세기포 저장소(20mL 섬광 바이알)에 추가하여 0.1% BSA의 PBS 완충액에서 106 마이크로버블/mL의 농도를 달성하여 미세버블 분산액을 준비합니다. 피더 저장소를 마그네틱 플레이트 교반기에 놓습니다. 1cm x 2cm 마그네틱 교반 막대를 삽입하고 ~400RPM으로 저어주어 연구 과정에서 균질성을 유지합니다.
- 물탱크13 내의 유동 챔버에 대한 초음파 이미징을 수행합니다.
- 플로우 챔버 어셈블리를 탈기된 물에 담그고 실험 중 움직임을 방지하기 위해 무게로 제자리에 고정합니다.
- 이미징 프로브를 놓습니다.amp채널 바로 위에 놓고 뒤쪽으로 15° 각도로, 시계 방향으로 5° 각도로 기울여 접시 표면의 정반사를 최소화합니다. 이미징 평면 내에 플로우 챔버 채널을 배치합니다.
- 다음 이미징 조건을 사용하십시오: 15L8 변환기, 콘트라스트별 이미징 모드, 동적 범위 50dB, 7MHz, 기계적 인덱스(MI) = 0.18, CPS 게인 = 0. 시간 이득 보정을 전체 이미지에서 균일하게 유지합니다.
- 변환기 면이 깊이 잠기지 않고 물 표면에 닿도록 놓습니다. 또는 초음파 젤로 채워진 고무 보호 슬리브를 사용하십시오.
참고: 이미징을 위한 플로우 챔버 시스템의 재현 가능한 위치를 보장하려면 마커를 물통 또는 초음파 시스템 화면에 배치해야 합니다.
- 저장소에서 챔버를 통해 펌프로 2분 동안 미세 기포 분산액을 끌어옵니다.
- 흐름을 PBS로 전환하여 채널에서 비접착성 기포를 제거하고 나머지 점착성(대상) 기포의 음향 후방 산란을 평가합니다. 배경 이미지를 얻으려면 MI를 1.9로 높여 초음파 이미징 시야에서 부착된 기포를 파괴합니다.
참고: 미세 기포 분산은 반복 실행을 위해 교체해야 합니다: 높은 희석에서, 미세 기포는 시간이 지남에 따라 점차적으로 분해됩니다.
- 흐름을 PBS로 전환하여 채널에서 비접착성 기포를 제거하고 나머지 점착성(대상) 기포의 음향 후방 산란을 평가합니다. 배경 이미지를 얻으려면 MI를 1.9로 높여 초음파 이미징 시야에서 부착된 기포를 파괴합니다.
- 화면 녹화 비디오 스트림에서 개별 이미지를 내보냅니다: PBS 플러싱 전, 플러시 후, 파괴 후, 오프라인 분석을 위해 ImageJ로 가져옵니다. 관심 영역(ROI)을 선택하여 챔버의 입구 및 출구 부분을 제외합니다. 배경 ROI 신호를 뺀 후 에코 강도를 ROI 내의 평균 픽셀 강도로 정량화합니다.
참고: 초음파 이미징의 대안으로, 거꾸로 된 홀더의 평행판 흐름 챔버 어셈블리를 복합 현미경의 스테이지에 배치할 때 비디오 현미경으로 대상 표면에 대한 미세 기포의 접착을 관찰할 수 있습니다.tag비디오 녹화 5,11,12,14. 이는 조직 배양 접시에서 수용체 발현 세포가 성장하고 각 표적 세포에 결합된 미세 기포의 수를 직접 계산할 수 있을 때 세포 배양에서 세포 표면 바이오마커 수용체에 대한 마이크로버블의 표적 접착을 이미징하는 데 특히 유용합니다.
결과
펩타이드와 지질의 공유 결합
반응 완료 및 원하는 생성물 형성은 TLC에 의해 확인되었습니다. 별도의 미반응 펩타이드 대조군은 TLC 동안 상향 이동하지 않았습니다: 처음에는 유지되었으며, 그 반점은 닌히드린 분무 후 가열 시 관찰된 바와 같이 1차 아미노 그룹에 대해 양성이었습니다. 이 닌히드린 양성 유리 펩타이드 반점은 DIPEA, DMSO를 제거하고 클로로포름에서 재용해한 후 반응 혼합물 샘플의 TLC에 따라 반응 완료 후 혼합물에서 더 이상 관찰되지 않았습니다. NHS 에스테르 시약 품질의 중요한 문제와 관련하여 그림 1 은 가수분해 역학의 분광 광도계 추적을 보여주며, 반응 시작 시 0 시점은 유기 용매의 NHS 에스테르가 큐벳에 첨가되었을 때입니다. 이것은 carboxy-PEG-DSPE의 NHS 활성 에스테르의 기능을 확인합니다(방법 섹션 1 참조). 제로 시점에서 외삽된 A260=0.33은 테스트 전에 이미 가수분해된 재료를 나타냅니다. 가수분해 반응이 완료되면 10-15분을 초과하여 A260=1.54(흡광도가 더 이상 상당히 증가하지 않는 경우). 이것은 활성 에스테르의 존재를 확인합니다. 또한 물질의 78% 이상이 사전 가수분해된 NHS가 아니므로 시약 양의 적절한 조정으로 펩타이드 결합에 성공적으로 사용할 수 있는 정량적 데이터를 제공합니다.
수성 매체에서 기포 껍질로 지질 물질의 준비 및 이동: 형광 지질
본 연구를 위한 마이크로버블은 DSPC 및 PEG 스테아레이트의 식염수-PG 용액에 PG 용액으로 첨가된 특징적인 적색 형광을 가진 형광 염료 DiI의 미량(1% 미만)을 함유하도록 제조되었습니다. 그 결과로 생긴 마이크로버블은 현미경에서 녹색 광 여기(green light excitation)와 적색 방출 필터(red emission filter)를 사용할 때 쉘 형광(shell fluorescence)을 명확하게 보여줍니다(그림 2, 왼쪽 참조). 마이크로버블 기체 상태의 명시야 현미경(그림 2, 오른쪽)을 마이크로버블 쉘 형광과 비교할 수 있습니다. 수성상으로부터 버블 쉘로의 지질 물질 이동의 정량적 평가를 위해, 마이크로버블은 원심분리를 이용하여 부유하고, 명백한 인프라탕 상의 형광 신호를 마이크로버블 융합 이전에 초기 용액의 형광과 비교하였습니다. 거의 한 자릿수의 신호 감소가 관찰되었는데(그림 3), 즉, 지질 물질의 85% 이상이 융합에 의해 마이크로버블 쉘로 이동했습니다.
microbubbles의 준비 그리고 크기 배급 개정
융합에 의해 생성된 마이크로버블은 높은 농도(예: 비오틴화된 기포의 경우 mL당 ~4.8 x 109 입자)로 일반적인 크기 분포를 보여주었습니다. 크기 분포는 넓었고 측정 된 범위 (1에서 30 μm 사이) 내에 입자가 존재했습니다. ~6.3% 미세 기포는 직경이 5μm를 초과합니다(그림 4, 녹색 곡선). 큰 마이크로버블의 혈관 내 투여는 혈액 모세혈관에 비특이적으로 축적될 수 있으므로 피해야 합니다. 정상 중력에서 거꾸로 된 바이알을 짧게(15-17분) 부유선광하고 이후 격막 표면 가까이에서 0.3mL를 수집하면 총 입자수 농도가 ~4.6 x 10까지 약간 감소하면서 더 큰 미세 기포를 완전히 제거할 수 있습니다.9: 부유선광 후 정제된 샘플의 입자 중 0.01%만이 직경이 5μm 이상입니다(그림 4, 빨간색 곡선).
수용체 코팅 표면에 대한 마이크로 기포의 접착: 정적 분석
이 절차는 이전 세기1에서 처음으로 기술되고, 표적으로 한 microbubbles의 기능을 확인하는 빠른 시험으로 사용되고 있습니다. 마이크로버블은 수용체를 운반하는 접시 표면에 접촉할 수 있습니다. 리간드-수용체 상호작용이 일어나면, 격렬한 세척에도 불구하고 표면에 기포가 남아 있을 수 있습니다. 재조합 αvβ 3로 코팅된 표면에 c(RGDfK)-microbubbles의 기능적 접착력에 대한 이러한 빠른 테스트의 예가 제시됩니다. 그림 5는 PBS로 세척한 후 결합되지 않은 기포를 제거하기 위해 페트리 접시의 수용체 표면에 부착된 미세 기포의 대표적인 명시야 현미경 이미지입니다. 이러한 유형의 현미경 검사에서 기포는 어두운 원형 패턴으로 나타납니다. 유사한 상태에서, 표면이 알부민으로만 코팅된 경우(비특이적 접착을 차단하기 위해), 미세 기포가 부착되지 않고 부드러운 헹굼으로도 쉽게 씻겨 나갈 것입니다.
유동 매체로부터 미세 기포의 결합: 평행판 흐름 챔버
이 절차는 통제된 교류 조정 15에 있는 세포 접착의 연구 결과를 위한 공구로 처음에 제안되고11 후에 표적으로 하는 microbubble의 연구 결과를 위해 적응되었다. 플로우 스루(flow-through) 시스템에서의 검사는 정적 분석과 달리 혈액 흐름의 순환 기포가 혈관 벽에 잠시 닿고 표적 수용체가 있는 경우 혈관 벽에 달라붙을 수 있는 임상 이미징 시나리오에서 훨씬 더 현실적입니다. 그러한 연구의 두 가지 예가 제시됩니다. 첫 번째 예는 보다 전통적인 접근 방식으로, 수용체 코팅 표면에 펩타이드로 장식된 미세 기포의 접착을 비디오 현미경으로 모니터링합니다. 현미경 검사는 유동하는 그들에 의하여 접착성 microbubbles를 구별할 수 있습니다. 그것은 또한 현미경 화상 진찰 구조에 있는 그 부착성 microbubbles를 정량하는 것을 허용합니다: 더 많은 c (RGDfK) microbubbles (좌 란)는, 뒤섞인 c (RADfK) 펩티드가 이용되는 통제와 비교될 때, 또는 표면이 BSA (숫자 6)로서만 입힌 경우에, 표면에 고착합니다.
두 번째 예는 스트렙타비딘(그림 7, 오른쪽)으로 코팅된 페트리 접시의 조영제 초음파 영상으로, 비오틴화된 마이크로버블이 유동 매체에서 성공적으로 흡착되며, PBS와 플러시한 후 조영제 초음파 영상으로 검출할 수 있습니다. 제어 접시 표면은 흐름에서 부착 된 미세 기포를 유지하지 않으므로 기본적으로 모든 초음파 대비 신호는 PBS 흐름으로 제거됩니다. 초음파 조영제 신호 정량화는 관찰된 차이의 강력한 통계적 유의성을 보여줍니다. 표적 신호와 제어 신호의 비율이 한 자릿수를 초과했습니다.
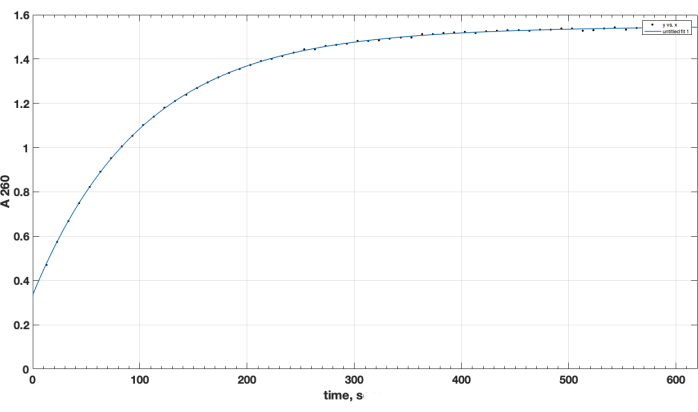
그림 1. 260nm 파장에서 분광 광도법 테스트에 의해 알칼리 매질에서 NHS 방출에 의해 관찰된 NHS-PEG-DSPE 활성 에스테르의 가수분해 동역학. 제로 시점은 0.1M 붕산염 완충액, pH 9.2에 유기 용매의 NHS-PEG-DSPE를 첨가한 시간입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 융합 후 가스로 채워진 마이크로버블의 현미경 검사. 왼쪽, 형광 현미경 (녹색 여기, 적색 방출, DiI 지질 껍질 염료). 오른쪽, 명시야 현미경(기체 상태 관찰), 동일한 배율. 프레임 너비, 85um(각 이미지의 오른쪽 하단에 포함된 10μm 스테이지 마이크로미터). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
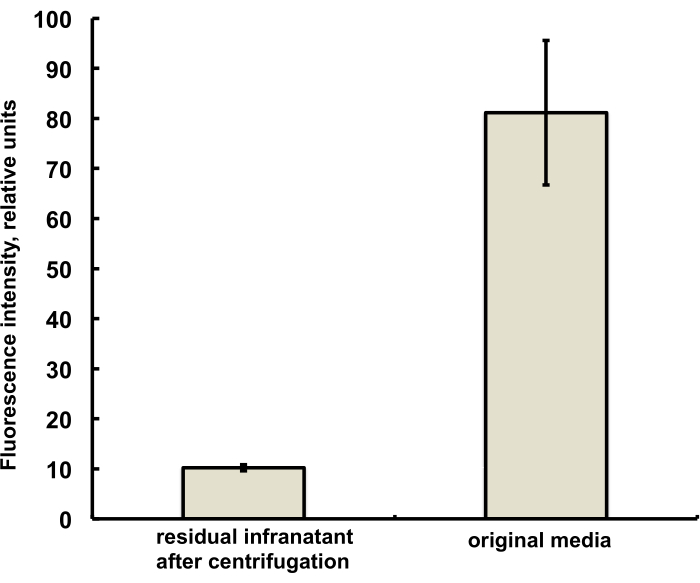
그림 3. 혼합(오른쪽) 전(오른쪽)과 원심 부유선광에 의한 미세 기포의 융합 및 제거 후(왼쪽)에 의한 마이크로 버블 준비 배지의 DiI 지질 염료 샘플의 형광 분광법. 형광 여기 - 555nm, 방출 - 620nm. 평균 ± 표준 편차로 표시되는 데이터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
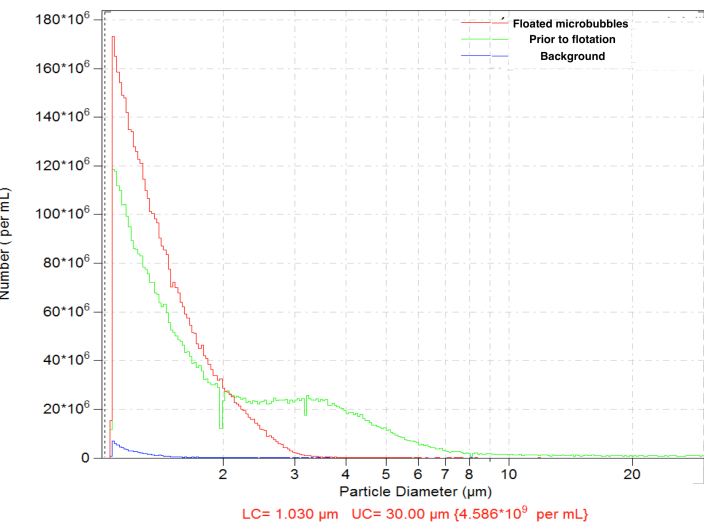
그림 4. 합병 준비(녹색) 후 미세기포 수 농도의 입자 크기 분포, 큰 미세기포(빨간색) 및 희석제 전용 백그라운드 수(파란색) 제거를 위한 후속 정상 중력 부유선광. 생리식염수, 50μm 오리피스에서 입자 계수를 감지하는 Electrozone. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. αvβ로 코팅된 접시의 c(RGDfK)-마이크로버블의 명시야 현미경 검사. 이미지 프레임 너비는 106 μm이고 막대는 10 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6. 재조합 αvβ로 코팅된 표면에 펩타이드로 장식된 마이크로버블을 표적으로 하는 시험관 내 병렬 플레이트 플로우 챔버 3. cRGDfK로 장식된 마이크로버블이 접시에 효율적으로 부착되었고(왼쪽), 대조군 비표적 cRADfK(스크램블, 중앙) 마이크로버블의 부착은 최소(p<0.00005)였으며, 알부민 전용 대조 표면(오른쪽, p<0.0025)에서 미세버블 머무름도 마찬가지였습니다. 챔버 흐름 벽 전단 응력 1 dyn/ cm 2. 비디오 현미경으로 모니터링되는 미세 기포 접착; field of view에 있는 입자의 수가 표시됩니다. 누적 시간은 4분입니다. 평균 ± 표준 편차로 표시되는 데이터. 5의 허락을 받아 재인쇄했습니다. 저작권, 2018, 미국 화학 학회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
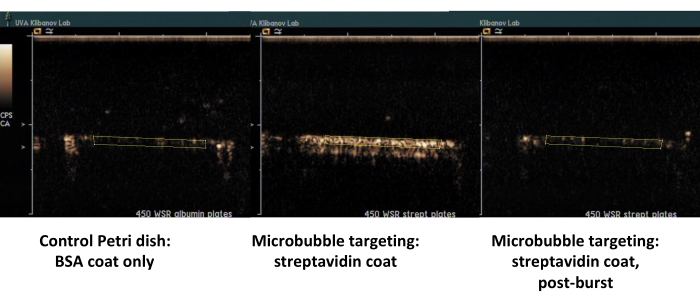
그림 7. 스트렙타비딘으로 코팅된 접시에서 비오틴화된 미세기포의 표적 접착 및 완충액 플러시 후 병렬 플레이트 흐름 챔버의 조영제 초음파 영상(가운데, 고-MI 초음파 폭발 후 동일한 접시, 오른쪽, 동일한 접시) 및 알부민으로만 코팅된 대조 접시(왼쪽). 450 s-1 전단 속도에서 마이크로 버블 분산액(PBS/BSA, 106 입자/mL)을 2분 동안 관류한 후 완충액 플러시. 초음파 신호의 정량화는 배경 빼기 후 비디오 프레임의 관심 영역에서 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
리간드 장식된 microbubbles의 준비를 위한 간단한 기술의 중요성은 명백합니다. Unger et al.16 이 개척한 바와 같이 마이크로버블 준비를 위한 융합 기술의 사용은 여러 가지 이유로 이러한 목적에 기여할 수 있습니다. 합병기에 의한 microbubbles의 제조는 수행하기 쉽습니다. 설치 공간이 작은 데스크탑 단상 120V 장치를 사용할 수 있으며 저렴합니다. 절차는 빠르고(45초) 효율적입니다: 수성 매질에서 1mL의 마이크로버블 분산액이 한 번에 준비됩니다. 여기에는 mL당 수십억 개의 입자가 포함되어 있어 연구 연구에 충분합니다. 제조는 과불화 가스 헤드스페이스가 있는 밀봉된 바이알에서 이루어집니다. 필요한 경우, 바이알 내용물은 무균 충전 시점부터, 제조(합병) 중, 그리고 사용할 때까지 멸균 상태로 유지됩니다. 따라서 이 접근 방식은 임상의 전용 멸균 환경에서 정교한 준비가 필요하지 않기 때문에 임상적 사용과 관련이 있습니다.
이 절차는 자체 조립을 기반으로 합니다: 혼합하는 동안 움직이는 바이알 내의 가스-물 계면에 높은 전단력이 적용됨에 따라 표면 장력의 작용으로 인해 구형을 취하는 작은 가스 조각이 형성됩니다. PG는 고농도로 매체에 존재하는 계면활성제로서 전단 중 가스-물 계면을 생성하는 데 필요한 표면 장력과 에너지를 감소시킵니다. 다음으로, 훨씬 낮은 농도로 존재하는 PEG-지질 및 인지질과 같은 보다 "고전적인" 계면활성제는 계면에 도달하여 PG를 대체하고 기포 표면에 단분자 층을 형성할 가능성이 높습니다. 이 쉘은 상당히 안정적입니다. 이는 "고체" 지질(DSPC 상전이 온도가 56°C이므로 막간 융합이 잘 되지 않음)과 미세 기포를 둘러싸고 주변 기포의 직접적인 단층 접촉을 억제하는 확장된 PEG 브러시 코트의 조합 때문일 수 있습니다. 매체에 고농도의 PG가 존재하면 마이크로 버블 쉘 안정성이 저하 될 수 있다고 추측 할 수 있습니다. 그것의 결핍에서는, microbubbles는 거품 사이에서만 온건한 융해와 더불어 플루오로카본 대기권의 밑에 수 달 동안 밀봉한 작은 유리병에서 안정되어 있습니다. 임상적 사용의 경우, 침대 곁에 소형 융합 장치를 설치하면 마이크로 버블 준비와 사용 사이의 간격이 몇 분 또는 몇 시간으로 짧을 수 있습니다. 매체에 PG가 존재하면 마이크로 버블 농도가 적어도 몇 시간의 냉장 보관 기간 동안 크게 떨어지지 않습니다.
설명 된 절차의 추가 이점 (거품 준비 배지에서 PG cosurfactant의 사용에 의해 도움)은 껍질로의 지질 전달의 높은 효율 (>85 %)이며, 전통적인 초음파 처리는 ~ 20 %의 효능을 제공하고5 및 현대 미세 유체 방법은 훨씬 더 낮습니다17. 높은 수준의 전달 효율은 지질 물질과 값비싼 리간드의 낭비가 감소할 뿐만 아니라 배지에 함께 존재하는 기포가 없는 리간드의 양이 최소화되기 때문에 중요합니다. 그런 다음 자유 리간드는 미세 기포가 표면의 리간드를 통해 결합할 것으로 예상되는 바이오마커 표적 수용체를 차단할 기회가 없을 수 있습니다. 표적 혈관 구조에 있는 바이오마커 수용체의 일반적인 양은 종종 상당히 높기 때문에 이것이 가장 중요하지 않을 수 있습니다. 입수가능한 특허 문헌18 로부터, 임상 시험에서 마이크로버블 제형에 있는 지질 껍질 물질 및 표적 리간드의 최소 50%가 거품 껍질과 관련될 수 있다고 제안할 수 있다. 이것은 핵의학 수용체 화상 진찰 학문에서 널리 이용되는 방사선 표지한 항체 또는 펩티드와 일반적으로 비교될 수 있습니다: 표적으로 한 microbubbles를 위해, 이 학문에 있는 포탄 물자 (를 포함하여 리간드 지질)는 microbubbles에 주로 붙어 있는반면, 리간드 분자를 표적으로 하는 그들 표적으로 하는 리간드 분자의 대부분은 실제로 보고된 가장 높은 특정한 활동을 위해 조차 "뜨거운" radioisotope를 나르지 않습니다.
이 기술에 의해 시험관 내에서 제조된 표적 마이크로버블의 선택적 접착은 두 세트의 표적 모델: 정적 접착 및 플로우 챔버 표적 실험에서 입증되었습니다. 정적 분석실험에서, 표적 마이크로버블은 타겟 수용체 층에 단단히 부착되어 부드러운 헹굼으로도 표면에서 마이크로버블이 제거된 대조군 설정과 달리 완충 린스로 제거되지 않았습니다. 마찬가지로, 평행 플레이트 유동 챔버에서 수행된 플로우 스루 테스트에서 비오틴화된 기포는 대조군 알부민 전용 표면과 비교할 때 폴리스티렌 접시의 스트렙타비딘 층에 통계적으로 유의미하고 탁월한 접착력을 보여주었습니다. 펩타이드 c(RGDfK) 장식된 마이크로버블은 정적 접착 분석법과 평행 플레이트 흐름 챔버 모두에서 αvβ3 코팅 표면에 선택적으로 부착되었습니다.
다음 문제는 설명된 프로토콜의 제한 사항으로 간주될 수 있습니다. 첫째, 이 절차는 서브미크론 입자를 고려하지 않습니다. 연구에 사용된 기기는 나노 버블(즉, 직경 1μm 미만의 입자)을 감지하도록 설정되지 않았습니다. 이러한 입자는 제형에 존재했을 수 있습니다. 그들의 청각적인 후방 산란 신호는 일반적으로 낮기 위하여 알려져 있고, 현미경 검사법으로 이 학문에서 관찰되지 않았더라도, nanobubbles의 존재는 아직도 고려되어야 합니다. 두 번째 중요한 문제는 미세 기포의 크기 이질성입니다. 더 큰 입자를 제거했음에도 불구하고 결과 기포의 크기는 균일하지 않습니다. 이것은 마이크로 버블 배합 분야의 추가 연구를 위한 고려 사항이자 정당화되어야 합니다.
결론적으로, 이 원고에 주어진 설명은 표적 마이크로버블을 빠르고 쉽게 제조할 수 있는 충분한 수준의 기술적 세부 사항을 제공해야 합니다. 추가적인 정제를 수행하고(바람직한 경우), 크기를 조정하거나 및/또는 수성 매체에 남아 있는 소량의 쉘 물질을 평가하는 단계가 제공된다. 크기 배급 및 농도와 같은 microbubble 모수의 평가를 위한 상세한 분석적인 공구, 및 표적 수용체에 고착하는 리간드 장식한 microbubbles의 시험관 내 능력은 기술됩니다.
공개
A. Klibanov는 현재 해산된 전임상 표적 마이크로버블 분야의 신생 기업인 Targeson Inc의 공동 창립자이자 소액 주주입니다. 그의 UVA 실험실은 NIH R44를 통해 SoundPipe Therapeutics의 HL139241 하청을 받았습니다.
감사의 말
A.L. Klibanov는 미국 국립보건원(National Institutes of Health)의 국립 생물의학 이미징 및 생명공학 연구소(National Institute of Biomedical Imaging and Bioengineering)가 수여한 NIH R01EB023055, NIH R01NS076726를 통해 버지니아 대학교(University of Virginia)에 하도급을 주고, 미국 국립보건원(National Institutes of Health)의 국립 신경 장애 및 뇌졸중 연구소(National Institute of Neurological Disorders and Stroke)가 UCSF에 수여한 하도급, NIH 보조금 R44HL139241를 통해 버지니아 대학교(University of Virginia)에 하청을 준 것에 대해 부분적으로 감사를 표합니다. 국립 심장, 폐 및 혈액 연구소(National Heart, Lung, and Blood Institute)에서 SoundPipe Therapeutics에 수여. 이 간행물의 내용은 전적으로 저자의 책임이며 반드시 미국 국립보건원(National Institutes of Health)의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
참고문헌
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, Suppl 1 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , US Patent 5,585,112 (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , US Patent 5,686,060A (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유