Method Article
Préparation et caractérisation de microbulles ciblées
Dans cet article
Résumé
L’objectif de ce protocole est de préparer, purifier et caractériser des microbulles remplies de gaz (agents de contraste ciblés pour l’imagerie moléculaire par ultrasons). Deux systèmes de ciblage sont décrits : des bulles biotinylées adhérentes à la streptavidine, et des microbulles peptidiques cycliques RGD qui se lient à αv β3, un biomarqueur connu de la néo-ovasculature tumorale.
Résumé
Le ciblage des microbulles (agents de contraste à ultrasons pour l’imagerie moléculaire) fait l’objet de recherches depuis plus de deux décennies. Cependant, les méthodes de préparation des microbulles et de ciblage de la fixation des ligands sont lourdes, compliquées et longues. Par conséquent, il est nécessaire de simplifier la procédure de préparation ciblée des microbulles pour la rapprocher de la traduction clinique. L’objectif de cette publication est de fournir une description détaillée et une explication des étapes nécessaires à la préparation ciblée des microbulles, à la caractérisation fonctionnelle et aux essais. Une séquence des procédures optimisées et simplifiées est présentée pour deux systèmes : un modèle de paire ciblant la biotine-streptavidine, et un peptide RGD cyclique ciblant la protéine recombinante αv β3, qui est surexprimée sur la muqueuse endothéliale de la néo-ovasculature tumorale.
Ici, nous montrons ce qui suit : couplage covalent du ligand de ciblage à une ancre lipidique, évaluation de la qualité du réactif et tests qui confirment la réussite de la réaction ; préparation du milieu précurseur aqueux contenant des composants de l’enveloppe des microbulles, suivie de la préparation des microbulles par amalgamation ; évaluation de l’efficacité du transfert de lipides sur la coquille du stabilisateur de microbulles ; ajustement de la distribution de la taille des microbulles par flottation à gravité normale pour éliminer les microbulles plus grosses qui pourraient être préjudiciables à l’utilisation in vivo ; évaluation de la distribution de la taille des microbulles par détection électrozone ; évaluation de la liaison ciblée des microbulles à la surface recouverte d’un récepteur dans un test de dosage de liaison statique (dans une boîte inversée) ; et l’évaluation de la liaison ciblée des microbulles à la surface recouverte d’un récepteur dans un essai en chambre d’écoulement sur plaques parallèles.
Introduction
L’imagerie moléculaire avec des microbulles ciblées fait l’objet de recherches et d’essais depuis plus de deux décennies. Le concept général est simple : des microbulles remplies de gaz qui possèdent une affinité sélective pour le biomarqueur moléculaire spécifique de l’endothélium vasculaire dans la zone de la maladie sont injectées par voie intraveineuse. Ces particules circulent et s’accumulent dans la cible (par exemple, la tumeur, le néo-système ou la zone de lésion inflammatoire ischémique). Les microbulles adhérentes sont ensuite détectées par imagerie par ultrasons de contraste. Les premiers efforts de recherche conceptuelle du siècle dernier 1,2 progressent maintenant progressivement vers l’adoption clinique : ils ont atteint le stade des essais cliniques à moyenne échelle il y a quelques années seulement 3,4. Le but de ce manuscrit est de fournir une explication détaillée de la préparation et de la caractérisation de ces microbulles ciblées, sur la base de deux exemples publiés 1,5.
La procédure de préparation du peptide-PEG-phospholipide, un composant crucial pour la formulation de ces microbulles ciblées, est complétée par la description du contrôle de la qualité du réactif, comme requis pour la réussite de la réaction. Malheureusement, certains fournisseurs de réactifs lipidiques à base d’esters actifs fournissent un matériau qui est hydrolysé à l’arrivée et qui ne peut donc pas participer à la formation de la liaison amide. L’information sur la quantité de matière lipidique transférée sur la coquille de la microbulle à partir du milieu aqueux pendant la préparation des microbulles est fournie, ainsi que la technique permettant d’obtenir cette information.
Il est important de préparer des microbulles avec une distribution granulométrique relativement étroite : la coprésence de grosses microbulles dans les milieux injectables pour les essais intravasculaires in vivo peut entraîner un colmatage de la microvascularisation ; L’accumulation non spécifique de microbulles qui contournent les shunts pulmonaires pourrait provoquer une amélioration tissulaire faussement positivenon spécifique 6, qui est évitée en éliminant les microbulles de plus grande taille. Par conséquent, une procédure simple pour réaliser la sélection granulométrique est présentée, complétée par la description d’une méthode d’évaluation de la concentration et de la distribution granulométrique des particules à l’aide d’un compteur de particules.
Le premier protocole d’essai pour l’évaluation du ciblage des microbulles, tel que présenté ci-dessous, décrit un système purement modèle, avec des microbulles biotinylées ciblées sur la surface1 recouverte de streptavidine. Le deuxième protocole est basé sur un manuscrit décrivant une préparation simplifiée de microbulles ciblées sur les peptides, décorées d’un peptide RGD cyclique qui possède une affinité spécifique envers αv β3, un biomarqueur moléculaire de la néovascularisation tumorale5. Il a été démontré que des microbulles décorées avec ce peptide cyclo[Arg-Gly-Asp-D-Phe-Lys], c’est-à-dire c(RGDfK) par la technique présentée, ciblent le néo-système tumoral et réalisent une imagerie moléculaire par ultrasons dans un modèle de tumeur murine.
Protocole
1. Couplage covalent du peptide au NHS-PEG-DSPE
- Dissoudre le peptide c(RGDfK) avec le ε-aminogroupe primaire de la lysine non protégé et disponible pour le couplage, dans du diméthylsulfoxyde (DMSO, 10 mg/mL). Préparez une solution de méthanol ou de chloroforme d’ester N-hydroxysuccinimide de poly(éthylèneglycol)-3400-distéaroyl-phosphatidyléthanolamine (NHS-PEG-DSPE, 200 mg/mL), et ajoutez-l’ajouter à 1 mg de peptide dans du DMSO. Ajouter 3 μL de N,N-diisopropyléthylamine (DIPEA).
- Maintenez un rapport molaire peptide/NHS-PEG-DSPE d’au moins 1:1,2, afin que tous les groupes aminés primaires puissent réagir. Maintenir un rapport molaire DIPEA :peptide d’au moins 2:1 pour assurer les conditions de base du support.
ATTENTION : Le chloroforme, le méthanol et le DIPEA sont des matières dangereuses. Utilisez une protection appropriée, comme des gants, une blouse de laboratoire, des lunettes de protection et une hotte.
REMARQUE : Tout autre peptide ou mimétique avec un groupe amino primaire peut être utilisé à la place de c(RGDfK), avec un N-terminal non protégé ou une lysine située à l’extérieur du site de liaison. Pour que la réaction se poursuive, tous les composants (c’est-à-dire ciblant le ligand et le lipide) doivent être solubles dans un mélange DMSO-chloroforme. D’autres solvants, tels que le diméthylformamide, ou ses mélanges, peuvent également être testés. Une réaction en milieu aqueux est également possible, mais le rendement de couplage sera beaucoup plus faible en raison de l’hydrolyse rapide de l’ester actif.
- Maintenez un rapport molaire peptide/NHS-PEG-DSPE d’au moins 1:1,2, afin que tous les groupes aminés primaires puissent réagir. Maintenir un rapport molaire DIPEA :peptide d’au moins 2:1 pour assurer les conditions de base du support.
- Après une incubation d’une nuit à température ambiante, éliminer la matière organique volatile par évaporation (utiliser un courant d’azote gazeux ou un évaporateur rotatif, suivi d’une évaporation d’une nuit sous une pompe à vide poussé, pour éliminer le DMSO). Redissoudre le résidu non volatil dans le chloroforme à 1 mg/mL pour un échantillonnage contrôlé.
- Confirmer la fin de la réaction par chromatographie sur couche mince (développer des plaques CCM dans un milieu de solvant chloroforme :méthanol, 2:1 v/v). Confirmer la présence ou l’absence du groupe amino primaire avec un spray de ninhydrine lors du chauffage de la plaque sur un bloc chauffant à 150 °C.
ATTENTION : La ninhydrine est une matière dangereuse. Utilisez une protection appropriée, comme décrit ci-dessus. Le traitement des blocs chauffants des plaques CCM doit être effectué dans une hotte. Le bloc chauffant présente un risque potentiel d’incendie. - Avant la préparation des microbulles, aliquoter un échantillon de peptide-PEG-DSPE à partir du chloroforme (p. ex., 1 mL de solution à 1 mg/mL), évaporer le chloroforme jusqu’à ce qu’il soit sec dans un courant d’azote gazeux, puis l’incubation par pompe à vide poussé, et ajouter une solution saline à 1 mg/mL, pour obtenir une solution micellaire transparente.
- S’il est souhaitable de purifier davantage le mélange réactionnel, le redissoudre dans une solution saline normale. Ensuite, soumettez le mélange micellaire obtenu à la dialyse (seuil de coupure de poids moléculaire de 6 à 8 kDa, ou similaire), d’abord contre une solution saline normale, puis contre plusieurs changements d’eau désionisée.
- Confirmer la fin de la dialyse par un contrôle de conductivité du dialysat. Retirer la matière dialysée du sac de dialyse, la placer dans un flacon dont la masse est connue et lyophiliser jusqu’à ce qu’elle soit complètement sèche.
REMARQUE : Il existe une autre réaction covalente pour attacher le ligand à l’extrémité terminale du PEG-lipide (p. ex., une réaction du maléimide-PEG-DSPE avec le ligand thiol). Le principal avantage de cette approche est le couplage orienté, si un seul thiol est disponible sur la molécule de ligand 7. La principale préoccupation est la stabilité à long terme : le lien qui en résulte entre le maléimide et le thiol peut être sujet à la dégradation par une réaction rétro-Michael, selon les conditions de stockage 8.
REMARQUE : La qualité des réactifs d’ester actif varie considérablement d’un fabricant à l’autre : elle peut dépendre des conditions de transfert et de stockage (si le matériau n’est pas stocké ou transporté correctement, l’ester actif s’hydrolysera et ne pourra pas se coupler avec le peptide). Par conséquent, il y a un sentiment d’obligation de décrire une procédure (voir ci-dessous) pour la détermination du degré de dégradation du NHS-PEG-DSPE, un réactif de fixation covalente des ligands de ciblage aux microbulles. Le NHS-PEG-DSPE, fourni sous forme de poudre sèche sous argon, est stocké dans une chambre froide. Un flacon est porté à température ambiante (pour éviter la condensation de l’humidité), un échantillon est pesé à l’aide d’une balance analytique et dissous dans du méthanol ou du DMSO. Un flacon contenant du réactif sec en vrac doit être fermé sous argon et remis à la congélation, dans un contenant scellé avec un dessiccant, jusqu’à ce qu’il soit utilisé à nouveau. - Préparez une solution micellaire aqueuse de peptide-PEG-DSPE (étape 1.4), ainsi que de biotine-PEG-DSPE, par simple ajout de réactif sec à une solution saline aqueuse, et incubation. De petites micelles sphériques se forment. Pour accélérer le transfert du réactif de l’état en vrac à la forme micellaire, une sonication et un bain d’eau chaude peuvent être appliqués.
- Évaluer la qualité du réactif de l’ester actif NHS-PEG-DSPE.
- Confirmer que le NHS présent dans le réactif se présente sous forme d’ester actif, afin de pouvoir effectuer la réaction de couplage avec la formation de liaisons amides.
- Placez 0,99 mL de tampon de tétraborate de sodium 0,1 M, pH 9,2, dans une cuvette en quartz ou en plastique transparent aux rayons ultraviolets (pas en verre) dans un spectrophotomètre, et zéro à la longueur d’onde de 260 nm.
- Ajouter 10 μL de la solution fraîchement préparée à 200 mg/mL de NHS-PEG-DSPE dans du méthanol dans la cuvette. En même temps, démarrez le chronomètre. Mélangez rapidement et vigoureusement le contenu de la cuvette pour obtenir une uniformité. Placez la cuvette dans le photomètre, fermez le couvercle et commencez la mesure.
- Au début de la mesure du spectrophotomètre, marquez l’heure du début de l’enregistrement, et effectuez en continu des mesures d’absorbance photométrique à 260 nm toutes les 10 s pendant ~10 min, ou jusqu’à la stabilisation de la valeur d’absorbance.
- Tracez la courbe cinétique, vérifiez les points temporels initiaux A260 et extrapolez la courbe au moment du début de la réaction (c’est-à-dire déterminez A260 au point où le réactif a été ajouté au tampon aqueux et où la réaction d’hydrolyse a commencé). Supposons qu’avant l’ajout de NHS-PEG-DSPE au tampon dans la cuvette, aucune hydrolyse n’a eu lieu dans un solvant organique en raison d’un manque d’eau.
- Calculer le rapport entre A260 au début de la réaction et à la fin de l’hydrolyse ; Il représente la fraction de l’ester actif dégradé. Utilisez ces informations pour sélectionner la quantité appropriée de NHS-PEG-DSPE pour la modification complète du groupe amino primaire du peptide.
2. Préparation des microbulles par amalgamation
- Préparation de microbulles biotinylées
- Co-dissoudre la distéaroylphosphatidylcholine (DSPC) et le stéarate de PEG dans du propylène glycol (PG, concentration de 10 mg/mL pour chacun dans un solvant pur). Utilisez un bain d’eau chaude pour solubiliser les matériaux.
- Ajouter 0,1 mL de cette solution chaude de PG dans un flacon contenant 0,85 mL de solution saline normale chaude, mélanger rapidement et ajouter de la biotine micellaire-PEG-DSPE (50 μL, 1 mg/mL dans une solution saline) dans un rapport massique de 1:20 par rapport au DSPC.
REMARQUE : La solubilité des composants lipidiques dans le PG dépend de la température, un bain d’eau chaude est donc nécessaire. Il est utile de chauffer le flacon en verre contenant du sérum physiologique dans un bain d’eau chaude avant l’ajout de lipides, afin de créer un milieu uniforme sans particules visibles. - Amenez le flacon à température ambiante, placez un bouchon en caoutchouc sur le flacon, inséré à moitié, et insérez un tube capillaire en PTFE dans le flacon. Utilisez le flux de gaz décafluorobutane pour remplir le flacon, puis fermez le bouchon, tout en retirant le capillaire.
REMARQUE : La température du flacon pendant l’amalgame peut avoir un effet significatif sur la distribution granulométrique des microbulles résultantes 9. - Sertir le flacon bouché, à température ambiante, et le placer dans un amalgamateur. Démarrez l’amalgamateur. L’unité clinique utilisée est préréglée pour fonctionner à 4300 tr/min pendant 45 secondes.
- Une fois l’amalgame terminé, retirez de l’amalgamateur le flacon contenant les microbulles résultantes. De préférence, caractérisez la distribution de la taille et la composition des microbulles et utilisez-les dans les heures qui suivent la préparation.
- Préparation de microbulles décorées de peptides
- Co-dissoudre le DSPC et le PEG stéarate dans du PG pur (concentration de 10 mg/mL pour chaque matière). Utilisez un bain d’eau chaude pour solubiliser. Ajouter 0,1 mL de cette solution chaude dans du PG dans un flacon contenant 0,85 mL de solution saline normale chaude, mélanger rapidement et ajouter du peptide micellaire-PEG-DSPE (50 μL, 1 mg/mL dans une solution saline) ajouté dans un rapport massique de 1:20 au DSPC.
- Amenez le flacon à température ambiante, placez un bouchon en caoutchouc sur le dessus du flacon, inséré à mi-chemin, et insérez un tube capillaire en polytétrafluoroéthylène (PTFE) dans le flacon. Utilisez le flux de gaz décafluorobutane pour remplir le flacon, puis fermez le bouchon, tout en retirant le capillaire.
- Sertissez le flacon bouché et placez-le dans un amalgamateur pour mélanger. Le flacon avec dispersion de microbulles est prêt en 45 s.
- Préparation de microbulles lipidiques de colorant pour l’évaluation du transfert de lipides vers l’enveloppe des microbulles
- Co-dissoudre le DSPC et le stéarate de PEG dans du PG pur, comme décrit ci-dessus (utiliser un bain d’eau chaude) (concentration de 10 mg/mL pour chaque matière).
- Ajouter 0,1 mL de cette solution chaude de PG dans un flacon contenant 0,89 mL de solution saline normale chaude, mélanger rapidement, ajouter 10 μL de solution de colorant DiI (1 mg/mL dans du PG pur) et mélanger. Amenez le flacon à température ambiante.
- Remplissez l’espace libre du flacon avec du gaz décafluorobutane comme ci-dessus, bouchez le flacon, sertissez et amalgamez comme décrit ci-dessus.
3. Testez le transfert de lipides DiI du milieu aqueux micellaire à la coquille de la bulle
- Pour confirmer au microscope que la matière lipidique fluorescente a été transférée du milieu aqueux à l’enveloppe des microbulles, prélever une aliquote de microbulles du flacon à travers le septum à l’aide d’une seringue à insuline.
- Ajoutez ensuite une goutte à une lame de verre et couvrez-la d’une lamelle standard. Diluez-le d’abord avec une gouttelette de solution saline dégazée.
- Effectuez la microscopie avec un microscope vidéo, équipé d’un épi-éclairage par fluorescence, d’un objectif à huile 100x et d’une caméra vidéo haute sensibilité.
- Pour déterminer l’efficacité du transfert de matières lipidiques du milieu salin aqueux/PG à la coquille de bulles pendant l’amalgamation, prenez un flacon scellé de microbulles, retournez-le et placez-le dans un tube conique de 50 ml.
- Effectuer la centrifugation dans un rotor à godets (10 min, 200 x g). Retirez le flacon de la centrifugeuse et maintenez-le inversé.
- Insérez l’aiguille d’une seringue à insuline dans le septum du flacon inversé. Aspirez lentement un petit volume (~50 μL) d’infranatant clair.
REMARQUE : La pointe biseautée de l’aiguille pour l’aspiration infranatant à partir du flacon inversé après centrifugation doit être située aussi près que possible du septum, afin de minimiser les risques d’absorption de microbulles.
- Placez les échantillons d’infranatant (2 μL), ainsi que les échantillons du milieu salin lipide-PG d’origine qui a été utilisé pour générer des microbulles (2 μL) dans une plaque à 96 puits avec 0,1 mL de milieu salin tamponné au phosphate (PBS) :éthanol 1:1 avec 1 % de Triton X-100.
- Mesurez la fluorescence rouge du colorant DiI (excitation de 555 nm, émission de 620 nm) à l’aide d’un lecteur de microplaques de fluorescence.
- Utilisez des plaques noires avec un fond non transparent pour la spectroscopie de fluorescence en raison d’un bruit de fond plus faible et d’un manque de transfert de signal entre puits qui peut devenir un problème pour les plaques transparentes.
- Assurez-vous que le signal de fluorescence se situe dans la plage d’étalonnage linéaire : une concentration excessive de colorant dans les puits peut entraîner une atténuation de la lumière et un signal sous-déclaré.
REMARQUE : Il peut parfois être souhaitable d’enlever le matériau résiduel de l’enveloppe qui reste dans le milieu aqueux après l’amalgamation. Pour ce faire, après la centrifugation par flottation à microbulles, retirez tout le volume infranatant par aspiration lente du flacon inversé, et remplacez-le par une solution saline normale dégazée. Pour éviter un changement excessif de la pression ambiante dans le flacon en raison du retrait ou de l’ajout de liquide, insérez une longue aiguille supplémentaire dans le septum pour atteindre la phase gazeuse à l’intérieur du flacon. Pour maintenir la phase gazeuse à l’intérieur du flacon, connectez d’abord l’aiguille à une seringue remplie de gaz fluorocarboné, afin d’éviter tout contact avec l’air avec la préparation de microbulles.
4. Ajustement de la distribution de la taille des microbulles
- Utilisez la flottation par gravité normale dans un flacon inversé statique pour ajuster la distribution de la taille des microbulles, c’est-à-dire pour éliminer les plus grosses microbulles rapidement et efficacement 5,10.
- Prendre un flacon de microbulles immédiatement après la préparation comme décrit à la rubrique 2. Retournez et placez à l’envers sur une surface stable et non vibrante pendant 15 à 20 min.
- Après cette incubation, insérez une aiguille de seringue à insuline dans le septum du flacon, pendant qu’il est encore inversé, et recueillez doucement 300 à 500 μL de microbulles de la couche inférieure.
REMARQUE : L’aiguille de la seringue doit rester près de la surface interne du septum pour éviter l’accumulation de bulles plus grosses présentes plus près du haut du liquide dans le flacon.- Tirez lentement le piston de la seringue vers l’arrière pour éviter les turbulences et l’expansion hydrostatique des bulles dans le corps de la seringue. Lorsque l’échantillon prélevé est retiré de la seringue, évitez la surpression pour éviter l’effondrement des bulles.
- Transférez la dispersion de microbulles de la seringue dans un flacon de petit volume. Remplissez ensuite de gaz perfluoré, bouchon et sertissage, pour le stockage à court terme, le comptage des particules (voir ci-dessous) et une utilisation ultérieure.
- Si le prélèvement est effectué directement à partir de la seringue, tenez-la horizontalement et tournez-la pour éviter la flottaison des bulles et obtenir l’uniformité de l’échantillon.
5. Évaluation de la distribution de la taille des microbulles
- Utilisez un compteur de particules (basé sur la détection par électrozone ou le principe de l’obscurcissement de la lumière) pour évaluer la distribution granulométrique et la concentration des particules. Vous pouvez également utiliser un hémocytomètre et un microscope.
- Brièvement, ajoutez une aliquote d’échantillon de microbulles dans une solution saline normale ou isotone dans une chambre de comptoir (généralement d’un volume de 60 à 100 ml) et comptez. Comparez la distribution de la taille des microbulles avant et après la purification par flottation.
REMARQUE : Soumettez le flacon à un mélange doux (pas de vortex) immédiatement avant l’échantillonnage, afin d’obtenir des mesures représentatives et reproductibles. Échantillonnez à partir du centre du volume testé. - Remplissez un bécher de 100 ml avec au moins 60 ml de diluant en solution saline à 0,9 % et placez-le sur la platine de l’instrument émetteur d’électrozone. Soulevez la platine de sorte que le tube, la plaque d’électrode extérieure et l’agitateur soient tous complètement immergés dans le diluant et que l’agitateur puisse tourner.
REMARQUE : Le volume du diluant dans le bécher peut être déterminé avec précision à l’aide de sa masse, à l’aide d’une échelle (la densité saline est proche de 1). Alternativement, une pompe doseuse peut être utilisée. Les électrodes pendant l’étude de détection d’électrozone doivent être complètement immergées. - Enregistrez le volume d’électrolyte du diluant dans le logiciel de contrôle de l’unité. Le compteur de détection électrozone est équipé d’un orifice de 50 μm, ce qui permet de mesurer des particules de 1 à 30 μm de diamètre. Effectuez d’abord une exécution en arrière-plan ; on s’attend à ce qu’il y ait moins de 5000 comptages dans 0,5 mL de diluant à blanc. Les meilleurs niveaux d’arrière-plan peuvent être inférieurs à 100 points.
- Réglez le volume de l’échantillon dans le logiciel de contrôle de l’unité, pour tenir compte du facteur de dilution. Ajoutez 10 à 20 μL du mélange de microbulles dans le bécher et effectuez le deuxième passage.
- Utilisez les données de distribution de la taille d’arrière-plan à prendre en compte à l’aide de la fonction « soustraire l’exécution en arrière-plan » dans le logiciel. Obtenir la concentration des particules dans l’échantillon de microbulles d’origine en nombre de particules/mL ; Il comprend le facteur de dilution.
- La surface extérieure de l’extrémité de la pipette peut également être recouverte de bulles pendant l’échantillonnage ; Assurez-vous de l’essuyer avant d’insérer l’embout dans le milieu de comptage. Ne touchez pas l’orifice de l’extrémité de la pipette avec une lingette.
- Évitez les dilutions insuffisantes des particules de l’échantillon pendant le comptage, afin de minimiser les problèmes de correction de coïncidence, lorsque plus d’une particule à la fois se trouve à l’intérieur de l’orifice du capteur : le système peut alors sous-estimer la concentration des particules.
REMARQUE : Le diamètre de l’orifice pour le comptage des particules peut varier. La sélection de l’orifice de 50 μm permet de détecter des microbulles d’un diamètre inférieur à 1 μm, mais il n’est pas aussi sujet au colmatage que les options de plus petit diamètre. - Étalonnez le compteur de détection électrozone pour le même milieu d’essai de diluant (p. ex., solution d’irrigation saline normale filtrée stérile) que celui utilisé dans les essais réels. Une alternative d’obscurcissement laser à la détection par électrozone présente l’avantage de ne pas avoir besoin d’une solution saline filtrée avec une concentration en sel et une conductivité électrique contrôlées.
- Brièvement, ajoutez une aliquote d’échantillon de microbulles dans une solution saline normale ou isotone dans une chambre de comptoir (généralement d’un volume de 60 à 100 ml) et comptez. Comparez la distribution de la taille des microbulles avant et après la purification par flottation.
6. Tester le ciblage des microbulles in vitro dans un test d’adhésion/rétention
- Préparez la surface du récepteur du biomarqueur pour le ciblage des microbulles sur les boîtes de Pétri.
- Prenez des plats en polystyrène de 35 mm de diamètre à utiliser comme surface cible. Profitez de l’adhérence non spécifique des protéines à la surface de la boîte de polystyrène à partir d’une solution saline normale. Utilisez une protéine modèle, la streptavidine, pour tester le ciblage des bulles biotinylées qui contiennent de la biotine-PEG-DSPE dans la coquille.
- Placez une gouttelette de solution de streptavidine (0,2 mL, 10 μg/mL dans du PBS) au centre de chaque boîte de Pétri et couvrez-la d’une lamelle en plastique de 22 mm x 22 mm pour permettre un revêtement uniforme de la surface de la boîte. Après une nuit d’incubation à 4 °C dans un environnement humide clos pour éviter que la parabole ne se dessèche, retirez les lamelles.
- Laver immédiatement et exhaustivement les plaques avec de l’eau, du PBS, et les bloquer par incubation avec de l’albumine sérique bovine (BSA) à 1,5 % dans du PBS pendant au moins 4 h pour minimiser l’adhérence non spécifique des microbulles sur la surface non revêtue. Utilisez les boîtes de culture propres bloquées avec 1,5 % de BSA comme témoins.
- Vous pouvez également utiliser une solution recombinante de récepteursα Vβ3 (p. ex., à 4 μg/mL dans le PBS)5 au lieu de la streptavidine. Ciblez les microbulles de ce biomarqueur via un ligand peptidique RGD cyclique attaché à la coquille de la microbulle.
- Gardez la parabole avec le récepteur cible déposé humide : la protéine réceptrice peut être inactivée si elle se dessèche.
REMARQUE : Il est important d’utiliser des protéines réceptrices sans porteur qui ne contiennent pas de protéines porteuses ou de tensioactifs dans le milieu - leur présence inactivera l’adhésion.
- Adhérence de microbulles dans une petite gouttelette : vérifiez rapidement l’adhérence ciblée dans des conditions statiques.
- Déposez une gouttelette de microbulles (5 à 20 μL) par le dessous sur la surface cible (ou le contrôle BSA uniquement) dans une boîte de Pétri inversée à l’envers. Cela amènera les bulles à la surface recouverte de récepteur par flottation.
- Après 5 à 10 minutes d’incubation de la parabole inversée dans un environnement humide, retournez la parabole dans une position normale, remplissez-la de PBS et rincez doucement pour éliminer les microbulles libres. Effectuez une microscopie à fond clair pour évaluer l’adhérence ciblée.
- Adhérence de microbulles sur la surface d’une boîte de Pétri : effectuer un ciblage dans une boîte pleine1.
- Prenez la parabole, qui a un revêtement de surface récepteur, et remplissez-la complètement avec un tampon PBS-BSA dégazé (plus de 10 ml pour la boîte de 35 mm), de sorte que le ménisque du tampon s’étende sur le dessus de la boîte et soit maintenu par la force capillaire. Injectez les bulles (50 μL) dans la majeure partie du tampon et mélangez rapidement pour obtenir une homogénéité. Évitez la formation de bulles d’air pendant le mélange.
- Placez rapidement un segment de ruban d’emballage transparent ou un ruban de scellement de plaque de culture, soutenu par un morceau de plastique plat, sur le plat. Scellez sous pression le film sur le plat, inversez l'« assemblage » et placez-le à l’envers pendant 30 minutes pour permettre aux microbulles de flotter vers le haut, de toucher la surface cible et d’adhérer.
- Inversez l'« assemblage » du plat scellé en configuration « à l’envers », retirez le joint et lavez les microbulles non adhérentes en rinçant avec une solution tampon dégazée. Observez des microbulles ciblées par microscopie ou par imagerie par ultrasons.
REMARQUE : Lorsque le plat scellé inversé complètement rempli de la dispersion de microbulles est incubé, il peut être placé légèrement incliné, donc si de grosses bulles sont présentes, elles flotteront vers le bord du plat, en dehors de la région centrale d’intérêt. Le rinçage forcé à débit rapide provenant de la pointe d’une micropipette pendant la microscopie peut être utilisé pour évaluer la force d’adhérence des bulles à la cible (les bulles se détachent complètement de la surface de contrôle, même en cas d’écoulement lent) 11. Le tampon dégazé est préférable pour la dilution des bulles, car un excès d’air dissous entraînera une croissance incontrôlée des microbulles.
7. Tester le ciblage des microbulles in vitro : évaluer les dosages dynamiques d’adhésion/rétention dans une chambre d’écoulement à plaques parallèles
REMARQUE : Nous testons l’adhésion des bulles biotinylées à la couche de streptavidine avec l’imagerie par ultrasons.
- Utilisez une chambre d’écoulement à plaques parallèles disponible dans le commerce avec un support d’onduleur sur mesure pour observer l’adhérence ciblée à une boîte de Pétri de 35 mm à partir d’un fluide en écoulement. Après adsorption de la protéine cible dans la boîte (voir 6.1.1), insérez le corps de la chambre avec le joint préinstallé dans la boîte et fermez-le dans le support. Utilisez des joints d’étanchéité d’une hauteur de canal (c’est-à-dire une épaisseur de joint) de 0,127 mm et d’une largeur de canal de 2,5 mm.
REMARQUE : Lors de l’assemblage d’une chambre d’écoulement à plaque parallèle, la quantité de graisse de silicone utilisée sur le joint doit être minimale. Ne laissez pas la graisse pénétrer dans la zone du canal : évitez de recouvrir la surface recouverte de protéines de biomarqueurs avec de la graisse. Pour obtenir une bonne étanchéité, choisissez soigneusement des plats de 35 mm (voir le tableau des matériaux pour les informations sur la chambre et le plat). - Pour l’assemblage de la chambre d’écoulement, ne vissez pas trop fermement le capuchon et le cadre qui maintiennent la combinaison plat-chambre d’écoulement, afin d’éviter les fuites.
- Connectez la tubulure d’écoulement à une pompe à seringue fonctionnant en mode de retrait, et du côté de l’alimentateur, connectez une fine tubulure en polyéthylène (PE50) au flacon avec une dispersion de microbulles diluée, soumise à un mélange constant avec une barre d’agitation via un agitateur magnétique12. Contrôlez le paramètre du taux de cisaillement de la paroi (WSR) de la chambre en ajustant le débit volumétrique de la pompe sur la base de la formule 6Q/bh2, où Q est le débit, « b » est la largeur du canal et « h » est la hauteur du canal.
REMARQUE : Retirez les bulles d’air de l’ensemble du système avant la perfusion du milieu contenant des microbulles ou PBS, car toute bulle d’air passant à travers le canal délogera les microbulles adhérentes de la surface cible et invalidera l’expérience. La connexion entre le tube de la chambre d’écoulement et la seringue doit être correctement scellée. - Préparez une dispersion de microbulles en ajoutant un volume calculé de bulles concentrées dans le réservoir de microbulles (un flacon à scintillation de 20 ml) pour obtenir une concentration de 10à 6 microbulles/mL, dans un tampon PBS avec 0,1 % de BSA. Placez le réservoir de l’alimentateur sur un agitateur à plaques magnétiques. Insérez une barre d’agitation magnétique de 1 cm x 2 cm et agitez à ~400 tr/min pour maintenir l’homogénéité au cours de l’étude.
- Effectuer une imagerie par ultrasons de la chambre d’écoulement dans un réservoir d’eau13.
- Immergez l’ensemble de la chambre d’écoulement dans de l’eau dégazée et maintenez-le en place par un poids pour éviter tout mouvement pendant les expériences.
- Placez la sonde d’imagerie fixée directement au-dessus du canal et inclinez-la à un angle de 15° vers l’arrière, ainsi qu’à un angle de 5° dans le sens des aiguilles d’une montre pour minimiser la réflexion spéculaire de la surface de la parabole. Positionnez le canal de la chambre d’écoulement dans le plan d’imagerie.
- Utilisez les conditions d’imagerie suivantes : sonde 15L8, mode d’imagerie spécifique au contraste, plage dynamique 50 dB, 7 MHz, indice mécanique (MI) = 0,18, gain CPS = 0. Gardez la compensation de gain de temps uniforme sur l’ensemble de l’image.
- Placez la face de la sonde de manière à ce qu’elle touche la surface de l’eau, et non à une immersion profonde. Vous pouvez également utiliser un manchon de protection en caoutchouc rempli de gel à ultrasons.
REMARQUE : Pour garantir un positionnement reproductible du système de chambre d’écoulement pour l’imagerie, les marqueurs doivent être placés sur le bassin d’eau ou sur l’écran du système d’échographie.
- Aspirez la dispersion de microbulles du réservoir à travers la chambre et dans la pompe pendant 2 min.
- Basculez le flux sur PBS pour éliminer les bulles non adhérentes du canal et évaluer la rétrodiffusion acoustique des bulles adhérentes (ciblées) restantes. Pour obtenir une image d’arrière-plan, augmentez le MI à 1,9 pour détruire les bulles adhérentes dans le champ de vision de l’imagerie par ultrasons.
REMARQUE : La dispersion des microbulles doit être remplacée pour les cycles répétés : à forte dilution, les microbulles se dégradent progressivement avec le temps.
- Basculez le flux sur PBS pour éliminer les bulles non adhérentes du canal et évaluer la rétrodiffusion acoustique des bulles adhérentes (ciblées) restantes. Pour obtenir une image d’arrière-plan, augmentez le MI à 1,9 pour détruire les bulles adhérentes dans le champ de vision de l’imagerie par ultrasons.
- Exportez des images individuelles à partir du flux vidéo d’enregistrement d’écran : avant le vidage PBS, après le rinçage et après destruction, à importer dans ImageJ pour une analyse hors ligne. Sélectionnez la région d’intérêt (ROI) pour exclure les parties d’entrée et de sortie de la chambre. Après soustraction du signal ROI d’arrière-plan, quantifiez l’intensité de l’écho en tant qu’intensité moyenne des pixels dans le ROI.
REMARQUE : Comme alternative à l’imagerie par ultrasons, l’adhésion des microbulles à la surface cible peut être observée par vidéomicroscopie, lorsque l’ensemble de la chambre d’écoulement à plaques parallèles dans le support inversé est placé sur une platine d’un microscope composé, avec enregistrement vidéo 5,11,12,14. Ceci est particulièrement utile pour l’imagerie de l’adhésion ciblée des microbulles aux récepteurs de biomarqueurs de surface cellulaire dans la culture cellulaire, lorsque les cellules exprimant les récepteurs sont cultivées sur la boîte de culture tissulaire, et que le nombre de microbulles liées à chaque cellule cible peut être compté directement.
Résultats
Couplage covalent du peptide et du lipide
L’achèvement de la réaction et la formation souhaitée du produit ont été confirmés par TLC. Un témoin peptidique distinct n’ayant pas réagi n’a pas progressé pendant la CCM : il a été conservé au début, et sa tache était positive pour le groupe amino primaire, comme observé après pulvérisation de ninhydrine, lors du chauffage. Cette tache peptidique libre positive à la ninhydrine n’a plus été observée dans le mélange après la fin de la réaction, après la CCM de l’échantillon du mélange réactionnel, après l’élimination du DIPEA, du DMSO et la redissolution dans le chloroforme. En ce qui concerne la question cruciale de la qualité du réactif d’ester NHS, la figure 1 présente la piste spectrophotométrique de la cinétique d’hydrolyse, le point temporel zéro au début de la réaction étant lorsque l’ester NHS dans un solvant organique a été ajouté à la cuvette. Cela confirme la fonctionnalité de l’ester actif NHS du carboxy-PEG-DSPE (voir Méthodes Section 1). Au point temporel zéro, l’extrapolation A260 = 0,33 représente le matériau qui a déjà été hydrolysé avant l’essai. À la fin de la réaction d’hydrolyse, au-delà de 10-15 min, A260 = 1,54 (lorsque l’absorbance n’augmente plus considérablement). Cela confirme la présence d’ester actif. Il fournit également des données quantitatives, selon lesquelles plus de 78 % du matériau n’est pas pré-hydrolysé NHS, et peut donc être utilisé avec succès pour le couplage peptidique, avec un ajustement correct de la quantité de réactif.
Préparation et transfert de la matière lipidique du milieu aqueux sur la coquille de la bulle : lipide de fluorescence
Les microbulles de cette étude ont été préparées de manière à contenir une quantité infime (moins de 1 %) du colorant fluorescent DiI, avec une fluorescence rouge caractéristique, qui a été ajouté sous forme de solution dans du PG à la solution saline-PG de DSPC et de stéarate de PEG. Les microbulles résultantes montrent clairement la fluorescence de la coquille lorsque des filtres d’excitation de la lumière verte et d’émission rouge sont utilisés au microscope (voir la figure 2, à gauche). La microscopie à fond clair de la phase gazeuse de microbulles (Figure 2, à droite) peut être comparée à la fluorescence de la coquille de microbulles. Pour l’évaluation quantitative du transfert de matière lipidique de la phase aqueuse à la coquille de bulles, les microbulles ont été flottées par centrifugation, et le signal de fluorescence de la phase infranatant claire a été comparé à la fluorescence de la solution initiale, avant l’amalgamation des microbulles. Une réduction du signal de près d’un ordre de grandeur a été observée (figure 3), c’est-à-dire que plus de 85 % de la matière lipidique a été transférée dans la coquille de la microbulle par amalgamation.
Préparation et correction de la distribution granulométrique des microbulles
Les microbulles générées par l’amalgamation ont montré une distribution granulométrique typique, avec une concentration élevée (p. ex., ~4,8 x 109 particules par mL pour les bulles biotinylées). La distribution granulométrique était large, avec des particules présentes dans la plage mesurée (entre 1 et 30 μm) ; ~6,3 % des microbulles dépassent 5 μm de diamètre (figure 4, courbe verte). L’administration intravasculaire de grosses microbulles peut entraîner leur accumulation non spécifique dans les capillaires sanguins et doit être évitée. Une flottation courte (15-17 min) du flacon inversé en gravité normale, avec le prélèvement ultérieur de 0,3 mL près de la surface du septum, permet d’éliminer complètement les microbulles plus grosses, avec une perte mineure de la concentration totale en nombre de particules, jusqu’à ~4,6 x 109 : après flottation, seulement 0,01 % des particules de l’échantillon purifié ont un diamètre supérieur à 5 μm (Figure 4, courbe rouge).
Adhérence des microbulles sur la surface recouverte d’un récepteur : dosage statique
Cette procédure a été décrite pour la première fois au siècle précédent1 et est utilisée comme un test rapide qui confirme la fonctionnalité des microbulles ciblées. Les microbulles sont autorisées à entrer en contact avec la surface de la parabole porteuse du récepteur. Si l’interaction ligand-récepteur a lieu, des bulles peuvent être retenues à la surface malgré le lavage vigoureux. Un exemple d’un tel test rapide de l’adhésion fonctionnelle des microbulles c(RGDfK) sur la surface recouverte de αrecombinant vβ3 est présenté. La figure 5 est une image représentative de la microscopie à fond clair de microbulles adhérentes à la surface du récepteur dans une boîte de Pétri, après un lavage avec du PBS, pour éliminer les bulles non liées. Les bulles dans ce type de microscopie se présentent sous forme de motifs circulaires sombres. Dans des conditions similaires, si la surface n’est recouverte que d’albumine (pour bloquer l’adhérence non spécifique), les microbulles n’adhéreront pas et seront facilement éliminées même par le rinçage doux.
Liaison des microbulles du fluide en écoulement : chambre d’écoulement à plaques parallèles
Cette procédure a été initialement proposée comme outil pour l’étude de l’adhésion cellulaire dans un environnement d’écoulement contrôlé15 et adaptée pour l’étude du ciblage des microbulles des décennies plus tard11. Les tests dans un système à flux continu, contrairement à un test statique, sont beaucoup plus réalistes pour un scénario d’imagerie clinique, où des bulles circulantes dans un flux sanguin touchent brièvement la paroi du vaisseau et peuvent y adhérer si le récepteur cible est présent. Deux exemples de ces études sont présentés. Le premier exemple est une approche plus traditionnelle, où l’adhésion des microbulles décorées de peptides à la surface recouverte d’un récepteur est surveillée par vidéomicroscopie. La microscopie permet de distinguer les microbulles adhérentes de celles qui coulent. Il permet également de quantifier les microbulles adhérentes dans le cadre de l’imagerie du microscope : beaucoup plus de microbulles c(RGDfK) (colonne de gauche) adhèrent à la surface, par rapport au contrôle, où le peptide c(RADfK) brouillé est utilisé, ou si la surface n’est recouverte que de BSA (Figure 6).
Le deuxième exemple est l’imagerie par ultrasons de contraste de la boîte de Pétri recouverte de streptavidine (figure 7, côté droit) sur laquelle les microbulles biotinylées s’adsorbent avec succès à partir du milieu en écoulement, et peut être détectée par imagerie par ultrasons de contraste après un rinçage avec du PBS. La surface de la parabole de contrôle ne retient pas les microbulles adhérentes du flux, de sorte que pratiquement tout le signal de contraste des ultrasons est éliminé avec le flux PBS. La quantification du signal de contraste échographique montre une forte signification statistique de la différence observée ; Le rapport entre les signaux cible et de commande dépassait un ordre de grandeur.
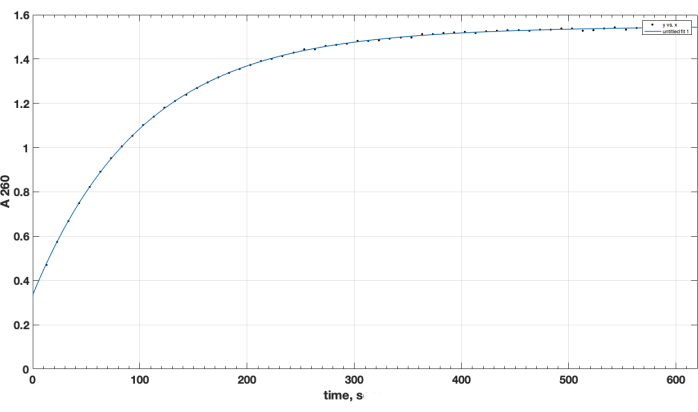
Graphique 1. Cinétique d’hydrolyse de l’ester actif NHS-PEG-DSPE, observée par libération NHS en milieu alcalin par test spectrophotométrique à une longueur d’onde de 260 nm. Le point temporel zéro est le temps d’ajout du NHS-PEG-DSPE dans le solvant organique au tampon de borate 0,1 M, pH 9,2. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Microscopie de microbulles remplies de gaz après amalgamation. À gauche, microscopie à fluorescence (excitation verte, émission rouge, colorant de coquille lipidique DiI). À droite, microscopie à fond clair (observation en phase gazeuse), même grossissement. Largeur du cadre, 85 um (micromètre de platine de 10 μm intégré en bas à droite de chaque image). Veuillez cliquer ici pour voir une version agrandie de cette figure.
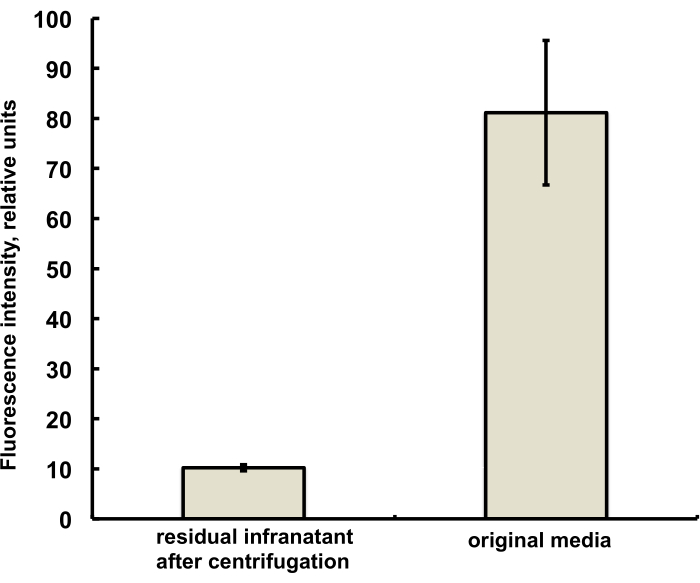
Graphique 3. Spectroscopie de fluorescence d’un échantillon de colorant lipidique DiI provenant du milieu de préparation des microbulles avant l’amalgamation (à droite) et après l’amalgamation et l’élimination des microbulles par flottation centrifuge (à gauche). Excitation de fluorescence - 555 nm, émission - 620 nm. Les données sont présentées sous forme d’écart type moyen ±. Veuillez cliquer ici pour voir une version agrandie de cette figure.
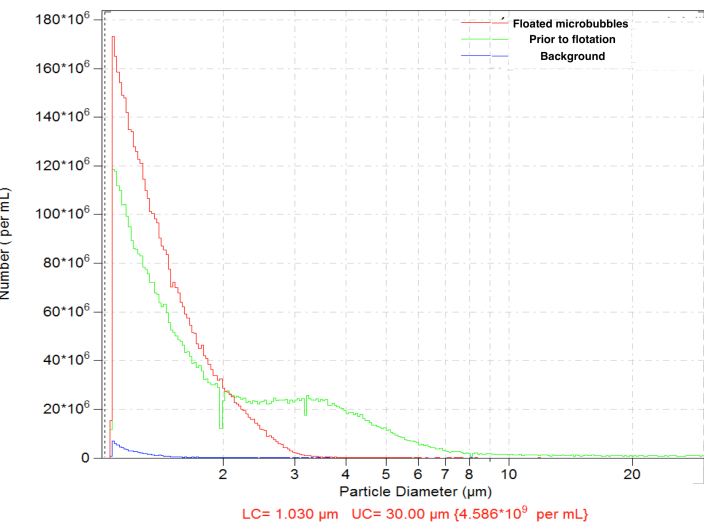
Graphique 4. Distribution granulométrique de la concentration en nombre de microbulles après la préparation de l’amalgamation (vert), avec flottation gravitaire normale subséquente pour l’élimination des grosses microbulles (rouge) et numération du fond de diluant seulement (bleu). Comptage de particules par détection d’électrozone dans une solution saline normale, orifice de 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 5. Microscopie à fond clair de microbulles c(RGDfK) sur une parabole recouverte de αvβ3. La largeur du cadre de l’image est de 106 μm et celle de la barre est de 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 6. Ciblage in vitro des microbulles décorées de peptides sur la surface recouverte de αv recombinante β3. Les microbulles décorées de cRGDfK ont adhéré efficacement à la boîte (à gauche), la fixation des microbulles cRADfK non ciblées (brouillées, au centre) a été minime (p<0,00005), tout comme la rétention des microbulles à la surface de contrôle contenant uniquement de l’albumine (à droite, p<0,0025). Contrainte de cisaillement de la paroi de l’écoulement de la chambre à 1 dyn/cm2. Adhérence des microbulles surveillée par vidéomicroscopie ; Le nombre de particules dans le champ de vision est présenté. Le temps d’accumulation est de 4 min. Les données sont présentées sous forme d’écart type moyen ±. Réimprimé avec la permission de5. Droits d’auteur, 2018, American Chemical Society. Veuillez cliquer ici pour voir une version agrandie de cette figure.
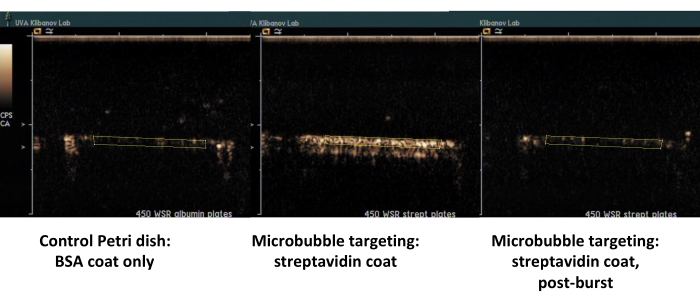
Graphique 7. Imagerie par ultrasons de contraste d’une chambre d’écoulement à plaque parallèle après adhésion ciblée et rinçage tampon de microbulles biotinylées sur la boîte recouverte de streptavidine (au milieu, microbulles ciblées adhérentes, à droite, même boîte, après une rafale d’ultrasons à MI élevé), et boîte témoin recouverte uniquement d’albumine (à gauche). Deux minutes de perfusion de dispersion de microbulles (PBS/BSA, 106 particules/mL) à un taux de cisaillement de 450 s-1 , suivies d’un rinçage du tampon. La quantification du signal ultrasonore est effectuée à partir des régions d’intérêt dans les images vidéo après soustraction de l’arrière-plan. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’importance d’une technique simple pour la préparation de microbulles décorées de ligands est évidente. L’utilisation de la technique de l’amalgamation pour la préparation des microbulles, telle qu’elle a été mise au point par Unger et coll.16 , peut servir à cette fin pour un certain nombre de raisons. La fabrication de microbulles par amalgamateur est facile à réaliser. Une unité monophasée de bureau 120 V à faible encombrement est disponible et peu coûteuse. La procédure est rapide (45 secondes) et efficace : 1 mL de dispersion de microbulles dans un milieu aqueux est préparé en une seule fois. Il contient des milliards de particules par ml, plus que suffisant pour les études de recherche. La fabrication s’effectue dans un flacon scellé avec un espace libre de gaz perfluoré. Si nécessaire, le contenu du flacon restera stérile à partir du moment du remplissage aseptique, pendant la fabrication (amalgamation) et jusqu’à l’utilisation. Cela rend l’approche pertinente pour une utilisation clinique, car elle ne nécessite pas de préparations élaborées dans un environnement stérile dédié en clinique.
Le procédé est basé sur l’auto-assemblage : pendant le mélange, comme un cisaillement élevé est appliqué à l’interface gaz-eau à l’intérieur du flacon en mouvement, de petits fragments de gaz se forment, qui prennent une forme sphérique en raison de l’action de la tension superficielle. Le PG, en tant que cosurfactant, présent dans le milieu à haute concentration, réduit la tension superficielle et l’énergie nécessaire pour générer l’interface gaz-eau pendant le cisaillement. Ensuite, des tensioactifs plus « classiques », tels que les lipides PEG et les phospholipides, qui sont présents à des concentrations beaucoup plus faibles, atteignent l’interface, déplaçant très probablement le PG et établissant une couche monomoléculaire à la surface de la bulle. Cette coquille est raisonnablement stable ; cela est probablement dû à une combinaison d’un lipide « solide » (la température de transition de phase DSPC est de 56 °C, il n’est donc pas sujet à la fusion intermembranaire) et d’une couche de brosse PEG étendue qui entoure les microbulles et inhibe le contact monocouche direct des bulles voisines. On peut supposer que la présence d’une forte concentration de PG dans le milieu peut réduire la stabilité de la coquille des microbulles. En son absence, les microbulles sont stables dans les flacons scellés sous atmosphère fluorocarbonée pendant de nombreux mois, avec une fusion modérée entre les bulles. Pour une utilisation clinique, avec un petit appareil d’amalgamation au chevet du patient, l’intervalle entre la préparation et l’utilisation des microbulles peut être court, quelques minutes ou quelques heures. Avec le PG présent dans les milieux, la concentration en microbulles ne montre pas de baisse significative, du moins pour plusieurs heures de stockage réfrigéré.
Un avantage supplémentaire de la procédure décrite (assistée par l’utilisation d’un cosurfactant PG dans le milieu de préparation des bulles) est une efficacité élevée (>85 %) du transfert de lipides vers la coquille, alors que la sonication traditionnelle offre une efficacité de ~20 %5 et les méthodes microfluidiques modernes encore plus faibles17. Un haut niveau d’efficacité de transfert est important non seulement parce que le gaspillage de matériaux lipidiques et de ligands coûteux est réduit, mais aussi parce que la quantité de ligand sans bulles co-présente dans le milieu est minimisée. Ensuite, le ligand libre peut ne pas avoir la possibilité de bloquer le récepteur cible du biomarqueur auquel les microbulles sont censées se lier via un ligand à leur surface. La quantité générale du récepteur du biomarqueur sur le système vasculaire cible est souvent assez élevée, ce qui n’est peut-être pas de la plus haute importance. D’après la littérature brevet disponible18 , on pourrait suggérer qu’au moins 50 % du matériau de l’enveloppe lipidique et du ligand de ciblage dans les formulations de microbulles dans les essais cliniques pourraient être associés à la coquille de bulles. Cela peut généralement être comparé aux anticorps radiomarqués ou aux peptides qui sont largement utilisés dans les études d’imagerie des récepteurs de médecine nucléaire : la plupart de ceux qui ciblent les molécules de ligand ne transportent pas de radio-isotope « chaud », même pour l’activité spécifique la plus élevée signalée19, tandis que pour les microbulles ciblées, le matériau de la coquille de cette étude (y compris le ligand-lipide) est principalement attaché à des microbulles.
L’adhésion sélective de microbulles ciblées préparées par cette technique in vitro a été démontrée, dans deux séries de modèles de ciblage : l’adhésion statique et une expérience de ciblage en chambre d’écoulement. Dans un test statique, les microbulles ciblées ont adhéré étroitement à la couche réceptrice cible et n’ont pas été délogées avec un rinçage tampon, contrairement à un réglage de contrôle, où les microbulles ont été éliminées de la surface même avec un rinçage doux. De même, dans un essai à flux continu, effectué dans une chambre d’écoulement à plaques parallèles, les bulles biotinylées ont démontré une adhérence statistiquement significative et superbe à la couche de streptavidine sur une boîte en polystyrène, par rapport à la surface témoin contenant uniquement de l’albumine. Des microbulles décorées de peptides c(RGDfK) ont adhéré sélectivement à αvβ surface à3 couches, à la fois dans le test d’adhésion statique et dans une chambre d’écoulement de plaques parallèles.
Les problèmes suivants peuvent être considérés comme les limitations du protocole décrit. Tout d’abord, la procédure ne tient pas compte des particules submicroniques. L’instrument utilisé dans l’étude n’était pas configuré pour détecter les nanobulles (c’est-à-dire les particules de moins de 1 m de diamètre). Ces particules pourraient avoir été présentes dans la formulation. Bien que leur signal de rétrodiffusion acoustique soit généralement connu pour être faible, et qu’ils n’aient pas été observés dans cette étude par microscopie, la présence de nanobulles doit tout de même être prise en compte. Le deuxième problème important est l’hétérogénéité de taille des microbulles. Malgré l’élimination des particules plus grosses, la taille des bulles résultantes est loin d’être uniforme. Cela devrait être une considération et une justification pour des recherches plus approfondies dans le domaine de la formulation de microbulles.
En conclusion, le récit donné dans ce manuscrit devrait fournir un niveau de détail technique suffisant pour fabriquer rapidement et facilement des microbulles ciblées. Les étapes permettant d’effectuer une purification supplémentaire (si nécessaire), d’ajuster la taille et/ou d’évaluer la petite quantité de matériau de la coquille qui reste dans le milieu aqueux sont fournies. Les outils analytiques détaillés pour l’évaluation des paramètres des microbulles, tels que la distribution de taille et la concentration, et la capacité in vitro des microbulles décorées de ligands à adhérer aux récepteurs cibles sont décrits.
Déclarations de divulgation
A. Klibanov est co-fondateur et actionnaire minoritaire de Targeson Inc, une startup dans le domaine des microbulles ciblées précliniques, aujourd’hui dissoute. Son laboratoire UVA a un contrat de sous-traitance via NIH R44 HL139241 de SoundPipe Therapeutics.
Remerciements
A.L. Klibanov remercie en partie le NIH R01EB023055, accordé par le National Institute of Biomedical Imaging and Bioengineering des National Institutes of Health, un sous-contrat à l’Université de Virginie via le NIH R01NS076726, attribué à l’UCSF par le National Institute of Neurological Disorders and Stroke des National Institutes of Health, et un sous-contrat à l’Université de Virginie via la subvention NIH R44HL139241, décerné à SoundPipe Therapeutics par le National Heart, Lung, and Blood Institute. Le contenu de cette publication relève de la seule responsabilité de l’auteur et ne représente pas nécessairement les opinions officielles des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
Références
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.