Method Article
Preparazione e caratterizzazione di microbolle mirate
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è quello di preparare, purificare e caratterizzare microbolle riempite di gas (agenti di contrasto mirati per l'imaging molecolare ad ultrasuoni). Vengono descritti due sistemi di targeting: bolle biotinilate aderenti alla streptavidina e microbolle peptidiche RGD cicliche che si legano a αv β3, un noto biomarcatore di neovascolarizzazione tumorale.
Abstract
Il targeting delle microbolle (agenti di contrasto a ultrasuoni per l'imaging molecolare) è stato studiato per più di due decenni. Tuttavia, i metodi di preparazione delle microbolle e di targeting dell'attacco del ligando sono ingombranti, complicati e lunghi. Pertanto, è necessario semplificare la procedura di preparazione delle microbolle mirata per avvicinarla alla traslazione clinica. Lo scopo di questa pubblicazione è quello di fornire una descrizione dettagliata e una spiegazione dei passaggi necessari per la preparazione mirata delle microbolle, la caratterizzazione funzionale e il test. Viene presentata una sequenza delle procedure ottimizzate e semplificate per due sistemi: un modello di coppia di targeting biotina-streptavidina e un peptide RGD ciclico che ha come bersaglio la proteina ricombinante αvβ3 , che è sovraespressa sul rivestimento endoteliale della neovascolarizzazione tumorale.
Qui, mostriamo quanto segue: accoppiamento covalente del ligando di targeting a un ancoraggio lipidico, valutazione della qualità del reagente e test che confermano il completamento con successo della reazione; preparazione del mezzo precursore acquoso contenente i componenti della conchiglia delle microbolle, seguita dalla preparazione delle microbolle mediante amalgama; valutazione dell'efficacia del trasferimento lipidico sul guscio dello stabilizzatore di microbolle; regolazione della distribuzione delle dimensioni delle microbolle mediante flottazione a gravità normale per rimuovere le microbolle più grandi che potrebbero essere dannose per l'uso in vivo; valutazione della distribuzione dimensionale delle microbolle mediante rilevamento elettrozonale; valutazione del legame mirato delle microbolle alla superficie rivestita di recettore in un test di saggio di legame statico (in un piatto capovolto); e valutazione del legame mirato delle microbolle alla superficie rivestita di recettore in un test in camera di flusso a piastre parallele.
Introduzione
L'imaging molecolare con microbolle mirate è in fase di ricerca e test da oltre due decenni. Il concetto generale è semplice: le microbolle riempite di gas che possiedono un'affinità selettiva per il biomarcatore molecolare specifico dell'endotelio vascolare nell'area della malattia vengono iniettate per via endovenosa. Queste particelle circolano e si accumulano nel bersaglio (ad esempio, la neovascolarizzazione tumorale o l'area del danno infiammatorio ischemico). Le microbolle aderenti vengono quindi rilevate mediante ecografia con contrasto. I primi sforzi di ricerca concettuale del secolo scorso 1,2 stanno ora gradualmente progredendo verso l'adozione clinica: hanno raggiunto la fase di sperimentazione clinica su media scala solo pochi anni fa 3,4. Lo scopo di questo manoscritto è quello di fornire una spiegazione dettagliata sulla preparazione e la caratterizzazione di tali microbolle mirate, sulla base di due esempi pubblicati 1,5.
La procedura per la preparazione del peptide-PEG-fosfolipide, un componente cruciale per la formulazione di queste microbolle mirate, è integrata con la descrizione del controllo di qualità del reagente, come richiesto per il completamento con successo della reazione. Sfortunatamente, alcuni fornitori di reagenti lipidici a base di esteri attivi forniscono materiale che viene idrolizzato all'arrivo e quindi non è in grado di partecipare alla formazione del legame ammidico. Vengono fornite le informazioni sulla quantità di materiale lipidico trasferito sul guscio delle microbolle dal mezzo acquoso durante la preparazione delle microbolle, nonché la tecnica per ottenere queste informazioni.
È importante preparare microbolle con una distribuzione granulometrica relativamente stretta: la co-presenza di grandi microbolle nel terreno iniettabile per i test intravascolari in vivo può portare all'intasamento della microvascolarizzazione; L'accumulo aspecifico di microbolle che bypassano gli shunt polmonari potrebbe causare un aumento tissutale aspecificofalso positivo 6, che viene evitato rimuovendo microbolle di dimensioni maggiori. Pertanto, viene presentata una semplice procedura per ottenere la selezione della dimensione delle particelle, integrata dalla descrizione di un metodo per valutare la concentrazione e la distribuzione dimensionale delle particelle con un contatore di particelle.
Il primo protocollo di test per la valutazione del targeting delle microbolle, come presentato di seguito, descrive un sistema puramente modello, con microbolle biotinilate mirate alla superficie rivestita di streptavidina1. Il secondo protocollo si basa su un manoscritto che descrive la preparazione semplificata di microbolle mirate a peptidi, decorate con un peptide RGD ciclico che possiede un'affinità specifica verso αv β3, un biomarcatore molecolare della neovascolarizzazione tumorale5. È stato dimostrato che le microbolle decorate con questo ciclo[Arg-Gly-Asp-D-Phe-Lys], cioè il peptide c(RGDfK) con la tecnica presentata, mirano alla neovascolarizzazione tumorale e ottengono l'imaging molecolare ad ultrasuoni in un modello di tumore murino.
Protocollo
1. Accoppiamento covalente del peptide a NHS-PEG-DSPE
- Sciogliere il peptide c(RGDfK) con il ε-amminogruppo primario della lisina non protetto e disponibile per l'accoppiamento, in dimetilsolfossido (DMSO, 10 mg/mL). Preparare una soluzione di metanolo o cloroformio di N-idrossisuccinimmide estere di poli(etilenglicole)-3400-distearoilfosfatidiletanolammina (NHS-PEG-DSPE, 200 mg/mL) e aggiungere a 1 mg di peptide in DMSO. Aggiungere 3 μL di N,N-diisopropil etilammina (DIPEA).
- Mantenere un rapporto molare peptide-NHS-PEG-DSPE di almeno 1:1,2, in modo che tutti i gruppi amminici primari siano in grado di reagire. Mantenere un rapporto molare DIPEA:peptide di almeno 2:1 per garantire le condizioni di base del terreno.
ATTENZIONE: Il cloroformio, il metanolo e il DIPEA sono materiali pericolosi. Utilizzare protezioni adeguate, come guanti, camice da laboratorio, occhiali e cappa aspirante.
NOTA: Qualsiasi altro peptide o mimetico con un gruppo amminico primario può essere utilizzato al posto di c(RGDfK), con N-terminale non protetto o una lisina situata al di fuori del sito di legame. Affinché la reazione proceda, tutti i componenti (cioè il ligando e il lipide che hanno come bersaglio) devono essere solubili in una miscela DMSO-cloroformio. Possono essere testati anche solventi alternativi, come la dimetilformammide, o le sue miscele. È possibile anche la reazione in mezzi acquosi, ma la resa di accoppiamento sarà molto più bassa a causa della rapida idrolisi dell'estere attivo.
- Mantenere un rapporto molare peptide-NHS-PEG-DSPE di almeno 1:1,2, in modo che tutti i gruppi amminici primari siano in grado di reagire. Mantenere un rapporto molare DIPEA:peptide di almeno 2:1 per garantire le condizioni di base del terreno.
- Dopo l'incubazione notturna a temperatura ambiente, rimuovere il materiale organico volatile mediante evaporazione (utilizzare un flusso di azoto gassoso o un evaporatore rotante, seguito da un'evaporazione notturna sotto una pompa ad alto vuoto, per rimuovere il DMSO). Risciogliere il residuo non volatile nel cloroformio a 1 mg/mL per un campionamento controllato.
- Confermare il completamento della reazione mediante cromatografia su strato sottile (sviluppare piastre TLC in terreno solvente cloroformio:metanolo, 2:1 v/v). Confermare la presenza o l'assenza del gruppo amminico primario con spray di ninidrina dopo aver riscaldato la piastra su un blocco riscaldante a 150 °C.
ATTENZIONE: La ninidrina è un materiale pericoloso. Utilizzare una protezione adeguata, come descritto sopra. Il trattamento del blocco riscaldante delle piastre TLC deve essere eseguito in una cappa aspirante. Il blocco riscaldante è un potenziale pericolo di incendio. - Prima della preparazione delle microbolle, aliquotare un campione di peptide-PEG-DSPE dal cloroformio (ad es. 1 mL di soluzione da 1 mg/mL), far evaporare il cloroformio fino a secchezza in un flusso di azoto gassoso, con successiva incubazione con pompa ad alto vuoto, e aggiungere soluzione salina a 1 mg/mL, per ottenere una soluzione micellare trasparente.
- Se è auspicabile un'ulteriore purificazione della miscela di reazione, scioglierla nuovamente in soluzione fisiologica. Quindi sottoporre la miscela micellare risultante a dialisi (cut-off del peso molecolare di 6-8 kDa, o simile), prima contro soluzione fisiologica normale e poi contro diversi cambi di acqua deionizzata.
- Confermare il completamento della dialisi mediante un controllo della conducibilità del dializzato. Rimuovere il materiale dializzato dalla sacca per dialisi, metterlo in una fiala di massa nota e liofilizzare fino a completa asciugatura.
NOTA: È disponibile una reazione covalente alternativa per legare il ligando all'estremità del PEG-lipide (ad esempio, una reazione di maleimmide-PEG-DSPE con il tiolo-ligando). Il vantaggio principale di questo approccio è l'accoppiamento orientato, se un singolo tiolo è disponibile sulla molecola del ligando 7. La preoccupazione principale è la stabilità a lungo termine: il legame risultante tra maleimmide e tiolo può essere soggetto a degradazione da una reazione retro-Michael, a seconda delle condizioni di conservazione 8.
NOTA: La qualità dei reagenti a base di esteri attivi varia notevolmente tra i produttori: può dipendere dalle condizioni di trasferimento e conservazione (se il materiale non viene immagazzinato o trasportato correttamente, l'estere attivo si idrolizzerà e non sarà in grado di accoppiarsi con il peptide). Di conseguenza, c'è un senso di obbligo nel descrivere una procedura (vedi sotto) per la determinazione del grado di degradazione di NHS-PEG-DSPE, un reagente per l'attaccamento covalente di ligandi di targeting a microbolle. NHS-PEG-DSPE, fornito come polvere secca sotto argon, viene conservato in congelatore. Una fiala viene portata a temperatura ambiente (per evitare la condensazione dell'umidità), un campione pesato, utilizzando una bilancia analitica, e disciolto in metanolo o DMSO. Una fiala con reagente secco sfuso deve essere chiusa sotto argon e rimessa in congelatore, in un contenitore sigillato con essiccante, fino a nuovo utilizzo. - Preparare una soluzione micellare acquosa di peptide-PEG-DSPE (Passaggio 1.4), nonché di biotina-PEG-DSPE, mediante semplice aggiunta di reagente secco a soluzione salina acquosa e incubazione. Si formano piccole micelle sferiche. Per accelerare il trasferimento del reagente dallo stato di massa alla forma micellare, è possibile applicare la sonicazione e il bagno di acqua calda.
- Valutare la qualità del reagente dell'estere attivo NHS-PEG-DSPE.
- Confermare che l'NHS presente nel reagente sia sotto forma di estere attivo, per poter eseguire la reazione di accoppiamento con la formazione del legame ammidico.
- Posizionare 0,99 mL di tampone tetraborato di sodio 0,1 M, pH 9,2, in una cuvetta di plastica trasparente al quarzo o ai raggi ultravioletti (non di vetro) in uno spettrofotometro e azzerare alla lunghezza d'onda di 260 nm.
- Aggiungere 10 μl della soluzione appena preparata di 200 mg/mL di NHS-PEG-DSPE in metanolo nella cuvetta. Allo stesso tempo, avviare il cronometro. Mescolare rapidamente e vigorosamente il contenuto della cuvetta per ottenere uniformità. Posizionare la cuvetta nel fotometro, chiudere il coperchio e avviare la misurazione.
- All'inizio della misurazione dello spettrofotometro, segnare l'ora di inizio della registrazione ed eseguire continuamente misurazioni fotometriche dell'assorbanza a 260 nm ogni 10 s per ~10 minuti o fino alla stabilizzazione del valore di assorbanza.
- Tracciare la curva cinetica, controllare i punti temporali iniziali di A260 ed estrapolare la curva al momento di inizio della reazione (cioè, scoprire A260 nel punto in cui il reagente è stato aggiunto al tampone acquoso ed è iniziata la reazione di idrolisi). Si supponga che prima dell'aggiunta di NHS-PEG-DSPE al tampone nella cuvetta non si sia verificata alcuna idrolisi nel solvente organico a causa della mancanza di acqua.
- Calcolare il rapporto tra A260 all'inizio della reazione e al completamento dell'idrolisi; Rappresenta la frazione dell'estere attivo degradato. Utilizzare queste informazioni per selezionare la quantità corretta di NHS-PEG-DSPE per la modifica completa del gruppo amminico primario del peptide.
2. Preparazione di microbolle per amalgama
- Preparazione di microbolle biotinilate
- Co-dissciogliere la distearoilfosfatidilcolina (DSPC) e lo stearato PEG nel glicole propilenico (PG, concentrazione di 10 mg/mL per ciascuno in solvente intero). Utilizzare un bagno di acqua calda per solubilizzare i materiali.
- Aggiungere 0,1 mL di questa soluzione PG calda a un flaconcino contenente 0,85 mL di soluzione fisiologica normale, mescolare rapidamente e aggiungere biotina-PEG-DSPE micellare (50 μL, 1 mg/mL in soluzione fisiologica) in un rapporto di massa di 1:20 a DSPC.
NOTA: La solubilità dei componenti lipidici nel PG dipende dalla temperatura, quindi è necessario un bagno di acqua calda. È utile riscaldare la fiala di vetro contenente soluzione salina in un bagno di acqua calda prima dell'aggiunta di lipidi, per creare un mezzo uniforme senza particelle visibili. - Portare il flaconcino a temperatura ambiente, posizionare un tappo di gomma sul flaconcino inserito a metà e inserire il tubo capillare in PTFE nel flaconcino. Utilizzare il flusso di gas decafluorobutano per riempire la fiala, quindi chiudere il tappo, rimuovendo il capillare.
NOTA: La temperatura della fiala durante l'amalgama può avere un effetto significativo sulla distribuzione dimensionale delle microbolle risultanti 9. - Crimpare il flaconcino con tappo, a temperatura ambiente, e metterlo in un apparecchio amalgamatore. Avviare l'amalgamatore. L'unità clinica utilizzata è preimpostata per funzionare a 4300 giri/min per 45 secondi.
- Al termine dell'amalgamazione, rimuovere la fiala con le microbolle risultanti dall'amalgamatore. Preferibilmente, caratterizzare la distribuzione e la composizione delle dimensioni delle microbolle e utilizzarle entro diverse ore dalla preparazione.
- Preparazione di microbolle decorate con peptidi
- Co-sciogliere DSPC e PEG stearato in PG puro (concentrazione di 10 mg/mL per ciascun materiale). Utilizzare un bagno di acqua calda per solubilizzare. Aggiungere 0,1 mL di questa soluzione calda in PG a un flaconcino contenente 0,85 mL di soluzione fisiologica normale calda, mescolare rapidamente e aggiungere peptide micellare-PEG-DSPE (50 μL, 1 mg/mL in soluzione fisiologica) aggiunto a un rapporto di massa 1:20 a DSPC.
- Portare il flaconcino a temperatura ambiente, posizionare un tappo di gomma sopra il flaconcino, inserito a metà, e inserire il tubo capillare in politetrafluoroetilene (PTFE) nel flaconcino. Utilizzare il flusso di gas decafluorobutano per riempire la fiala, quindi chiudere il tappo, rimuovendo il capillare.
- Crimpare il flaconcino con tappo e metterlo in un amalgamatore per la miscelazione. Il flacone con dispersione di microbolle è pronto in 45 s.
- Preparazione di microbolle lipidiche coloranti per la valutazione del trasferimento dei lipidi al guscio delle microbolle
- Co-sciogliere DSPC e PEG stearato in PG puro, come descritto sopra (utilizzare un bagno di acqua calda) (concentrazione di 10 mg/mL per ciascun materiale).
- Aggiungere 0,1 mL di questa soluzione di PG calda a un flaconcino con 0,89 mL di soluzione fisiologica normale calda, mescolare rapidamente, aggiungere 10 μL di soluzione colorante DiI (1 mg/mL in PG puro) e mescolare. Portare la fiala a temperatura ambiente.
- Riempire lo spazio di testa del flaconcino con gas decafluorobutano come sopra, tappare il flaconcino, crimpare e amalgamare come descritto sopra.
3. Testare il trasferimento dei lipidi DiI dal mezzo acquoso micellare al guscio della bolla
- Per la conferma al microscopio che il materiale lipidico fluorescente si è trasferito dal mezzo acquoso al guscio delle microbolle, prelevare un'aliquota di microbolle dalla fiala attraverso il setto con una siringa da insulina.
- Quindi aggiungere una goccia a un vetrino e coprirlo con un vetrino coprioggetti standard. Per prima cosa diluirlo con una goccia di soluzione salina degassata.
- Eseguire la microscopia con un videomicroscopio, dotato di epi-illuminazione a fluorescenza, obiettivo ad olio 100x e videocamera ad alta sensibilità.
- Per determinare l'efficacia del trasferimento di materiale lipidico dal mezzo acquoso salino/PG al guscio della bolla durante l'amalgamazione, prendere una fiala sigillata di microbolle, capovolgerla e metterla in una provetta conica da 50 mL.
- Eseguire la centrifugazione in un rotore a secchiello (10 min, 200 x g). Togliere il flaconcino dalla centrifuga e tenerlo capovolto.
- Inserire l'ago di una siringa da insulina nel setto del flaconcino capovolto. Aspirare lentamente un piccolo volume (~50 μL) di infranatante trasparente.
NOTA: La punta smussata dell'ago per l'aspirazione a infranatanti dalla fiala capovolta dopo la centrifugazione deve essere posizionata il più vicino possibile al setto, per ridurre al minimo le possibilità di assunzione di microbolle.
- Collocare i campioni di infranatante (2 μL), nonché i campioni del terreno lipidico-PG-salino originale utilizzato per generare microbolle (2 μL) in una piastra a 96 pozzetti con 0,1 mL di soluzione salina tamponata con fosfato (PBS):terreno 1:1 di etanolo con Triton X-100 all'1%.
- Misurare la fluorescenza rossa del colorante DiI (555 nm di eccitazione, 620 nm di emissione) con un lettore di micropiastre a fluorescenza.
- Utilizzare piastre nere con fondo non trasparente per la spettroscopia di fluorescenza a causa del fondo inferiore e della mancanza di trasferimento del segnale tra pozzetti che può diventare un problema per le piastre trasparenti.
- Assicurarsi che il segnale di fluorescenza rientri nell'intervallo di calibrazione lineare: un'eccessiva concentrazione di colorante nei pozzetti può portare a un'attenuazione della luce e a un segnale sottostimato.
NOTA: A volte può essere desiderabile rimuovere il materiale residuo del guscio che rimane nel mezzo acquoso dopo l'amalgama. A tale scopo, dopo la centrifugazione per flottazione a microbolle, prelevare tutto il volume dell'infranatante mediante aspirazione lenta dal flacone capovolto e sostituirlo con soluzione fisiologica degassata. Per evitare un'eccessiva variazione della pressione ambiente nel flaconcino dovuta alla rimozione o all'aggiunta di liquido, inserire un ago lungo aggiuntivo nel setto per raggiungere la fase gassosa all'interno del flaconcino. Per mantenere la fase gassosa all'interno del flaconcino, per prima cosa, collegare l'ago a una siringa riempita di gas fluorocarburi, per evitare il contatto dell'aria con la preparazione a microbolle.
4. Regolazione della distribuzione delle dimensioni delle microbolle
- Utilizzare la normale flottazione a gravità in una fiala statica rovesciata per regolare la distribuzione dimensionale delle microbolle, cioè per rimuovere le microbolle più grandi in modo rapido ed efficiente 5,10.
- Assumere un flaconcino di microbolle immediatamente dopo la preparazione come descritto nel paragrafo 2. Capovolgere e posizionare a testa in giù su una superficie stabile e non vibrante per 15-20 minuti.
- Dopo questa incubazione, inserire un ago per siringa da insulina nel setto della fiala, mentre è ancora capovolto, e raccogliere delicatamente 300-500 μL di microbolle dallo strato inferiore.
NOTA: L'ago della siringa deve rimanere vicino alla superficie interna del setto per evitare la raccolta di bolle più grandi presenti più vicino alla parte superiore del liquido nel flaconcino.- Tirare indietro lentamente lo stantuffo della siringa, per evitare turbolenze e dilatazioni idrostatiche delle bolle nel corpo della siringa. Quando il campione raccolto viene estratto dalla siringa, evitare la sovrapressione per evitare il collasso delle bolle.
- Trasferire la dispersione di microbolle dalla siringa in un flaconcino di piccolo volume. Quindi riempire con gas perfluorurato, tappare e crimpare, per lo stoccaggio a breve termine, il conteggio delle particelle (vedi sotto) e un ulteriore utilizzo.
- Se il campionamento viene eseguito direttamente dalla siringa, tenerla orizzontalmente e ruotarla per evitare la flottazione delle bolle e ottenere l'uniformità del campione.
5. Valutazione della distribuzione dimensionale delle microbolle
- Utilizzare un contatore di particelle (basato sul rilevamento dell'elettrozona o sul principio dell'oscuramento della luce) per valutare la distribuzione e la concentrazione delle dimensioni delle particelle. In alternativa, utilizzare un emocitometro e un microscopio.
- In breve, aggiungere un'aliquota di campione di microbolle in soluzione salina normale o isotone in una controcamera (tipicamente, volume 60-100 mL) e contare. Confrontare le distribuzioni dimensionali delle microbolle prima e dopo la purificazione per flottazione.
NOTA: Sottoporre la fiala a una miscelazione delicata (non a vortici) immediatamente prima del campionamento, per ottenere misurazioni rappresentative e riproducibili. Campione dal centro del volume testato. - Riempire un becher da 100 mL con almeno 60 mL di diluente in soluzione salina allo 0,9% e posizionarlo sul tavolino dello strumento di invio dell'elettrozona. Sollevare il tavolino in modo che il tubo, la piastra dell'elettrodo esterno e l'agitatore siano completamente immersi nel diluente e l'agitatore possa ruotare.
NOTA: Il volume del diluente nel becher può essere determinato con precisione utilizzando la sua massa, con una scala (la densità salina è vicina a 1). In alternativa, è possibile utilizzare una pompa dosatrice. Gli elettrodi durante lo studio del rilevamento dell'elettrozona devono essere completamente immersi. - Registrare il volume dell'elettrolita del diluente nel software di controllo dell'unità. Il contatore di rilevamento per elettrozona è dotato di orifizio da 50 μm, che consente la misurazione di particelle di diametro compreso tra 1 e 30 μm. Eseguire prima un'esecuzione in background; si prevede che abbia meno di 5000 conteggi in 0,5 mL di diluente come bianco. I migliori livelli di sfondo possono essere inferiori a 100 conteggi.
- Impostare il volume del campione nel software di controllo dell'unità, per tenere conto del fattore di diluizione. Aggiungere 10-20 μl della miscela di microbolle al becher ed eseguire la seconda corsa.
- Utilizzare i dati di distribuzione delle dimensioni dello sfondo per tenere conto dell'uso della funzione "sottrai esecuzione in background" all'interno del software. Ottenere la concentrazione delle particelle nel campione originale di microbolle come numero di particelle/mL; Include il fattore di diluizione.
- La superficie esterna del puntale della pipetta potrebbe anche essere ricoperta di bolle durante il campionamento; Assicurarsi di pulirlo prima di inserire la punta nel mezzo di conteggio. Non toccare l'orifizio della punta della pipetta con una salvietta.
- Evitare diluizioni insufficienti delle particelle del campione durante il conteggio, per ridurre al minimo i problemi con la correzione delle coincidenze, dove più di una particella alla volta si trova all'interno dell'orifizio del sensore: il sistema potrebbe quindi sottostimare la concentrazione di particelle.
NOTA: Il diametro dell'orifizio per il conteggio delle particelle può variare. La selezione dell'orifizio da 50 μm consente il rilevamento di microbolle con diametro fino a 1 μm, ma non è così incline all'intasamento come le opzioni di diametro inferiore. - Calibrare il contatore di rilevamento dell'elettrozona per gli stessi mezzi di prova del diluente (ad esempio, soluzione di irrigazione salina normale filtrata sterile) utilizzati nei test reali. Un'alternativa di oscuramento laser al rilevamento elettrozonale ha il vantaggio di non aver bisogno di soluzione salina filtrata con concentrazione salina e conducibilità elettrica controllate.
- In breve, aggiungere un'aliquota di campione di microbolle in soluzione salina normale o isotone in una controcamera (tipicamente, volume 60-100 mL) e contare. Confrontare le distribuzioni dimensionali delle microbolle prima e dopo la purificazione per flottazione.
6. Test del targeting a microbolle in vitro in un saggio di aderenza/ritenzione
- Preparare la superficie del recettore del biomarcatore per il targeting delle microbolle alle piastre di Petri.
- Prendi come superficie di destinazione piatti di polistirolo di diametro 35 mm da utilizzare. Sfrutta l'adesione aspecifica delle proteine alla superficie della capsula di polistirene rispetto alla normale soluzione salina. Utilizzare una proteina modello, la streptavidina, per testare il targeting di bolle biotinilate che contengono biotina-PEG-DSPE come parte del guscio.
- Posizionare una goccia di soluzione di streptavidina (0,2 mL, 10 μg/mL in PBS) al centro di ciascuna piastra di Petri e coprirla con un vetrino coprioggetti di plastica da 22 mm x 22 mm per consentire un rivestimento uniforme della superficie della piastra. Dopo un'incubazione notturna a 4 °C in un ambiente umido chiuso per evitare che la capsula si secchi, rimuovere i vetrini.
- Lavare immediatamente ed esaustivamente le piastre con acqua, PBS, e bloccarle mediante incubazione con albumina sierica bovina (BSA) all'1,5% in PBS per almeno 4 ore per ridurre al minimo l'adesione aspecifica delle microbolle alla superficie non rivestita. Utilizzare i piatti di coltura puliti bloccati con l'1,5% di BSA come controlli.
- In alternativa, utilizzare una soluzione ricombinante del recettore αVβ 3 (ad es. a 4 μg/mL in PBS)5 al posto della streptavidina. Indirizzare le microbolle a questo biomarcatore tramite il ligando ciclico del peptide RGD attaccato al guscio della microbolla.
- Mantenere bagnato il piatto con il recettore bersaglio depositato: la proteina del recettore può essere inattivata se si asciuga.
NOTA: È importante utilizzare proteine recettoriali prive di trasportatori che non contengano proteine trasportatrici o tensioattivi nel terreno: la loro presenza inattiverà l'adesione.
- Adesione di microbolle in una piccola gocciolina: controllo rapido dell'adesione mirata in condizioni statiche.
- Depositare una goccia di microbolle (5-20 μL) da sotto sulla superficie del bersaglio (o solo BSA di controllo) in una capsula di Petri capovolta. Questo porterà le bolle sulla superficie rivestita dal recettore mediante flottazione.
- Dopo 5-10 minuti di incubazione della piastra capovolta in un ambiente umido, capovolgere la piastra in una posizione normale, riempirla con PBS e risciacquare delicatamente per rimuovere le microbolle libere. Eseguire la microscopia in campo chiaro per valutare l'adesione mirata.
- Adesione di microbolle sulla superficie della piastra di Petri: eseguire il targeting in una piastra piena1.
- Prendere la capsula, che ha un rivestimento superficiale del recettore, e riempirla completamente con tampone PBS-BSA degassato (oltre 10 ml per la piastra da 35 mm), in modo che il menisco del tampone si estenda sopra la parte superiore della capsula e sia trattenuto dalla forza capillare. Iniettare le bolle (50 μL) nella maggior parte del tampone e mescolare rapidamente per ottenere l'omogeneità. Evitare la formazione di bolle d'aria durante la miscelazione.
- Posiziona rapidamente un segmento di nastro adesivo trasparente per pacchi o un nastro sigillante per piastre di coltura, sostenuto da un pezzo di plastica piatto, sul piatto. Sigillare a pressione la pellicola sul piatto, capovolgere il "gruppo" e posizionarlo a testa in giù per 30 minuti per consentire alle microbolle di galleggiare verso l'alto, toccare la superficie target e aderire.
- Capovolgere il "gruppo" del piatto sigillato in configurazione "a testa in giù", rimuovere il sigillo e lavare via le microbolle non aderenti risciacquando con una soluzione tampone degassata. Osservare le microbolle mirate mediante microscopia o ecografia.
NOTA: Quando il piatto sigillato capovolto completamente riempito con la dispersione di microbolle viene incubato, può essere posizionato con una leggera angolazione, quindi se sono presenti bolle di grandi dimensioni, galleggeranno sul bordo del piatto, al di fuori della regione centrale di interesse. Il risciacquo forzato con flusso veloce proveniente da una punta di micropipetta durante la microscopia può essere utilizzato per valutare la fermezza con cui le bolle aderiscono al bersaglio (le bolle si staccano completamente dalla superficie di controllo anche in caso di flusso lento) 11. Il tampone degassato è preferibile per la diluizione delle bolle, perché l'eccesso di aria disciolta porterà alla crescita incontrollata di microbolle.
7. Test del targeting delle microbolle in vitro: valutazione dei saggi dinamici di adesione/ritenzione in una camera di flusso a piastre parallele
NOTA: Testiamo l'adesione delle bolle biotinilate allo strato di streptavidina con l'ecografia.
- Utilizzare una camera di flusso a piastre parallele disponibile in commercio con un supporto per inverter personalizzato per osservare l'adesione mirata a una piastra di Petri da 35 mm da un fluido in movimento. Dopo l'adsorbimento della proteina bersaglio nella piastra (vedere 6.1.1), inserire il corpo della camera con la guarnizione preinstallata nella piastra e sigillarlo nel supporto. Utilizzare guarnizioni con altezza del canale (cioè spessore della guarnizione) 0,127 mm e larghezza del canale 2,5 mm.
NOTA: Durante l'assemblaggio della camera di flusso a piastre parallele, la quantità di grasso siliconico utilizzata sulla guarnizione deve essere minima. Evitare che il grasso penetri nell'area del canale: evitare di coprire di grasso la superficie rivestita di proteine del biomarcatore. Per ottenere una tenuta adeguata, selezionare attentamente le piastre da 35 mm (vedere la tabella dei materiali per le informazioni sulla camera e sulla capsula). - Per il gruppo della camera di flusso, non avvitare troppo saldamente il tappo e il telaio che tiene troppo stretta la combinazione piatto-camera di flusso, per evitare perdite.
- Collegare il tubo di flusso a una pompa a siringa azionata in modalità di prelievo e, sul lato dell'alimentatore, collegare un sottile tubo in polietilene (PE50) alla fiala con una dispersione di microbolle diluite, sottoposta a miscelazione costante con una barra di agitazione tramite un agitatore magnetico12. Controllare il parametro della velocità di taglio della parete (WSR) della camera regolando la portata volumetrica della pompa in base alla formula 6Q/bh2, dove Q è la portata, 'b' è la larghezza del canale e 'h' è l'altezza del canale.
NOTA: Rimuovere le bolle d'aria dall'intero sistema prima della perfusione del mezzo contenente microbolle o PBS, poiché qualsiasi bolla d'aria che passa attraverso il canale rimuoverà le microbolle aderenti dalla superficie del bersaglio e invaliderà l'esperimento. Il collegamento tra il tubo della camera di flusso e la siringa deve essere adeguatamente sigillato. - Preparare una dispersione di microbolle aggiungendo un volume calcolato di bolle concentrate al serbatoio delle microbolle (una fiala di scintillazione da 20 mL) per ottenere una concentrazione di 10-6 microbolle/mL, in tampone PBS con 0,1% di BSA. Posizionare il serbatoio di alimentazione su un agitatore a piastra magnetica. Inserire un'ancoretta magnetica di 1 cm x 2 cm e mescolare a ~400 giri/min per mantenere l'omogeneità durante il corso dello studio.
- Eseguire l'ecografia della camera di flusso in un serbatoio dell'acqua13.
- Immergere il gruppo della camera di flusso in acqua degassata e tenerlo in posizione con un peso per impedirne il movimento durante gli esperimenti.
- Posizionare la sonda di imaging bloccata direttamente sopra il canale e inclinarla di un angolo di 15° all'indietro, nonché di un angolo di 5° in senso orario per ridurre al minimo la riflessione speculare dalla superficie della parabola. Posizionare il canale della camera di flusso all'interno del piano di imaging.
- Utilizzare le seguenti condizioni di imaging: trasduttore 15L8, modalità di imaging specifica per contrasto, gamma dinamica 50 dB, 7 MHz, indice meccanico (MI) = 0,18, guadagno CPS = 0. Mantieni la compensazione del guadagno di tempo uniforme su tutta l'immagine.
- Posizionare la superficie del trasduttore in modo che tocchi la superficie dell'acqua, non in profondità. In alternativa, utilizzare una guaina protettiva in gomma riempita con gel per ultrasuoni.
NOTA: Per garantire un posizionamento riproducibile del sistema della camera di flusso per l'imaging, i marcatori devono essere posizionati sulla vasca dell'acqua o sullo schermo del sistema a ultrasuoni.
- Aspirare la dispersione di microbolle dal serbatoio attraverso la camera e nella pompa per 2 minuti.
- Commutare il flusso su PBS, per rimuovere le bolle non aderenti dal canale e valutare la retrodiffusione acustica delle restanti bolle aderenti (mirate). Per ottenere un'immagine di sfondo, aumentare l'MI a 1,9 per distruggere le bolle aderenti nel campo visivo dell'imaging ecografico.
NOTA: La dispersione delle microbolle deve essere sostituita per cicli ripetuti: ad alta diluizione, le microbolle si degradano gradualmente con il tempo.
- Commutare il flusso su PBS, per rimuovere le bolle non aderenti dal canale e valutare la retrodiffusione acustica delle restanti bolle aderenti (mirate). Per ottenere un'immagine di sfondo, aumentare l'MI a 1,9 per distruggere le bolle aderenti nel campo visivo dell'imaging ecografico.
- Esporta singole immagini dal flusso video di registrazione dello schermo: prima del lavaggio PBS, dopo il lavaggio e dopo la distruzione, da importare in ImageJ per l'analisi offline. Selezionare la regione di interesse (ROI) per escludere le parti di ingresso e uscita della camera. Dopo aver sottratto il segnale ROI di fondo, quantificare l'intensità dell'eco come l'intensità media dei pixel all'interno della ROI.
NOTA: In alternativa all'imaging a ultrasuoni, l'adesione delle microbolle alla superficie del bersaglio può essere osservata mediante videomicroscopia, quando il gruppo della camera di flusso a piastre parallele nel supporto invertito viene posizionato su un tavolino di un microscopio composto, con registrazione video 5,11,12,14. Ciò è particolarmente utile per l'imaging dell'adesione mirata di microbolle ai recettori dei biomarcatori della superficie cellulare in coltura cellulare, quando le cellule che esprimono il recettore vengono coltivate sulla piastra di coltura tissutale e il numero di microbolle legate a ciascuna cellula bersaglio può essere contato direttamente.
Risultati
Accoppiamento covalente di peptide e lipide
Il completamento della reazione e la formazione del prodotto desiderata sono stati confermati da TLC. Un controllo peptidico separato non reagito non si è spostato verso l'alto durante la TLC: è stato trattenuto all'inizio e il suo punto era positivo per il gruppo amminico primario, come osservato dopo lo spray con ninidrina, dopo il riscaldamento. Questa macchia peptidica libera positiva alla ninidrina non è stata più osservata nella miscela dopo il completamento della reazione, dopo la TLC del campione della miscela di reazione, dopo la rimozione di DIPEA, DMSO e la ridissoluzione in cloroformio. Per quanto riguarda la questione cruciale della qualità del reagente estere NHS, la Figura 1 presenta la traccia spettrofotometrica della cinetica di idrolisi, con il punto di tempo zero all'inizio della reazione che è quando l'estere NHS in un solvente organico è stato aggiunto alla cuvetta. Ciò conferma la funzionalità dell'estere attivo NHS della carbossi-PEG-DSPE (vedi Sezione 1 dei metodi). Al punto di tempo zero, l'estrapolato A260=0,33 rappresenta il materiale che era già stato idrolizzato prima del test. Al completamento della reazione di idrolisi, in eccesso di 10-15 min, A260=1.54 (quando l'assorbanza non aumenta più considerevolmente). Ciò conferma la presenza di estere attivo. Fornisce inoltre dati quantitativi, che oltre il 78% del materiale non è NHS pre-idrolizzato, e può quindi essere utilizzato con successo per l'accoppiamento peptidico, con la corretta regolazione della quantità di reagente.
Preparazione e trasferimento del materiale lipidico dal mezzo acquoso al guscio della bolla: lipidi di fluorescenza
Le microbolle per questo studio sono state preparate per contenere una traccia (inferiore all'1%) del colorante fluorescente DiI, con caratteristica fluorescenza rossa, che è stato aggiunto come soluzione in PG alla soluzione salina-PG di DSPC e PEG stearato. Le microbolle risultanti dimostrano chiaramente la fluorescenza del guscio quando l'eccitazione della luce verde e i filtri di emissione rossi vengono utilizzati nel microscopio (vedi Figura 2, a sinistra). La microscopia in campo chiaro della fase gassosa a microbolle (Figura 2, a destra) può essere confrontata con la fluorescenza della conchiglia a microbolle. Per la valutazione quantitativa del trasferimento di materiale lipidico dalla fase acquosa al guscio della bolla, le microbolle sono state fatte galleggiare mediante centrifugazione e il segnale di fluorescenza della fase infranatante chiara è stato confrontato con la fluorescenza della soluzione iniziale, prima dell'amalgama delle microbolle. È stata osservata una riduzione del segnale di quasi un ordine di grandezza (Figura 3), ovvero oltre l'85% del materiale lipidico si è trasferito al guscio della microbolla per amalgama.
Preparazione e correzione della distribuzione dimensionale delle microbolle
Le microbolle generate dall'amalgama hanno dimostrato una distribuzione dimensionale tipica, con un'alta concentrazione (ad esempio, ~4,8 x 109 particelle per mL per le bolle biotinilate). La distribuzione dimensionale era ampia, con particelle presenti all'interno del range misurato (tra 1 e 30 μm); ~6,3% le microbolle superano i 5 μm di diametro (Figura 4, curva verde). La somministrazione intravascolare di microbolle di grandi dimensioni può portare al loro accumulo aspecifico nei capillari sanguigni e deve essere evitata. Una breve flottazione (15-17 minuti) della fiala capovolta in gravità normale, con la successiva raccolta di 0,3 mL vicino alla superficie del setto, consente la rimozione completa delle microbolle più grandi, con una perdita minore nella concentrazione totale del numero di particelle, fino a ~4,6 x 109: dopo la flottazione, solo lo 0,01% delle particelle nel campione purificato ha diametri superiori a 5 μm (Figura 4, curva rossa).
Adesione di microbolle alla superficie rivestita di recettore: saggio statico
Questa procedura è stata descritta per la prima volta nel secolo scorso1 e viene utilizzata come test rapido che conferma la funzionalità delle microbolle mirate. Le microbolle possono entrare in contatto con la superficie del piatto che trasporta il recettore. Se avviene l'interazione ligando-recettore, le bolle possono essere trattenute sulla superficie nonostante il lavaggio vigoroso. Viene presentato un esempio di tale test rapido dell'adesione funzionale di microbolle di c(RGDfK) sulla superficie rivestita con αricombinante vβ3 . La Figura 5 è un'immagine rappresentativa al microscopio in campo chiaro di microbolle aderenti sulla superficie del recettore in una piastra di Petri, dopo un lavaggio con PBS, per rimuovere le bolle non legate. Le bolle in questo tipo di microscopia si presentano come modelli circolari scuri. In condizioni simili, se la superficie è rivestita solo di albumina (per bloccare l'adesione aspecifica), le microbolle non aderiranno e saranno facilmente lavate via anche dal risciacquo delicato.
Legatura di microbolle dal fluido che scorre: camera di flusso a piastre parallele
Questa procedura è stata inizialmente proposta come strumento per lo studio dell'adesione cellulare in un ambiente a flusso controllato15 e adattata per lo studio del targeting delle microbolle decenni dopo11. Il test in un sistema a flusso continuo, a differenza di un test statico, è molto più realistico per uno scenario di imaging clinico, in cui le bolle circolanti in un flusso di sangue toccano brevemente la parete del vaso e possono aderire ad essa se è presente il recettore bersaglio. Vengono presentati due esempi di tali studi. Il primo esempio è un approccio più tradizionale, in cui l'adesione di microbolle decorate con peptidi alla superficie rivestita dal recettore viene monitorata mediante videomicroscopia. La microscopia permette di distinguere le microbolle aderenti da quelle che scorrono. Consente inoltre di quantificare le microbolle aderenti nel fotogramma del microscopio: molte più microbolle di c(RGDfK) (colonna di sinistra) aderiscono alla superficie, rispetto al controllo, dove viene utilizzato il peptide c(RADfK) strapazzato, o se la superficie è rivestita solo con BSA (Figura 6).
Il secondo esempio è l'ecografia con mezzo di contrasto della piastra di Petri rivestita con streptavidina (Figura 7, lato destro) in cui le microbolle biotinilate si adsorbono con successo dal mezzo che scorre e possono essere rilevate mediante ecografia con mezzo di contrasto dopo un lavaggio con PBS. La superficie della capsula di controllo non trattiene le microbolle aderenti al flusso, quindi essenzialmente tutto il segnale di contrasto ultrasonico viene rimosso con il flusso PBS. La quantificazione del segnale di contrasto ad ultrasuoni mostra una forte significatività statistica della differenza osservata; Il rapporto tra i segnali di destinazione e di controllo superava un ordine di grandezza.
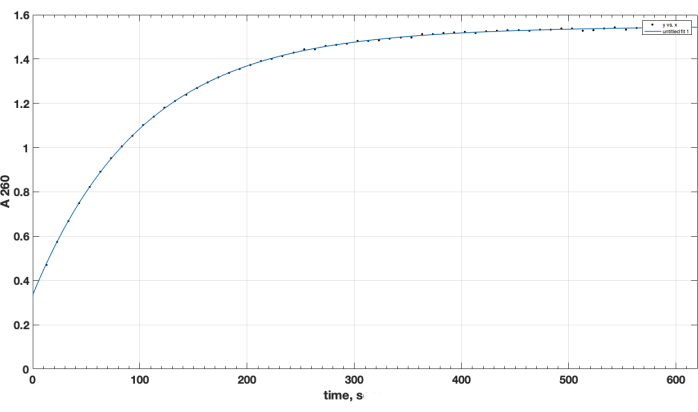
Figura 1. Cinetica dell'idrolisi dell'estere attivo NHS-PEG-DSPE, osservata mediante rilascio di NHS in mezzo alcalino mediante test spettrofotometrici a lunghezza d'onda di 260 nm. Il punto temporale zero è il tempo di aggiunta di NHS-PEG-DSPE in solvente organico al tampone borato 0,1 M, pH 9,2. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. Microscopia di microbolle riempite di gas dopo l'amalgama. A sinistra, microscopia a fluorescenza (eccitazione verde, emissione rossa, colorante a guscio lipidico DiI). A destra, microscopia in campo chiaro (osservazione in fase gassosa), stesso ingrandimento. Larghezza del fotogramma, 85 um (micrometro da tavolino da 10 μm incorporato in basso a destra di ogni immagine). Clicca qui per visualizzare una versione più grande di questa figura.
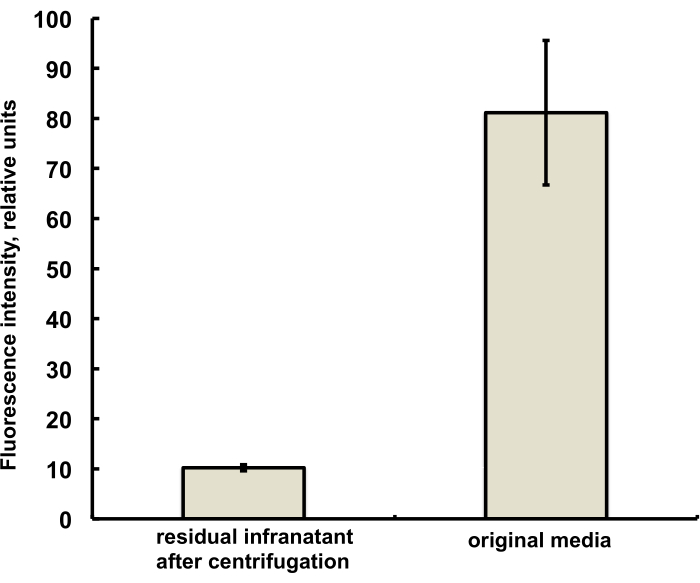
Figura 3. Spettroscopia di fluorescenza di un campione di colorante lipidico DiI dal terreno di preparazione delle microbolle prima dell'amalgamazione (a destra) e dopo l'amalgama e la rimozione delle microbolle mediante flottazione centrifuga (a sinistra). Eccitazione della fluorescenza - 555 nm, emissione - 620 nm. Dati presentati come media ± deviazione standard. Clicca qui per visualizzare una versione più grande di questa figura.
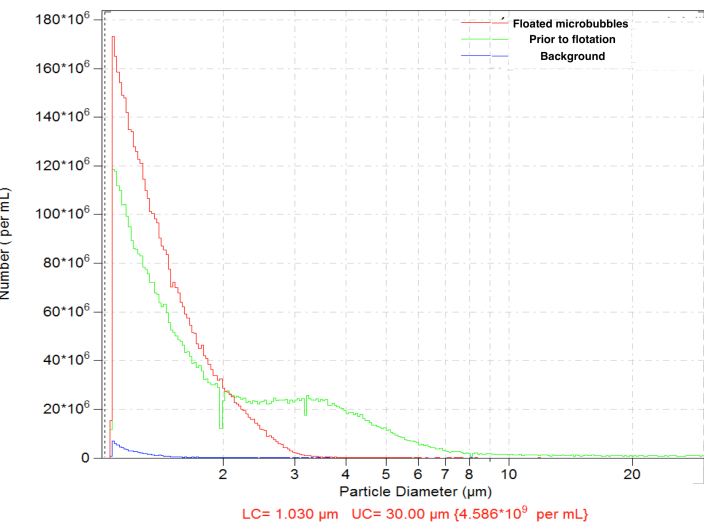
Figura 4. Distribuzione granulometrica del numero di concentrazioni di microbolle dopo la preparazione all'amalgama (verde), con successiva flottazione a gravità normale per la rimozione di microbolle di grandi dimensioni (rosso) e conteggio di fondo solo diluente (blu). Conteggio delle particelle con rilevamento elettrozonale in soluzione salina normale, orifizio da 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5. Microscopia in campo chiaro di microbolle di c(RGDfK) su un piatto rivestito con αvβ3. La larghezza del fotogramma dell'immagine è di 106 μm; la barra è di 10 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6. La camera di flusso parallela su piastra in vitro ha come bersaglio le microbolle decorate con peptidi sulla superficie rivestita con α ricombinante vβ3. Le microbolle decorate con cRGDfK hanno aderito in modo efficiente alla piastra (a sinistra), l'attacco delle microbolle cRADfK (strapazzate, al centro) di controllo è stato minimo (p<0,00005), così come la ritenzione di microbolle sulla superficie di controllo della sola albumina (a destra, p<0,0025). Sforzo di taglio della parete di flusso della camera a 1 dyn/cm2. Adesione di microbolle monitorata mediante videomicroscopia; Viene presentato il numero di particelle nel campo visivo. Il tempo di accumulo è di 4 min. Dati presentati come media ± deviazione standard. Ristampato con il permesso di5. Diritto d'autore, 2018, Società chimica americana. Clicca qui per visualizzare una versione più grande di questa figura.
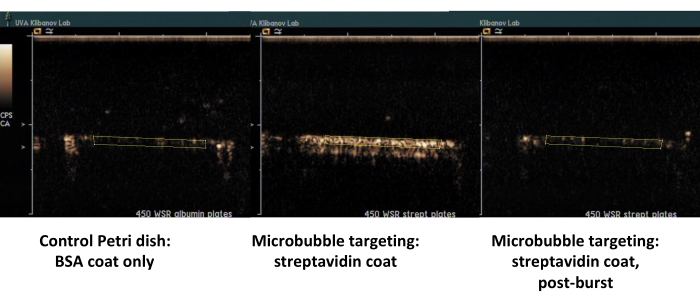
Figura 7. Ecografia con contrasto di una camera di flusso a piastre parallele dopo l'adesione mirata e il lavaggio del tampone delle microbolle biotinilate sulla piastra rivestita con streptavidina (al centro, microbolle mirate aderenti, a destra, stessa piastra, dopo lo scoppio di ultrasuoni ad alto infarto miocardico) e piastra di controllo rivestita solo con albumina (a sinistra). Due minuti di perfusione della dispersione di microbolle (PBS/BSA, 106 particelle/mL) a una velocità di taglio di 450 s-1 , seguiti da lavaggio con tampone. La quantificazione del segnale ultrasonico viene eseguita dalle regioni di interesse nei fotogrammi video dopo la sottrazione di fondo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'importanza di una tecnica semplice per la preparazione di microbolle decorate con leganti è evidente. L'uso della tecnica di amalgamazione per la preparazione di microbolle, come sperimentato da Unger et al.,16 può servire a questo scopo per una serie di motivi. La produzione di microbolle mediante amalgamatore è facile da eseguire. È disponibile un'unità da tavolo monofase da 120 V a ingombro ridotto ed economica. La procedura è rapida (45 secondi) ed efficiente: viene preparato immediatamente 1 mL di dispersione di microbolle in un mezzo acquoso. Contiene miliardi di particelle per mL, più che sufficienti per gli studi di ricerca. La produzione avviene in una fiala sigillata con spazio di testa del gas perfluorurato. Se necessario, il contenuto del flaconcino rimarrà sterile dal momento del riempimento asettico, durante la produzione (amalgama) e fino all'uso. Ciò rende l'approccio rilevante per l'uso clinico, in quanto non richiede preparazioni elaborate in un ambiente sterile dedicato in clinica.
La procedura si basa sull'autoassemblaggio: durante la miscelazione, poiché viene applicato un elevato taglio all'interfaccia gas-acqua all'interno della fiala in movimento, si formano piccoli frammenti di gas, che assumono una forma sferica a causa dell'azione della tensione superficiale. Il PG, come cotensioattivo, presente nel mezzo ad alta concentrazione, riduce la tensione superficiale e l'energia necessaria per generare l'interfaccia gas-acqua durante il taglio. Successivamente, tensioattivi più "classici", come i lipidi PEG e i fosfolipidi, che sono presenti a concentrazioni molto più basse, raggiungono l'interfaccia, molto probabilmente spostando il PG e stabilendo uno strato monomolecolare sulla superficie della bolla. Questo guscio è ragionevolmente stabile; è probabilmente dovuto a una combinazione di un lipide "solido" (la temperatura di transizione di fase DSPC è di 56 °C, quindi non è incline alla fusione intermembrana) e di un esteso rivestimento a spazzola PEG che circonda le microbolle e inibisce il contatto diretto del monostrato delle bolle vicine. Si può ipotizzare che la presenza di un'alta concentrazione di PG nel terreno possa ridurre la stabilità del guscio delle microbolle. In sua assenza, le microbolle sono stabili nelle fiale sigillate in atmosfera di fluorocarburi per molti mesi, con solo una fusione moderata tra le bolle. Per l'uso clinico, con un piccolo dispositivo amalgamatore al letto del paziente, l'intervallo tra la preparazione delle microbolle e l'uso può essere breve, minuti o ore. Con il PG presente nel terreno, la concentrazione di microbolle non mostra un calo significativo, almeno per diverse ore di conservazione refrigerata.
Un ulteriore vantaggio della procedura descritta (assistita dall'uso del cosurfattante PG nel terreno di preparazione delle bolle) è l'elevata efficacia (>85%) del trasferimento lipidico al guscio, mentre la sonicazione tradizionale fornisce un'efficacia del ~20%5 e i moderni metodi microfluidici ancora più bassi17. Un alto livello di efficienza di trasferimento è importante non solo perché si riduce lo spreco di materiale lipidico e il costoso ligando, ma anche perché si riduce al minimo la quantità di legante privo di bolle co-presente nel terreno. Quindi il ligando libero potrebbe non avere l'opportunità di bloccare il recettore bersaglio del biomarcatore a cui ci si aspetta che le microbolle si leghino tramite ligando sulla loro superficie. La quantità generale del recettore del biomarcatore sul sistema vascolare bersaglio è spesso piuttosto elevata, quindi questo potrebbe non essere della massima importanza. Dalla letteratura brevettuale disponibile18 si potrebbe suggerire che almeno il 50% del materiale del guscio lipidico e del ligando mirato nelle formulazioni di microbolle nei test clinici possa essere associato al guscio della bolla. Questo può essere generalmente confrontato con anticorpi o peptidi radiomarcati che sono ampiamente utilizzati negli studi di imaging dei recettori della medicina nucleare: la maggior parte di quelli che hanno come bersaglio le molecole del ligando in realtà non trasportano radioisotopi "caldi" anche per la più alta attività specifica riportata19, mentre per le microbolle mirate, il materiale del guscio in questo studio (incluso il lipide ligando) è per lo più attaccato alle microbolle.
L'adesione selettiva di microbolle mirate preparate con questa tecnica in vitro è stata dimostrata, in due serie di modelli di targeting: adesione statica e un esperimento di targeting in camera di flusso. In un test statico, le microbolle mirate hanno aderito saldamente allo strato del recettore bersaglio e non sono state rimosse con il risciacquo del tampone, a differenza di un ambiente di controllo, in cui le microbolle sono state rimosse dalla superficie anche con un risciacquo delicato. Allo stesso modo, in un test a flusso continuo, eseguito in una camera di flusso a piastre parallele, le bolle biotinilate hanno dimostrato un'adesione statisticamente significativa e superba allo strato di streptavidina su una piastra di polistirene, rispetto alla superficie di controllo della sola albumina. Le microbolle decorate con peptide c (RGDfK) hanno aderito selettivamente alla superficie rivestita αvβ3, sia nel saggio di adesione statica, sia in una camera di flusso a piastre parallele.
I seguenti problemi possono essere considerati come le limitazioni del protocollo descritto. In primo luogo, la procedura non tiene conto delle particelle submicroniche. Lo strumento utilizzato nello studio non è stato impostato per rilevare le nanobolle (cioè particelle di diametro inferiore a 1 μm). Queste particelle potrebbero essere state presenti nella formulazione. Sebbene il loro segnale di retrodiffusione acustica sia generalmente noto per essere basso e non siano stati osservati in questo studio al microscopio, la presenza di nanobolle dovrebbe comunque essere considerata. Il secondo problema significativo è l'eterogeneità dimensionale delle microbolle. Nonostante la rimozione di particelle più grandi, la dimensione delle bolle risultanti è tutt'altro che uniforme. Questa dovrebbe essere una considerazione e una giustificazione per ulteriori ricerche nel campo della formulazione di microbolle.
In conclusione, la narrazione fornita in questo manoscritto dovrebbe fornire un livello sufficiente di dettagli tecnici per produrre microbolle mirate in modo rapido e semplice. Vengono fornite le fasi per eseguire un'ulteriore purificazione (se necessario), regolando le dimensioni e/o valutando la piccola quantità di materiale del guscio che rimane nel mezzo acquoso. Vengono descritti gli strumenti analitici dettagliati per la valutazione dei parametri delle microbolle, come la distribuzione dimensionale e la concentrazione, e la capacità in vitro delle microbolle decorate con ligando di aderire ai recettori bersaglio.
Divulgazioni
A. Klibanov è co-fondatore e azionista di minoranza di Targeson Inc, una startup nel settore delle microbolle precliniche mirate, ora disciolta. Il suo laboratorio UVA ha un subappalto tramite NIH R44 HL139241 da SoundPipe Therapeutics.
Riconoscimenti
A.L. Klibanov riconosce il sostegno in parte tramite NIH R01EB023055, assegnato dal National Institute of Biomedical Imaging and Bioengineering del National Institutes of Health, un subappalto all'Università della Virginia tramite NIH R01NS076726, assegnato all'UCSF dal National Institute of Neurological Disorders and Stroke del National Institutes of Health e un subappalto all'Università della Virginia tramite sovvenzione NIH R44HL139241, assegnato a SoundPipe Therapeutics dal National Heart, Lung, and Blood Institute. Il contenuto di questa pubblicazione è di esclusiva responsabilità dell'autore e non rappresenta necessariamente le opinioni ufficiali del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
Riferimenti
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, Suppl 1 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , US Patent 5,585,112 (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , US Patent 5,686,060A (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon