Method Article
تحضير وتوصيف الفقاعات الدقيقة المستهدفة
In This Article
Summary
الهدف من هذا البروتوكول هو تحضير وتنقية وتوصيف الفقاعات الدقيقة المملوءة بالغاز (عوامل التباين المستهدفة للتصوير الجزيئي بالموجات فوق الصوتية). تم وصف نظامي استهداف : فقاعات البيوتينيل الملتصقة بالستربتافيدين ، والفقاعات الدقيقة الببتيد RGD الدورية التي ترتبط ب αvβ3 ، وهو مؤشر حيوي معروف للأوعية الدموية الجديدة.
Abstract
تم البحث عن استهداف الفقاعات الدقيقة (عوامل التباين بالموجات فوق الصوتية للتصوير الجزيئي) لأكثر من عقدين. ومع ذلك ، فإن طرق تحضير الفقاعات الدقيقة واستهداف ربط الترابط مرهقة ومعقدة وطويلة. لذلك ، هناك حاجة لتبسيط إجراء تحضير الفقاعات الدقيقة المستهدفة لتقريبها من الترجمة السريرية. الغرض من هذا المنشور هو تقديم وصف وشرح مفصل للخطوات اللازمة لإعداد الفقاعات الدقيقة المستهدفة والتوصيف الوظيفي والاختبار. يتم تقديم سلسلة من الإجراءات المحسنة والمبسطة لنظامين: نموذج زوج استهداف البيوتين والستربتافيدين ، وببتيد RGD دوري يستهدف بروتين αالمؤتلف vβ3 ، والذي يتم التعبير عنه بشكل مفرط على البطانة للأوعية الدموية الجديدة للورم.
هنا ، نعرض ما يلي: الاقتران التساهمي للرابط المستهدف بمرساة الدهون ، وتقييم جودة الكاشف ، والاختبارات التي تؤكد الإكمال الناجح للتفاعل ؛ تحضير وسط السلائف المائية الذي يحتوي على مكونات غلاف الفقاعات الدقيقة ، متبوعا بتحضير الفقاعات الدقيقة عن طريق الاندماج ؛ تقييم فعالية نقل الدهون على غلاف مثبت الفقاعات الدقيقة ؛ تعديل توزيع حجم الفقاعات الدقيقة عن طريق التعويم عند الجاذبية العادية لإزالة الفقاعات الدقيقة الأكبر حجما التي قد تكون ضارة بالاستخدام في الجسم الحي؛ تقييم توزيع حجم الفقاعات الدقيقة عن طريق استشعار المنطقة الكهربائية؛ تقييم الارتباط المستهدف للفقاعات الدقيقة بالسطح المطلي بالمستقبلات في اختبار فحص الربط الثابت (في طبق مقلوب) ؛ وتقييم الارتباط المستهدف للفقاعات الدقيقة بالسطح المطلي بالمستقبلات في اختبار غرفة تدفق اللوحة المتوازية.
Introduction
كان التصوير الجزيئي باستخدام الفقاعات الدقيقة المستهدفة قيد البحث والاختبار لأكثر من عقدين. المفهوم العام واضح ومباشر: يتم حقن الفقاعات الدقيقة المملوءة بالغاز التي تمتلك تقاربا انتقائيا بالعلامة الحيوية الجزيئية الخاصة ببطانة الأوعية الدموية في منطقة المرض عن طريق الوريد. تنتشر هذه الجسيمات وتتراكم في الهدف (على سبيل المثال ، الأوعية الدموية الجديدة للورم أو منطقة الإصابة الالتهابية الإقفارية). ثم يتم الكشف عن الفقاعات الدقيقة الملتصقة عن طريق التصوير بالموجات فوق الصوتية على النقيض. تتقدم جهود البحث في المفهوم المبكر من القرن الماضي1،2 الآن تدريجيا نحو التبني السريري: لقد وصلت إلى مرحلة التجارب السريرية متوسطة النطاق منذ عدة سنواتفقط 3،4. الغرض من هذه المخطوطة هو تقديم شرح مفصل حول إعداد وتوصيف هذه الفقاعات الدقيقة المستهدفة ، بناء على مثالين منشورين1،5.
يتم استكمال إجراء تحضير الببتيد-PEG-phospholipid ، وهو مكون حاسم لصياغة هذه الفقاعات الدقيقة المستهدفة ، بوصف مراقبة جودة الكاشف ، كما هو مطلوب لإكمال التفاعل بنجاح. لسوء الحظ ، يوفر بعض موردي كاشف دهون الإستر النشطين مادة يتم تحللها عند الوصول وبالتالي فهي غير قادرة على المشاركة في تكوين رابطة أميد. يتم توفير معلومات حول مقدار المادة الدهنية التي يتم نقلها إلى غلاف الفقاعات الدقيقة من الوسط المائي أثناء تحضير الفقاعات الدقيقة ، بالإضافة إلى تقنية الحصول على هذه المعلومات.
من المهم تحضير الفقاعات الدقيقة ذات التوزيع الضيق نسبيا لحجم الجسيمات: قد يؤدي الوجود المشترك للفقاعات الدقيقة الكبيرة في الوسائط القابلة للحقن لاختبار الأوعية الدموية داخل الجسم الحي إلى انسداد الأوعية الدموية الدقيقة. قد يتسبب التراكم غير المحدد للفقاعات الدقيقة التي تتجاوز تحويلات الرئة في تحسين الأنسجة الإيجابية الكاذبةغير المحددة 6 ، والذي يتم تجنبه عن طريق إزالة الفقاعات الدقيقة ذات الأحجام الأكبر. لذلك ، يتم تقديم إجراء بسيط لتحقيق اختيار حجم الجسيمات ، مع استكماله بوصف طريقة لتقييم تركيز الجسيمات وتوزيع الحجم باستخدام عداد الجسيمات.
يصف بروتوكول الاختبار الأول لتقييم استهداف الفقاعات الدقيقة ، كما هو موضح أدناه ، نظاما نموذجيا بحتا ، مع فقاعات دقيقة بيوتينيل تستهدف السطح المطلي بالستربتافيدين1. يعتمد البروتوكول الثاني على مخطوطة تصف التحضير المبسط للفقاعات الدقيقة المستهدفة بالببتيد ، المزينة بببتيد RGD دوري يمتلك تقاربا محددا تجاه αvβ3 ، وهو مؤشر حيوي جزيئي للأوعية الدموية الجديدةللورم 5. ثبت أن الفقاعات الدقيقة المزينة بهذا الببتيد الدائري [Arg-Gly-Asp-D-Phe-Lys] ، أي c (RGDfK) بالتقنية المقدمة تستهدف الأوعية الدموية الجديدة للورم وتحقق التصوير الجزيئي بالموجات فوق الصوتية في نموذج ورم الفئران.
Protocol
1. اقتران تساهمي الببتيد إلى NHS-PEG-DSPE
- قم بإذابة الببتيد c (RGDfK) مع مجموعة ε الأمينية الأولية لليسين غير محمية ومتاحة للاقتران ، في ثنائي ميثيل سلفوكسيد (DMSO ، 10 مجم / مل). قم بإعداد محلول ميثانول أو كلوروفورم من إستر N-hydroxysuccinimide من بولي (إيثيلين غليكول) -3400-ديستيرويل فوسفاتيديليثانولامين (NHS-PEG-DSPE ، 200 مجم / مل) ، وأضفه إلى 1 مجم من الببتيد في DMSO. أضف 3 ميكرولتر من N ، N-diisopropyl ethylamine (DIPEA).
- حافظ على نسبة المولية من الببتيد إلى NHS-PEG-DSPE على الأقل 1: 1.2 ، بحيث تكون جميع المجموعات الأمينية الأولية قادرة على التفاعل. حافظ على نسبة مولية DIPEA: الببتيد على الأقل 2: 1 لضمان ظروف الوسائط الأساسية.
تنبيه: الكلوروفورم والميثانول و DIPEA مواد خطرة. استخدم الحماية المناسبة ، مثل القفازات ومعطف المختبر والنظارات الواقية وغطاء الدخان.
ملاحظة: يمكن استخدام أي ببتيد أو محاكي آخر مع مجموعة أمينية أولية بدلا من c (RGDfK) ، مع طرف N غير محمي أو ليسين يقع خارج موقع الربط. لكي يستمر التفاعل ، يجب أن تكون جميع المكونات (أي الترابط المستهدف والدهون) قابلة للذوبان في خليط DMSO-chloroform. يمكن أيضا اختبار المذيبات البديلة ، مثل ثنائي ميثيل فورماميد ، أو مخاليطها. التفاعل في الوسط المائي ممكن أيضا ، لكن عائد الاقتران سيكون أقل بكثير بسبب التحلل المائي السريع للإستر النشط.
- حافظ على نسبة المولية من الببتيد إلى NHS-PEG-DSPE على الأقل 1: 1.2 ، بحيث تكون جميع المجموعات الأمينية الأولية قادرة على التفاعل. حافظ على نسبة مولية DIPEA: الببتيد على الأقل 2: 1 لضمان ظروف الوسائط الأساسية.
- بعد الحضانة بين عشية وضحاها في درجة حرارة الغرفة ، قم بإزالة المواد العضوية المتطايرة عن طريق التبخر (استخدم تيار غاز النيتروجين أو المبخر الدوار ، متبوعا بالتبخر طوال الليل تحت مضخة تفريغ عالية ، لإزالة DMSO). أعد إذابة البقايا غير المتطايرة في الكلوروفورم عند 1 مجم / مل لأخذ العينات الخاضعة للرقابة.
- تأكيد اكتمال التفاعل عن طريق كروماتوغرافيا الطبقة الرقيقة (تطوير ألواح TLC في الكلوروفورم: وسائط مذيبات الميثانول ، 2: 1 v / v). تأكد من وجود أو عدم وجود المجموعة الأمينية الأولية برذاذ النينهيدرين عند تسخين اللوحة على كتلة تسخين 150 درجة مئوية.
تنبيه: النينهيدرين مادة خطرة. استخدم الحماية المناسبة ، كما هو موضح أعلاه. يجب إجراء معالجة كتلة التسخين لألواح TLC في غطاء الدخان. كتلة التسخين هي خطر حريق محتمل. - قبل تحضير الفقاعات الدقيقة ، قم بتقطيع عينة من الببتيد-PEG-DSPE من الكلوروفورم (على سبيل المثال ، 1 مل من محلول 1 مجم / مل) ، وتبخر الكلوروفورم إلى الجفاف في تيار من غاز النيتروجين ، مع حضانة مضخة التفريغ العالية اللاحقة ، وأضف المحلول الملحي إلى 1 مجم / مل ، لتحقيق محلول ميسيلار شفاف.
- إذا كان من المستحسن تنقية خليط التفاعل ، فقم بإذابته في محلول ملحي عادي. ثم يخضع خليط ميسيلار الناتج لغسيل الكلى (قطع الوزن الجزيئي 6-8 كيلو دالتون ، أو ما شابه ذلك) ، أولا ضد المحلول الملحي العادي ، ثم ضد عدة تغييرات في الماء منزوع الأيونات.
- التأكد من إتمام غسيل الكلى عن طريق فحص التوصيلية الكهربية لغسيل الكلى. قم بإزالة المواد التي تم تحللها من كيس غسيل الكلى ، وضعها في قارورة ذات كتلة معروفة ، وقم بتجميدها حتى تجفيفها تماما.
ملاحظة: يتوفر تفاعل تساهمي بديل لربط الترابط بنهاية PEG-lipid (على سبيل المثال ، تفاعل maleimide-PEG-DSPE مع ثيول ليجند). الميزة الرئيسية لهذا النهج هي الاقتران الموجه ، إذا كان هناك ثيول واحد متاح على جزيء الترابط 7. الشاغل الرئيسي هو الاستقرار على المدى الطويل: قد يكون الارتباط الناتج بين ماليميد والثيول عرضة للتحلل عن طريق تفاعل مايكل الرجعي ، اعتمادا على ظروف التخزين 8.
ملاحظة: تختلف جودة كواشف الإستر النشطة اختلافا كبيرا بين الشركات المصنعة: قد يعتمد ذلك على ظروف النقل والتخزين (إذا لم يتم تخزين المادة أو نقلها بشكل صحيح ، فسوف يتحلل الإستر النشط ولن يكون قادرا على الاقتران بالببتيد). وبالتالي ، هناك شعور بالالتزام بوصف إجراء (انظر أدناه) لتحديد درجة تدهور NHS-PEG-DSPE ، وهو كاشف للارتباط التساهمي للروابط المستهدفة بالفقاعات الدقيقة. يتم تخزين NHS-PEG-DSPE ، الذي يتم توفيره كمسحوق جاف تحت الأرجون ، في التجميد العميق. يتم إحضار قارورة إلى درجة حرارة الغرفة (لتجنب تكثيف الرطوبة) ، ويتم وزن العينة ، باستخدام الميزان التحليلي ، وإذابتها في الميثانول أو DMSO. يجب إغلاق قارورة بها كاشف جاف سائب تحت الأرجون وإعادتها إلى التجميد العميق ، في وعاء محكم الغلق مع مجفف ، حتى الاستخدام الآخر. - قم بإعداد محلول ميسيلار مائي من الببتيد-PEG-DSPE (الخطوة 1.4) ، وكذلك البيوتين-PEG-DSPE ، عن طريق إضافة الكاشف الجاف إلى المحلول الملحي المائي ، والحضانة. تتشكل مذيلات كروية صغيرة. لتسريع نقل الكاشف من الحالة السائبة إلى شكل ميسيلار ، يمكن تطبيق الصوتنة وحمام الماء الساخن.
- تقييم جودة الكاشف للاستر النشط NHS-PEG-DSPE.
- تأكد من أن NHS الموجود في الكاشف في شكل إستر نشط ، لتتمكن من إجراء تفاعل الاقتران مع تكوين رابطة أميد.
- ضع 0.99 مل من المخزن المؤقت رباعي الصوديوم 0.1 متر ، درجة الحموضة 9.2 ، في كوفيت كوارتز أو بلاستيك شفاف بالأشعة فوق البنفسجية (وليس زجاج) في مقياس الطيف الضوئي ، وصفر عند الطول الموجي 260 نانومتر.
- أضف 10 ميكرولتر من محلول 200 مجم / مل المحضر حديثا من NHS-PEG-DSPE في الميثانول إلى الكوفيت. في نفس الوقت ، ابدأ ساعة الإيقاف. امزج محتوى الكوفيت بسرعة وقوة لتحقيق التوحيد. ضع الكوفيت في مقياس الضوء ، وأغلق الغطاء ، وابدأ القياس.
- في بداية قياس مقياس الطيف الضوئي ، حدد وقت بداية التسجيل ، وقم بإجراء قياسات الامتصاص الضوئي باستمرار عند 260 نانومتر كل 10 ثوان لمدة ~ 10 دقائق ، أو حتى استقرار قيمة الامتصاص.
- ارسم المنحنى الحركي ، وتحقق من260 نقطة زمنية أولية A ، واستقراء المنحنى إلى وقت بدء التفاعل (على سبيل المثال ، اكتشف A260 عند النقطة التي تمت فيها إضافة الكاشف إلى المخزن المؤقت المائي وبدأ تفاعل التحلل المائي). افترض أنه قبل إضافة NHS-PEG-DSPE إلى المخزن المؤقت في الكوفيت لم يحدث أي تحلل مائي في المذيب العضوي بسبب نقص المياه.
- احسب النسبة بين A260 في بداية التفاعل وعند الانتهاء من التحلل المائي ؛ وهو يمثل جزء من الإستر النشط المتدهور. استخدم هذه المعلومات لتحديد الكمية المناسبة من NHS-PEG-DSPE للتعديل الكامل للمجموعة الأمينية الأولية للببتيد.
2. تحضير الفقاعات الدقيقة عن طريق الاندماج
- تحضير الفقاعات الدقيقة البيوتينيل
- يذوب ديستيرويل فوسفاتيديل كولين (DSPC) وستيرات PEG في البروبيلين جلايكول (PG ، تركيز 10 مجم / مل لكل منهما في مذيب أنيق). استخدم حمام الماء الساخن لإذابة المواد.
- أضف 0.1 مل من محلول PG الساخن هذا إلى قارورة تحتوي على 0.85 مل من المحلول الملحي العادي الساخن ، واخلطه بسرعة ، وأضف ميسيلار البيوتين-PEG-DSPE (50 ميكرولتر ، 1 مجم / مل في محلول ملحي) بنسبة كتلة 1:20 إلى DSPC.
ملاحظة: تعتمد قابلية ذوبان مكونات الدهون في PG على درجة الحرارة ، لذا فإن حمام الماء الساخن ضروري. من المفيد تسخين القارورة الزجاجية التي تحتوي على محلول ملحي في حمام ماء ساخن قبل إضافة الدهون ، لإنشاء وسط موحد بدون جزيئات مرئية. - أحضر القارورة إلى درجة حرارة الغرفة ، ضع سدادة مطاطية على القارورة ، وأدخلها في منتصف الطريق ، وأدخل الأنابيب الشعرية PTFE في القارورة. استخدم تدفق غاز ديكافلوروبوتان لملء القارورة ، ثم أغلق السدادة ، مع إزالة الشعيرات الدموية.
ملاحظة: قد يكون لدرجة حرارة القارورة أثناء الاندماج تأثير كبير على توزيع حجم الفقاعات الدقيقة الناتجة 9. - قم بتجعيد القارورة المسدودة في درجة حرارة الغرفة وضعها في جهاز المغتم. ابدأ الملغم. تم ضبط الوحدة السريرية المستخدمة مسبقا للعمل عند 4300 دورة في الدقيقة لمدة 45 ثانية.
- عند اكتمال الدمج ، قم بإزالة القارورة مع الفقاعات الدقيقة الناتجة من المغمس. يفضل توصيف توزيع حجم الفقاعات الدقيقة وتكوينها واستخدامها في غضون عدة ساعات من التحضير.
- تحضير الفقاعات الدقيقة المزينة بالببتيد
- قم بإذابة ستيرات DSPC و PEG في PG أنيق (تركيز 10 مجم / مل لكل مادة). استخدم حمام الماء الساخن للذوبان. أضف 0.1 مل من هذا المحلول الساخن في PG إلى قارورة تحتوي على 0.85 مل من المحلول الملحي العادي الساخن ، واخلطها بسرعة ، وأضف ببتيد ميسيلار-PEG-DSPE (50 ميكرولتر ، 1 مجم / مل في محلول ملحي) مضاف بنسبة كتلة 1:20 إلى DSPC.
- أحضر القارورة إلى درجة حرارة الغرفة ، ضع سدادة مطاطية أعلى القارورة ، وأدخلها في منتصف الطريق ، وأدخل الأنابيب الشعرية الشعرية من البولي تترافلورو إيثيلين (PTFE) في القارورة. استخدم تدفق غاز ديكافلوروبوتان لملء القارورة ، ثم أغلق السدادة ، مع إزالة الشعيرات الدموية.
- تجعيد القارورة السدادة وضعها في مغم للخلط. القارورة مع تشتت الفقاعات الدقيقة جاهزة في 45 ثانية.
- تحضير الفقاعات الدقيقة الدهنية الصبغية لتقييم انتقال الدهون إلى قشرة الفقاعات الدقيقة
- قم بإذابة ستيرات DSPC و PEG في PG أنيق ، كما هو موضح أعلاه (استخدم حمام الماء الساخن) (تركيز 10 مجم / مل لكل مادة).
- أضف 0.1 مل من محلول PG الساخن هذا إلى قارورة تحتوي على 0.89 مل من المحلول الملحي العادي الساخن ، واخلطها بسرعة ، وأضف 10 ميكرولتر من محلول صبغة DiI (1 مجم / مل في PG أنيق) واخلطها. أحضر القارورة إلى درجة حرارة الغرفة.
- املأ مساحة رأس القارورة بغاز ديكافلوروبوتان على النحو الوارد أعلاه ، وقم بسدادة القارورة ، وتجعيد واندمجها كما هو موضح أعلاه.
3. اختبار نقل الدهون DiI من الوسط المائي الميسيلار إلى غلاف الفقاعة
- لتأكيد الفحص المجهري أن مادة الدهون الفلورية قد انتقلت من الوسط المائي إلى غلاف الفقاعات الدقيقة ، قم بأخذ عينات من الفقاعات الدقيقة من القارورة عبر الحاجز باستخدام حقنة الأنسولين.
- ثم أضف قطرة إلى شريحة زجاجية وقم بتغطيتها بغطاء قياسي. قم أولا بتخفيفه بقطرة من المحلول الملحي منزوع الغاز.
- إجراء الفحص المجهري باستخدام مجهر الفيديو ، المجهز بإضاءة epi مضان ، وهدف زيت 100x وكاميرا فيديو عالية الحساسية.
- لتحديد فعالية نقل المواد الدهنية من الوسائط المائية المالحة / PG إلى غلاف الفقاعة أثناء الاندماج ، خذ قارورة محكمة الغلق من الفقاعات الدقيقة ، واقلبها وضعها في أنبوب مخروطي الشكل سعة 50 مل.
- قم بإجراء الطرد المركزي في دوار دلو (10 دقائق ، 200 × جم). قم بإزالة القارورة من جهاز الطرد المركزي واحتفظ بها مقلوبة.
- أدخل إبرة من حقنة الأنسولين في حاجز القارورة المقلوبة. استنشق حجم صغير (~ 50 ميكرولتر) من الأشعة تحت الحمراء الصافية ببطء.
ملاحظة: يجب وضع الطرف المائل للإبرة لشفط الأشعة تحت الحمراء من القارورة المقلوبة بعد الطرد المركزي بالقرب من الحاجز قدر الإمكان ، لتقليل فرص تناول الفقاعات الدقيقة.
- ضع عينات الأشعة تحت الحمراء (2 ميكرولتر) ، بالإضافة إلى عينات الوسط الملحي الأصلي للدهون PG الذي تم استخدامه لتوليد فقاعات دقيقة (2 ميكرولتر) في صفيحة مكونة من 96 بئرا مع 0.1 مل من محلول ملحي مخزن بالفوسفات (PBS): وسط الإيثانول 1: 1 مع 1٪ تريتون X-100.
- قم بقياس التألق الأحمر لصبغة DiI (إثارة 555 نانومتر ، انبعاث 620 نانومتر) باستخدام قارئ صفيحة دقيقة مضانة.
- استخدم الألواح السوداء ذات القاع غير الشفاف للتحليل الطيفي الفلوري بسبب الخلفية المنخفضة ونقص نقل الإشارات بين البئر التي قد تصبح مشكلة بالنسبة للألواح الشفافة.
- تأكد من أن إشارة التألق ضمن نطاق المعايرة الخطية: قد يؤدي التركيز المفرط للصبغة في الآبار إلى توهين الضوء والإشارة التي لا يتم الإبلاغ عنها بشكل كاف.
ملاحظة: قد يكون من المرغوب فيه في بعض الأحيان إزالة مادة القشرة المتبقية التي تبقى في الوسط المائي بعد الدمج. للقيام بذلك ، بعد الطرد المركزي لتعويم الفقاعات الدقيقة ، قم بإخراج كل حجم الأشعة تحت الحمراء عن طريق الشفط البطيء من القارورة المقلوبة ، واستبدلها بالمحلول الملحي العادي منزوع الغازات. لتجنب التغيير المفرط في الضغط المحيط في القارورة بسبب إزالة السائل أو إضافته ، أدخل إبرة طويلة إضافية في الحاجز للوصول إلى مرحلة الغاز داخل القارورة. للحفاظ على طور الغاز داخل القارورة ، أولا ، قم بتوصيل الإبرة بحقنة مملوءة بغاز الفلوروكربون ، لمنع ملامسة الهواء لمستحضر الفقاعات الدقيقة.
4. تعديل توزيع حجم الفقاعات الدقيقة
- استخدم تعويم الجاذبية العادية في قارورة مقلوبة ثابتة لضبط توزيع حجم الفقاعات الدقيقة ، أي لإزالة أكبر الفقاعات الدقيقة بسرعة وكفاءة 5,10.
- خذ قارورة من الفقاعات الدقيقة مباشرة بعد التحضير كما هو موضح في القسم 2. اقلبها وضعها رأسا على عقب على سطح ثابت غير اهتزازي لمدة 15-20 دقيقة.
- بعد هذه الحضانة ، أدخل إبرة حقنة الأنسولين في حاجز القارورة ، بينما لا تزال مقلوبة ، واجمع برفق 300-500 ميكرولتر من الفقاعات الدقيقة من الطبقة السفلية.
ملاحظة: يجب أن تظل إبرة المحقنة قريبة من السطح الداخلي للحاجز لتجنب تجمع الفقاعات الكبيرة الموجودة بالقرب من الجزء العلوي من السائل في القارورة.- اسحب مكبس المحقنة للخلف ببطء ، لتجنب الاضطراب والتمدد الهيدروستاتيكي للفقاعات في جسم المحقنة. عندما يتم إخراج العينة التي تم جمعها من المحقنة ، تجنب الضغط الزائد لمنع انهيار الفقاعات.
- نقل تشتت الفقاعات الدقيقة من المحقنة إلى قارورة صغيرة الحجم. ثم املأ بالغاز المشبع بالفلور ، والسدادة والتجعيد ، للتخزين قصير الأجل ، وعد الجسيمات (انظر أدناه) ومزيد من الاستخدام.
- إذا تم إجراء أخذ العينات مباشرة من المحقنة ، فقم بتثبيته أفقيا وقم بتدويره لتجنب تعويم الفقاعات وتحقيق توحيد العينة.
5. تقييم توزيع حجم الفقاعات الدقيقة
- استخدم عداد الجسيمات (بناء على استشعار المنطقة الكهربائية أو مبدأ حجب الضوء) لتقييم توزيع حجم الجسيمات وتركيزها. بدلا من ذلك ، استخدم مقياس الدم والمجهر.
- باختصار ، أضف عينة من الفقاعات الدقيقة إلى محلول ملحي عادي أو متساوي التون في غرفة مضادة (عادة ، حجم 60-100 مل) وقم بالعد. قارن توزيعات حجم الفقاعات الدقيقة قبل وبعد تنقية التعويم.
ملاحظة: أخضع القارورة للخلط اللطيف (وليس الدوامة) مباشرة قبل أخذ العينات ، لتحقيق قياسات تمثيلية وقابلة للتكرار. عينة من مركز الحجم المختبر. - املأ دورق سعة 100 مل بما لا يقل عن 60 مل من محلول ملحي مخفف بنسبة 0.9٪ ، وضعه على مرحلة أداة إرسال المنطقة الكهربائية. ارفع المسرح بحيث يتم غمر الأنبوب ولوحة القطب الخارجي والنمام بالكامل في المخفف ، ويمكن أن يدور النمام.
ملاحظة: يمكن تحديد الحجم المخفف في الدورق بدقة باستخدام كتلته ، بمقياس (كثافة المحلول الملحي قريبة من 1). بدلا من ذلك ، يمكن استخدام مضخة القياس. يجب غمر الأقطاب الكهربائية أثناء دراسة استشعار المنطقة الكهربائية بالكامل. - سجل حجم الإلكتروليت المخفف في برنامج التحكم في الوحدة. تم تجهيز عداد استشعار المنطقة الكهربائية بفتحة 50 ميكرومتر ، والتي تسمح بقياس الجسيمات التي يتراوح قطرها بين 1 و 30 ميكرومتر. قم بإجراء تشغيل الخلفية أولا ؛ من المتوقع أن يكون أقل من 5000 عدد في 0.5 مل من المخفف كفارغ. يمكن أن تكون أفضل مستويات الخلفية أقل من 100 عدد.
- اضبط حجم العينة في برنامج التحكم في الوحدة ، لمراعاة عامل التخفيف. أضف 10-20 ميكرولتر من خليط الفقاعات الدقيقة إلى الدورق ، وقم بإجراء التشغيل الثاني.
- استخدم بيانات توزيع حجم الخلفية لحسابها باستخدام وظيفة "طرح تشغيل الخلفية" داخل البرنامج. الحصول على تركيز الجسيمات في عينة الفقاعات الدقيقة الأصلية كعدد جسيم / مل ؛ ويشمل عامل التخفيف.
- قد يكون السطح الخارجي لطرف الماصة مغطى أيضا بالفقاعات أثناء أخذ العينات. تأكد من مسحها قبل إدخال الطرف في وسط العد. لا تلمس فتحة طرف الماصة بمسح.
- تجنب التخفيفات غير الكافية لجزيئات العينة أثناء العد ، لتقليل المشكلات المتعلقة بتصحيح المصادفة ، حيث يكون أكثر من جسيم واحد في وقت واحد داخل فتحة المستشعر: قد يقلل النظام بعد ذلك من تركيز الجسيمات.
ملاحظة: قد يختلف قطر الفتحة لعد الجسيمات. يسمح اختيار الفتحة التي يبلغ طولها 50 ميكرومتر باكتشاف الفقاعات الدقيقة التي يصل قطرها إلى 1 ميكرومتر ، ومع ذلك فهي ليست عرضة للانسداد مثل خيارات القطر الأصغر. - قم بمعايرة عداد استشعار المنطقة الكهربائية لنفس وسائط الاختبار المخففة (على سبيل المثال ، محلول الري الملحي العادي المصفى بالمعقم) كما هو مستخدم في الاختبارات الفعلية. يتميز بديل التعتيم بالليزر لاستشعار المنطقة الكهربائية بعدم الحاجة إلى محلول ملحي مفلتر بتركيز ملح متحكم فيه وموصلية كهربائية.
- باختصار ، أضف عينة من الفقاعات الدقيقة إلى محلول ملحي عادي أو متساوي التون في غرفة مضادة (عادة ، حجم 60-100 مل) وقم بالعد. قارن توزيعات حجم الفقاعات الدقيقة قبل وبعد تنقية التعويم.
6. اختبار استهداف الفقاعات الدقيقة في المختبر في اختبار الالتصاق / الاحتفاظ
- قم بإعداد سطح مستقبلات المؤشر الحيوي لاستهداف الفقاعات الدقيقة لأطباق بتري.
- خذ أطباق البوليسترين بقطر 35 مم لاستخدامها كسطح مستهدف. استفد من الالتصاق غير المحدد للبروتينات بسطح طبق البوليسترين من المحلول الملحي العادي. استخدم بروتين نموذجي ، ستربتافيدين ، لاختبار استهداف الفقاعات الحيوية التي تحتوي على البيوتين-PEG-DSPE كجزء من القشرة.
- ضع قطرة من محلول الستربتافيدين (0.2 مل ، 10 ميكروغرام / مل في PBS) في وسط كل طبق بتري وقم بتغطيته بغطاء بلاستيكي مقاس 22 مم × 22 مم للسماح بطلاء سطح الطبق بشكل متساو. بعد الحضانة طوال الليل عند 4 درجات مئوية في بيئة رطبة مغلقة لمنع الطبق من الجفاف ، قم بإزالة الغطاء.
- اغسل الألواح على الفور وبشكل شامل بالماء ، PBS ، وقم بسدها عن طريق الحضانة باستخدام 1.5٪ ألبومين مصل البقر (BSA) في PBS لمدة 4 ساعات على الأقل لتقليل الالتصاق غير المحدد للفقاعات الدقيقة بالسطح غير المطلي. استخدم أطباق الثقافة النظيفة المحظورة بنسبة 1.5٪ BSA كعناصر تحكم.
- بدلا من ذلك ، استخدم محلول مستقبلات αالمؤتلف Vβ3 (على سبيل المثال ، عند 4 ميكروغرام / مل في PBS)5 بدلا من الستربتافيدين. استهدف الفقاعات الدقيقة إلى هذا المؤشر الحيوي عبر رابط الببتيد RGD الدوري المتصل بغلاف الفقاعات الدقيقة.
- حافظ على الطبق مع المستقبل المستهدف المودع رطبا: قد يتم تعطيل بروتين المستقبل إذا جف.
ملاحظة: من المهم استخدام بروتينات مستقبلات خالية من الناقل لا تحتوي على أي بروتينات حاملة أو مواد خافضة للتوتر السطحي في الوسط - سيؤدي وجودها إلى تعطيل الالتصاق.
- التصاق الفقاعات الدقيقة في قطرة صغيرة: تحقق بسرعة من الالتصاق المستهدف في الظروف الثابتة.
- قم بإيداع قطرة من الفقاعات الدقيقة (5-20 ميكرولتر) من الأسفل على السطح المستهدف (أو التحكم في BSA فقط) في طبق بتري مقلوب رأسا على عقب. سيؤدي ذلك إلى إحضار الفقاعات إلى السطح المطلي بالمستقبلات عن طريق التعويم.
- بعد 5-10 دقائق من حضانة الطبق المقلوب في بيئة رطبة ، اقلب الطبق مرة أخرى إلى الوضع الطبيعي ، واملأه ب PBS واشطفه برفق لإزالة الفقاعات الدقيقة الحرة. إجراء الفحص المجهري للحقل الساطع لتقييم الالتصاق المستهدف.
- التصاق الفقاعات الدقيقة على سطح طبق بتري: قم بإجراء الاستهداف في طبق كامل1.
- خذ الطبق ، الذي يحتوي على طلاء سطح المستقبل ، واملأه بالكامل بمخزن PBS-BSA منزوع الغازات (أكثر من 10 مل للطبق 35 مم) ، بحيث يمتد الغضروف المفصلي للمخزن المؤقت فوق الجزء العلوي من الطبق ويتم تثبيته بقوة الشعيرات الدموية. حقن الفقاعات (50 ميكرولتر) في الجزء الأكبر من المخزن المؤقت واخلطها بسرعة لتحقيق التجانس. تجنب تكوين فقاعات الهواء أثناء الخلط.
- ضع جزءا من شريط التغليف الشفاف أو شريط مانع للتسرب من لوحة الثقافة ، مدعوما بقطعة مسطحة من البلاستيك فوق الطبق بسرعة. قم بالضغط على الفيلم على الطبق ، واقلب "التجميع" وضعه رأسا على عقب لمدة 30 دقيقة للسماح للفقاعات الدقيقة بالطفو لأعلى ، ولمس السطح المستهدف والالتصاق.
- اقلب "تجميع" الطبق المغلق مرة أخرى إلى تكوين "الجانب السفلي لأسفل" ، وقم بإزالة الختم ، واغسل الفقاعات الدقيقة غير الملتصقة عن طريق الشطف بمحلول عازل منزوع الغاز. مراقبة الفقاعات الدقيقة المستهدفة عن طريق الفحص المجهري أو التصوير بالموجات فوق الصوتية.
ملاحظة: عندما يتم تحضين الطبق المقلوب المغلق المملوء بالكامل بتشتت الفقاعات الدقيقة ، يمكن وضعه بزاوية طفيفة ، لذلك في حالة وجود أي فقاعات كبيرة ، فسوف تطفو على حافة الطبق ، خارج المنطقة المركزية محل الاهتمام. يمكن استخدام الشطف القسري مع التدفق السريع القادم من طرف الماصة الدقيقة أثناء الفحص المجهري لتقييم مدى ثبات التصاق الفقاعات بالهدف (تنفصل الفقاعات تماما عن سطح التحكم حتى في التدفق البطيء) 11. يفضل المخزن المؤقت منزوع الغاز لتخفيف الفقاعات ، لأن فائض الهواء المذاب سيؤدي إلى نمو غير منضبط للفقاعات الدقيقة.
7. اختبار استهداف الفقاعات الدقيقة في المختبر: تقييم فحوصات الالتصاق / الاحتفاظ الديناميكي في غرفة تدفق اللوحة المتوازية
ملاحظة: نقوم باختبار التصاق الفقاعات الحيوية بطبقة الستربتافيدين بالتصوير بالموجات فوق الصوتية.
- استخدم غرفة تدفق اللوحة المتوازية المتوفرة تجاريا مع حامل عاكس مصمم خصيصا لمراقبة الالتصاق المستهدف بطبق بتري مقاس 35 مم من الوسط المتدفق. بعد امتصاص البروتين المستهدف في الطبق (انظر 6.1.1) ، أدخل جسم الغرفة بحشية مثبتة مسبقا في الطبق وأغلقها في الحامل. استخدم حشوات بارتفاع القناة (أي سمك الحشية) 0.127 مم وعرض القناة 2.5 مم.
ملاحظة: أثناء تجميع غرفة تدفق اللوحة المتوازية ، يجب أن تكون كمية شحم السيليكون المستخدمة في الحشية ضئيلة. لا تسمح للشحوم بالدخول إلى منطقة القناة: تجنب تغطية السطح المطلي بالبروتين بالعلامة الحيوية بالشحوم. لتحقيق ختم مناسب ، حدد أطباق 35 مم بعناية (انظر جدول المواد للحصول على معلومات الغرفة والطبق). - بالنسبة لمجموعة غرفة التدفق ، لا تقم بربط الغطاء والإطار اللذين يمسكان بتركيبة غرفة تدفق الأطباق بإحكام شديد ، لتجنب التسرب.
- قم بتوصيل أنبوب التدفق بمضخة حقنة تعمل في وضع الانسحاب ، وعلى جانب التغذية ، قم بتوصيل أنبوب بولي إيثيلين رفيع (PE50) بالقارورة بتشتت الفقاعات الدقيقة المخففة ، يخضع للخلط المستمر مع قضيب التحريك عبر محرك مغناطيسي12. التحكم في معلمة معدل قص الجدار (WSR) للغرفة عن طريق ضبط معدل التدفق الحجمي للمضخة بناء على الصيغة 6Q /bh 2 ، حيث Q هو معدل التدفق ، و "b" هو عرض القناة ، و "h" هو ارتفاع القناة.
ملاحظة: قم بإزالة فقاعات الهواء من النظام بأكمله قبل نضح الوسط المحتوي على الفقاعات الدقيقة أو PBS ، حيث أن أي فقاعة هواء تمر عبر القناة ستزيح الفقاعات الدقيقة الملتصقة من السطح المستهدف ، وتبطل التجربة. يجب إغلاق الاتصال بين أنبوب غرفة التدفق والحقنة بشكل صحيح. - قم بإعداد تشتت الفقاعات الدقيقة عن طريق إضافة حجم محسوب من الفقاعات المركزة إلى خزان الفقاعات الدقيقة (قارورة تلألؤ سعة 20 مل) لتحقيق تركيز 106 فقاعات دقيقة / مل ، في مخزن مؤقت PBS مع 0.1٪ BSA. ضع خزان التغذية على محرك لوحة مغناطيسية. أدخل قضيب تحريك مغناطيسي مقاس 1 سم × 2 سم وحرك عند ~ 400 دورة في الدقيقة للحفاظ على التجانس أثناء الدراسة.
- قم بإجراء التصوير بالموجات فوق الصوتية لغرفة التدفق في خزان المياه13.
- اغمر مجموعة غرفة التدفق في الماء منزوع الغاز وثبته في مكانه بوزن لمنع الحركة أثناء التجارب.
- ضع مسبار التصوير مثبتا فوق القناة مباشرة ، وقم بإمالته بزاوية 15 درجة للخلف ، بالإضافة إلى زاوية 5 درجات في اتجاه عقارب الساعة لتقليل الانعكاس المرآوي من سطح الطبق. ضع قناة غرفة التدفق داخل مستوى التصوير.
- استخدم ظروف التصوير التالية: محول طاقة 15L8 ، وضع التصوير الخاص بالتباين ، النطاق الديناميكي 50 ديسيبل ، 7 ميجاهرتز ، الفهرس الميكانيكي (MI) = 0.18 ، كسب CPS = 0. حافظ على تعويض كسب الوقت موحدا عبر الصورة بأكملها.
- ضع وجه محول الطاقة بحيث يلامس سطح الماء ، وليس مغمورا بعمق. بدلا من ذلك ، استخدم غلافا واقيا مطاطيا مملوءا بهلام الموجات فوق الصوتية.
ملاحظة: لضمان تحديد المواقع القابلة للتكرار لنظام غرفة التدفق للتصوير ، يجب وضع العلامات على حوض الماء أو على شاشة نظام الموجات فوق الصوتية.
- ارسم تشتت الفقاعات الدقيقة من الخزان عبر الغرفة إلى المضخة لمدة دقيقتين.
- قم بتبديل التدفق إلى PBS ، لإزالة الفقاعات غير الملتصقة من القناة وتقييم التشتت الخلفي الصوتي للفقاعات الملتصقة (المستهدفة) المتبقية. للحصول على صورة خلفية ، قم بزيادة MI إلى 1.9 لتدمير الفقاعات الملتصقة في مجال رؤية التصوير بالموجات فوق الصوتية.
ملاحظة: يجب استبدال تشتت الفقاعات الدقيقة للتشغيل المتكرر: عند التخفيف العالي ، تتحلل الفقاعات الدقيقة تدريجيا بمرور الوقت.
- قم بتبديل التدفق إلى PBS ، لإزالة الفقاعات غير الملتصقة من القناة وتقييم التشتت الخلفي الصوتي للفقاعات الملتصقة (المستهدفة) المتبقية. للحصول على صورة خلفية ، قم بزيادة MI إلى 1.9 لتدمير الفقاعات الملتصقة في مجال رؤية التصوير بالموجات فوق الصوتية.
- تصدير الصور الفردية من دفق فيديو تسجيل الشاشة: قبل مسح PBS ، وبعد التنظيف ، وبعد التدمير ، ليتم استيرادها إلى ImageJ لتحليلها دون اتصال بالإنترنت. حدد منطقة الاهتمام (ROI) لاستبعاد أجزاء المدخل والمخرج من الغرفة. بعد طرح إشارة عائد الاستثمار في الخلفية ، حدد شدة الصدى كمتوسط شدة البكسل داخل عائد الاستثمار.
ملاحظة: كبديل للتصوير بالموجات فوق الصوتية ، يمكن ملاحظة التصاق الفقاعات الدقيقة بالسطح المستهدف عن طريق الفحص المجهري بالفيديو ، عندما يتم وضع مجموعة غرفة تدفق اللوحة المتوازية في الحامل المقلوب على مرحلة من المجهر المركب ، مع تسجيل الفيديو 5،11،12،14. هذا مفيد بشكل خاص لتصوير الالتصاق المستهدف للفقاعات الدقيقة بمستقبلات المؤشرات الحيوية لسطح الخلية في زراعة الخلايا ، عندما تزرع الخلايا الشفرة عن المستقبلات على طبق زراعة الأنسجة ، ويمكن حساب عدد الفقاعات الدقيقة المرتبطة بكل خلية مستهدفة مباشرة.
النتائج
اقتران تساهمي الببتيد والدهون
تم تأكيد اكتمال التفاعل وتكوين المنتج المطلوب بواسطة TLC. لم يتحرك عنصر تحكم الببتيد المنفصل غير المتفاعل لأعلى أثناء TLC: تم الاحتفاظ به في البداية ، وكانت بقعته إيجابية للمجموعة الأمينية الأولية ، كما لوحظ بعد رش النينهيدرين ، عند التسخين. لم تعد بقعة الببتيد الحرة إيجابية النينهيدرين هذه في الخليط بعد اكتمال التفاعل ، بعد TLC لعينة خليط التفاعل ، بعد إزالة DIPEA و DMSO وإعادة الذوبان في الكلوروفورم. بالنسبة للمسألة الحاسمة المتمثلة في جودة كاشف إستر NHS ، يعرض الشكل 1 المسار الطيفي لحركية التحلل المائي ، مع نقطة زمنية صفرية في بداية التفاعل عندما تمت إضافة إستر NHS في مذيب عضوي إلى الكوفيت. هذا يؤكد وظيفة الإستر النشط NHS من carboxy-PEG-DSPE (انظر قسم الطرق 1). عند نقطة الصفر ، يمثل A260 = 0.33 المستقر المادة التي تم تحللها بالفعل قبل الاختبار. عند الانتهاء من تفاعل التحلل المائي ، بما يزيد عن 10-15 دقيقة ، A260 = 1.54 (عندما لا يزداد الامتصاص بشكل كبير بعد الآن). هذا يؤكد وجود إستر نشط. كما يوفر بيانات كمية ، أن أكثر من 78٪ من المواد ليست NHS متحللة مسبقا ، وبالتالي يمكن استخدامها بنجاح لاقتران الببتيد ، مع التعديل المناسب لكمية الكاشف.
تحضير ونقل المواد الدهنية من الوسط المائي إلى غلاف الفقاعة: دهون مضان
تم تحضير الفقاعات الدقيقة لهذه الدراسة لاحتواء كمية ضئيلة (أقل من 1٪) من صبغة الفلورسنت DiI ، مع التألق الأحمر المميز ، والتي تمت إضافتها كمحلول في PG إلى محلول PG الملحي لستيرات DSPC و PEG. توضح الفقاعات الدقيقة الناتجة بوضوح مضان القشرة عند استخدام مرشحات إثارة الضوء الأخضر وانبعاث اللون الأحمر في المجهر (انظر الشكل 2 ، على اليسار). يمكن مقارنة الفحص المجهري الساطع لمرحلة غاز الفقاعات الدقيقة (الشكل 2 ، يمين) مع مضان غلاف الفقاعات الدقيقة. من أجل التقييم الكمي لنقل المواد الدهنية من المرحلة المائية إلى غلاف الفقاعة ، تم تعويم الفقاعات الدقيقة باستخدام الطرد المركزي ، وتمت مقارنة إشارة التألق للمرحلة تحت الحمراء الواضحة مع تألق المحلول الأولي ، قبل اندماج الفقاعات الدقيقة. لوحظ انخفاض إشارة من حيث الحجم تقريبا (الشكل 3) ، أي أن أكثر من 85٪ من المواد الدهنية قد انتقلت إلى غلاف الفقاعات الدقيقة عن طريق الدمج.
إعداد وتصحيح توزيع حجم الفقاعات الدقيقة
أظهرت الفقاعات الدقيقة الناتجة عن الاندماج توزيعا نموذجيا للحجم ، بتركيز عال (على سبيل المثال ، ~ 4.8 × 109 جزيئات لكل مل للفقاعات البيوتينية). كان توزيع الحجم واسعا ، مع وجود جزيئات داخل النطاق المقاس (بين 1 و 30 ميكرومتر). ~ 6.3٪ من الفقاعات الدقيقة يتجاوز قطرها 5 ميكرومتر (الشكل 4 ، المنحنى الأخضر). قد يؤدي إعطاء الفقاعات الدقيقة الكبيرة داخل الأوعية الدموية إلى تراكمها غير المحدد في الشعيرات الدموية ويجب تجنبها. يسمح التعويم القصير (15-17 دقيقة) للقارورة المقلوبة في الجاذبية العادية ، مع التجميع اللاحق ل 0.3 مل بالقرب من سطح الحاجز ، بإزالة الفقاعات الدقيقة الأكبر حجما تماما ، مع خسارة طفيفة في إجمالي تركيز عدد الجسيمات ، وصولا إلى ~ 4.6 × 109: بعد التعويم ، فقط 0.01٪ من الجسيمات في العينة المنقاة لها أقطار تزيد عن 5 ميكرومتر (الشكل 4 ، منحنى أحمر).
التصاق الفقاعات الدقيقة بالسطح المطلي بالمستقبلات: فحص ثابت
تم وصف هذا الإجراء لأول مرة في القرن الماضي1 ، ويتم استخدامه كاختبار سريع يؤكد وظائف الفقاعات الدقيقة المستهدفة. يسمح للفقاعات الدقيقة بالاتصال بسطح الطبق الحامل للمستقبلات. إذا حدث تفاعل الترابط والمستقبلات ، فقد يتم الاحتفاظ بالفقاعات على السطح على الرغم من الغسيل القوي. يتم تقديم مثال على هذا الاختبار السريع للالتصاق الوظيفي للفقاعات الدقيقة c (RGDfK) على السطح المطلي ب α المؤتلفvβ3 . الشكل 5 عبارة عن صورة مجهرية تمثيلية للحقل الساطع للفقاعات الدقيقة الملتصقة على سطح المستقبل في طبق بتري ، بعد الغسيل باستخدام PBS ، لإزالة الفقاعات غير المقيدة. تظهر الفقاعات في هذا النوع من الفحص المجهري على شكل أنماط دائرية داكنة. في حالة مماثلة ، إذا كان السطح مغطى فقط بالألبومين (لمنع الالتصاق غير المحدد) ، فلن تلتصق الفقاعات الدقيقة وسيتم غسلها بسهولة حتى عن طريق الشطف اللطيف.
ربط الفقاعات الدقيقة من الوسط المتدفق: غرفة تدفق اللوحة المتوازية
تم اقتراح هذا الإجراء في البداية كأداة لدراسة التصاق الخلية في إعداد التدفق المتحكم فيه15 وتم تكييفه لدراسة استهداف الفقاعات الدقيقة بعد عقود11. يعد الاختبار في نظام التدفق ، على عكس الفحص الثابت ، أكثر واقعية لسيناريو التصوير السريري ، حيث تلمس الفقاعات المنتشرة في تدفق الدم جدار الوعاء لفترة وجيزة وقد تلتصق به إذا كان المستقبل المستهدف موجودا. يتم تقديم مثالين على هذه الدراسات. المثال الأول هو نهج أكثر تقليدية ، حيث تتم مراقبة التصاق الفقاعات الدقيقة المزينة بالببتيد على السطح المطلي بالمستقبلات بواسطة الفحص المجهري بالفيديو. يسمح الفحص المجهري بتمييز الفقاعات الدقيقة الملتصقة عن الفقاعات المتدفقة. كما يسمح بتحديد تلك الفقاعات الدقيقة الملتصقة في إطار التصوير المجهري: يلتصق العديد من الفقاعات الدقيقة c (RGDfK) (العمود الأيسر) بالسطح ، عند مقارنتها بالتحكم ، حيث يتم استخدام الببتيد المخفوق c (RADfK) ، أو إذا كان السطح مغطى فقط ب BSA (الشكل 6).
المثال الثاني هو التصوير بالموجات فوق الصوتية المتباينة لطبق بتري المطلي بالستربتافيدين (الشكل 7 ، الجانب الأيمن) الذي تمتص فيه الفقاعات الدقيقة الحيوية بنجاح من الوسط المتدفق ، ويمكن اكتشافها عن طريق التصوير بالموجات فوق الصوتية المتباينة بعد التدفق باستخدام PBS. لا يحتفظ سطح طبق التحكم بأي فقاعات دقيقة ملتصقة من التدفق ، لذلك تتم إزالة جميع إشارات تباين الموجات فوق الصوتية بشكل أساسي مع تدفق PBS. يظهر القياس الكمي لإشارة التباين بالموجات فوق الصوتية دلالة إحصائية قوية للفرق الذي لوحظ. تجاوزت نسبة إشارات الهدف والتحكم ترتيبا من حيث الحجم.
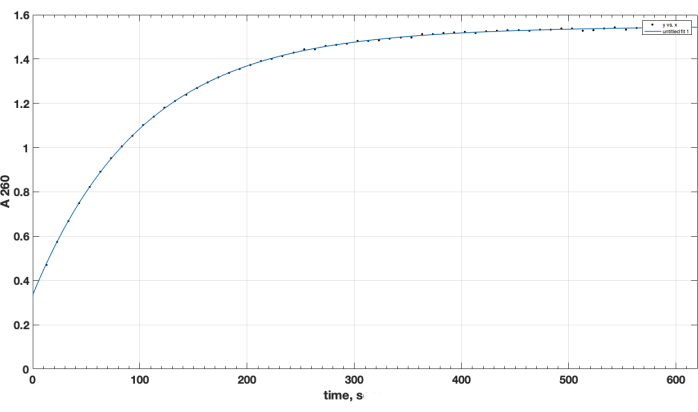
الشكل 1. حركية التحلل المائي للإستر النشط NHS-PEG-DSPE ، لوحظ بواسطة إطلاق NHS في وسط قلوي عن طريق اختبار القياس الطيفي عند الطول الموجي 260 نانومتر. النقطة الزمنية الصفرية هي وقت إضافة NHS-PEG-DSPE في المذيب العضوي إلى المخزن المؤقت للبورات 0.1 M ، الرقم الهيدروجيني 9.2. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. الفحص المجهري للفقاعات الدقيقة المملوءة بالغاز بعد الدمج. اليسار ، الفحص المجهري الفلوري (الإثارة الخضراء ، الانبعاث الأحمر ، صبغة قشرة الدهون DiI). اليمين ، الفحص المجهري للحقل الساطع (مراقبة طور الغاز) ، نفس التكبير. عرض الإطار، 85 ميكرومتر (ميكرومتر 10 ميكرومتر مضمن في أسفل يمين كل صورة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
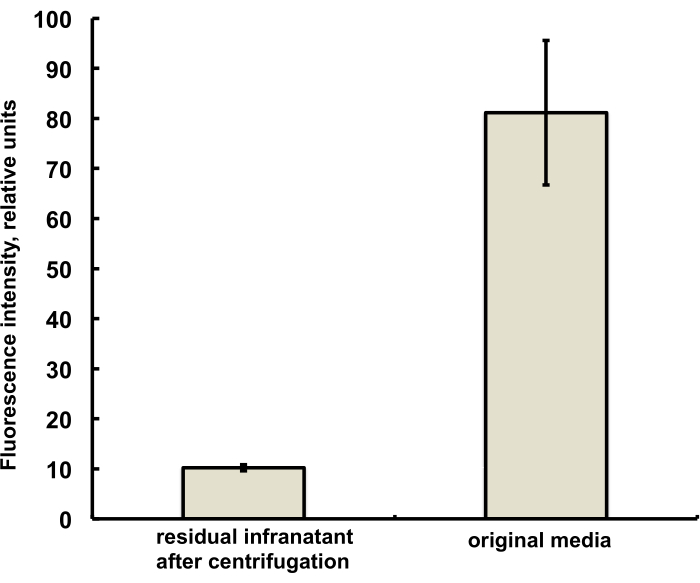
الشكل 3. التحليل الطيفي الفلوري لعينة صبغة الدهون DiI من وسط تحضير الفقاعات الدقيقة قبل الاندماج (يمين) وبعد الاندماج وإزالة الفقاعات الدقيقة عن طريق التعويم بالطرد المركزي (يسار). إثارة مضان - 555 نانومتر ، انبعاث - 620 نانومتر. البيانات المعروضة على أنها متوسط ± الانحراف المعياري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
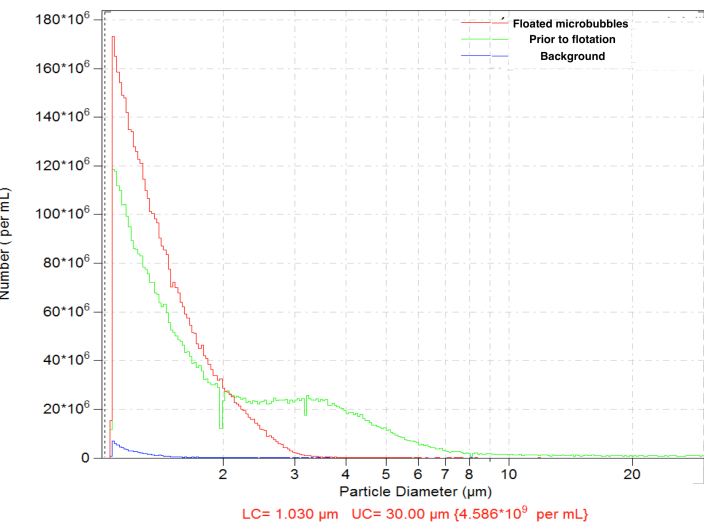
الشكل 4. توزيع حجم الجسيمات لعدد تركيز الفقاعات الدقيقة بعد تحضير الاندماج (أخضر) ، مع تعويم الجاذبية الطبيعي اللاحق لإزالة الفقاعات الدقيقة الكبيرة (الحمراء) وعدد الخلفية المخففة فقط (الأزرق). عد الجسيمات المستشعرة بالمنطقة الكهربائية في محلول ملحي عادي ، فتحة 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5. الفحص المجهري برايتفيلد للفقاعات الدقيقة c (RGDfK) على طبق مغطى ب αvβ3. عرض إطار الصورة 106 μم ؛ الشريط 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6. في المختبر ، استهداف غرفة تدفق اللوحة المتوازية للفقاعات الدقيقة المزينة بالببتيد على السطح المطلي ب α المؤتلف vβ3. تم لصق الفقاعات الدقيقة المزينة ب cRGDfK بكفاءة على الطبق (على اليسار) ، وكان مرفق الفقاعات الدقيقة غير المستهدفة للتحكم cRADfK (المخفوق ، المركز) ضئيلا (p<0.00005) ، وكذلك الاحتفاظ بالفقاعات الدقيقة على سطح التحكم في الألبومين فقط (يمين ، ص <0.0025). إجهاد قص جدار تدفق الغرفة عند 1 دين / سم2. التصاق الفقاعات الدقيقة التي يتم مراقبتها بواسطة الفحص المجهري بالفيديو. يتم تقديم عدد الجسيمات في مجال الرؤية. وقت التراكم 4 دقائق. البيانات المعروضة على أنها متوسط ± الانحراف المعياري. أعيد طبعها بإذن من5. حقوق الطبع والنشر ، 2018 ، الجمعية الكيميائية الأمريكية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
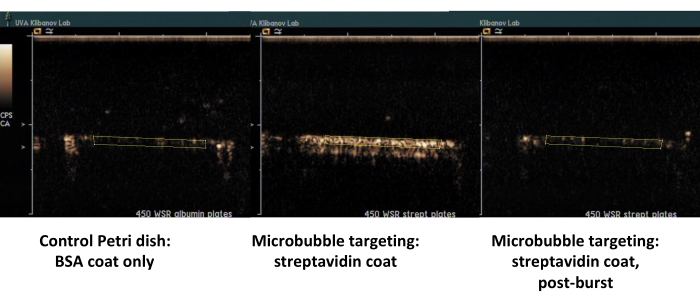
الشكل 7. التصوير بالموجات فوق الصوتية على النقيض لغرفة تدفق اللوحة المتوازية بعد الالتصاق المستهدف والتدفق المؤقت للفقاعات الدقيقة الحيوية على الطبق المغطى بالستربتافيدين (الفقاعات الدقيقة المستهدفة الوسطى ، الملتصقة ، اليمين ، نفس الطبق ، بعد انفجار الموجات فوق الصوتية عالية MI) ، وطبق التحكم المطلي فقط بالألبومين (يسار). دقيقتان من نضح تشتت الفقاعات الدقيقة (PBS / BSA ، 106 جسيمات / مل) بمعدل قص 450 ثانية - 1 ، متبوعا بتدفق عازل. يتم إجراء القياس الكمي لإشارة الموجات فوق الصوتية من مناطق الاهتمام في إطارات الفيديو بعد طرح الخلفية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تتضح أهمية تقنية بسيطة لإعداد الفقاعات الدقيقة المزينة بالترابط. قد يخدم استخدام تقنية الاندماج لإعداد الفقاعات الدقيقة ، كما كان رائدا من قبل Unger et al. ،16 ، هذا الغرض لعدد من الأسباب. من السهل إجراء تصنيع الفقاعات الدقيقة بواسطة المغمس. تتوفر وحدة سطح المكتب أحادية الطور صغيرة الحجم بجهد 120 فولت وغير مكلفة. الإجراء سريع (45 ثانية) وفعال: يتم تحضير 1 مل من تشتت الفقاعات الدقيقة في وسط مائي مرة واحدة. يحتوي على مليارات الجسيمات لكل مل ، وهو أكثر من كاف للدراسات البحثية. يحدث التصنيع في قارورة محكمة الغلق مع فراغ غاز مشبع بالفلور. إذا لزم الأمر ، ستظل محتويات القارورة معقمة من وقت التعبئة المعقمة ، أثناء التصنيع (الاندماج) ، وحتى الاستخدام. هذا يجعل النهج مناسبا للاستخدام السريري ، لأنه لا يتطلب استعدادات متقنة في بيئة معقمة مخصصة في العيادة.
يعتمد الإجراء على التجميع الذاتي: أثناء الخلط ، حيث يتم تطبيق القص العالي على واجهة الغاز والماء داخل القارورة المتحركة ، تتشكل شظايا غاز صغيرة ، والتي تتخذ شكلا كرويا بسبب عمل التوتر السطحي. يقلل PG ، باعتباره مادة خافضة للتوتر السطحي ، موجودة في الوسط بتركيز عال ، من التوتر السطحي والطاقة المطلوبة لتوليد واجهة الغاز والماء أثناء القص. بعد ذلك ، تصل المزيد من المواد الخافضة للتوتر السطحي "الكلاسيكية" ، مثل دهون PEG والفوسفوليبيدات ، الموجودة بتركيزات أقل بكثير ، إلى الواجهة ، على الأرجح إزاحة PG وإنشاء طبقة أحادية الجزيئات على سطح الفقاعة. هذه القشرة مستقرة بشكل معقول. من المحتمل أن يكون ذلك بسبب مزيج من الدهون "الصلبة" (درجة حرارة انتقال طور DSPC هي 56 درجة مئوية ، لذا فهي ليست عرضة للاندماج بين الأغشية) وطبقة فرشاة PEG الممتدة التي تحيط بالفقاعات الدقيقة وتمنع التلامس المباشر أحادي الطبقة للفقاعات المجاورة. يمكن للمرء أن يتكهن بأن وجود تركيز عال من PG في الوسائط قد يقلل من استقرار غلاف الفقاعات الدقيقة. في حالة عدم وجودها ، تكون الفقاعات الدقيقة مستقرة في القوارير المختومة تحت الغلاف الجوي الفلوروكربوني لعدة أشهر ، مع اندماج معتدل فقط بين الفقاعات. للاستخدام السريري ، مع وجود جهاز مدمج صغير بجانب السرير ، يمكن أن تكون الفترة الفاصلة بين تحضير الفقاعات الدقيقة واستخدامها قصيرة أو دقائق أو ساعات. مع وجود PG في الوسائط ، لا يظهر تركيز الفقاعات الدقيقة انخفاضا كبيرا ، على الأقل لعدة ساعات من التخزين المبرد.
ميزة إضافية للإجراء الموصوف (بمساعدة استخدام PG cosurtuant في وسط تحضير الفقاعة) هي فعالية عالية (>85٪) لنقل الدهون إلى القشرة ، في حين أن الصوتنة التقليدية توفر ~ 20٪ فعالية5 وطرق الموائع الدقيقة الحديثة أقلمن 17. يعد المستوى العالي من كفاءة النقل أمرا مهما ليس فقط بسبب تقليل هدر المواد الدهنية والترابط باهظ الثمن ، ولكن لأن كمية الترابط الخالي من الفقاعات الموجود في الوسائط يتم تقليله أيضا. ثم قد لا تتاح للرابط الحر فرصة لمنع المستقبل المستهدف للعلامة الحيوية الذي من المتوقع أن ترتبط به الفقاعات الدقيقة عبر الترابط على سطحها. غالبا ما تكون الكمية العامة لمستقبل المؤشر الحيوي على الأوعية الدموية المستهدفة عالية جدا ، لذلك قد لا يكون هذا ذا أهمية قصوى. من أدبيات براءات الاختراعالمتاحة 18 ، قد يقترح المرء أن ما لا يقل عن 50٪ من مادة القشرة الدهنية والروابط المستهدفة في تركيبات الفقاعات الدقيقة في الاختبارات السريرية قد ترتبط بقشرة الفقاعة. يمكن مقارنة ذلك بشكل عام بالأجسام المضادة أو الببتيدات ذات العلامات الإشعاعية التي تستخدم على نطاق واسع في دراسات تصوير مستقبلات الطب النووي: معظم تلك التي تستهدف جزيئات الترابط لا تحمل في الواقع نظائر مشعة "ساخنة" حتى بالنسبة لأعلى نشاط محدد تم الإبلاغعنه 19 ، بينما بالنسبة للفقاعات الدقيقة المستهدفة ، فإن مادة القشرة في هذه الدراسة (بما في ذلك الترابط والدهون) مرتبطة في الغالب بالفقاعات الدقيقة.
تم عرض الالتصاق الانتقائي للفقاعات الدقيقة المستهدفة التي أعدتها هذه التقنية في المختبر ، في مجموعتين من نماذج الاستهداف: التصاق ثابت ، وتجربة استهداف غرفة التدفق. في الفحص الثابت ، تلتصقت الفقاعات الدقيقة المستهدفة بطبقة المستقبلات المستهدفة بإحكام ولم يتم إزاحتها بالشطف العازل ، على عكس إعداد التحكم ، حيث تمت إزالة الفقاعات الدقيقة من السطح حتى مع الشطف اللطيف. وبالمثل ، في اختبار التدفق ، الذي تم إجراؤه في غرفة تدفق اللوحة المتوازية ، أظهرت فقاعات البيوتينيل التصاق ذو دلالة إحصائية ورائعة لطبقة الستربتافيدين على طبق البوليسترين ، عند مقارنتها بسطح الألبومين الضابط فقط. تم لصق الفقاعات الدقيقة المزينة بالببتيد c (RGDfK) بشكل انتقائي بسطح αvβ3 ، سواء في مقايسة الالتصاق الساكن ، أو في غرفة تدفق اللوحة المتوازية.
يمكن اعتبار القضايا التالية قيودا على البروتوكول الموصوف. أولا ، لا يأخذ الإجراء في الحسبان الجسيمات دون الميكرون. لم يتم إعداد الأداة التي تم استخدامها في الدراسة للكشف عن الفقاعات النانوية (أي الجسيمات التي يقل قطرها عن 1 ميكرومتر). ربما كانت هذه الجسيمات موجودة في الصيغة. على الرغم من أنه من المعروف عموما أن إشارة التشتت الخلفي الصوتية منخفضة ، ولم يتم ملاحظتها في هذه الدراسة بواسطة الفحص المجهري ، إلا أنه لا يزال يتعين النظر في وجود الفقاعات النانوية. القضية الثانية المهمة هي عدم تجانس حجم الفقاعات الدقيقة. على الرغم من إزالة الجسيمات الأكبر حجما ، فإن حجم الفقاعات الناتجة بعيد كل البعد عن التوحيد. يجب أن يكون هذا اعتبارا ومبررا لمزيد من البحث في مجال صياغة الفقاعات الدقيقة.
في الختام ، يجب أن يوفر السرد الوارد في هذه المخطوطة مستوى كافيا من التفاصيل الفنية لتصنيع الفقاعات الدقيقة المستهدفة بسرعة وسهولة. يتم توفير خطوات إجراء تنقية إضافية (إذا كان ذلك مرغوبا فيها) ، وضبط الحجم و / أو تقييم الكمية الصغيرة من مادة القشرة المتبقية في الوسط المائي. تم وصف الأدوات التحليلية التفصيلية لتقييم معلمات الفقاعات الدقيقة ، مثل توزيع الحجم والتركيز ، وقدرة الفقاعات الدقيقة المزخرفة بالترابط في المختبر على الالتصاق بالمستقبلات المستهدفة.
Disclosures
A. Klibanov هو مؤسس مشارك ومساهم أقلية في Targeson Inc ، وهي شركة ناشئة في مجال الفقاعات الدقيقة المستهدفة قبل السريرية ، والتي تم حلها الآن. يمتلك مختبر UVA الخاص به عقدا من الباطن عبر HL139241 المعاهد الوطنية للصحة R44 من SoundPipe Therapeutics.
Acknowledgements
يقر A.L. Klibanov بالدعم جزئيا من خلال R01EB023055 المعاهد الوطنية للصحة ، الممنوحة من قبل المعهد الوطني للتصوير الطبي الحيوي والهندسة الحيوية التابع للمعاهد الوطنية للصحة ، وهو عقد من الباطن لجامعة فيرجينيا عبر المعاهد الوطنية للصحة R01NS076726 ، الممنوح لجامعة كاليفورنيا في سان فرانسيسكو من قبل المعهد الوطني للاضطرابات العصبية والسكتة الدماغية التابع للمعاهد الوطنية للصحة ، وعقد من الباطن لجامعة فيرجينيا عبر منح المعاهد الوطنية للصحة R44HL139241 ، منحت إلى SoundPipe Therapeutics من قبل المعهد الوطني للقلب والرئة والدم. محتوى هذا المنشور هو مسؤولية المؤلف وحده ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
References
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved