Method Article
Um ensaio ex vivo para estudar candida albicans Hórgênese Háfal no Trato Gastrointestinal
Neste Artigo
Resumo
O ensaio ex vivo descrito neste estudo utilizando extratos de homogeneização intestinal e coloração de imunofluorescência representa um novo método para examinar a morfogênese húfa de Candida albicans no trato GI. Este método pode ser utilizado para investigar os sinais ambientais que regulam a transição morfogenética no intestino.
Resumo
A morfogênese húfala candida albicans no trato gastrointestinal (GI) é fortemente controlada por vários sinais ambientais, e desempenha um papel importante na disseminação e patogênese deste patógeno fúngico oportunista. No entanto, os métodos para visualizar a hifa fúngica no trato GI in vivo são desafiadores, o que limita a compreensão dos sinais ambientais no controle desse processo de morfogênese. O protocolo aqui descrito demonstra um novo método ex vivo para visualização da morfogênese hifal em extratos homogeneizados intestinais. Usando um ensaio ex vivo, este estudo demonstra que o conteúdo cecal de camundongos tratados com antibióticos, mas não de camundongos de controle não tratados, promovem a morfogênese háfagênese C. albicans no conteúdo intestinal. Além disso, adicionar de volta grupos específicos de metabólitos intestinais ao conteúdo cecal de camundongos tratados com antibióticos regula diferencialmente a morfogênese hifalina ex vivo. Em conjunto, este protocolo representa um novo método para identificar e investigar os sinais ambientais que controlam a morfogênese húfa cofálica no trato GI.
Introdução
Candida albicans é um patógeno fúngico oportunista e polimórfico que normalmente é commensal, mas pode sofrer uma alteração morfológica em uma forma virulenta capaz de causar infecções fatais em indivíduos imunocomprometidos1,2,3,4,5,6,7,8,9,10,11,12,13. C. albicans é uma das principais causas de infecções nosocomiais sistêmicas, com uma taxa de mortalidade de 40\u201260% mesmo com tratamento antifúngico2,14,15. Embora os albicanos residam em diferentes nichos hospedeiros, incluindo o sistema reprodutivo feminino16,17, a cavidade oral de indivíduos saudáveis18 e o trato gastrointestinal (GI)19,20, a maioria das infecções sistêmicas originárias do trato GI e, além disso, a fonte de infecção sistêmica é frequentemente confirmada como o trato GI21,22,23,24,25,26,27,28,29,30,31,32,33,34. C. a patogenicidade dos albicanos no trato GI é influenciada por uma ampla gama de fatores; no entanto, uma característica importante necessária para a virulência é a transição de uma morfologia celular levedura para uma morfologia de células hífas virulenta35,36,37,38,39,40,41,42,43,44. C. o apego e disseminação do trato de GI durante a infecção está altamente associado à sua capacidade de transição de uma levedura commensal para hifa virulenta, permitindo que os fungos causem doença invasiva44,45,46,47,48,49,50,51,52,53.
Uma variedade de fatores no intestino, incluindo n-acetilglucosamina, regulam a formação hifáfal por C. albicans. Portanto, é crucial diminuir a lacuna de conhecimento sobre a morfogênese hifal deste patógeno fúngico no trato GI54,55,56. Evidências recentes indicam que vários metabólitos intestinais controlam diferencialmente a morfogênese háfa de C. albicans in vitro57,58,59,60. No entanto, as restrições técnicas apresentam problemas ao tentar estudar a formação de c. albicans hyphae em amostras in vivo, especialmente a coloração de leveduras e células de higia e análise quantitativa do desenvolvimento de higificos. Para entender a morfogênese hábica de C. albicans no trato GI, um método ex vivo foi desenvolvido utilizando extratos solúveis de conteúdo intestinal homogeneizado de camundongos para estudar o efeito de metabólitos na morfogênese húfa fúngica. Utilizando amostras intestinais de camundongos resistentes e suscetíveis à infecção por C. albicans GI, este método ajudará a identificar e estudar o efeito de metabólitos, antibióticos e xenobióticos na morfogênese húfa fúngica no trato GI.
Protocolo
Todos os protocolos de animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Centro-Oeste (IACUC), conforme descrito antesde 57. O Comitê Institucional de Cuidados e Uso de Animais da Universidade do Centro-Oeste aprovou este estudo sob o Protocolo MWU IACUC #2894. As políticas de atenção animal da MWU seguem a Política de Atenção e Uso de Animais de Laboratório do Serviço Público de Saúde (PHS) e as políticas previstas na Lei de Bem-Estar Animal (AWA).
1. Os ratos estudam o protocolo padrão
- Use camundongos C57BL/6J machos e femininos com pelo menos seis semanas de idade. Suplementá-los com água estéril com ou sem cefoperazone (0,5 mg/mL).
- Co-house ratos em grupos de 5, com cada gaiola contendo todos os machos ou todos os ratos fêmeas. Forneça aos ratos comida e água padrão do mouse (através de uma garrafa de 400 mL) o tempo todo.
- Verifique as gaiolas diariamente para garantir que os níveis de comida e água sejam suficientes, e para examinar os ratos em busca de sinais de angústia.
- Substitua a água por cefoperazone a cada 48 horas para garantir que antibióticos frescos sejam fornecidos independentemente da água restante nas garrafas de alimentação da gaiola.
- Após 5\u20127 dias de tratamento cefoperazone, eutanize camundongos via asfixia de CO2 observando o protocolo IACUC estabelecido. Confirme a morte por luxação cervical.
- Disseco camundongos usando tesouras afiadas esterilizadas autoclave e fórceps esterilizados por autoclave.
- Após a eutanásia, proteja o animal a uma superfície de dissecção fixando todos os membros de tal forma que o abdômen seja exposto.
- Pulverize a região abdominal com 70% de etanol para evitar que os peles grudem em fórceps, tesouras ou seções intestinais durante a dissecção.
- Use fórceps para beliscar e levantar uma seção da pele na base do abdômen e criar uma pequena incisão através da pele e fáscia subjacente usando uma tesoura. Tome muito cuidado ao fazer esta incisão para evitar perfurar o ceco ou parede intestinal.
- Este corte até a caixa torácica, expondo parcialmente a cavidade peritoneal. Faça um corte a partir do ponto da incisão inicial de ambos os lados estendendo-se para cima e lateralmente.
- Puxe estes retalhos lateralmente e fixe na superfície dissecando para expor totalmente a cavidade peritoneal.
- Extrair o trato GI usando fórceps, ao mesmo tempo em que usar a tesoura para fazer cortes superiores ao estômago e na região distal do intestino grosso para garantir a coleta da maior quantidade de conteúdo intestinal de cada seção.
- Ao remover o trato GI, tome cuidado para evitar a ruptura dos componentes individuais. Separe o estômago, o intestino delgado, o ceco e o intestino grosso individualmente usando uma tesoura em suas extremidades proximal e distal.
- Para a coleta de cada conteúdo intestinal de cada seção, faça uma única incisão na extremidade distal de cada seção usando uma tesoura, seguida de expulsão manual do conteúdo intestinal em um tubo de microcentrifuuge de 1,5 mL usando fórceps.
- Armazene o conteúdo intestinal a -80 °C para ensaios ex vivo.
2. Preparação de placas de ágar extrato de levedura-peptone-dextrose (YPD)
- A uma garrafa de vidro de 1 L adicione 25 g de fermento extrato peptone-dextrose em pó, 10 g de ágar e água ultrauso a um volume final de 500 mL.
- Autoclave a 121 °C por 30 min em um ciclo líquido para esterilizar a mídia.
- Sob um capô de fluxo laminar, despeje aproximadamente 20 mL de mídia de ágar em uma placa de Petri estéril. 500 mL de mídia ágar deve render aproximadamente 25 placas.
- Armazene as placas a 4 °C até ficar pronta para uso.
3. Preparação ex vivo para ensaio de morfogênese hifal
- Traço uma nova cultura de C. albicans SC5314 em uma placa de ágar YPD e incubar durante a noite a 30 °C.
- Escolha duas a três colônias individuais de médio porte da cultura C. albicans sc5314 cultivadas durante a noite e suspenda-se em 1 mL de soro fisiológico tamponado de fosfato (PBS).
- Recupere o conteúdo do intestino congelado do congelador -80 °C e descongele a 25 °C.
- Pesar cerca de 150 mg de conteúdo intestinal em um novo tubo de 1,5 mL.
- Suspenda o conteúdo intestinal com 150 μL de PBS (conteúdo intestinal e PBS a uma razão peso/volume de 1:1).
- Vórtice em alta velocidade por 30 s para homogeneizar o conteúdo intestinal e permitir sentar-se à temperatura ambiente por cerca de um minuto.
- Centrifugar os homogeneiza em 1000 x g por 3 min.
- Transfira o supernatante para um novo tubo de 1,5 mL.
- Repita as etapas 3.7 e 3.8 para remover todos os detritos do supernaspe.
- Adicione 10 μL do C. albicans SC5314 inóculo preparado acima para este supernatante
- Misture bem e incubar a 37 °C por 4 a 5 h.
4. Adição exógena de metabólitos aos extratos homogeneizantes do intestino para o ensaio de morfogênese hifál
- Recuperar o conteúdo do intestino congelado do congelador -80 °C e reinsu suspensão na PBS na proporção 1:1 (peso: volume).
- Adicione a concentração desejada de metabólitos intestinais ao conteúdo intestinal e à mistura de PBS.
- Vórtice em alta velocidade por 30 s para homogeneizar o conteúdo intestinal contendo metabólitos e permitir sentar-se à temperatura ambiente por cerca de 10 minutos.
- Centrifugar os homogeneiza em 1000 x g por 3 min.
- Transfira o supernatante para um novo tubo de 1,5 mL. Repita as etapas 4.4 e 4.5 para remover todos os detritos do supernaspe.
- Adicione 10 μL do C. albicans SC5314 inóculo preparado acima a este supernatante. Misture bem e incubar a 37 °C por 4 a 5 h.
5. Ensaio de morfogênese de albicanos (imunostaining e imagem)
- Centrifugar as amostras a 1000 x g por 2 min e descartar o supernatante através de pipetagem.
- Fixar as amostras em 100 μL de 2% de paraformaldeído (PFA) por 15 min.
- Centrifugar a 1000 x g por 2 min e descartar supernaspeuta via pipetação.
- Lave as amostras duas vezes com 1 mL de PBS. Para lavar amostras, suspenda a pelota em PBS, encanar suavemente. Não vórtice a amostra, pois isso pode danificar estruturas hifais. Após a suspensão, centrífuga a 1000 x g por 2 min e descarte o supernaspeuta através de pipetagem.
- Incubar as amostras à temperatura ambiente em 100 μL de PBS contendo anticorpo policlonal C. albicans (diluição 1:100) por 30 min.
- Lave as amostras três vezes com 1 mL de PBS.
NOTA: Ao usar um anticorpo fluorescente, recomenda-se que todas as etapas de diluição e lavagem sejam realizadas em luz fraca para evitar branqueamento de fotos e melhorar a longevidade da amostra. - Incubar as amostras à temperatura ambiente por 15 minutos em 100 μL de PBS contendo anticorpo anti-Rabbit IgG Alexafluor 488 a 1:500 diluição. Realize a incubação em uma gaveta ou sala escura para evitar branqueamento de fotos.
- Lave as amostras três vezes com 1 mL de PBS.
- Suspenda as amostras em 100 μL de PBS e transfira para uma placa de 96 poços para imagem.
NOTA: Quando não for imageada, recomenda-se que a placa de 96 poços seja enrolada em papel alumínio para evitar branqueamento fotográfico. - Células fúngicas de imagem usando lentes objetivas de 20x e 40x usando um microscópio de imagem de fluorescência. Use um filtro de proteína fluorescente verde (GFP) (comprimento de onda de excitação 470/40 e comprimento de onda de emissão 525/50) para detectar fluorescência.
Resultados
Esses resultados, juntamente com os achados anteriores do laboratório Thangamani60, indicam que quando os albicanos são cultivados ex vivo em extratos homogeneizados intestinais retirados do estômago, intestinos delgados e intestinos grandes de controle não tratado e camundongos tratados com antibióticos, C. albicans geralmente se desenvolve com uma morfologia de levedura(Figura 1B). No entanto, quando cultivados no extrato cecal de camundongos tratados com antibióticos, os albicanos prontamente sofrem morfogênese, resultando em amostras contendo formas de levedura e hifa(Figura 1B); isso não ocorre em ratos de controle. Isso suporta resultados anteriores, que mostraram um aumento significativo das formas de higia em amostras cultivadas em extratos cecal tratados com antibióticos, mas não em quaisquer outros extratos intestinais tratados com antibióticos60. Esses resultados sugerem que o tratamento com antibióticos causa alterações no ambiente cecal, que induzem morfogênese hifalina de C. albicans. Além disso, a localização específica deste fenótipo notado apenas no ceco também sugere que essas condições promotoras de higeia podem não necessariamente estar presentes em todo o trato GI, mas, em vez disso, estão restritas a segmentos específicos do trato GI, dependendo da disponibilidade de nutrientes, metabólitos e outras moléculas desconhecidas.
Uma vez que o extrato cecal de camundongos tratados com antibióticos promove a morfogênese de C. albicans57,58,59,60, examinamos se a adição exógena de um grupo selecionado de metabólitos intestinais (identificados a partir de estudos in vitro anteriores) ao teor cecal de camundongos tratados com cef afetará a morfogênese de C. albicans ex vivo. Trabalhos anteriores realizados pelo laboratório de Thangamani caracterizaram o perfil metabolômico do conteúdo cecal homogenate extraído de camundongos não tratados e tratados com antibióticos, revelando mudanças significativas na abundância de vários metabólitos como resultado do tratamento antibiótico — especificamente, diminuição da abundância de ácidos biliares secundários e aumento da abundância de carboidratos60. Além disso, este estudo identificou que ácidos biliares secundários e ácidos carboxílicos inibem o desenvolvimento de hifas, enquanto carboidratos, incluindo glicose, promovem a morfênese háfaca de C. albicans in vitro60. Os resultados indicam que a adição de um pool de metabólitos inibitórios do intestino contendo ácido desoxicólico (DCA, 0,5 mg/mL), ácido litocólico (LCA, 0,1 mg/mL), ácido palmítico (0,1 mg/mL), ácido p-tolylacetic (0,1 mg/mL), ácido sebacic (0,5 mg/mL), 0,5 mg/mL), 0,5 mg/mL), 0,5 mg/mL), 0,5 mg/mL), 0,5 mg/mL), 0,5 mgs/mL), 0,5 mg/mL), 0 2-metilbutírico ácido (0,5 mg/mL) e ácido láctico (5 mg/mL) para o homogeneado cecal de camundongos tratados com cef completamente inibiram a morfogênese hifacal ex vivo. Por outro lado, a adição exógena de glicose (1 mg/mL) ao homogeneado cecal de camundongos tratados com cef mostrou um desenvolvimento de higfêquico maciço ex vivo (Figura 2B). Coletivamente, esses achados indicam que a adição de metabólitos intestinais de volta ao homogeneto cecal dos camundongos tratados com cef regula diferencialmente a morfogênese dos c. albicanos, confirmando assim achados in vitro anteriores. Esses resultados indicam que os metabólitos intestinais desempenham um papel crítico na morfogênese háfaca dos albicanos e a compreensão dos alvos genéticos e caminhos de sinalização modulados por esses metabólitos ajudarão no desenvolvimento de novas abordagens terapêuticas para prevenir e tratar infecções por C. albicans.

Figura 1: Ensaio ex vivo para determinar o efeito do tratamento cefoperazone em C. albicans húfalogênese no conteúdo intestinal. (A) Esboço esquemático do protocolo. (B) Os conteúdos intestinais tratados com antibióticos (painéis superiores) e não tratados (painéis inferiores) foram retirados dos estômagos, intestinos delgados, cecos e intestinos grossos de camundongos C57BL/6J. O conteúdo intestinal inoculado com C. albicans SC5314 foi incubado a 37 °C por 4\u20125 h e manchado com anticorpo C. albicans. As células foram imagens com ampliação de 40x. Imagens representativas são mostradas aqui. Clique aqui para ver uma versão maior desta figura.
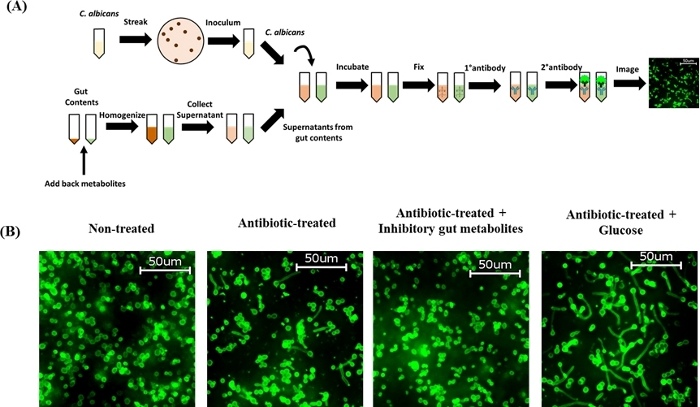
Figura 2: Adição exógena de metabólitos intestinais ao conteúdo cecal de camundongos tratados com cef na formação de hifalia de C. albicans ex vivo. (A) Esboço esquemático do protocolo. (B) Piscina de metabólitos inibitórios contendo DCA (0,5 mg/mL), LCA (0,1 mg/mL), ácido palmítico (0,1 mg/mL), ácido p-tolylacetic (0,1 mg/mL), ácido sebacic (0,5 mg/mL); 2-ácido metilbutírico (0,5 mg/mL) e ácido láctico (5 mg/mL) ou glicose (1 mg/mL) foram adicionados de volta ao teor cecal de camundongos tratados com cef, misturados completamente e incubados a 37 °C por 15 min para realizar o ensaio ex vivo hyphae. Os conteúdos cecal inoculados com C. albicans SC5314 foram incubados a 37 °C por 4\u20125 h e manchados com anticorpo C. albicans. As células foram imagens com ampliação de 40x. Imagens representativas são mostradas aqui. Clique aqui para ver uma versão maior desta figura.
Discussão
O método descrito aqui apresenta uma nova maneira de investigar o efeito de antibióticos, impactos dietéticos, xenobióticos e terapêuticos na morfogênese hífa de C. albicans no trato GI. Uma vez que a maioria das infecções sistêmicas se origina do trato GI21,22,23,24,25,26,27,28,29,30,31,32,33,34 e a formação de hifa é um fator crítico de virulência que promove a disseminação de C. albicanos do trato GI, entendendo os fatores que controlam essa morfogênese no trato GI, expandirão o conhecimento sobre mecanismos de patogênese e identificarão novas opções de tratamento.
Embora o método aqui apresentado seja relativamente simples, algumas etapas discutidas abaixo foram identificadas como críticas e importantes. i O inóculo inicial dos albicanos C. deve ser ideal para permitir tanto o crescimento quanto a morfogênese hifal de fungos. Com a disponibilidade limitada de nutrientes nos extratos homogeneizadores do intestino, maior volume de inóculo pode reduzir significativamente o crescimento fúngico e o processo de morfogênese. No entanto, o crescimento de diferentes isolados clínicos e cepas provavelmente será variável, assim, otimizar o inóculo e o tempo de incubação para isolados específicos de C. albicans é essencial. (ii) Várias etapas de centrifugação ao preparar o extrato de homogeneização intestinal foram consideradas cruciais para remover os detritos no conteúdo intestinal o máximo possível. (iii) Devido à velocidade relativamente baixa de centrifugação (para evitar danificar estruturas hifais), deve-se tomar cuidado para evitar a perda celular durante as etapas imunossurgiantes deste protocolo.
Métodos alternativos para visualizar hifas fúngicas no trato GI têm sido utilizados no passado, com certas vantagens e limitações associadas a cada método. Um método relativamente notável usando a hibridização fluorescente in situ (FISH) para visualizar hifas fúngicas no trato GI foi recentemente demonstrado por Witchley et al.61,62. Trata-se de um método in vivo promissor atualmente disponível para detectar c. albicans hyphae diretamente no trato GI, no entanto, a complexidade deste protocolo dificulta a adaptação a estudos de triagem inicial rápida e em larga escala. Métodos tradicionais de histopatologia também foram usados no passado para vitalizar as formas de levedura e hifa de C. albicans no trato GI. No entanto, a observação e a imagem de células fúngicas com histopatologia básica, e manchas de Hematoxilina e Eosina (H/E) permanecem desafiadoras, já que muitos métodos de fixação padrão têm o potencial de interromper a camada mucosa de amostras do trato GI, muitas vezes danificando estruturas de higeêquico no processo e levando a relatos contraditórios sobre a abundância relativa da morfologia celular hiphal durante a infecção63,64,65,66. Este método foi desenvolvido para evitar danos à hifa durante o processamento para abordar esta questão. Além disso, as explanações teciduais têm sido utilizadas como forma de examinar as condições biológicas ex vivo, porém esses métodos são geralmente focados e úteis para examinar o potencial de adesão ou invasão dos C. albicans67, mas também geralmente excluem a maioria dos componentes metabolômicos e microbiomas que contribuem para a patogênese in vivo. Embora o protocolo ex vivo descrito aqui não imite completamente o ambiente in vivo GI, como descrito anteriormente61,62, ele fornece as condições mais próximas possíveis que os c. albicans encontram no ambiente intestinal em comparação com métodos in vitro usando condições de crescimento artificial.
Este protocolo pode ser usado para ensaios básicos de triagem para identificar o impacto dos sinais ambientais no trato GI em C. albicans hyphal morphogenesis. Este método permite que grandes grupos de compostos, incluindo inibidores de pequenas moléculas, novos antimicostes e metabólitos sejam rastreados rapidamente para o desenvolvimento de higeêfas, podendo ser usados na triagem de tratamentos terapêuticos ou na identificação de fatores de risco para doenças sistêmicas. Uma vez que os c. albicans colonizam todo o trato GI, este protocolo ajudará ainda mais na identificação dos sinais ambientais presentes nos segmentos específicos do trato GI que controlam a morfogênese hifalina em indivíduos que tomam antibióticos, agentes quimioterápicos e em pacientes com distúrbios metabólicos, incluindo diabetes mellitus. Em última análise, o método descrito aqui permite a caracterização rápida da morfogênese háfana em C. albicans sobre uma ampla gama de fatores ambientais de uma maneira que é mais biologicamente relevante do que os métodos in vitro atuais e é substancialmente mais rápido e eficiente em recursos do que os métodos in vivo atuais.
Divulgações
Os autores não têm interesses financeiros concorrentes ou outros conflitos de interesse.
Agradecimentos
Os autores reconhecem recursos e apoio da instalação de pesquisa de núcleos celulares e moleculares da Universidade do Centro-Oeste.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 - 10 µL Pipet Tips | Fisher Scientific | 02-707-454 | Misc |
| 100 - 1000 µL Pipet Tips | Fisher Scientific | 02-707-400 | Misc |
| 20 - 200 µL Pipet Tips | Fisher Scientific | 02-707-451 | Misc |
| 2-methylbutyric acid | Sigma | 193070-25G | hyphal-inhibitory compound |
| 488 goat anti-rabbit IgG | Invitrogen (Fisher) | A11008 | IF Staining secondary ab |
| Agar | Fisher | BP1423-500 | YPD agar component |
| Automated Imaging Microscope | Keyence | BZX700 | |
| Candida Albicans Antibody | Invitrogen (Fisher) | PA1-27158 | IF Staining primary ab |
| cefoperazone | Cayman | 16113 | antibiotic |
| deoxycholic acid | Sigma | 30960 | hyphal-inhibitory compound |
| D-Glucose | Fisher | D16-500 | hyphal-promoting compound |
| forceps | Fisher | 08-885 | |
| lactic acid | Alfa Aesar | AAAL13242-06 | hyphal-inhibitory compound |
| lithocholic acid | Sigma | L6250-10G | hyphal-inhibitory compound |
| palmitic acid | Sigma | P5585-10G | hyphal-inhibitory compound |
| Paraformaldehyde | Alfa Aesar | A11313 | IF Staining fixative |
| Phosphate-buffered saline (PBS), 10x | Alfa Aesar | J62692 | PBS component |
| p-tolylacetic acid | SCBT | sc-257959 | hyphal-inhibitory compound |
| sebacic acid | Sigma | 283258-250G | hyphal-inhibitory compound |
| sharp ended scissors | Fisher | 28301 | |
| sterile Milli-Q water | N/A | N/A | Misc |
| YPD Broth | BD Biosciences | 242810 | YPD agar component |
Referências
- Huffnagle, G. B., Noverr, M. C. The emerging world of the fungal microbiome. Trends in Microbiology. 21 (7), 334-341 (2013).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Hajjeh, R. A., et al. Incidence of Bloodstream Infections Due to Candida Species and In Vitro Susceptibilities of Isolates Collected from 1998 to 2000 in a Population-based Active Surveillance Program. Journal of Clinical Microbiology. 42 (4), 1519-1527 (2004).
- Lockhart, S. R., et al. Species Identification and Antifungal Susceptibility Testing of Candida Bloodstream Isolates from Population-Based Surveillance Studies in Two U.S. Cities from 2008 to 2011. Journal of Clinical Microbiology. 50 (11), 3435-3442 (2012).
- Pfaller, M., et al. Epidemiology and outcomes of candidemia in 3648 patients: data from the Prospective Antifungal Therapy (PATH Alliance(R)) registry, 2004-2008. Diagnostic Microbiology and Infectious Disease. 74 (4), 323-331 (2012).
- Angarone, M. Fungal infections in cancer patients. Cancer Treatment and Research. 161, 129-155 (2014).
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113(2012).
- Calton, E. A., et al. Invasive bacterial and fungal infections in paediatric patients with cancer: incidence, risk factors, aetiology and outcomes in a UK regional cohort 2009-2011. Pediatric Blood & Cancer. 61 (7), 1239-1245 (2014).
- Carter, J. H., et al. Medical management of invasive fungal infections of the central nervous system in pediatric cancer patients. Pediatric Blood & Cancer. 62 (6), 1095-1098 (2015).
- Low, C. Y., Rotstein, C. Emerging fungal infections in immunocompromised patients. F1000 Medicine Reports. 3, 14(2011).
- Mousset, S., et al. Treatment of invasive fungal infections in cancer patients-updated recommendations of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Annals of Hematology. 93 (1), 13-32 (2014).
- Perfect, J. R., Hachem, R., Wingard, J. R. Update on epidemiology of and preventive strategies for invasive fungal infections in cancer patients. Clinical Infectious Diseases. 59, Suppl 5 352-355 (2014).
- Sipsas, N. V., Kontoyiannis, D. P. Invasive fungal infections in patients with cancer in the Intensive Care Unit. International Journal of Antimicrobial Agents. 39 (6), 464-471 (2012).
- Falagas, M. E., Apostolou, K. E., Pappas, V. D. Attributable mortality of candidemia: a systematic review of matched cohort and case-control studies. European Journal of Clinical Microbiology and Infectious Diseases. 25 (7), 419-425 (2006).
- Chi, H. W., et al. Candida albicans versus non-albicans bloodstream infections: the comparison of risk factors and outcome. Journal of Microbiology, Immunology and Infection. 44 (5), 369-375 (2011).
- Drell, T., et al. Characterization of the vaginal micro- and mycobiome in asymptomatic reproductive-age Estonian women. PLoS One. 8 (1), 54379(2013).
- Merenstein, D., et al. Colonization by Candida species of the oral and vaginal mucosa in HIV-infected and noninfected women. AIDS Research and Human Retroviruses. 29 (1), 30-34 (2013).
- Ghannoum, M. A., et al. Characterization of the oral fungal microbiome (mycobiome) in healthy individuals. PLoS Pathogens. 6 (1), 1000713(2010).
- Hoffmann, C., et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents. PLoS One. 8 (6), 66019(2013).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida albicans cell-type switching and functional plasticity in the mammalian host. Nature Reviews Microbiology. 15 (2), 96-108 (2017).
- Samonis, G., et al. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans. Antimicrobial Agents and Chemotherapy. 37 (1), 51-53 (1993).
- Sahni, V., et al. Candidemia--an under-recognized nosocomial infection in Indian hospitals. The Journal of the Association of Physicians of India. 53, 607-611 (2005).
- Meijer-Severs, G. J., Joshi, J. H. The effect of new broad-spectrum antibiotics on faecal flora of cancer patients. Journal of Antimicrobial Chemotherapy. 24 (4), 605-613 (1989).
- Kennedy, M. J., Volz, P. A., Edwards, C. A., Yancey, R. J. Mechanisms of association of Candida albicans with intestinal mucosa. Journal of Medical Microbiology. 24 (4), 333-341 (1987).
- Miranda, L. N., et al. Candida colonisation as a source for candidaemia. Journal of Hospital Infections. 72 (1), 9-16 (2009).
- Nucci, M., Anaissie, E. Revisiting the source of candidemia: skin or gut. Clinical Infectious Diseases. 33 (12), 1959-1967 (2001).
- Raponi, G., Visconti, V., Brunetti, G., Ghezzi, M. C. Clostridium difficile infection and Candida colonization of the gut: is there a correlation. Clinical Infectious Diseases. 59 (11), 1648-1649 (2014).
- Guastalegname, M., Russo, A., Falcone, M., Giuliano, S., Venditti, M. Candidemia subsequent to severe infection due to Clostridium difficile: is there a link. Clinical Infectious Diseases. 57 (5), 772-774 (2013).
- Nerandzic, M. M., Mullane, K., Miller, M. A., Babakhani, F., Donskey, C. J. Reduced acquisition and overgrowth of vancomycin-resistant enterococci and Candida species in patients treated with fidaxomicin versus vancomycin for Clostridium difficile infection. Clinical Infectious Diseases. 55, Suppl 2 121-126 (2012).
- Krause, R., Krejs, G. J., Wenisch, C., Reisinger, E. C. Elevated fecal Candida counts in patients with antibiotic-associated diarrhea: role of soluble fecal substances. Clinical and Diagnostic Laboratory Immunology. 10 (1), 167-168 (2003).
- Krause, R., et al. Role of Candida in antibiotic-associated diarrhea. The Journal of Infectious Diseases. 184 (8), 1065-1069 (2001).
- Zuo, T., et al. Gut fungal dysbiosis correlates with reduced efficacy of fecal microbiota transplantation in Clostridium difficile infection. Nature Communications. 9 (1), 3663(2018).
- Delaloye, J., Calandra, T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 5 (1), 161-169 (2014).
- Cole, G. T., Halawa, A. A., Anaissie, E. J. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside. Clinical Infectious Diseases. 22, Suppl 2 73-88 (1996).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Bendel, C. M., et al. Systemic infection following intravenous inoculation of mice with Candida albicans int1 mutant strains. Molecular genetics and metabolism. 67 (4), 343-351 (1999).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial agents and chemotherapy. 49 (3), 963-972 (2005).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences. 106 (2), 599-604 (2009).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences. 110 (33), 13594-13599 (2013).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature genetics. 45 (9), 1088(2013).
- Bar-Yosef, H., Gonzalez, N. V., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific reports. 7 (1), 5692(2017).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans hypha-inducing transcription factor Ume6 by the CDK1 cyclins Cln3 and Hgc1. mSphere. 2 (2), 00248(2017).
- Vila, T., et al. Targeting Candida albicans filamentation for antifungal drug development. Virulence. 8 (2), 150-158 (2017).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Bar-Yosef, H., Vivanco Gonzalez, N., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific Reports. 7 (1), 5692(2017).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 599-604 (2009).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans Hypha-Inducing Transcription Factor Ume6 by the CDK1 Cyclins Cln3 and Hgc1. mSphere. 2 (2), (2017).
- Bendel, C. M., et al. Effects of Alteration of the Candida albicans Gene INT1 on Cecal Colonization in Orally Innoculated Mice. Pediatric Research. 45, 156(1999).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial Agents and Chemotherapy. 49 (3), 963-972 (2005).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 13594-13599 (2013).
- Naseem, S., Gunasekera, A., Araya, E., Konopka, J. B. N-acetylglucosamine (GlcNAc) induction of hyphal morphogenesis and transcriptional responses in Candida albicans are not dependent on its metabolism. Journal of Biological Chemistry. 286 (33), 28671-28680 (2011).
- Piispanen, A. E., Hogan, D. A. PEPped up: induction of Candida albicans virulence by bacterial cell wall fragments. Cell Host & Microbe. 4 (1), 1-2 (2008).
- Xu, X. L., et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host & Microbe. 4 (1), 28-39 (2008).
- Guinan, J., Thangamani, S. Antibiotic-induced alterations in taurocholic acid levels promote gastrointestinal colonization of Candida albicans. FEMS microbiology letters. 365 (18), (2018).
- Guinan, J., Villa, P., Thangamani, S. Secondary bile acids inhibit Candida albicans growth and morphogenesis. Pathogens and disease. 76 (3), (2018).
- Guinan, J., Wang, S., Hazbun, T. R., Yadav, H., Thangamani, S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Scientific Reports. 9 (1), 1-11 (2019).
- Gutierrez, D., et al. Antibiotic-induced gut metabolome and microbiome alterations increase the susceptibility to Candida albicans colonization in the gastrointestinal tract. FEMS microbiology ecology. 96 (1), 187(2020).
- Witchley, J. N., et al. Candida albicans morphogenesis programs control the balance between gut commensalism and invasive infection. Cell Host & Microbe. 25 (3), 432-443 (2019).
- Witchley, J. N., Penumetcha, P. M., Noble, S. M. Visualization of Candida albicans in the Murine Gastrointestinal Tract Using Fluorescent In Situ Hybridization. JoVE (Journal of Visualized Experiments). (153), e60283(2019).
- Johansson, M. E., Hansson, G. C. Preservation of mucus in histological sections, immunostaining of mucins in fixed tissue, and localization of bacteria with FISH. Mucins. , Springer. 229-235 (2012).
- Lossinsky, A. S., et al. The histopathology of Candida albicans invasion in neonatal rat tissues and in the human blood-brain barrier in culture revealed by light, scanning, transmission and immunoelectron microscopy scanning. Histology and histopathology. , (2006).
- Rosenbach, A., Dignard, D., Pierce, J. V., Whiteway, M., Kumamoto, C. A. Adaptations of Candida albicans for growth in the mammalian intestinal tract. Eukaryotic Cell. 9, 1075-1086 (2010).
- Vautier, S., et al. C andida albicans colonization and dissemination from the murine gastrointestinal tract: the influence of morphology and T h17 immunity. Cellular Microbiology. 17, 445-450 (2015).
- Lyman, C., Navarro, E., Garrett, K., Roberts, D., Pizzo, P., Walsh, T. Adherence of Candida albicans to bladder mucosa: development and application of a tissue explant assay. Mycoses. 42, 255-259 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados