Method Article
胃腸管における カンジダ・アルビカンス ・ヒphphal形態形成を研究するエクスビボアッセイ
要約
腸ホモジネート抽出物および免疫蛍光染色を用いた本研究で説明したex vivoアッセイは、GI管における カンジダ・アルビカン スの催眠形態形成を調べる新規の方法を表す。この方法は、腸内の形態遺伝学的遷移を調節する環境シグナルを調べるのに利用することができる。
要約
胃腸(GI)管におけるカンジダ・アルビカンスの催眠形態形成は、様々な環境シグナルによって厳しく制御され、この日和見真菌病原体の普及および病因において重要な役割を果たしている。しかし、生体内のGI管で真菌性ヒphphaeを可視化する方法は、この形態形成プロセスを制御する環境信号の理解を制限する困難です。ここで説明するプロトコルは、腸管ホモジネート抽出物における催眠形態形成の可視化のための新規のex vivo方法を示す。この研究は、ex vivoアッセイを用いて、抗生物質治療マウスのcecal内容物は、未治療の対照マウスからではなく、腸内のC.アルビカンス催眠形態形成を促進することを示している。さらに、抗生物質処理マウスからcecal内容物に腸代謝物の特定のグループを付加すると、ヒファアル形態形成ex vivoを差し出して調節する。このプロトコルを組み合わせると、このプロトコルは、GI管におけるC.アルビカンス催眠形態形成を制御する環境信号を同定し、調査するための新しい方法を表す。
概要
カンディダ・アルビカンスは、通常はコメンサルである日和見的な多形性真菌病原体であるが、免疫不全個体1、2、3、4、5、6、7、8、9、10、11、12、13で生命を脅かす感染症を引き起こす可能性のある悪質な形態に形態変化を受けることができる。C. アルビカンスは全身性結室感染症の主要な原因であり、抗真菌治療2、14、15でも40\u201260%の死亡率を有する。C.アルビカンは、女性の生殖器系16、17、健康な個体18および胃腸(GI)管19、20の口腔を含む異なる宿主ニッチに存在するが、全身感染の大部分は、消化管に由来し、さらに、 全身感染の原因は、しばしば、GI管21、22、23、24、25、26、27、28、29、30、31、32、33、34であることが確認される。C. アルビカンスの消化管の病原性は、幅広い因子の影響を受ける。しかし、病原性に必要な主な特徴は、酵母細胞形態から、病変性のヒュファル細胞形態35、36、37、38、39、40、41、42、43、44への移行である。感染時のGI管からのアルビカンスの付着および播種は、病原酵母から毒性のヒファエに移行する能力と強く関連しており、真菌が侵襲性疾患44、49、50、51、52、53を引き起こすことを可能にする。
腸内の様々な要因, n-アセチルグルコサミンを含む, C. アルビカンによる催眠形成を調節します.したがって、GI管54、55、56におけるこの真菌病原体の催眠形態形成に関する知識のギャップを狭めることが重要である。最近の証拠は、様々な腸代謝産物が、Vitro57、58、59、60のC.アルビカンの催眠形態形成を差し出して制御することを示している。しかし、技術的な制約は、生体内の腸内サンプルでのC.アルビカンス催眠の形成、特に酵母およびヒファエ細胞の染色および催眠の発達の定量的分析を試みる際に問題を提示する。GI管におけるC.アルビカンスの催眠形態形成を理解するために、マウスからの均質化された腸内含量の可溶性抽出物を用いて、真菌性催眠形態形成に対する代謝産物の効果を研究するために、ex vivo法が開発された。この方法は、C.アルビカンスGI感染に耐性があり、感受性のマウスからの腸サンプルを利用して、消化管における真菌性催眠形態形成に対する代謝産物、抗生物質および異種生物系の効果を同定し、研究するのに役立つ。
プロトコル
すべての動物プロトコルは、57の前に記載されているように中西部大学の制度的動物の世話と使用委員会(IACUC)によって承認されました。中西部大学の制度的動物ケアおよび使用委員会は、MWU IACUCプロトコル#2894の下でこの研究を承認しました.MWU動物ケア政策は、ヒューマンケアと実験動物の使用に関する公衆衛生サービス(PHS)ポリシーと動物福祉法(AWA)に定められた方針に従います。
1. マウスは標準プロトコルを研究する
- 少なくとも6週齢の雄と雌のC57BL/6Jマウスを使用してください。セフォペラゾン(0.5 mg/mL)の有無にかかわらず、滅菌水でそれらを補います。
- 5のグループでマウスを共同収容し、各ケージには全ての雄マウスまたはすべての雌マウスを含む。常にマウスの標準的なマウスチャウと水(400 mLボトルを介して)を提供します。
- 毎日ケージをチェックして、食料と水のレベルが十分であることを確認し、マウスの苦痛の兆候を調べます。
- ケージ給餌ボトルに残っている水に関係なく新鮮な抗生物質が提供されていることを確認するために、48時間ごとにセフォペラゾーンに水を交換してください。
- セフォペラゾン治療の5\u20127日後、確立されたIACUCプロトコルを観察するCO2 窒息を介してマウスを安楽死させる。子宮頸部脱臼による死亡を確認する。
- オートクレーブ滅菌された鋭利なはさみとオートクレーブ滅菌鉗子を使用してマウスを解剖する。
- 安楽死後、腹部が露出するようにすべての手足を固定することによって、動物を解剖面に固定する。
- 腹部に70%エタノールをスプレーして、ファーが解剖中に鉗子、はさみ、または腸切片に付着するのを防ぎます。
- 鉗子を使用して腹部の基部の皮膚をつまんで持ち上げ、はさみを使用して皮膚と下層筋膜を通して小さな切開を作成します。この切開を行う際には、盲腸壁や腸壁を穿刺しないように細心の注意を払ってください。
- このカットをリブケージまで伸ばし、腹腔を部分的に露出します。上方および横方向に延びる両側の最初の切開の点から始まるカットを行います。
- これらのフラップを横に引き、解剖表面にピンで固定し、腹腔を完全に露出させます。
- 鉗子を使用してGI管を抽出し、はさみを使用して胃よりも優れた切り傷を作り、大腸の遠位領域で各セクションから最大量の腸分の収集を確実にします。
- GI管を取り外す場合は、個々のコンポーネントが破裂しないように注意してください。胃、小腸、盲腸、大腸を、近位および遠位端のはさみを使用して個別に分離します。
- 各セクションから各腸の内容物を収集するには、はさみを使用して各セクションの遠位端で単一の切開を行い、続いて鉗子を使用して1.5 mLマイクロ遠心分離管に腸の内容物を手動で排出します。
- 腸内の内容物は-80°Cで保存し、エキソビボアッセイを行います。
2. 酵母エキスペプトンデキストロース(YPD)寒天プレートの調製
- 1 Lガラス瓶に、ペプトンデキストロース粉末25gの酵母エキス、寒天10g、超純水を500mLの最終体積に加える。
- 121°Cで30分間、液体サイクルでオートクレーブを使用して、培地を滅菌する。
- 層流フードの下に、約20mLの寒天培地を滅菌ペトリプレートに注ぎます。寒天培地の500 mLは、約25プレートを得る必要があります。
- プレートは、使用できる状態になるまで4°Cで保管してください。
3. 催眠形態形成アッセイのための元生体準備
- C.アルビカンSC5314の新鮮な培養物をYPD寒天プレートにストリークし、30°Cで一晩インキュベートする。
- 一晩成長した C.アルビカンSC5314 培養から2〜3個の中型の個々のコロニーを選び、リン酸緩衝生理食塩分(PBS)の1mLで再中断する。
- 冷凍腸の内容物を-80°C冷凍庫から取り出し、25°Cで解凍します。
- 新しい1.5 mLチューブに約150mgの腸内含量を量る。
- 150 μL の PBS (腸内の内容と PBS を 1:1 重量対体積比で) で再中断します。
- 30 sの高速で渦は腸の内容物を均質化し、約1分間室温で座ることを可能にする。
- ホモジエートを1000 x g で3分間遠心する。
- 上清を新しい1.5 mLチューブに移します。
- 手順 3.7 と 3.8 を繰り返して、上清内のすべての破片を取り除く。
- この上清に上記で準備された C.アルビカン SC5314接種の10 μLを追加します。
- よく混ぜ合わせ、37°Cで4〜5時間インキュベートします。
4. 腸内均質性抽出物への代謝物の外因性添加による、催眠形態形成アッセイ
- 冷凍腸の内容物を-80°C冷凍庫から取り出し、1:1比(重量:体積)でPBSで再懸濁します。
- 腸内含量およびPBS混合物に必要な腸代謝物の濃度を加える。
- 30 sの高速で渦は、代謝物を含む腸内の内容物を均質化し、約10分間室温で座ることを可能にする。
- ホモジエートを1000 x g で3分間遠心する。
- 上清を新しい1.5 mLチューブに移します。手順 4.4 と 4.5 を繰り返して、上清内のすべての破片を取り除く。
- 上記の上清に、上記で準備した C.アルビカン SC5314の10μLを加えます。よく混ぜ合わせ、37°Cで4〜5時間インキュベートします。
5. C. アルビカンス 形態形成アッセイ (免疫染色およびイメージング)
- サンプルを1000 x g で2分間遠心し、ピペットで上清を捨てます。
- 2%パラホルムアルデヒド(PFA)の100 μLでサンプルを15分間固定します。
- 2分間1000 x g で遠心分離機を使用し、ピペットを介して上清を捨てます。
- サンプルを1 mLのPBSで2回洗浄します。サンプルを洗浄するには、PBS中のペレットを軽くピペットで再懸濁します。これは、催眠構造を損傷する可能性がありますので、サンプルを渦を起こすしないでください。再懸濁後、1000xgで2分間遠心分離し、ピペットを介して上清を捨てる。
- ポリクローナル C.アルビカン抗体 (1:100希釈)を含むPBSの100 μLで30分間、室温でサンプルをインキュベートします。
- 1 mLのPBSでサンプルを3回洗います。
注:蛍光抗体を使用する場合、すべての希釈および洗浄手順を薄暗い光の中で行い、写真の漂白を避け、サンプルの寿命を改善することをお勧めします。 - 抗ウサギIgGアレクサフルオール488抗体を1:500希釈時に含むPBSの100 μLで15分間、室温でサンプルをインキュベートします。暗い引き出しや部屋でインキュベーションを行い、写真の漂白を避けてください。
- 1 mLのPBSでサンプルを3回洗います。
- サンプルを100 μLのPBSで再中断し、イメージング用に96ウェルプレートに移します。
注:画像を撮っていない場合は、96ウェルプレートをアルミ箔で包み、写真の漂白を避けることをお勧めします。 - 蛍光イメージング顕微鏡を用いた20xおよび40x対物レンズを用いた画像真菌細胞。蛍光を検出するには、緑色蛍光タンパク質(GFP)フィルタ(励起波長470/40および発光波長525/50)を使用します。
結果
タンガマニ研究所60 からの以前の知見と共に 、C.アルビカンス が胃から採取された腸ホモゲネート抽出物でex vivoを成長させると、未治療のコントロールおよび抗生物質処理マウスの小腸および大腸が 、C.アルビカンは 一般的に酵母形態で発症することを示している(図1B)。しかし、抗生物質処理マウスからcecal抽出物で増殖すると 、C.アルビカンは 容易に形態形成を受け、酵母およびヒファの形態を含むサンプルを生じる(図1B)。これはコントロールマウスでは発生しません。これは、抗生物質処理されたcecal抽出物で成長したサンプル中の催眠形態の有意な増加を示したが、他の抗生物質処理腸抽出物60では示さなかった以前の結果を支持する。これらの結果は、抗生物質治療がC. アルビカン の催眠形態形成を誘導するcecal環境の変化を引き起こすことを示唆している。さらに、cecumにのみ気づいたこの表現型の特定の局在化は、これらの催眠促進条件が必ずしもGI管全体に存在するわけではないが、代わりに栄養素、代謝物および他の未知の分子の入手可能性に応じてGI管の特定のセグメントに制限されることを示唆している。
抗生物質処理マウスのcecal抽出物は、C.アルビカンス57、58、59、60の形態形成を促進するため、cef処理マウスのcecal含有量に対する選択された腸代謝産物(以前のインビトロ研究から同定)の外因性添加がC.アルビカンゼビボの形態形成に影響を及ぼすかどうかを調べた。タンガマニ研究所が行った以前の研究では、未治療マウスおよび抗生物質処理マウスから抽出されたセカリスカル含量ホモジネートのメタボロミクスプロファイルを特徴付け、抗生物質治療の結果として様々な代謝産物の豊富さの有意な変化を明らかにした。具体的には、二次胆汁酸の存在量の減少および炭水化物の増加60。また、本研究では、二次胆汁酸およびカルボン酸がヒファエの発生を阻害することを同定し、一方、グルコースを含む炭水化物は、Vitro60においてC.アルビカンスのヒPHAL形成を促進する。結果は、デオキシコール酸(DCA、0.5 mg/mL)、リトコール酸(LCA、 0.1 mg/mL、パルミチン酸(0.1 mg/mL)、p-tolylacetic酸(0.1 mg/mL)、セバシン酸(0.5mg/mL)、2-メチルブチリン酸(0.5mg/mL)、および乳酸(5mg/mL)を全くヒリジアル化を阻害した。一方、cef処理マウスのcecalホモゲン酸グルコース(1mg/mL)の外因性添加は、ex vivoの大規模な催眠発達を示した(図2B)。総称して、これらの知見は、cef処理マウスのセカルホモゲネートに戻る腸代謝物の添加がC.アルビカンの形態形成を差し出して調節し、したがって以前のインビトロ所見を確認することを示している。これらの結果は、C.アルビカンスの催眠形態形成において腸内代謝産物が重要な役割を果たし、これらの代謝産物によって変調された遺伝子標的およびシグナル伝達経路を理解することが、C.アルビカンス感染を予防および治療するための新しい治療アプローチの開発に役立つことを示している。

図1:腸内のC. アルビカン ス催眠形態形成に対するcefoperazone治療の効果を決定するEx vivoアッセイ。(A) プロトコルの概略図。(B)抗生物質処理(上パネル)および非治療(下パネル)の腸内含量は、C57BL/6Jマウスの胃、小腸、盲腸、および大腸から採取した。 C.アルビカン SC5314で接種した腸内含量を、37°Cで4\u20125時間インキュベートし 、C.アルビカンス 抗体で染色した。細胞を40倍の倍率で画像化した。代表的な画像をここに示します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
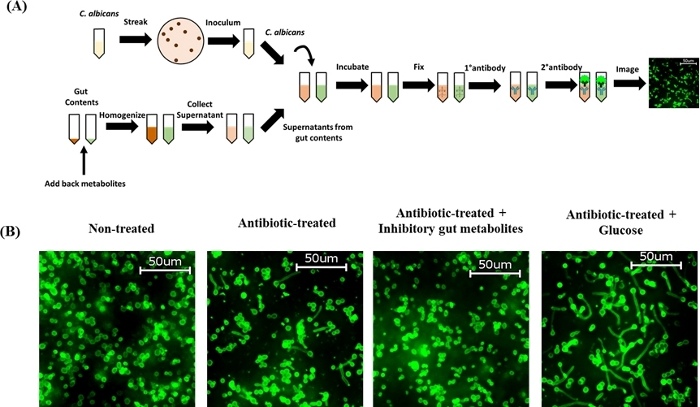
図2:C.アルビカンスex vivoのヒファエ形成に関するcef処置マウスからのcecal内容物への腸代謝物の外因性付加。(A) プロトコルの概略図。(B)DCA(0.5 mg/mL)、LCA(0.1 mg/mL)、パルミチン酸(0.1mg/mL)、p-lyly酢酸(0.1mg/mL)、セバシック酸(0.5mg/mL)を含む阻害性腸代謝物プール。2-メチルブチル酸(0.5 mg/mL)、および乳酸(5mg/mL)またはグルコース(1mg/mL)をcef処理マウスのcecal含有量に戻し、十分に混合し、37°Cで15分間インキュベートし、エクスビボヒファアセイを実施した。C.アルビカンSC5314で接種したセカール内容物を、37°Cで4\u20125 hでインキュベートし、C.アルビカンス抗体で染色した。細胞を40倍の倍率で画像化した。代表的な画像をここに示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで説明する方法は、GI管におけるC.アルビカンス催眠形態形成に対する抗生物質、食事、異種および治療的影響の影響を調査する新しい方法を提示する。全身感染の大部分は、GI管21、22、23、24、25、26、27、28、29、30、31、32、33、34およびヒファエ形成に由来するので、Cの播種を促進する重要な毒性因子である。 GI管からのアルビカンは、この形態形成を制御する要因を理解し、病因メカニズムに関する知識を広げ、新しい治療選択肢を特定する。
ここで示す方法は比較的簡単ですが、以下で説明する特定の手順は重要かつ重要であると特定されました。(i) C. アルビカン スの初期接種は、真菌の成長および催眠形態形成の両方を可能にするために最適であるべきである。腸ホモジネート抽出物の栄養素の利用が限られているので、接種の量が多いと、真菌の成長と形態形成プロセスが大幅に減少する可能性があります。しかし、異なる臨床分離株および株の成長は可変である可能性が高く、したがって、特定の C.アルビカン 分離物の接種およびインキュベーション時間を最適化することが不可欠である。(ii)腸内ホモジネート抽出物を調製する際の複数の遠心分離ステップは、可能な限り腸内の残骸を除去することが重要であることが判明した。(iii) 遠心分離の速度が比較的低いため(催眠構造の損傷を避けるために)、このプロトコルの免疫染色ステップ中の細胞損失を避けるために注意が必要です。
消化管内の真菌性ヒphphaeを可視化する代替方法は、過去に使用されており、各方法に関連する一定の利点および制限がある。GI管内の真菌性ヒphphaeを可視化するために蛍光をその地で使用する蛍光(FISH)を用いた比較的顕著な方法の1つは、最近Witchleyらら61,62によって実証されている。これは、現在、GI管内で直接C.アルビカンス催眠を検出するために利用可能な有望なin vivo法ですが、このプロトコルの複雑さは、迅速で大規模な初期スクリーニング研究に適応することを困難にします。従来の組織病理学的方法は、過去にC.アルビカン酵母およびヒファエの形態をGI管内で活性化させるために使用されてきた。しかし、基本的な組織病理学的な真菌細胞の観察とイメージング、およびヘマトキシリンおよびエオシン(H/E)染色は、多くの標準的な固定法がGI管サンプルの粘膜層を破壊する可能性があり、しばしばその過程で催眠構造を損傷し、感染時の催眠細胞形態の相対的な存在に関する矛盾した報告につながる63,646である。この方法は、この問題に対処するために、処理中の催眠術の損傷を避けるために開発されました。さらに、組織外植物は、ex vivoの生物学的条件を調べる方法として使用されてきたが、これらの方法は一般的にC.albicans67の付着性または侵入可能性を調べるのに有用であるが、一般的には生体内の病原性に寄与するメタボロミクスおよびマイクロバイオーム成分の大部分を排除する。ここで説明したex vivoプロトコルは、前に説明した61,62のin vivo GI環境を完全に模倣するわけではありませんが、人工増殖条件を用いたインビトロ法と比較して、C.アルビカンが腸内環境で遭遇する最も近い条件を提供します。
このプロトコルは、GI管内の環境信号が C.アルビカン ス催眠形態形成に及ぼす影響を特定するための基本的なスクリーニングアッセイに使用することができる。この方法は、低分子阻害剤、新しい抗ミコティック、代謝産物を含む大規模な化合物群を催眠発達のために迅速にスクリーニングすることを可能にし、治療治療のスクリーニングまたは全身疾患の危険因子の同定に使用することができる。 C.アルビカンスは GI管全体に植民地化するので、このプロトコルは、抗生物質、化学療法剤、および糖尿病を含む代謝障害を有する患者において、催眠形態形成を制御するGI管の特定のセグメントに存在する環境信号を同定するのにさらに役立つ。最終的にここで説明する方法は、現在のインビトロ法よりも生物学的に関連性が高く、現在のインビボ法よりも実質的に迅速かつ資源効率が高い方法で、幅広い環境要因にわたって C.アルビカン におけるヒphphalの形態形成の迅速な特徴付けを可能にする。
開示事項
著者は、競合する金銭的利益やその他の利益相反を持っていません。
謝辞
著者らは、中西部大学セルラーアンド分子コア研究施設からのリソースと支援を認めている。
資料
| Name | Company | Catalog Number | Comments |
| 1 - 10 µL Pipet Tips | Fisher Scientific | 02-707-454 | Misc |
| 100 - 1000 µL Pipet Tips | Fisher Scientific | 02-707-400 | Misc |
| 20 - 200 µL Pipet Tips | Fisher Scientific | 02-707-451 | Misc |
| 2-methylbutyric acid | Sigma | 193070-25G | hyphal-inhibitory compound |
| 488 goat anti-rabbit IgG | Invitrogen (Fisher) | A11008 | IF Staining secondary ab |
| Agar | Fisher | BP1423-500 | YPD agar component |
| Automated Imaging Microscope | Keyence | BZX700 | |
| Candida Albicans Antibody | Invitrogen (Fisher) | PA1-27158 | IF Staining primary ab |
| cefoperazone | Cayman | 16113 | antibiotic |
| deoxycholic acid | Sigma | 30960 | hyphal-inhibitory compound |
| D-Glucose | Fisher | D16-500 | hyphal-promoting compound |
| forceps | Fisher | 08-885 | |
| lactic acid | Alfa Aesar | AAAL13242-06 | hyphal-inhibitory compound |
| lithocholic acid | Sigma | L6250-10G | hyphal-inhibitory compound |
| palmitic acid | Sigma | P5585-10G | hyphal-inhibitory compound |
| Paraformaldehyde | Alfa Aesar | A11313 | IF Staining fixative |
| Phosphate-buffered saline (PBS), 10x | Alfa Aesar | J62692 | PBS component |
| p-tolylacetic acid | SCBT | sc-257959 | hyphal-inhibitory compound |
| sebacic acid | Sigma | 283258-250G | hyphal-inhibitory compound |
| sharp ended scissors | Fisher | 28301 | |
| sterile Milli-Q water | N/A | N/A | Misc |
| YPD Broth | BD Biosciences | 242810 | YPD agar component |
参考文献
- Huffnagle, G. B., Noverr, M. C. The emerging world of the fungal microbiome. Trends in Microbiology. 21 (7), 334-341 (2013).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Hajjeh, R. A., et al. Incidence of Bloodstream Infections Due to Candida Species and In Vitro Susceptibilities of Isolates Collected from 1998 to 2000 in a Population-based Active Surveillance Program. Journal of Clinical Microbiology. 42 (4), 1519-1527 (2004).
- Lockhart, S. R., et al. Species Identification and Antifungal Susceptibility Testing of Candida Bloodstream Isolates from Population-Based Surveillance Studies in Two U.S. Cities from 2008 to 2011. Journal of Clinical Microbiology. 50 (11), 3435-3442 (2012).
- Pfaller, M., et al. Epidemiology and outcomes of candidemia in 3648 patients: data from the Prospective Antifungal Therapy (PATH Alliance(R)) registry, 2004-2008. Diagnostic Microbiology and Infectious Disease. 74 (4), 323-331 (2012).
- Angarone, M. Fungal infections in cancer patients. Cancer Treatment and Research. 161, 129-155 (2014).
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113(2012).
- Calton, E. A., et al. Invasive bacterial and fungal infections in paediatric patients with cancer: incidence, risk factors, aetiology and outcomes in a UK regional cohort 2009-2011. Pediatric Blood & Cancer. 61 (7), 1239-1245 (2014).
- Carter, J. H., et al. Medical management of invasive fungal infections of the central nervous system in pediatric cancer patients. Pediatric Blood & Cancer. 62 (6), 1095-1098 (2015).
- Low, C. Y., Rotstein, C. Emerging fungal infections in immunocompromised patients. F1000 Medicine Reports. 3, 14(2011).
- Mousset, S., et al. Treatment of invasive fungal infections in cancer patients-updated recommendations of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Annals of Hematology. 93 (1), 13-32 (2014).
- Perfect, J. R., Hachem, R., Wingard, J. R. Update on epidemiology of and preventive strategies for invasive fungal infections in cancer patients. Clinical Infectious Diseases. 59, Suppl 5 352-355 (2014).
- Sipsas, N. V., Kontoyiannis, D. P. Invasive fungal infections in patients with cancer in the Intensive Care Unit. International Journal of Antimicrobial Agents. 39 (6), 464-471 (2012).
- Falagas, M. E., Apostolou, K. E., Pappas, V. D. Attributable mortality of candidemia: a systematic review of matched cohort and case-control studies. European Journal of Clinical Microbiology and Infectious Diseases. 25 (7), 419-425 (2006).
- Chi, H. W., et al. Candida albicans versus non-albicans bloodstream infections: the comparison of risk factors and outcome. Journal of Microbiology, Immunology and Infection. 44 (5), 369-375 (2011).
- Drell, T., et al. Characterization of the vaginal micro- and mycobiome in asymptomatic reproductive-age Estonian women. PLoS One. 8 (1), 54379(2013).
- Merenstein, D., et al. Colonization by Candida species of the oral and vaginal mucosa in HIV-infected and noninfected women. AIDS Research and Human Retroviruses. 29 (1), 30-34 (2013).
- Ghannoum, M. A., et al. Characterization of the oral fungal microbiome (mycobiome) in healthy individuals. PLoS Pathogens. 6 (1), 1000713(2010).
- Hoffmann, C., et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents. PLoS One. 8 (6), 66019(2013).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida albicans cell-type switching and functional plasticity in the mammalian host. Nature Reviews Microbiology. 15 (2), 96-108 (2017).
- Samonis, G., et al. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans. Antimicrobial Agents and Chemotherapy. 37 (1), 51-53 (1993).
- Sahni, V., et al. Candidemia--an under-recognized nosocomial infection in Indian hospitals. The Journal of the Association of Physicians of India. 53, 607-611 (2005).
- Meijer-Severs, G. J., Joshi, J. H. The effect of new broad-spectrum antibiotics on faecal flora of cancer patients. Journal of Antimicrobial Chemotherapy. 24 (4), 605-613 (1989).
- Kennedy, M. J., Volz, P. A., Edwards, C. A., Yancey, R. J. Mechanisms of association of Candida albicans with intestinal mucosa. Journal of Medical Microbiology. 24 (4), 333-341 (1987).
- Miranda, L. N., et al. Candida colonisation as a source for candidaemia. Journal of Hospital Infections. 72 (1), 9-16 (2009).
- Nucci, M., Anaissie, E. Revisiting the source of candidemia: skin or gut. Clinical Infectious Diseases. 33 (12), 1959-1967 (2001).
- Raponi, G., Visconti, V., Brunetti, G., Ghezzi, M. C. Clostridium difficile infection and Candida colonization of the gut: is there a correlation. Clinical Infectious Diseases. 59 (11), 1648-1649 (2014).
- Guastalegname, M., Russo, A., Falcone, M., Giuliano, S., Venditti, M. Candidemia subsequent to severe infection due to Clostridium difficile: is there a link. Clinical Infectious Diseases. 57 (5), 772-774 (2013).
- Nerandzic, M. M., Mullane, K., Miller, M. A., Babakhani, F., Donskey, C. J. Reduced acquisition and overgrowth of vancomycin-resistant enterococci and Candida species in patients treated with fidaxomicin versus vancomycin for Clostridium difficile infection. Clinical Infectious Diseases. 55, Suppl 2 121-126 (2012).
- Krause, R., Krejs, G. J., Wenisch, C., Reisinger, E. C. Elevated fecal Candida counts in patients with antibiotic-associated diarrhea: role of soluble fecal substances. Clinical and Diagnostic Laboratory Immunology. 10 (1), 167-168 (2003).
- Krause, R., et al. Role of Candida in antibiotic-associated diarrhea. The Journal of Infectious Diseases. 184 (8), 1065-1069 (2001).
- Zuo, T., et al. Gut fungal dysbiosis correlates with reduced efficacy of fecal microbiota transplantation in Clostridium difficile infection. Nature Communications. 9 (1), 3663(2018).
- Delaloye, J., Calandra, T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 5 (1), 161-169 (2014).
- Cole, G. T., Halawa, A. A., Anaissie, E. J. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside. Clinical Infectious Diseases. 22, Suppl 2 73-88 (1996).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Bendel, C. M., et al. Systemic infection following intravenous inoculation of mice with Candida albicans int1 mutant strains. Molecular genetics and metabolism. 67 (4), 343-351 (1999).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial agents and chemotherapy. 49 (3), 963-972 (2005).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences. 106 (2), 599-604 (2009).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences. 110 (33), 13594-13599 (2013).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature genetics. 45 (9), 1088(2013).
- Bar-Yosef, H., Gonzalez, N. V., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific reports. 7 (1), 5692(2017).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans hypha-inducing transcription factor Ume6 by the CDK1 cyclins Cln3 and Hgc1. mSphere. 2 (2), 00248(2017).
- Vila, T., et al. Targeting Candida albicans filamentation for antifungal drug development. Virulence. 8 (2), 150-158 (2017).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Bar-Yosef, H., Vivanco Gonzalez, N., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific Reports. 7 (1), 5692(2017).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 599-604 (2009).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans Hypha-Inducing Transcription Factor Ume6 by the CDK1 Cyclins Cln3 and Hgc1. mSphere. 2 (2), (2017).
- Bendel, C. M., et al. Effects of Alteration of the Candida albicans Gene INT1 on Cecal Colonization in Orally Innoculated Mice. Pediatric Research. 45, 156(1999).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial Agents and Chemotherapy. 49 (3), 963-972 (2005).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 13594-13599 (2013).
- Naseem, S., Gunasekera, A., Araya, E., Konopka, J. B. N-acetylglucosamine (GlcNAc) induction of hyphal morphogenesis and transcriptional responses in Candida albicans are not dependent on its metabolism. Journal of Biological Chemistry. 286 (33), 28671-28680 (2011).
- Piispanen, A. E., Hogan, D. A. PEPped up: induction of Candida albicans virulence by bacterial cell wall fragments. Cell Host & Microbe. 4 (1), 1-2 (2008).
- Xu, X. L., et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host & Microbe. 4 (1), 28-39 (2008).
- Guinan, J., Thangamani, S. Antibiotic-induced alterations in taurocholic acid levels promote gastrointestinal colonization of Candida albicans. FEMS microbiology letters. 365 (18), (2018).
- Guinan, J., Villa, P., Thangamani, S. Secondary bile acids inhibit Candida albicans growth and morphogenesis. Pathogens and disease. 76 (3), (2018).
- Guinan, J., Wang, S., Hazbun, T. R., Yadav, H., Thangamani, S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Scientific Reports. 9 (1), 1-11 (2019).
- Gutierrez, D., et al. Antibiotic-induced gut metabolome and microbiome alterations increase the susceptibility to Candida albicans colonization in the gastrointestinal tract. FEMS microbiology ecology. 96 (1), 187(2020).
- Witchley, J. N., et al. Candida albicans morphogenesis programs control the balance between gut commensalism and invasive infection. Cell Host & Microbe. 25 (3), 432-443 (2019).
- Witchley, J. N., Penumetcha, P. M., Noble, S. M. Visualization of Candida albicans in the Murine Gastrointestinal Tract Using Fluorescent In Situ Hybridization. JoVE (Journal of Visualized Experiments). (153), e60283(2019).
- Johansson, M. E., Hansson, G. C. Preservation of mucus in histological sections, immunostaining of mucins in fixed tissue, and localization of bacteria with FISH. Mucins. , Springer. 229-235 (2012).
- Lossinsky, A. S., et al. The histopathology of Candida albicans invasion in neonatal rat tissues and in the human blood-brain barrier in culture revealed by light, scanning, transmission and immunoelectron microscopy scanning. Histology and histopathology. , (2006).
- Rosenbach, A., Dignard, D., Pierce, J. V., Whiteway, M., Kumamoto, C. A. Adaptations of Candida albicans for growth in the mammalian intestinal tract. Eukaryotic Cell. 9, 1075-1086 (2010).
- Vautier, S., et al. C andida albicans colonization and dissemination from the murine gastrointestinal tract: the influence of morphology and T h17 immunity. Cellular Microbiology. 17, 445-450 (2015).
- Lyman, C., Navarro, E., Garrett, K., Roberts, D., Pizzo, P., Walsh, T. Adherence of Candida albicans to bladder mucosa: development and application of a tissue explant assay. Mycoses. 42, 255-259 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved