Method Article
Un essai ex vivo pour étudier Candida albicans Hyphal Morphogenesis dans le tractus gastro-intestinal
Dans cet article
Résumé
L’analyse ex vivo décrite dans cette étude à l’aide d’extraits d’homogénéisation intestinale et de taches d’immunofluorescence représente une nouvelle méthode pour examiner la morphogenèse hyphale de Candida albicans dans le tractus gastro-intestinal. Cette méthode peut être utilisée pour étudier les signaux environnementaux régulant la transition morphogenétique dans l’intestin.
Résumé
Candida albicans morphogenèse hyphale dans le tractus gastro-intestinal (GI) est étroitement contrôlée par divers signaux environnementaux, et joue un rôle important dans la diffusion et la pathogénie de cet agent pathogène fongique opportuniste. Cependant, les méthodes pour visualiser l’hyphe fongique dans le tractus gastro-intestinal in vivo sont difficiles, ce qui limite la compréhension des signaux environnementaux dans le contrôle de ce processus de morphogenèse. Le protocole décrit ici démontre une nouvelle méthode ex vivo pour la visualisation de la morphogenèse hyphale dans les extraits d’homogénéisation intestinale. À l’aide d’un essai ex vivo, cette étude démontre que le contenu cécal des souris traitées aux antibiotiques, mais pas des souris témoins non traitées, favorise la morphogenèse hyphale de C. albicans dans la teneur en intestin. En outre, l’ajout de groupes spécifiques de métabolites intestinaux au contenu cécal des souris traitées aux antibiotiques régule différemment la morphogenèse hyphale ex vivo. Pris ensemble, ce protocole représente une nouvelle méthode pour identifier et étudier les signaux environnementaux qui contrôlent la morphogenèse hyphale de C. albicans dans le tractus gastro-intestinal.
Introduction
Candida albicans est un pathogène fongique opportuniste et polymorphe qui est normalement proportionnel, mais qui peut subir un changement morphologique en une forme virulente capable de causer des infections potentiellement mortelles chez les personnes immunocompromisées1,2,3,4,5,6,7,8,9,10,11,12,13. C. albicans est l’une des principales causes d’infections nosocomiales systémiques, avec un taux de mortalité de 40\u201260%, même avec un traitement antifongique2,14,15. Bien que C. albicans réside dans différents créneaux d’accueil, y compris le systèmereproducteur féminin 16,17, la cavité buccale des personnes en bonne santé18 et le tractus gastro-intestinal (GI)19,20, la majorité des infections systémiques proviennent du tractus gastro-intestinal et en outre, la source de l’infection systémique est souvent confirmée pour être letractus gastro-intestinal 21,22,23,24,25,26,27,28,29,30,31,32,33,34. La pathogénie de C. albicans dans le tractus gastro-intestinal est influencée par un large éventail de facteurs; cependant, une caractéristique majeure nécessaire à la virulence est la transition d’une morphologie des cellules de levure en une morphologie virulente des cellules hyphaliques35,36,37,38,39,40,41,42,43,44. C. albicans attachement et la diffusion du tractus gastro-intestinal pendant l’infection est fortement associée à sa capacité à passer d’une levure proportionnelle à hyphe virulente, permettant aux champignons de causer des maladies invasives44,45,46,47,48,49,50,51,52,53.
Une variété de facteurs dans l’intestin, y compris n-acétylglucosamine, réguler la formation d’hyphal par C. albicans. Par conséquent, il est crucial de réduire l’écart dans la connaissance concernant la morphogenèse hyphale de cet agent pathogène fongique dans letractus gastro-intestinal 54,55,56. Des preuves récentes indiquent que divers métabolites intestinaux contrôlent différemment la morphogenèse hyphale de C. albicans in vitro57,58,59,60. Cependant, les contraintes techniques présentent des problèmes lorsqu’on tente d’étudier la formation d’hyphes de C. albicans dans des échantillons intestinaux in vivo, en particulier la coloration des cellules de levure et d’hyphes et l’analyse quantitative du développement hyphal. Pour comprendre la morphogenèse hyphale de C. albicans dans le tractus gastro-intestinal, une méthode ex vivo a été développée à l’aide d’extraits solubles de contenu intestinal homogénéisé de souris pour étudier l’effet des métabolites sur la morphogenèse hyphale fongique. Utilisant des échantillons d’intestin de souris résistantes et sensibles à l’infection par l’IG de C. albicans, cette méthode aidera à identifier et à étudier l’effet des métabolites, des antibiotiques et des xénobiotiques sur la morphogenèse hyphale fongique dans le tractus gastro-intestinal.
Protocole
Tous les protocoles animaux ont été approuvés par le Midwestern University Institutional Animal Care and Use Committee (IACUC) tel que décritavant 57. Le Comité institutionnel de soins et d’utilisation des animaux de l’Université du Midwest a approuvé cette étude en vertu du Protocole IACUC de l’UTW #2894. Les politiques de soins aux animaux de l’UTW suivent la Politique du Service de santé publique (SSP) sur les soins et l’utilisation des animaux de laboratoire et les politiques énoncées dans la Loi sur le bien-être des animaux (AWA).
1. Les souris étudient le protocole standard
- Utilisez des souris C57BL/6J mâles et femelles âgées d’au moins six semaines. Complétez-les avec de l’eau stérile avec ou sans cefoperazone (0,5 mg/mL).
- Co-maison souris en groupes de 5, avec chaque cage contenant soit tous les mâles ou toutes les souris femelles. Fournissez aux souris du chow de souris standard et de l’eau (via une bouteille de 400 mL) en tout temps.
- Vérifiez les cages quotidiennement pour vous assurer que les niveaux de nourriture et d’eau sont suffisants et pour examiner les souris à la recherche de signes de détresse.
- Remplacez l’eau par de la cefoperazone toutes les 48 h pour vous assurer que des antibiotiques frais sont fournis, peu importe le reste de l’eau dans les biberons de la cage.
- Après 5\u20127 jours de traitement de cefoperazone, euthanasiez des souris par asphyxie de CO2 observant le protocole établi d’IACUC. Confirmer la mort par dislocation cervicale.
- Disséquer les souris à l’aide de ciseaux pointus autoclave-stérilisés et de forceps autoclave-stérilisés.
- Après l’euthanasie, fixez l’animal à une surface de dissection en épinglant tous les membres de sorte que l’abdomen soit exposé.
- Vaporiser la région abdominale avec 70% d’éthanol pour empêcher la fourrure de coller aux forceps, ciseaux, ou des sections intestinales pendant la dissection.
- Utilisez des forceps pour pincer et soulever une section de peau à la base de l’abdomen et créer une petite incision à travers la peau et fascia sous-jacente à l’aide de ciseaux. Prenez grand soin lors de la fabrication de cette incision pour éviter de percer le cecum ou la paroi intestinale.
- Étendre cette coupe à la cage thoracique, exposant partiellement la cavité péritonéale. Faire une coupe à partir du point de l’incision initiale de chaque côté s’étendant vers le haut et latéralement.
- Tirez ces volets latéralement et épinglez à la surface disséquante pour exposer complètement la cavité péritonéale.
- Extraire le tractus gastro-intestinal à l’aide de forceps, tout en utilisant des ciseaux pour rendre les coupures supérieures à l’estomac et à la région distale du gros intestin pour assurer la collecte de la plus grande quantité de contenu intestinal de chaque section.
- Lors de la suppression du tractus gastro-intestinal, prenez soin d’éviter de rompre les composants individuels. Séparez l’estomac, l’intestin grêle, le cecum et le gros intestin individuellement à l’aide de ciseaux à leurs extrémités proximales et distales.
- Pour la collecte de chaque contenu intestinal de chaque section, faire une incision unique à l’extrémité distale de chaque section à l’aide de ciseaux, suivie par l’expulsion manuelle de la teneur en intestin dans un tube de microcentrifugeuse de 1,5 mL à l’aide de forceps.
- Conserver le contenu de l’intestin à -80 °C pour les analyses ex vivo.
2. Préparation des plaques d’agar extrait-peptone-dextrose (YPD) de levure
- À une bouteille en verre de 1 L ajouter 25 g d’extrait de levure peptone-dextrose poudre de bouillon, 10 g d’agar, et l’eau ultrapure à un volume final de 500 mL.
- Autoclave à 121 °C pendant 30 min sur un cycle liquide pour stériliser le média.
- Sous une hotte d’écoulement laminaire, verser environ 20 mL de supports d’agar dans une plaque de Petri stérile. 500 mL de supports d’agar devraient produire environ 25 plaques.
- Conserver les assiettes à 4 °C jusqu’à ce qu’elles soient prêtes à l’emploi.
3. Préparation ex vivo pour l’essai hyphal de morphogenèse
- Stries d’une culture fraîche de C. albicans SC5314 sur une plaque d’agar YPD et incuber toute la nuit à 30 °C.
- Choisissez deux à trois colonies individuelles de taille moyenne provenant de la culture C. albicans SC5314 cultivées pendant la nuit et suspendez-les en 1 mL de salin tamponné de phosphate (PBS).
- Récupérer le contenu des intestins congelés dans le congélateur de -80 °C et décongeler à 25 °C.
- Pesez environ 150 mg de contenu intestinal dans un nouveau tube de 1,5 mL.
- Suspendre à nouveau le contenu intestinal avec 150 μL de PBS (teneur en intestin et PBS à un rapport poids/volume de 1:1).
- Vortex à grande vitesse pendant 30 s pour homogénéiser le contenu de l’intestin et permettre de s’asseoir à température ambiante pendant environ une minute.
- Centrifugeuse l’homogénéise à 1000 x g pendant 3 min.
- Transférer le supernatant dans un nouveau tube de 1,5 mL.
- Répétez les étapes 3.7 et 3.8 pour enlever tous les débris dans le surnatant.
- Ajouter 10 μL de l’inoculum C. albicans SC5314 préparé ci-dessus à ce supernatant
- Bien mélanger et incuber à 37 °C pendant 4 à 5 h.
4. Ajout exogène de métabolites aux extraits homogénéisés d’intestin pour l’essai hyphal de morphogenèse
- Récupérer le contenu des intestins congelés du congélateur de -80 °C et les suspendre de nouveau en PBS à un rapport de 1:1 (poids : volume).
- Ajouter la concentration désirée de métabolites intestinaux au contenu intestinal et au mélange PBS.
- Vortex à grande vitesse pendant 30 s pour homogénéiser le contenu intestinal contenant des métabolites et permettre de s’asseoir à température ambiante pendant environ 10 min.
- Centrifugeuse l’homogénéise à 1000 x g pendant 3 min.
- Transférer le supernatant dans un nouveau tube de 1,5 mL. Répétez les étapes 4.4 et 4.5 pour enlever tous les débris dans le supernatant.
- Ajouter 10 μL de l’inoculum C. albicans SC5314 préparé ci-dessus à ce supernatant. Bien mélanger et incuber à 37 °C pendant 4 à 5 h.
5. Essai de morphogenèse de C. albicans (immunostaining et imagerie)
- Centrifuger les échantillons à 1000 x g pendant 2 min et jeter le supernatant par pipetting.
- Fixer les échantillons dans 100 μL de 2% de paraformaldéhyde (PFA) pendant 15 min.
- Centrifugeuse à 1000 x g pendant 2 min et jeter le supernatant par pipetting.
- Lavez les échantillons deux fois avec 1 mL de PBS. Pour laver les échantillons, suspendez la pastille dans PBS en pipetting doucement. Ne pas vortex de l’échantillon car cela peut endommager les structures hyphal. Après la re-suspension, centrifugeuse à 1000 x g pendant 2 min et jeter le supernatant par pipetting.
- Incuber les échantillons à température ambiante dans 100 μL de PBS contenant de l’anticorps polyclonal C. albicans (1:100 dilution) pendant 30 min.
- Lavez les échantillons trois fois avec 1 mL de PBS.
REMARQUE : Lors de l’utilisation d’un anticorps fluorescent, il est recommandé que toutes les étapes de dilution et de lavage soient effectuées en faible lumière afin d’éviter le blanchiment des photos et d’améliorer la longévité de l’échantillon. - Incuber les échantillons à température ambiante pendant 15 min dans 100 μL de PBS contenant anti-Lapin IgG Alexafluor 488 anticorps à 1:500 dilution. Effectuez l’incubation dans un tiroir ou une pièce sombre pour éviter le blanchiment des photos.
- Lavez les échantillons trois fois avec 1 mL de PBS.
- Suspendre à nouveau les échantillons dans 100 μL de PBS et les transférer dans une plaque de 96 puits pour l’imagerie.
REMARQUE : Lorsqu’elle n’est pas photographiée, il est recommandé d’envelopper la plaque de 96 puits dans du papier d’aluminium pour éviter le blanchiment des photos. - Cellules fongiques d’image utilisant des lentilles objectives 20x et 40x utilisant un microscope d’imagerie de fluorescence. Utilisez un filtre à protéines fluorescentes vertes (longueur d’onde excitation 470/40 et longueur d’onde d’émission 525/50) pour détecter la fluorescence.
Résultats
Ces résultats ainsi que les résultats antérieurs du laboratoire Thangamani60 indiquent que lorsque C. albicans est cultivé ex vivo dans des extraits d’homogénéisation intestinale prélevés dans l’estomac, les intestins grêles et les gros intestins de souris témoins non traitées et traitées aux antibiotiques, C. albicans se développe généralement avec une morphologie de levure (figure 1B). Cependant, lorsqu’il est cultivé dans l’extrait cécal à partir de souris traitées aux antibiotiques, C. albicans subit facilement la morphogenèse, ce qui entraîne des échantillons contenant des formes de levure et d’hyphes (Figure 1B); cela ne se produit pas chez les souris témoins. Ceci soutient des résultats précédents, qui ont montré une augmentation significative des formes d’hyphe dans les échantillons cultivés dans les extraits cecal antibiotiques-traités, mais pas dans n’importe quels autres extraits antibiotique-traitésd’intestin 60. Ces résultats suggèrent que le traitement antibiotique provoque des changements dans l’environnement cécal, qui induisent la morphogenèse hyphale de C. albicans. En outre, la localisation spécifique de ce phénotype remarqué seulement dans le cecum suggère également que ces conditions hyphae-promotion peuvent ne pas nécessairement présenter dans tout le tractus gastro-intestinal, mais sont plutôt limitées à des segments spécifiques du tractus gastro-intestinal en fonction de la disponibilité des nutriments, métabolites et autres molécules inconnues.
Puisque l’extrait cécal des souris antibiotiques-traitées favorise la morphogenèse de C. albicans57,58,59,60,nous avons examiné si l’addition exogène d’un groupe choisi de métabolites d’intestin (identifiés des études in vitro précédentes) à la teneur cecal des souris cef-traitées affectera la morphogenèse de C. albicans ex vivo. Des travaux antérieurs effectués par le laboratoire Thangamani ont caractérisé le profil métabolomique de l’homogénéité à teneur cécale extraite de souris non traitées et traitées aux antibiotiques, révélant des changements significatifs dans l’abondance de divers métabolites à la suite d’un traitement antibiotique, en particulier une diminution de l’abondance des acides biliaires secondaires et une abondanceaccrue de glucides 60. En outre, cette étude a identifié que les acides biliaires secondaires et les acides carboxyliques inhibent le développement d’hyphe, tandis que les hydrates de carbone comprenant le glucose, favorisent la morphogenèse hyphal de C. albicans in vitro60. Les résultats indiquent que l’ajout d’un pool de métabolites inhibiteurs de l’intestin contenant de l’acide désoxycholique (DCA, 0,5 mg/mL), de l’acide lithocholic (LCA, 0,1 mg/mL), acide palmitique (0,1 mg/mL), acide p-tolylacetic (0,1 mg/mL), acide sébacique (0,5 mg/mL), 2 l’acide méthylbutyrique (0,5 mg/mL) et l’acide lactique (5 mg/mL) à l’homogénéité cécale des souris traitées au cef ont complètement inhibé la morphogenèse hyphale ex vivo. D’autre part, l’addition exogène du glucose (1 mg/mL) à l’homogénéate cecal des souris cef-traitées a montré un ex vivo massif de développement hyphal (figure 2B). Collectivement, ces résultats indiquent que l’addition des métabolites d’intestin de nouveau à l’homogénéate cecal des souris cef-traitées régule différentiellement la morphogenèse de C. albicans, confirmant ainsi des résultats in vitro précédents. Ces résultats indiquent que les métabolites intestinaux jouent un rôle essentiel dans la morphogenèse hyphale de C. albicans et la compréhension des cibles génétiques et des voies de signalisation modulées par ces métabolites aidera au développement de nouvelles approches thérapeutiques pour prévenir et traiter les infections à C. albicans.

Figure 1 : Analyse ex vivo pour déterminer l’effet du traitement de cefoperazone sur la morphogenèse hyphale de C. albicans dans le contenu intestinal. (A) Schéma de protocole. (B) Le contenu intestinal traité aux antibiotiques (panneaux supérieurs) et non traité (panneaux du bas) a été prélevé sur l’estomac, les intestins grêles, les ccums et les gros intestins des souris C57BL/6J. Le contenu intestinal inoculé avec C. albicans SC5314 a été incubé à 37 °C pendant 4\u20125 h et taché d’anticorps C. albicans. Les cellules ont été imaged au grossissement de 40x. Des images représentatives sont affichées ici. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
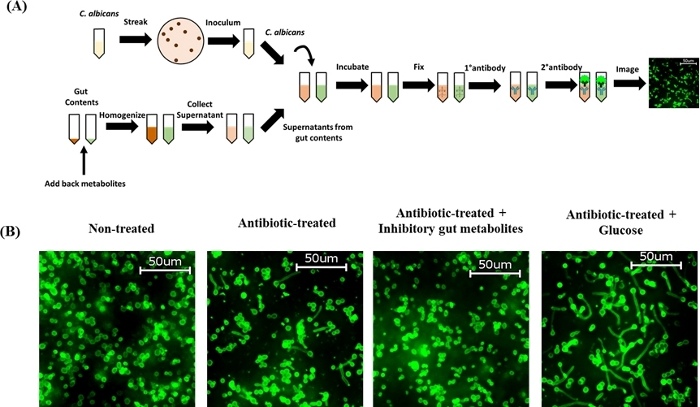
Figure 2 : Ajout exogène de métabolites intestinaux au contenu cécal des souris traitées au cef sur la formation hyphe de C. albicans ex vivo. (A) Schéma de protocole. (B) Piscine inhibitrice de métabolites intestinaux contenant du DCA (0,5 mg/mL), du LCA (0,1 mg/mL), de l’acide palmitique (0,1 mg/mL), de l’acide p-tolylacétique (0,1 mg/mL), de l’acide sébacique (0,5 mg/mL); L’acide 2-méthylbutyrique (0.5 mg/mL), et l’acide lactique (5 mg/mL) ou le glucose (1 mg/mL) ont été ajoutés de nouveau à la teneur en cecal des souris cef-traitées, mélangées complètement et incubées à 37 °C pendant 15 min pour effectuer l’essai ex vivo hyphae. Le contenu cécal inoculé avec C. albicans SC5314 a été incubé à 37 °C pendant 4\u20125 h et taché d’anticorps C. albicans. Les cellules ont été imaged au grossissement de 40x. Des images représentatives sont affichées ici. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
La méthode décrite ici présente une nouvelle façon d’étudier l’effet des impacts antibiotiques, diététiques, xénobiotiques et thérapeutiques sur la morphogenèse hyphale de C. albicans dans le tractus gastro-intestinal. Puisque la majorité des infections systémiques proviennent du tractusgastro-intestinal 21,22,23,24,25,26,27,28,29,30,31,32,33,34 et la formation d’hyphe est un facteur de virulence critique qui favorise la diffusion de C. albicans du tractus gastro-intestinal, la compréhension des facteurs qui contrôlent cette morphogenèse dans le tractus gastro-intestinal permettra d’élargir les connaissances sur les mécanismes de pathogénie et d’identifier de nouvelles options de traitement.
Bien que la méthode présentée ici soit relativement simple, certaines étapes examinées ci-dessous ont été identifiées comme critiques et importantes. (i) L’inoculum initial de C. albicans devrait être optimal pour permettre à la fois la croissance et la morphogenèse hyphale des champignons. Avec la disponibilité limitée des éléments nutritifs dans les extraits homogénéisés d’intestin, le volume plus élevé de l’inoculum peut réduire de manière significative la croissance fongique et le processus de morphogenèse. Cependant, la croissance de différents isolats cliniques et souches sont susceptibles d’être variables, optimisant ainsi l’inoculum et le temps d’incubation pour des isolats spécifiques de C. albicans est essentiel. (ii) Les étapes multiples de centrifugation lors de la préparation de l’extrait d’homogénéisation intestinale se sont révélés cruciales pour enlever autant que possible les débris dans le contenu intestinal. iii) En raison de la vitesse relativement faible de centrifugation (pour éviter d’endommager les structures hyphes), il faut prendre soin d’éviter la perte cellulaire pendant les étapes d’immunostaining dans ce protocole.
Des méthodes alternatives pour visualiser l’hyphe fongique dans le tractus gastro-intestinal ont été utilisées dans le passé, avec certains avantages et limitations associés à chaque méthode. Une méthode relativement notable utilisant l’hybridation in situ fluorescente (FISH) pour visualiser l’hyphe fongique dans le tractus gastro-intestinal a été récemment démontrée par Witchley et coll.61,62. Il s’agit d’une méthode in vivo prometteuse actuellement disponible pour détecter l’hyphae de C. albicans directement dans le tractus gastro-intestinal, mais la complexité de ce protocole rend difficile son adaptation à des études initiales rapides et à grande échelle. Des méthodes traditionnelles d’histopathologie ont également été utilisées dans le passé pour vitaliser les formes de levure et d’hyphae de C. albicans dans le tractus gastro-intestinal. Cependant, l’observation et l’imagerie des cellules fongiques avec l’histopathologie de base, et les taches d’hématoxyline et d’Éosin (H/E) restent provocantes, car beaucoup de méthodes standard de fixation ont le potentiel de perturber la couche muqueuse des échantillons de tractus gastro-intestinaux, endommageant souvent des structures hyphales dans le processus et menant aux rapports contradictoires au-dessus de l’abondance relative de la morphologie hyphal de cellules pendant l’infection63,64,65,66. Cette méthode a été développée pour éviter les dommages à l’hyphe pendant le traitement pour résoudre ce problème. En outre, les explantations tissulaires ont été utilisées comme un moyen d’examiner les conditions biologiques ex vivo, mais ces méthodes sont généralement ciblées et utiles pour examiner le potentiel d’adhérence ou d’invasion de C. albicans67, mais aussi ils excluent généralement la majorité des composants de métabolomique et de microbiome qui contribuent à la pathogénie in vivo. Bien que le protocole ex vivo décrit ici n’imite pas complètement l’environnement gastro-intestinal in vivo tel que décritprécédemment 61,62, il fournit les conditions les plus proches possibles que C. albicans rencontre dans l’environnement intestinal par rapport aux méthodes in vitro en utilisant des conditions de croissance artificielle.
Ce protocole peut être utilisé pour des tests de dépistage de base afin d’identifier l’impact des signaux environnementaux dans le tractus gastro-intestinal sur la morphogenèse hyphale de C. albicans. Cette méthode permet de dépister rapidement de grands groupes de composés, y compris de petits inhibiteurs de molécules, de nouveaux antimycotiques et métabolites, et de les dépister rapidement pour le développement de l’hyphal, et pourrait être utilisée dans le dépistage des traitements thérapeutiques ou l’identification des facteurs de risque de maladie systémique. Puisque C. albicans colonise dans tout le tractus gastro-intestinal, ce protocole aidera davantage à identifier les signaux environnementaux présents dans les segments spécifiques du tractus gastro-intestinal qui contrôlent la morphogenèse hyphale chez les personnes prenant des antibiotiques, des agents chimiothérapeutiques, et chez les patients présentant des troubles métaboliques, y compris le diabète sucré. En fin de compte, la méthode décrite ici permet une caractérisation rapide de la morphogenèse hyphale chez C. albicans sur un large éventail de facteurs environnementaux d’une manière qui est plus biologiquement pertinente que les méthodes in vitro actuelles et qui est sensiblement plus rapide et plus économe en ressources que les méthodes in vivo actuelles.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers concurrents ou d’autres conflits d’intérêts.
Remerciements
Les auteurs reconnaissent les ressources et le soutien du centre de recherche cellulaire et moléculaire de base de l’Université du Midwest.
matériels
| Name | Company | Catalog Number | Comments |
| 1 - 10 µL Pipet Tips | Fisher Scientific | 02-707-454 | Misc |
| 100 - 1000 µL Pipet Tips | Fisher Scientific | 02-707-400 | Misc |
| 20 - 200 µL Pipet Tips | Fisher Scientific | 02-707-451 | Misc |
| 2-methylbutyric acid | Sigma | 193070-25G | hyphal-inhibitory compound |
| 488 goat anti-rabbit IgG | Invitrogen (Fisher) | A11008 | IF Staining secondary ab |
| Agar | Fisher | BP1423-500 | YPD agar component |
| Automated Imaging Microscope | Keyence | BZX700 | |
| Candida Albicans Antibody | Invitrogen (Fisher) | PA1-27158 | IF Staining primary ab |
| cefoperazone | Cayman | 16113 | antibiotic |
| deoxycholic acid | Sigma | 30960 | hyphal-inhibitory compound |
| D-Glucose | Fisher | D16-500 | hyphal-promoting compound |
| forceps | Fisher | 08-885 | |
| lactic acid | Alfa Aesar | AAAL13242-06 | hyphal-inhibitory compound |
| lithocholic acid | Sigma | L6250-10G | hyphal-inhibitory compound |
| palmitic acid | Sigma | P5585-10G | hyphal-inhibitory compound |
| Paraformaldehyde | Alfa Aesar | A11313 | IF Staining fixative |
| Phosphate-buffered saline (PBS), 10x | Alfa Aesar | J62692 | PBS component |
| p-tolylacetic acid | SCBT | sc-257959 | hyphal-inhibitory compound |
| sebacic acid | Sigma | 283258-250G | hyphal-inhibitory compound |
| sharp ended scissors | Fisher | 28301 | |
| sterile Milli-Q water | N/A | N/A | Misc |
| YPD Broth | BD Biosciences | 242810 | YPD agar component |
Références
- Huffnagle, G. B., Noverr, M. C. The emerging world of the fungal microbiome. Trends in Microbiology. 21 (7), 334-341 (2013).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Hajjeh, R. A., et al. Incidence of Bloodstream Infections Due to Candida Species and In Vitro Susceptibilities of Isolates Collected from 1998 to 2000 in a Population-based Active Surveillance Program. Journal of Clinical Microbiology. 42 (4), 1519-1527 (2004).
- Lockhart, S. R., et al. Species Identification and Antifungal Susceptibility Testing of Candida Bloodstream Isolates from Population-Based Surveillance Studies in Two U.S. Cities from 2008 to 2011. Journal of Clinical Microbiology. 50 (11), 3435-3442 (2012).
- Pfaller, M., et al. Epidemiology and outcomes of candidemia in 3648 patients: data from the Prospective Antifungal Therapy (PATH Alliance(R)) registry, 2004-2008. Diagnostic Microbiology and Infectious Disease. 74 (4), 323-331 (2012).
- Angarone, M. Fungal infections in cancer patients. Cancer Treatment and Research. 161, 129-155 (2014).
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113 (2012).
- Calton, E. A., et al. Invasive bacterial and fungal infections in paediatric patients with cancer: incidence, risk factors, aetiology and outcomes in a UK regional cohort 2009-2011. Pediatric Blood & Cancer. 61 (7), 1239-1245 (2014).
- Carter, J. H., et al. Medical management of invasive fungal infections of the central nervous system in pediatric cancer patients. Pediatric Blood & Cancer. 62 (6), 1095-1098 (2015).
- Low, C. Y., Rotstein, C. Emerging fungal infections in immunocompromised patients. F1000 Medicine Reports. 3, 14 (2011).
- Mousset, S., et al. Treatment of invasive fungal infections in cancer patients-updated recommendations of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Annals of Hematology. 93 (1), 13-32 (2014).
- Perfect, J. R., Hachem, R., Wingard, J. R. Update on epidemiology of and preventive strategies for invasive fungal infections in cancer patients. Clinical Infectious Diseases. 59, 352-355 (2014).
- Sipsas, N. V., Kontoyiannis, D. P. Invasive fungal infections in patients with cancer in the Intensive Care Unit. International Journal of Antimicrobial Agents. 39 (6), 464-471 (2012).
- Falagas, M. E., Apostolou, K. E., Pappas, V. D. Attributable mortality of candidemia: a systematic review of matched cohort and case-control studies. European Journal of Clinical Microbiology and Infectious Diseases. 25 (7), 419-425 (2006).
- Chi, H. W., et al. Candida albicans versus non-albicans bloodstream infections: the comparison of risk factors and outcome. Journal of Microbiology, Immunology and Infection. 44 (5), 369-375 (2011).
- Drell, T., et al. Characterization of the vaginal micro- and mycobiome in asymptomatic reproductive-age Estonian women. PLoS One. 8 (1), 54379 (2013).
- Merenstein, D., et al. Colonization by Candida species of the oral and vaginal mucosa in HIV-infected and noninfected women. AIDS Research and Human Retroviruses. 29 (1), 30-34 (2013).
- Ghannoum, M. A., et al. Characterization of the oral fungal microbiome (mycobiome) in healthy individuals. PLoS Pathogens. 6 (1), 1000713 (2010).
- Hoffmann, C., et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents. PLoS One. 8 (6), 66019 (2013).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida albicans cell-type switching and functional plasticity in the mammalian host. Nature Reviews Microbiology. 15 (2), 96-108 (2017).
- Samonis, G., et al. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans. Antimicrobial Agents and Chemotherapy. 37 (1), 51-53 (1993).
- Sahni, V., et al. Candidemia--an under-recognized nosocomial infection in Indian hospitals. The Journal of the Association of Physicians of India. 53, 607-611 (2005).
- Meijer-Severs, G. J., Joshi, J. H. The effect of new broad-spectrum antibiotics on faecal flora of cancer patients. Journal of Antimicrobial Chemotherapy. 24 (4), 605-613 (1989).
- Kennedy, M. J., Volz, P. A., Edwards, C. A., Yancey, R. J. Mechanisms of association of Candida albicans with intestinal mucosa. Journal of Medical Microbiology. 24 (4), 333-341 (1987).
- Miranda, L. N., et al. Candida colonisation as a source for candidaemia. Journal of Hospital Infections. 72 (1), 9-16 (2009).
- Nucci, M., Anaissie, E. Revisiting the source of candidemia: skin or gut. Clinical Infectious Diseases. 33 (12), 1959-1967 (2001).
- Raponi, G., Visconti, V., Brunetti, G., Ghezzi, M. C. Clostridium difficile infection and Candida colonization of the gut: is there a correlation. Clinical Infectious Diseases. 59 (11), 1648-1649 (2014).
- Guastalegname, M., Russo, A., Falcone, M., Giuliano, S., Venditti, M. Candidemia subsequent to severe infection due to Clostridium difficile: is there a link. Clinical Infectious Diseases. 57 (5), 772-774 (2013).
- Nerandzic, M. M., Mullane, K., Miller, M. A., Babakhani, F., Donskey, C. J. Reduced acquisition and overgrowth of vancomycin-resistant enterococci and Candida species in patients treated with fidaxomicin versus vancomycin for Clostridium difficile infection. Clinical Infectious Diseases. 55, 121-126 (2012).
- Krause, R., Krejs, G. J., Wenisch, C., Reisinger, E. C. Elevated fecal Candida counts in patients with antibiotic-associated diarrhea: role of soluble fecal substances. Clinical and Diagnostic Laboratory Immunology. 10 (1), 167-168 (2003).
- Krause, R., et al. Role of Candida in antibiotic-associated diarrhea. The Journal of Infectious Diseases. 184 (8), 1065-1069 (2001).
- Zuo, T., et al. Gut fungal dysbiosis correlates with reduced efficacy of fecal microbiota transplantation in Clostridium difficile infection. Nature Communications. 9 (1), 3663 (2018).
- Delaloye, J., Calandra, T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 5 (1), 161-169 (2014).
- Cole, G. T., Halawa, A. A., Anaissie, E. J. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside. Clinical Infectious Diseases. 22, 73-88 (1996).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Bendel, C. M., et al. Systemic infection following intravenous inoculation of mice with Candida albicans int1 mutant strains. Molecular genetics and metabolism. 67 (4), 343-351 (1999).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial agents and chemotherapy. 49 (3), 963-972 (2005).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences. 106 (2), 599-604 (2009).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences. 110 (33), 13594-13599 (2013).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature genetics. 45 (9), 1088 (2013).
- Bar-Yosef, H., Gonzalez, N. V., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific reports. 7 (1), 5692 (2017).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans hypha-inducing transcription factor Ume6 by the CDK1 cyclins Cln3 and Hgc1. mSphere. 2 (2), 00248 (2017).
- Vila, T., et al. Targeting Candida albicans filamentation for antifungal drug development. Virulence. 8 (2), 150-158 (2017).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Bar-Yosef, H., Vivanco Gonzalez, N., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific Reports. 7 (1), 5692 (2017).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 599-604 (2009).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans Hypha-Inducing Transcription Factor Ume6 by the CDK1 Cyclins Cln3 and Hgc1. mSphere. 2 (2), (2017).
- Bendel, C. M., et al. Effects of Alteration of the Candida albicans Gene INT1 on Cecal Colonization in Orally Innoculated Mice. Pediatric Research. 45, 156 (1999).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial Agents and Chemotherapy. 49 (3), 963-972 (2005).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 13594-13599 (2013).
- Naseem, S., Gunasekera, A., Araya, E., Konopka, J. B. N-acetylglucosamine (GlcNAc) induction of hyphal morphogenesis and transcriptional responses in Candida albicans are not dependent on its metabolism. Journal of Biological Chemistry. 286 (33), 28671-28680 (2011).
- Piispanen, A. E., Hogan, D. A. PEPped up: induction of Candida albicans virulence by bacterial cell wall fragments. Cell Host & Microbe. 4 (1), 1-2 (2008).
- Xu, X. L., et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host & Microbe. 4 (1), 28-39 (2008).
- Guinan, J., Thangamani, S. Antibiotic-induced alterations in taurocholic acid levels promote gastrointestinal colonization of Candida albicans. FEMS microbiology letters. 365 (18), (2018).
- Guinan, J., Villa, P., Thangamani, S. Secondary bile acids inhibit Candida albicans growth and morphogenesis. Pathogens and disease. 76 (3), (2018).
- Guinan, J., Wang, S., Hazbun, T. R., Yadav, H., Thangamani, S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Scientific Reports. 9 (1), 1-11 (2019).
- Gutierrez, D., et al. Antibiotic-induced gut metabolome and microbiome alterations increase the susceptibility to Candida albicans colonization in the gastrointestinal tract. FEMS microbiology ecology. 96 (1), 187 (2020).
- Witchley, J. N., et al. Candida albicans morphogenesis programs control the balance between gut commensalism and invasive infection. Cell Host & Microbe. 25 (3), 432-443 (2019).
- Witchley, J. N., Penumetcha, P. M., Noble, S. M. Visualization of Candida albicans in the Murine Gastrointestinal Tract Using Fluorescent In Situ Hybridization. JoVE (Journal of Visualized Experiments). (153), e60283 (2019).
- Johansson, M. E., Hansson, G. C. Preservation of mucus in histological sections, immunostaining of mucins in fixed tissue, and localization of bacteria with FISH. Mucins. , 229-235 (2012).
- Lossinsky, A. S., et al. The histopathology of Candida albicans invasion in neonatal rat tissues and in the human blood-brain barrier in culture revealed by light, scanning, transmission and immunoelectron microscopy scanning. Histology and histopathology. , (2006).
- Rosenbach, A., Dignard, D., Pierce, J. V., Whiteway, M., Kumamoto, C. A. Adaptations of Candida albicans for growth in the mammalian intestinal tract. Eukaryotic Cell. 9, 1075-1086 (2010).
- Vautier, S., et al. C andida albicans colonization and dissemination from the murine gastrointestinal tract: the influence of morphology and T h17 immunity. Cellular Microbiology. 17, 445-450 (2015).
- Lyman, C., Navarro, E., Garrett, K., Roberts, D., Pizzo, P., Walsh, T. Adherence of Candida albicans to bladder mucosa: development and application of a tissue explant assay. Mycoses. 42, 255-259 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon