Method Article
Un ensayo ex vivo para estudiar Candida albicans Morphogenesis hifal en el tracto gastrointestinal
En este artículo
Resumen
El ensayo ex vivo descrito en este estudio utilizando extractos de homogeneización intestinal y tinción de inmunofluorescencia representa un método novedoso para examinar la morfogénesis hifágica de Candida albicans en el tracto gastrointestinal. Este método se puede utilizar para investigar las señales ambientales que regulan la transición morfogenética en el intestino.
Resumen
Candida albicans hyphal morphogenesis in the gastrointestinal (GI) está estrechamente controlada por varias señales ambientales, y desempeña un papel importante en la difusión y patogénesis de este patógeno fúngico oportunista. Sin embargo, los métodos para visualizar las hifas fúngicas en el tracto gastrointestinal in vivo son desafiantes, lo que limita la comprensión de las señales ambientales en el control de este proceso de morfogénesis. El protocolo descrito aquí demuestra un novedoso método ex vivo para la visualización de la morfogénesis hifal en extractos de homogeneización intestinal. Utilizando un ensayo ex vivo, este estudio demuestra que el contenido de cecal de ratones tratados con antibióticos, pero no de ratones de control no tratados, promueven la morfogénesis hiphal de C. albicans en el contenido intestinal. Además, la adición de grupos específicos de metabolitos intestinales al contenido de cecal de ratones tratados con antibióticos regula diferencialmente la morfogénesis hifílo ex vivo. En conjunto, este protocolo representa un método novedoso para identificar e investigar las señales ambientales que controlan la morfogénesis hipófrica de C. albicans en el tracto gastrointestinal.
Introducción
Candida albicans es un patógeno fúngico oportunista y polimórfico que normalmente es commensal, pero puede sufrir un cambio morfológico en una forma virulenta capaz de causar infecciones potencialmente mortales en individuos inmunocomprometidos1,2,3,4,5,6,7,8,9,10,11,12,13. C. albicans es una de las principales causas de infecciones nosocomiales sistémicas, con una tasa de mortalidad de 40-u201260% incluso con tratamiento antifúngico2,14,15. Aunque C. albicans reside en diferentes nichos de acogida, incluido el sistema reproductivo femenino16,17, la cavidad oral de individuos sanos18 y el tracto gastrointestinal (GI)19,20, la mayoría de las infecciones sistémicas se originan en el tracto gastrointestinal y, además, la fuente de infección sistémica se confirma a menudo como el tracto gastrointestinal21,22,23,24,25,26,27,28,29,30,31,32,33,34. C. patogenicidad albicans en el tracto gastrointestinal está influenciado por una amplia gama de factores; sin embargo, una característica importante necesaria para la virulencia es la transición de una morfología celular de levadura a una morfología celular hiphal virulenta35,36,37,38,39,40,41,42,43,44. C. El apego y la difusión de los hongos del tracto gastrointestinal durante la infección está altamente asociado con su capacidad de transición de una levadura commensal a hifas virulentas, permitiendo que los hongos causen enfermedades invasivas44,45,46,47,48,49,50,51,52,53.
Una variedad de factores en el intestino, incluyendo n-acetilglucosamina, regular la formación de hiphal por C. albicans. Por lo tanto, es crucial reducir la brecha en el conocimiento con respecto a la morfogénesis hifal de este patógeno fúngico en el tracto gastrointestinal54,55,56. La evidencia reciente indica que varios metabolitos intestinales controlan diferencialmente la morfogénesis hifral de C. albicans in vitro57,58,59,60. Sin embargo, las limitaciones técnicas presentan problemas al intentar estudiar la formación de las hifas de C. albicans en muestras intestinales in vivo, especialmente la tinción de células de levadura e hifas y el análisis cuantitativo del desarrollo hiphal. Para entender la morfogénesis hifrética de C. albicans en el tracto gastrointestinal, se desarrolló un método ex vivo utilizando extractos solubles de contenido intestinal homogeneizado de ratones para estudiar el efecto de los metabolitos en la morfogénesis hipófológica fúngica. Utilizando muestras intestinales de ratones que son resistentes y susceptibles a la infección por C. albicans GI, este método ayudará a identificar y estudiar el efecto de metabolitos, antibióticos y xenobióticos en la morfogénesis hipófológica fúngica en el tracto gastrointestinal.
Protocolo
Todos los protocolos de animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad del Medio Oeste (IACUC) como se describió antesdel 57. El Comité Institucional de Cuidado y Uso de Animales de la Universidad del Medio Oeste aprobó este estudio bajo el Protocolo MWU IACUC #2894. Las políticas de cuidado animal de MWU siguen la Política del Servicio de Salud Pública (PHS) sobre cuidado y uso humano de animales de laboratorio y las políticas establecidas en la Ley de Bienestar Animal (AWA).
1. Los ratones estudian el protocolo estándar
- Utilice ratones C57BL/6J machos y hembras de al menos seis semanas de edad. Suplementarlos con agua estéril con o sin cefoperazona (0,5 mg/ml).
- Co-casa de ratones en grupos de 5, con cada jaula que contiene todos los ratones macho o hembra. Proporcione a los ratones comida de ratón estándar y agua (a través de una botella de 400 ml) en todo momento.
- Revise las jaulas diariamente para asegurarse de que los niveles de alimentos y agua sean suficientes, y para examinar a los ratones en busca de signos de angustia.
- Sustituya el agua por cefoperazona cada 48 h para asegurarse de que se suministra antibiótico fresco independientemente del agua restante en las botellas de alimentación de la jaula.
- Después de 5 días de tratamiento con cefoperazona, eutanasia a los ratones a través de la asfixia porCO2 observando el protocolo establecido de la IACUC. Confirme la muerte por luxación cervical.
- Disecciona ratones usando tijeras afiladas esterilizadas con autoclave y fórceps esterilizadas con autoclave.
- Después de la eutanasia, fije el animal a una superficie de disección fijando todas las extremidades de tal manera que el abdomen esté expuesto.
- Rocíe la región abdominal con 70% de etanol para evitar que el pelaje se pegue a fórceps, tijeras o secciones intestinales durante la disección.
- Usa fórceps para pellizcar y levantar una sección de la piel en la base del abdomen y crea una pequeña incisión a través de la piel y la fascia subyacente usando tijeras. Tenga mucho cuidado al hacer esta incisión para evitar perforar el cecum o la pared intestinal.
- Extienda este corte a la caja torácica, exponiendo parcialmente la cavidad peritoneal. Haga un corte comenzando en el punto de la incisión inicial a cada lado extendiéndose hacia arriba y lateralmente.
- Tire de estas aletas lateralmente y ancle a la superficie de disección para exponer completamente la cavidad peritoneal.
- Extraer el tracto gastrointestinal usando fórceps, mientras que el uso de tijeras para hacer cortes superiores al estómago y en la región distal del intestino grueso para asegurar la recolección de la mayor cantidad de contenido intestinal de cada sección.
- Al retirar el tracto gastrointestinal, tenga cuidado de evitar la rotura de los componentes individuales. Separe el estómago, el intestino delgado, el cecum y el intestino grueso individualmente usando tijeras en sus extremos proximal y distal.
- Para la recolección de cada contenido intestinal de cada sección, haga una sola incisión en el extremo distal de cada sección usando tijeras, seguida de expulsar manualmente el contenido intestinal en un tubo de microcentrífuga de 1,5 ml utilizando fórceps.
- Almacene el contenido intestinal a -80 oC para ensayos ex vivos.
2. Preparación de placas de agar de extracto de levadura-peptona-dextrosa (YPD)
- A una botella de vidrio de 1 L añadir 25 g de extracto de levadura de caldo de peptona-dextrosa en polvo, 10 g de agar, y agua ultrapura a un volumen final de 500 mL.
- Autoclave a 121 oC durante 30 min en un ciclo de líquido para esterilizar el medio.
- Bajo una capucha de flujo laminar, vierta aproximadamente 20 ml de medios de agar en una placa petri estéril. 500 ml de soporte de agar deben producir aproximadamente 25 placas.
- Almacene las placas a 4oC hasta que estén listas para su uso.
3. Preparación ex vivo para el ensayo de morfosis hifígena
- Raya un nuevo cultivo de C. albicans SC5314 en una placa de agar YPD e incuba durante la noche a 30oC.
- Escoja de dos a tres colonias individuales de tamaño mediano del cultivo de C. albicans SC5314 cultivado durante la noche y vuelva a suspender en 1 ml de solución salina tamponada de fosfato (PBS).
- Recuperar el contenido del intestino congelado del congelador de -80 oC y descongelar a 25 oC.
- Pesar alrededor de 150 mg de contenido intestinal en un nuevo tubo de 1,5 ml.
- Re-suspender el contenido intestinal con 150 s de PBS (contenido intestinal y PBS en una relación peso-volumen de 1:1).
- Vórtice a alta velocidad durante 30 s para homogeneizar el contenido intestinal y dejar reposar a temperatura ambiente durante aproximadamente un minuto.
- Centrifugar los homogeneizas a 1000 x g durante 3 min.
- Transfiera el sobrenadante a un nuevo tubo de 1,5 ml.
- Repita los pasos 3.7 y 3.8 para eliminar todos los residuos del sobrenadante.
- Añadir 10 l del inóculo C. albicans SC5314 preparado arriba a este sobrenadante
- Mezclar bien e incubar a 37oC durante 4 a 5 h.
4. Adición exógena de metabolitos a los extractos de homogeneato intestinal para el ensayo de morfosis hifígena
- Recuperar el contenido intestinal congelado del congelador de -80 oC y volver a suspenderlo en PBS a una relación 1:1 (peso: volumen).
- Añadir la concentración deseada de metabolitos intestinales al contenido intestinal y la mezcla de PBS.
- Vórtice a alta velocidad durante 30 s para homogeneizar el contenido intestinal que contiene metabolitos y permitir sentarse a temperatura ambiente durante unos 10 min.
- Centrifugar los homogeneizas a 1000 x g durante 3 min.
- Transfiera el sobrenadante a un nuevo tubo de 1,5 ml. Repita los pasos 4.4 y 4.5 para eliminar todos los residuos del sobrenadante.
- Añadir 10 l del inóculo C. albicans SC5314 preparado arriba a este sobrenadante. Mezclar bien e incubar a 37oC durante 4 a 5 h.
5. C. Ensayo de morfogénesis de C. albicans (inmunosu manchado e imágenes)
- Centrifugar las muestras a 1000 x g durante 2 min y deseche el sobrenadante a través de pipeteo.
- Fijar las muestras en 100 l de 2% de paraformaldehído (PFA) durante 15 min.
- Centrifugar a 1000 x g durante 2 min y deseche el sobrenadante a través de pipeteo.
- Lave las muestras dos veces con 1 ml de PBS. Para lavar las muestras, vuelva a suspender el pellet en PBS pipeteando suavemente. No vórtice la muestra, ya que esto puede dañar las estructuras hiphales. Después de la re-suspensión, centrifugar a 1000 x g durante 2 minutos y deseche el sobrenadante a través de pipeteo.
- Incubar las muestras a temperatura ambiente en 100 ml de PBS que contenga anticuerpo policlonal C. albicans (1:100 dilución) durante 30 min.
- Lave las muestras tres veces con 1 ml de PBS.
NOTA: Cuando se utiliza un anticuerpo fluorescente, se recomienda que todos los pasos de dilución y lavado se realicen con poca luz para evitar el blanqueo fotográfico y mejorar la longevidad de la muestra. - Incubar las muestras a temperatura ambiente durante 15 minutos en 100 ml de PBS que contenga anticuerpos anti-Rabbit IgG Alexafluor 488 a 1:500 dilución. Realice la incubación en un cajón oscuro o habitación para evitar el blanqueo fotográfico.
- Lave las muestras tres veces con 1 ml de PBS.
- Vuelva a suspender las muestras en 100 oL de PBS y transfiera a una placa de 96 pocillos para la toma de imágenes.
NOTA: Cuando no se está tomando una imagen, se recomienda que la placa de 96 pozos se envuelva en papel de aluminio para evitar el blanqueo fotográfico. - Imagen de células fúngicas utilizando lentes objetivo 20x y 40x utilizando un microscopio de imágenes de fluorescencia. Utilice un filtro de proteína fluorescente verde (GFP) (longitud de onda de excitación 470/40 y longitud de onda de emisión 525/50) para detectar la fluorescencia.
Resultados
Estos resultados junto con los hallazgos anteriores del laboratorio Thangamani60 indican que cuando C. albicans se cultiva ex vivo en extractos de homogeneato intestinal tomados del estómago, intestino delgado e intestino grueso de control no tratado y ratones tratados con antibióticos, C. albicans generalmente se desarrolla con una morf levaduraología (Figura 1B). Sin embargo, cuando se cultiva en el extracto de cecal de ratones tratados con antibióticos, C. albicans se somete fácilmente a la morfogénesis, dando como resultado muestras que contienen formas de levadura e hifas (Figura 1B); esto no ocurre en ratones de control. Esto apoya los resultados anteriores, que mostraron un aumento significativo en las formas de hifas en muestras cultivadas en extractos de cecal tratados con antibióticos, pero no en ningún otro extracto intestinal tratado con antibióticos60. Estos resultados sugieren que el tratamiento con antibióticos causa cambios en el entorno cecal, que inducen morfogénesis hifífala de C. albicans. Además, la localización específica de este fenotipo que sólo se nota en el cecum también sugiere que estas condiciones de promoción de hifas pueden no estar necesariamente presentes en todo el tracto gastrointestinal, sino que se limitan a segmentos específicos del tracto gastrointestinal dependiendo de la disponibilidad de nutrientes, metabolitos y otras moléculas desconocidas.
Dado que el extracto cecal de ratones tratados con antibióticos promueve la morfogénesis de C. albicans57,58,59,60, examinamos si la adición exógena de un grupo seleccionado de metabolitos intestinales (identificados a partir de estudios in vitro anteriores) al contenido cecal de ratones tratados con cef afectará a la morfogénesis de C. albicans ex vivo. El trabajo previo realizado por el laboratorio de Thangamani ha caracterizado el perfil metabolómico del homogeneizado de contenido cecal extraído de ratones no tratados y tratados con antibióticos, revelando cambios significativos en la abundancia de diversos metabolitos como resultado del tratamiento con antibióticos, específicamente, la disminución de la abundancia de ácidos biliares secundarios y el aumento de la abundancia de carbohidratos60. Además, este estudio identificó que los ácidos biliares secundarios y los ácidos carboxílicos inhiben el desarrollo de hifas, mientras que los carbohidratos incluyendo la glucosa, promueven la morfogénesis hifal de C. albicans in vitro60. Los resultados indican que la adición de un grupo de metabolitos intestinales inhibitorios que contienen ácido desoxicólico (DCA, 0,5 mg/ml), ácido litoólico (LCA, 0,1 mg/ml), ácido palmítico (0,1 mg/ml), ácido p-tolylacetic (0,1 mg/ml), ácido sebáceo (0,5 mg/ml), 2-ácido metilbutírico (0,5 mg/ml) y ácido láctico (5 mg/ml) al homogeneato cecal de ratones tratados con cef inhibió completamente la morfogénesis hifía ex vivo. Por otro lado, la adición exógena de glucosa (1 mg/ml) al homogeneato cecal de ratones tratados con cef mostró un desarrollo hiphal masivo ex vivo (Figura 2B). En conjunto, estos hallazgos indican que la adición de metabolitos intestinales al homogeneato cecal de los ratones tratados con cef regula diferencialmente la morfogénesis de C. albicans, confirmando así hallazgos in vitro anteriores. Estos resultados indican que los metabolitos intestinales desempeñan un papel crítico en la morfogénesis hifígena de C. albicans y la comprensión de las dianas genéticas y las vías de señalización moduladas por estos metabolitos ayudará en el desarrollo de nuevos enfoques terapéuticos para prevenir y tratar las infecciones por C. albicans.

Figura 1: Ensayo ex vivo para determinar el efecto del tratamiento de cefoperazona en C. albicans morfogénesis hifílica en el contenido intestinal. (A) Esquema de protocolo. (B) El contenido intestinal tratado con antibióticos (paneles superiores) y no tratado (paneles inferiores) se tomó de los estómagos, intestinos delgados, cecums y intestinos gruesos de ratones C57BL/6J. El contenido de la tripa inoculado con C. albicans SC5314 se incuba a 37 oC durante 4-u20125 h y se tiñe con anticuerpo C. albicans. Las células fueron se imaginaron con un aumento de 40x. Las imágenes representativas se muestran aquí. Haga clic aquí para ver una versión más grande de esta figura.
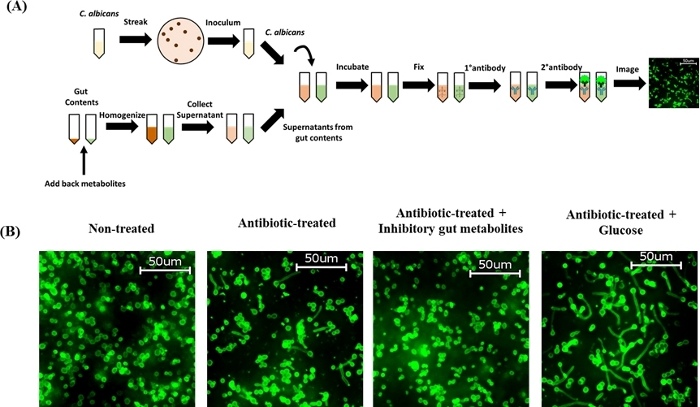
Figura 2: Adición exógena de metabolitos intestinales al contenido de cef de ratones tratados con cef en la formación de hifas de C. albicans ex vivo. (A) Esquema de protocolo. (B) Grupo de metabolitos intestinales inhibitorios que contienen DCA (0,5 mg/ml), LCA (0,1 mg/ml), ácido palmítico (0,1 mg/ml), ácido p-tolacetic (0,1 mg/ml), ácido sebácico (0,5 mg/ml); 2-ácido metilbutírico (0,5 mg/ml), y ácido láctico (5 mg/ml) o glucosa (1 mg/ml) se añadieron de nuevo al contenido de cef-tratados, mezclados a fondo e incubados a 37 oC durante 15 min para llevar a cabo el ensayo de hifas ex vivo. El contenido de Cecal inoculado con C. albicans SC5314 se incuba a 37 oC durante 4-u20125 h y se tiñe con anticuerpo C. albicans. Las células fueron se imaginaron con un aumento de 40x. Las imágenes representativas se muestran aquí. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método descrito aquí presenta una forma novedosa de investigar el efecto de los impactos antibiótico, dietético, xenobiótico y terapéutico en la morfogénesis hiphal de C. albicans en el tracto gastrointestinal. Dado que la mayoría de las infecciones sistémicas se originan en el tracto gastrointestinal21,22,23,24,25,26,27,28,29,30,31,32,33,34 y la formación de hifas es un factor de virulencia crítica que promueve la difusión de C. albicans del tracto gastrointestinal, la comprensión de los factores que controla esta morfogénesis en el tracto gastrointestinal ampliará el conocimiento sobre los mecanismos de patogénesis e identificará nuevas opciones de tratamiento.
Si bien el método presentado aquí es relativamente sencillo, ciertos pasos que se describen a continuación se identificaron como críticos e importantes. (i) El inóculo inicial de C. albicans debe ser óptimo para permitir tanto el crecimiento como la morfogénesis hifílica de los hongos. Con la disponibilidad limitada de nutrientes en los extractos de homogeneización intestinal, mayor volumen de inóculo puede reducir significativamente el crecimiento de hongos y el proceso de morfogénesis. Sin embargo, es probable que el crecimiento de diferentes aislados clínicos y cepas sea variable, optimizando así el inóculo y el tiempo de incubación para aislados específicos de C. albicans es esencial. (ii) Múltiples pasos de centrifugación al preparar el extracto de homogeneato intestinal fueron encontrados cruciales para eliminar los residuos en el contenido intestinal tanto como sea posible. (iii) Debido a la velocidad relativamente baja de la centrifugación (para evitar dañar las estructuras hifrales), se debe tener cuidado para evitar la pérdida de células durante las medidas de inmunostaining en este protocolo.
En el pasado se han utilizado métodos alternativos para visualizar las hifas fúngicas en el tracto gastrointestinal, con ciertas ventajas y limitaciones asociadas con cada método. Un método relativamente notable utilizando hibridación fluorescente in situ (FISH) para visualizar hifas fúngicas en el tracto gastrointestinal ha sido demostrado recientemente por Witchley et al.61,62. Este es un método in vivo prometedor actualmente disponible para detectar C. albicans hifae directamente en el tracto gastrointestinal, sin embargo, la complejidad de este protocolo hace que sea difícil adaptarlo a estudios de cribado iniciales rápidos y a gran escala. Métodos tradicionales de histopatología también se han utilizado en el pasado para vitalizar C. albicans levadura y formas de hifas en el tracto gastrointestinal. Sin embargo, la observación y la toma de imágenes de células fúngicas con histopatología básica, y las manchas de Hematoxilina y Eosina (H/E) siguen siendo un reto, ya que muchos métodos de fijación estándar tienen el potencial de interrumpir la capa mucosa de las muestras del tracto gastrointestinal, a menudo dañando las estructuras hiphales en el proceso y dando lugar a informes contradictorios sobre la abundancia relativa de morfología de células hifáricas durante la infección63,64,65,66. Este método fue desarrollado para evitar daños a las hifas durante el procesamiento para abordar este problema. Además, los explantes de tejidos se han utilizado como una forma de examinar las condiciones biológicas ex vivo, sin embargo estos métodos son generalmente enfocados y útiles para examinar la adherencia o el potencial de invasión de C. albicans67,pero también generalmente excluyen la mayoría de los metabolómicos y componentes del microbioma que contribuyen a la patogénesis in vivo. Aunque el protocolo ex vivo descrito aquí no imita completamente el entorno GI in vivo como se describió anteriormente61,62, proporciona las condiciones más cercanas posibles que C. albicans encuentra en el entorno intestinal en comparación con los métodos in vitro utilizando condiciones de crecimiento artificial.
Este protocolo se puede utilizar para ensayos de cribado básicos para identificar el impacto de las señales ambientales en el tracto gastrointestinal en la morfogénesis hifrética de C. albicans. Este método permite que grandes grupos de compuestos, incluidos inhibidores de moléculas pequeñas, nuevos antimicóticos y metabolitos, se tomografías rápidamente para el desarrollo de la hipófala, y podría utilizarse en la detección de tratamientos terapéuticos o la identificación de factores de riesgo de enfermedad sistémica. Dado que C. albicans coloniza a lo largo del tracto gastrointestinal, este protocolo ayudará aún más a identificar las señales ambientales presentes en los segmentos específicos del tracto gastrointestinal que controlan la morfogénesis hifal en individuos que toman antibióticos, agentes quimioterápicos y en pacientes con trastornos metabólicos como la diabetes mellitus. En última instancia, el método descrito aquí permite una caracterización rápida de la morfogénesis hifígena en C. albicans en una amplia gama de factores ambientales de una manera que es más biológicamente relevante que los métodos in vitro actuales y es sustancialmente más rápida y eficiente en los recursos que los métodos in vivo actuales.
Divulgaciones
Los autores no tienen intereses financieros competidores u otros conflictos de intereses.
Agradecimientos
Los autores reconocen los recursos y el apoyo de la central de investigación de núcleos celulares y moleculares de la Universidad del Medio Oeste.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 - 10 µL Pipet Tips | Fisher Scientific | 02-707-454 | Misc |
| 100 - 1000 µL Pipet Tips | Fisher Scientific | 02-707-400 | Misc |
| 20 - 200 µL Pipet Tips | Fisher Scientific | 02-707-451 | Misc |
| 2-methylbutyric acid | Sigma | 193070-25G | hyphal-inhibitory compound |
| 488 goat anti-rabbit IgG | Invitrogen (Fisher) | A11008 | IF Staining secondary ab |
| Agar | Fisher | BP1423-500 | YPD agar component |
| Automated Imaging Microscope | Keyence | BZX700 | |
| Candida Albicans Antibody | Invitrogen (Fisher) | PA1-27158 | IF Staining primary ab |
| cefoperazone | Cayman | 16113 | antibiotic |
| deoxycholic acid | Sigma | 30960 | hyphal-inhibitory compound |
| D-Glucose | Fisher | D16-500 | hyphal-promoting compound |
| forceps | Fisher | 08-885 | |
| lactic acid | Alfa Aesar | AAAL13242-06 | hyphal-inhibitory compound |
| lithocholic acid | Sigma | L6250-10G | hyphal-inhibitory compound |
| palmitic acid | Sigma | P5585-10G | hyphal-inhibitory compound |
| Paraformaldehyde | Alfa Aesar | A11313 | IF Staining fixative |
| Phosphate-buffered saline (PBS), 10x | Alfa Aesar | J62692 | PBS component |
| p-tolylacetic acid | SCBT | sc-257959 | hyphal-inhibitory compound |
| sebacic acid | Sigma | 283258-250G | hyphal-inhibitory compound |
| sharp ended scissors | Fisher | 28301 | |
| sterile Milli-Q water | N/A | N/A | Misc |
| YPD Broth | BD Biosciences | 242810 | YPD agar component |
Referencias
- Huffnagle, G. B., Noverr, M. C. The emerging world of the fungal microbiome. Trends in Microbiology. 21 (7), 334-341 (2013).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Hajjeh, R. A., et al. Incidence of Bloodstream Infections Due to Candida Species and In Vitro Susceptibilities of Isolates Collected from 1998 to 2000 in a Population-based Active Surveillance Program. Journal of Clinical Microbiology. 42 (4), 1519-1527 (2004).
- Lockhart, S. R., et al. Species Identification and Antifungal Susceptibility Testing of Candida Bloodstream Isolates from Population-Based Surveillance Studies in Two U.S. Cities from 2008 to 2011. Journal of Clinical Microbiology. 50 (11), 3435-3442 (2012).
- Pfaller, M., et al. Epidemiology and outcomes of candidemia in 3648 patients: data from the Prospective Antifungal Therapy (PATH Alliance(R)) registry, 2004-2008. Diagnostic Microbiology and Infectious Disease. 74 (4), 323-331 (2012).
- Angarone, M. Fungal infections in cancer patients. Cancer Treatment and Research. 161, 129-155 (2014).
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113 (2012).
- Calton, E. A., et al. Invasive bacterial and fungal infections in paediatric patients with cancer: incidence, risk factors, aetiology and outcomes in a UK regional cohort 2009-2011. Pediatric Blood & Cancer. 61 (7), 1239-1245 (2014).
- Carter, J. H., et al. Medical management of invasive fungal infections of the central nervous system in pediatric cancer patients. Pediatric Blood & Cancer. 62 (6), 1095-1098 (2015).
- Low, C. Y., Rotstein, C. Emerging fungal infections in immunocompromised patients. F1000 Medicine Reports. 3, 14 (2011).
- Mousset, S., et al. Treatment of invasive fungal infections in cancer patients-updated recommendations of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Annals of Hematology. 93 (1), 13-32 (2014).
- Perfect, J. R., Hachem, R., Wingard, J. R. Update on epidemiology of and preventive strategies for invasive fungal infections in cancer patients. Clinical Infectious Diseases. 59, 352-355 (2014).
- Sipsas, N. V., Kontoyiannis, D. P. Invasive fungal infections in patients with cancer in the Intensive Care Unit. International Journal of Antimicrobial Agents. 39 (6), 464-471 (2012).
- Falagas, M. E., Apostolou, K. E., Pappas, V. D. Attributable mortality of candidemia: a systematic review of matched cohort and case-control studies. European Journal of Clinical Microbiology and Infectious Diseases. 25 (7), 419-425 (2006).
- Chi, H. W., et al. Candida albicans versus non-albicans bloodstream infections: the comparison of risk factors and outcome. Journal of Microbiology, Immunology and Infection. 44 (5), 369-375 (2011).
- Drell, T., et al. Characterization of the vaginal micro- and mycobiome in asymptomatic reproductive-age Estonian women. PLoS One. 8 (1), 54379 (2013).
- Merenstein, D., et al. Colonization by Candida species of the oral and vaginal mucosa in HIV-infected and noninfected women. AIDS Research and Human Retroviruses. 29 (1), 30-34 (2013).
- Ghannoum, M. A., et al. Characterization of the oral fungal microbiome (mycobiome) in healthy individuals. PLoS Pathogens. 6 (1), 1000713 (2010).
- Hoffmann, C., et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents. PLoS One. 8 (6), 66019 (2013).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida albicans cell-type switching and functional plasticity in the mammalian host. Nature Reviews Microbiology. 15 (2), 96-108 (2017).
- Samonis, G., et al. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans. Antimicrobial Agents and Chemotherapy. 37 (1), 51-53 (1993).
- Sahni, V., et al. Candidemia--an under-recognized nosocomial infection in Indian hospitals. The Journal of the Association of Physicians of India. 53, 607-611 (2005).
- Meijer-Severs, G. J., Joshi, J. H. The effect of new broad-spectrum antibiotics on faecal flora of cancer patients. Journal of Antimicrobial Chemotherapy. 24 (4), 605-613 (1989).
- Kennedy, M. J., Volz, P. A., Edwards, C. A., Yancey, R. J. Mechanisms of association of Candida albicans with intestinal mucosa. Journal of Medical Microbiology. 24 (4), 333-341 (1987).
- Miranda, L. N., et al. Candida colonisation as a source for candidaemia. Journal of Hospital Infections. 72 (1), 9-16 (2009).
- Nucci, M., Anaissie, E. Revisiting the source of candidemia: skin or gut. Clinical Infectious Diseases. 33 (12), 1959-1967 (2001).
- Raponi, G., Visconti, V., Brunetti, G., Ghezzi, M. C. Clostridium difficile infection and Candida colonization of the gut: is there a correlation. Clinical Infectious Diseases. 59 (11), 1648-1649 (2014).
- Guastalegname, M., Russo, A., Falcone, M., Giuliano, S., Venditti, M. Candidemia subsequent to severe infection due to Clostridium difficile: is there a link. Clinical Infectious Diseases. 57 (5), 772-774 (2013).
- Nerandzic, M. M., Mullane, K., Miller, M. A., Babakhani, F., Donskey, C. J. Reduced acquisition and overgrowth of vancomycin-resistant enterococci and Candida species in patients treated with fidaxomicin versus vancomycin for Clostridium difficile infection. Clinical Infectious Diseases. 55, 121-126 (2012).
- Krause, R., Krejs, G. J., Wenisch, C., Reisinger, E. C. Elevated fecal Candida counts in patients with antibiotic-associated diarrhea: role of soluble fecal substances. Clinical and Diagnostic Laboratory Immunology. 10 (1), 167-168 (2003).
- Krause, R., et al. Role of Candida in antibiotic-associated diarrhea. The Journal of Infectious Diseases. 184 (8), 1065-1069 (2001).
- Zuo, T., et al. Gut fungal dysbiosis correlates with reduced efficacy of fecal microbiota transplantation in Clostridium difficile infection. Nature Communications. 9 (1), 3663 (2018).
- Delaloye, J., Calandra, T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 5 (1), 161-169 (2014).
- Cole, G. T., Halawa, A. A., Anaissie, E. J. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside. Clinical Infectious Diseases. 22, 73-88 (1996).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Bendel, C. M., et al. Systemic infection following intravenous inoculation of mice with Candida albicans int1 mutant strains. Molecular genetics and metabolism. 67 (4), 343-351 (1999).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial agents and chemotherapy. 49 (3), 963-972 (2005).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences. 106 (2), 599-604 (2009).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences. 110 (33), 13594-13599 (2013).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature genetics. 45 (9), 1088 (2013).
- Bar-Yosef, H., Gonzalez, N. V., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific reports. 7 (1), 5692 (2017).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans hypha-inducing transcription factor Ume6 by the CDK1 cyclins Cln3 and Hgc1. mSphere. 2 (2), 00248 (2017).
- Vila, T., et al. Targeting Candida albicans filamentation for antifungal drug development. Virulence. 8 (2), 150-158 (2017).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Bar-Yosef, H., Vivanco Gonzalez, N., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific Reports. 7 (1), 5692 (2017).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 599-604 (2009).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans Hypha-Inducing Transcription Factor Ume6 by the CDK1 Cyclins Cln3 and Hgc1. mSphere. 2 (2), (2017).
- Bendel, C. M., et al. Effects of Alteration of the Candida albicans Gene INT1 on Cecal Colonization in Orally Innoculated Mice. Pediatric Research. 45, 156 (1999).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial Agents and Chemotherapy. 49 (3), 963-972 (2005).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 13594-13599 (2013).
- Naseem, S., Gunasekera, A., Araya, E., Konopka, J. B. N-acetylglucosamine (GlcNAc) induction of hyphal morphogenesis and transcriptional responses in Candida albicans are not dependent on its metabolism. Journal of Biological Chemistry. 286 (33), 28671-28680 (2011).
- Piispanen, A. E., Hogan, D. A. PEPped up: induction of Candida albicans virulence by bacterial cell wall fragments. Cell Host & Microbe. 4 (1), 1-2 (2008).
- Xu, X. L., et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host & Microbe. 4 (1), 28-39 (2008).
- Guinan, J., Thangamani, S. Antibiotic-induced alterations in taurocholic acid levels promote gastrointestinal colonization of Candida albicans. FEMS microbiology letters. 365 (18), (2018).
- Guinan, J., Villa, P., Thangamani, S. Secondary bile acids inhibit Candida albicans growth and morphogenesis. Pathogens and disease. 76 (3), (2018).
- Guinan, J., Wang, S., Hazbun, T. R., Yadav, H., Thangamani, S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Scientific Reports. 9 (1), 1-11 (2019).
- Gutierrez, D., et al. Antibiotic-induced gut metabolome and microbiome alterations increase the susceptibility to Candida albicans colonization in the gastrointestinal tract. FEMS microbiology ecology. 96 (1), 187 (2020).
- Witchley, J. N., et al. Candida albicans morphogenesis programs control the balance between gut commensalism and invasive infection. Cell Host & Microbe. 25 (3), 432-443 (2019).
- Witchley, J. N., Penumetcha, P. M., Noble, S. M. Visualization of Candida albicans in the Murine Gastrointestinal Tract Using Fluorescent In Situ Hybridization. JoVE (Journal of Visualized Experiments). (153), e60283 (2019).
- Johansson, M. E., Hansson, G. C. Preservation of mucus in histological sections, immunostaining of mucins in fixed tissue, and localization of bacteria with FISH. Mucins. , 229-235 (2012).
- Lossinsky, A. S., et al. The histopathology of Candida albicans invasion in neonatal rat tissues and in the human blood-brain barrier in culture revealed by light, scanning, transmission and immunoelectron microscopy scanning. Histology and histopathology. , (2006).
- Rosenbach, A., Dignard, D., Pierce, J. V., Whiteway, M., Kumamoto, C. A. Adaptations of Candida albicans for growth in the mammalian intestinal tract. Eukaryotic Cell. 9, 1075-1086 (2010).
- Vautier, S., et al. C andida albicans colonization and dissemination from the murine gastrointestinal tract: the influence of morphology and T h17 immunity. Cellular Microbiology. 17, 445-450 (2015).
- Lyman, C., Navarro, E., Garrett, K., Roberts, D., Pizzo, P., Walsh, T. Adherence of Candida albicans to bladder mucosa: development and application of a tissue explant assay. Mycoses. 42, 255-259 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados