Method Article
칸디다 알비칸스 위장관에서 최면 모포 발생을 연구하는 Ex vivo 분석
요약
이 연구에서 기장 균질 추출물과 면역형광 스테인링을 사용하여 기술된 전 생체 분석법은 기관에서 칸디다 알비칸스의 최면 형태 발생을 검사하는 새로운 방법을 나타낸다. 이 방법은 창자에 있는 형태유전학 전이를 통제하는 환경 신호를 조사하기 위하여 이용될 수 있습니다.
초록
위장(GI) 관내 칸디다 알비칸스 최면 형태발생은 다양한 환경 신호에 의해 엄격하게 제어되며, 이 기회성 곰팡이 병원균의 보급 및 병원성 발생에 중요한 역할을 한다. 그러나, 생체 내 기관에서 곰팡이 최해를 시각화하는 방법은 이러한 형태 발생 과정을 제어하는 환경 신호의 이해를 제한하는 도전적이다. 여기에 설명된 프로토콜은 장 동형 추출물에서 최면 형태 발생의 시각화를 위한 새로운 ex vivo 방법을 보여줍니다. 전 생체 분석기를 사용하여, 이 연구는 항생제 처리된 마우스에게서 cecal 내용이, 그러나 처리되지 않은 대조마우스에서, 창자 내용에서 C. albicans 최면 형태발생을 승진시키는 것을 보여줍니다. 또한, 항생제 처리된 마우스로부터 세칼 내용물의 특정 군을 다시 첨가하면 자궁 내형성 전 생체내를 분화한다. 종합하면, 이 프로토콜은 기관에서 C. albicans 최면 형태발생을 제어하는 환경 신호를 식별하고 조사하는 새로운 방법을 나타냅니다.
서문
칸디다 알비칸스는 일반적으로 기만적이지만 면역 절인 개인1,2,3,4,5,6,7,8,9,10,11,12, 12, 12에서생명을 위협하는 감염을 유발할 수 있는 악성 형태로 형태학적 변화를 겪을 수 있습니다. C. 알비칸은 항진균 치료2,14,15에서도40\u201260% 사망률을 가진 전신 외장 감염의 주요 원인이다. C. albicans는 여성 생식시스템(16,17)및 건강한 개인의구강(18)과 위장관(GI)19,20,전신 감염의 대부분을 기관에서 유래하는 등 상이한 숙주 틈새에 거주하고 있지만, 또한, 전신 감염의 근원은 종종 GI요로 확인된다21,22,23,24,25,26,27,28,29,30,31,32, 33,34. C. 기관의 알비칸 병원성은 광범위한 요인에 의해 영향을 받습니다. 그러나, 독성에 필요한 주요 특징은 효모 세포 형태에서 악성 최음세포형태(35,36,37,38,39,40,41,42, 43,44)로의 전환이다. C. 알비칸스 감염 시 기관으로부터의 부착 및 보급은 기막 효모에서 악성 최면으로 전환하는 능력과 매우 관련이 있어 곰팡이가 침습적 질환44,45,47,48,49,50,51,52,53을유발할 수 있다.
n-아세틸글루코사민을 포함한 창자에 있는 다양한 요인은 C. albicans에의하여 최면 형성을 조절합니다. 따라서, 기관54,55,56에서이 곰팡이 병원균의 최면 형태발생에 관한 지식의 격차를 좁히는 것이 중요하다. 최근 증거에 따르면 다양한 장 대사산물이 체외57,58,59,60에서 C. 알비칸의 최면 형태 발생을 차별화적으로 제어한다는 것을 나타낸다. 그러나, 기술적 제약은 생체 내 의 자궁 내의 C. 알비칸최면 형성, 특히 염색 효모 및 최면 세포 및 최면 발달의 정량적 분석을 연구하려고 할 때 문제를 제시한다. 기관에서 C. 알비칸스 최면 형태발생을 이해하기 위해, 전 생체 내 방법은 균질 최면 형태발생에 대한 대사산물의 효과를 연구하기 위해 마우스로부터 균질화 된 장 함량의 용용 추출물을 사용하여 개발되었다. C. albicans GI 감염에 저항하고 영향을 받기 쉬운 마우스에서 창자 견본을 이용하는, 이 방법은 GI 관에 있는 곰팡이 최면 형태발생에 대사 산물, 항생제 및 xenobiotics의 효력을 확인하고 공부하는 것을 도울 것입니다.
프로토콜
모든 동물 프로토콜은57이전에 설명된 바와 같이 중서부 대학 기관 동물 관리 및 사용 위원회 (IACUC)에 의해 승인되었다. 미드웨스턴 대학의 기관 동물 관리 및 사용 위원회는 MWU IACUC 프로토콜 #2894 따라이 연구를 승인했습니다. MWU 동물 관리 정책은 실험실 동물의 인도적 관리 및 사용에 대한 공중 보건 서비스 (PHS) 정책과 동물 복지법 (AWA)에 명시된 정책을 따릅니다.
1. 마우스 연구 표준 프로토콜
- 남성과 여성 C57BL/6J 마우스를 적어도 6 주 오래 사용 하십시오. 체파오레존(0.5 mg/mL)의 유무에 관계없이 멸균물로 보충하십시오.
- 5의 그룹으로 공동 집 마우스, 모든 남성 또는 모든 여성 마우스를 포함하는 각 케이지와. 마우스 표준 마우스 차우와 물(400mL 병을 통해)을 항상 제공합니다.
- 음식과 수위가 충분하도록 매일 케이지를 확인하고, 조난의 징후를 위해 마우스를 검사하십시오.
- 케이지 수유 병에 남은 물에 관계없이 신선한 항생제가 제공되도록 48h마다 물을 cefoperazone로 교체하십시오.
- 5\u20127 일간의 cefoperazone 치료 후, CO2 질식을 통해 마우스를 안락사하여 확립 된 IACUC 프로토콜을 관찰합니다. 자궁 경부 탈구를 통해 죽음을 확인합니다.
- 자동 클래브 멸균 날카로운 끝 가위와 자동 클라브 멸균 집게를 사용하여 마우스를 해부.
- 안락사 후 복부가 노출되는 모든 사지를 고정하여 해부 표면에 동물을 고정하십시오.
- 해부 동안 모피가 집게, 가위 또는 창자 섹션에 달라붙지 않도록 70%의 에탄올로 복부 부위를 분사하십시오.
- 집게를 사용하여 복부 의 바닥에 피부 의 한 부분을 꼬집고 들어 올리고 가위를 사용하여 피부와 기본 근막을 통해 작은 절개를 만듭니다. 이 절개를 만들 때 세쿰이나 장 벽을 뚫지 않도록 주의하십시오.
- 이 컷을 늑골 케이지로 확장하여 복막 구멍이 부분적으로 노출됩니다. 위쪽과 측면으로 확장양쪽의 초기 절개 지점에서 컷을 만듭니다.
- 이러한 플랩을 측면으로 당기고 해부 표면에 고정하여 복막 구멍을 완전히 노출시합니다.
- 집게를 사용하여 기관을 추출하는 동안 가위를 사용하여 위와 대장의 탈구 부위에서 절단을 하여 각 섹션에서 가장 많은 양의 장 함량을 수집합니다.
- 기관을 제거할 때는 개별 구성 요소의 파열을 피하십시오. 위장, 소장, cecum 및 대형 내장을 각각 근위와 탈구 끝에서 가위를 사용하여 분리하십시오.
- 각 섹션에서 각 창자 내용물의 수집을 위해 가위를 사용하여 각 섹션의 단면 끝에서 단일 절개를 한 다음 집게를 사용하여 1.5 mL 미세 원심 분리 튜브로 직감 함량을 수동으로 추방합니다.
- 전 생체 내 애사에 대해 -80°C에 내장 콘텐츠를 저장합니다.
2. 효모 추출물 펩톤 덱스트로스(YPD) 식기 판 준비
- 1 L 유리 병에 효모 추출물 펩톤-덱스트로스 국물 분말 25g, 10g의 천, 초순수수를 500mL의 최종 부피에 넣습니다.
- 121°C에서 30분 동안 액체 사이클에서 자동 클락을 사용하여 미디어를 살균합니다.
- 라미나르 플로우 후드 아래에 약 20mL의 한천 미디어를 멸균 페트리 플레이트에 붓습니다. 500 mL의 천은 약 25 플레이트를 산출해야합니다.
- 사용할 준비가 될 때까지 4 °C에 접시를 보관하십시오.
3. 최면 형태 형성 분석에 대한 Ex vivo 준비
- C. 알비칸S SC5314의 신선한 문화를 YPD 한천 접시에 적시고 밤새 30°C에서 배양합니다.
- 하룻밤 재배 C. albicans SC5314 문화에서 2 ~ 3 개의 중간 크기의 개별 식민지를 선택하고 인산 완충식 식염수 (PBS)의 1 mL에서 다시 중단합니다.
- -80°C 냉동고에서 냉동 용기 내용을 검색하고 25°C에서 해동합니다.
- 새로운 1.5 mL 튜브에 약 150 mg의 장 내 내용의 무게.
- PBS의 150 μL (장 내 함량 및 PBS1:1 중량 대 부피 비율)로 장 내 내용을 다시 일시 중단합니다.
- 30s의 고속으로 소용돌이가 장 내 함량을 균질화하고 실온에서 약 1분 동안 앉을 수 있도록 합니다.
- 원심분리기균질은 1000 x g에서 3분 동안 균일합니다.
- 새로운 1.5 mL 튜브로 상체를 전송합니다.
- 3.7 및 3.8 단계를 반복하여 상체의 모든 잔해를 제거합니다.
- C. 알비칸 SC5314 이내무통의 10 μL을 이 상체에 추가합니다.
- 잘 섞고 37°C에서 4~5시간 동안 배양합니다.
4. 최면 형태 형성 분석에 대한 장균성 추출물에 대사 산물을 외인성 첨가
- -80°C 냉동고에서 냉동 용기 내용물을 회수하고 PBS에서 1:1 비율(중량: 부피)으로 다시 중단됩니다.
- 창 자 내용 및 PBS 혼합물에 창 자 대사 산물의 원하는 농도 추가.
- 30s의 고속으로 소용돌이가 대사산물을 함유한 장내 함량을 균질화하고 실온에 약 10분 동안 앉을 수 있도록 합니다.
- 원심분리기균질은 1000 x g에서 3분 동안 균일합니다.
- 새로운 1.5 mL 튜브로 상체를 전송합니다. 4.4 및 4.5 단계를 반복하여 상차의 모든 잔해를 제거합니다.
- C. 알비칸 SC5314 이내 무큐럼의 10 μL을 이 상체에 추가합니다. 잘 섞고 37°C에서 4~5시간 동안 배양합니다.
5. C. 알비칸스 형태 발생 분석 (면역 염색 및 이미징)
- 샘플을 1000 x g에서 2분 동안 원심분리하고 파이펫팅을 통해 상퍼를 폐기합니다.
- 100 μL의 2% 파라포름알데히드(PFA)로 샘플을 15분 간 수정합니다.
- 1000 x g의 원심분리기는 2분 동안 피펫팅을 통해 상류부를 폐기합니다.
- PBS 1mL로 샘플을 두 번 세척합니다. 샘플을 세척하려면 부드럽게 파이프를 사용하여 PBS에서 펠릿을 다시 중단하십시오. 이 하이픈 구조를 손상 시킬 수 있기 때문에 샘플을 소용돌이 하지 마십시오. 다시 서스펜션 후 원심분리기는 1000 x g에서 2분 동안 피펫팅을 통해 상체를 폐기합니다.
- 폴리클론 C. 알비칸 항체(1:100 희석)를 함유한 PBS의 100μL에서 실온에서 샘플을 30분 동안 배양한다.
- PBS 1mL로 샘플을 세 번 세척합니다.
참고: 형광 항체를 사용하는 경우, 모든 희석 및 세척 단계는 사진 표백을 피하고 시료 수명을 개선하기 위해 희미한 빛으로 수행되는 것이 좋습니다. - 1:500 희석시 항래비게이그 알렉사플루어 488 항체를 함유한 PBS의 100 μL에서 실온에서 15분 동안 샘플을 배양한다. 사진 표백을 피하기 위해 어두운 서랍이나 방에서 인큐베이션을 수행합니다.
- PBS 1mL로 샘플을 세 번 세척합니다.
- PBS의 100 μL에서 샘플을 다시 중단하고 이미징을 위해 96웰 플레이트로 이송합니다.
참고: 이미지화되지 않을 때는 96웰 플레이트를 알루미늄 호일로 감싸서 사진 표백을 피하는 것이 좋습니다. - 형광 이미징 현미경을 사용하여 20배 및 40배 의 객관적렌즈를 사용하는 이미지 곰팡이 세포. 녹색 형광 단백질 (GFP) 필터 (흥분 파장 470/40 및 방출 파장 525/50)를 사용하여 형광을 감지하십시오.
결과
이러한 결과는 탄가마니실험실(60)의 이전 연구 결과와 함께 C. 알비칸이 위장에서 가져온 장용 균질 추출물에서 전 생체을 재배할 때, 치료되지 않은 대조군 및 항생제 처리 마우스의 소장 및 대형 장, C. 알비칸스는 일반적으로 효모 형태학(도1B)으로개발된다는 것을 나타낸다. 그러나, 항생제 처리된 마우스에서 세칼 추출물에서 재배될 때, C. 알비칸스는 쉽게 형태발생을 겪으며, 효모와 최면 형태를 함유한 시료(도1B); 이것은 대조군 마우스에서 발생하지 않습니다. 이는 항생제 처리된 세칼 추출물에서 자란 샘플에서 최해 형태의 현저한 증가를 보였지만, 다른 항생제 치료장추출물(60)에서는그렇지 않은 이전 결과를 뒷받침한다. 이러한 결과는 항생제 치료가 C. albicans의 최면 형태 발생을 유도하는 세칼 환경에 있는 변경을 일으키는 원인이 된다는 것을 건의합니다. 추가적으로, cecum에서만 발견된 이 표현형의 특정 국소화는 또한 이러한 최면 촉진 조건이 반드시 기관 전체에 존재하지 않을 수 있다는 것을 건의합니다, 대신 영양분, 대사 산물 및 그밖 알려지지 않은 분자의 가용성에 따라 기장의 특정 세그먼트에 제한됩니다.
항생제 처리된 마우스의 세칼 추출물이 C. albicans57, 58,59, 60의 형태발생을 촉진하기 때문에, 우리는 C. albicans의 형태발생을 촉진하기 때문에,58,59,60,우리는 cf 처리 마우스의 cecal 함량에 창자 대사 산물의 선택된 그룹의 외인성 추가 여부를 검토하여 Cbicans의 형태발생에 영향을 미칠 지 여부를 조사하였다. 탄가마니 연구소에서 수행한 이전 연구는 치료되지 않은 항생제 처리 마우스에서 추출한 세칼 함량의 메타볼로믹스 프로파일을 특징으로 하며, 항생제 치료의 결과로 다양한 대사산물의 풍부에 상당한 변화를 드러내며, 특히 이차 담즙산의 풍부도를 감소시키고 탄수화물60의풍부도가 증가하였다. 또한, 이차 담산과 카복실산이 최해 개발을 억제하는 반면, 포도당을 포함한 탄수화물은 체외60에서 C. 알비칸스의 최면 형태 발생을 촉진한다는 것을 확인했습니다. 결과는 탈옥산을 포함하는 억제장 대사산물의 풀을 다시 추가하는 것을 나타냅니다 (DCA, 0.5 mg/mL), 리토홀산 (LCA, 0.1 mg/mL), 팔미티산(0.1 mg/mL), p-tolylacetic acid (0.1 mg/mL), 세바틱 산 (0.5 mg/mL), 2-메틸부티르산 (0.5 mg/mL), 그리고 유산산(5 mg/mL) 및 유산산(5 mg/mL) 및 세포균의 모름모케를 완전히 억제한다. 한편, 외인성 포도당(1 mg/mL)을 cef-treated 마우스의 세칼 호모게네이트에 첨가하여 대규모 최음제발달(도 2B)을보였다. 총체적으로, 이 사실 인정은 cef 처리한 마우스의 cecal 균형에 다시 창자 대사산물의 추가가 C. albicans의 형태발생을 분화하게 통제한다는 것을 표시합니다, 따라서 이전 시험관 내 사실 인정을 확인합니다. 이러한 결과는 장 대사산물이 C. 알비칸의 최면 형태발생에 중요한 역할을 하고 이러한 대사산물에 의해 변조된 유전자 표적 및 신호 경로를 이해하는 것이 C. 알비칸 감염을 예방하고 치료하는 새로운 치료 접근법의 개발에 도움이 될 것임을 나타냅니다.

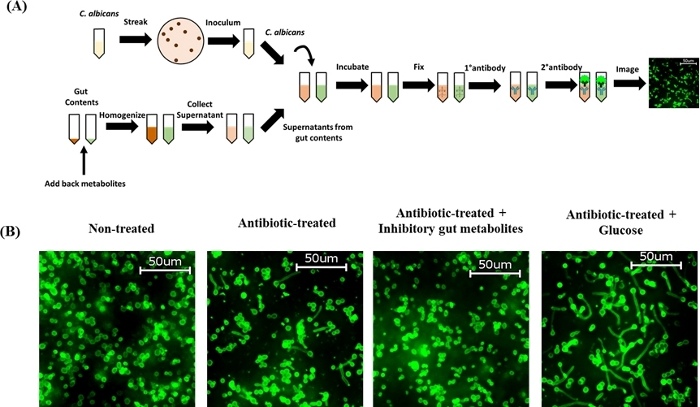
도 1: C. 알비칸스 최면 형태발생에 대한 cefoperazone 치료의 효과를 결정하는 Ex vivo 분석. (A)프로토콜 회로도 개요. (B)항생제 처리(상단 패널) 및 비처리(하단 패널) 장 내 내용물들은 위장, 소장, 실금 및 C57BL/6J 마우스의 대장으로부터 채취하였다. C. albicans SC5314로 접종된 창자 내용물들은 4\u20125 h에 대해 37°C에서 배양되었고 C. 알비칸 항체로 염색하였다. 세포는 40배배율로 배율로 이미지되었다. 대표적인 이미지는 여기에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 2: C. 알비칸전 생체내 의 최해 형성에 대한 세프 처리 마우스로부터 의 세칼 내용물까지 장 대사 산물을 외인성 첨가한다. (A)프로토콜 회로도 개요. (B)억제 장 대사 산물 DCA를 포함하는 수영장 (0.5 mg/mL), LCA (0.1 mg/mL), 팔미티산 (0.1 mg/mL), p-tolylacetic 산 (0.1 mg/mL), 세바식산 (0.5 mg/mL); 2-메틸부티산(0.5 mg/mL), 및 유산산(5 mg/mL) 또는 포도당(1 mg/mL)은 세프 처리 마우스의 세칼 함량에 다시 첨가되었고, 37°C에서 37°C에서 철저히 혼합하여 배양하여 전 생체균 분석등을 수행하였다. C. albicans SC5314로 접종된 Cecal 내용물4\u20125 h에 대해 37°C에서 배양되었고 C. 알비칸 항체로 염색하였다. 세포는 40배배율로 배율로 이미지되었다. 대표적인 이미지는 여기에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서 기술된 방법은 기관에 있는 C. albicans 최면 형태발생에 대한 항생제, 규정식, xenobiotic 및 치료 충격의 효력을 조사하는 새로운 방법을 제시합니다. 전신 감염의 대부분은 기관21,22,23,24,25,26,27,28,29,30,31,32, 33,34 및 최면 형성으로부터 유래되기 때문에 C의 보급을 촉진하는 중요한 독성 인자이다. 기관에서 albicans, 기관에 있는 이 형태발생을 통제하는 요인을 이해하는 것은 병인 기계장치에 관하여 지식을 확장하고 새로운 처리 선택권을 식별할 것입니다.
여기에 제시된 방법은 비교적 간단하지만 아래에 설명된 특정 단계는 중요하고 중요한 것으로 확인되었습니다. (i) C. 알비칸스의 초기 접종은 곰팡이의 성장과 최면 형태 발생을 모두 허용하도록 최적이어야 한다. 장 동종 추출물의 영양소의 가용성이 제한되어 있는 상황에서, 더 많은 양의 접종은 곰팡이 성장과 형태 발생 과정을 크게 감소시킬 수 있습니다. 그러나, 상이한 임상 분리 및 균주의 성장은 가변적일 가능성이 있으므로 특정 C. 알비칸 분리에 대한 접종 및 잠복기 시간을 최적화하는 것이 필수적이다. (ii) 장균제 추출물을 제조할 때 여러 원심 분리 단계는 가능한 한 장 내 내용물의 이물질을 제거하는 데 중요한 것으로 나타났다. (iii) 원심분리의 비교적 낮은 속도 (최면 구조를 손상시키지 않기 위해) 이 프로토콜에서 면역 스테인링 단계 동안 세포 손실을 피하기 위해주의를 기울여야한다.
기관에서 곰팡이 최해를 시각화하는 대체 방법은 과거에 사용되어 왔으며, 각 방법과 관련된 특정 장점과 한계가 있습니다. 위관에서 곰팡이 하이파를 시각화하기 위해 시투 혼성화(FISH)에서 형광을 사용하는 비교적 주목할 만한 방법 중 하나는 최근 Witchley 외61,62에의해 입증되었다. 이것은 현재 기관에서 직접 C. albicans 최면을 검출할 수 있는 유망한 생체 내 방법이지만, 이 프로토콜의 복잡성으로 인해 신속하고 대규모 초기 스크리닝 연구에 적응하기가 어렵다. 전통적인 조직 병리학 방법은 또한 기관에 있는 C. albicans 효모 및 최면 양식을 활성화하기 위하여 과거에 이용되었습니다. 그러나, 기본적인 조직병리학을 가진 곰팡이 세포의 관찰 및 화상 진찰, 그리고 헤마톡시린과 에오신 (H/E) 얼룩은 많은 표준 고정 방법이 기관 견본의 점막 층을 방해할 가능성이 있기 때문에, 수시로 프로세스에 있는 최면 구조물을 손상하고63,66감염 도중 효성 세포 모형학의 상대적인 풍부에 모순되는 보고로 이끌어 내는 도전남아 있습니다 , 66 ,66의효청 세포 모형학의 상대적인 풍부에 모순되는 보고로 이끌어 냅니다.66. 이 방법은 이 문제를 해결하기 위해 가공 중 최면에 손상을 방지하기 위해 개발되었다. 또한, 조직 이종은 생체 조건을 검사하는 방법으로 사용되어 왔지만, 이러한 방법은 일반적으로 C. albicans67의준수 또는 침입 잠재력을 검사하는 데 초점을 맞추고 유용하지만, 또한 일반적으로 생체 내 병기 발생에 기여하는 메타볼로믹스 및 미생물군구성성분의 대부분을 배제한다. 여기에 설명된 전 생체내 프로토콜은이전에설명된 바와 같이 생체 내 GI 환경에서 완전히 모방되지는않지만,인공 성장 조건을 이용한 시험관내 방법에 비해 C. albicans가 장 환경에서 발생하는 가장 가까운 조건을 제공한다.
이 프로토콜은 C. albicans 최면 형태발생에 기관에 있는 환경 신호의 충격을 확인하기 위하여 기본적인 검열 분석에 이용될 수 있습니다. 이 방법은 작은 분자 억제제, 새로운 항마이코스제 및 대사 산물을 포함한 대규모 화합물 그룹이 최면 발달을 위해 빠르게 선별될 수 있게 하고, 치료 치료를 선별하거나 전신 질환에 대한 위험 요소를 식별하는 데 사용될 수 있다. C. albicans가 기관 전체에 걸쳐 식민지화되기 때문에, 이 프로토콜은 항생제를 취하는 개별에 있는 최면 형태 발생을 통제하는 기장의 특정 세그먼트에 존재하는 환경 신호를 확인하는 추가 원조할 것입니다, 화학요법 에이전트, 당뇨병을 포함한 신진 대사 무질서를 가진 환자에서. 궁극적으로 여기에 설명된 방법은 C. albicans에서 현수막 형태발생의 빠른 특성화를 현재 시험관내 방법보다 생물학적으로 더 관련성이 높으며 생체 내 방법보다 실질적으로 빠르고 자원 효율이 큰 방식으로 광범위한 환경 적 요인에 걸쳐 허용된다.
공개
저자는 경쟁 적인 재정적 이익 이나 이해의 다른 충돌.
감사의 말
저자는 미드웨스턴 대학 세포 및 분자 코어 연구 시설에서 자원과 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 - 10 µL Pipet Tips | Fisher Scientific | 02-707-454 | Misc |
| 100 - 1000 µL Pipet Tips | Fisher Scientific | 02-707-400 | Misc |
| 20 - 200 µL Pipet Tips | Fisher Scientific | 02-707-451 | Misc |
| 2-methylbutyric acid | Sigma | 193070-25G | hyphal-inhibitory compound |
| 488 goat anti-rabbit IgG | Invitrogen (Fisher) | A11008 | IF Staining secondary ab |
| Agar | Fisher | BP1423-500 | YPD agar component |
| Automated Imaging Microscope | Keyence | BZX700 | |
| Candida Albicans Antibody | Invitrogen (Fisher) | PA1-27158 | IF Staining primary ab |
| cefoperazone | Cayman | 16113 | antibiotic |
| deoxycholic acid | Sigma | 30960 | hyphal-inhibitory compound |
| D-Glucose | Fisher | D16-500 | hyphal-promoting compound |
| forceps | Fisher | 08-885 | |
| lactic acid | Alfa Aesar | AAAL13242-06 | hyphal-inhibitory compound |
| lithocholic acid | Sigma | L6250-10G | hyphal-inhibitory compound |
| palmitic acid | Sigma | P5585-10G | hyphal-inhibitory compound |
| Paraformaldehyde | Alfa Aesar | A11313 | IF Staining fixative |
| Phosphate-buffered saline (PBS), 10x | Alfa Aesar | J62692 | PBS component |
| p-tolylacetic acid | SCBT | sc-257959 | hyphal-inhibitory compound |
| sebacic acid | Sigma | 283258-250G | hyphal-inhibitory compound |
| sharp ended scissors | Fisher | 28301 | |
| sterile Milli-Q water | N/A | N/A | Misc |
| YPD Broth | BD Biosciences | 242810 | YPD agar component |
참고문헌
- Huffnagle, G. B., Noverr, M. C. The emerging world of the fungal microbiome. Trends in Microbiology. 21 (7), 334-341 (2013).
- Wisplinghoff, H., et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases. 39 (3), 309-317 (2004).
- Hajjeh, R. A., et al. Incidence of Bloodstream Infections Due to Candida Species and In Vitro Susceptibilities of Isolates Collected from 1998 to 2000 in a Population-based Active Surveillance Program. Journal of Clinical Microbiology. 42 (4), 1519-1527 (2004).
- Lockhart, S. R., et al. Species Identification and Antifungal Susceptibility Testing of Candida Bloodstream Isolates from Population-Based Surveillance Studies in Two U.S. Cities from 2008 to 2011. Journal of Clinical Microbiology. 50 (11), 3435-3442 (2012).
- Pfaller, M., et al. Epidemiology and outcomes of candidemia in 3648 patients: data from the Prospective Antifungal Therapy (PATH Alliance(R)) registry, 2004-2008. Diagnostic Microbiology and Infectious Disease. 74 (4), 323-331 (2012).
- Angarone, M. Fungal infections in cancer patients. Cancer Treatment and Research. 161, 129-155 (2014).
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113(2012).
- Calton, E. A., et al. Invasive bacterial and fungal infections in paediatric patients with cancer: incidence, risk factors, aetiology and outcomes in a UK regional cohort 2009-2011. Pediatric Blood & Cancer. 61 (7), 1239-1245 (2014).
- Carter, J. H., et al. Medical management of invasive fungal infections of the central nervous system in pediatric cancer patients. Pediatric Blood & Cancer. 62 (6), 1095-1098 (2015).
- Low, C. Y., Rotstein, C. Emerging fungal infections in immunocompromised patients. F1000 Medicine Reports. 3, 14(2011).
- Mousset, S., et al. Treatment of invasive fungal infections in cancer patients-updated recommendations of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Annals of Hematology. 93 (1), 13-32 (2014).
- Perfect, J. R., Hachem, R., Wingard, J. R. Update on epidemiology of and preventive strategies for invasive fungal infections in cancer patients. Clinical Infectious Diseases. 59, Suppl 5 352-355 (2014).
- Sipsas, N. V., Kontoyiannis, D. P. Invasive fungal infections in patients with cancer in the Intensive Care Unit. International Journal of Antimicrobial Agents. 39 (6), 464-471 (2012).
- Falagas, M. E., Apostolou, K. E., Pappas, V. D. Attributable mortality of candidemia: a systematic review of matched cohort and case-control studies. European Journal of Clinical Microbiology and Infectious Diseases. 25 (7), 419-425 (2006).
- Chi, H. W., et al. Candida albicans versus non-albicans bloodstream infections: the comparison of risk factors and outcome. Journal of Microbiology, Immunology and Infection. 44 (5), 369-375 (2011).
- Drell, T., et al. Characterization of the vaginal micro- and mycobiome in asymptomatic reproductive-age Estonian women. PLoS One. 8 (1), 54379(2013).
- Merenstein, D., et al. Colonization by Candida species of the oral and vaginal mucosa in HIV-infected and noninfected women. AIDS Research and Human Retroviruses. 29 (1), 30-34 (2013).
- Ghannoum, M. A., et al. Characterization of the oral fungal microbiome (mycobiome) in healthy individuals. PLoS Pathogens. 6 (1), 1000713(2010).
- Hoffmann, C., et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents. PLoS One. 8 (6), 66019(2013).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida albicans cell-type switching and functional plasticity in the mammalian host. Nature Reviews Microbiology. 15 (2), 96-108 (2017).
- Samonis, G., et al. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans. Antimicrobial Agents and Chemotherapy. 37 (1), 51-53 (1993).
- Sahni, V., et al. Candidemia--an under-recognized nosocomial infection in Indian hospitals. The Journal of the Association of Physicians of India. 53, 607-611 (2005).
- Meijer-Severs, G. J., Joshi, J. H. The effect of new broad-spectrum antibiotics on faecal flora of cancer patients. Journal of Antimicrobial Chemotherapy. 24 (4), 605-613 (1989).
- Kennedy, M. J., Volz, P. A., Edwards, C. A., Yancey, R. J. Mechanisms of association of Candida albicans with intestinal mucosa. Journal of Medical Microbiology. 24 (4), 333-341 (1987).
- Miranda, L. N., et al. Candida colonisation as a source for candidaemia. Journal of Hospital Infections. 72 (1), 9-16 (2009).
- Nucci, M., Anaissie, E. Revisiting the source of candidemia: skin or gut. Clinical Infectious Diseases. 33 (12), 1959-1967 (2001).
- Raponi, G., Visconti, V., Brunetti, G., Ghezzi, M. C. Clostridium difficile infection and Candida colonization of the gut: is there a correlation. Clinical Infectious Diseases. 59 (11), 1648-1649 (2014).
- Guastalegname, M., Russo, A., Falcone, M., Giuliano, S., Venditti, M. Candidemia subsequent to severe infection due to Clostridium difficile: is there a link. Clinical Infectious Diseases. 57 (5), 772-774 (2013).
- Nerandzic, M. M., Mullane, K., Miller, M. A., Babakhani, F., Donskey, C. J. Reduced acquisition and overgrowth of vancomycin-resistant enterococci and Candida species in patients treated with fidaxomicin versus vancomycin for Clostridium difficile infection. Clinical Infectious Diseases. 55, Suppl 2 121-126 (2012).
- Krause, R., Krejs, G. J., Wenisch, C., Reisinger, E. C. Elevated fecal Candida counts in patients with antibiotic-associated diarrhea: role of soluble fecal substances. Clinical and Diagnostic Laboratory Immunology. 10 (1), 167-168 (2003).
- Krause, R., et al. Role of Candida in antibiotic-associated diarrhea. The Journal of Infectious Diseases. 184 (8), 1065-1069 (2001).
- Zuo, T., et al. Gut fungal dysbiosis correlates with reduced efficacy of fecal microbiota transplantation in Clostridium difficile infection. Nature Communications. 9 (1), 3663(2018).
- Delaloye, J., Calandra, T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 5 (1), 161-169 (2014).
- Cole, G. T., Halawa, A. A., Anaissie, E. J. The role of the gastrointestinal tract in hematogenous candidiasis: from the laboratory to the bedside. Clinical Infectious Diseases. 22, Suppl 2 73-88 (1996).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Bendel, C. M., et al. Systemic infection following intravenous inoculation of mice with Candida albicans int1 mutant strains. Molecular genetics and metabolism. 67 (4), 343-351 (1999).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial agents and chemotherapy. 49 (3), 963-972 (2005).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences. 106 (2), 599-604 (2009).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences. 110 (33), 13594-13599 (2013).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature genetics. 45 (9), 1088(2013).
- Bar-Yosef, H., Gonzalez, N. V., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific reports. 7 (1), 5692(2017).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans hypha-inducing transcription factor Ume6 by the CDK1 cyclins Cln3 and Hgc1. mSphere. 2 (2), 00248(2017).
- Vila, T., et al. Targeting Candida albicans filamentation for antifungal drug development. Virulence. 8 (2), 150-158 (2017).
- Pande, K., Chen, C., Noble, S. M. Passage through the mammalian gut triggers a phenotypic switch that promotes Candida albicans commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Lo, H. J., et al. Nonfilamentous C. albicans mutants are avirulent. Cell. 90 (5), 939-949 (1997).
- Bar-Yosef, H., Vivanco Gonzalez, N., Ben-Aroya, S., Kron, S. J., Kornitzer, D. Chemical inhibitors of Candida albicans hyphal morphogenesis target endocytosis. Scientific Reports. 7 (1), 5692(2017).
- Carlisle, P. L., et al. Expression levels of a filament-specific transcriptional regulator are sufficient to determine Candida albicans morphology and virulence. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 599-604 (2009).
- Mendelsohn, S., Pinsky, M., Weissman, Z., Kornitzer, D. Regulation of the Candida albicans Hypha-Inducing Transcription Factor Ume6 by the CDK1 Cyclins Cln3 and Hgc1. mSphere. 2 (2), (2017).
- Bendel, C. M., et al. Effects of Alteration of the Candida albicans Gene INT1 on Cecal Colonization in Orally Innoculated Mice. Pediatric Research. 45, 156(1999).
- Gale, C. A., et al. Linkage of adhesion, filamentous growth, and virulence in Candida albicans to a single gene, INT1. Science. 279 (5355), 1355-1358 (1998).
- Toenjes, K. A., et al. Small-molecule inhibitors of the budded-to-hyphal-form transition in the pathogenic yeast Candida albicans. Antimicrobial Agents and Chemotherapy. 49 (3), 963-972 (2005).
- Fazly, A., et al. Chemical screening identifies filastatin, a small molecule inhibitor of Candida albicans adhesion, morphogenesis, and pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 13594-13599 (2013).
- Naseem, S., Gunasekera, A., Araya, E., Konopka, J. B. N-acetylglucosamine (GlcNAc) induction of hyphal morphogenesis and transcriptional responses in Candida albicans are not dependent on its metabolism. Journal of Biological Chemistry. 286 (33), 28671-28680 (2011).
- Piispanen, A. E., Hogan, D. A. PEPped up: induction of Candida albicans virulence by bacterial cell wall fragments. Cell Host & Microbe. 4 (1), 1-2 (2008).
- Xu, X. L., et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host & Microbe. 4 (1), 28-39 (2008).
- Guinan, J., Thangamani, S. Antibiotic-induced alterations in taurocholic acid levels promote gastrointestinal colonization of Candida albicans. FEMS microbiology letters. 365 (18), (2018).
- Guinan, J., Villa, P., Thangamani, S. Secondary bile acids inhibit Candida albicans growth and morphogenesis. Pathogens and disease. 76 (3), (2018).
- Guinan, J., Wang, S., Hazbun, T. R., Yadav, H., Thangamani, S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Scientific Reports. 9 (1), 1-11 (2019).
- Gutierrez, D., et al. Antibiotic-induced gut metabolome and microbiome alterations increase the susceptibility to Candida albicans colonization in the gastrointestinal tract. FEMS microbiology ecology. 96 (1), 187(2020).
- Witchley, J. N., et al. Candida albicans morphogenesis programs control the balance between gut commensalism and invasive infection. Cell Host & Microbe. 25 (3), 432-443 (2019).
- Witchley, J. N., Penumetcha, P. M., Noble, S. M. Visualization of Candida albicans in the Murine Gastrointestinal Tract Using Fluorescent In Situ Hybridization. JoVE (Journal of Visualized Experiments). (153), e60283(2019).
- Johansson, M. E., Hansson, G. C. Preservation of mucus in histological sections, immunostaining of mucins in fixed tissue, and localization of bacteria with FISH. Mucins. , Springer. 229-235 (2012).
- Lossinsky, A. S., et al. The histopathology of Candida albicans invasion in neonatal rat tissues and in the human blood-brain barrier in culture revealed by light, scanning, transmission and immunoelectron microscopy scanning. Histology and histopathology. , (2006).
- Rosenbach, A., Dignard, D., Pierce, J. V., Whiteway, M., Kumamoto, C. A. Adaptations of Candida albicans for growth in the mammalian intestinal tract. Eukaryotic Cell. 9, 1075-1086 (2010).
- Vautier, S., et al. C andida albicans colonization and dissemination from the murine gastrointestinal tract: the influence of morphology and T h17 immunity. Cellular Microbiology. 17, 445-450 (2015).
- Lyman, C., Navarro, E., Garrett, K., Roberts, D., Pizzo, P., Walsh, T. Adherence of Candida albicans to bladder mucosa: development and application of a tissue explant assay. Mycoses. 42, 255-259 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유